Method Article
نموذج دروسوفيليا لدراسة البوليسبليد الناجم عن الجروح
In This Article
Summary
الزرع المستحث بالجرح هو استراتيجية إصلاح الأنسجة المحفوظة حيث تنمو الخلايا في الحجم بدلاً من الانقسام للتعويض عن فقدان الخلايا. هنا هو بروتوكول مفصل حول كيفية استخدام ذبابة الفاكهة كنموذج لقياس ploidy وتنظيمها الجيني في إصلاح الجرح الظهارية.
Abstract
البوليبلويد ظاهرة متكررة لا يزال تأثيرها على صحة الكائنات الحية والمرض غير مفهومة بشكل جيد. يتم تعريف الخلية بأنها بوليبلويد إذا كانت تحتوي على أكثر من نسخة من الكروموسومات diploid لها، والذي هو نتيجة للاندويس أو الانصهار الخلية. في إصلاح الأنسجة، تم العثور على التصليح الناجم عن الجروح (WIP) ليكون استراتيجية الشفاء المحفوظة من ذباب الفاكهة إلى الفقاريات. ولـ WIP عدة مزايا على انتشار الخلايا، بما في ذلك مقاومة النمو الناسخ والإجهاد السمية الجينية. وكان التحدي هو تحديد سبب ظهور خلايا البوليبلويد وكيفية عمل هذه الخلايا الفريدة. المقدم هو بروتوكول مفصل لدراسة WIP في الفاكهة الكبار يطير ظهارة حيث يتم توليد الخلايا البوليبلويد في غضون 2 أيام بعد ثقب الجرح. الاستفادة من مجموعة الأدوات الوراثية واسعة النطاق D. melanogaster، الجينات المطلوبة لبدء وتنظيم WIP، بما في ذلك Myc، وقد بدأت في تحديد. يمكن أن تكشف الدراسات المستمرة باستخدام هذه الطريقة كيف أن المتغيرات الوراثية والفسيولوجية الأخرى بما في ذلك الجنس والنظام الغذائي والعمر تنظم وتؤثر على وظيفة WIP.
Introduction
Drosophila الميلانوغاستر هو نظام نموذج جذاب لدراسة الآليات الخلوية والجزيئية لإصلاح الجروح الظهارية. كما هو الحال في الثدييات، تعتمد آليات إصلاح الأنسجة المستخدمة على كل من الأنسجة ومرحلة تطورها. يحدث التئام الجروح Scarless في جنين ذبابة الفاكهة حيث actomyosin "سلسلة محفظة" أشكال في حافة الرائدة الظهارية تمكين الجرح لإغلاق بسلاسة1،2. بعد الجنين التئام الجروح في اليرقات، pupae، وذباب الفاكهة الكبار النتائج في إعادة عرض المصفوفة خارج الخلية، وتشكيل ندبة الميلانين، ونمو الخلايا الظهارية3،4،5،6. زيادة الخلايا الظهارية في الحجم عن طريق دمج الخلايا و endocycle، وهي دورة خلية غير مكتملة التي تتجاوز الانقسام3،4،7،8. ونتيجة لذلك، يتم تعويض فقدان الخلية عن طريق نمو الخلايا البوليبلويد بدلا من انقسام الخلايا. الكبار الذبابة hindgut، midgut، وظهارة الجريب أيضا الاعتماد على نمو الخلايا البولية لتعويض فقدان الخلايا بعد تلف الأنسجة9،10،11.
Polyploidy هو جانب معروف من التنمية في الكائنات الحية في النباتات والحشرات ، ولكن في السنوات القليلة الماضية أصبح أكثر وضوحا أن polyploidy هو الحفاظ على استراتيجية إصلاح الأنسجة في الفقاريات12. الحمار الوحشي، الذي لديه القدرة على تجديد قلبها، ويعتمد على نمو الخلايا المتعددة الخلايا للشفاء من epicardium التالفة13. البوليبلويد يساهم أيضا في تجديد الكبد الثدييات والكلى tubule ظهارة إصلاح بعد الإصابة الحادة14,15. في هذه الأمثلة، يتم إنشاء الخلايا المتعددة الخلايا عن طريق الاندورفيشن عن طريق إما إندوسيكل أو بطانة الرحم، مما يؤدي إلى خلية مُصلَّدة بسبب كتلة في cytokinesis12. لغز هو لماذا تنشأ الخلايا البوليبلويد أثناء إصلاح الجروح وكيف يؤثر بوليبلويد على وظيفة الأنسجة. وقد وفرت الدراسات الحديثة نظرة جديدة في مسألة ما إذا كان polyploidy يقدم ميزة الشفاء أو العيب. في epicardium حمار وحشي، تعزيز polyploidy سرعة التئام الجروح13. في D. melanogaster hindgut والثدييات الكبد, تم العثور على البوليبلويدي لتكون واقية ضد النمو oncogenic11,14. في ظهارة ذبابة الكبار، وقد وجد مؤخرا أن polyploidy تمكن من إصلاح الجرح في وجود الإجهاد السمية الجينية16. Endoreplication مقاومة لتلف الحمض النووي، والسماح التئام الجروح عندما انتشار الخلايا وإلا سيكون للخطر17. بالنسبة لـ cardiomyocytes في قلوب الماوس وسمك الحمار الوحشي ، ومع ذلك ، فإن polyploidy يبطئ الشفاء ، مما يؤدي إلى تعزيز تكوينالندبة 18،19. لذلك ، اعتمادًا على العضو و / أو نوع الخلية ، يمكن أن يكون polyploidy استراتيجية إصلاح الأنسجة المفيدة أو الضارة. إن إمكانية الوصول إلى جينات D. melanogaster إلى جانب تحليل استجابة التحلل الناجم عن الجروح (WIP) تجعل منه نظامًا نموذجيًا مثاليًا لتوضيح الآليات الجزيئية والخلوية التي توجه استراتيجية التئام الجروح هذه.
هنا، نقدم بروتوكول لتحليل WIP في ظهارة D. الميلانوغاستر الكبار. وشملت تعليمات لإصابة ذبابة الفاكهة، تشريح، والمناعة، وتركيب، والتصوير، وتحليل إعادة الظهارة، والانصهار الخلية، واندورفيشن (ploidy). كما يمكن تكييف التصوير وتحليل ploidy لنماذج أخرى لاختبار ما إذا كان يحدث WIP. وتجدر الإشارة إلى أنه مع زيادة محتوى الحمض النووي النووي، كثيراً ما تكون هناك زيادة مقابلة في الحجم النووي. ومع ذلك ، هناك العديد من الأمثلة في علم الأحياء حيث لا يعكس الحجم النووي تغييرًا مقابلًا في ploidy20. وينبغي توخي المزيد من الحذر عند تفسير الحجم النووي في سياق بيئة الجرح حيث تنتشر الخلايا أو تمتد في كثير من الأحيان لتغطية موقع الجرح. ولذلك، فإن الدليل القاطع الوحيد على التغيير في ploidy هو قياس محتوى الحمض النووي بواسطة هذه الطريقة (أو غيرها، مثل تسلسل الجينوم الكامل)21. هذه الطريقة تزيد من ملاءمة الكبار D. الميلانوغاستر ظهارة البطن كنموذج لدراسة دور وتنظيم البوليبلويدي في إصلاح الجروح.
Protocol
1. تنظيم وجرح ذباب الفاكهة الكبار
- حدد D. سلالة الميلانوغاستر من الاختيار (أي epi-Gal4 / سلالة UAS، انظر جدول المواد).
ملاحظة: هنا، يتم استخدام نظام Gal4/UAS لتمكين التعبير الجيني الظهاري المحدد (epi-Gal4) من الجينات أو RNAi المشفرة المصب من UAS. تستخدم هذه الدراسة بروتين الغشاء الفلوري (UAS-Cd8.mRFP) ، ومحفز mitotic (UAS-FzrRNAi، UAS-stg) ، ومثبط WIP (UAS-E2F1RNAi؛ UAS-RacDN). - جمع قاريتين من 10-15 الإناث المغلقة حديثا فاكهة الذباب كل والعمر على قوارير المواد الغذائية الطازجة في 25 درجة مئوية حتى 3-5 أيام من العمر. واحدة قارورة سوف تكون بمثابة السيطرة غير المصابة والقارورة الأخرى سوف تكون مجروحة على النحو المبين أدناه. يجب الحفاظ على الذباب الأنثوي مع الذكور (~ 5/قارورة).
- لجرح الذباب، تجميع العديد من أصحاب دبوس مع كل واحد 0.10 مم غير القابل للصدأ دبوس. تأكد من أن النهاية الحادة للدبوس تواجهها. دبابيس يمكن أن ينحني بسهولة أو رقاقة بعد ثقب الذبابة والمضاجعة أو التالفة ينبغي التخلص منها.
- تخدير ذباب الفاكهة الإناث الذين تتراوح أعمارهم بين على CO2-يطير وسادة تحت منظار مجسم ومحاذاة لهم في صف باستخدام فرشاة الطلاء. ارتداء نظارات السلامة، وعقد حامل دبوس في يد واحدة والملامل في الآخر، واستخدام ملقط لوضع ذبابة مع البطن البطني التي تواجهها.
- ثقب الذباب الإناث الكبار داخل منطقة pleurite الظهارية من tergite A4 على جانبي ستيرنات خط الوسط البطني (الشكل 1A). ثقب هذه المنطقة البطنية يوفر مساحة مثالية بعيدا عن مواقع تشريح حيث سيتم تمزيق حواف الأنسجة عن طريق المعالجة الميكانيكية.
- عودة الجرحى الذباب إلى قارورة الطعام والعمر إلى إصابة ما بعد اليوم المطلوب (dpi). يبدأ التئام الجروح الظهارية في نقطة في البوصة 1 وينتهي بنسبة 3 نقطة في البوصة. إنفوريبليكيشن الذروة في 2 نقطة في البوصة، وهو مثالي لنظراء EdU (القسم 4، الشكل 2).
2. ذبابة تشريح البطن
ملاحظة: خلال هذه الخطوة، من المهم تجنب لمس أنسجة البطن البطنية مع أدوات التشريح لأنه سوف يضر سلامة الظهارة.
- الحصول على جميع المواد المطلوبة لتشريح: حل غريس، ملقط، مقص الربيع فانا، دبابيس 0.10 ملم، تشريح لوحات، 9 صحن تشريح الزجاج جيدا، حل التثبيت (4٪ شبهformaldehyde في 1x PBS)، 1X PBS، مناديل، والماصات ونصائح ل30 ميكرومتر، والقفازات (انظر جدول المواد).
- تأكد من أن الذباب قد أصيب بنجاح عن طريق تخدير الذباب الجريح على وسادة CO2-flyتحت منظار مجسم ومجروحة والتحقق من وجود ندبة الجرح (أي بقعة الميلانين على البطن، انظر الشكل 1B). تخلص من أي ذباب من المجموعة التجريبية التي لم تُصاب بنجاح.
- لبدء تشريح، وملء بئر واحد من 9 جيدا طبق تشريح الزجاج مع حل غريس. استخدام زوج من ملقط لفهم ذبابة أنثى الجرحى من جانب الظهر من الصدر وغمر الذبابة في البئر التي تحتوي على حل غريس.
- باستخدام ملقط في اليد المقابلة دون الإفراج عن الصدر، ثقب بشرة الظهرية أدناه tergite A6 وسحب بشرة قبالة النهاية الخلفية لذبابة الفاكهة. عادة ما تخرج الأعضاء الداخلية (المبيض والأمعاء) في هذه الخطوة. إذا لم يكن كذلك، ادفع بلطف على الجانب الظهري من البطن مع ملقط للضغط على الأعضاء المتبقية والتخلص منها في بئر فارغة.
- التقط كامل البطن عند تقاطع الصدر فوق تيرجيت A2 باستخدام ملقط ونقل البطن إلى بئر فارغ يحتوي على ~ 100 ميكرولتر من محلول غريس.
- كرر الخطوات 2.3-2.5 حتى يتم تشريح جميع البطن تطير.
- تقليل حجم محلول غريس إلى 30 ميكرولتر في البطن المتجمعة والمجمّعة.
- فيليه البطن مفتوحة عن طريق وضع البطن على الجانب الظهري مع ملقط في يد واحدة ومن ثم إدراج شفرة أسفل مقص الربيع فانا في تجويف البطن مع اليد الأخرى. قطع على طول خط الوسط الظهر حتى يتم فتح البطن بالكامل، والتي يمكن أن تتطلب ما يصل إلى ثلاث قطع (الشكل 1ج، 1D).
- قم بإعداد لوحة تشريح جافة مع أربعة دبابيس 0.10 ملم لكل منطقة تركيب البطن. كل 35 مم تشريح لوحة يمكن أن يصلح ما يصل إلى سبع مناطق تصاعد. Pipette 30 ميكرولتر من محلول غريس على كل منطقة تركيب ونقل بطن واحد إلى كل قطرة.
- اُثبِت البطن في اللبن على الطبق على الزوايا الظهرية الأربعة (الشكل 1E). تأكد من أن الأنسجة تقع مسطحة دون تمزق أو الإفراط في تمدد أنسجة البطن.
- لإصلاح الأنسجة، والماصات قبالة محلول غريس وإضافة 30 ميكرولتر من حل الإصلاح إلى البطن المثبتة.
تنبيه: ارتداء القفازات أثناء التعامل مع حل الإصلاح، حيث أن ما قبل الشكل هو مادة سامة. - كرر الخطوات 2.10-2.11 حتى يتم تثبيت جميع البطن فيلييد على لوحة تشريح.
- ضع علامة الشريط على الجزء السفلي من كل طبق لوضع علامة على كل مجموعة تحكم وتجريبية. إصلاح العينات لمدة 30-60 دقيقة في درجة حرارة الغرفة (RT).
- غسل قبالة حل الإصلاح عن طريق pipetting على 1.5 مل من 1X برنامج تلفزيوني لكل لوحة. التخلص من حل الإصلاح والبلاستيك في حاويات النفايات الكيميائية السائلة أو الجافة المناسبة وفقا للمبادئ التوجيهية المؤسسية.
- غسل لوحات 2x مع 1.5 مل من 1X PBS وتخزين الأنسجة الثابتة المغطاة في 1.5 مل من 1X PBS في حاوية بلاستيكية مع غطاء. إضافة طبقة من منشفة ورقية رطبة إلى الجزء السفلي من الحاوية وتخزين العينات في 4 درجة مئوية حتى جاهزة لمناعة في غضون 1 أسبوع من تشريح.
3. المناعةfluorescence
- تحضير الكواشف الطازجة (انظر جدول المواد):محلول الغسيل العازل (0.3% Triton X 100، 0.3% BSA في PBS 1x). يمكن حفظ بقايا الغسيل العازلة في 4 درجة مئوية واستخدامها لمدة 2 يوم تلطيخ البروتوكول. إعداد ما يكفي من حل الأجسام المضادة الأولية في مقايسة(الشكل 2) باستخدام المضادة لFASIII (1:50 الماوس المضادة للFasciclin-III) في عازلة غسل مع إما المضادة لجرخ (1:300 تقارب الأرانب النقية المضادة للحبوب8)أو المضادة لـ RFP (1:1,000 الأرانب المضادة لـ RFP). يمكن حفظ حلول الأجسام المضادة الأولية عند 4 درجة مئوية وإعادة استخدامها عدة مرات حتى يتم تقليل الإشارة بشكل كبير.
- Permeabilize الأنسجة عن طريق الأنابيب قبالة 1X PBS، مضيفا 1.5 مل من العازلة غسل، والاحتضان لمدة 30 دقيقة على الأقل على شاكر المدارية (80 دورة في الدقيقة) في RT.
- إزالة العازلة غسل وصمة عار بين عشية وضحاها مع 1.5 مل من محلول الأجسام المضادة الأولية، والاحتضان على شاكر المدارية (80 دورة في الدقيقة) في 4 درجة مئوية. جمع الحل الأجسام المضادة الأولية وحفظ في أنبوب في 4 درجة مئوية للتجارب في المستقبل.
- شطف أول عينة بسرعة مع 1X برنامج تلفزيوني ثم غسل 3x مع 1.5 مل من العازلة غسل. لكل غسل، احتضان العينات في RT على شاكر المداري لمدة 30 دقيقة على الأقل.
- أثناء الغسيل النهائي، قم بإعداد محلول الأجسام المضادة الثانوية: 1:1,000 حمار مضاد للأرنب أليكسا 488 أو 568 و1:1,000 الماعز المضاد للماوس أليكسا 488 أو 568 (أو الفلوروفوريس المفضلة) في عازلة الغسيل.
- إزالة العازلة غسل وصبغ الأنسجة مع 1.5 مل من محلول الأجسام المضادة الثانوية. تغطية العينات مع رقائق الألومنيوم واحتضان على شاكر المدارية في RT لمدة 3 ساعة. بدلاً من ذلك، يمكن احتضان العينات بين عشية وضحاها عند 4 درجات مئوية على شاكر مداري.
- غسل العينات عن طريق التخلص أولاً من محلول الأجسام المضادة الثانوية ثم شطف العينة بسرعة مع 1x PBS تليها ثلاثة يغسل مع 1.5 مل من عازلة الغسيل. لكل غسل، احتضان العينات في RT على شاكر المداري لمدة 30 دقيقة على الأقل.
- قم بإعداد حل DAPI عن طريق تخفيف DAPI إلى 10 ميكروغرام/مل في مخزن الغسيل. بعد الغسيل النهائي، عينات من البقع مع محلول DAPI 1.5 مل في RT لمدة 30 دقيقة.
- تخلص من محلول DAPI وعينات الشطف 2x في 1.5 مل من PBS 1x. تخزين الأنسجة الملون في 1.5 مل من 1X PBS في الظلام، مغطاة رقائق الألومنيوم، في 4 درجة مئوية حتى جاهزة لتركيب على شريحة زجاجية مع غطاء. وينبغي أن يتم تنفيذ الخطوة تصاعد في غضون 1 أسبوع.
4. نشاط دورة الخلية (EdU مقايسة)
- تشكل 10 mM EdU حل الأسهم من مجموعة انقر على iT (انظر جدول المواد)عن طريق حل مسحوق EdU في dH20 وخلط ل ~ 15 دقيقة حتى حل تماما. يمكن أن يكون حل الأسهم aliquoted (250 ميكرولتر لكل أنبوب) وتخزينها في -80 درجة مئوية.
- تغذية الذباب EdU عن طريق تخفيف أول مخزون EdU إلى 5 mM في dH2O. إضافة الخميرة الجافة حتى الحل غائم ودوامة لفترة وجيزة لخلط. قطع 0.5 مل سقف أنبوب وضعه في الجزء السفلي من قارورة الطعام ذبابة. دفع الغطاء في الطعام، لذلك فمن مستقرة.
- تخدير الذباب ونقل الذباب 3-5 يوم من العمر في القارورة. اضغط على الذباب إلى حافة واحدة حتى لا شيء عالق في الغطاء.
- ماصة 75 ميكرولتر من حل الخميرة-EdU في الغطاء. يجب أن يتم تغذية الذباب حل الخميرة EdU الطازجة كل يوم ونقلها إلى قارورة الطعام الطازج مع قبعة كل يوم لضمان عدم تعثر الذباب في الجزء السفلي من القارورة.
- لنقل الذباب، الوجه إلى قارورة جديدة مع قبعة، ووضع الذباب في النوم، والاستفادة من الذباب إلى جانب واحد، وإضافة حل جديد الخميرة EdU.
- في اليوم الثالث، إصابة الذباب والاستمرار في تغذية الخميرة-EdU حتى تشريح في 2 نقطة في البوصة(الشكل 4A). انظر البروتوكول القسم 2 لأساليب التشريح والتشطيب.
- إعداد الكواشف تلطيخ EdU: غسل العازلة (0.3٪ تريتون X 100، 0.3٪ BSA في 1x PBS)، عازلة permeabilization (0.5٪ تريتون X 100 في 1X PBS)، العازلة حظر (3٪ BSA في 1X PBS)، وإعداد الكواشف من عدة فحص EdU (انظر جدول المواد)،بما في ذلك 1x التفاعل العازلة و 1x رد فعل العازلة المضافة وفقا لتوجيهات الشركة المصنعة.
- غسل العينات لمدة 1 ساعة، والاختلاط في RT في 1.5 مل من العازلة الغسيل.
- إضافة 1.5 مل من المخزن المؤقت permeabilization وعينات احتضان لمدة 20 دقيقة.
ملاحظة: ذوبان وإعداد حل كوكتيل رد فعل باستخدام حجم 500 ميكرولتر / لوحة. - غسل العينات 1x بسرعة مع 1X PBS ثم 3x بسرعة مع 1 مل من العازلة حظر.
- Pipette قبالة جميع العازلة منع المتبقية وإضافة 500 μL من رد فعل كوكتيل الحل في لوحة. لوحات دوامة لضمان تغطية الأنسجة تماما. احتضان في درج في الظلام لمدة 1 ساعة في RT.
- غسل العينات 1x بسرعة مع 1.5 مل من العازلة حظر.
- وصمة عار مع 1.5 مل من محلول DAPI في 1:5,000 في عازلة غسل لمدة 30 دقيقة.
- غسل 2X مع 1X برنامج تلفزيوني بسرعة، والتفاف في احباط، وتخزينها في الظلام في 4 °C حتى جاهزة لتركيب العينات في غضون 3 أيام.
5. جبل الأنسجة الملون
- الحصول على جميع المواد المطلوبة لتركيب: الشرائح الزجاجية، وأغطية الزجاج، وطلاء الأظافر واضحة، وسائل الإعلام المتصاعدة، زوج من ملقط، ومناديل.
- لتركيب أنسجة ذبابة ملطخة ، unpin البطن من لوحة تشريح باستخدام ملقط تحت منظار مجسم. نقل الأنسجة إلى ~ 30 ميكرولتر من تصاعد وسائل الإعلام على غطاء زجاجي عن طريق الاستيلاء بلطف على الأنسجة مع ملقط من قبل الجناحين الظهرية لها، مع الحرص على تجنب لمس منطقة البطن مع ملقط.
- تحت stereomicroscope توجيه أنسجة البطن بحيث يكون في الداخل تواجه أسفل نحو غطاء (أي، البشرة الخارجية / شعيرات تواجه ما يصل). سحب البطن المنحى إلى حافة قطرة وسائل الإعلام باستخدام ملقط. سوف يساعد التوتر السطحي على الحفاظ على الأنسجة المسطحة(الشكل 1F).
ملاحظة: من المفيد للتصوير تنظيم البطن في عمود أو صف في هذه المرحلة. - تسمية شريحة زجاجية (أي، التحكم أو التجريبية) والتقاط الغطاء عن طريق جعل الشريحة ببطء أقرب إلى غطاء. قم بقلب الانزلاق ولطخة بلطف مع مسح لإزالة وسائط التركيب الزائدة.
- ختم حواف الغطاء مع طلاء الأظافر واضحة وكرر لجميع المجموعات التجريبية المتبقية. تخزين الشرائح في مربع شريحة في 4 درجة مئوية حتى جاهزة للصورة.
6. التصوير والتجهيز
- صورة منطقة جرح البطن يطير عن طريق تحديد موقع أول ندبة الميلانين مع مجهر confocal(الشكل 1B)،إما ماسحة نقطة أو إضاءة منظم (ApoTome) مع 40x النفط أو الهدف الجاف.
- تحقق من التعرض على كل قناة، مع التأكد من أن الإشارة أقل من التشبع. يجب أن تستند إعدادات التصوير إلى مجموعة العينات الأكثر سطوعًا. وهذا مهم بشكل خاص لتحليل ploidy كما قناة DAPI يحتاج إلى البقاء في نطاق خطي لقياس محتوى الحمض النووي بدقة.
- خذ صورة كاملة تى - المكدس فى جميع القنوات الثلاث مع مسافة مثالية لا تقل عن 0.50 ميكرومتر بين الشرائح. حفظ الصور الملتقطة وفتح الملف في برنامج تحليل الصور فيجي (المعروف أيضا باسم ImageJ).
- لكل صورة، قم بإنشاء إسقاط رصة z باستخدام خيار مجموع الشرائح لكافة القنوات.
- تدوير الصور حسب الضرورة لضمان اصطفا للنيات أفقيا عبر الصور(الشكل 3A والشكل 4E).
- احصد جميع الصور إلى مجموعة مستطيلة من 300 ميكرومتر × 300 ميكرومتر تمركزت حول موقع الجرح أو مركز التحكم غير المصاب. تحديد المنطقة عن طريق رسم مستطيل وتحديد تحرير | اختيار | حدد. تحقق من أن الوحدات ذات الحجم المقاس هي في ميكرون لضمان استخدام نفس المربع الحجم لجميع الصور التي سيتم تحليلها.
7. تحليل Endoreplication (ploidy)
- باستخدام فيجي، حدد نافذة قناة جره وقم بتكرار الصورة. ثم استخدم أداة العتبة لإنشاء قناع. ضبط يدويا عتبة عن طريق انزلاق شريط أعلى للحد من الخلفية دون التسبب في النوى لتقليص جذري(الشكل 4D).
- إذا كانت أي نواة في قناة Grh لمس في الصورة عتبة، واستخدام أداة فرشاة الطلاء (2 عرض بكسل) في نفس لون الخلفية، لرسم خط بين النوى. انقر لتطبيق 1x عند الانتهاء لإنشاء قناع النهائي.
- إنشاء خريطة منطقة ذات أهمية (ROI) باستخدام وظيفة تحليل الجسيمات: تعيين حجم إلى 5 ميكرومتر-60 ميكرومتر من أجل التقاط معظم النوى دون بما في ذلك الخلفية.
- قم بضبط خريطة عائد الاستثمار يدويًا حسب الحاجة في مدير عائد الاستثمار. حذف أي التحديدات التي ليست نواة وإضافة أي نواة إلى القائمة التي لم يتم تحديدها من خلال تحديد النواة مع أداة اختيار حر وإضافتها إلى مدير العائد على الاستثمار (الشكل 4D).
- حدد قناة DAPI ثم انقر فوق إظهار الكل في مدير ROI لتطبيق مخطط العائد على الاستثمار الذي تم إنشاؤه في قناة Grh على قناة DAPI.
- حذف أي تحديدات تتداخل فيها الخطوط العريضة للنيوية الظهارية مع النيوية غير البطية (مثل النوى من العضلات أو الدهون) من خريطة العائد على الاستثمار. Grainyhead فقط بقع الظهارية الظهارية، في حين أن DAPI البقع جميع النوى. تأكد من أن كل تحديد محدد يحتوي على نواة واحدة فقط وحذف أو تحرير أي تحديدات مع أكثر من نواة واحدة. حفظ قائمة العائد على الاستثمار المحررة.
- قياس المساحة والكثافة المتكاملة لكل نواة ظهارية في خريطة عائد الاستثمار باستخدام أدوات التحليل في فيجي. تصدير القيم إلى برنامج جدول بيانات.
- قياس متوسط خلفية الصورة باستخدام أداة التحديد الدائري. رسم ثلاث دوائر لا تتداخل مع أي نواة في مناطق مختلفة من صورة DAPI. أضف المنطقة والكثافة المتكاملة لكل دائرة إلى برنامج جدول بيانات لإنشاء سطوع صورة الخلفية.
- ابدأ بحساب متوسط الخلفية لكل وحدة مساحة لكل صورة عن طريق قسمة كل قيمة كثافة متكاملة للخلفية على المساحة المقابلة لها. ثم متوسط الكثافة الثلاثة المتكاملة لكل قياسات المنطقة للصورة من أجل الحصول على متوسط الخلفية لكل مساحة وحدة.
- بعد ذلك، حساب الخلفية الإجمالية لكل نواة DAPI بضرب مساحة النواة في متوسط الخلفية لكل وحدة المساحة. ويمكن بعد ذلك حساب كثافة DAPI التي تم تطبيعها لكل نواة تم قياسها عن طريق طرح الخلفية الكلية لكل نواة من كثافتها المتكاملة المقاسة.
- متوسط كافة قيم كثافة DAPI التي تم تسويتها من عنصر التحكم الظهاري غير المُلَجَّط. النيوية الظهارية غير المُضَنّة كانت تُحسب سابقاً لتكون لها قيمة غير مُلّمة من 2C ويمكن أن تكون بمثابة مرجع لحساب الظهارية في النوبة الظهارية من الظروف التجريبية8.
- حساب ploidy لكل نواة عن طريق تقسيم كثافة DAPI تطبيع كل نواة بواسطة القيمة التي تم تسويتها من مرجع عنصر تحكم ظهاري uninjujuded (2C) ، ثم قم بضرب القيمة على 2 إلى يساوي ploidy تطبيع (C-value):
(الكثافة النووية المتكاملة - الخلفية النووية المتكاملة الكثافة)/متوسط الكثافة النووية المتكاملة (نواة الظهارية غير المُضَلَّة = 2C) x 2 = ظهارية نووية (C) - ناوى الرسم البياني مع القيم ploidy كمؤامرة نقطة، المدرج التكراري، أو مجمعة في الرسم البياني شريط وفقا لذلك (أي، 2C [0.6-2.9C] ، 4C [3.0-5.9C] ، 8C [6.0-12.9C] ، 16C [13.0-24.9C] ، و > 32C [> 25.0C] (الشكل 3F).
النتائج
يتم توفير بروتوكول مفصل لاستخدام D. الميلانوغاستر كنموذج لدراسة البوليسيل المستحث بالجرح (WIP). هذا نموذج التئام الجروح يوفر العديد من المزايا على الثدييات ونماذج أخرى من ذبابة WIP. تم إحداث البوليبلويد بسهولة بواسطة ثقب ميكانيكي مع دبوس حشرة وخلايا بوليبلويد تم إنشاؤها خلال فترة قصيرة من الزمن (2-3 نقطة في البوصة) (الشكل 1A ، 1B)4. التحدي الرئيسي هو تشريح أنسجة البطن سليمة دون أي تشوهات في الظهارة. ظهارة D. الميلانوغاستر هو صدم بسهولة بطريق الخطأ أو خدش مع أدوات تشريح حادة. ولذلك، ينبغي أن تُمارس خطوات هذا البروتوكول قبل استخدامها وتحليلها.
أولاً، كانت الإصابة مقتصرة على بطن الإناث البطني، الذي يوفر منطقة كبيرة ومسطحة من الأنسجة المبهمة مثالية للتصوير. وقد لحقت الجروح ثقب في ظهارة pleurite، الذي يقع على جانبي ستيرنات خط الوسط البطني واستهدفت بين tergite (T) شرائح T4-T5(الشكل 1A-C). يوفر موضع الجرح هذا منطقة كبيرة مرئية لا تعطل من قبل تشريح. وتشمل الخطوات الصعبة مقص الربيع البطني والخطوات التثبيت (الشكل 1D, 1E). عملت خطوة قطع الربيع أفضل عندما تم قطع البطن في حجم مخفض من محلول غريس (~ 30 ميكرولتر) لتقليل حركة الأنسجة. وكان من الضروري قطع مركزها بشكل جيد على طول خط الوسط الظهري لتوفير مساحة كافية على اللوحات الظهرية في البطن دبوس مفتوحة على لوحة تشريح (الشكل 1C). البطن يجب أن تكون معلقة بلطف على الزوايا الأربعة دون قوة مفرطة (الشكل 1E). دفعة دبوس الذي هو من الصعب جدا تشويه أنسجة البطن ويمكن حتى دفع الأنسجة في لوحة تشريح. إذا حدث هذا، يجب التخلص من الأنسجة. مرة واحدة تم إصلاح أنسجة البطن، فإنه بقي على لوحة تشريح حتى stainence immunofluorescence كاملة والبطن شنت على غطاء زجاجي للتصوير (الشكل 1F).
التئام الجروح يتطلب ورقة ظهارية مستمرة لتشكيل، والذي يعتمد على الإندورفيشن و انصهار الخلية4،16. وسبتات وصلة بروتين FasIII، الذي تسميات تقاطعات الخلية الخلية، قدمت مؤشرا على ما إذا كان أي انزعاج المعالجة وقعت أثناء التحضير (الشكل 1G، 1H). البطن مع خدوش كبيرة (منطقة غير ملوثة) التي تُجَبَّر منطقة الجرح يجب التخلص منها ولم تُستخدم لإجراء مزيد من التحليل(الشكل 1حاء).
وكانت الخطوة التالية هي تحليل عينات سليمة لأي عيوب في الأعمال تحت التنفيذ. يتضمن هذا البروتوكول مقايسات مميزة للكشف عن جوانب مختلفة من استجابة WIP(الشكل 2). وقد اكتمل إصلاح الجروح عندما غطت خلية مركزية، كبيرة، متعددة النوى الجرح (الشكل 3أ). هنا تم الكشف عن الانصهار الخلية عن طريق تلطيخ لFASIII / Grh وتحديد عدد من جره+ الظهارية الظهارية النيوية تشمل في FasIII المنطقةالمبينة 4. تم الكشف عن عيوب في إغلاق الجروح أو إعادة الظهارة عندما لوحظ وجود فجوات > 10 ميكرومتر في الورقة الظهارية (الشكل 3B، السهم الأحمر). وكان هذا هو الحال، على سبيل المثال، عندما تم تثبيط WIP من قبل تفعيل دورة mitotic عن طريق التعبير عن stg، fzrRNAi، كما ذكرت مؤخرا16. في هذه الحالة الوراثية، 52٪ من الجروح لم تكن قادرة على تشكيل ورقة ظهارية مستمرة على الجرح (الشكل 3B, 3C).
طريقة أخرى لقياس إصلاح الجرح في هذا النموذج عن طريق تصور الغشاء الظهاري مع تعبير epi-Gal4 من UAS-mCD8-ChRFP4 (الشكل 2، الشكل 3D). في السيطرة، 91٪ من الجروح الظهارية مغلقة تماما من قبل 3 نقطة في البوصة، ولكن تثبيط WIP عن طريق منع endoreplication(E2f1RNAi)والانصهار الخلية(RacDN)في وقت واحد، كما ذكرت سابقا، تسبب 92٪ من الجروح الظهارية لتبقى مفتوحة تماما(الشكل 3D، 3E)8،16. أدى تنشيط دورة الخلية الميتوليتكية عن طريق التعبير عن stg ، FzrRNAi أيضًا إلى عيب في إغلاق الجروح الظهارية. ومع ذلك، عن طريق تصور غشاء الخلية الظهارية، يمكن تحديد مدى إعادة الظهارة عيب. وDE MUTANT (E2f1RNAi, RacDN) كانت الجروح تطير أكثر انفتاحا من stg, fzrRNAi الجروح (الشكل 3D, مخطط أحمر متقطع)16. هذا الغشاء التئام التئام قدم المزيد من المعلومات عن مدى عيب إصلاح الجرح. ونتيجة لذلك، يمكن تجميع عيوب إعادة الظهارة إما على أنها مفتوحة تمامًا أو مغلقة جزئيًا (أي 10 μm فجوات) أو مغلقة تمامًا(الشكل 3D, 3E).
بالإضافة إلى دمج الخلايا، تنمو الخلايا الظهارية في الحجم عن طريق الإندورفيشن، وهي دورة خلية غير مكتملة تضاعف محتوى الحمض النووي. تم تحليل Endoreplication بواسطة كل من نشاط دورة الخلية والقياسات النووية المباشرة الحمض النووي ploidy(الشكل 2 والشكل 4). هنا، تم الكشف عن نشاط دورة الخلية عن طريق دمج التناظرية thymidine، EdU (الشكل 4A، 4B). د. تم العثور على الخلايا الظهارية الميلانوغاستر لدخول endocycle، وهي دورة الخلية غير مكتملة التي تتأرجح بين مراحل S و G دون تدخل M المرحلة4،12. تم استكمال النظام الغذائي البالغ D. melanogaster مع EdU+ الغذاء قبل الإصابة والذباب تم الحفاظ على EdU+ النظام الغذائي حتى تشريح في 2 نقطة في البوصة (الشكل 4A). تم الكشف عن EdU باستخدام بروتوكول Click-iT التابع للشركة المصنعة. تم استخدام هذا الفحص EdU لتحديد أين ومتى، وكيف تم تشغيل العديد من النوى لدخول المرحلة S استجابة لجرح. باستخدام نظام Gal4 / UAS ، وجد مؤخرًا أن التعبير المحدد الظهاري للميريك يمكن إما أن يمنع (mycRNAi)أو يؤدي إلى تفاقم (Myc overexpression) كفاءة الخلايا الظهارية لدخول مرحلة S. ونتيجة لذلك، فقد ثبت أن Myc يكفي للحث على الإندورفيشن في الخلايا ما بعد التشنج، حتى من دون إصابة16،22.
بعد ذلك، تم تحديد ploidy الظهارية من خلال قياس محتوى الحمض النووي مباشرة. تم تحديد النوبة الظهارية عن طريق وصمة الفلوروس المناعي لعلامة محددة الظهارية، غر(الشكل 4D). وفي برنامج التصوير في فيجي، تم تحديد النيوية الظهارية بشكل منهجي ثم تم تحديدها باستخدام وصمة عار نووية من جره. ثم تم فصل Nuclei و ROIs مضاف على مجموع المكدسات DAPI صورة(الشكل 4D، السهم الأخضر). تم حذف أي نواة متداخلة يدويًا قبل قياس الكثافة المتكاملة للنيات المختارة(الشكل 4D، السهام الحمراء). هذه الطريقة semiautomated يسمح لأحد لتحديد كمية التوزيع و ploidy من معظم النوى في جميع أنحاء غير مصاب وإصلاحها ذبابة ظهارة البطن8. كما ذكرت مؤخرا، كانت تتكون النيوية الظهارية المحيطة الجرح من 44٪ نويات بوليبلويد مع محتوى الحمض النووي أكثر من 3C في 3 نقطة في البوصة (الشكل 4E, 4F)16. كما هو متوقع من نتائج EdU ، أدت الضربة القاضية من myc إلى كتلة كبيرة في الاندورفين ، حيث أن 9٪ فقط من النيوية الظهارية كانت متعددة الظهارات ، في حين أن فرط التعبير عن Myc أدى إلى 100٪ من النيوية الظهارية المتعددة حول موقع الجرح (الشكل 4F)16. كما تأثر الحجم النووي الظهاري بشكل واضح بتعبير المايك مع وجود نواة إما مخفضة أو مكبرة. ومع ذلك، المنطقة النووية ليست مقياسا دقيقا للآثار ploidy والفسيولوجية، وذلك لأن عوامل مثل تمتد الخلية يمكن أن تؤثر أيضا على حجم النووية دون التأثير على محتوى الحمض النووي20.
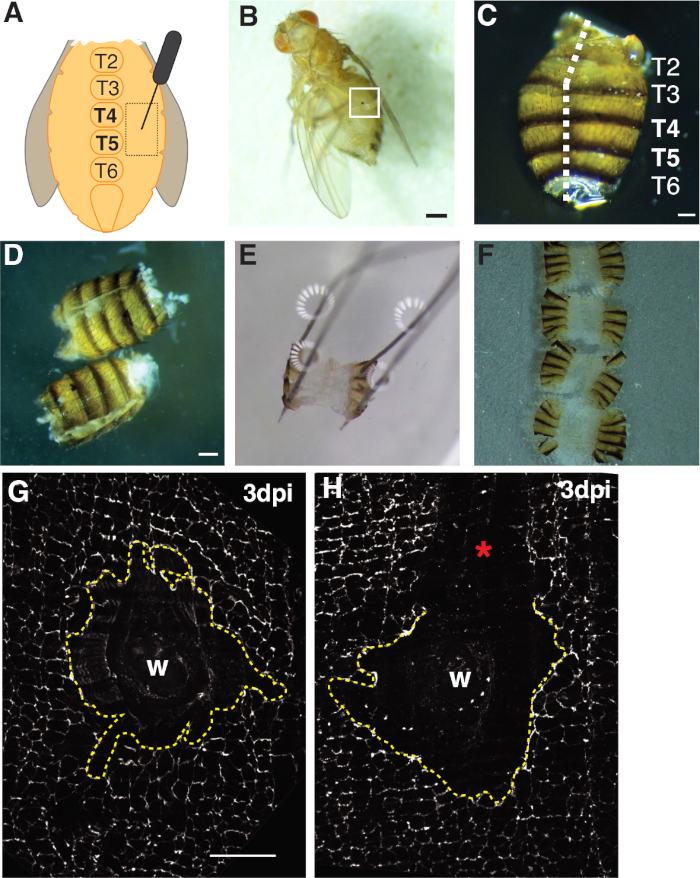
الشكل 1: الفاكهة الكبار ذبابة جرح البطن، تشريح، وتصاعد الأنسجة. (أ) الرسم البياني للجرح البطني الكبار. يجب أن يصاب الذباب على جانبي البطن عند تيرجيت 4 (T4). (B) أنثى بالغة تطير 3 نقطة في البوصة مع الجرب الميلانين شكلت من التئام الجروح (مربع أبيض). شريط مقياس = 50 μm. (C) تشريح البطن الكبار، عرض الظهرية، مع tergites المسمى. تم حشو البطن أسفل خط الوسط من الجانب الظهري (خط أبيض متقطع). شريط مقياس = 50 μm. (D) تشريح وملء البطن الكبار قبل التثبيت. شريط مقياس = 50 ميكرومتر . (E) البطن الكبار المثبتة على لوحة تشريح. تم وضع دبوس في كل من الزوايا الأربعة للبطن على الجانب الظهري. تم فتح الأنسجة بلطف ولكن لم تمتد، لتجنب تمزق. (F) تم تركيب البطن الكبار ووضعها على غطاء زجاجي مع الجزء الداخلي من البطن متجهة نحو غطاء و بشرة موجهة نحو الشريحة الزجاجية. (G) Fasiii تلطيخ من منطقة الجرح سليمة مع عدم وجود انزعاج المعالجة وsyncytium المركزية (خط أصفر متقطع). شريط مقياس = 50 ميكرومتر (H) صورة لمنطقة جرح مخدوش (*) مع منطقة فاسين غير ملوثة تعطل التزامنية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
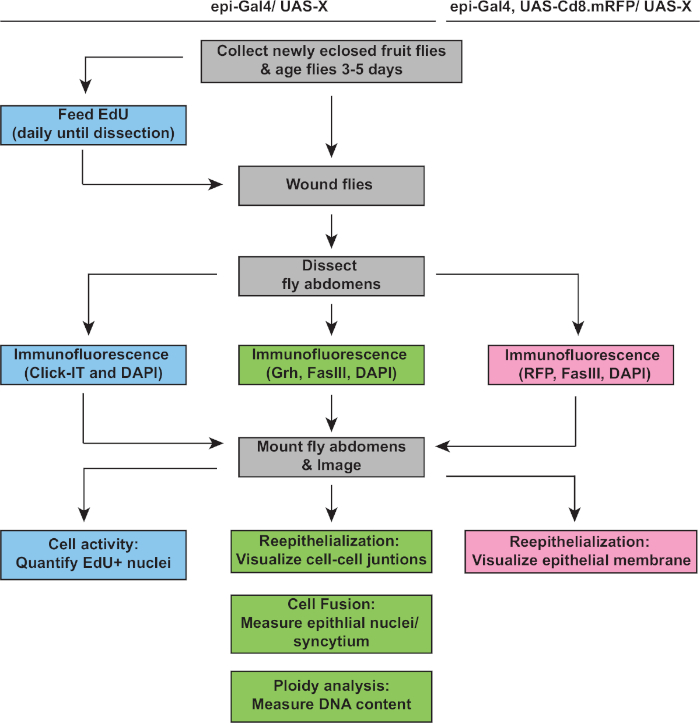
الشكل 2: سير عمل تحليل الأعمال تحت التنفيذ. ويصور المخطط البياني ثلاثة مقايسات الموصوفة في هذه الدراسة والخطوات المتداخلة والمميزة للكشف عن وقياس استجابة WIP. التقييس EdU يقيس نشاط دورة الخلية (مربعات زرقاء), ploidy وإعادة الظهارة يتم الكشف عن قبل Grh /FasIII المثبطة للمناعة (صناديق خضراء), والتعبير عن RFP غشاء يسمح قياس مدى إغلاق الجروح الظهارية (مربعات الوردي). الخطوات الشائعة هي في مربعات رمادية ويتم سرد D. أنواع وراثية سلالة الميلانوغاستر أعلاه. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
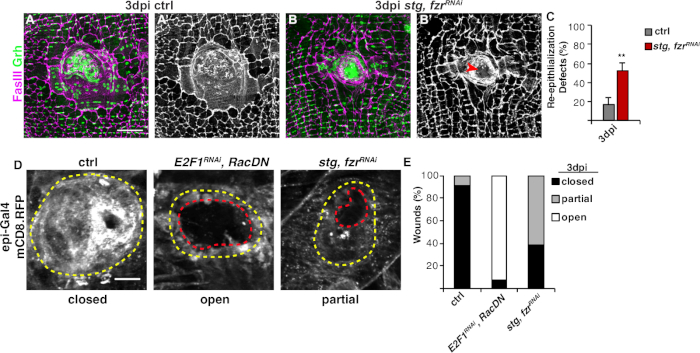
الشكل 3: طرق الكشف عن إعادة الظهارة أثناء WIP. وقد أُثِبَت إعادة الظهارة عندما تم تثبيط أعمال المسح تحت التنفيذ وراثياً. صور immunofluorescent من السيطرة (A) وstg ، fzrRNAi (B) في 3 نقطة في البوصة. كانت النيوية الظهارية وتقاطعات الحاجز ملطخة بغ (الأخضر) و FasIII (أرجواني)، على التوالي. (ألف' و 'ب') Fasiii تلطيخ وحدها أظهرت أن ضعف إعادة الظهارة (السهم الأحمر) في stg، fzrRNAi ظهارة. شريط مقياس = 50 ميكرومتر (C) القياس الكمي لعيوب إعادة الظهارة (٪ ) في 3 نقطة في البوصة (الرمادي): التحكم (n = 8)، stg، FzrRNAi (n = 6). تشير أشرطة الخطأ إلى خطأ قياسي؛ ثم يشير الخطأ إلى الخطأ القياسي. تم قياس الأهمية الإحصائية عن طريق اختبار T للطالب، **P < 0.01. ويمكن أيضاً اكتشاف إعادة الظهارة أثناء إصلاح الجروح عن طريق التعبير عن غشاء مرتبط ببرنامج تقديم العروض عبر EPI-Gal4، UAS-mCD8-RFP. (D)صور مناعية من السيطرة، E2F1RNAi،RacDN، وstg، fzrRNAi في 3 نقطة في البوصة. شريط مقياس = 20 ميكرومتر. جرح الجرح (مخطط أصفر) ومنطقة جرح ظهاري مفتوحة (مخطط أحمر). (E) القياس الكمي لاغلاق الجروح في ctrl (ن = 11)، E2F1RNAi، RacDN (ن = 13)، وstg، fzrRNAi (n = 13). مقتبسة من غريندرر وآخرون16. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
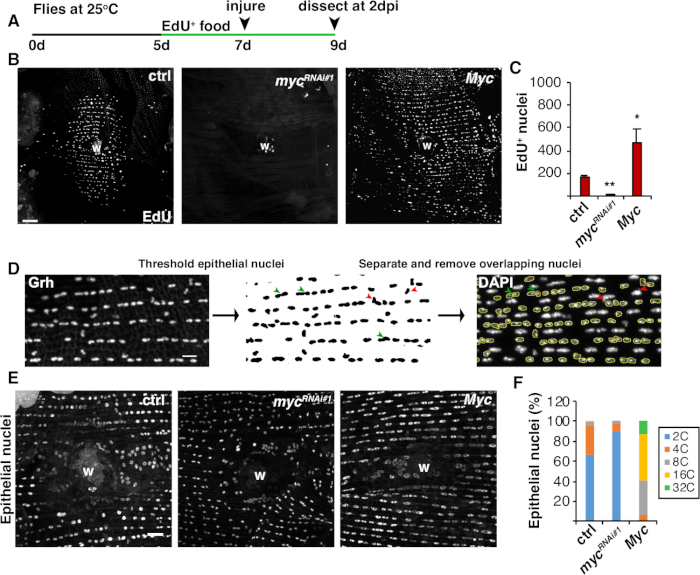
الشكل 4: طرق الكشف عن endoreplication أثناء WIP. (أ)الجدول الزمني للMEDU المقايسة: تم تغذية 75 μL 75 μL من 5 mM الخميرة EdU كل يوم 2 أيام قبل الإصابة واستمرت حتى 2 نقطة في البوصة. (ب) صور مناعية للتسمية EdU في سلالات ذبابة أعرب عن مع epi-Gal4 / نظام UAS في 2 نقطة في البوصة. جرح جرح (W). شريط مقياس = 50 ميكرومتر (C) متوسط عدد EdU + ظهارية النوى لكل ذبابة في 2 نقطة في البوصة: ctrl (ن = 37)، mycRNAi # 1 (ن = 10)، وميك (ن = 8). تشير أشرطة الخطأ إلى خطأ قياسي؛ ثم يشير الخطأ إلى الخطأ القياسي. تم قياس الأهمية الإحصائية عن طريق اختبار T للطالب، *P < 0.05، **P < 0.01. (D) التخطيطي للكشف عن وقياس ploidy النووية الظهارية. تم تحديد النيوية الظهارية وعتبها من خلال وصمة العار المضادة للGrh في فيجي. تم فصل النيوية الظهارية المتداخلة (رؤوس الأسهم الخضراء) أو إزالتها (رؤوس الأسهم الحمراء) إذا كانت متراكبة ب nuclei غير مضاف. تم قياس الكثافة المتكاملة والمنطقة النووية للصورة الملطخة بالناوية الملطخة DAPI. (E) حجم النووية الظهارية (Grh) تم تغييرها من قبل التعبير myc في 3 نقطة في البوصة. (F) الظهارية النووية ploidy (٪ ) في 3 نقطة في البوصة: ctrl (n = 4)، mycRNAi #1 (n = 6)، و Myc (n = 3). مقتبسة من غريندرر وآخرون16. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
قدم هو بروتوكول مفصل حول كيفية تشريح واستخدام ظهارة البطن D. الميلانوغاستر الكبار لدراسة كيفية تنظيم الجينات WIP عن طريق تغيير إعادة الظهارة و endoreplication أثناء إصلاح الجروح16. باستخدام هذه الطريقة ، تم تحديد myc proto-oncogene مؤخرًا كمنظم رئيسي WIP. مطلوب Myc للخلايا الظهارية لإنهاء إصابة ما بعد endoreplicate ويكفي للخلايا الظهارية هادئة لإنهاء كل من في الكبار يطير ظهارة والغدد الملحقة16,22. ووجد أيضا أن تحويل الخلايا الظهارية إلى دورة الخلية الميتوتيك من خلال التعبير عن stg، fzrRNAi يضر إصلاح الجرح. الدراسات المستمرة باستخدام هذه الطريقة سوف تحدد الجينات الأخرى اللازمة لتنظيم إعادة الظهارة والتنطيب أثناء WIP، والكشف عن أوجه التشابه والاختلاف على حد سواء لكيفية تنظيم polyploidy والوظائف في مجموعة متنوعة من الأنسجة.
هذا النموذج وطريقة تقديم مزايا فريدة من نوعها، بما في ذلك الحث سهلة من بوليبلويدي مع ثقب الميكانيكية وحقيقة أن يتم توليد الخلايا البوليبلويد في غضون أيام4. تعتمد بروتوكولات تشريح الأنسجة وإعدادها على تقنيات تشريح اليرقات23، ولكن البطن الذبابي البالغ أكثر صلابة وبالتالي يتم إزعاجه بسهولة. ونتيجة لذلك، يتطلب هذا البروتوكول ممارسة ودقة لعزل الأنسجة السليمة لدراسة WIP. وبمجرد تشريحها، ومع ذلك، فإن الظهارة واضحة للعيان وصورة بسهولة، مما أسفر عن لقطة من عملية التئام الجروح. يوفر هذا الأسلوب ثروة من المعلومات عن منظمة الذبابة الكبار الظهارية ، وحجم الخلية و syncytium ، و ploidy من الخلايا والنوى الفردية. في حين أن التصوير الحي غير ممكن بعد داخل ذبابة الفاكهة سليمة بسبب بشرة مبهمة لها، يمكن تكييف هذا البروتوكول لتشمل الظروف المتاحة حاليا السابقين فيفو ثقافة المستخدمة في D. melanogaster لأداء دراسات التصوير الحي على المدى القصير24.
في المستقبل، سيكون هذا النموذج مثاليا لدراسة التحدث المتبادل بين الخلايا إلى الخلية ومساهمة أنواع الخلايا الأخرى في الأعمال تحت التنفيذ عن طريق تنظيم التعبير الجيني مع نظام Gal4/UAS في أنواع الخلايا الأخرى من الفائدة. ويمكن أيضا الإجابة على أسئلة مماثلة باستخدام مجموعة متنوعة من الخلفيات الوراثية والمتحولة. يحتوي البطن ذبابة الكبار تشريح مجموعة متنوعة من أنواع الخلايا التي يمكن تصورها بسهولة باستخدام هذه الطريقة، بما في ذلك الجسم الدهون وoenocytes، ألياف العضلات الجانبي، والخلايا العصبية الحسية، القصبة الهوائية، والهيموسيات الضامة مثل الضامة. بالإضافة إلى ذلك، سيسمح هذا النموذج للباحثين بالتحقيق في كيفية تأثير المتغيرات الفسيولوجية على WIP، بما في ذلك الجنس والنظام الغذائي والعدوى والعمر والضغوط البيئية. في حين أن البروتوكول يستخدم ذبابة الإناث الكبار بسبب حجمها الأكبر ، يحدث WIP أيضًا في ذبابة الفاكهة الذكرية (Gjelsvik و Losick ، غير منشور). تم العثور على خلايا بوليبلويد تنشأ خلال الشيخوخة والأمراض المرتبطة بالعمر في الكبد الثدييات والدماغ والعين والقلب12. نموذج ذبابة الفاكهة سيمكن الباحثين من دراسة تعدد الرض في السياقات الفسيولوجية والمرض لأن الجينات المرتبطة بالأمراض البشرية يتم الحفاظ عليها بشكل كبير.
Disclosures
اي.
Acknowledgements
في كلية بوسطن، نود أن نشكر الدكتور إريك فولكر على استخدام كاميرا مختبره وإعداد مجهر المجهر المجسم للتصوير وبريت جودسون في كلية بوسطن للتصوير الأساسية للبنية التحتية والدعم. ونود أيضا أن نشكر موارد المجتمع يطير: بلومينغتون دروسوفيليا مركز الأسهم (NIH P40OD018537)، مركز موارد فيينا دروسوفيليا، ومركز TRiP في كلية الطب بجامعة هارفارد (NIH/NIGMS R01-GM084947) لتوفير المخزونات المعدلة وراثيا المستخدمة في هذه الدراسة. تم الحصول على الأجسام المضادة FasIII الماوس من الدراسات التنموية Hybridoma البنك بدعم من NICHD المعاهد القومية للصحة والحفاظ عليها في جامعة ايوا، قسم البيولوجيا، مدينة ايوا، IA. وقد تم دعم البحوث التي تم الإبلاغ عنها في هذا المنشور من قبل المعهد الوطني للعلوم الطبية العامة التابع للمعاهد الوطنية للصحة تحت رقم الجائزة R35GM124691. والمحتوى هو مسؤولية المؤلفين وحده ولا يمثل بالضرورة وجهات النظر الرسمية للمعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| 35 mm Petri dishes | Fisher Scientific | FB0875713 | For creating plates to dissect in |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | For preparing staining reagents in |
| AxioImager M2 with Apotome | Zeiss | NA | For imaging samples |
| Blowgun mini | Genesee Scientific | 54-104M | For anethesizing D. melanogaster strains |
| Bovine Serum Albumin, 30% | Sigma | A7284-500ML | For immuostaining |
| Carbon dioxide tank | various distributors | N/A | For anethesizing D. melanogaster strains |
| Click-iT EdU 594 Kit | Thermofisher | C10339 | For EdU assay |
| Coverslips | Thermofisher | 3406 | For mounting |
| DAPI | Sigma | D9542-10MG | For immuostaining |
| Dissecting Plates (use Sylgard 184 Sil Elastic Kit) | Ellsworth Adhesives | 184SIL | For creating plates to dissect in. Mix epoxy as directed, let dry overnight |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A21206 | For secondary immuostaining |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A10042 | For secondary immuostaining |
| Drosophila tubing and fittings | Genesee Scientific | 59-124C, 59-123, 59-140 | For anethesizing D. melanogaster strains |
| Dumont #5 Forceps | Fine Science Tools | 11252-20 | For dissecting |
| epi-Gal4 | Bloomington Drosophila Stock Center (b) | b38793 | Losick et al. Current Biology, 2013 |
| epi-Gal4, UAS-mCD8.RFP | Bloomington Drosophila Stock Center (b) | b38793, b27392 | Losick et al. Current Biology, 2013 |
| Excel | Microsoft | For performing ploidy calculations | |
| Fiji/ImageJ (image analysis software) | NIH | https://imagej.nih.gov/ij | For image analysis |
| Fly food | Archon Scientific | N/A | Corn Syrup/Soy food |
| Flystuff Flypad | Genesee Scientific | 59-114 | For anethesizing D. melanogaster strains |
| Glass dissecting dish | Fisher Scientific | 13-748B | For performing dissections in |
| Glass slides | Fisher Scientific | 12-518-104C | For mounting |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A11001 | For secondary immuostaining |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A11031 | For secondary immuostaining |
| Grace's Insect Medium, unsupplemented | Thermofisher | 11595030 | For dissecting in |
| Insect pins | Fine Science Tools | 26002-10 | For wounding and pinning fly abdomens flat |
| Mouse anti-Fasciclin III (Drosophila) Primary Antibody | Developmental Studies Hybridoma Bank | 7G10 | For immunostaining epithelial cell-cell junctions |
| Mouting media | Vector Laboratories | H-1000 | Anti-fade mounting media to prevent photo bleaching during imaging |
| Nail polish | Electron Microscopy Sciences | 72180 | For sealing slides |
| Ortibal shaker | Fisher Scientific | 02-217-988 | For immuostaining |
| Phosphate Buffered Saline, PH 7.4 | Sigma | P3813-10PAK | For staining |
| Pin holders | Fine Science Tools | 91606-07 | For wounding |
| Rabbit anti-Grainyhead Primary Antibody | N/A | N/A | For immunostaining epithelial nuclei. Protocol to make antibody can be found (Ref. #4 and 8) |
| Rabbit anti-RFP Primary Antibody | MBL | PM005 | For immunostaining mCD8-RFP fly epithelium |
| Stereomicroscope | Olympus | SZ51 | For dissecting and mounting fly tissue |
| Triton X-100 | Sigma | 10789704001 | For immuostaining |
| UAS-E2F RNAi, UAS-RacDN | VDRC (v) and Bloomington Drosophila Stock Center (b) | v108837, b6292 | Losick et al. Current Biology, 2013 |
| UAS-fzr RNAi, UAS-Stg | VDRC (v) and Bloomington Drosophila Stock Center (b) | v25550, b56562 | Grendler et al. Development, 2019 |
| UAS-Myc | Bloomington Drosophila Stock Center (b) | b9674 | Grendler et al. Development, 2019 |
| UAS-myc RNAi | Bloomington Drosophila Stock Center (b) | b36123 | Grendler et al. Development, 2019 |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | For dissecting |
References
- Abreu-Blanco, M. T., Verboon, J. M., Liu, R., Watts, J. J., Parkhurst, S. M. Drosophila embryos close epithelial wounds using a combination of cellular protrusions and an actomyosin purse string. Journal of Cell Science. 125 (Pt 24), 5984-5997 (2012).
- Wood, W., et al. Wound healing recapitulates morphogenesis in Drosophila embryos. Nature Cell Biology. 4 (11), 907-912 (2002).
- Galko, M. J., Krasnow, M. A. Cellular and genetic analysis of wound healing in Drosophila larvae. PLoS Biology. 2 (8), E239 (2004).
- Losick, V. P., Fox, D. T., Spradling, A. C. Polyploidization and cell fusion contribute to wound healing in the adult Drosophila epithelium. Current Biology. 23 (22), 2224-2232 (2013).
- Wang, Y., et al. Integrin Adhesions Suppress Syncytium Formation in the Drosophila Larval Epidermis. Current Biology. 25 (17), 2215-2227 (2015).
- Ramos-Lewis, W., LaFever, K. S., Page-McCaw, A. A scar-like lesion is apparent in basement membrane after wound repair in vivo. Matrix Biology. 74, 101-120 (2018).
- Lee, C. W., Kwon, Y. C., Lee, Y., Park, M. Y., Choe, K. M. cdc37 is essential for JNK pathway activation and wound closure in Drosophila. Molecular Biology of the Cell. 30 (21), 2651-2658 (2019).
- Losick, V. P., Jun, A. S., Spradling, A. C. Wound-Induced Polyploidization: Regulation by Hippo and JNK Signaling and Conservation in Mammals. PLoS One. 11 (3), e0151251 (2016).
- Tamori, Y., Deng, W. M. Tissue repair through cell competition and compensatory cellular hypertrophy in postmitotic epithelia. Developmental Cell. 25 (4), 350-363 (2013).
- Xiang, J., et al. EGFR-dependent TOR-independent endocycles support Drosophila gut epithelial regeneration. Nature Communications. 8, 15125 (2017).
- Cohen, E., Allen, S. R., Sawyer, J. K., Fox, D. T. Fizzy-Related dictates A cell cycle switch during organ repair and tissue growth responses in the Drosophila hindgut. Elife. 7, e38327 (2018).
- Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. Solving the Polyploid Mystery in Health and Disease. Trends in genetics: TIG. 35 (1), 6-14 (2019).
- Cao, J., et al. Tension Creates an Endoreplication Wavefront that Leads Regeneration of Epicardial Tissue. Developmental Cell. 42 (6), 600-615 (2017).
- Zhang, S., et al. The Polyploid State Plays a Tumor-Suppressive Role in the Liver. Developmental Cell. 44 (4), 447-459 (2018).
- Lazzeri, E., et al. Endocycle-related tubular cell hypertrophy and progenitor proliferation recover renal function after acute kidney injury. Nature Communications. 9 (1), 1344 (2018).
- Grendler, J., Lowgren, S., Mills, M., Losick, V. P. Wound-induced polyploidization is driven by Myc and supports tissue repair in the presence of DNA damage. Development. 146 (15), 173005 (2019).
- Mehrotra, S., Maqbool, S. B., Kolpakas, A., Murnen, K., Calvi, B. R. Endocycling cells do not apoptose in response to DNA rereplication genotoxic stress. Genes & Development. 22 (22), 3158-3171 (2008).
- Patterson, M., et al. Frequency of mononuclear diploid cardiomyocytes underlies natural variation in heart regeneration. Nature Genetics. 49 (9), 1346-1353 (2017).
- Gonzalez-Rosa, J. M., et al. Myocardial Polyploidization Creates a Barrier to Heart Regeneration in Zebrafish. Developmental Cell. 44 (4), 433-446 (2018).
- Webster, M., Witkin, K. L., Cohen-Fix, O. Sizing up the nucleus: nuclear shape, size and nuclear-envelope assembly. Journal of Cell Science. 122 (Pt 10), 1477-1486 (2009).
- Knouse, K. A., Lopez, K. E., Bachofner, M., Amon, A. Chromosome Segregation Fidelity in Epithelia Requires Tissue Architecture. Cell. 175 (1), 200-211 (2018).
- Box, A. M., et al. Endocycles support tissue growth and regeneration of the adult Drosophila accessory gland. bioRxiv. , 719013 (2019).
- Karim, M. R., Moore, A. W. Morphological analysis of Drosophila larval peripheral sensory neuron dendrites and axons using genetic mosaics. Journal of Visualized Experiments. (57), e3111 (2011).
- Dai, W., Montell, D. J. Live Imaging of Border Cell Migration in Drosophila. Methods in Molecular Biology. 1407, 153-168 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved