A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ثقافة بيريكيتس الشعيرات الدموية في الدماغ لقياسات الكالسيوم السيتوسوليك ودراسات تصوير الكالسيوم
In This Article
Summary
البيريات الشعيرات الدموية هي لاعبين أساسيين في تنظيم خصائص حاجز الدم في الدماغ وتدفق الدم. يصف هذا البروتوكول كيف يمكن عزل الشعيرات الشعرية في الدماغ، واستزراعها، وتتميز فيما يتعلق بنوع الخلية، وتطبيقها على التحقيقات في إشارات الكالسيوم داخل الخلايا مع تحقيقات الفلورسنت.
Abstract
ترتبط الـ Pericytes بالخلايا البطانية و endfeet الفلكية في بنية تعرف باسم الوحدة العصبية الوعائية (NVU). وظيفة بيريميري الدماغ غير معروفة تماما. وقد اقترح Pericytes للمشاركة في تطوير الشعيرات الدموية، وتنظيم ضيق الحاجز البطانية ونشاط trancytosis، وتنظيم لهجة الشعرية ولعب أدوار حاسمة في بعض أمراض الدماغ.
Pericytes هي صعبة للتحقيق في الدماغ سليمة بسبب صعوبات في تصور العمليات في الدماغ parenchyma، فضلا عن القرب من الخلايا الأخرى من NVU. يصف هذا البروتوكول طريقة لعزل وثقافة الشعيرات الدموية الدموية الأولية في الدماغ واستخدامها التالي في دراسات تصوير الكالسيوم ، حيث يمكن التحقيق في آثار ناهضين يشاركون في إشارات الدماغ والأمراض. يسمح لشظايا الشعيرات الدموية القشرية بالتعلق بأسفل قارورة الثقافة ، وبعد 6 أيام ، نمت الخلايا البطانية والخلايا من شظايا الشعيرات الدموية. تتم إزالة الخلايا البطانية عن طريق التربسينسيس لطيف ويتم استزراع pericytes لمدة 5 أيام إضافية قبل passaging.
يتم بذر pericytes المعزولة في 96-جيدا لوحات ثقافة وتحميلها مع صبغة مؤشر الكالسيوم (Fura-2 acetoxymethyl (AM)) للسماح لقياس مستويات الكالسيوم داخل الخلايا في إعداد قارئ لوحة. بدلاً من ذلك، يتم بذر البيريسيت على الأغطية ويتم تركيبها في غرف الخلايا. بعد التحميل مع مؤشر الكالسيوم (Cal-520 AM)، يمكن إجراء التصوير الحي للكالسيوم باستخدام المجهر الناظر في الطول الموجي للإثارة من 488 نانومتر والطول الموجي للانبعاثات من 510-520 نانومتر.
وقد استخدمت الطريقة المذكورة هنا للحصول على قياسات الكالسيوم الأولى داخل الخلايا من بيريكيات الشعيرات الدموية الأولية في الدماغ، مما يدل على أن يتم تحفيز بيريكيتس عن طريق ATP وقادرة على العقد في المختبر.
Introduction
الشعيرات الدموية في الدماغ، جنبا إلى جنب مع الخلايا البطانية والخلايا الفلكية، تشكل NVU1،2،3. تشكل الخلايا البطانية ، التي تشكل الأساس الهيكلي للعيعييات ، أنابيب أسطوانية طويلة بقطر 5-8 ميكرومتر. وتغطي الخلايا البطانية بشكل متقطع مع الخصيات وتحيط بها نتوءات من الخلايا الفلكية; endfeet الفلكية.
حاجز الدم في الدماغ (BBB)، يقع في الشعيرات الدموية في الدماغ، هو الموقع الرئيسي لتبادل المواد الغذائية والغازات ونفايات المنتجات بين الدماغ والدم. كما يحمي BBB الدماغ من السموم العصبية الذاتية والخارجية، ويعمل كحاجز لإيصال عدد كبير من مركبات المخدرات. وظيفة الحاجز هو مجال التركيز، فضلا عن عقبة، لشركات الأدوية تطوير أدوية الجهاز العصبي المركزي (CNS). وقد أثار هذا اهتماما كبيرا في التحقيق في خلايا NVU في الثقافة4. وقد تم زراعة الخلايا الفلكية في الدماغ والخلايا البطانية وتتميز في عدد من الدراسات، في حين أن الدراسات والبروتوكولات لثقافة البيرثيت متناثرة.
وقد وصفت البروتوكولات المنشورة سابقا جيل من الثقافات الشعيرات الدموية في الدماغ إلى حد ما، وذلك باستخدام مجموعة من النهج المختلفة مثل المناعة5،وسائل الإعلام عالية ومنخفضة الجلوكوز6،الخلايا الفلورية المنشطة فرز7،كثافة الانحدار المركزي8،الخ. على الرغم من أن هذه الأساليب تبدو كافية للحصول على ثقافات من pericytes، وبعضها مضيعة للوقت، وتكلفة باهظة الثمن وال pericytes الحصول على قد لا تكون مثالية نظرا لعدد من الممرات الثقافة التي يمكن أن دي- تمييز pericytes9. وعلاوة على ذلك، فإن إمكانات pericytes مثقف في دراسات الإشارات في المختبر لم يتم استكشافها إلى حد ما حتى الآن.
يركز العمل الحالي على توليد ثقافات pericyte من الشعيرات الدموية المخية البقرية المعزولة والإعداد اللاحق للقياسات ودراسات التصوير للتغيرات في الكالسيوم داخل الخلايا ، وهو رسول ثانٍ مهم داخل الخلايا. نحن نصف بإيجاز عزل الشعيرات الدموية عن المادة الرمادية القشرية (للحصول على التفاصيل انظر هيلمز وآخرون10)وعزل وثقافة البيريثيات في زراعة أحادية نقية دون تلوث مع الخلايا البطانية أو الدبقية. ثم نقدم بروتوكولا لبذات من pericytes في 96-جيدا لوحات وبروتوكولات التحميل لمسبار الكالسيوم فورا -2 AM. وأخيرا، فإننا نظهر كيف يمكن استخدام البيرليكات في التصوير confocal في الوقت الحقيقي في غرف ثقافة المجهر ووصف البروتوكولات لهذا.
Protocol
1- إعداد المخازن المؤقتة والحلول استزراع الخلايا
- إعداد محلول مخزون الكولاجين عن طريق حل 5 ملغ من الكولاجين الرابع من المشيمة البشرية في 50 مل من برنامج تلفزيوني بين عشية وضحاها في 4 °C. Aliquot حل الأسهم في أجزاء 5 مل وتخزينها في -20 درجة مئوية.
- إعداد محلول مخزون الليفي عن طريق حل 5 ملغ من الليفي في 5 مل من الماء العقيم بين عشية وضحاها. تخزين الأرصدة فيبرومينكتين في aliquots من 500 ميكرولتر في -20 درجة مئوية. عند الذوبان، أضف برنامج تلفزيوني إلى حجم نهائي قدره 50 مل لإعداد حل العمل وتخزينه عند 4 درجات مئوية.
- إعداد Dulbecco 'sعدّد النسر المتوسط (DMEM) متوسطة كاملة بإضافة 50 مل من مصل الأبقار الجنين (FBS)، 5 مل من الأحماض الأمينية غير الأساسية MEM و 5 مل من البنسلين /ستربتوميسين (0.1 غرام / لتر كبريتات ستربتوميسين و 100،000 U / لتر البنسلين G الصوديوم) إلى 500 مل من DMEM.
- إعداد 5 ملغ / مل محلول الأسهم الهيبارين عن طريق حل ملح الصوديوم الهيبارين في برنامج تلفزيوني وتمريره من خلال مرشح 0.2 ميكرومتر للتعقيم. تخزين حل الأسهم عند 4 درجة مئوية.
- إعداد متوسط النمو (GM) مباشرة قبل الاستخدام؛ مزيج 10 مل من DMEM-comp و 250 ميكرولتر من محلول الأسهم الهيبارين في T75-قارورة.
2. عزل الشعيرات الدموية من الدماغ البقري الطازج
ملاحظة: يتم عزل الشعيرات الدموية المخ البقرية واستزراعها كما هو موضح سابقا (هيلمزوآخرون. 10).
- جمع العقول من العجول، لا يزيد عمرها عن 12 شهرا، من المسلخ وجلب مباشرة إلى المختبر على الجليد.
- إزالة السحايا وجمع كل المادة الرمادية من الدماغ باستخدام مشرط. تحديد السحايات كما فيلم يغطي الدماغ والرمادي المادة من لونه الرمادي.
- استخدام 40 مل مطحنة الأنسجة Dounce لتجانس المادة الرمادية في Dulbecco 'sعدل النسر المتوسط (DMEM). ملء الجزء ضئيلة من طاحونة الأنسجة 1/5 مع تعليق المادة الرمادية وإضافة DMEM حتى يتم تعبئة الجزء ضئيلة.
- فصل الشعيرات الدموية من الخلايا الحرة وقطع الأنسجة الصغيرة عن طريق ترشيح التجانس من خلال مرشح صافي النايلون 160 ميكرومتر. قم بمسح عوامل التصفية باستخدام شركة DMEM. استرداد الشعيرات الدموية وتجمع التعليقات في أنابيب الطرد المركزي 50 مل.
- Resuspend الشعيرات الدموية في شركة DMEM و إضافة مزيج انزيم من DNase I (170 U/mL)، الكولاجين من النوع الثالث (200 U/mL) و تريبسين (90 U/mL). اترك التعليق لمدة 1 ساعة في حمام مائي 37 درجة مئوية لهضم الشعيرات الدموية.
- تشغيل التعليق من خلال مرشح شبكة 200 ميكرومتر و resuspend في FBS مع 10٪ ثنائي الفينيل سلفوكسيد (DMSO). تجميد الشعيرات الدموية بين عشية وضحاها في -80 درجة مئوية ونقلها إلى النيتروجين السائل في اليوم التالي لتخزين على المدى الطويل.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا.
3- البذر واستزراع الشعيرات الدموية البقرية
- اليوم 0: مزيج 0.7 مل من الكولاجين الرابع الأسهم مع 6.3 مل من برنامج تلفزيوني. أضف الحل إلى قارورة T75 واترك القارورة لمدة 2 ساعة في درجة حرارة الغرفة (RT) أو اتركها بين عشية وضحاها عند 4 درجات مئوية.
- إزالة الحل الكولاجين من القارورة وغسل ثلاث مرات مع برنامج تلفزيوني.
- إضافة 7 مل من حل عمل فيبرومينيكتين وترك القارورة لمدة 30 دقيقة في RT. ثم، إزالة حل فيبرومينيكين وبذور الشعيرات الدموية مباشرة بعد.
- خلال فترة الانتظار 30 دقيقة، ذوبان قارورة واحدة من الشعيرات الدموية في حمام مائي 37 °C.
- عندما يتم إذابة الشعيرات الدموية، ونقل فورا إلى أنبوب الطرد المركزي مع 30 مل من شركات DMEM والطرد المركزي لمدة 5 دقائق في 500 س ز وRT. إزالة DMEM-comp من الأنبوب وإعادة تعليق بيليه الشعيرات الدموية في 10 مل من 10 زمن جديدة.
- نقل تعليق 10 مل إلى المغلفة T75-قارورة وترك الشعيرات الدموية إلى التمسك الجزء السفلي من قارورة لمدة 4-6 ح في ح 37 درجة مئوية حاضنة في 10٪ CO2.
ملاحظة: معدل نمو الخلايا أعلى بنسبة 10٪ ثاني أكسيد الكربون2 بدلاً من 5٪ CO2التقليدية. - بعد 4-6 ساعة من الحضانة فحص القارورة تحت المجهر الخفيف. وينبغي الآن أن تعلق كسور الشعيرات الدموية إلى أسفل القارورة(الشكل 1، اليوم 0).
- إعداد جنرال موتورز وpirate متوسطة DMEN-comp جدا حذرا من الشعيرات الدموية واستبدالها مع 10 مل من جنرال موتورز الطازجة.
- اليوم الثاني: إزالة جنرال موتورز من الشعيرات الدموية واستبدالها مع 10 مل من جنرال موتورز الطازجة التي أدلى بها. وينبغي أن تكون مرئية من الشعر الشعري من الشعيرات الدموية تحت مجهر خفيف في هذه المرحلة(الشكل 1, يوم 2-3).
4. عزل pericytes الأولية من الشعيرات الدموية المخ البقرية
-
اليوم الرابع: تفقد الشعيرات الدموية تحت مجهر الضوء.
ملاحظة: يجب أن تكون القارورة الآن 60-70% تقريبًا التقاء لتوفير كمية مناسبة من pericytes(الشكل 1، اليوم 4). وإذا لم يكن الأمر كذلك؛ استبدال جنرال موتورز مع 10 مل من المتوسطة الطازجة وترك القارورة في الحاضنة ليوم آخر. - التعرق المتوسطة وغسل الخلايا بلطف في برنامج تلفزيوني.
- إضافة 2 مل من تريبسين-EDTA المذاب للخلايا البطانية وترك القارورة في الحاضنة لمدة 1-3 دقيقة. إخراج القارورة في كثير من الأحيان ومراقبة مع المجهر خلال هذه الفترة الزمنية.
ملاحظة: يجب أن تكون الخلايا البطانية تقريب و فصل من القارورة; يجب أن تكون pericytes مرئية كخلايا مع "شبح" مورفولوجيا ولا تزال تعلق على سطح القارورة. هذه خطوة صعبة ومهمة. من الضروري إزالة معظم الخلايا البطانية لتجنب تلوث أحادية البيريك، ولكن يمكن أيضاً فصل التربسينية المطولة. يمكن أن يختلف وقت التربسينات قليلاً من وقت لآخر ، وبالتالي من الأهمية القصوى مراقبة القارورة بشكل متكرر مع المجهر أثناء العلاج. - اضغط بلطف على القارورة، عندما بدأت الخلايا البطانية في التقريب، لفصل الخلايا البطانية المخفّبة.
- لإيقاف التربسيني، أضف 10 مل من DMEM-comp إلى القارورة. قم بشطف القارورة بعناية عدة مرات باستخدام الوسيط لإزالة الخلايا البطانية. استلهم تعليق الخلية البطانية من القارورة. يمكن الآن استخدام الخلايا البطانية لأغراض أخرى.
- إضافة 10 مل من DMEM-comp إلى القارورة. ننظر تحت المجهر الضوء لضمان وجود البيركيات لا تزال موجودة ومتعلقة إلى أسفل. ضع القارورة مرة أخرى في الحاضنة للسماح للثقافة الغنية بال pericyte بالنمو.
ملاحظة: من المهم ملاحظة الثقافة أثناء الأيام التالية. إذا كان لا يزال هناك كمية لا بأس بها من الخلايا البطانية التي تنمو آخر تريبسين العلاج يمكن أن يؤديها. - السماح للعمود أحادية التحلل لتنمو مع تغيير DMEM-comp. متوسطة كل يوم ثاني. تحقق من نمو الخلايا تحت المجهر الخفيف(الشكل 1، اليوم 5-8).
5. توليد وتخزين أحادية من pericytes الأبقار الأولية
-
اليوم 8-9: فحص الشعيرات الدموية تحت مجهر خفيف
ملاحظة: يجب أن يكون ال pericytes قد وصلت الآن 70-80٪ التقاء وتنمو في الجزر في قارورة(الشكل 1، اليوم 9). إذا كان التقاء البيرليكات أقل من 70٪، اسمح للخلايا بالنمو ليوم آخر. سوف لا تشكل الـ pericytes أحادية كاملة كما ستفعل الخلايا البطانية. - الطامح DMEM-comp وغسل البيريطات مع 7 مل من برنامج تلفزيوني.
- إضافة 2 مل من التربسين-EDTA إلى القارورة واتركها في الحاضنة لمدة 2-3 دقائق. ضع القارورة بشكل متكرر تحت المجهر الخفيف لمراقبة عندما يتم تقريب البيريسيت وفصله عن القارورة. عندما بدأت pericytes في التقريب ، يمكن استغلالها بلطف قارورة لفصل الخلايا.
- اضغط بلطف على القارورة، عندما بدأت pericytes لتجميع، لفصل الخلايا.
- إضافة 10 مل من DMEM-comp إلى القارورة لوقف عملية التربسيني. قم بشطف القارورة عدة مرات باستخدام الوسيط للمساعدة في فصل البيرليكات الأخيرة.
- نقل تعليق الخلية 12 مل إلى أنبوب الطرد المركزي 50 مل وملء ما يصل إلى 30 مل مع DMEM-comp.
- الطرد المركزي تعليق الخلية لمدة 5 دقائق في 500 س ز وRT. التعرق في DMEM-comp. بعناية دون لمس بيليه الخلية. Resuspend بيليه الخلية في 3 مل من FBS مع DMSO 10٪.
- نقل تعليق الخلية إلى cryovials; إضافة 1 مل لكل من، لذلك سيكون هناك ما مجموعه 3 قوارير لكل T75-قارورة من pericytes. تجميد pericytes في -80 درجة مئوية بين عشية وضحاها ونقلها إلى النيتروجين السائل في اليوم التالي للتخزين على المدى الطويل.
ملاحظة: قد يتم حساب الخلايا قبل التجميد لتقدير لاحق من نسبة البقاء على قيد الحياة. يمكن إيقاف البروتوكول مؤقتًا هنا.
6. إنشاء زراعة أحادية pericyte للتجارب
- معطف T75-قارورة مع الكولاجين الرابع وفيبرومينكتين باستخدام نفس الإجراء كما ذكر في القسم 3.1-3.4.
- في حين يجري المغلفة قارورة مع fibronectin، ذوبان قارورة واحدة من بيريكيت في حمام مائي 37 درجة مئوية.
- نقل pericytes المذاب الآن من التبريد إلى أنبوب الطرد المركزي مع 30 مل من DMEM-comp. الطرد المركزي تعليق الخلية لمدة 5 دقائق في 500 × ز, RT.
- pirate بعناية المتوسطة، وترك بيليه الخلية في الجزء السفلي من الأنبوب. إعادة تعليق بيليه في 10 مل DMEM-comp.
- جمع ونقل تعليق الخلية إلى قارورة المغلفة. ترك قارورة مع بيريكليس لتنمو في حاضنة 37 درجة مئوية في 10٪ CO2.
- كل يوم ثان، تحديث المتوسطة مع 10 مل من 10-comp.
ملاحظة: بعد 5 أيام من النمو، يجب أن تصل إلى 80٪ تقريبا التقاء البيركيات. إذا كان الالتقاء أقل، اترك الخلايا لتنمو ليوم أو يومين آخرين. الخلايا يجب أن تكون الآن جاهزة للبذاءة لمزيد من التجارب.
7. البذر من pericytes في لوحة 96- جيدا المغلفة
- تخفيف الكولاجين الرابع كما هو موضح في الخطوة 3.1. أضف 100 ميكرولتر إلى كل بئر في لوحة 96 بئرًا وحضن لمدة 2 ساعة في RT أو بين عشية وضحاها عند 4 درجات مئوية.
- التعرق الحل وغسل الآبار ثلاث مرات مع برنامج تلفزيوني.
- إضافة 100 μL من الليفي المخفف إلى كل بئر واحتضان في RT لمدة 30 دقيقة. إزالة حل فيبرومينكتين واستخدام لوحة على الفور.
ملاحظة: اعتماداً على مدى نمو دفعة pericyte، يجب أن يكون هناك خلايا كافية لبذات اثنين من لوحات. - إخراج البيريدات من الحاضنة وpirate المتوسطة. غسل الخلايا مع برنامج تلفزيوني.
- إضافة 2 مل من التربسين-EDTA إلى البيرسيسيت واتبع نفس الإجراء كما هو الحال في الخطوة 5.3-5.6.
- التعرق المتوسطة، دون الإضرار بيليه الخلية وإعادة تعليق بيليه في 1 مل من 1 DMEM-شركات جديدة.
- أخرج 12 ميكرولتر من تعليق الخلية وإضافته إلى غرفة العد. تحت المجهر الخفيف، عد على الأقل 3 من شبكات 3x3 واستخدام متوسط عدد الخلايا لكل شبكة.
- استخدام المعادلة أدناه لحساب حجم تعليق الخلية التي ينبغي أن تضاف إلى كل بئر لذرة 10.000 الخلايا في البئر، في لوحة 96-جيدا.
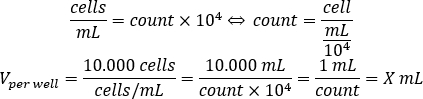
- إضافة DMEM-comp والحجم المحسوب من تعليق الخلية في كل بئر للوصول إلى حجم النهائي من 200 ميكرولتر.
- ضع لوحة 96-well في حاضنة 37 درجة مئوية في 10٪ CO2. ترك الخلايا لتنمو لمدة 4 أيام مع تغيير المتوسطة بعد 2 أيام.
8. إعداد المخازن المؤقتة والحلول لCa2 +- التصوير
- يغطي الخلايا غطاء أوتوكلاف وأغطية الغرف.
- المخزن المؤقت: أضف 1.19 غرام من الـ HEPES إلى 500 مل من العازلة HBSS لتركيز نهائي من 10 مل من الهبات. ضبط درجة اله pH إلى 7.4.
- إعداد 20٪ (ث / الخامس) Pluronic F127 + 1٪ (الخامس / الخامس) بوليثوكسيلات حل مخزون زيت الخروع عن طريق حل 0.5 غرام من حل F127 Pluronic في 2.5 مل من DMSO اللامائية في قارورة زجاجية. الحرارة إلى 40 درجة مئوية لمدة 30 دقيقة تقريبا أو حتى الذوبان ودوامة. أضف 25 ميكرولتر من زيت الخروع البولي أوكسيد وتخزينه في RT. لا تتجمد
- إعداد 2 mM Fura-2 AM المخزون عن طريق حل 1 ملغ في 500 ميكرولتر من DMSO اللامائية. تخزين في aliquots من 20 ميكرولتر في -20 درجة مئوية محمية من الضوء.
- إعداد 5 μM فورا-2 صباحا حل التحميل عن طريق خلط 20 ميكرولتر من 20٪ Pluronic F-127 + 1٪ بولي إيثوكسيلاتيد محلول مخزون زيت الخروع مع 20 ميكرولتر من 2 mM Fura-2 AM aliquot. إضافة 500 μL من المخزن المؤقت والملايسة. إضافة المخزن المؤقت إلى حجم النهائي من 8 مل. وينبغي إعداد الحل مباشرة قبل الاستخدام وحمايتها من الضوء.
- إعداد 4 mM كال-520 AM عن طريق حل 1 ملغ في 226.7 μL من DMSO اللامائية. تخزين في aliquots من 20 ميكرولتر في -20 درجة مئوية محمية من الضوء.
- إعداد 20 μM كال-520 AM حل التحميل عن طريق خلط 20 ميكرولتر من 20٪ Pluronic F-127 + 1٪ بولي إيثوكسيلاتيد محلول مخزون زيت الخروع مع 20 ميكرولتر 4 mM Cal-520 aliquot. إضافة 500 μL من المخزن المؤقت والملايسة. إضافة المخزن المؤقت إلى حجم النهائي من 4 مل. وينبغي إعداد الحل مباشرة قبل الاستخدام وحمايتها من الضوء.
9. تحميل pericytes مع صبغة مؤشر الكالسيوم فورا -2 في إعداد لوحة القارئ
ملاحظة: يجب أن تكون كافة الحلول في RT قبل بدء التجربة.
- أخرج لوحة 96-well مع خلايا من الحاضنة والتعرق المتوسط من الآبار. غسل الخلايا مرتين مع المخزن المؤقت.
- إضافة 100 μL من حل التحميل إلى كل بئر والتفاف لوحة مع tinfoil، لتجنب تبييض الصورة. احتضان لمدة 45 دقيقة مع 30 دورة في الدقيقة تهتز في RT.
ملاحظة: لا تقم بتحميل Fura-2 AM عند 37 درجة مئوية، لأنها قد تقوم بتحميل المقصورات الداخلية. تذكر أن تترك الآبار مع الخلايا في المخزن المؤقت المقايسة بدلاً من تحميل المخزن المؤقت. هذه هي "الفراغات" المستخدمة لقياس الفلورس الخلفية. - استلهمي مخزن التحميل المؤقت وغسل الخلايا بمخزن مُجرّد مرتين. إضافة 100 μL من المخزن المؤقت الطازج وترك الخلايا لاحتضان لمدة 30 دقيقة في RT؛ هذا يسمح لانشقاق مستمر من AM-إستر وبالتالي محاصرة فورا-2 صباحا داخل الخلايا.
- قبل Ca2+التصوير، وغسل واستبدال المخزن المؤقت مع 100 ميكرولتر من المخزن المؤقت المقايسة الطازجة.
10. جيدا لوحة قراءة fluorescence من pericytes في إعداد لوحة القارئ
- تعيين درجة حرارة قارئ لوحة إلى 37 درجة مئوية ونقل لوحة 96-well مع الخلايا إلى موضع لوحة عينة. ضع لوحة الكاشف مع ناهض في موقف لوحة الكاشف.
- ابدأ بقياس تحميل الخلايا لضمان التحميل المتساوي لـ Fura-2 AM في جميع الآبار.
- إجراء القياسات مع الطول الموجي الفلوري الإثارة في 340 نانومتر/380 نانومتر والطول الموجي للانبعاثات في 510 نانومتر. إضافة 50 ميكرولتر من ناهض في سرعة 150 ميكرولتر / س من لوحة الكاشف إلى كل بئر مع الخلايا في موضع لوحة العينة.
- حفظ البيانات وتصدير كملفات xlsx لمزيد من التحليل. ويبين الشكل 2 cytosolic Ca2 +- استجابة تقاس كنسبة بين الطولين الموجي الإثارة على مر الزمن، حيث يتم طرح الفلورس الخلفية.
ملاحظة: يجب أن يكون قارئ اللوحة قارئًا صغيرًا مزدوجًا مع مساحة لـ "صينية الخلايا" و"صينية عينة" ونظام أنبوبي متكامل.
11. البذر من pericytes في غرفة الخلية المغلفة للتصوير الحي
ملاحظة: قد يتم وضع الأغطية في قاع آبار الثقافة، المغلفة والمصنفة مع pericytes كما هو موضح أعلاه، ثم شنت في الغرفة قبل التجارب.
- جبل غطاء في غرفة الخلية وجعلها ضيقة لتجنب تسرب.
- تخفيف الكولاجين الرابع كما هو موضح في الخطوة 3.1. أضف 500 ميكرولتر إلى كل غرفة خلية وحضن لمدة 2 ساعة في RT أو بين عشية وضحاها عند 4 درجات مئوية.
- استلهم محلول الكولاجين واغسل الغرف ثلاث مرات مع 500 ميكرولتر من برنامج تلفزيوني.
- إضافة 500 ميكرولتر من الليفي المخفف إلى كل بئر واحتضان في RT لمدة 30 دقيقة. إزالة حل فيبرومينكتين واستخدام غرفة الخلية مباشرة بعد ذلك.
- في غضون ذلك، أخرج القارورة مع بيريكيت ملتبسة وغسل مع 7 مل من برنامج تلفزيوني.
- إضافة 2 مل من التربسين-EDTA إلى البيرسيسيت واتبع نفس الإجراء كما هو الحال في الخطوة 5.3-5.6.
- تابع باتباع نفس الخطوات كما في الخطوة 8.6-8.7.
- استخدم المعادلة أدناه لحساب حجم تعليق الخلية، والتي يجب إضافتها إلى كل غرفة لذر 90.000 خلية لكل غرفة.
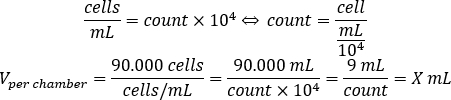
- إضافة DMEM-comp وحجم محسوب من تعليق الخلية في كل غرفة للوصول إلى حجم النهائي من 500 μL.
- ضع غرف الخلية في الحاضنة عند 37 درجة مئوية، 10٪ CO2. ترك الخلايا لتنمو لمدة 6 أيام (أو حتى التقاء).
ملاحظة: تنمو البيركسيات أبطأ على الشرائح الزجاجية مقارنة بالبلاستيك؛ المزيد من أيام النمو ضرورية.
12. تحميل pericytes مع Cal-520 صباحا صبغة مؤشر الكالسيوم للتصوير الحي
ملاحظة: يجب أن تكون كافة الحلول في RT قبل بدء التجربة.
- إعداد 20 ميكرومتر كال- 520 AM العازلة التحميل: مزيج 20 ميكرولتر من 20٪ Pluronic F-127 + 1٪ بولي أوكسيد محلول مخزون زيت الخروع مع 20 ميكرولتر 4 mM كال-520 aliquot. إضافة 500 من μL المخزن المؤقت و الدوامة. إضافة المخزن المؤقت إلى حجم النهائي من 4 مل. وينبغي إعداد الحل مباشرة قبل الاستخدام وحمايتها من الضوء.
ملاحظة: حماية الحلول التي تحتوي على Cal-520 AM من التعرض للضوء. - إخراج غرف الخلية من الحاضنة والطامح المتوسطة. غسل الخلايا مرتين مع المخزن المؤقت.
- إضافة 500 μL من تحميل العازلة لكل غرفة واحتضان في RT لمدة 45 دقيقة.
- استلهمي مخزن التحميل المؤقت وغسل الخلايا مرتين بمخزن مُجرّد.
- إضافة 500 μL من المخزن المؤقت المقايسة الطازجة لكل غرفة واحتضان لمدة 30 دقيقة في RT للسماح انشقاق AM-إستر.
- استبدل المخزن المؤقت بـ 500 ميكرولتر من مخزن المقايسة الطازج قبل إجراء التصوير المباشر في مجهر confocal.
13. التصوير الحي من داخل الخلية كاليفورنيا2 +- المستويات
ملاحظة: يمكن استخدام مجموعة متنوعة من أنواع المجهر للتصوير. يمكن استخدام مجاهر الفلورسنس التقليدية المستقيمة أو المقلوبة ، وكذلك مجاهر المسح الضوئي بالليزر المقلوبة أو المقلوبة مع مصدر الإثارة المناسب (488 نانومتر) ومرشحات الانبعاثات (510-520 نانومتر). وينبغي أن تكون الأهداف مناسبة للفلورا وأن تكون ذات جودة عالية وذات فتحة رقمية عالية (NA).
- جبل غرفة الخلية على خشبة المسرح من المجهر confocal لطيف قدر الإمكان، من أجل تجنب اضطراب الخلايا.
- حدد الطول الموجي للإثارة من 488 نانومتر، والانبعاثات في 515 نانومتر، وحيازة صورة متسلسلة مع 5 فترات ثانية، وحجم صورة س ص من 512 × 512 بكسل وقياس لمدة 2 دقيقة لقياس إشارات الكالسيوم الأساسية.
- أضف 3 ميكرولتر من 100 mM ATP إلى غرفة الخلية مع ماصة، ومواصلة اقتناء الصورة التسلسلية. تنفيذ إضافة ببطء وبلطف لعدم تعكير إعداد ونقل الخلايا من التركيز.
- مراقبة درجة التغيرات وزيادة الفاصل الزمني مع مرور الوقت حسب الحاجة لحوالي 18 دقيقة حتى لا يتم ملاحظة أي تغيير مورفولوجي آخر(الشكل 3).
- توفير الصور الفاصل الزمني وتصديرها على أنها TIFF و / أو ملفات AVI لمزيد من التحليل.
ملاحظة: يجب أن تعطي قارورة واحدة من البيريكس خلايا كافية للبذاءة في 1-2 96-آبار وأغطية متعددة، مما يعني أنه يمكنك إعداد الخلايا لكلا النوعين من قياسات الكالسيوم.
النتائج
تم عزل الشعيرات الدموية المخ البقرية من أنسجة الدماغ الطازجة والشكل 1 يعرض البذر الشعرية والخروج الخلوي على مدى أيام وتنقية لاحقة من pericytes. يتم إرفاق الشعيرات الدموية بالكامل إلى القارورة في اليوم 1 وفي اليوم 2 براعم البطانية أصبحت مرئية(الشكل 1...
Discussion
في هذه الدراسة، قمنا بتقديم طريقة لعزل البيرليكات الأولية من أدمغة الأبقار. البروتوكول الموصوف يسمح الثقافة من هذا النوع خلية غير قابلة للوصول بدلاً من ذلك. في وقت لاحق تم الحصول على ثقافة الخلية هو سكان متجانس تقريبا من pericytes، مع تلوث قليل أو معدومة مع الخلايا البطانية والخلايا الدبقية ع?...
Disclosures
ولا يعلن أصحاب البلاغ عن أي مصالح مالية متنافسة.
Acknowledgements
يرغب المؤلفون في الاعتراف بالتمويل من مبادرة أبحاث مؤسسة لوندبيك حول حواجز الدماغ وتسليم الأدوية (RIBBDD) ومؤسسة عائلة سيمون هوغنرز.
Materials
| Name | Company | Catalog Number | Comments |
| ATP | Tocris | 3245 | |
| Cal-520 AM | AAT Bioquest | 21130 | |
| Cell incubator | Thermo Fisher | ||
| Centrifuge | Thermo Fisher | Heraeus Multifuge 3SR+ | Standard large volume centrifuge for spinning down cells |
| Collagen IV | Sigma Aldrich | C5533 | |
| Confocal laser scanning microscope | Carl Zeiss | Zeiss LSM 510 | Inverted microscope |
| Counting chamber | FastRead | 102 | |
| Coverslip cell chamber | Airekacells | SC15022 | |
| Cremophor EL | Sigma Aldrich | C5135 | Formerly known as Kolliphor EL |
| DMSO | Sigma Aldrich | 471267 | |
| Dulbecco's Modified Eagles Medium | Sigma Aldrich | D0819 | |
| Fetal bovine serum (FBS) | PAA/GE Healthcare | A15-101 | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Fura-2 AM | Thermo Fisher | F1201 | |
| Glass coverslips 22x22 mm | VWR International | 631-0123 | |
| HBSS | Gibco | 14065-049 | |
| Heparin | Sigma Aldrich | H3149 | |
| HEPES | AppliChem Panreac | A1069 | |
| Light microscope | Olympus | Olympus CK2 | Upright light microscope with phase contrast |
| MEM nonessential amino acids | Sigma Aldrich | M7145 | |
| Microplate Reader | BMG LabTech | NOVOstar | |
| PBS | Sigma Aldrich | D8537 | Phosphate-buffered saline |
| penicillin G sodium/streptomycin sulfate | Sigma Aldrich | P0781 | |
| Pluronic F127 | Sigma Aldrich | P2443 | |
| Trypsin-EDTA | Sigma Aldrich | T4299 | |
| T-75 flask | Sigma Aldrich | CLS3972 | |
| 96-well plate | Corning incorporated | 3603 |
References
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: Developmental, Physiological, and Pathological Perspectives, Problems, and Promises. Developmental Cell. 21 (2), 193-215 (2011).
- Abbott, N. J., Ronnback, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Mathiisen, T. M., Lehre, K. P., Danbolt, N. C., Ottersen, O. P. The Perivascular Astroglial Sheath Provides a Complete Covering of the Brain Microvessels: An Electron Microscopic 3D Reconstruction. Glia. 58 (9), 1094-1103 (2010).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Zhou, L., Sohet, F., Daneman, R. Purification of Pericytes from Rodent Optic Nerve by Immunopanning. Cold Spring Harbor Protocols. , 608-617 (2014).
- Liu, G. H., et al. Isolation, Purification, and Cultivation of Primary Retinal Microvascular Pericytes: A Novel Model Using Rats. Microcirculation. 21 (6), 478-489 (2014).
- Nayak, R. C., Herman, I. M. Bovine retinal microvascular pericytes: isolation, propagation, and identification. Methods In Molecular Medicine. 46, 247-263 (2001).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology-Heart and Circulatory Physiology. 302 (1), H69-H84 (2012).
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Helms, H. C., Brodin, B., Milner, R. Methods in Molecular Biology. Cerebral Angiogenesis: Methods and Protocols. 1135, 365-382 (2014).
- Abbracchio, M. P., Burnstock, G., Verkhratsky, A., Zimmermann, H. Purinergic signalling in the nervous system: an overview. Trends in Neurosciences. 32 (1), 19-29 (2009).
- Cai, C., et al. Stimulation-induced rises in cerebral blood flow and local capillary vasoconstriction depend on conducted vascular responses in brain capillaries. PNAS. , (2018).
- Tigges, U., Welser-Alves, J. V., Boroujerdi, A., Milner, R. A novel and simple method for culturing pericytes from mouse brain. Microvascular Research. 84 (1), 74-80 (2012).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant Outgrowth, Propagation and Characterization of Human Pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Orlidge, A., Damore, P. A. Cell specific effects of glycosaminoglycans on the attachment and proliferation of vascular wall components. Microvascular Research. 31 (1), 41-53 (1986).
- Rhinehart, K., Zhang, Z., Pallone, T. L. Ca2+ signaling and membrane potential in descending vasa recta pericytes and endothelia. American Journal of Physiology-Renal Physiology. 283, F852-F860 (2002).
- Bintig, W., et al. Purine receptors and Ca2+ signalling in the human blood-brain barrier endothelial cell line hCMEC/D3. Purinergic Signalling. 8 (1), 71-80 (2012).
- Neuhaus, A. A., Couch, Y., Sutherland, B. A., Buchan, A. M. Novel method to study pericyte contractility and responses to ischaemia in vitro using electrical impedance. Journal of Cerebral Blood Flow and Metabolism. 37 (6), 2013-2024 (2017).
- Kamouchi, M., et al. Calcium influx pathways in rat CNS pericytes. Molecular Brain Research. 126 (2), 114-120 (2004).
- Das, A., et al. ATP Causes Retinal Pericytes to Contract In vitro. Experimental Eye Research. 46, 349-362 (1988).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved