Method Article
تصور الانحطاط متشابك في دروسوفيليا الكبار بالاشتراك مع التنكس العصبي
In This Article
Summary
والهدف من هذا الإجراء هو تشريح العضلات الطولية الظهرية (DLM) الأنسجة لتقييم سلامة الهيكلية من DLM تقاطعات عصبية عضلية (NMJs) في نماذج الأمراض العصبية باستخدام drosophila الميلانوغاستر.
Abstract
Drosophila بمثابة نموذج مفيد لتقييم بنية متشابك وظيفة المرتبطة الأمراض العصبية. في حين أن الكثير من العمل قد ركز على الوصلات العصبية العضلية (NMJs) في يرقات دروسوفيليا ، فإن تقييم السلامة المتشابكة في Drosophila البالغين قد تلقى اهتمامًا أقل بكثير. هنا نقدم طريقة واضحة لتشريح العضلات الطولية الظهرية (DLMs) ، والتي هي مطلوبة لقدرة الرحلة. بالإضافة إلى الطيران كمقروء سلوكي، يسمح هذا التشريح لكل من نقاط الاشتباك العصبي DLM والأنسجة العضلية لتكون قابلة للتحليل الهيكلي باستخدام الأجسام المضادة المسمى الفلورسنت لعلامات متشابك أو البروتينات ذات الأهمية. يسمح هذا البروتوكول بتقييم السلامة الهيكلية للاشتباكات العصبية في دروسوفيليا الكبار أثناء الشيخوخة لنمذى الطبيعة التقدمية التي تعتمد على العمر لمعظم الأمراض العصبية.
Introduction
الخلل العصبي هو من بين السمات المعروفة في وقت مبكر من معظم الأمراض العصبية الرئيسية1،2،3،4،5،6. ومع ذلك، لا يُعرف إلا القليل جداً فيما يتعلق بكيفية ارتباط هذه الإعاقات الهيكلية والوظيفية بالمراحل اللاحقة من تطور المرض. وقد ثبت Drosophila أن يكون نموذجا مفيدا لنظام لفهم نمو synapse والتنمية باستخدام NMJsاليرقات 7,8,9. ومع ذلك ، تستمر المرحلة الثالثة من اليرقات في النجوم بضعة أيام فقط ، مما يحد من فائدتها في دراسة التنكس العصبي التدريجي الذي يعتمد على العمر. بديل لتقييم NMJs اليرقات هو فحص الهياكل متشابك في دروسوفيلياالكبار ، مثل نقاط الاشتباك العصبي التي تشكلت على العضلات الطولية الظهرية (DLMs) التي هي مطلوبة للرحلة10،11،12،13،14،15،16. هذه نقاط الاشتباك العصبي الثلاثية منظمة هيكليا بطريقة مماثلة لـ الثدييات17، مما يوفر ميزة فريدة لتقييم نماذج الأمراض العصبية.
هنا نحن وصف طريقة واضحة لتحليل السلامة الهيكلية للبالغين NMJs في نموذج Drosophila من التنكس العصبي. وقد أكدت أساليب والدراسات السابقة في تشريح DLM على أهمية الحفاظ على الأنسجة العضلية لمجموعة متنوعة من التطبيقات18،19،20،21،22،23. بروتوكولنا يوفر طريقة شاملة للحفاظ على كل من الأنسجة العصبية والعضلات للتحقيق في الأمراض العصبية. عنصر رئيسي آخر لدراسة هذه الأمراض هو القدرة على فهم فقدان الخلايا العصبية بطريقة تعتمد على العمر. الأعمال السابقة يوفر فهم نقدي ومتعمق لكيفية تشكيل الـ DLM NMJs خلال التحول إلى مرحلة البلوغ المبكرة11,12,14,15,16,24. بروتوكولنا يؤسس طريقة للبناء على هذا العمل للتحقيق في DLM NMJs بطريقة تعتمد على العمر في الشيخوخة والأمراض العصبية.
Protocol
1- توليد ذباب مُعدّل وراثياً
- لتوليد الذباب المعدلة وراثيا لهذه التجربة، وجمع OK371-Gal425 الذباب الإناث العذراء والذكور من UAS-TDP-43M337V 26 (الشكل 1A)عن طريق تخدير الذباب مع CO2 على لوحة لفرز.
- فرز الذباب المُعَدَّد للعمود في قوارير مع وسائط دروسوفيليا القياسية للصليب. ضع قوارير تحمل علامة على 25 درجة مئوية للجيل القادم للظهور.
ملاحظة: قم بمسح البالغين من القوارير قبل ظهور النسل لضمان النمط الجيني المناسب. - بمجرد ظهور النسل ، وجمع الذباب المعدلة وراثيا في قوارير والفرز حسب الجنس لبدء الشيخوخة لظروف تجريبية.
- مرة واحدة يتم جمع الذباب، ونقل الذباب إلى المواد الغذائية الطازجة كل 2 أيام حتى الذباب هي 21 يوما من العمر.
2. تشريح الإعدادية
- للتحضير للتشريح، والحصول على درجة حرارة الغرفة الفوسفات المخزن المالحة (1X PBS)، وهو طبق تشريح 10 سم المغلفة مع الاستومر سيليكون، مستقيم حافة تشريح مقص، مجموعة واحدة من ملقط تشريح حادة، ونصائح P200 ماصة والماصات، 2.0 مل أنابيب microcentuge، مقص مكتب القياسية، 70٪ الإيثانول، طبق بيتري 6 سم، و 32٪ الفورمالديهايد المخفف إلى 4٪ مع برنامج تلفزيوني 1x.
- تسمية أنابيب لكل نوع جيني أو شرط وإضافة 900 ميكرولتر من 1X PBS (درجة حرارة الغرفة) و 150 ميكرولتر من 32٪ الفورمالديهايد لكل أنبوب. ارتداء القفازات ونظارات السلامة عند إعداد تثبيت الفورمالديهايد 4٪ .
- تخدير 6\u201210 الذباب في المجموعة مباشرة من القارورة مع CO2 وغمر الذباب في طبق بيتري 6 سم مع الإيثانول 70٪. اضغط على الذباب إلى أسفل في الإيثانول باستخدام فرشاة الطلاء لضمان أن العينات مغمورة بالكامل. هذا سوف إزالة طبقة من النفط على بشرة الخارجي.
3. Thorax العزل واللصلح
- قبل تشريح كل عينة، إضافة ما يقرب من 7\u201210 مل من 1X برنامج تلفزيوني إلى طبق تشريح المغلفة مع الاستومر السيليكون. وينبغي أن يضمن هذا الحجم أن عينات الأنسجة مغمورة تماما.
- نقل ذبابة واحدة إلى طبق تشريح من الإيثانول 70٪ باستخدام ملقط حادة واستيعاب إما الأجنحة أو الساقين.
- ركّز العينة في طبق التشريح تحت مجهر تشريحي. المقبل غمر العينة في 1X برنامج تلفزيوني، وإزالة بعناية أجنحة باستخدام dumont حادة #5 الملاط.
- باستخدام مقص تشريح الربيع حافة Vannas مستقيم، إزالة الساقين عن طريق خلق شق صغير في الجانب البطني من بشرة. في الخطوة 3.8، سيسمح هذا الشق للفورمالديهايد باختراق الأنسجة.
- اتخاذ مقص في يد واحدة وعقد ملقط في الآخر لوضع الجانب البطني يطير. أثناء الاحتفاظ باعينة في مكانها مع ملقط حادة ، قم بإزالة الرأس والبطن بمقص التشريح.
- نقل الصدر المعزول باستخدام طرف الماصات المعدلة في أنبوب المسمى، من الخطوة 3.2.
ملاحظة: تعيين ماصة إلى 40 μL لتجنب إضافة 1X PBS إضافية إلى المثبت. - كرر الخطوات 3.2\u20123.6 أعلاه لكل عينة.
- إصلاح العينات لمدة 30 دقيقة في درجة حرارة الغرفة.
- إزالة الإصلاح باستخدام ماصة باستور وتجاهله في حاوية النفايات المناسبة تحت غطاء محرك الدخان. شطف العينات ثلاث مرات مع 1.5 مل من 1X PBS كل باستخدام ماصة باستور. إكمال شطف الرابع باستخدام 750 ميكرولتر فقط وترك الأنسجة في 1X PBS.
ملاحظة: في هذه المرحلة، يمكن أن تبقى عينات الأنسجة عند 4 درجات مئوية لمدة تصل إلى 3 أيام قبل الانتقال إلى الخطوات التالية.
4. فلاش تجميد وbiection الصدر
- قبل البدء في bisections، ملء قارورة ديوار مع النيتروجين السائل ارتداء قفازات واقية من التبريد المناسبة ونظارات السلامة. الحصول على قواطع شفرة، ريش ريشة، زوج واحد من ملقط غرامة، والجليد، والجليد الباردة 1X PBS، والملاقط المبردة.
- إعداد دلو الثلج للحفاظ على 1x PBS الجليد الباردة.
- استخدام قواطع شفرة للاستيلاء على ريشة شفرة في زاوية، وثني شفرة من أجل كسر قطعة صغيرة. يمكن لتكسير شفرة ثم قفل شفرة في موقف للاستخدام كمشرط صغير.
ملاحظة: يجب أن تستمر شفرة واحدة لكافة المجموعات. التبديل إذا كسر شفرة أو تصبح مملة. - إضافة طرف ماصة نظيفة إلى P200 وإزالة 1/5th من طرف لنقل العينات.
- إعداد أنبوب جديد microcentrifuge لكل مجموعة وإضافة 200 ميكرولتر من 1X برنامج تلفزيوني لكل أنبوب. سيتم استخدام هذا الأنبوب الثاني لجمع ا المسبقة DLM النهائي.
- إزالة جميع 1X PBS من الأنابيب باستخدام ماصة باستور.
- ارتداء معدات الحماية المناسبة، غمر الأنبوب في قارورة النيتروجين السائل لمدة 10 ق مع ملاقط التبريد.
ملاحظة: ينبغي إغلاق الأنابيب بإحكام للحفاظ على أنبوب من الانفجار. - إزالة أنبوب من النيتروجين السائل وإضافة ما يقرب من 300 ميكرولتر من الجليد البارد 1X برنامج تلفزيوني إلى العينات مع ماصة باستور. إبقاء العينات على الجليد.
- إضافة الجليد الباردة 1X برنامج تلفزيوني إلى طبق تشريح 10 سم المغلفة مع الاستومر سيليكون والاستغناء عن الصدر الأول مع ماص 200 μL المعدلة.
- ضع الجانب الصدري البطني للأعلى. في يد واحدة استخدام زوج مملة من ملقط لوضع الصدر وفي الآخر استخدام زوج غرامة من ملقط لإزالة بعض من ganglion الصدر لفضح خط الوسط من الصدر.
- استخدام خط الوسط من الصدر كدليل لجعل قطع الضحلة من خلال 1/3rd من الصدر مع شفرة.
- إزالة النصل من الصدر ووضع الصدر في زاوية 45 درجة مع ملقط حادة. أعد إدخال النصل وقطع مباشرة أسفل خط الوسط من الصدر. وهذا سيؤدي إلى اثنين من hemithoraces.
- تأخذ hemithorax واحد في وقت واحد وإزالة الأنسجة الزائدة تحت DLM الألياف العضلية F (الشكل 1B)، والألياف البطنية الأكثر. استخدم الشفرة لإجراء واحد أو اثنين من التخفيضات بعناية لإزالة الأنسجة الزائدة دون الإضرار DLMs.
- مرة واحدة معزولة، ونقل hemithorax إلى أنبوب الصحيح مع 1X PBS.
- كرر الخطوات 4.6\u20124.14 حتى يتم إجراء 10 hemithoraces تشريح لكل مجموعة.
5. تلطيخ الهيكلية
- بعد قسم العينات الصدر، ووضع الأنسجة في العازلة سد (1X PBS مع مصل الماعز العادي 0.1٪ ، و 0.2٪ تريتون X-100 في 7.4 pH) ل permeabilize الأنسجة ومنع تلطيخ غير محددة. استخدام ماصة باستور لإزالة الزائد 1X برنامج تلفزيوني وإضافة 1.5 مل من العازلة حظر إلى كل أنبوب. كتلة الأنسجة لمدة 1 ساعة على الأقل عند 4 درجة مئوية.
- إعداد العينات لتلطيخ الهيكلي باستخدام الأجسام المضادة مترافق الفلورسنت، بيروكسيديز الفجل 488 (المضادة للHRP-488) في تخفيف 1:200 و Phalloidin-647 في تخفيف 1:1000 في عازلة سد لطخة الخلايا العصبية الحركية والأنسجة العضلية، على التوالي. جعل ما يكفي من وصمة عار أن يكون 150 ميكرولتر لكل أنبوب. تخزين وصمة عار في 4 درجة مئوية مغطاة في احباط أو في مربع الظلام حتى جاهزة للتلوين.
- بعد حظر، وإزالة العازلة حظر الزائدة مع ماصة باستور الزجاج.
- قبل الاستغناء عن وصمة عار الهيكلية، دوامة وصمة عار. إضافة 150 μL من وصمة عار لكل أنبوب. ضع العينات في صندوق داكن على الدوار في درجة حرارة الغرفة لمدة 2 ساعة.
- إزالة وصمة عار وغسل الأنسجة أربع مرات في 1.5 مل من غرفة درجة الحرارة 1X PBS مع 0.3٪ تريتون X-100 لمدة 5 دقائق على الدوار في مربع الظلام. العينات الآن جاهزة للانطلاق إلى شريحة.
6. تصاعد الأنسجة
- بعد غسل العينات في PBST، وإعداد شريحة المجهر لتركيب الأنسجة لتلطيخ. إعداد إمدادات إضافية بما في ذلك زلات الغطاء الزجاجي، ماصة P200، 200 μL نصائح ماصة، مقص، تعزيزات واضحة، ملقط حافة مستقيمة، وسائل الإعلام المضادة للتلاشي تصاعد الفلورسنت، طلاء الأظافر، وصندوق الظلام لتغطية الشرائح.
- تسمية الشريحة لتحديد العينات وتنظيف الشريحة مع kimwipes لضمان عدم وجود لطخات.
- لضمان عدم تلف عينات hemithorax من زلة الغطاء ، وبناء "جسر" باستخدام تسميات التعزيز. اتخاذ واحد التسمية تعزيز، وقطع عليه في النصف، ووضع كل نصف تقريبا 15 ملم عن بعضها البعض. يجب أن تكون هذه المسافة أصغر من عرض قسيمة الغطاء. كرر هذه الخطوة أربع مرات لإكمال "جسر" الذي هو تسميات 5 عالية.
- خذ ماصة P200 وتعديل طرف بقطع 1/5من الطرف لنقل العينات إلى الشريحة. يجب نقل العينات على الشريحة في وسط الجسر.
- خذ حافة مسح مختبر وإزالة أي PBST الزائدة. باستخدام ملقط، وترتيب DLMs بحيث جميع العينات التي تواجه الجانب العضلات صعودا وجانب بشرة أسفل.
- باستخدام نصيحة P200 ماصة قياسية، تطبيق 70 ميكرولتر من تصاعد وسائل الإعلام على الشريحة، وتجنب فقاعات الهواء. الاستغناء عن وسائل الإعلام في نمط دائري داخل التعزيزات بدءا من الخارج إلى المركز.
- ضع زلة غطاء على التعزيزات.
- استخدام طلاء الأظافر لمعطف الحواف الخارجية حول محيط الغطاء. تطبيق بسخاء لتشكيل ختم كامل من الأنسجة.
- ضع الشريحة على سطح مستو في الظلام، مما يسمح لـ 10 دقائق على الأقل بالجفاف ومنع تبييض الصور أو فقدان الفلور. يمكن الآن استخدام الشرائح للتصوير على الفور، أو تخزينها في مجلد الشرائح عند -20 درجة مئوية للعرض لاحقًا.
7. البديل: تلطيخ مع الأجسام المضادة الأولية
ملاحظة: هذا المقطع اختياري ويجب استخدامه مباشرة بين القسمين 4 و 5 إذا رغبت في ذلك.
- لطخة الأنسجة مع الأجسام المضادة الأولية، غمر الأنسجة في عازلة سد لمدة 1 ساعة على الأقل.
- إعداد الأجسام المضادة الأولية مع التخفيف السليم في العازلة منع. على الأقل، إعداد ما يكفي من خليط الأجسام المضادة أن يكون 150 ميكرولتر لكل مجموعة. لاحظ أن يتم الاحتفاظ النماذج لا يزال. يُخزن عند 4 درجة مئوية حتى يصبح جاهزاً للاستخدام.
- إزالة العازلة حظر الزائدة مع ماصة باستور. لفترة وجيزة دوامة الأجسام المضادة الأولية وإضافة 150 ميكرولتر من خليط الأجسام المضادة لكل مجموعة ووضع العينات في 4 درجة مئوية بين عشية وضحاها.
- في اليوم التالي، وإزالة الأجسام المضادة الأولية وغسل الأنسجة 4 مرات مع PBST لمدة 5 دقائق كل على ددورة.
- إعداد وصمة عار ثانوية في منع العازلة. إضافة وصمة عار الثانوية إلى العينة ومن ثم الاحتفاظ بها على درجة حرارة الغرفة لمدة 2 ساعة في مربع الظلام على الدوار.
ملاحظة: يمكن أن تشمل تلطيخ الثانوية أيضا HRP و phalloidin. - بعد الحضانة 2 ح، لإزالة غسول وصمة عار الثانوية 4 مرات لمدة 5 دقائق مع PBST والمضي قدما في تصاعد.
النتائج
جيل الذباب المعدلة وراثيا التعبير عن الإنسان القطران ملزمة البروتين من 43 كيلو ا ا متحولة (TDP-43M337V)ويمثل التخطيطي (الشكل 1A). وهذا يدل على تطبيق ثنائي Gal4/UAS النظام في Drosophila27. الرسم التوضيحي يصور هيميتهوراك مع ستة ألياف العضلات، A\u2012F الانتقال من الألياف الظهرية الأكثر ألف إلى أكثر ventral F(الشكل 1B)11،12. لتقييم سلامة متشابك، كانت ملطخة NMJs مع HRP و Phalloidin(الشكل 1C\u2012E). الخلايا العصبية الحركية في طفراتM337V TDP-43(الشكل 1F)قليلاً أو لا تلطخ HRP من قبل اليوم 21، في حين أن WT (ولاية أوريغون-R) لا تزال سليمة(الشكل 1C). لا توجد اختلافات واضحة في تلطيخ العضلات(الشكل 1D, G). التغييرات في المورفولوجيا الإجمالية التي لوحظت فيM337V M337V M 43 M المسوخ TDP-43 يوضح كيف يمكن أن تكون متورطة في التكافل في نموذج مرض تنكسي عصبي من التصلب الجانبي الضموري (ALS) باستخدام نموذج DLM الكبار. بالإضافة إلى تلطيخ الهيكلية، تلطيخ NMJs DLM يمكن أيضا تقديم تقييم سلامة متشابك مع presynaptic(الشكل 2A\u2012R)وما بعد متشابك(الشكل 2S\u2012X)علامات. معا، هذه النتائج توضح كيف يمكن تطبيق هذا البروتوكول تشريح لدراسة DLM الأنسجة في الأمراض العصبية.
أحد الجوانب الرئيسية لهذا التشريح هو تطبيق النيتروجين السائل لفلاش تجميد الأنسجة لجعل البيسير أسهل. ويتضح فائدة النيتروجين السائل في ذباب WT مع النيتروجين السائل حيث أنسجة العضلات ليس له ضرر أو ألياف(الشكل 3A\u2012C). بدون النيتروجين السائل ، يمكن أن يكون من الصعب تشريح الأنسجة. على سبيل المثال، بعد هذا البروتوكول وتخطي خطوة تجميد فلاش النيتروجين السائل يسمح للأنسجة لتكون أكثر عرضة للتلف من أدوات تشريح مثل الخلايا العصبية التالفة (الشكل 3D) أو تلف ألياف العضلات (الشكل 3E). يساعد تطبيق النيتروجين السائل على منع تلف الأنسجة التي يمكن أن تحدث عند العمل مع أنسجة DLM بغض النظر عن النمط الجيني للعينة (الشكل 3C و 3F).
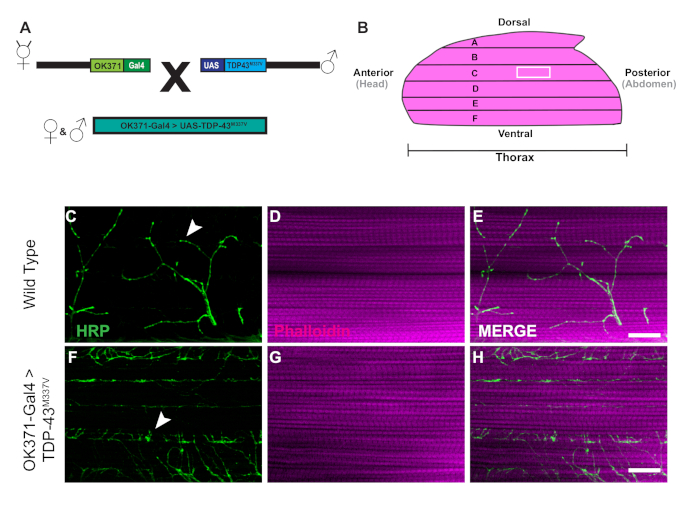
الشكل 1: إزالة تدريجيا من نقاط الاشتباك العصبي DLM في نموذج Drosophila من ALS. (أ)يظهر في التخطيطي توليد الذباب المعدلة وراثيا ALS التعبير عن شكل متحولة الإنسان من بروتين تضاريس ملزمة من 43 كيلو ادا (TDP-43). (B) الرسم التوضيحي يصور شكل واتجاه hemithorax في دروسوفيلياالكبار . باستخدام البروتوكول ، يمكننا مراقبة الخسارة التدريجية للسلامة المتشابكة من نقاط الاشتباك العصبي DLM NMJ من خلال التلطخ الهيكلي للخلايا العصبية الحركية مع HRP (الأخضر) والأنسجة العضلية مع Phalloidin (أرجواني). نموذجنا يصور فقدان السلامة متشابك في نموذج الكبار من ALS من خلال جيل من الذباب الكبار التعبير عن متحولة من الإنسان TDP-43M337V في الخلايا العصبية الحركية(الشكل 1F\u2012H)بالمقارنة مع WT(الشكل 1C\u2012E)الذباب في العضلات الألياف C. الأسهم تسليط الضوء على أمثلة من WT المشبك(الشكل 1C)ومثال على فقدان السلامة متشابك. شريط مقياس = 20 μm في 63x التكبير. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
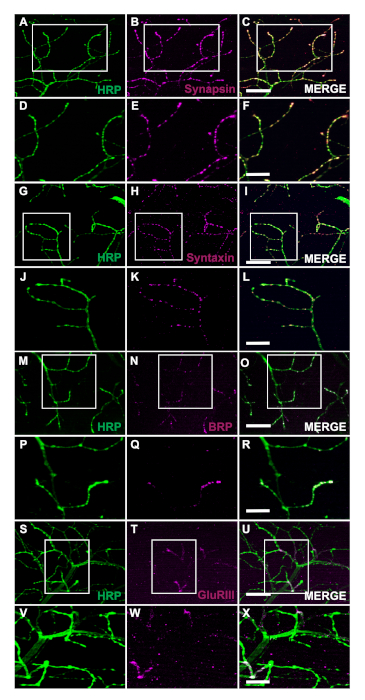
الشكل 2: تقييم السلامة المتشابكة باستخدام علامات presynaptic في NMJs الكبار. يمكن أيضا تقييم سلامة متشابك باستخدام علامات presynaptic وما بعد تينابتيك في ذباب WT التي هي 14 يوما في الألياف العضلات C. علامات presynaptic Synapsin (B) ، Syntaxin (H) ، وBruchpilot (BRP) (N) هي الملطخة مع HRP (A، G، M). الملون يصور توطين هذه العلامات إلى المحطات presynaptic (C، I، O). في التكبير أعلى، والصور توضيح توطين سينابسين (E)،Syntaxin (K)،وBRP (س) مع HRP (D، J، وP) بمزيد من التفصيل (الشكل F، L، و R). كما نعرض على علامة الغلوتامات مستقبلات الغلوتامات الثالث (GluRIII) (T)الملطخة مع HRP (S). وCo-تلطيخ يوضح فائدة هذه العلامات (U). في التكبير أعلى الصور التمثيلية تجسد التعريب (X) من GluRIII (W) و HRP (V) إلى أنسجة العضلات بعد المسنينبك والمحطات الخوائية presynaptic ، على التوالي. شريط مقياس للألواح A\u2012C، G-I، M\u2012O، S\u2012U تمثل 20 ميكرومتر في التكبير 63x. شريط مقياس للألواح D\u2012F، 2J-2L، 2P-2R، و 2V-2X تمثل 10 ميكرومتر في التكبير 63x. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
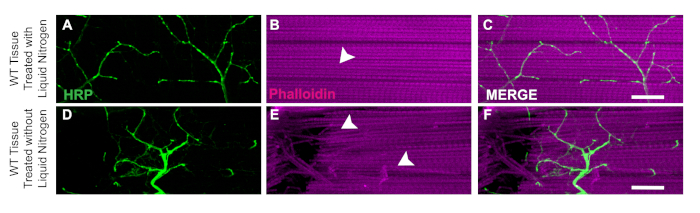
الشكل 3: فائدة النيتروجين السائل لتشريحات DLM. لإثبات فائدة النيتروجين السائل لتشريح DLM، نعرض مقارنة بين اليوم 21 WT الذباب مع وبدون النيتروجين السائل من الألياف العضلية C. مع النيتروجين السائل، Phalloidin (B) لا تزال سليمة ولا تمس الهضاب HRP (A, C). بدون النيتروجين السائل، يصبح النسيج العضلي خيطيًا ويصعب أن يُفرَط(E)ويصبح تلطيخ HRP(D, F)عرضة للخطر بسبب الخطأ التقني. الأسهم البيضاء تظهر منطقة من أي ضرر العضلات في مع النيتروجين السائل (B) والأنسجة العضلية التالفة (E). شريط مقياس = 20 ميكرومتر في 63x التكبير. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
باستخدام الطرق المذكورة في هذا البروتوكول، ونحن نقدم نهجا مباشرا لتشريح أنسجة DLM وتبين كيف يمكن تطبيق هذا لتقييم سلامة متشابك من خلال تلطيخ الهيكلية وعلامات متشابك في دروسوفيليا الكبار. خطوة واحدة حاسمة في البروتوكول الذي يجعل الأنسجة DLM أسهل لتشريح هو تجميد فلاش مع النيتروجين السائل. دون هذه الخطوة، والأنسجة هي أقل حزما وأكثر صعوبة لقطع بدقة كما لوحظ في الشكل 3. هذا البروتوكول يبني على أساليب التشريح السابقة للسماح للحفاظ على كل من الخلايا العصبية الحركية والأنسجة العضلية18,19,20,21,22,23. أحد القيود المفروضة على هذا البروتوكول هو أنه عند إجراء خفض خط الوسط للbiection ، يمكن أن يكون من الصعب الحصول على اثنين من preps نظيفة لكل الصدر. طريقة واحدة لضمان واحد على الأقل hemithorax لكل ذبابة، يمكنك قطع عمدا قبالة إلى جانب واحد من الصدر للحصول على الإعدادية واحدة نظيفة. مع هذا التعديل، قد يحتاج المرء أيضا إلى إزالة الأنسجة الزائدة إضافية من قطع لتنظيف العينة مع قواطع شفرة. بالنسبة لأولئك جديدة على هذه التقنية، مع استمرار الممارسة، وسوف تزيد دقة bisection.
الطريقة الموصوفة هنا تسمح للباحثين بتقييم بسهولة السلامة الهيكلية للبالغين DLM NMJs في أي وقت طوال فترة حياتهم. ومن المزايا الرئيسية لهذا البروتوكول القدرة على الوصول إلى السلامة المتشابكة في نماذج الأمراض العصبية التنكسية باستخدام علامات متشابك. ونحن نثبت أن هذا التطبيق يمكن أن تساعد في تصور التغيرات في التشكل الإجمالي مع تلطيخ الهيكلية (الشكل 1C\u2012H). بالإضافة إلى ذلك، يمكن تقييم سلامة متشابك مع تلطيخ علامات presynaptic بما في ذلك على سبيل المثال لا الحصر Synapsin28 (الشكل 2A\u2012F) جمل29 (الشكل 2G\u2012L)وBRP30 (الشكل 2م\u2012R). ويمكن أيضا أن أنسجة العضلات ما بعد المينابتيك يمكن تقييمها باستخدام مستقبلات الغلوتامات الثالث الأجسام المضادةالوحدة الفرعية 31 (الشكل 2S\u2012X) ، مما يدل على فائدة هذا البروتوكول.
يمكن للباحثين أيضا الاستفادة من هذه الطريقة تشريح لاستكمال البيانات الوظيفية لدراسة شاملة سلامة الهيكلية من نقاط الاشتباك العصبي المرتبطة مجموعة واسعة من الأمراض. هذه نقاط الاشتباك العصبي تسمح أيضا للتحليل الوظيفي من خلال التسجيلات الكهربائية الفيزيولوجية32،33،34 و اختبار الرحلة10. هذا البروتوكول يمكن أن توفر أيضا سهولة الوصول إلى الأنسجة للعديد من التطبيقات والمقدّمات. على سبيل المثال، يمكن أن تستخدم الدراسات المستقبلية هذا البروتوكول لتحديد التغيرات متشابك من خلال القياس الكمي للكثافة وعدد من نقاط الاشتباك العصبي15،16. في حين أن البروتوكول الموصوف هنا يدرس على وجه التحديد سلامة متشابك الخلايا العصبية الحركية، يمكن أيضا بروتوكولات تكميلية لتقييم فقدان خلايا العضلات تنفيذها مع هذا التشريح باستخدام تتلوين TUNEL35. لفحص فقدان الخلايا العصبية، تشريح العقدة الصدرية36 يمكن أيضا أن تستخدم مع تلطخ TUNEL. ونتوقع أن يكون للتشريح الموصوف هنا المزيد من التطبيقات للدراسات المستقبلية التي تقيّم الأمراض المرتبطة بالعمر وكذلك الأمراض العصبية.
Disclosures
ولا يوجد لدى أصحاب البلاغ أي تضارب في المصالح للكشف عنه.
Acknowledgements
وقد دعم هذا العمل المعاهد الوطنية للصحة (R01 NS10727) إلى D.T.B.
Materials
| Name | Company | Catalog Number | Comments |
| 32% Formaldehyde | Electron Microscopy Sciences | 15714 | Tissue preservation |
| Alexa Fluor 568 goat anti mouse | Fisher Scientific | A11031 | Labels primary antibodies. Used at 1:200 concentration. |
| Alexa Fluor 568 goat anti rabbit | Fisher Scientific | A11036 | Labels primary antibodies. Used at 1:200 concentration. |
| anti- Bruchpilot (BRP) antibody | Developmental Studies Hybridoma Bank | NC82 | Stains the active zones in presynaptic neurons. Used at 1:25 concentration. |
| anti-GluRIII antibody | Gift from Aaron DiAntonio | N/A | Labels glutamate receptor subunits. Used at 1:1000 concentration. |
| anti-Synapsin antibody | Developmental Studies Hybridoma Bank | 3C11 | Labels the synaptic protein synapsin. Used at 1:50 concentration. |
| anti-Syntaxin antibody | Developmental Studies Hybridoma Bank | 8C3 | labels the synaptic protein syntaxin. Used at 1:10 concentration. |
| BenchRocker | Genesee Scientific | 31-302 | Rotating samples during staining |
| Blade Breaker | Fine Science Tools | 10053-09 | Used for holding feather blade |
| cover slips | Fisher Scientific | 12548A | For mounting tissue |
| cryogenic gloves | VWR | 97008-198 | protect hands from liquid nitrogen |
| cryogenic tweezers | VWR | 82027-432 | Hold 2.0 mL tube in liquid nitrogen |
| dewar flask-1900 mL | Thomas Scientific | 5028M54 | Hold liquid nitrogen |
| Feather Blades | Electron Microscopy Sciences | 72002-01 | Scalpel Blades |
| Fine Forecps x 2 | Fine Science Tools | 11252-20 | One fine pair for Clearing midline of thorax. The other pair can be dulled using a sharpening stone. |
| FITC-conjugated anti HRP | Jackson Laboratories | 123-545-021 | Stains Motor Neurons. Used at 1:100 concentration |
| freezer box (Black) | Fisher Scientific | 14100F | Protects samples from light |
| glass pasteur pipettes | VWR | 14637-010 | Used to transfer samples |
| glass slides | Fisher Scientific | 12550143 | For mounting tissue |
| mounting media (vectashield) anti-fade | VWR | 101098-042 | Mounting media retains fluorescent signaling |
| nail polish | Electron Microscopy Sciences | 72180 | Seals microscope slides |
| normal goat serum | Fisher Scientific | PCN5000 | Prevents non-specific binding of antibodies |
| paint brush | Genesee Scientific | 59-204 | Transferring flies |
| PBS | Fisher Scientific | 10-010-023 | Saline solution for dissecting and staining |
| Phalloidin 647 | Abcam | AB176759 | Stains F-Actin in muscle Tissue. Used at 1:1000 concentration |
| plastic petri dish (100 mm) | VWR | 25373-100 | Dissection dish |
| reinforcement labels | W.B. Mason | AVE05722 | Provides support for glass coverslip over the mounted tissue |
| sharpening block | Grainger | 1RDF5 | Keeping fine forceps sharp and also dulling separate pair |
| slide folder | VWR | 10126-326 | Sample storage |
| standard office scissors | W.B. Mason | ACM40618 | Cutting reinforcement labels |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | Coating for dissection dish |
| Triton-X-100 | Electron Microscopy Sciences | 22140 | Helps to permeabilize tissue |
| Vannas Disssection Sissors | Fine Science Tools | 1500-00 | Ued for removing fly legs and making an incision on thorax |
References
- Casas, C., Manzano, R., Vaz, R., Osta, R., Brites, D. Synaptic failure: focus in an integrative view of ALS. Brain Plasticity. 1, 159-175 (2016).
- Lodato, M. A., et al. Aging and neurodegeneration are associated with increased mutations in single human neurons. Science. 359, 555-559 (2018).
- López-Erauskin, J., et al. ALS/FTD-linked mutation in FUS suppresses intra-axonal protein synthesis and drives disease without nuclear loss-of-function of FUS. Neuron. 100, 816-830 (2018).
- Munsie, L., et al. Retromer-dependent neurotransmitter receptor trafficking to synapses is altered by the Parkinson's disease VPS35 mutation p. D620N. Human Molecular Genetics. 24, 1691-1703 (2015).
- Oddo, S., et al. Triple-transgenic model of Alzheimer's disease with plaques and tangles: intracellular Aβ and synaptic dysfunction. Neuron. 39, 409-421 (2003).
- Selkoe, D. J. Alzheimer's disease is a synaptic failure. Science. 298, 789-791 (2002).
- Collins, C. A., DiAntonio, A. Synaptic development: insights from Drosophila. Current Opinion in Neurobiology. 17, 35-42 (2007).
- Jan, L., Jan, Y. Properties of the larval neuromuscular junction in Drosophila melanogaster. The Journal of Physiology. 262, 189-214 (1976).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Babcock, D. T., Ganetzky, B. An improved method for accurate and rapid measurement of flight performance in Drosophila. Journal of Visualized Experiments. , e51223 (2014).
- Fernandes, J., Bate, M., Vijayraghavan, K. Development of the indirect flight muscles of Drosophila. Development. 113, 67-77 (1991).
- Fernandes, J., VijayRaghavan, K. The development of indirect flight muscle innervation in Drosophila melanogaster. Development. 118, 215-227 (1993).
- Fernandes, J. J., Keshishian, H. Patterning the dorsal longitudinal flight muscles (DLM) of Drosophila: insights from the ablation of larval scaffolds. Development. 122, 3755-3763 (1996).
- Fernandes, J. J., Keshishian, H. Nerve-muscle interactions during flight muscle development in Drosophila. Development. 125, 1769-1779 (1998).
- Hebbar, S., Fernandes, J. J. Pruning of motor neuron branches establishes the DLM innervation pattern in Drosophila. Journal of Neurobiology. 60, 499-516 (2004).
- Hebbar, S., Fernandes, J. J. A role for Fas II in the stabilization of motor neuron branches during pruning in Drosophila. Developmental Biolology. 285, 185-199 (2005).
- Danjo, R., Kawasaki, F., Ordway, R. W. A tripartite synapse model in Drosophila. PloS One. 6, (2011).
- Hunt, L. C., Demontis, F. Whole-mount immunostaining of Drosophila skeletal muscle. Nature Protocols. 8, 2496-2501 (2013).
- Kucherenko, M. M., et al. Paraffin-embedded and frozen sections of Drosophila adult muscles. Journal of Visualized Experiments. , e2438 (2010).
- Llamusi, B., et al. BSF and TBPH are mislocalized in the muscle sarcomere of a Drosophila myotonic dystrophy model. Disease Models & Mechanisms. 6, 184-196 (2013).
- Pantoja, M., Fischer, K. A., Ieronimakis, N., Reyes, M., Ruohola-Baker, H. Genetic elevation of sphingosine 1-phosphate suppresses dystrophic muscle phenotypes in Drosophila. Development. 140, 136-146 (2013).
- Schnorrer, F., et al. Systematic genetic analysis of muscle morphogenesis and function in Drosophila. Nature. 464, 287-291 (2010).
- Viswanathan, M. C., Blice-Baum, A. C., Schmidt, W., Foster, D. B., Cammarato, A. Pseudo-acetylation of K326 and K328 of actin disrupts Drosophila melanogaster indirect flight muscle structure and performance. Frontiers in Physiology. 6, 116 (2015).
- Hebbar, S., Fernandes, J. J. Glial remodeling during metamorphosis influences the stabilization of motor neuron branches in Drosophila. Developmental Biology. 340, 344-354 (2010).
- Mahr, A., Aberle, H. The expression pattern of the Drosophila vesicular glutamate transporter: a marker protein for motoneurons and glutamatergic centers in the brain. Gene Expression Patterns. 6, 299-309 (2006).
- Ritson, G. P., et al. TDP-43 mediates degeneration in a novel Drosophila model of disease caused by mutations in VCP/p97. Journal of Neuroscience. 30, 7729-7739 (2010).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Klagges, B. R., et al. Invertebrate synapsins: a single gene codes for several isoforms in Drosophila. Journal of Neuroscience. 16, 3154-3165 (1996).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proceedings of the National Academy of Sciences of the United States of America. 79, 7929-7933 (1982).
- Wagh, D. A., et al. a protein with homology to ELKS/CAST, is required for structural integrity and function of synaptic active zones in Drosophila. Neuron. 49, 833-844 (2006).
- Marrus, S. B., DiAntonio, A. Preferential localization of glutamate receptors opposite sites of high presynaptic release. Current Biology. 14, 924-931 (2004).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological recordings from the giant fiber pathway of D. melanogaster. Journal of Visualized Experiments. , e2412 (2011).
- Maccioni, R., et al. Standardized phytotherapic extracts rescue anomalous locomotion and electrophysiological responses of TDP-43 Drosophila melanogaster model of ALS. Scientific Reports. 8, 16002 (2018).
- Siddiqi, O., Benzer, S. Neurophysiological defects in temperature-sensitive paralytic mutants of Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America. 73, 3253-3257 (1976).
- Wang, Z. H., Clark, C., Geisbrecht, E. R. Drosophila clueless is involved in Parkin-dependent mitophagy by promoting VCP-mediated Marf degradation. Human Molecular Genetics. 25, 1946-1964 (2016).
- O'Sullivan, A., et al. Multifunctional Wing Motor Control of Song and Flight. Current Biology. 28, 2705-2717 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved