A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصور من الحمض النووي إصلاح البروتينات التفاعل من قبل immunofluorescence
In This Article
Summary
بعد تلف الحمض النووي، تقوم الخلايا البشرية بتنشيط مسارات الإصلاح الأساسية لاستعادة سلامة جينومها. هنا، نحن وصف طريقة من المناعة غير المباشرةflufluorescence كوسيلة للكشف عن البروتينات إصلاح الحمض النووي، وتحليل توظيفها المكانية والزمانية، والمساعدة في استجواب التفاعل البروتين البروتيني في مواقع الضرر الحمض النووي.
Abstract
تتعرض خلايا الثدييات باستمرار للمواد الكيميائية والإشعاعات والمنتجات الثانوية الأيضية التي تحدث بشكل طبيعي ، والتي تخلق أنواعًا محددة من إهانات الحمض النووي. يمكن أن تضر العوامل السامة جينيًا العمود الفقري للحمض النووي أو تكسره أو تعدل الطبيعة الكيميائية للقواعد الفردية. بعد إهانة الحمض النووي، يتم تنشيط مسارات الاستجابة لتلف الحمض النووي (DDR) ويتم تجنيد البروتينات المشاركة في الإصلاح. وتشارك مجموعة كبيرة من العوامل في استشعار نوع الضرر وتفعيل استجابة الإصلاح المناسبة. يمكن أن يؤدي الفشل في تنشيط وتوظيف عوامل نزع السلاح والتسريح وإعادة الإدماج بشكل صحيح إلى عدم الاستقرار الجينومي ، الذي يكمن وراء العديد من الأمراض البشرية بما في ذلك السرطان. ويمكن أن توفر دراسات بروتينات نزع السلاح والتسريح وإعادة الإدماج رؤى في الاستجابة للأدوية السمية الجينية والآليات الخلوية لمقاومة الأدوية.
هناك طريقتان رئيسيتان لتصور البروتينات في الجسم الحي:المراقبة المباشرة، عن طريق وضع علامات على البروتين الذي يهمك مع بروتين الفلورسنت واتباعه عن طريق التصوير الحي، أو الفلوروسين غير المباشر على عينات ثابتة. في حين أن التصور من البروتينات الموسومة الفلورسنت يسمح الرصد الدقيق مع مرور الوقت، ووضع علامات مباشرة في N- أو C-terminus يمكن أن تتداخل مع توطين البروتين أو وظيفة. ويفضل مراقبة البروتينات في إصدارها غير المعدلة، الذاتية. عندما يتم تجنيد البروتينات إصلاح الحمض النووي لإهانة الحمض النووي، وزيادة تركيزها محليا، وأنها تشكل مجموعات، أو "بؤر"، التي يمكن تصورها من قبل immunofluorescence غير مباشر باستخدام أجسام مضادة محددة.
على الرغم من أن الكشف عن بؤر البروتين لا يقدم دليلا قاطعا على التفاعل المباشر، فإن التعريب المشترك للبروتينات في الخلايا يشير إلى أنها تجمع إلى موقع الضرر ويمكن أن تبلغ عن تسلسل الأحداث المطلوبة لتشكيل معقد. تحليل دقيق للتراكب المكاني البؤري في الخلايا التي تعبر عن النوع البري أو الإصدارات المتحولة من البروتين يمكن أن توفر أدلة ثمينة على المجالات الوظيفية الهامة لوظيفة إصلاح الحمض النووي. وأخيراً، يشير التعريب المشترك للبروتينات إلى التفاعلات المباشرة المحتملة التي يمكن التحقق منها عن طريق المشاركة في المناعة في الخلايا، أو السحب المباشر باستخدام البروتينات النقية.
Introduction
تتعرض الخلايا البشرية باستمرار لمجموعة متنوعة من العوامل الضارة الحمض النووي من أصول مختلفة. المصادر الخارجية تتكون في الغالب من التعرض للإشعاعات والمواد الكيميائية (بما في ذلك العوامل العلاجية الكيميائية وبعض المضادات الحيوية) والفيروسات، في حين أن المصادر الذاتية الرئيسية تشمل أخطاء في تكرار الحمض النووي والإجهاد التأ المؤدّس. ويمكن أن تتراوح الآثار المباشرة للتعرض للسمية الجينية من قاعدة معدلة إلى كسر مزدوج حبل الحمض النووي القاتل المحتمل ، اعتمادا على الإجهاد وجرعة التعرض. في نهاية المطاف، يمكن أن يؤدي تلف الحمض النووي غير المصلح أو غير إصلاحه إلى تراكم الطفرات وإعادة ترتيب الجينوم وعدم استقرار الجينوم ويؤدي في نهاية المطاف إلى الإصابة بالسرطان1. وقد تطورت خلايا الثدييات مسارات معقدة للتعرف على أنواع محددة من الضرر الحمض النووي2,3 وإصلاحها في الوقت المناسب, تزامن مع تطور دورة الخلية.
الإشعاع المؤين (IR) يضر الحلزون المزدوج الحمض النووي ويخلق فواصل حبلا مزدوج (DSBs)، واحدة من أكثر أشكال الضرر الضارة الحمض النووي. وMN (MRE11، RAD50، NBS1) وظائف معقدة كمستشعر من ينتهي الحمض النووي وينشط كيناز البروتين ترنح تيلانغيكتسيا تحور (ATM)4،5. بعد التنشيط الأولي من أجهزة الصراف الآلي من قبل ينتهي الحمض النووي، أجهزة الصراف الآلي يؤدي سلسلة من الأحداث DDR في موقع الاستراحة، والشروع مع حدث رئيسي، وفسفورل من البديل هيستون H2AX6. H2AX الفوسفور على بقايا S139 ينشط في γH2AX ، تمتد المناطق حتى megabases حول آفة الحمض النووي6،7،8،9. هذا الحدث يزيد من إمكانية الحصول على الحمض النووي، مما يؤدي إلى تجنيد وتراكم البروتينات إصلاح الحمض النووي الأخرى7. لأن γH2AX هو بزفير وعلى وجه التحديد المستحثة DSBs المحيطة، فإنه يمكن تصور بسهولة باستخدام أجسام مضادة محددة، ويستخدم عادة كعلامة بديلة لDSBs في مجال إصلاح الحمض النووي. بمجرد الإشارة إلى الكسر ، تقوم الخلايا بتنشيط مسارات إصلاح الحمض النووي ومعالجة تلف الحمض النووي. البروتين MDC1 (وسيط الحمض النووي الضرر نقطة تفتيش البروتين 1) يربط مباشرة γH2AX10, يتفاعل مع أجهزة الصراف الآلي11 وأيضا مع NBS112,13. وهو يساهم في زيادة تركيز مركب MRN في DSB وبدء حلقة تغذية مرتدة إيجابية الصراف الآلي. تتم إزالة γH2AX بسرعة بمجرد إصلاح الكسر ، وبالتالي ، مما يسمح بمراقبة إزالة DSB. تليها المجهر، وانخفاض في γH2AX مع مرور الوقت يوفر قياس غير مباشر من فواصل المتبقية وكفاءة إصلاح الحمض النووي.
يمكن للخلايا النوى إصلاح DSBs من قبل عدة مسارات، وهما الرئيسية التي يجري غير متجانسة نهاية الانضمام (NHEJ) وإعادة التركيب المتماثل (الموارد البشرية) (الشكل 1). NHEJ أساسا ربط الحمض النووي مزدوجة حبلا ينتهي دون استخدام homology الموسعة وتعمل في جميع أنحاء دورة الخلية14،15. الموارد البشرية تصبح الغالبة خلال مراحل S و G2 ، وقمعها على خلاف ذلك ، لأنه يتطلب chromatid الشقيقة كقالب متجانس لإصلاح14،16. اختيار المسار بين NHEJ و الموارد البشرية لا يعتمد فقط على القرب المادي من الكروماتيد الشقيقة، ولكن أيضا على تمديد استئصال نهاية الحمض النووي17، مما يمنع NHEJ.
إصلاح DSB المعتمد على Homology يبدأ عن طريق التحلل النووي من حبلا 5 'من ينتهي الكسر لتوليد 3 'واحد حبلا الحمض النووي (ssDNA) ذيول، وهي عملية يشار إليها باسم 5 '-3' استئصال. مجمع MRN يبدأ استئصال نهاية الحمض النووي ويتم معالجة مزيد من استئصال في تركيبة مع BLM /EXO1 (بلوم متلازمة البروتين / exonuclease 1) أو BLM / DNA2 (الحمض النووي النسخ المتماثل ATP- تعتمد على helicase/nuclease)18,19,20,21,22. يتم تعزيز استئصال الحمض النووي نهاية بواسطة CtIP (CtBP التفاعل البروتين) من خلال تفاعلها المباشر مع MRN مجمع23 وتجنيد BRCA1 (سرطان الثدي نوع 1 البروتين القابلية للحساسية)24,25. بروتين النسخ المتماثل A (RPA) يربط على الفور إلى ssDNA يتعرض ومن ثم يتم إزاحة من قبل البروتين إعادة الكومبيناز RAD51 لتشكيل خيوط البروتين النووي الذي يحفز البحث المتجانسة وغزو حبلا26،27،28.
بدء عملية استئصال هو خطوة حاسمة لإصلاح المسار الاختيار. مرة واحدة وقد بدأت استئصال, ينتهي الحمض النووي تصبح ركائز الفقراء للربط بواسطة ku70/Ku80 heterodimer (مكون من مسار NHEJ) وتلتزم الخلايا إلى الموارد البشرية17,29,30. وKu70/Ku80 هيتيروديمر يربط إلى ينتهي DSB, تجنيد الحمض النووي-PKcs وp53 البروتين ملزمة 1 (53BP1)29,30. 53BP1 بمثابة حاجز للتشفط في G1، وبالتالي منع الموارد البشرية في حين تعزيز NHEJ31،32، ولكن تتم إزالته بطريقة BRCA1 تعتمد في المرحلة S، وبالتالي السماح للتشفط أن يحدث33،34. ولذلك، 53BP1 و BRCA1 تلعب أدوارا متعارضة في إصلاح DSB، مع 53BP1 كونه ميسر NHEJ في حين BRCA1 أعمال تمكين فواصل لإصلاح من خلال الموارد البشرية.
في المختبر، يمكن أن يكون سبب تكوين DSB الإشعاع المؤين (IR). في حين أن هذا المثال يستخدم جرعة عالية من 4 Gy، 1 غي و 2 غي أيضا إنشاء كمية كبيرة من DSBs، ومناسبة لتحليل تشكيل بؤر بواسطة البروتينات وفيرة. من المهم أن نلاحظ أن نوع وجرعة الإشعاع المستخدمة يمكن أن تؤدي إلى آفات مختلفة في الحمض النووي وفي الخلية: في حين أن الأشعة تحت الحمراء تحفز DSBs، يمكن أن تسبب أيضا فواصل حبلا واحد أو تعديل قاعدة (انظر35،,36 للاطلاع على مرجع على نقل الطاقة الخطي المشع (LET) ونوع الضرر الحمض النووي). لتحديد الحركية من المؤينة الناجمة عن الإشعاع تشكيل بؤر (IRIF) وإزالتها، والتي تشير إلى إصلاح الضرر وعكس من DDR تنشيط8،9،37،38، ويمكن رصد تشكيل بؤر في نقاط زمنية مختلفة بعد الإشعاع المؤين. ومن المعروف توقيت التنشيط وإزالة جميع البروتينات الضرر الحمض النووي الرئيسية39, ويتم التحقيق في العديد من علامات بديلة للأحداث الرئيسية. على سبيل المثال، pRPA، التي تمتلك تقارب عالية لSSDNA يستخدم كبديل للاستئصال كسر، يمكن استخدام البروتينات MRN (MRE11، RAD50، NBS1) والإفلات من الدهون لتقييم كفاءة استئصال أيضا. في حين RAD51، BRCA1، BRCA2 (سرطان الثدي نوع 2 البروتين القابلة للحساسية)، وPALB2 (شريك و localizer من BRCA2) يمكن رصدها لتقييم كفاءة الموارد البشرية، ووجود بروتينات كو أو 53BP1، وتستخدم كعلامات من NHEJ (الشكل 1).
كما البروتينات من آلات إصلاح الحمض النووي تجنيد بعضها البعض لكسر والتجمع في مجمعات فائقة، يمكن الاستدلال على التفاعلات الحمض النووي البروتين والبروتين من خلال اتباع التعريب الفردية مع مرور الوقت وتحليل التعريب المشترك للبروتينات، كما تصورها إشارات متداخلة في الخلية40،41،42. في خطوط الخلايا، يسمح إدخال طفرات نقطة أو حذف في جينات إصلاح الحمض النووي المحددة إما من خلال تحرير الجينوم، أو عن طريق التعبير الزائد عن مسوخ البلازميد، بالتحقيق في بقايا محددة ودورها المحتمل في التعرف على تلف الحمض النووي (على سبيل المثال، التعريب المشترك مع γH2AX) أو التجميع المعقد (التعريب المشترك مع بروتينات أخرى أو عدة)، فضلاً عن تأثيرها على إصلاح الحمض النووي. هنا، نستخدم الفلورا المناعية غير المباشرة كوسيلة للتحقيق في تشكيل وحل DSBs باتباع بؤر γH2AX مع مرور الوقت. كما نقدم مثالاً واحداً على تشكيل البؤر وتحليل التعريب المشترك من قبل لاعب رئيسي في إصلاح DSB: p53 ملزمة البروتين 1 (53BP1)32. كما ذكر سابقا، يعتبر 53BP1 مركزية لإصلاح الحمض النووي اختيار المسار. بعد تراكم 53BP1 وتوطينه المشترك مع γH2AX يوفر معلومات ثمينة عن مرحلة دورة الخلية ، وتراكم تلف الحمض النووي ، والمسار المستخدم لإصلاح DSBs. الغرض من تخصيص المناعة غير المباشرة هو تقييم كفاءة إصلاح تلف الحمض النووي في خطوط الخلايا ، بعد الأشعة تحت الحمراء كما في هذه الدراسة ، أو بعد التعرض لضغوط مختلفة في الخلية ، من ربط الحمض النووي إلى انسداد شوكة النسخ المتماثل (يتم توفير قائمة من العوامل الضارة للحمض النووي في الجدول 1).
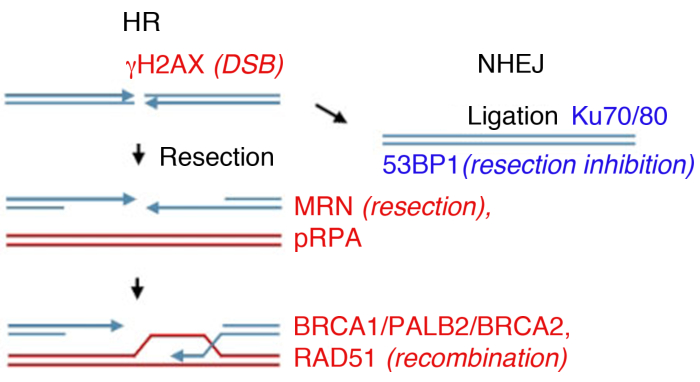
الشكل 1: فواصل الحمض النووي المزدوجة فواصل (DSB) مسارات الإصلاح.
إصلاح DSB ينطوي على مسارين رئيسيين: إعادة التركيب المتماثل (HR, اليسار) وغير متجانسة نهاية-صلة (NHEJ, حق). بعد الاستراحة، يتم تنشيط البروتينات للاحتفال بالكسر (γH2AX)، والمشاركة في استئصال نهاية (MRN)، أو معطف SsDNA (pRPA)، والترويج لإعادة الكومبونيشن (BRCA1، PALB2، BRCA2، RAD51) أو الحد من استئصال وترقية NHEJ (53BP1). البروتينات الأخرى المشاركة في إصلاح الضرر، ولكن البروتينات المذكورة تليها بشكل روتيني مناعي غير مباشر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| عامل إتلاف الحمض النووي | آلية العمل | الجرعة الموصى بها |
| γ أشعة / الأشعة السينية | الاشعاع تشكيل فواصل مزدوجة تقطعت بها السبل مع بعض الآثار الخلوية غير المنضبط | 1-4 غي |
| 36 آر أيونات | الاشعاع تشكيل فواصل مزدوجة تقطعت بها السبل | 270 كيلو متر/ميكرومتر |
| α-الجسيمات | الاشعاع تشكيل فواصل مزدوجة تقطعت بها السبل | 116 كيلو/ميكرومتر |
| بلوميسين | مثبط تخليق الحمض النووي | 0.4-2 ميكروغرام/مل |
| كامبتويثسين | مثبط توبواomerase الأول | 10-200 nM |
| سيسبلاتين | وكيل Alkylating (تحريض الروابط المتقاطعة داخل العلامة التجارية) | 0.25-2 ميكرومتر |
| دوكسوروبسين | عامل المعايرة البينية مثبطات توبواomerase II | 10-200 nM |
| إيتوبوسيد | مثبطات توبواomerase II | 10 ميكرومتر |
| هيدروكسي يوريا | مثبط تخليق الحمض النووي (بواسطة ريبونوكليوتيد الاستئصال) | 10-200 ميكرومتر |
| ميثيل الميثان | وكيل Alkylating | 0.25-2 mM |
| ميتوميسين سي | وكيل Alkylating | 0.25-2 ميكرومتر |
| الأشعة فوق البنفسجية (UV) الخفيفة | تشكيل خافمات الثيميدين (توليد تشويه من سلسلة الحمض النووي) | 50-100 mJ / سم2 |
الجدول 1: العوامل السمية الجينية أمثلة على عوامل إتلاف الحمض النووي، وآلية عملها والأضرار الناجمة عن ذلك استناداً إلى التركيز المقترح للعمل.
Protocol
1. خلية HeLa ثقافة
- قبل علاج يغطي الزجاج المستدير مع 1 M HCl في 50 درجة مئوية لمدة 16-18 ساعة. شطف مع ddH2O وتخزينها في EtOH 100٪.
- إعداد خلية ثقافة المتوسطة: إضافة 10٪ (v/v) FBS إلى متوسط DMEM.
- تنمو 4.0 × 104 خلايا / جيدا في لوحة معقمة 12-well مع غطاء زجاجي مستدير 18 ملم في 37 درجة مئوية و 5٪ CO2 في حاضنة مرطبة. تنمو الخلايا إلى 80٪ التقاء (ما يقرب من 24 ساعة).
2. معالجة الخلايا مع الإشعاع (IR)
- للحث على تشكيل فواصل مزدوجة حبلا، وفضح الخلايا إلى 4 غي γ-تشعيع (السيطرة: لا تشعيع، t = 0). في خلية غاما -40، وهذا يتوافق مع 4.54 دقيقة، في 0.815 غي لكل دقيقة.
- احتضان الخلايا في 37 درجة مئوية و 5٪ CO2 في حاضنة مرطبة لطول الوقت المناسب (نقاط زمنية مختارة هنا t= 1، 2، 4، 16 h).
3- الاستخراج النووي و تثبيت الخلايا
- إعداد حلول الأسهم: 0.2 M PIPES (pH 6.8)، 5 M NaCl، 2 M سكروز، 1 M MgCl2، 0.1 M EGTA (pH 8.0).
- إعداد العازلة استخراج النووية (NEB): حل 10 mM PIPES (pH 6.8)، 100 mM NaCl، 300 mM السكروز، 3 mM MgCl2،1 mM EGTA (pH 8.0) و 0.5٪ (v/v) Triton X-100 في DdH2O. ميكس حتى يذوب تماما.
- إعداد 4٪ (v/v) شبهformaldehyde (PFA): تذوب 10 مل من 16٪ PFA محلول مائي في PBS 30 مل. تخلط حتى يذوب تماما.
- عند نقطة زمنية مناسبة (t = 0، 1، 2، 4، 16 h)، وغسل الخلايا مرتين مع 1 مل من برنامج تلفزيوني. إزالة برنامج تلفزيوني تماما.
- إضافة 200 μL من NEB إلى كل بئر لاستخراج نواة الخلية (تحلل السيتوبلازم، يبقى نواة فقط) (الشكل 2). احتضان لمدة 2 دقيقة في درجة حرارة الغرفة وإزالة تماما.
ملاحظة: لا تتجاوز دقيقتين.
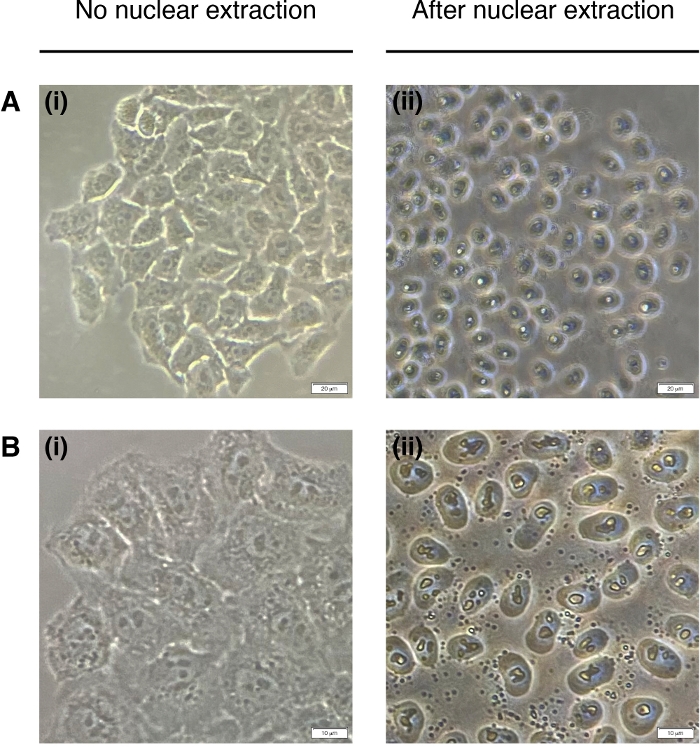
الشكل 2: الاستخراج النووي.
صور تمثيلية للخلايا قبل (اليسار) والناشر (يمين) استخراج نووي. وينبغي هضم السيتوبلازم ولكن ينبغي أن يظل الهيكل النووي سليماً بعد الاستخراج (يمين). (أ) 20x التكبير؛ شريط مقياس = 20 ميكرومتر و (ب) 40x التكبير؛ شريط مقياس = 10 μm. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- غسل الخلايا مع 1 مل من برنامج تلفزيوني. إزالة برنامج تلفزيوني تماما. إضافة برنامج تلفزيوني بعناية، والخلايا هشة جدا في هذه الخطوة.
- إضافة 200 μL من 4٪ (v/v) PFA إلى كل بئر لتثبيت الخلايا. احتضان لمدة 10 دقائق عند 4 درجة مئوية. إزالة PFA تماما.
- إضافة 1 مل من برنامج تلفزيوني.
ملاحظة: يمكن تخزين الخلايا في برنامج تلفزيوني عند 4 درجة مئوية.
4. وصمة المناعة
- إعداد حل حجب: حل 5٪ BSA (ث / الخامس) في برنامج تلفزيوني وإضافة 0.3٪ (v/v) تريتون X-100. تخلط حتى يذوب تماما.
- إعداد العازلة التخفيف: حل 1٪ BSA (ث / الخامس) في برنامج تلفزيوني وإضافة 0.3٪ (v/v) تريتون X-100. تخلط حتى يذوب تماما.
- للحظر، أضف 200 ميكرولتر من محلول الحجب إلى كل بئر. احتضان لمدة 2 ساعة في درجة حرارة الغرفة أو 16-18 ساعة في 4 درجة مئوية.
ملاحظة: إذا سيتم استخدام الأجسام المضادة الماعز، إضافة مصل الماعز 5٪ إلى حل حظر. - تخفيف الأجسام المضادة الأولية في عازلة التخفيف (1:500؛ انظر الجدول 2 لقائمة الأجسام المضادة) ودوامة حتى مختلطة جيدا.
ملاحظة: إذا تم استخدام الأجسام المضادة الماعز، إضافة 1٪ مصل الماعز إلى العازلة التخفيف. - في علبة الرطوبة/الحضانة، التزم بقطعة من البارا فيلم. أضف 10 ميكرولتر من الأجسام المضادة الأولية (في قطرة واحدة). محاذاة حافة واحدة من الغطاء مع قطرة وانخفاض ببطء على parafilm، السائل لتنتشر في جميع أنحاء (تجنب فقاعات إذا كان ذلك ممكنا). احتضان لمدة 2 ساعة في درجة حرارة الغرفة.
- غسل يغطي ثلاث مرات في برنامج تلفزيوني لمدة 1 دقيقة.
- تخفيف الأجسام المضادة الثانوية في العازلة التخفيف (التركيز النهائي: 2 ميكروغرام / مل) ودوامة حتى مختلطة جيدا.
- تطبيق 10 ميكرولتر من الأجسام المضادة الثانوية كما هو موضح للأجسام المضادة الأولية. احتضان لمدة 2 ساعة في درجة حرارة الغرفة.
ملاحظة: حماية من الضوء.
| جسم | الشركه | مرجع | مصدر |
| 53BP1 | إشارة الخلية | 4937 | الارنب |
| مكافحة ماوس IgG H & L (اليكسا فلور 647) | Abcam | ab150103 | الحمار |
| مضاد للفوسفو-هيستون H2A. X (Ser139)، استنساخ JBW301 | ميليبور | 05-636 | الماوس |
| مكافحة الأرنب IgG H & L (اليكسا فلور 488) | Abcam | ab150081 | الماعز |
الجدول 2: الأجسام المضادة المستخدمة. قائمة الأجسام المضادة المستخدمة في هذه الدراسة.
- غسل يغطي ثلاث مرات في برنامج تلفزيوني لمدة 1 دقيقة.
- غسل الأغطية مع H2O لمدة 1 دقيقة.
- الحمض النووي المضاد مع DAPI: تطبيق 10 ميكرولتر من 300 NM DAPI (كما هو موضح للأجسام المضادة)، واحتضان لمدة 30 دقيقة في درجة حرارة الغرفة ثم جبل على الشريحة الزجاجية مع وسائل الإعلام تصاعد الجلسرين القائمة. بدلاً من ذلك، إضافة قطرة واحدة (10 ميكرولتر) من الوسائط التجارية المتصاعدة antifade التي تحتوي على DAPI على شريحة وتطبيق غطاء. اضغط بلطف على غطاء الغطاء وأزل السوائل الزائدة حوله بمنشفة ورقية.
- يغطي الختم مع طلاء الأظافر شفافة والسماح لهم الجافة لمدة 20 دقيقة.
- تخزين الشرائح عند 4 درجة مئوية.
5. الحصول على صورة
- ضع قطرة من زيت الغمر على العدسة الهدف 60x. استخدام DAPI لتحديد موقع النوى من خلال قطعة العين.
- للحصول على صورة XYZ، فتح اقتناء البرمجيات وتحديد المعلمات: نوع الماسح الضوئي: غالفانو؛ وضع الماسح الضوئي: دائري؛ حجم الصورة: 512×512; وضع PMT: VBF; متوسط PMT: الإطار (4 مرات)؛ PMT فحص متسلسل: خط.
- حدد الصبغة وأجهزة الكشف:
قناة (CH1)، صبغ (DAPI)، كاشف (SD1)
قناة (CH2)، صبغ (اليكسا فلور 488)، كاشف (HSD3)
قناة (CH3)، صبغ (اليكسا فلور 647)، كاشف (HSD4) - حدد ON في "Z".
- ضبط الصورة الحية. اضغط على الزر Live في إطار Live.
- ضبط التركيز وتعيين كثافة الليزر (٪)، والحساسية (HV)، والحصول على وموازنة على "PMT" نافذة أداة.
- ضبط كثافة الليزر (٪): للسطوع والتبييض. كلما زادت كثافة الليزر ، كلما كانت الإشارة أقوى ، ولكن العينة سوف photobleach.
- ضبط حساسية (HV): مستوى الضوضاء. كلما ارتفع HV ، كلما كانت الإشارة أقوى ، ولكن الصورة ستكون صاخبة إذا كانت عالية جدًا.
ملاحظة: دائما الحفاظ على الجهد ثابت. - ضبط الإزاحة: مستوى الخلفية.
- حدد البدء/النهاية (15 شريحة)، للرصاصات Z.
- ضبط التركيز وتعيين كثافة الليزر (٪)، والحساسية (HV)، والحصول على وموازنة على "PMT" نافذة أداة.
- ابدأ عملية الاستحواذ.
- حدد المجلد لحفظ الصور. اضغط الزر ابدأ LSM لبدء الحصول على الصورة. اضغط على الزر سلسلة تم لإكمال الحصول على الصورة.
6 - تحليل البيانات
- لتحليل الصور، افتح برنامج التحليل.
- اضغط على نافذة أداة الدفعة، حدد الصور لتحليل وتحديد مجلد الإخراج.
- اضغط على نافذة أداة التحليل وحدد الإسقاط (سيعرض إسقاط الحد الأقصى للكثافة من 15 شريحة).
- ضمن إعداد الإدخال/الإخراج، حدد المجموعة التي تم إنشاؤها.
- اضغط على العملية من أجل معالجة الصور.
- تصدير الصور كملفات .tiff.
- بالنسبة إلى القياس الكمي لـ foci النووي، افتح CellProfiler.
- فتح خط أنابيب γH2AX و 53BP1 foci quantification (انظر المعلومات التكميلية).
- بيانات الرسم البياني باستخدام برنامج جدول.
- لتحليل التعريب المشترك، افتح CellProfiler.
- فتح خط أنابيب التكلس (راجع المعلومات التكميلية). سيتم إنشاء ملف جدول بيانات وحفظه في الموقع المفضل. ومع ذلك، لن يتم حفظ الرسومات البيانية نفسها تلقائيا. ويقترح أن تأخذ لقطة من النوافذ للحفاظ على سجل النتائج.
- بيانات الرسم البياني باستخدام برنامج جدول.
النتائج
في اليوم 2، أو 24 ح خلايا البذر على الأغطية، وقد خضعت الخلايا قسمة واحدة و80٪ التقاء. يمكن أن تؤدي السقطات أو الطفرات المحددة في بروتينات إصلاح الحمض النووي إلى زيادة الوقت المضاعف، أو توعية الخلايا بالعلاج السمية الجينية، وينبغي تعديل كثافة البذر وكذلك جرعات العلاج وفقًا لذلك. لتحديد أفضل ?...
Discussion
وقد ثبت أن تحليل توقيت وكفاءة إصلاح تلف الحمض النووي عن طريق المجهر ضروري لفهم كيفية عمل آلات إصلاح الحمض النووي ، في الخلايا العادية وفي الأمراض البشرية مثل السرطان.
وقد لعبت تطوير الأجسام المضادة المحددة التي تسمح للكشف عن البروتينات المنشطة في النسخة الفوسفورية (مثل γH2AX...
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد دعم هذا العمل منحة من مؤسسة منطقة سان انطونيو. ويدعم مركز مايس للسرطان من قبل مركز دعم مركز NCI الأساسية منحة P30 CA054174. ونود أن نشكر ستيفن هولواي على مساعدته في الحصول على الكواشف، ومختبر سونغ لتوفير المساحة وسعة الفحص المجهري.
Materials
| Name | Company | Catalog Number | Comments |
| 16% (v/v) paraformaldehyde (PFA) aqueous solution | Electron Microscopy Sciences | 15710 | Microscopy quality of the PFA ensures best images. If using "home-made PFA", filter prior to use. |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A3059 | Heat-shock fraction is recommended, to avoid precipitation/background. |
| Coverglass #1, 18 mm round (coverslips) | Neuvitro | NC0308920 | Coverslips need to be cleaned and sterilized prior using, with HCl or ethanol. |
| DMEM, High Glucose [(+) 4.5 g/L D-Glucose, (+) L-Glutamine, (-) Sodium Pyruvate] | Gibco | 11965118 | Adjust the growing media to the needs of cell line used. |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | PBS for tissue culture. |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N′,N′-tetraacetic acid (EGTA) | Research Products International | E57060 | Nuclear extraction buffer. |
| Fetal Bovine Serum (FBS) | Life Technologies | 104370028 | The quality of FBS can be assessed by testing gH2AX foci formation. If traces of genotoxic endotoxin are present in the batch, gH2AX will be positive in the absence of stress. |
| Magnesium chloride (MgCl2) | Research Products International | M24000 | Nuclear extraction buffer. |
| Piperazine-N,N′-bis(2-ethanesulfonic acid) (PIPES) | Research Products International | P40150 | Nuclear extraction buffer. |
| SlowFade Diamond Antifade Mountant with DAPI | Invitrogen | S36973 | 300 nM DAPI with VECTASHIELD Antifade Mounting Medium can be used instead. |
| Sodium chloride (NaCl) | Research Products International | S23020 | Nuclear extraction buffer. |
| Sucrose | Research Products International | S24060 | Nuclear extraction buffer. |
| Superfrost Plus Microscope Slides | Fisherbrand | 1255015 | Polysine Slides can be used instead. |
| TC-Treated Multiple Well Plates, size 12 wells | Costar | 3513 | Seeding on coverslips is done in 12-wells plate. |
| Triton X-100 | AmericanBio | AB02025 | Nuclear extraction buffer. |
| TrypLE Express Enzyme (1X), No Phenol Red | Gibco | 12604021 | Trypsin-EDTA can be used instead. |
| Trypsin-EDTA (0.5%), No Phenol Red | Gibco | 15400054 | TrypLE can be used instead. |
References
- Prakash, R., Zhang, Y., Feng, W., Jasin, M. Homologous recombination and human health: the roles of BRCA1, BRCA2, and associated proteins. Cold Spring Harbor Perspectives in Biology. 7 (4), 016600 (2015).
- Jalan, M., Olsen, K. S., Powell, S. N. Emerging Roles of RAD52 in Genome Maintenance. Cancers (Basel). 11 (7), (2019).
- Oh, J., Symington, L. S. Role of the Mre11 Complex in Preserving Genome Integrity. Genes (Basel). 9 (12), (2018).
- Uziel, T., et al. Requirement of the MRN complex for ATM activation by DNA damage. The EMBO Journal. 22 (20), 5612-5621 (2003).
- Lee, J. H., Paull, T. T. ATM activation by DNA double-strand breaks through the Mre11-Rad50-Nbs1 complex. Science. 308 (5721), 551-554 (2005).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. Journal of Biological Chemistry. 273, 5858-5868 (1998).
- Kinner, A., Wu, W., Staudt, C., Iliakis, G. γ-H2AX in recognition and signaling of DNA double-strand breaks in the context of chromatin. Nucleic Acids Research. 36 (17), 5678-5694 (2008).
- Martin, O. A., Pilch, D. R., Redon, C., Bonner, W. M. Histone H2AX in DNA damage repair. Cancer Biology & Therapy. 2 (3), 233-235 (2003).
- Rogakou, E. P., Boon, C., Redon, C., Bonner, W. M. Megabase chromatin domains involved in DNA double-strand breaks in vivo. Journal of Cell Biology. 146 (5), 905-916 (1999).
- Stucki, M., et al. MDC1 directly binds phosphorylated histone H2AX to regulate cellular responses to DNA double-strand breaks. Cell. 123 (7), 1213-1226 (2005).
- Lou, Z., et al. MDC1 maintains genomic stability by participating in the amplification of ATM-dependent DNA damage signals. Molecular Cell. 21 (2), 187-200 (2006).
- Chapman, J. R., Jackson, S. P. Phospho-dependent interaction between NBS1 and MDC1 mediate chromatin retention of the MRN complex at sites of DNA damage. EMBO Reports. 9 (8), 795-801 (2008).
- Melander, F., et al. Phosphorylation of SDT repeats in the MDC1 N terminus triggers retention of NBS1 at the DNA damage-modified chromatin. Journal of Cell Biology. 181 (2), 213-226 (2008).
- Branzei, D., Foiani, M. Regulation of DNA repair throughout the cell cycle. Nature Review. Molecular Cell Biology. 9 (4), 297-308 (2008).
- Chiruvella, K. K., Liang, Z., Wilson, T. E. Repair of double-strand breaks by end joining. Cold Spring Harbor Perspectives in Biology. 5 (5), 012757 (2013).
- Mehta, A., Haber, J. E. Sources of DNA double-strand breaks and models of recombinational DNA repair. Cold Spring Harbor Perspectives in Biology. 6 (9), 016428 (2014).
- Symington, L. S., Gautier, J. Double-strand break end resection and repair pathway choice. Annual Review of Genetics. 45, 247-271 (2011).
- Huertas, P. DNA resection in eukaryotes: deciding how to fix the break. Nature Structural & Molecular Biology. 17 (1), 11-16 (2010).
- Nimonkar, A. V., et al. BLM-DNA2-RPA-MRN and EXO1-BLM-RPA-MRN constitute two DNA end resection machineries for human DNA break repair. Genes & Development. 25 (4), 350-362 (2011).
- Garcia, V., Phelps, S. E. L., Gray, S., Neale, M. J. Bidirectional resection of DNA double-strand breaks by Mre11 and Exo1. Nature. 479 (7372), 241-244 (2011).
- Sturzenegger, A., et al. DNA2 cooperates with the WRN and BLM RecQ helicases to mediate long-range DNA end resection in human cells. Journal of Biological Chemistry. 289 (39), 27314-27326 (2014).
- Daley, J. M., Niu, H., Miller, A. S., Sung, P. Biochemical mechanism of DSB end resection and its regulation. DNA Repair. 32, 66-74 (2015).
- Sartori, A. A., et al. Human CtIP promotes DNA end resection. Nature. 450 (7169), 509-514 (2007).
- Chen, L., Nievera, C. J., Lee, A. Y. L., Wu, X. Cell cycle-dependent complex formation of BRCA1-CtIP-MRN is important for DNA double-strand break repair. Journal of Biological Chemistry. 283, 7713-7720 (2008).
- Yun, M. H., Hiom, K. CtIP-BRCA1 modulates the choice of DNA double-strand break repair pathway throughout the cell cycle. Nature. 459 (7245), 460-463 (2009).
- Sung, P., Klein, H. Mechanism of homologous recombination: mediators and helicases take on regulatory functions. Nature Review. Molecular Cell Biology. 7, 739-750 (2006).
- San Filippo, J., Sung, P., Klein, H. Mechanisms of eukaryotic homologous recombination. Annual Review of Biochemistry. 77, 229-257 (2008).
- Jasin, M., Rothstein, R. Repair of strand breaks by homologous recombination. Cold Spring Harbor Perspectives in Biology. 5 (11), 012740 (2013).
- Dynan, W. S., Yoo, S. Interaction of Ku protein and DNA-dependent protein kinase catalytic subunit with nucleic acids. Nucleic Acids Research. 26 (7), 1551-1559 (1998).
- Lieber, M. R. The mechanism of double-strand DNA break repair by the nonhomologous DNA end-joining pathway. Annual Review of Biochemistry. 79, 181-211 (2010).
- Cejka, P. DNA end resection: nucleases team up with the right partners to initiate homologous recombination. Journal of Biological Chemistry. 290 (38), 22931-22938 (2015).
- Mirman, Z., de Lange, T. 53BP1: a DSB escort. Genes & Development. 34, 7-23 (2020).
- Cao, L., et al. A selective requirement for 53BP1 in the biological response to genomic instability induces by BRCA1 deficiency. Molecular Cell. 35 (4), 534-541 (2009).
- Zimmermann, M., de Lange, T. 53BP1: Pro choice in DNA repair. Trends in Cell Biology. 24 (2), 108-117 (2014).
- Mavragani, I. V., Nikitaki, Z., Kalospyros, S. A., Georgakilas, A. G. Ionizing Radiation and Complex DNA Damage: From Prediction to Detection Challenges and Biological Significance. Cancers (Basel). 11 (11), (2019).
- Nikitaki, Z., et al. Measurement of complex DNA damage induction and repair in human cellular systems after exposure to ionizing radiations of varying linear energy transfer (LET). Free Radical Research. 50, 64-78 (2016).
- Redon, C., et al. Histone H2A variants H2AX and H2AZ. Current Opinion in Genetics & Development. 12 (2), 162-169 (2002).
- Fernandez-Capetillo, O., Lee, A., Nussenzweig, M., Nussenzweig, A. H2AX: the histone guardian of the genome. DNA Repair. 3 (8-9), 959-967 (2004).
- Paull, T. T., et al. A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage. Current Biology. 10 (15), 886-895 (2000).
- Sy, S. M. H., Huen, M. S. Y., Chen, J. PALB2 is an integral component of the BRCA complex required for homologous recombination repair. Proceedings of the National Academy of Sciences. 106 (17), 7155-7160 (2009).
- Buisson, R., Masson, J. Y. PALB2 self-interaction controls homologous recombination. Nucleic Acids Research. 40 (20), 10312-10323 (2012).
- Belotserkovskaya, R., et al. PALB2 chromatin recruitment restores homologous recombination in BRCA1-deficient cells depleted of 53BP1. Nature Communications. 11 (1), 819 (2020).
- Betts, J. A., et al. Long noncoding RNAs CUPID1 and CUPID2 mediate breast cancer risk at 11q13 by modulating the response to DNA damage. American Journal of Human Genetics. 101 (2), 255-266 (2017).
- Dray, E., et al. Molecular basis for enhancement of the meiotic DMC1 recombinase by RAD51 associated protein 1 (RAD51AP1). Proceedings of the National Academy of Sciences. 108 (9), 3560-3565 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved