A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكشف عن الحمض النووي خالية من الخلايا في عينات بلازما الدم من مرضى السرطان
In This Article
Summary
في هذه الورقة نقدم بروتوكول مفصل لتقنية خزعة السائل غير الغازية، بما في ذلك جمع الدم، البلازما وفصل معطف بافي، استخراج CFDNA والحمض النووي الجرثومي، وتحديد كم CFDNA أو الحمض النووي الجرومي، وتحليل إثراء جزء CFDNA.
Abstract
تحديد الطفرات في أورام مرضى السرطان هو خطوة هامة جدا في إدارة الأمراض. هذه الطفرات بمثابة المؤشرات الحيوية لتشخيص الورم وكذلك لاختيار العلاج واستجابته في مرضى السرطان. الطريقة القياسية الذهبية الحالية للكشف عن الطفرات الورم ينطوي على اختبار وراثي للحمض النووي الورم عن طريق خزعات الورم. ومع ذلك، من الصعب إجراء هذه الطريقة الغازية بشكل متكرر كاختبار متابعة لذخيرة الورم الطفرة. خزعة السائل هو أسلوب جديد وناشئ للكشف عن الطفرات الورمية باعتبارها سهلة الاستخدام وغير الغازية نهج الخزعة.
الخلايا السرطانية تتكاثر بسرعة. بالتوازي، العديد من الخلايا السرطانية تخضع لتخثر الدم. يتم إطلاق الحطام من هذه الخلايا في نظام الدورة الدموية للمريض ، جنبا إلى جنب مع قطع الحمض النووي المجزأة بشكل دقيق ، تسمى شظايا الحمض النووي الخالية من الخلايا (CFDNA) ، والتي تحمل طفرات الحمض النووي الورم. لذلك ، لتحديد المؤشرات الحيوية القائمة على عقود زعنف نا باستخدام تقنية خزعة سائلة ، يتم جمع عينات الدم من مرضى السرطان ، يليها فصل البلازما والمعطف البافي. بعد ذلك ، تتم معالجة البلازما لعزل cfDNA ، ويتم معالجة المعطف الماطفي الخاص به لعزل الحمض النووي الجينومي للمريض. ثم يتم فحص كل من عينات الحمض النووي لكمية ونوعية؛ وتحليلها للطفرات باستخدام الجيل التالي من تقنيات التسلسل (NGS).
في هذه المخطوطة، نقدم بروتوكول مفصل للخزعة السائلة، بما في ذلك جمع الدم، والبلازما، وفصل المعطف البافي، واستخراج الحمض النووي لثنائي cfDNA والجراثيم، وتحديد كمية الحمض النووي للحمض النووي باستخدام الـCFDNA أو الحمض النووي الجرثومي، وتحليل الإثراء لشظايا cfDNA.
Introduction
وقد أدت التطورات التكنولوجية إلى تسلسل مئات من الجينوم السرطان و النسخ1. وقد ساهم هذا في فهم المناظر الطبيعية للتغيرات الجزيئية عبر أنواع السرطان المختلفة2. وقد ساعدت دراسات أخرى على هذه المناظر الطبيعية تميز التعديلات الجسدية المتتابعة والانصهار الجيني3 التي تشارك في السرطان أو تطور الورم ، عن طريق تعطيل مسارات الخلايا المبرمجة تسلسليا4. ولذلك، يمكن أن الطفرات الجسدية وندمج الجينات الجينات تقديم معلومات حول الأورام من خلال العمل كعلامات حيوية في المرضى الفردية لنوع معين من الورم5، وتحديد الأورام الأولية القائمة التكهن6، تصنيف الأورام الثانوية على أساس التغيرات الجزيئية7، وتحديد أهداف الورم القابلة للأدوية8. قد تسهل هذه المعلومات في اختيار العلاج المخصص لمرضى السرطان وفي تحديد ردود إيجابية وسلبية العلاج9. ومع ذلك، الحصول على مواد الورم لتحديد التنميط الجينومي للأنسجة الورم هو إجراء الغازية10. وعلاوة على ذلك, خزعة الورم لا تشمل سوى جزء صغير من ورم غير متجانسة; ويجوز لذلك، لا يكون ممثلا للملامح الجزيئية للورم كله11. يتطلب الرصد المتسلسل والورم genotyping مجموعة متكررة من أنسجة الورم ، والتي ، عادة ، غير مجدية بسبب غزو إجراء خزعة الورم وقضايا السلامة التي تنشأ عن مثل هذه الإجراءات12.
تقنية خزعة السائل، من ناحية أخرى، وقد اكتسبت اهتماما هائلا في علم الأورام الدقة على مدى العقد الماضي13،14. ويرجع ذلك أساسا إلى عدم الغازية من هذه التقنية، وإمكانية تكرار ذلك في نقاط زمنية متعددة، مما يتيح تقنية سهلة الاستخدام وآمنة لرصد دورات المرض15،16. تعتمد الخزعة السائلة على ظاهرة تتكاثر فيها الخلايا السرطانية بسرعة ، وفي نفس الوقت يخضع العديد منها للتخثر والناخر. وهذا يؤدي إلى إطلاق حطام الخلايا المبرمج في دم المرضى ، جنبا إلى جنب مع شظايا الحمض النووي التي يتم قطعها بأحجام دقيقة خلال المبرمج17. إن موت الخلايا غير السرطانية يؤدي أيضاً إلى إطلاق حطامها الخلوي في الدم، ومع ذلك، فإن معدل موت الخلايا المبرمج في هذه الخلايا أقل بكثير نسبياً من الخلايا السرطانية18. عقلاني من تقنية خزعة السائل هو التقاط الجزيئات المرتبطة بالورم مثل الحمض النووي, RNA, البروتينات, والخلايا السرطانية14,19 التي تدور باستمرار في الدم. تقنيات مختلفة20 يمكن استخدامها لتحليل هذه الجزيئات بما في ذلك الجيل التالي التسلسل (NGS)، الرقمية القطيرة البوليميراز سلسلة التفاعل (DdPCR)، PCR في الوقت الحقيقي، والمناعة المرتبطة الانزيم المقايسة (ELISA). تقنية خزعة السائل تمكن تحديد المؤشرات الحيوية التي هي خصائص الخلايا السرطانية. هذه الجزيئات العلامات الحيوية ليست فقط إطلاقها من أجزاء محددة من الورم، ولكن بدلا من جميع أجزاء الورم21. وبالتالي، علامات محددة في خزعة السائل يمثل التنميط الجزيئي للورم غير متجانسة بالكامل، بالإضافة إلى الأورام الأخرى في الجسم، وبالتالي، وجود مزايا على الأنسجة على أساس تقنية22.
وcfDNA لديه فترة قصيرة نصف العمر في الدم المتداولة تتراوح بين بضع دقائق إلى 1-2 ساعة23. ومع ذلك، فإن فترة نصف العمر القصيرة لـ cfDNA تسهل إجراء التحليلات في الوقت الحقيقي من خلال تقييم استجابة العلاج وتقييمات الورم الديناميكية. تشير مستويات cfDNA المشتقة من الورم إلى التكهن بمرحلة الورم / حجمها الذي أظهرته العديد من الدراسات ، والتي أظهرت وجود علاقة بين مستويات CFDNA ونتائج البقاء على قيد الحياة24. وعلاوة على ذلك، أثبتت الدراسات أن CFDNA لديه قدرة تنبؤ أفضل من علامات الورم الموجودة25. التكهن من cfDNA هو أكثر وضوحا بعد علاج السرطان, مستويات أعلى من cfDNA بعد العلاج يرتبط بشكل جيد مع انخفاض معدل البقاء على قيد الحياة, ومقاومة للعلاج. في حين, انخفاض مستويات cfDNA بعد العلاج يتوافق عموما مع استجابة إيجابية للعلاج. وبالإضافة إلى ذلك، ييسر نظام cfDNA الكشف المبكر عن الاستجابة للعلاج من طرق الكشف التقليدية.
وcfDNA يزيد من إمكانية الكشف المبكر عن الطفرات المرتبطة بالسرطان: خلال مرحلة مبكرة من المرض15, بداية الأعراض26 وقبل تشخيص السرطان تصل إلى 2 سنة27. كما يتم الافراج عن cfDNA من مناطق أو بؤر متعددة الورم، وتحليلها يوفر نظرة شاملة للجينوم الورم أنه يمثل28. ولذلك، فإن cfDNA تمكن من الكشف عن الطفرات الجسدية التي قد غاب في عينات الأنسجة29. كما يمكن الكشف عن التغايرية داخل الورم والطفرات تحت النسيلة عن طريق التسلسل العميق للمناطق الجينومية التي تمتد على آلاف القواعد، وبالتالي فإن تحليل cfDNA تمكن من الكشف عن أنواع فرعية جزيئية محددة مع تواقيع الجينومية المتميزة13. للحصول على مستوى مماثل من المعلومات من خلال عينة الأنسجة كان هناك حاجة إلى العديد من الخزعات الصلبة.
وعلاوة على ذلك، فإن مستويات cfDNA في المرضى الذين يعانون من مرض محلي مثل القولون, المبيض, وسرطان الرئة بعد العلاج الجراحي و / أو العلاج الكيميائي, أظهرت أن علامة قوية التكهن لتكرار السرطان ونتائج العلاج20. وعلاوة على ذلك، في المرضى الذين يعانون من سرطان القولون والثدي والرئة، يمكن لتحليلات cfDNA من الدم الكشف بنجاح عن التغيرات الورم محددة، مما أدى إلى التنبؤ الدقيق لتكرار عدة أشهر مقدما13. وعلاوة على ذلك, علامات المقاومة العلاج, مثل الطفرات KRAS في المرضى الذين يعانون من CRC تلقي العلاج المضاد EGFR30; VAFs للجينات مثل PIK3CA, MED1 أو EGFR في المرضى الذين يعانون من سرطان الثدي بعد العلاج مع العلاجات المختلفة31; وEGFR T790M المقاومة الطفرة في سرطان الرئة المرضى الذين عولجوا مع المعارف التقليدية التي تستهدف EGFRيمكن أيضا تحديدها من خلال تحليل cfDNA.
باختصار، تحليل cfDNA يمكن أن تستخدم لتحديد المؤشرات الحيوية الدقيقة في مجال الأورام13،33. في هذا البروتوكول، تمت معالجة عينات دم من 3 مرضى الورم الدبقي و 3 ضوابط صحية للحصول على الحمض النووي الجينومي من WBCs وCFDNA من البلازما. في سرطان الورم الدبقي، والطفرات في IDH، TERT، ATRX، EGFR، وTP53 بمثابة علامات التشخيص وكذلك التكهن التي قد تساعد في التشخيص المبكر للأورام الدبقية، وتصنيف أنواع مختلفة من الأورام الدبقية، وتوجيه العلاج الدقيق للمريض الفرد وفهم استجابة العلاج34،35. يمكن تحديد الحالة الطفرة لهذه الجينات باستخدام CFDNA المستمدة من الدم. في هذه المخطوطة، نقدم بروتوكول مفصل من cfDNA المشتقة من البلازما التي تم استخدامها لدراسة التغيرات الطفرة في سرطان الورم الدبقي12. مثل هذا بروتوكول خزعة السائل المستندة إلى cfDNA الموضح في هذه المقالة يمكن استخدامه لدراسة التغيرات الطفرة في العديد من أنواع السرطان الأخرى. وعلاوة على ذلك، أظهرت دراسة حديثة أن خزعة السائل المستندة إلى CFDNA يمكن الكشف عن 50 نوعا مختلفا منالسرطانات 36.
جمع عينات الدم وتخزينها وشحنها هي خطوات حاسمة في هذا البروتوكول، حيث أن درجة الحرارة غير المنضبطة خلال هذه الخطوات تتسبب في تحلل مراكز حماية الملوثات البرية ، مما يؤدي إلى إطلاق الحمض النووي الجينومي من WBC في البلازما والتسبب في تلوث عينة cfDNA ، مما يؤثر على بقية الإجراء37. يمكن أن ينكمز الانحلال بسبب درجة الحرارة غير المنضبطة عمليات إعداد عينة المصب من cfDNA، مثل خطوات PCR38. يحتوي المصل على نسبة عالية من cfDNA الخط الجرثومي بدلاً من البلازما ، على الرغم من أنه يقدم ضوضاء خلفية كبيرة لـ cfDNA المرتبطة بالورم39. ولذلك، لعزل cfDNA المرتبطة بالورم، البلازما هي عينة مناسبة39. وينبغي طرد الدم المسحوب في مضاد للتخثر يحتوي على أنبوب جمع الدم على الفور أو في غضون ما يصل إلى ساعتين، لفصل البلازما وتجنب التلوث بcfDNA. في هذا البروتوكول، يتم استخدام أنابيب جمع الدم CFDNA التجارية المخصصة (انظر جدول المواد)، والتي هي بديل لتخثر الدم التي تحتوي على أنابيب جمع الدم. هذه الأنابيب المخصصة لجمع الدم تحافظ على CFDNA و CFRNA ، وتمنع تحلل WBCs لمدة تصل إلى 30 يومًا في درجة الحرارة المحيطة ، وما يصل إلى 8 أيام عند 37 درجة مئوية. وهذا يسهل الحفاظ على درجة الحرارة المناسبة أثناء شحنة عينة الدم وحتى يتم فصل البلازما وWBC40.
هناك ثلاثة أنواع من منهجيات استخراج cfDNA المتاحة حاليا: عزل المرحلة، السيليكون غشاء محور العمود، والعزلة المغناطيسية القائمة على الخرز41. وأسفرت طريقة عمود الدوران القائم على غشاء السيليكون عن كمية عالية من cfDNA مع سلامة عالية مقارنة مع أساليب استخراج cfDNA الأخرى42.
التقييم الكمي للحمض النووي هو شرط أساسي في خزعة السائل، وهناك حاجة لتطوير بسيطة، بأسعار معقولة، وإجراء موحدة لتنفيذها سهلة والاستخدام على نطاق واسع. ثلاث طرق شائعة الاستخدام لقياس كمي cfDNA هي القياس الطيفي، الفلوريمترية، و qPCR. وثبت أن الأسلوب الفلوريمتري أفضل من الطرق الأخرى المتعلقة بدقة وتكلفة وسهولة إجراء43.
يمكن تقدير سلامة ونقاء cfDNA إما بواسطة الأجاجوز الكهربائي أو الكهربائي الشعري. Agarose electrophoresis لا يظهر حساسية في تركيز منخفض من cfDNA ولا دقة عالية لإظهار حجم جزء دقيق من cfDNA. من ناحية أخرى، الكهربائي الشعري لديه ميزة على الكهربائي agarose من خلال التغلب على التحديات المرتبطة بها، وبالتالي، تستخدم على نطاق واسع من قبل الباحثين لتحليل حجم الجزء cfDNA. في هذا البروتوكول، تم تقدير توزيع حجم جزء من cfDNA معزولة باستخدام أداة كهربائية شعرية آلية (انظر جدول المواد).
Protocol
قبل جمع الدم، يجب الحصول على موافقة مستنيرة من الأشخاص المشاركين في البحث ويجب الحصول عليها. تم إجراء البحث الموصوف في هذه المخطوطة وفقاً والامتثال لمركز رابين الطبي، ولجنة أخلاقيات إسرائيل (رمز الأخلاقيات: 0039-17-RMC) وكلية الطب دير كريستيان-ألبريخت-Universität zu كييل، لجنة أخلاقيات ألمانيا (رمز الأخلاق: D 405/14).
1- جمع عينات الدم وتخزينها في أنابيب المواد الحافظة لcfDNA أو CFRNA
- تسمية بشكل صحيح أنابيب الحفظ
- جمع ~ 8 مل من الدم في أنبوب الحفاظ على CF-DNA (انظر جدول المواد)،وذلك باستخدام مجموعة جمع الدم وحامل، وفقا للبروتوكول المؤسسي القياسية ل venipuncture كما هو موضح أدناه.
ملاحظة: قد يؤدي استخدام مجموعة جمع الدم إلى منع التدفق الخلفي المحتمل للدم من الأنبوب.- محاذاة المريض مع الذراع في وضع الهبوط.
- عقد أنبوب تستقيم، مع غطاء تواجه التصاعدي، مع التأكد من أن محتويات أنبوب لا تلمس الغطاء أو طرف إبرة.
- كما يبدأ الدم تتدفق في الأنبوب، وإطلاق سراح tourniquet ببطء.
- مباشرة بعد أن يتم تعبئة أنبوب مع الدم (قدرة قصوى: 8.4 مل من الدم كله)، عكس بلطف أنبوب (بدوره معصم الذراع التي هي عقد الأنبوب بنسبة 180 درجة إلى أسفل والعودة) 5 مرات لتثبيت العينة.
ملاحظة: يضمن الانعكاس خلط المادة الحافظة بشكل موحد مع العينة. ومع ذلك، لا يهز محتويات مرة أخرى، حتى قبل إعداد البلازما. يؤدي عدم كفاية خلط المواد الحافظة مع عينة الدم إلى زعزعة استقرار المحتويات وتشكيل الجلطات الدقيقة أو الانحلال الدموي. في هذه المرحلة، يمكن الاستمرار في البروتوكول فورا لفصل البلازما أو أنابيب مملوءة بالدم يمكن الانتظار لمدة تصل إلى 30 يوما في درجة الحرارة المحيطة (15-25 درجة مئوية)، و 8 أيام في 37 درجة مئوية.
2. البلازما وبافي معطف الفصل والتخزين
- الطرد المركزي أنبوب الحفظ مملوءة بالدم في 425 × ز لمدة 20 دقيقة في درجة حرارة الغرفة لفصل البلازما.
ملاحظة: يجب تنفيذ الخطوتين 2.2 و 2.3 في خزانة السلامة الحيوية. - الماص بعناية من طبقة البلازما العليا إلى أنبوب جديد في 1 مل aliquots، دون إزعاج الطبقات السفلى.
- نقل بعناية الطبقة التالية من معطف بافي إلى أنبوب جديد (تظهر الطبقة كخاتم فوق الكريات RBC)، مع تجنب RBCs في الطبقة السفلى.
- المضي قدما إلى الخطوة 3 مع البلازما والخطوة 4 مع معطف بافي. إذا لزم الأمر تخزين محتويات فصل في -80 درجة مئوية.
3. تنقية تداول cfDNA من 1 مل من البلازما
ملاحظة: يتم تنفيذ هذه الخطوة مع مجموعة تجارية (راجع جدول المواد). يتم توفير كافة المخازن المؤقتة مع مجموعة.
- إعداد المخازن المؤقتة والكواشف
تنبيه: لا تضيف حلول حمضية أو تبيض مباشرة إلى نفايات إعداد العينة. أملاح الغوانيدين الموجودة في عازلة Lysis، ملزم العازلة، وغسل العازلة-1 عند دمجها مع التبييض أو الأحماض يمكن أن تنتج مركبات تفاعلية للغاية.- العازلة ملزمة: مزيج 300 مل من تركيز العازلة ملزمة مع 200 مل من isopropanol 100٪ لجعل 500 مل من العمل العازلة ملزم. يُخزن في درجة حرارة الغرفة.
ملاحظة: يسمح العازلة الربط الأمثل الربط من الأحماض النووية المتداولة إلى غشاء السيليكا. 500 مل من العازلة ملزمة كافية لمعالجة 276، 138، 92، 69 أو 55 عينات من 1، 2، 3، 4 أو 5 مل من البلازما على التوالي ومستقرة لمدة 1 سنة في درجة حرارة الغرفة. - غسل العازلة-1: مزيج 19 مل من غسل العازلة-1 التركيز مع 25 مل من 96-100٪ الإيثانول لجعل 44 مل من العمل غسل العازلة-1. يُخزن في درجة حرارة الغرفة.
ملاحظة: غسل العازلة-1 يزيل الملوثات المرتبطة غشاء السيليكا. 44 مل من العمل غسل العازلة-1 كافية لمعالجة 73 عينات من 1/2/3/4/5 مل من البلازما ومستقرة لمدة 1 سنة في درجة حرارة الغرفة. - غسل العازلة-2: مزيج جيدا 13 مل غسل العازلة-2 التركيز مع 30 مل من 96-100٪ الإيثانول لجعل 43 مل من العمل غسل العازلة-2. يُخزن في درجة حرارة الغرفة.
ملاحظة: غسل العازلة-2 يزيل الملوثات المرتبطة غشاء السيليكا. 43 مل من العمل غسل العازلة-2 كافية لمعالجة ~ 56 عينات من 1/2/3/4/5 مل من البلازما ومستقرة لمدة 1 سنة في درجة حرارة الغرفة. - إلى أنبوب يحتوي على 310 ميكروغرام الناقل النيضبي RNA، إضافة 1550 ميكرولتر من العازلة Elution، لإعداد حل RNA الناقل من 0.2 ميكروغرام /ميكرولتر. بعد حل شامل الناقل RNA، تقسيم الحل إلى aliquots مناسبة، وتخزينها في -30 درجة مئوية إلى -15 درجة مئوية. لا تجميد ذوبان هذه aliquots أكثر من 3 مرات. إلى العازلة Lysis، كما هو مبين في الجدول S1، إضافة الناقل المعاد تشكيله RNA المذابة في العازلة Elution.
ملاحظة: لأن الناقل RNA لا يذوب مباشرة في مخزن Lysis المؤقت، فإنه يحتاج إلى أن يتم حل أولاً في مخزن مؤقت Elution ثم في Lysis Buffer. أولا، يتم تعزيز الأحماض السيليكا الغشاء النووي ملزمة عندما يكون هناك عدد قليل جدا من الجزيئات المستهدفة الموجودة في العينة. وثانيا، يقل خطر تدهور الحمض النووي الريبي بسبب وجود كميات كبيرة من الحمض النووي الريبي الحامل.
- العازلة ملزمة: مزيج 300 مل من تركيز العازلة ملزمة مع 200 مل من isopropanol 100٪ لجعل 500 مل من العمل العازلة ملزم. يُخزن في درجة حرارة الغرفة.
- قبل البدء في العزلة، وجلب الأعمدة والعينات إلى درجة حرارة الغرفة وضبط حجم العينة إلى 1 مل مع المالحة المعقمة الفوسفات المخزنة (PBS)، إذا لزم الأمر. قبل 2 الحرارة حمامات المياه أو كتل التدفئة التي تحتوي على 50 أنابيب أجهزة الطرد المركزي مل و 2 مل أنابيب جمع إلى 60 درجة مئوية و 56 درجة مئوية، على التوالي.
- إلى أنبوب الطرد المركزي 50 مل، إضافة 100 ميكرولتر من البروتينات K، 1 مل البلازما، و0.8 مل من العازلة تحلل التي تحتوي على 1.0 ميكروغرام من الحمض النووي الريبي الناقل (أعدت في الخطوة 3.1.4). أغلق أنبوب الطرد المركزي بغطاء وخلط المحتويات عن طريق نبض الدوامة لمدة 30 s، مع ضمان دوامة مرئية في الأنبوب. خلط شامل للمحتويات مهم لتحلل كفاءة.
ملاحظة: مباشرة بعد vortexing انتقل إلى الخطوة 3.4 دون تأخير. - احتضان الحل عند 60 درجة مئوية لمدة 30 دقيقة.
- قم بإزالة الغطاء، وأضف 1.8 مل من المخزن المؤقت للربط إلى الأنبوب، واخلط جيداً مع نبضات النبض لمدة 15-30 s بعد وضع الغطاء.
- احتضان الخليط الناتج لمدة 5 دقائق على الجليد وإدراج عمود غشاء السيليكا في جهاز فراغ التي ترتبط مضخة فراغ. ثم، إدراج بقوة تمديد أنبوب 20 مل في العمود المفتوح لمنع تسرب العينة.
- صب بعناية خليط المحتضنة في موسع أنبوب العمود والتبديل على مضخة فراغ. بعد كل خليط lysate يعمل تماما من خلال الأعمدة، إيقاف مضخة فراغ، والافراج عن الضغط إلى 0 mbar، وإزالة وتجاهل موسع أنبوب.
ملاحظة: تجنب التلوث المتبادل، يجب أن يتم تجاهل موسع الأنبوب بعناية، لمنع انتشاره عبر الأعمدة المجاورة. - إزالة العمود من جهاز فراغ، إدراج في أنبوب جمع، والطرد المركزي في 11،000 س ز لمدة 30 s في درجة حرارة الغرفة، لإزالة أي lysate المتبقية. تجاهل التدفق من خلال.
- إضافة 600 μL من غسل العازلة -1 في العمود، والطرد المركزي في 11،000 س ز لمدة 1 دقيقة في درجة حرارة الغرفة، والتخلص من تدفق من خلال.
- أضف 750 ميكرولتر من الغسيل العازل-2 إلى العمود، والطرد المركزي عند 11000 × ز لمدة دقيقة في درجة حرارة الغرفة، وتجاهل التدفق من خلال.
- أضف 750 ميكرولتر من الإيثانول (96-100٪) إلى العمود، الطرد المركزي في 11،000 س ز لمدة 1 دقيقة في درجة حرارة الغرفة والتخلص من تدفق من خلال.
- الطرد المركزي العمود في 20،000 س ز لمدة 3 دقائق، عن طريق وضعه في أنبوب جمع 2 مل نظيفة.
- جفف تجميع عمود الغشاء تمامًا عن طريق وضعه في أنبوب جمع جديد 2 مل مع غطاء مفتوح واحتضان في 56 درجة مئوية لمدة 10 دقائق.
- ضع العمود في أنبوب 1.5 مل اِل اِل 1. إلى مركز غشاء العمود، وتطبيق 20-150 ميكرولتر من عازل Elution واحتضان في درجة حرارة الغرفة لمدة 3 دقائق مع غطاء مغلقة.
ملاحظة: تأكد من أن المخزن المؤقت Elution هو توازن درجة حرارة الغرفة. في حالة استخدام عازلة elution أقل من 50 ميكرولتر، تأكد من أن يتم الاستغناء عنها بعناية على مركز الغشاء. وهذا يساعد مع elution كاملة من الحمض النووي ملزمة. ومع ذلك، وحدة تخزين elution غير ثابتة ويمكن تغيير حسب التطبيقات المتلقين للمعلومات. يمكن أن يكون eluate المستردة تصل إلى 5 ميكرولتر وبالتأكيد أقل من حجم elution المطبقة على العمود. - الطرد المركزي eluate المستردة في microcentrifuge في 20،000 س ز لمدة 1 دقيقة ل elute الأحماض النووية، وتخزينها في -20 درجة مئوية.
4. تنقية الحمض النووي الجينومي من معطف بافي
ملاحظة: ترد مجموعة الأدوات التجارية المستخدمة في هذا البروتوكول في جدول المواد. المخازن المؤقتة والكواشف المذكورة في البروتوكول أدناه أي، Lysis العازلة A، Lysis العازلة B، غسل العازلة X، غسل العازلة Y، المخزن المؤقت Proteinase، العازلة Elution، وK البروتينات هي جزء من هذه المجموعة التجارية.
- إعداد المخازن المؤقتة والكواشف
تنبيه: لا تضيف حلول حمضية أو تبيض مباشرة إلى نفايات إعداد العينة. أملاح غوانيدين الموجودة في Lysis العازلة B وغسل العازلة X عندما جنبا إلى جنب مع التبييض أو الأحماض، يمكن أن تنتج مركبات تفاعلية للغاية.- غسل العازلة Y: مزيج جيدا 12 مل من غسل العازلة Y التركيز مع الإيثانول 48 مل (96-100٪) للحصول على 60 مل من العمل غسل العازلة Y. تخزين في درجة حرارة الغرفة.
ملاحظة: 60 مل من العمل غسل العازلة Y كافية لمعالجة 100 عينات معطف بافي ومستقرة لمدة 1 سنة. - البروتينات K: إعداد محلول البروتينات K عن طريق حل 30 ملغ البروتينات الlyophilized K في 1.35 مل من البروتينات العازلة.
ملاحظة: مجموع حل العمل من البروتينات K كافية لمعالجة 52 عينات معطف بافي. يمكن تخزين محلول عمل Proteinase K لمدة 6 أشهر على الأقل عند -20 درجة مئوية.
- غسل العازلة Y: مزيج جيدا 12 مل من غسل العازلة Y التركيز مع الإيثانول 48 مل (96-100٪) للحصول على 60 مل من العمل غسل العازلة Y. تخزين في درجة حرارة الغرفة.
- الخطوات قبل بدء الإجراء
- إكويلاب المعطف المُبَافى لدرجة حرارة الغرفة
- تعيين كتلة الحرارة أو حمام الماء في 56 درجة مئوية.
- تعليق معطف بافي في عازلة Lysis A للحصول على حجم النهائي من 200 ميكرولتر. ثم إضافة 25 ميكرولتر من محلول البروتينات K، و 200 ميكرولتر من Lysis buffer B. مزيج من خلال دوامة واحتضان في 70 درجة مئوية لمدة 10-15 دقيقة. تأكد من أن يتم تغطية العينات بالكامل مع حل تحلل.
ملاحظة: بالنسبة لسلسلة معالجة العينات، قد يكون Buffer Lysis Lysis و Proteinase K مُزَمَجَدًا قبل 10-15 دقيقة من الإجراء، ولكن لم يعد قبل ذلك، حيث أن Proteinase K ذاتيًا في مخزن التحلل A بدون الركيزة. - إضافة 210 μL من 96-100٪ الإيثانول إلى الخليط أعلاه ودوامة بقوة.
ملاحظة: قد تشكل إضافة الإيثانول عجلاً وتري؛ ومع ذلك، وهذا لن يؤثر على عزل الحمض النووي. تأكد من تحميل الترسب أيضا على العمود، كما هو مبين في الخطوات التالية. - قم بتحميل العينة بأكملها على عمود السيليكا الموضوع في أنبوب جمع. جهاز طرد مركزي لمدة 1 دقيقة في 11000 x ز. ضع العمود في أنبوب جمع جديد وتجاهل الأنبوب السابق مع التدفق من خلال.
ملاحظة: كرر خطوة الطرد المركزي إذا لم يتم رسم العينة تماماً خلال المصفوفة. - أضف 500 ميكرولتر من مخزن الغسيل X، وطاردة مركزية لمدة دقيقة عند 11000 × ز، وتجاهل التدفق.
- ضع العمود في أنبوب التجميع، وأضف 600 ميكرولتر من الغسيل المؤقت Y على العمود، وطاردة مركزية لمدة 1 دقيقة عند 11000 × ز، وتجاهل التدفق.
- مرة أخرى، ضع العمود في أنبوب جمع، والطرد المركزي العمود لمدة 1 دقيقة في 20،000 س ز لتجفيف غشاء السيليكا.
- احتضان العمود في درجة حرارة الغرفة لمدة 1 دقيقة، وضعت في أنبوب microcentuge 1.5 مل، ثم إضافة 100 ميكرولتر من عازلة Elution. ثم، elute الحمض النووي عن طريق الطرد المركزي لمدة 1 دقيقة في 11،000 ز وتخزينها في -20 درجة مئوية.
5- القياس الكمي للحمض النووي للفلورو والدنا الجينومي
- قبل بدء تشغيل البروتوكول، نفذ الخطوات التالية.
- تخفيف 2 ميكرولتر من الحمض النووي الجينومي المائل (من الخطوة 4.9) في 1:10 النسب مع المياه فائقة الخطورة خالية من النوى. ونظراً للتركيزات المنخفضة المتوقعة، لا تمييع عينات من الـCFDNA من الخطوة 3-15.
- اكويبيل معيار #1 معيار الفحص #2 معيار الفحص لدرجة حرارة الغرفة.
- إعداد ما مجموعه 6 أنابيب واضحة رقيقة الجدران من حجم 0.5 مل.
ملاحظة: البروتوكول المقدم هو من أجل القياس الكمي لـ 2 cfDNA وعينات الحمض النووي الجينومية 2 ، وبالتالي ، 4 أنابيب لـ 4 عينات ويتطلب هذا الفحص 2 المعايير. - تسمية أغطية الأنبوب.
ملاحظة: يمكن أن تتداخل عملية وضع العلامات على جانب الأنبوب مع القراءة. بالإضافة إلى ذلك، يتم تسمية أنابيب معيار الفحص بعناية، حيث تتطلب معايرة مقياس الفلور أن تكون المعايير في الترتيب الصحيح. - تمييع الكاشف في 1:200 مع المخزن المؤقت Assay لإعداد حل العمل. ل 4 عينات و 2 المعايير، واستخدام 6 ميكرولتر من الكاشف مقول بالإضافة إلى 1،194 μL من العازلة المقايسة لجعل 1200 ميكرولتر (200 ميكرولتر في كل أنبوب) من حل العمل.
ملاحظة: لا تستخدم حاوية زجاجية، بدلاً من ذلك استخدام أنبوب بلاستيكي نظيف. يجب أن يحتوي كل أنبوب على ما يقرب من 200 ميكرولتر من الحجم النهائي (يجب أن يحتوي أنبوب معيار الفحص على 190 ميكرولتر من محلول العمل ، ويجب أن يحتوي أنبوب العينة على 180-199 ميكرولتر من محلول العمل). يجب إعداد حل عمل كاف لاستيعاب جميع معايير الفحص والعينات. - في أنابيب معيار القياسات العاملة، أضف 190 ميكرولتر من محلول العمل و10 ميكرولتر معيار اختبار وخلط الحل من خلال دوامة لمدة 2-3 s. تجنب تشكيل فقاعات داخل الحل.
- في عينات الأنابيب، إضافة 198 μL حل العمل و 2 ميكرولتر من cfDNA أو الحمض النووي الجينومي. اخلطي الحل عن طريق الدوامة لمدة 2-3 s، واحفظيها في درجة حرارة الغرفة لمدة 2 دقيقة.
- فيالشاشةالرئيسية للأداة الفلورية، اضغط على 'DNA' وحدد 'dsDNA عالية الحساسية AssDNA Assay'، لعرض شاشة 'معايير'، ثم اضغط على 'نعم' على جهاز قياس الفلور 'معايير' الشاشة لقراءة المعايير.
- في غرفة العينة، أدخل أنبوب #1 القياسي، أغلق الغطاء، واضغط على 'اقرأ. إزالة أنبوب بمجرد الانتهاء من القراءة (حوالي 3 s) وتكرار نفس الخطوة #2 القياسية.
- يتم عرض عينة الشاشة بعد الانتهاء من عملية المعايرة، ثم إدراج أنبوب عينة وتكرار الخطوة '5.8'. ثم تعرض "عينة الشاشة" قيمة تتوافق مع تركيز العينة بعد التخفيف في أنبوب العينة.
- لكل عينة تكرار الخطوة '5.9'، حتى يتم قراءة كافة العينات.
- استخدم المعادلة التالية لحساب التركيز الفعلي للعينة.
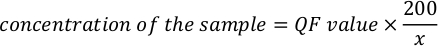
ملاحظة: قيم الفحص هي في نانوغرام / مل ويتوافق مع التركيز بعد التخفيف في أنبوب الفحص. المعادلة المذكورة أعلاه في الخطوة 5.11، قيمة مؤسسة قطر هي القيمة التي تعطى من قبل أداة الفلورمتر، وx هو عدد ميكرولتردات العينة المضافة إلى أنبوب المقايسة. وتتشابه وحدات قيم مؤسسة قطر التي يتم إنشاؤها بواسطة المعادلة مع القيمة التي يوفرها مقياس الفلور. فعلى سبيل المثال، إذا كانت قيمة مقياس الفلور في نانوغرام/مل، تكون وحدات التركيز المحسوبة بالمعادلة هي نانوغرام/مل.
6. توزيع حجم جزء الحمض النووي من cfDNA بواسطة محلل جزء
- الخطوة قبل بدء الإجراء: اكويريبرات تركيز صبغة الحمض النووي ومصفوفة هلام الحمض النووي لدرجة حرارة الغرفة لمدة 30 دقيقة.
- إعداد مزيج هلام صبغ
تنبيه: التعامل مع الحلول بحذر كما هو معروف DMSO لتسهيل دخول الجزيئات العضوية في الأنسجة.- ذوبان بدقة DMSO عن طريق دوامة صبغة الحمض النووي قارورة مركزة لمدة 10 s. Pipette من أصل 15 ميكرولتر من هذا التركيز في قارورة مصفوفة هلام الحمض النووي وتخزينها عند 4 درجة مئوية في الظلام.
- مرة أخرى، دوامة القارورة توج لمدة 10 s حتى يتم تصور خلط الجل والصبغة.
- صب المزيج على مرشح تدور إلى وعاء أعلى.
- ميكروcentة تصفية الدوران في 2240 × ز ± 20٪ لمدة 10 دقيقة في درجة حرارة الغرفة.
- تسمية صبغة هلام المعدة في الأنبوب والتخلص من المرشح، وفقا للممارسات المختبرية الجيدة. تسمية الأنبوب وتسجيل تاريخ التحضير.
ملاحظة: تخلص من الترشيحات حسب الممارسات المختبرية الجيدة. ويمكن استخدام مزيج هلام صبغ ل5 عالية الحساسية (HS) رقائق الحمض النووي. إذا لم يتم استخدامها لأكثر من 1 ساعة، يُخزن عند 4 درجة مئوية. يمكن تخزينها في الظلام لمدة تصل إلى 6 أسابيع.
- لتحميل مزيج هلام صبغ، وضمان موقف لوحة قاعدة من رقاقة فتيلة محطة وضبط مقطع في أدنى موقف.
- اكويبيل مزيج هلام صبغ إلى درجة حرارة الغرفة لمدة 30 دقيقة، مع رصد التعرض للضوء.
- اتخاذ رقاقة الحمض النووي HS جديدة من كيس مختومة ووضعها على محطة فتيلة رقاقة، ثم إزالة 9.0 ميكرولتر من مزيج هلام صبغ والاستغناء عنه في الجزء السفلي من رقاقة جيدا، وضعت باسم 'G'.
ملاحظة: قم برسم مزيج صبغة الجل، وتجنب الجسيمات التي قد تتراكم في الجزء السفلي من القارورة. في حين الاستغناء عن مزيج هلام صبغ في رقاقة الحمض النووي HS جيدا، إدراج غيض من ماصة تماما، لمنع تشكيل فقاعات الهواء كبيرة. وعلاوة على ذلك، فإن لمس الماصات على حواف البئر سوف يؤدي إلى نتائج سيئة. - ضع المكبس عند 1 مل واغلق محطة الـ رقاقة فتيلة. ضمان قفل من النقرات مزلاج وتعيين جهاز ضبط الوقت إلى 60 ق، ثم اضغط على المكبس لأسفل حتى يتم عقده من قبل مقطع، وبعد 60 ث بالضبط، والإفراج عن المكبس مع آلية كليب الإفراج.
- عندما يتراجع المكبس على الأقل إلى علامة 0.3 مل، انتظر لمدة 5 ثانية، ثم سحب ببطء إلى موقف 1 مل، ثم فتح محطة فتيلة رقاقة وإزالة مرة أخرى 9.0 ميكرولتر من هلام- صبغ مزيج والاستغناء في الجزء السفلي من رقاقة الحمض النووي HS جيدا، وضعت باسم 'G'.
- لتحميل علامة الحمض النووي، الاستغناء 5 ميكرولتر من علامة الحمض النووي في البئر، مع وضع علامة سلم. كرر الإجراء لجميع الآبار عينة 11.
- لتحميل السلم والعينات، استغنّي 1 ميكرولتر من سلم الحمض النووي في البئر، مع وضع علامة على رمز السلم، ثم أضف 1 ميكرولتر من العينة (الآبار المستعملة) أو 1 ميكرولتر من العلامة (الآبار غير المستخدمة) في جميع آبار العينة الـ 11.
- دوامة رقاقة الحمض النووي HS لمدة 60 s في 2400 دورة في الدقيقة عن طريق وضع رقاقة أفقيا في المحول. تأكد من أن الانتفاخ الذي يصلح رقاقة الحمض النووي HS لا يتلف أثناء الدوامة.
- لإدراج رقاقة الحمض النووي HS في أداة محلل التجزئة، افتح الغطاء وتأكد من إدخال خرطوشة القطب بشكل صحيح، ويتم وضع محدد الشريحة إلى "الحمض النووي للحساسية" في أداة محلل التجزئة.
- قم بتركيب رقاقة الحمض النووي HS بعناية في الوعاء ، والذي يناسب طريقة واحدة فقط ، ثم تفقد الغطاء من خلال ضمان أن خرطوشة القطب تناسبها تمامًا في آبار رقاقة الحمض النووي HS.
- تشير شاشة برنامج محلل الأجزاء إلى شريحة الحمض النووي HS المدرجة والغطاء المغلق، من خلال أيقونة الشريحة في أعلى يسار الشاشة.
- لبدء تشغيل شريحة الحمض النووي HS، حدد DsDNA عالية الحساسية AssDna من القائمة 'Assay' على شاشة الصك، ثم ملء الجدول بشكل صحيح من أسماء العينات عن طريق تغذية المعلومات مثل أسماء العينات والتعليقات وبدء تشغيل رقاقة عن طريق النقر على زر'ابدأ' في الجزء العلوي الأيمن من الشاشة.
- تنظيف القطب بعد تشغيل رقاقة الحمض النووي HS: على الفور إزالة رقاقة الحمض النووي HS المستخدمة، بمجرد الانتهاء من الفحص والتخلص منه وفقا للممارسات المختبرية الجيدة. تنفيذ الإجراء التالي لضمان الأقطاب نظيفة، دون بقايا بقايا من المقايسة السابقة.
- املأ ببطء 350 ميكرولتر من المياه ذات الصف التحليلي في واحدة من آبار أنظف القطب ووضع منظف القطب في أداة محلل التجزئة عن طريق فتح الغطاء ثم إغلاق الغطاء وانتظر حوالي 10 s.
- قم بإزالة منظف القطب الكهربائي عن طريق فتح الغطاء وانتظر 10 ق أخرى، حتى يتبخر الماء على الأقطاب الكهربائية قبل إغلاق الغطاء.
النتائج
فصل البلازما
8.5-9 مل الدم التي تم جمعها في cfDNA أو CFRNA أنابيب المواد الحافظة تسفر عن حوالي ~ 4 مل البلازما في الحجم. قد يختلف حجم البلازما المنفصلة عن الدم الذي يتم جمعه في أنابيب EDTA وفقًا لدرجة الحرارة. التعرض لأنابيب EDTA التي تحتوي على الدم في درجة حرارة أعلى من 37 درجة مئوية يؤدي إلى ا...
Discussion
جمع دم المريض في أنبوب, شحنة وتخزين الخطوات الأولية الحاسمة في خزعة السائل. يمكن أن تعيق المعالجة غير السليمة جودة البلازما ، وبالتالي ، يمكن أن تتداخل مع نتائج خزعة السائل47. إذا تم جمع عينة دم في أنبوب الدم EDTA، يجب فصل البلازما في غضون ساعتين من جمع الدم لتجنب تحلل من WBCs وإطلاق...
Disclosures
ويعلن أصحاب البلاغ أنهما لا يملكان مصالح مالية متنافسة.
Acknowledgements
ويود المؤلفون أن يشكروا أعضاء مختبر علم الجينوم السرطاني والتراكم البيولوجي للأمراض المعقدة على إسهاماتهم الملاحظةية الشديدة ومشاركتهم في مناقشات متعددة في مختلف مراحل هذا المشروع. ويشمل الدعم التمويلي منحة من جمعية إسرائيل للسرطان (ICA منحة M.F-M 2017-2019) ومنحة Kamin من هيئة الابتكار الإسرائيلية (ل M.F-M.).
Materials
| Name | Company | Catalog Number | Comments |
| 2100 Bioanalyzer Instrument | Agilent Technologies, Inc. | G2939BA | The 2100 Bioanalyzer system is an established automated electrophoresis tool for the sample quality control of biomolecules. |
| Adjustable Clip for Priming Station | Agilent Technologies, Inc. | 5042-1398 | Used in combination with syringe to apply defined pressure for chip priming. |
| Agilent High Sensitivity DNA Kit | Agilent Technologies, Inc. | 5067-4626 | The High Sensitivity DNA assays are often used for sample quality control for next-generation sequencing libraries |
| cf-DNA/cf-RNA Preservative Tubes | Norgen Biotek Corp. | 63950 | Norgen's cf-DNA/cf-RNA Preservative Tubes are closed, evacuated plastic tubes for the collection and the preservation of cf-DNA, circulating tumor DNA, cf-RNA and circulating tumor cells in human whole blood samples during storage and shipping |
| Chip Priming Station | Agilent Technologies, Inc. | 5065-4401 | Used to load gel matrix into a chip with a syringe provided with each assay kit— used for RNA, DNA, and protein assays. Includes priming station, stop watch, and 1 syringe clip |
| Electrode Cleaner Kit | Agilent Technologies, Inc. | 5065-9951 | Prevents cross-contamination. Removes bacterial or protein contaminants from electrodes. |
| Filters for Gel Matrix | Agilent Technologies, Inc. | 185-5990 | Used for proper mixing of DNA dye concentrate and DNA gel matrix |
| IKA Basic Chip Vortex | IKA-Werke GmbH & Co. KG | MS-3-S36 | Used for proper mixing of DNA ladder and DNA sample on Bioanalyzer assay chips |
| NucleoSpin Tissue kit | MACHEREY-NAGEL | 740952.5 | With the NucleoSpin Tissue kit, genomic DNA can be prepared from tissue, cells (e.g., bacteria), and many other sources. |
| QIAamp circulating nucleic acid kit | Qiagen | 55114 | The QIAamp Circulating Nucleic Acid Kit enables efficient purification of these circulating nucleic acids from human plasma or serum and other cell-free body fluids. |
| QIAvac 24 Plus vacuum manifold | Qiagen | 19413 | The QIAvac 24 Plus vacuum manifold is designed for vacuum processing of QIAGEN columns in parallel. |
| QIAvac Connecting System | Qiagen | 19419 | In combination with the QIAvac Connecting System, the QIAvac 24 Plus vacuum manifold can be used as a flow-through system. The sample flow-through, containing possibly infectious material, is collected in a separate waste bottle. |
| Qubit 2.0 fluorometer | Invitrogen | Q32866 | The Qubit 2.0 Fluorometer is an easy-to-use, analytical instrument designed to work with the Qubit assays for DNA, RNA, and protein quantitation. |
| Qubit assay tubes | Thermo Fisher Scientific | Q32856 | Qubit assay tubes are 500 µL thin-walled polypropylene tubes for use with the Qubit Fluorometer. |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific | Q32851 | The Qubit dsDNA HS (High Sensitivity) Assay Kit is designed specifically for use with the Qubit Fluorometer. The assay is highly selective for double-stranded DNA (dsDNA) over RNA and is designed to be accurate for initial sample concentrations from 10 pg/µL to 100 ng/µL. |
| Vacuum Pump | Qiagen | 84010 | used for vacuum processing of QIAGEN columns |
| Miscellaneous | |||
| 50 ml centrifuge tubes | |||
| Crushed ice | |||
| Ethanol (96–100%) | |||
| Heating block or similar at 56 °C (capable of holding 2 ml collection tubes) | |||
| Isopropanol (100%) | |||
| Microcentrifuge | |||
| Phosphate-buffered saline (PBS) | |||
| Pipettes (adjustable) | |||
| Sterile pipette tips (pipette tips with aerosol barriers are recommended to help prevent cross-contamination) | |||
| Water bath or heating block capable of holding 50 mL centrifuge tubes at 60 °C |
References
- Campbell, P. J., et al. Pan-cancer analysis of whole genomes. Nature. 578 (7793), 82-93 (2020).
- Liotta, L., Petricoin, E. Molecular profiling of human cancer. Nature Reviews Genetics. 1 (1), 48-56 (2000).
- Balamurali, D., et al. ChiTaRS 5.0: the comprehensive database of chimeric transcripts matched with druggable fusions and 3D chromatin maps. Nucleic Acids Research. 48 (1), 825-834 (2019).
- Trédan, O., et al. Molecular screening program to select molecular-based recommended therapies for metastatic cancer patients: Analysis from the ProfiLER trial. Annals of Oncology. 30 (5), 757-765 (2019).
- Oliveira, K. C. S., et al. Current perspectives on circulating tumor DNA, precision medicine, and personalized clinical management of cancer. Molecular Cancer Research. 18 (4), 517-528 (2020).
- Siegal, T. Clinical impact of molecular biomarkers in gliomas. Journal of Clinical Neuroscience. 22 (3), 437-444 (2015).
- Komori, T. The 2016 WHO Classification of Tumours of the Central Nervous System: The Major Points of Revision. Neurologia medico-chirurgica. 57 (7), 301-311 (2017).
- Duffy, M. J., O'Donovan, N., Crown, J. Use of molecular markers for predicting therapy response in cancer patients. Cancer Treatment Reviews. 37 (2), 151-159 (2011).
- Saenz-Antoñanzas, A., et al. Liquid Biopsy in Glioblastoma: Opportunities, Applications and Challenges. Cancers. 11 (7), 950 (2019).
- Marrugo-Ramírez, J., Mir, M., Samitier, J. Blood-Based Cancer Biomarkers in Liquid Biopsy: A Promising Non-Invasive Alternative to Tissue Biopsy. International Journal of Molecular Sciences. 19 (10), 2877 (2018).
- Pantel, K., Alix-Panabières, C. Liquid biopsy in 2016: Circulating tumour cells and cell-free DNA in gastrointestinal cancer. Nature Reviews Gastroenterology & Hepatology. 14 (2), 73-74 (2017).
- Bronkhorst, A. J., et al. The emerging role of cell-free DNA as a molecular marker for cancer management. Biomolecular Detection and Quantification. 17, 100087 (2019).
- Cescon, D. W., Bratman, S. V., Chan, S. M., Siu, L. L. Circulating tumor DNA and liquid biopsy in oncology. Nature Cancer. 1 (3), 276-290 (2020).
- Palmirotta, R., et al. Liquid biopsy of cancer: a multimodal diagnostic tool in clinical oncology. Therapeutic Advances in Medical Oncology. 10, 175883591879463 (2018).
- Cohen, J. D. J., et al. Detection and localization of surgically resectable cancers with a multi-analyte blood test. Science. 359 (6378), 926-930 (2018).
- Wan, J. C. M., et al. Liquid biopsies come of age: towards implementation of circulating tumour DNA. Nature Reviews Cancer. 17 (4), 223-238 (2017).
- Heitzer, E., Haque, I. S., Roberts, C. E. S., Speicher, M. R. Current and future perspectives of liquid biopsies in genomics-driven oncology. Nature Reviews Genetics. 20 (2), 71-88 (2018).
- Thierry, A. R., et al. Origins, structures, and functions of circulating DNA in oncology. Cancer and Metastasis Reviews. 35 (3), 347-376 (2016).
- Buscail, E., et al. High Clinical Value of Liquid Biopsy to Detect Circulating Tumor Cells and Tumor Exosomes in Pancreatic Ductal Adenocarcinoma Patients Eligible for Up-Front Surgery. Cancers. 11 (11), 1656 (2019).
- Heitzer, E., Ulz, P., Geigl, J. B. Circulating Tumor DNA as a Liquid Biopsy for Cancer. Clinical Chemistry. 61 (1), 112-123 (2015).
- Kustanovich, A., Schwartz, R., Peretz, T., Grinshpun, A. Life and death of circulating cell-free DNA. Cancer Biology and Therapy. 20 (8), 1057-1067 (2019).
- Crowley, E., Di Nicolantonio, F., Loupakis, F., Bardelli, A. Liquid biopsy: monitoring cancer-genetics in the blood. Nature Reviews Clinical Oncology. 10 (8), 472-484 (2013).
- Celec, P., et al. Cell-free DNA: the role in pathophysiology and as a biomarker in kidney diseases. Expert Reviews in Molecular Medicine. 20, (2018).
- Gautschi, O., et al. Origin and prognostic value of circulating KRAS mutations in lung cancer patients. Cancer Letters. 254 (2), 265-273 (2007).
- Bidard, F., et al. Detection rate and prognostic value of circulating tumor cells and circulating tumor DNA in metastatic uveal melanoma. International Journal of Cancer. 134 (5), 1207-1213 (2013).
- Chan, K. C. A., et al. Analysis of Plasma Epstein–Barr Virus DNA to Screen for Nasopharyngeal Cancer. New England Journal of Medicine. 377 (6), 513-522 (2017).
- Mao, L., et al. Detection of Oncogene Mutations in Sputum Precedes Diagnosis of Lung Cancer. Cancer Research. 54 (7), 1634-1637 (1994).
- De Mattos-Arruda, L., et al. Cerebrospinal fluid-derived circulating tumour DNA better represents the genomic alterations of brain tumours than plasma. Nature communications. 6 (1), 8839 (2015).
- Khier, S., Lohan, L. Kinetics of circulating cell-free DNA for biomedical applications: critical appraisal of the literature. Future science OA. 4 (4), 295 (2018).
- Misale, S., et al. Resistance to Anti-EGFR therapy in colorectal cancer: From heterogeneity to convergent evolution. Cancer Discovery. 4 (11), 1269-1280 (2014).
- Beddowes, E., Sammut, S. J., Gao, M., Caldas, C. Predicting treatment resistance and relapse through circulating DNA. Breast. 34, 31-35 (2017).
- Sacher, A. G., et al. Prospective Validation of Rapid Plasma Genotyping for the Detection of EGFR and KRAS Mutations in Advanced Lung Cancer. JAMA oncology. 2 (8), 1014-1022 (2016).
- Vaidyanathan, R., et al. Cancer diagnosis: from tumor to liquid biopsy and beyond. Lab on a Chip. 19 (1), 11-34 (2019).
- Kelly, P. Gliomas: Survival, origin and early detection. Surgical Neurology International. 1 (1), 96 (2010).
- Faria, G., Silva, E., Da Fonseca, C., Quirico-Santos, T. Circulating Cell-Free DNA as a Prognostic and Molecular Marker for Patients with Brain Tumors under Perillyl Alcohol-Based Therapy. International Journal of Molecular Sciences. 19 (6), 1610 (2018).
- Liu, M. C., et al. Sensitive and specific multi-cancer detection and localization using methylation signatures in cell-free DNA. Annals of Oncology. 31 (6), 745-759 (2020).
- Enko, D., Halwachs-Baumann, G., Kriegshäuser, G. Plasma free DNA: Evaluation of temperature-associated storage effects observed for roche cell-free DNA collection tubes. Biochemia Medica. 29 (1), 153-156 (2019).
- Streleckiene, G., et al. Effects of Quantification Methods Isolation Kits, Plasma Biobanking, and Hemolysis on Cell-Free DNA Analysis in Plasma. Biopreservation and Biobanking. 17 (6), 553-561 (2019).
- Thress, K. S., et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nature Medicine. 21 (6), 560-562 (2015).
- Ward Gahlawat, A., et al. Evaluation of Storage Tubes for Combined Analysis of Circulating Nucleic Acids in Liquid Biopsies. International Journal of Molecular Sciences. 20 (3), 704 (2019).
- Lu, J. L., Liang, Z. Y. Circulating free DNA in the era of precision oncology: Pre- and post-analytical concerns. Chronic Diseases and Translational Medicine. 2 (4), 223-230 (2016).
- Iyapparaj, P., et al. Optimization of bacteriocin production by Lactobacillus sp. MSU3IR against shrimp bacterial pathogens. Aquatic Biosystems. 9 (1), 12 (2013).
- Ponti, G., et al. The value of fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of cell-free DNA (cfDNA) in malignant melanoma and prostate cancer patients. Clinica Chimica Acta. 479, 14-19 (2018).
- Medina Diaz, I., et al. Performance of Streck cfDNA blood collection tubes for liquid biopsy testing. PLoS One. 11 (11), 0166354 (2016).
- Perkins, G., et al. Multi-Purpose Utility of Circulating Plasma DNA Testing in Patients with Advanced Cancers. PLoS One. 7 (11), 47020 (2012).
- Mouliere, F., et al. Multi-marker analysis of circulating cell-free DNA toward personalized medicine for colorectal cancer. Molecular Oncology. 8 (5), 927-941 (2014).
- Trigg, R. M., Martinson, L. J., Parpart-Li, S., Shaw, J. A. Factors that influence quality and yield of circulating-free DNA: A systematic review of the methodology literature. Heliyon. 4 (7), 00699 (2018).
- Risberg, B., et al. Effects of Collection and Processing Procedures on Plasma Circulating Cell-Free DNA from Cancer Patients. Journal of Molecular Diagnostics. 20 (6), 883-892 (2018).
- Markus, H., et al. Evaluation of pre-analytical factors affecting plasma DNA analysis. Scientific Reports. 8 (1), 7375 (2018).
- Chen, Z., et al. Comprehensive Evaluation of the Factors Affecting Plasma Circulating Cell-Free DNA Levels and Their Application in Diagnosing Nonsmall Cell Lung Cancer. Genetic Testing and Molecular Biomarkers. 23 (4), 270-276 (2019).
- Schwarzenbach, H., Hoon, D. S. B., Pantel, K. Cell-free nucleic acids as biomarkers in cancer patients. Nature Reviews Cancer. 11 (6), 426-437 (2011).
- Malyuchenko, N. V., et al. PARP1 Inhibitors: antitumor drug design. Acta Naturae. 7 (3), 27-37 (2015).
- Fleischhacker, M., Schmidt, B. Circulating nucleic acids (CNAs) and cancer-A survey. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1775 (1), 181-232 (2007).
- Jung, K., Fleischhacker, M., Rabien, A. Cell-free DNA in the blood as a solid tumor biomarker—A critical appraisal of the literature. Clinica Chimica Acta. 411 (21-22), 1611-1624 (2010).
- Frenkel-Morgenstern, M., et al. ChiTaRS: a database of human, mouse and fruit fly chimeric transcripts and RNA-sequencing data. Nucleic Acids Research. 41, 142-151 (2013).
- Frenkel-Morgenstern, M., et al. ChiTaRS 2.1--an improved database of the chimeric transcripts and RNA-seq data with novel sense-antisense chimeric RNA transcripts. Nucleic Acids Research. 43, 68-75 (2015).
- Gorohovski, A., et al. ChiTaRS-3.1-the enhanced chimeric transcripts and RNA-seq database matched with protein-protein interactions. Nucleic Acids Research. 45 (1), 790-795 (2017).
- Tate, J. G., et al. COSMIC: the Catalogue Of Somatic Mutations In Cancer. Nucleic Acids Research. 47 (1), 941-947 (2019).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Szopa, W., Burley, T. A., Kramer-Marek, G., Kaspera, W. Diagnostic and Therapeutic Biomarkers in Glioblastoma: Current Status and Future Perspectives. BioMed Research International. 2017, 1-13 (2017).
- Salesse, S., Verfaillie, C. M. BCR/ABL: from molecular mechanisms of leukemia induction to treatment of chronic myelogenous leukemia. Oncogene. 21 (56), 8547-8559 (2002).
- Frenkel-Morgenstern, M., Valencia, A. Novel domain combinations in proteins encoded by chimeric transcripts. Bioinformatics. 28 (12), 67-74 (2012).
- Frenkel-Morgenstern, M., et al. Chimeras taking shape: Potential functions of proteins encoded by chimeric RNA transcripts. Genome Research. 22 (7), 1231-1242 (2012).
- Simon, M., et al. TERT promoter mutations: a novel independent prognostic factor in primary glioblastomas. Neuro-Oncology. 17 (1), 45-52 (2015).
- Waitkus, M. S., Diplas, B. H., Yan, H. Isocitrate dehydrogenase mutations in gliomas. Neuro-Oncology. 18 (1), 16-26 (2016).
- Kindler, T., Meyer, R. G., Fischer, T. BCR-ABL as a target for novel therapeutic interventions. Expert Opinion on Therapeutic Targets. 6 (1), 85-101 (2002).
- Overman, M. J., et al. Use of research biopsies in clinical trials: are risks and benefits adequately discussed. Journal of Clinical Oncology Official Journal of the American Society of Clinical Oncology. 31 (1), 17-22 (2013).
- Vanderlaan, P. A., et al. Success and failure rates of tumor genotyping techniques in routine pathological samples with non-small-cell lung cancer. Lung Cancer. 84 (1), 39-44 (2014).
- Stewart, C. M., Tsui, D. W. Y. Circulating cell-free DNA for non-invasive cancer management. Cancer Genetics. 228-229, 169-179 (2018).
- Normanno, N., et al. The liquid biopsy in the management of colorectal cancer patients: Current applications and future scenarios. Cancer Treatment Reviews. 70, 1-8 (2018).
- Hufnagl, C., et al. Evaluation of circulating cell-free DNA as a molecular monitoring tool in patients with metastatic cancer. Oncology Letters. 19 (2), 1551-1558 (2020).
- Petit, J., et al. Cell-Free DNA as a Diagnostic Blood-Based Biomarker for Colorectal Cancer: A Systematic Review. The Journal of Surgical Research. 236, 184-197 (2019).
- Poulet, G., Massias, J., Taly, V. Liquid Biopsy: General Concepts. Acta Cytologica. 63 (6), 449-455 (2019).
- Alix-Panabières, C. The future of liquid biopsy. Nature. 579 (7800), 9 (2020).
- Eisenstein, M. Could liquid biopsies help deliver better treatment. Nature. 579 (7800), 6-8 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved