A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تمكين التعويض في الوقت الحقيقي في الأكسدة الكيميائية الضوئية السريعة من البروتينات لتحديد التغيرات في تضاريس البروتين
In This Article
Summary
أكسدة سريعة للبروتينات الضوئية هي تقنية ناشئة للتوصيف الهيكلي للبروتينات. مختلف المذيبات المضافة و ligands تختلف خصائص الهيدروكسيل الراديكالية الكسح. لمقارنة بنية البروتين في ظروف مختلفة، مطلوب التعويض في الوقت الحقيقي من الجذور الهيدروكسيل ولدت في رد الفعل لتطبيع ظروف رد الفعل.
Abstract
التأكسد الكيميائي الضوئي السريع للبروتينات (FPOP) هو تقنية بيولوجيا هيكلية تعتمد على القياس الطيفي الكتلي الذي يسبر مساحة السطح التي يمكن الوصول إليها من البروتينات. تعتمد هذه التقنية على رد فعل سلاسل جانبية من الأحماض الأمينية مع الجذور الهيدروكسيلية تنتشر بحرية في الحل. FPOP يولد هذه الجذور في الموقع عن طريق التحليل الضوئي بالليزر من بيروكسيد الهيدروجين، وخلق انفجار من الجذور الهيدروكسيل التي تستنفد على ترتيب ميكروثانية. عندما تتفاعل هذه الجذور الهيدروكسيل مع سلسلة جانبية من الأحماض الأمينية التي يمكن الوصول إليها من المذيبات ، فإن منتجات التفاعل تظهر تحولًا جماعيًا يمكن قياسه وتحديده كمًا بواسطة قياس الطيف الكتلي. وبما أن معدل رد فعل الأحماض الأمينية يعتمد جزئياً على متوسط سطح المذيبات التي يمكن الوصول إليها من تلك الأحماض الأمينية، فإن التغيرات المقاسة في كمية أكسدة منطقة معينة من البروتين يمكن أن ترتبط بشكل مباشر بالتغيرات في إمكانية الوصول إلى المذيبات في تلك المنطقة بين التشكلات المختلفة (على سبيل المثال، اللتيند المقيد مقابل الليغاند الحر، والمونمر مقابل التجميع، إلخ.) وقد طبقت FPOP في عدد من المشاكل في علم الأحياء، بما في ذلك التفاعلات البروتين البروتين، والتغيرات البروتين التشكلية، والبروتين liga.1. كما أن التركيز المتاح من الجذور الهيدروكسيل يختلف استناداً إلى العديد من الظروف التجريبية في تجربة FPOP، من المهم رصد الجرعة الجذرية الفعالة التي يتعرض لها تحليل البروتين. ويتحقق هذا الرصد بكفاءة من خلال دمج مقياس الجرعات مضمنة لقياس إشارة من تفاعل FPOP، مع فلونس الليزر تعديلها في الوقت الحقيقي لتحقيق المبلغ المطلوب من الأكسدة. مع هذا التعويض، يمكن تحديد التغيرات في تضاريس البروتين التي تعكس التغيرات التكونية، والأسطح ملزمة ليغاند، و/ أو التفاعل البروتين البروتيني واجهات التفاعل في عينات غير متجانسة باستخدام كميات عينة منخفضة نسبيا.
Introduction
الأكسدة الكيميائية الضوئية السريعة للبروتينات (FPOP) هي تقنية ناشئة لتحديد التغيرات الطوبوغرافية البروتينية عن طريق تعديل فائق السرعة في منطقة السطح المكشوفة للمذيبات من البروتينات متبوعاً بالكشف عن البروتينات LC-MS1. FPOP يولد تركيز عال من الجذور الهيدروكسيل في الموقع بواسطة الليزر الأشعة فوق البنفسجية فلاش ضوء بيروكسيد الهيدروجين. هذه الجذور الهيدروكسيل هي رد الفعل جدا وقصيرة الأجل، تستهلك على مقياس زمني تقريبا ميكرو ثانية في ظل ظروف FPOP2. هذه الجذور الهيدروكسيل تنتشر من خلال المياه وأكسدة مختلف المكونات العضوية في حل بمعدلات حركية تتراوح عموما من سريع (~6 6 M-1 S-1)لنشر التي تسيطر عليها3. عندما الهيدروكسيل الراديكالية لقاءات سطح البروتين، فإن الراديكالية تتأكسد سلاسل جانبية الأحماض الأمينية على سطح البروتين، مما أدى إلى تحول كتلة من أن الأحماض الأمينية (الأكثر شيوعاً الجمع الصافي لذرة أكسجين واحدة)4. يعتمد معدل تفاعل الأكسدة في أي حمض أميني على عاملين: التفاعل المتأصل في تلك الأحماض الأمينية (التي تعتمد على السلسلة الجانبية والسياق التسلسلي)4،5 وإمكانية الوصول إلى تلك السلسلة الجانبية إلى جذر الهيدروكسيل الناشر ، الذي يرتبط ارتباطًا وثيقًا بمتوسط مساحة السطح التي يمكن الوصول إليها من المذيبات6،7. وقد لوحظ كل من الأحماض الأمينية القياسية باستثناء الجليسين كما وصفت هذه الجذور الهيدروكسيل عالية التفاعل في التجارب FPOP, وإن كان في غلة مختلفة على نطاق واسع; في الممارسة العملية، Ser، Thr، Asn، وعلاء ونادرا ما ينظر إليها على أنها المؤكدة في معظم العينات إلا تحت جرعات متطرفة عالية والتي حددتها دقيق وحساسة ETD التجزئةالمستهدفة 8،9. بعد الأكسدة، يتم إخماد العينات لإزالة بيروكسيد الهيدروجين والمواد تأكسدية ثانوية (أكسيد فائق، أكسجين مفرد، هيدروبيروكسيد البيبتيديل، الخ.) ثم يتم هضم العينات المطفأة بشكل بروتيوليالي لتوليد خليط من الببتيدات المؤكدة ، حيث يتم تجميد المعلومات الهيكلية كـ "لقطة" كيميائية في أنماط منتجات الأكسدة من مختلف الببتيدات(الشكل 1). يستخدم الكروماتوغرافيا السائلة مقرونة إلى القياس الطيفي الشامل (LC-MS) لقياس كمية أكسدة الأحماض الأمينية في الببتيد البروتيني معين استناداً إلى الكثافة النسبية للإصدارات المؤسدة وغير المؤكد من ذلك الببتيد. بمقارنة هذه البصمة التأسدية من نفس البروتين التي تم الحصول عليها في ظل ظروف مختلفة من التشكل (على سبيل المثال، ملزمة بالليغان مقابل ليجوند خالية)، يمكن أن ترتبط الاختلافات في كمية أكسدة منطقة معينة من البروتين بشكل مباشر مع الاختلافات في مساحة السطح التي يمكن الوصول إليها من قبل المذيبات في تلك المنطقة6،7. القدرة على توفير معلومات الطبوغرافية البروتين يجعل FPOP تكنولوجيا جذابة لتحديد هيكل أعلى من أجل البروتينات، بما في ذلك في اكتشاف البروتين العلاجي والتنمية10،11.

الشكل 1: نظرة عامة على FPOP. يتم تعديل سطح البروتين بشكل مُساهم بواسطة الجذور الهيدروكسيلية شديدة التفاعل. سوف تتفاعل الجذور الهيدروكسيل مع سلاسل جانبية من الأحماض الأمينية من البروتين بمعدل يتأثر بقوة بإمكانية الوصول إلى المذيبات في السلسلة الجانبية. التغيرات الطبوغرافية (على سبيل المثال، بسبب ربط ليغاند كما هو مبين أعلاه) سوف تحمي الأحماض الأمينية في منطقة التفاعل من التفاعل مع الجذور الهيدروكسيل، مما يؤدي إلى انخفاض في كثافة الببتيد المعدلة في إشارة LC-MS. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
مكونات مختلفة موجودة في حل FPOP (على سبيل المثال، اليغاندات، واسحات، والمخازن) لها نشاط الكسح مختلفة نحو الجذور الهيدروكسيل ولدت على التحليل الضوئي ليزر من بيروكسيد الهيدروجين3. وبالمثل، قد يغير تغير صغير في تركيز البيروكسيد، والفلونة بالليزر، وتكوين المخزن المؤقت الجرعة الجذرية الفعالة، مما يجعل استنساخ بيانات FPOP يشكل تحديا عبر العينات وبين مختبرات مختلفة. ولذلك، فمن المهم أن تكون قادرة على مقارنة جرعة الهيدروكسيل الراديكالية المتاحة للرد مع البروتين في كل عينة باستخدام واحدة من عدة الجرعات الهيدروكسيل الجذر المتاحة12،13،14،15،16. تعمل مقاييس الهيدروكسيل الراديكالية من خلال التنافس مع التحليل (ومع جميع الزبالين في الحل) لتجمع الجذور الهيدروكسيلية؛ يتم قياس الجرعة الفعالة من الجذور الهيدروكسيل عن طريق قياس كمية أكسدة الدوسيمتر. لاحظ أن "الجرعة الجذرية الهيدروكسيل الفعالة" هي وظيفة من كل من التركيز الأولي للهيدروكسيل الراديكالية المتولدة ونصف العمر من الراديكالية. هذه المعلمتين تعتمد جزئيا على بعضها البعض، مما يجعل النمذجة الحركية النظرية معقدة إلى حد ما (الشكل 2). يمكن أن يكون اثنين من العينات مختلفة بعنف جذرية الأولية نصف حياة مع الحفاظ على نفس الجرعة الراديكالية الفعالة عن طريق تغيير التركيز الأولي من الهيدروكسيل الراديكالية التي شكلت; أنها لا تزال تولد آثار أقدام متطابقة17. Adenine13 و Tris12 هي مريحة hydroxyl الجذر دوسيمترات لأن مستوى الأكسدة الخاصة بهم يمكن قياسها عن طريق مطياف الأشعة فوق البنفسجية في الوقت الحقيقي، مما يسمح للباحثين لتحديد بسرعة عندما يكون هناك مشكلة مع جرعة جذرية الهيدروكسيل فعالة واستكشاف مشكلتهم. لحل هذه المشكلة، من المهم وجود مقياس الجرعات المضمن الموجود في نظام التدفق مباشرة بعد موقع التشعيع الذي يمكنه مراقبة الإشارة من تغيرات امتصاص الأدينين في الوقت الفعلي. وهذا يساعد في تنفيذ التجارب FPOP في المخازن المؤقتة أو أي سذر الأخرى مع مستويات مختلفة على نطاق واسع من الهيدروكسيل قدرة الكسحالجذرية 17. ويمكن تنفيذ هذا التعويض الجرعة الجذرية في الوقت الحقيقي, تسفر عن نتائج لا يمكن تحديدها إحصائيا لنفس المطابقة عن طريق تعديل الجرعة الراديكالية الفعالة.
في هذا البروتوكول، لدينا إجراءات مفصلة لتنفيذ تجربة FPOP نموذجية مع تعويض الجرعة الراديكالية باستخدام أدينين كمقياس الجرعات الراديكالية البصرية الداخلية. هذه الطريقة تسمح للمحققين بمقارنة آثار الأقدام عبر ظروف FPOP التي لديها قدرة الكسح المختلفة من خلال أداء التعويض في الوقت الحقيقي.
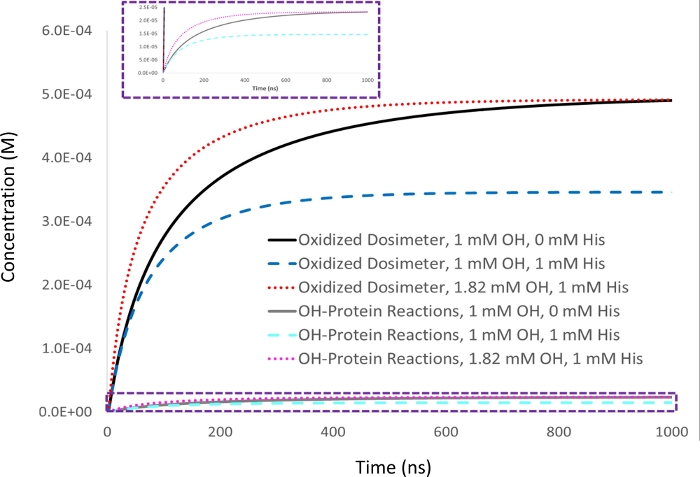
الشكل 2: محاكاة حركية للتعويض القائم على قياس الجرعات. 1 mM أدينين دوسيميت يتم قياس الاستجابة في 5 μM lysozyme التحليل مع تركيز جذري هيدروكسيل 1 mM الأولي (▪أو تي1/2=53 ن س), وتعيين كاستجابة مقياس الجرعات المستهدفة (أسود). عند إضافة 1 mM من الهستيدين الكاسح الزبال، استجابة مقياس الجرعات (الأزرق) يقلل جنبا إلى جنب مع كمية أكسدة البروتين بطريقة متناسبة (السماوي). وينخفض أيضا نصف عمر جذر الهيدروكسيل (▪OH t1/2=39 ns). عندما يتم زيادة كمية من هيدروكسل جذري ولدت لإعطاء عائد مكافئ من الجرعات المؤسدة في العينة مع 1 mm الهستيدين الكاسح كما يتحقق مع 1 mM هيدروكسل الراديكالية في غياب زبال (الأحمر)، وكمية أكسدة البروتين التي تحدث على نحو مماثل يصبح متطابقة (أرجواني)، في حين أن نصف العمر الراديكالي الهيدروكسيل يقلل أكثر من ذلك (▪OH ر1/2=29 ن). تم تكييفها بإذن من Sharp J.S.، Am Pharmaceut Rev 22، 50-55، 2019. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. إعداد مقاعد البدلاء البصرية والشعيراتية لFPOP
تنبيه: أشعة الليزر KrF excimer هي مخاطر قصوى للعين، والضوء المباشر أو المنعك يمكن أن يسبب تلفًا دائمًا للعين. ارتدي دائماً حماية مناسبة للعين، وتجنب وجود أي أجسام عاكسة بالقرب من مسار الحزمة عند الإمكان، واستخدم الضوابط الهندسية لمنع الوصول غير المصرح به إلى الليزر النشط وكبح أي انعكاسات طائشة.
- إعداد مقاعد البدلاء البصرية FPOP.
- تشغيل الليزر إلى الاحماء. تعيين الليزر إلى مشغل الخارجية، الطاقة المستمرة، لا استبدال الغاز. تعيين طاقة الليزر لكل نبضة (عادة بين 80-120 mJ / نبضة).
- اقامة مقاعد البدلاء البصرية مع عدسة بلانو محدب (30 مم ضياء. × 120 ملم FL uncoated) مباشرة في مسار شعاع الليزر وbackstop غير عاكسة لاستيعاب الضوء كما هو مبين في الشكل 3A.

الشكل 3: مقاعد البدلاء البصرية لتجربة FPOP. (أ) يتم خلط العينة مع H2O2، مقياس الجرعات الجذرية الأدينين ، و جلوتامين زبال وتحميلها في الحقنة. يتم دفع العينة من خلال الشعيرية السيليكا تنصهر من خلال مسار شعاع مركزة من ليزر الأشعة فوق البنفسجية KrF excimer. والضوء فوق البنفسجية h2O2 في الجذور الهيدروكسيل, الذي يتأكسد البروتين وdiimeter أدينين. يدفع تدفق الحقنة العينة المضيئة خارج مسار الليزر قبل نبض الليزر التالي ، مع حجم استبعاد غير مُبَحَّر بين المناطق المضيئة. مباشرة بعد الأكسدة، يتم تمرير العينة من خلال مطياف الأشعة فوق البنفسجية مضمنة، الذي يقيس امتصاص الأشعة فوق البنفسجية من أدينين في 265 نانومتر. ثم تودع العينة في مخزن إخماد للتخلص من المواد اإموكسيدة H2O2 وثانوية. (B) يتم قياس حجم البقعة بعد تشعيع ملاحظة لزجة ملونة الملصقة خلف الشعيرات الدموية مع الليزر في 248 نانومتر. يتم استخدام عرض البقعة لحساب معدل تدفق العينة ، ويتم استخدام صورة ظلية من الشعرية في وسط البقعة لمحاذاة مقاعد البدلاء البصرية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قطع طول مناسب من الشعيرية السيليكا تنصهر (360 ميكرومتر القطر الخارجي و 100 ميكرومتر القطر الداخلي) واستخدام كم، والاتصال بحقنة الغاز ضيق باستخدام انخفاض حجم الميت موصل.
- حرق بلطف طلاء بوليميد من الشعرية مع شعلة البيوتان في المكان حيث يقرأ dosimeter مضمنة إشارة الامتصاص في 265 نانومتر بعد التعرض بالليزر للعينات. امسح الحطام على الشعيرات الدموية باستخدام الميثانول بلطف على مسح خال من الوبر. طلاء بوليميد في موقع حدوث الليزر يمكن إما أن تكون أحرقت بالمثل قبالة مع شعلة البيوتان أو أحرقت قبالة مع إطلاق الليزر excimer في انخفاض الطاقة.
ملاحظة: انتظر حتى تبرد الشعيرات الدموية لأنها تشكل خطراً على النار لاستخدام الميثانول على الشعر الشعري الساخن. - ضع هذه الشعيرية من خلال مسار شعاع الليزر وإلى مقياس الجرعات المضمن.
- اضغط على الرافعة في الجزء العلوي من مقياس الجرعات المضمن لفتح المفصل. إزالة الاقحام المغناطيسي. ضع الشعيرات الدموية في الأخدود المُهتر من مقياس الجرعات المضمن، باستخدام الحامد المغناطيسي للحفاظ على الشعيرات الدموية في مكانها. أغلق المفصلي الجرعات فوق الشعر الشعري، والضغط عليه حتى أقفال رافعة في مكان.
- باستخدام برنامج قياس الجرعات ، انقر على زر بدء فلاش لبدء اطلاق ليزر excimer. تعيين قوة الليزر مسبقا بين 50-100 mJ / نبض على برنامج التحكم بالليزر نفسها، وتعيين معدل التكرار مسبقا بين 10-20 هرتز في علامة التبويب إعدادات من برنامج قياس الجرعات.
- التركيز على شعاع الليزر باستخدام عدسة محدبة بلانو التي شنت على مرحلة آلية خطية. قياس العرض والارتفاع من بقعة الليزر في موقف شعري على مذكرة لزجة باستخدام الفرجار بدقة لحساب حادث فلونس (mJ / مم2) كما هو مبين في الشكل 3B.
- ضع فتحة معتمة بالقرب من الشعيرية لضمان عرض مضيئة متسقة من الشعرية بغض النظر عن التغيرات في حجم شعاع بسبب حركة العدسة أو تغيير الطاقة لكل نبضة ليزر18.
- مع اطلاق الليزر ، ونقل المرحلة الآلية من خلال مجموعة من الحركة. تأكد من أن الشعاع يبقى مركزًا على الفتحة ويمكن ملاحظة صورة ظلية للشعر الشعري طوال الوقت. يجب أن يكون قطر الفتحة أصغر من عرض الحزمة المركزة في كل نقطة في نطاق المرحلة الآلية.
- تشغيل المياه من خلال الشعيرات الدموية في 20 ميكرولتر / دقيقة لمدة دقيقة واحدة على الأقل لغسل الشعرية.
- انقر فوق الزر بدء البيانات + زر زر زر زر زر زر زر زر زر الجرعات على برنامج مقياس الجرعات صفر مقياس الجرعات إلى الماء وبدء جمع البيانات.
ملاحظة: إذا كان نظام العازلة لFPOP امتصاص الأشعة فوق البنفسجية كبيرة في 265 نانومتر، يجب أن يكون نظام FPOP صفر على العازلة، وليس المياه.
- انقر فوق الزر بدء البيانات + زر زر زر زر زر زر زر زر زر الجرعات على برنامج مقياس الجرعات صفر مقياس الجرعات إلى الماء وبدء جمع البيانات.
- تعيين معدل التدفق المحسوب على مضخة الحقنة.
- يعتمد معدل تدفق عينة البروتين على حجم المشعع لكل طلقة (VIrr) ، وعدد لقطات الليزر في الثانية(R)، والكسر المطلوب لمحجم الاستبعاد غير المشعر (FEx)لتصحيح تأثيرات تدفق اللامينار ونشر العينة (0.15-0.30 الموصى به)2،19،20. حساب VIrr (في μL) استناداً إلى القطر الداخلي للشعر الشعري في مم(د)وعرض بقعة الليزر التي تمس على شعري (أي، عرض الفتحة) في مم (ث) باستخدام المعادلة التالية:
VIRR = π(d/2)2w - حساب معدل التدفق المطلوب (في μL/min) استناداً إلى المعادلة التالية:
تدفق = 60R[VIRR (1 + Fالسابقين)]
- يعتمد معدل تدفق عينة البروتين على حجم المشعع لكل طلقة (VIrr) ، وعدد لقطات الليزر في الثانية(R)، والكسر المطلوب لمحجم الاستبعاد غير المشعر (FEx)لتصحيح تأثيرات تدفق اللامينار ونشر العينة (0.15-0.30 الموصى به)2،19،20. حساب VIrr (في μL) استناداً إلى القطر الداخلي للشعر الشعري في مم(د)وعرض بقعة الليزر التي تمس على شعري (أي، عرض الفتحة) في مم (ث) باستخدام المعادلة التالية:
2. إعداد محلول البروتين لFPOP
- إعداد البروتين في اثنين أو أكثر من الظروف المختلفة التي يمكن مقارنتها (على سبيل المثال، ملزمة ليغاند وخالية من ليغاند؛ تجميع ومونمر؛ وحدها ومع شريك البروتين البروتين ملزمة؛ الخ) للكشف عن التغيرات في التشكل.
- تعيين الحجم الإجمالي المستخدم لـ FPOP لملاءمة احتياجات التجربة. ويتوقف الحد الأدنى عادة على حجم الشعيرات الدموية المشعة والمواد اللازمة للكشف القوي والتكسيم النسبي، وسيختلف ذلك إلى حد كبير تبعاً لنظام LC-MS/MS المستخدم وطريقة معالجة عينة ما بعد وضع العلامات. يبلغ الحجم الإجمالي لحلول FPOP المستخدمة عادة في مجموعتنا 20 ميكرولتر بعد إضافة بيروكسيد الهيدروجين. التركيز النهائي للبروتين هو عادة 1-10 ميكرومتر، مع 17 mM الجلوتامين (للحد من عمر الراديكالية الهيدروكسيل)، 1 mM أدينين (ليكون بمثابة دوسيمتر جذري)13،,17 و 10 mM العازلة الفوسفات (عازلة التي هي زبال الفقراء من الجذور الهيدروكسيل). يتم إعداد العينات بشكل عام مع تكرارات متعددة للسماح بالنمذجة الإحصائية للنتائج.
- للأغراض العامة، إعداد العينات في ثلاث ية في كلتا الدولتين، بالإضافة إلى عينة واحدة على الأقل لاستخدامها كتحكم بدون ليزر لقياس أكسدة الخلفية. إعداد 18 μL من هذا مزيج حل FPOP.
ملاحظة: العديد من المخازن المؤقتة والمواد المضافة المستخدمة عادة في الكيمياء الحيوية هي الزبالين الهيدروكسيل الراديكالية. يمكن استخدام هذه المضافات والمخازن؛ ومع ذلك، يمكن أن تحدث تخفيضات في الأكسدة بسبب الهيدروكسيل الكسح الجذرية من العازلة. بشكل عام، والحفاظ على جميع المضافات إلى الحد الأدنى المطلوب من قبل النظام البيولوجي لتحقيق أقصى قدر من البروتين أكسدة العائد. وينبغي تجنب ثنائي الفينيل سلفوكسيد بسبب الميل لتوليد الجذور الثانوية; وقد dimethylformamide بديلا مفيدا في أيدينا. عند استخدام المخازن المؤقتة التي هي الزبالين الراديكالية الهيدروكسيل قوية، يمكن في كثير من الأحيان أن تستبعد الجلوتامين من مزيج حل FPOP.
- للأغراض العامة، إعداد العينات في ثلاث ية في كلتا الدولتين، بالإضافة إلى عينة واحدة على الأقل لاستخدامها كتحكم بدون ليزر لقياس أكسدة الخلفية. إعداد 18 μL من هذا مزيج حل FPOP.
- إعداد بيروكسيد الهيدروجين 1 M مباشرة قبل تجربة FPOP.
ملاحظة: 30٪ بيروكسيد الهيدروجين كما تباع عادة من قبل البائعين يتضمن مثبت، مما يزيد من العمر الافتراضي. مرة واحدة المخفف، وينبغي استخدام بيروكسيد الهيدروجين بسرعة، بالتأكيد في نفس اليوم. كما ينبغي اختبار بيروكسيد الهيدروجين بانتظام للتحلل بواسطة FPOP باستخدام مقياس الجرعات الجذري للهيدروكسيل. - إعداد أنابيب microcentrifuge تحتوي على 25 ميكرولتر من محلول إخماد 0.5 ميكروغرام / ميكرولتر من ميثيونين أميد و 0.5 ميكروغرام / ميكرولتر كاتالاسي. إذا تم استخدام حجم عينة أكبر من 20 ميكرولتر لـ FPOP، قم بزيادة حجم محلول التبريد بشكل متناسب.
3. تنفيذ تجربة FPOP
- أضف 2 ميكرولتر من بيروكسيد الهيدروجين في 18 ميكرولتر من مزيج حل FPOP. اخلطي المحتويات بلطف مع ماصة و سرعان ما تدور أسفل المحلول إلى أسفل أنابيب microcentrifuge. جمع على الفور مع حقنة الغازية وتحميل في مضخة الحقنة.
- بدء تدفق على مضخة حقنة مع معدل التدفق كما هو محدد في الخطوة 1.8.1 (عادة بين 8-16 ميكرولتر / دقيقة) عن طريق النقر على زر ابدأ مضخة على برنامج قياس الجرعات.
- راقب قراءة الأدينين في الوقت الحقيقي باستخدام مقياس الجرعات المضمن (انظر جدول المواد)وجمع العينة في النفايات. انتظر إشارة Abs265 لتستقر.
- انقر على زر بدء فلاش في برنامج مقياس الجرعات لبدء اطلاق الليزر بمعدل التكرار مسبقا والطاقة.
- رصد القراءة الأدينين في الوقت الحقيقي باستخدام مقياس الجرعات المضمن (انظر جدول المواد); الفرق في عبس265 مع الليزر قبالة والليزر على هو ΔAbs265 القراءة.
ملاحظة: ظهور قراءات Abs265 غير مستقرة للغاية عند إطلاق الليزر في وجود بيروكسيد الهيدروجين يرجع إلى توليد فقاعات في الحل. الحد من أنفلونزا الليزر و / أو تركيز بيروكسيد الهيدروجين للقضاء على الفقاعات.
4. أداء التعويض
ملاحظة: قد يكون للليغانات المختلفة، والمخازن، وما إلى ذلك، قدرة مختلفة على الكسح نحو الجذور الهيدروكسيلية. من المهم التأكد من أن الجرعات الجذرية الهيدروكسيلية الفعالة القابلة للمقارنة متوفرة للتفاعل مع البروتين عبر عينات مختلفة. ويتم ذلك من خلال ضمان استجابة الهيدروكسيل الجذرية متساوية بين العينات. باستخدام قياس الجرعات الأدينين، يعكس التغير في امتصاص الأشعة فوق البنفسجية عند 265 نانومتر (ΔAbs265)الجرعة الجذرية الهيدروكسيلية الفعالة؛ أكبر ΔAbs265, كلما زادت الجرعة الراديكالية الهيدروكسيل فعالة.
- قارن القراءة ΔAbs265 التي تم الحصول عليها مع مقياس الجرعات المضمن مع القراءة ΔAbs265 المطلوبة التي تم الحصول عليها من قبل التجارب أو عناصر التحكم. A ΔAbs265 القراءة أقل من القراءة المطلوبة يشير إلى جرعة فعالة غير كافية من الجذور الهيدروكسيل; A ΔAbs265 القراءة يشير إلى جرعة جذرية فعالة عالية جدا. إذا كانت قراءةΔAbs 265 في المستوى المطلوب، جمع العينة مباشرة بعد تشعيع الليزر في المخزن المؤقت17إخماد .
- تعويض الجرعة الجذرية الفعالة لمعادلة ΔAbs265. ويمكن تنفيذ هذا التعويض في ثلاث طرق: تغيير تركيز بيروكسيد الهيدروجين، وزيادة فلونس الليزر عن طريق تغيير الطاقة الليزرية لكل نبضة، أو زيادة فلونس الليزر عن طريق تغيير الطائرة المحورية للعدسة التركيز.
- لإجراء تغيير كبير (> 10 mAU) في القراءة ΔAbs265 ، إعادة تشكيل العينة مع بيروكسيد الهيدروجين أكثر أو أقل وإعادة تشغيل العينة وفقا للقسم 3.
- لإجراء تغيير صغير في القراءةΔAbs 265 في الوقت الحقيقي، ضبط الطائرة البؤرية لشعاع الحادث عن طريق ضبط موقف العدسة التركيز باستخدام المرحلة الآلية 50 مم. جعل الطائرة التنسيق أقرب إلى موقف الشعيرية زيادة القراءة ΔAbs265; جلب الطائرة التنسيق أبعد من موقف الشعيرات الدموية سوف تقلل من القراءة ΔAbs265.
- مراقبة أدينين ΔAbs265 لقياس كمية فعالة من الهيدروكسيل الراديكالية الموجودة في العينة بعد أشعة الليزر13. وتتيح المراقبة في الوقت الحقيقي باستخدام كاشف الشعيرات الدموية المضمّن للأشعة فوق البنفسجية التعويض في الوقت الحقيقي على النحو المبين في 4-2-2؛ ضبط موضع العدسة باستخدام المرحلة الآلية حتى قراءة ΔAbs265 يساوي القراءة المطلوبة. قياسات الامتصاص بعد التجربة مع مقياس طيف الأشعة فوق البنفسجية هي أيضا دقيقة، ولكن تتطلب عينات جديدة لاستخدامها في كل جرعة جذرية فعالة.
5. اجسد عينات البروتين
ملاحظة: يتم استخدام التربسين الأكثر شيوعاً لهضم عينات البروتين لـ FPOP، وهو البروتياز المستخدم في هذا البروتوكول. وهو بروتياز موثوق به يولد الببتيدات مع المواقع الأساسية على حد سواء في N- وC-terminus، وتعزيز مضاعفة أيونات الببتيد المشحون في مرض التصلب العصبي المتعدد. وعلاوة على ذلك, انها ينجل بعد ليسين وarginine, اثنين من الأحماض الأمينية التي هي فقط رد الفعل معتدلة إلى الجذور الهيدروكسيل; ولذلك، فإن التغيرات في نمط الهضم بسبب أكسدة التحليل أمر نادر الحدوث. وقد استخدمت بنجاح مع proteases الأخرى FPOP21، ولكن ينبغي توخي الحذر لضمان أنماط الهضم قابلة للمقارنة بين العينات غير المؤكد وأكسدة.
- قياس الحجم النهائي لعينة FPOP المطفأة. أضف 500 mM Tris، درجة هيدروكلوري 8.0 مع 10 mM CaCl2 تحتوي على 50 mM dithiothreitol (DTT) إلى محلول البروتين بعد إخمادها إلى تركيز نهائي قدره 50 mM Tris و1 mM CaCl2 و 5 mM DTT.
- سخني عينة البروتين على درجة حرارة 95 درجة مئوية لمدة 15 دقيقة.
- تبريد على الفور العينة على الجليد لمدة 2 دقيقة.
- إضافة 1:20 التربسين / نسبة الوزن البروتين إلى العينات.
- هضم البروتين بين عشية وضحاها في 37 درجة مئوية مع الاختلاط.
- وقف رد فعل الهضم عن طريق إضافة 0.1٪ حمض فليك و / أو تسخين العينة إلى 95 درجة مئوية لمدة 10 دقيقة.
- إضافة 2 M DTT إلى العينات والحرارة في 60 درجة مئوية لمدة 15 دقيقة مباشرة قبل LC-MS / MS.
ملاحظة: في حين أن مجموعات أخرى قد أبلغت الألكيل من thiols في التجارب FPOP، في أيدينا لاحظنا المنتجات الجانبية على الألكيليشن من البروتينات المؤسدة (ربما بسبب رد فعل مع الكربونيات النوكلوفية شكلت كمنتج أكسدة طفيفة). لذلك، نختار لتجنب الألكل من ثيولس عندما يكون ذلك ممكنا.
6. أداء الكروماتوغرافيا السائلة جنبا إلى جنب الطيف الشامل (LC-MS / MS)
- إعداد المرحلة المتنقلة أ التي تتكون من المياه التي تحتوي على 0.1٪ حمض فليك والمرحلة المتنقلة B تتكون من الأسيتونيتريل مع 0.1٪ حمض فليك.
- قم بتحميل العينة أولاً على عمود مصيدة C18 (300 ميكرومتر I.D. x 5 مم 100 Å حجم المسام، 5 ميكرومتر حجم الجسيمات) الخراطيش المحاصرة وغسل مع 2٪ المذيب B لمدة 3 دقائق بمعدل تدفق 5.0 ميكرولتر / دقيقة لإزالة الأملاح والجزيئات المائية الصغيرة.
- ثم فصل الببتيدات على C18 نانوكولوم (0.75 مم × 150 مم، 2 ميكرومتر حجم الجسيمات، 100 Å المسام الحجم) بمعدل تدفق من 300 nL/min. يتكون التدرج من زيادة خطية من 2 إلى 35٪ المذيب B على مدى 22 دقيقة، وتدرج إلى 95٪ مذيب B على 5 دقائق وعقد لمدة 3 دقائق لغسل العمود، ثم عاد إلى 2٪ B على مدى 3 دقائق وعقد لمدة 9 دقائق لإعادة توازن العمود.
ملاحظة: هذا التدرج يكفي لLC-MS/MS لمعظم خليط FPOP من البروتينين والبروتين الذين يسعون إلى القيام بالتدسيم الكمي على مستوى الببتيد. قد تحتاج نسبة المذيب B إلى تغيير لزيادة دقة الببتيد في حالات نادرة حيث تتداخل الببتيدات مع بعضها البعض بسبب أوقات الاحتفاظ المماثلة وقيم m/z. Proteome على نطاق FPOP22 أو التصاميم التجريبية التي تسعى لفصل الببتيد أكسدة المنتج ايزومر1,23,24,25 قد تتطلب أطول LC التدرجات وهي خارج نطاق هذا التقرير. - Elute الببتيدات مباشرة في مصدر نانوسبراي من مطياف كتلة عالية الاستبانة باستخدام باعث نانوسبراي موصل.
- الحصول على البيانات في وضع الأيونات الإيجابية. تعيين الجهد رش إلى 2400 V، ودرجة حرارة أنبوب نقل أيون إلى 300 درجة مئوية.
- الحصول على مسح MS الكامل من m/z 250 إلى 2000 في قرار الاسمية في m/z 200 من 60,000 تليها ثمانية لاحقة البيانات الذاتي المستقيمة MS/ MS مسح على أعلى ثمانية معظم الأيونات الببتيد أكثر وفرة باستخدام تفكك الناجم عن الاصطدام في 35% الطاقة تطبيع لتحديد الببتيدات. تجزئة الببتيدات تصل إلى خمس مرات في غضون 30 ث ومن ثم نقلها إلى قائمة استبعاد لمدة 60 s.
7- معالجة البيانات وحساب متوسط أكسدة الببتيدات
- تحديد تغطية تسلسل البروتين، م / ض القيم، وأوقات الاحتفاظ بالببتيدات غير المؤكد باستخدام محرك البحث MS /MS proteomics.
- تعيين التسامح الشامل السلائف إلى 10 جزء في المليون والسماح لما يصل إلى اثنين من مواقع الانقسام غاب لعينات التربسين هضم، وذلك باستخدام خصوصية الانقسام التربسين القياسية.
- تعيين الببتيد كتلة جزء التسامح الجماعي إلى 0.4 Daltons.
- استنادا إلى نسبة م / ض من الببتيدات غير المعدلة الكشف عنها والتحولات الجماعية المعروفة من منتجات الأكسدة الرئيسية، وحساب م / ض من مختلف المنتجات أكسدة النظرية من كل الببتيد4،,26،,27،,28،,29.
- تحديد الكروماتوغرافية الأيون المستخرجة من هذه القيم م / ض باستخدام البرمجيات لعرض كتلة تشغيل الطيفية ( الشكل4). تحديد منتجات أكسدة الببتيد على أساس م / ض، الدولة تهمة ، والتشابه في وقت elution إلى الببتيد غير المعدلة. في أيدينا، منتجات أكسدة الببتيد elute بين 240 ثانية قبل إلى 180 ثانية بعد الببتيد غير المعدلة باستخدام التدرج LC أعلاه. كما سوف يؤدي في كثير من الأحيان الأكسدة في منتجات أكسدة isomeric متعددة، فمن الشائع أن نلاحظ قمم متعددة حل جزئيا في الكرومات الأيون المستخرجة من منتجات أكسدة الببتيد، كما هو مبين في الشكل 4. يتم تحديد كمية منتجات أكسدة الببتيد على أساس مساحة الذروة (ق) في الكروماتوغرافية الأيونة المستخرجة.
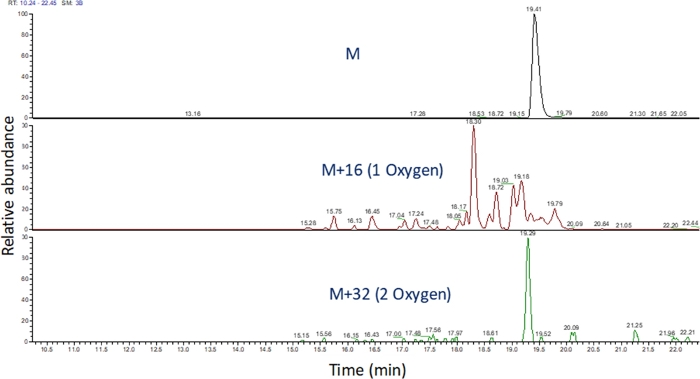
الشكل 4: استخراج الكروماتوغرافية الأيونات من الببتيد ومنتجات الأكسدة بعد FPOP. M/z من منتجات أكسدة الببتيد تحسب على أساس م / ض من الببتيد غير مؤكسد ومنتجات الأكسدة المعروفة؛ ويتم تحديد مناطق هذه المنتجات الببتيد. ثم يتم استخدام منطقة منتجات الببتيد لحساب متوسط أحداث الأكسدة في الببتيد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- حساب متوسط أكسدة الببتيدات باستخدام المعادلة التالية.
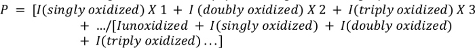
حيث P يدل على متوسط عدد من أحداث الأكسدة في جزيء الببتيد، وأنا يمثل منطقة الذروة من الببتيد غير المؤكد(Iunoxidized)والببتيد مع أحداث أكسدة ن. لاحظ أن I (مؤكسدة بشكل منفرد) لن تشمل فقط إضافات ذرة أكسجين واحدة ولكن أيضًا أحداث أكسدة واحدة أقل شيوعًا قد يختار المحقق قياسها (على سبيل المثال، إزالة الكربون الأكسدة، وتكوين الكربونيل، وما إلى ذلك). 4,26,27,28,29.
النتائج
مقارنة من البصمة الببتيد سلسلة الثقيلة من adalimumab biosimilar في العازلة الفوسفات وعند تسخينها في 55 درجة مئوية لمدة 1 ح تظهر نتائج مثيرة للاهتمام. يستخدم اختبار t للطالب لتحديد الببتيدات التي تتغير بشكل كبير في هذين الشرطين (p ≤ 0.05). الببتيدات 20-38، 99-125، 215-222، 223-252، 260-278، 376-413، و 414-420 تظهر حماية كبيرة م?...
Discussion
تقنيات التحاليل الطيفية القائمة على الكتلة، بما في ذلك تبادل الهيدروجين الديوتيريوم، الربط الكيميائي، وضع العلامات التكافؤة، وقياس الطيف الكتلي للرذاذ الأصلي وحركة الأيونات قد تزايد بسرعة في شعبيتها بسبب مرونتها وحساسيتها وقدرتها على التعامل مع الخلائط المعقدة. FPOP تفتخر العديد من الم?...
Disclosures
جوشوا S. شارب يكشف عن مصلحة مالية كبيرة في GenNext تكنولوجيز، وشركة، وهي شركة صغيرة تسعى إلى تسويق التقنيات لتحليل هيكل أعلى من أجل البروتين بما في ذلك البصمة البروتينية الراديكالية الهيدروكسيل.
Acknowledgements
نحن نعترف بتمويل البحوث من المعهد الوطني للعلوم الطبية العامة منحة R43GM125420-010 لدعم التنمية التجارية لجهاز FPOP على مقاعد البدلاء وR01GM127267 لتطوير توحيد ومقاييس بروتوكولات لFPOP عالية الطاقة.
Materials
| Name | Company | Catalog Number | Comments |
| Adenine | Acros Organics | 147440250 | Soluble in water upto 3.5 mM |
| Aperture | Edmund Optics | 39-905 | 1000 μm Aperture Diameter, Gold-Plated Copper Aperture |
| Aperture holder | Edmund Optics | 53-287 | 25.8mm Outer Diameter, Precision Pinhole Mount |
| Catalse | Sigma Aldrich | C-40 | Catalase from bovine liver, lyophilized powder, ≥10,000 units/mg protein |
| COMPex Pro laser | Coherent | 1113836 | COMPexPRO 102, F-Vversion, KrF laser, No XeCl |
| Dithiotheitol (DTT) | Promega | V3151 | DTT, Molecular Grade (DL-Dithiothreitol) |
| Fraction collector | GenNext Technologies, Inc. | N/A | Automated fraction collector |
| Fused silica capillay | Molex | 1068150023 | Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 100 µm, Outer Diameter 375 µm, TSP100375 |
| Glutamine | Acros Organics | 119951000 | L(+)-Glutamine, 99% |
| Holder for lens | Edmund Optics | 03-668 | 53 mm Outer Diameter, Three-Screw Adjustable Ring Mount |
| Hydrogen peroxide | Fisher Scientific | H325-100 | Hydrogen Peroxide, 30% (Certified ACS), Fisher Chemical |
| LC-MS/MS system | Thermo Scientific | IQLAAEGAAPFADBMBCX | Dionex Ultimate 3000 coupled to Orbitap Fusion Tribrid mass spectrometer |
| Mas spec grade Acetonitrile | Fisher Scientific | A955-1 | Acetonitrile, Optima LC/MS Grade, Fisher Chemical |
| Mass spec grade formic acid | Fisher Scientific | A117-50 | Formic Acid, 99.0+%, Optima™ LC/MS Grade, Fisher Chemical |
| Mass spec grade water | Fisher Scientific | W6-4 | Water, Optima LC/MS Grade, Fisher Chemical |
| MES buffer | Sigma Aldrich | M0164 | MES hemisodium salt |
| Methionine amide | Bachem | 4000594.0005 | H-met-NH2.HCl |
| Micro V clamp | Thor Labs | VK250 | Micro V-clamp with stainless steel blades |
| Motorized stage | Edmund Optics | 68-638 | 50mm Travel Motorized Stage System with Manual Control |
| Nano C18 colum | Thermo Scientific | 164534 | Acclaim PepMap 100 C18 HPLC Columns |
| Optical bench | Edmund Optics | 56-935 | 18" x 18" breadboard |
| Pioneer FPOP Module System | GenNext Technologies, Inc. | N/A | Inline FPOP Radical Dosimetry System |
| Post holder | Edmund Optics | 58-979 | 3" Length, ¼-20 Thread, Post Holder |
| Sodium phosphate dibasic | Fisher Scientific | BP331-500 | Sodium Phosphate Dibasic Heptahydrate (Colorless-to-White Crystals), Fisher BioReagents |
| Sodium phosphate monobasic | Fisher Scientific | BP330-500 | Sodium Phosphate Monobasic Monohydrate (Colorless-to-white Crystals), Fisher BioReagents |
| Syringe | Hamilton | 81065 | 100 µL, Model 1710 RN SYR, Small Removable NDL, 22s ga, 2 in, point style 3 |
| Syringe pump | KD Scientific | 788101 | Legato 101 syringe pump |
| Trap C18 column | Thermo Scientific | 160454 | Thermo Scientific Acclaim PepMap 100 C18 HPLC Columns |
| Tris | Sigma Aldrich | 252859 | Tris(hydroxymethyl)aminomethane |
| Trypsin | Promega | V5111 | Sequencing Grade Modified Trypsin |
| UV plano convex lens | Edmund Optics | 84-285 | 30 mm Dia. x 120 mm FL Uncoated, UV Plano-Convex Lens |
References
- Kaur, P., Kiselar, J., Yang, S., Chance, M. R. Quantitative protein topography analysis and high-resolution structure prediction using hydroxyl radical labeling and tandem-ion mass spectrometry (MS). Molecular & Cellular Proteomics. 14 (4), 1159-1168 (2015).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Buxton, G. V., Greenstock, C. L., Helman, W. P., Ross, A. B. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O- in Aqueous Solution. Journal of Physical and Chemical Reference Data. 17 (2), 513 (1988).
- Xu, G., Chance, M. R. Radiolytic modification and reactivity of amino acid residues serving as structural probes for protein footprinting. Analytical Chemistry. 77 (14), 4549-4555 (2005).
- Sharp, J. S., Tomer, K. B. Effects of anion proximity in peptide primary sequence on the rate and mechanism of leucine oxidation. Analytical Chemistry. 78 (14), 4885-4893 (2006).
- Huang, W., Ravikumar, K. M., Chance, M. R., Yang, S. Quantitative mapping of protein structure by hydroxyl radical footprinting-mediated structural mass spectrometry: a protection factor analysis. Biophysical Journal. 108 (1), 107-115 (2015).
- Xie, B., Sood, A., Woods, R. J., Sharp, J. S. Quantitative protein topography measurements by high resolution hydroxyl radical protein footprinting enable accurate molecular model selection. Scientific Reports. 7 (1), 4552 (2017).
- Li, Z., et al. High structural resolution hydroxyl radical protein footprinting reveals an extended Robo1-heparin binding interface. Journal of Biological Chemistry. 290 (17), 10729-10740 (2015).
- Li, X., et al. Structural analysis of the glycosylated intact HIV-1 gp120-b12 antibody complex using hydroxyl radical protein footprinting. Biochemistry. 56 (7), 957-970 (2017).
- Li, K. S., Shi, L., Gross, M. L. Mass spectrometry-based fast photochemical oxidation of proteins (FPOP) for higher order structure characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-834 (2019).
- Roush, A. E., Riaz, M., Misra, S. K., Weinberger, S. R., Sharp, J. S. Intrinsic buffer hydroxyl radical dosimetry using Tris(hydroxymethyl)aminomethane. Journal of the American Society for Mass Spectrometry. 31 (2), 169-172 (2020).
- Xie, B., Sharp, J. S. Hydroxyl radical dosimetry for high flux hydroxyl radical protein footprinting applications using a simple optical detection method. Analytical Chemistry. 87 (21), 10719-10723 (2015).
- Niu, B., Zhang, H., Giblin, D., Rempel, D. L., Gross, M. L. Dosimetry determines the initial OH radical concentration in fast photochemical oxidation of proteins (FPOP). Journal of the American Society for Mass Spectrometry. 26 (5), 843-846 (2015).
- Niu, B., et al. Incorporation of a reporter peptide in FPOP compensates for adventitious scavengers and permits time-dependent measurements. Journal of the American Society for Mass Spectrometry. 28 (2), 389-392 (2017).
- Garcia, N. K., Sreedhara, A., Deperalta, G., Wecksler, A. T. Optimizing hydroxyl radical footprinting analysis of biotherapeutics using internal standard dosimetry. Journal of the American Society for Mass Spectrometry. 31 (7), 1563-1571 (2020).
- Sharp, J. S., Misra, S. K., Persoff, J. J., Egan, R. W., Weinberger, S. R. Real time normalization of fast photochemical oxidation of proteins experiments by inline adenine radical dosimetry. Analytical Chemistry. 90 (21), 12625-12630 (2018).
- Zhang, B., Cheng, M., Rempel, D., Gross, M. L. Implementing fast photochemical oxidation of proteins (FPOP) as a footprinting approach to solve diverse problems in structural biology. Methods. 144, 94-103 (2018).
- Konermann, L., Stocks, B. B., Czarny, T. Laminar flow effects during laser-induced oxidative labeling for protein structural studies by mass spectrometry. Analytical Chemistry. 82 (15), 6667-6674 (2010).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast photochemical oxidation of protein footprints faster than protein unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Li, K. S., et al. Hydrogen-Deuterium exchange and hydroxyl radical footprinting for mapping hydrophobic interactions of human bromodomain with a small molecule Inhibitor. Journal of the American Society for Mass Spectrometry. 30 (12), 2795-2804 (2019).
- Espino, J. A., Jones, L. M. Illuminating biological interactions with in vivo protein footprinting. Analytical Chemistry. 91 (10), 6577-6584 (2019).
- Charvatova, O., et al. Quantifying protein interface footprinting by hydroxyl radical oxidation and molecular dynamics simulation: application to galectin-1. Journal of the American Society for Mass Spectrometry. 19 (11), 1692-1705 (2008).
- Gau, B., Garai, K., Frieden, C., Gross, M. L. Mass spectrometry-based protein footprinting characterizes the structures of oligomeric apolipoprotein E2, E3, and E4. Biochemistry. 50 (38), 8117-8126 (2011).
- Gau, B. C., Chen, J., Gross, M. L. Fast photochemical oxidation of proteins for comparing solvent-accessibility changes accompanying protein folding: Data processing and application to barstar. Biochimica et Biophysica Acta. 1834 (6), 1230-1238 (2013).
- Garrison, W. M. Reaction mechanisms in the radiolysis of peptides, polypeptides, and proteins. Chemical Reviews. 87 (2), 381-398 (1987).
- Xu, G., Chance, M. R. Radiolytic modification of sulfur-containing amino acid residues in model peptides: fundamental studies for protein footprinting. Analytical Chemistry. 77 (8), 2437-2449 (2005).
- Xu, G., Chance, M. R. Radiolytic modification of acidic amino acid residues in peptides: probes for examining protein-protein interactions. Analytical Chemistry. 76 (5), 1213-1221 (2004).
- Xu, G., Takamoto, K., Chance, M. R. Radiolytic modification of basic amino acid residues in peptides: probes for examining protein-protein interactions. Analytical Chemistry. 75 (24), 6995-7007 (2003).
- Misra, S. K., Orlando, R., Weinberger, S. R., Sharp, J. S. Compensated hydroxyl radical protein footprinting measures buffer and excipient effects on conformation and aggregation in an adalimumab biosimilar. AAPS Journal. 21 (5), 87 (2019).
- Simmons, D. A., Konermann, L. Characterization of transient protein folding intermediates during myoglobin reconstitution by time-resolved electrospray mass spectrometry with on-line isotopic pulse labeling. Biochemistry. 41 (6), 1906-1914 (2002).
- Vahidi, S., Konermann, L. Probing the time scale of FPOP (fast photochemical oxidation of proteins): radical reactions extend over tens of milliseconds. Journal of the American Society for Mass Spectrometry. 27 (7), 1156-1164 (2016).
- Chance, M. R. Unfolding of apomyoglobin examined by synchrotron footprinting. Biochemical and Biophysical Research Communications. 287 (3), 614-621 (2001).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107 (8), 3514-3543 (2007).
- Zhang, Y., Rempel, D. L., Zhang, H., Gross, M. L. An improved fast photochemical oxidation of proteins (FPOP) platform for protein therapeutics. Journal of the American Society for Mass Spectrometry. 26 (3), 526-529 (2015).
- Cornwell, O., Radford, S. E., Ashcroft, A. E., Ault, J. R. Comparing hydrogen deuterium exchange and fast photochemical oxidation of proteins: a structural characterisation of wild-type and ΔN6 β(2)-microglobulin. Journal of the American Society for Mass Spectrometry. 29 (2), 2413-2426 (2018).
- Xie, B., Sharp, J. S. Relative Quantification of sites of peptide and protein modification using size exclusion chromatography coupled with electron transfer dissociation. Journal of the American Society for Mass Spectrometry. 27 (8), 1322-1327 (2016).
- Srikanth, R., Wilson, J., Vachet, R. W. Correct identification of oxidized histidine residues using electron-transfer dissociation. Journal of Mass Spectrometry. 44 (5), 755-762 (2009).
- Li, X., Li, Z., Xie, B., Sharp, J. S. Improved identification and relative quantification of sites of peptide and protein oxidation for hydroxyl radical footprinting. Journal of the American Society for Mass Spectrometry. 24 (11), 1767-1776 (2013).
- Li, X., Li, Z., Xie, B., Sharp, J. S. Supercharging by m-NBA Improves ETD-Based Quantification of Hydroxyl Radical Protein Footprinting. Journal of the American Society for Mass Spectrometry. 26 (8), 1424-1427 (2015).
- Khaje, N. A., Sharp, J. S. Rapid quantification of peptide oxidation isomers from complex mixtures. Analytical Chemistry. 92 (5), 3834-3843 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved