Method Article
التلاعب بالخلايا الجذعية العصبية والخلايا العصبية في شرائح الدماغ باستخدام الحقن المجهري الروبوتي
* These authors contributed equally
In This Article
Summary
يوضح هذا البروتوكول استخدام منصة روبوتية للدمج المجهري في الخلايا الجذعية العصبية والخلايا العصبية في شرائح الدماغ. هذه التقنية متعددة الاستخدامات وتوفر طريقة لتتبع الخلايا في الأنسجة ذات الدقة المكانية العالية.
Abstract
سؤال مركزي في علم الأعصاب التنموي هو كيف تشكل الخلايا الجذعية والنسل العصبية الدماغ. للإجابة على هذا السؤال، يحتاج المرء إلى تسمية، والتلاعب، واتباع الخلايا الفردية في أنسجة الدماغ مع ارتفاع القرار مع مرور الوقت. هذه المهمة صعبة للغاية بسبب تعقيد الأنسجة في الدماغ. لقد طورنا مؤخرا الروبوت، التي توجه إبرة الحقن المجهري في أنسجة الدماغ عند الاستفادة من الصور المكتسبة من المجهر لتسليم كميات femtoliter من الحل في خلايا واحدة. تزيد العملية الروبوتية مما يؤدي إلى العائد العام الذي هو أمر أكبر من حجم الحقن المجهري اليدوي ويسمح لوضع العلامات الدقيقة والتلاعب المرن للخلايا الفردية في الأنسجة الحية. مع هذا، يمكن للمرء أن microinject مئات الخلايا داخل شريحة organotypic واحد. يوضح هذا المقال استخدام الروبوت الحقن المجهري للمجهر الآلي للخلايا السلف العصبي والخلايا العصبية في شرائح أنسجة الدماغ. على نطاق أوسع، يمكن استخدامه على أي نسيج ظهاري يضم سطح التي يمكن الوصول إليها من قبل ماصة. بمجرد إعدادها ، يمكن للروبوت الحقن المجهري تنفيذ 15 أو أكثر من الحقن المجهري في الدقيقة الواحدة. الروبوت الحقن المجهري بسبب الإنتاجية و versality سيجعل الحقن المجهري تقنية التلاعب بالخلايا عالية الأداء واضحة على نطاق واسع لاستخدامها في الهندسة الحيوية، والتكنولوجيا الحيوية، والفيزياء الحيوية لإجراء تحليلات خلية واحدة في شرائح الدماغ organotypic.
Introduction
يصف هذا البروتوكول استخدام الروبوت لاستهداف الخلايا الفردية ومعالجتها في شرائح أنسجة الدماغ ، مع التركيز بشكل خاص على الخلايا الجذعية العصبية والخلايا العصبية. وقد تم تطوير الروبوت لمعالجة مسألة مركزية في علم الأعصاب التنموية، وهذا هو كيف الجذعية العصبية والخلايا السلف تسهم في تكوين الدماغ1,2,3,4,5. للإجابة على هذا السؤال، يحتاج المرء إلى تسمية وتتبع الخلايا الجذعية العصبية الفردية ومتابعة تقدم نسبها مع مرور الوقت لربط سلوك الخلية الواحدة بتحول الأنسجة. ويمكن تحقيق ذلك بطرق مختلفة، على سبيل المثال، عن طريق كهربية أنسجة المخ في الرحم أو عن طريق وضع علامة على خلية واحدة باستخدام يموت الدهني. على الرغم من قوة، تفتقر هذه الأساليب دقة دقيقة خلية واحدة (الكهربائي) و / أو إمكانية التعامل مع الفضاء داخل الخلايا (صبغة lipophilic). تم تطوير الحقن المجهري في خلايا واحدة للتغلب على هذا التحدي6,7,8. خلال الحقن الدقيق ، يتم إدخال ماصة لفترة وجيزة في خلية واحدة داخل نسيج سليم تحت ضغط لصغر حجم femtoliter من الكواشف9. لقد سبق وصفنا إجراء يدوي للميكونات الخلايا الجذعية العصبية في الأنسجة العضوية(الشكل 1A)10,11. يعتمد الحقن المجهري في الخلايا الجذعية العصبية على استخدام ميكروبيبيت يتم إدخاله في الخلايا الجذعية العصبية الفردية لحقن محلول يحتوي على صبغة فلورية ، إلى جانب جزيئات أخرى ذات أهمية. يتم تحقيق الاستهداف الانتقائي للخلايا الجذعية العصبية عن طريق الاقتراب من التيتنسفالون النامية عبر سطح البطين (أو البطين ، انظر الرسوم المتحركة في الشكل 1A)، التي يتم تشكيلها من قبل غشاء البلازما apical من السلفة apical (الرسوم المتحركة في الشكل 1A). يجب تكرار هذه العملية لكل خلية يرغب المجرب في حقنها. علاوة على ذلك ، يعتمد نجاح الحقن المجهري على التحكم الدقيق في عمق ومدة حقن الدقيق في الأنسجة. وهكذا، على الرغم من المزايا الفريدة، فإن الحقن المجهري اليدوي أمر ممل للغاية ويتطلب ممارسة كبيرة لأداء الإنتاجية والإنتاجية المعقولة، مما يجعل من الصعب استخدام هذه التقنية بطريقة قابلة للتطوير. للتغلب على هذا القيد، قمنا بتطوير مؤخرا الروبوت صورة موجهة، ولصناعة السيارات12 (أو الروبوت الحقن المجهري) التي يمكن أن تؤدي تلقائيا microinjections في خلايا واحدة.
الروبوت microinjection يجعل من استخدام التصوير المجهري وخوارزميات رؤية الكمبيوتر لاستهداف مواقع محددة بدقة في الفضاء 3-D داخل الأنسجة للمجهر (الشكل 1B). يمكن بناء الروبوت الحقن المجهري من خلال إجراء تعديلات بسيطة نسبيا على الإعداد microinjection القائمة. يظهر المخطط العام للروبوت microinjection في الشكل 1C. يتم تركيب ماصة في حامل ماصة تعلق على المتلاعب ثلاثة محاور. يتم استخدام كاميرا المجهر للحصول على صور للأنسجة وإبرة الحقن المجهري. ويستخدم نظام مخصص لتنظيم الضغط للسيطرة على الضغط داخل الماصات ويستخدم micromanipulator للبرمجة للسيطرة على موقف ماصة ناخنة الصغرى. وتستخدم صور الكاميرا للأنسجة وماصة الحقن المجهري لتحديد الموقع المكاني لتلميح ماصات الحقن المجهري والمواقع التي يلزم فيها إجراء الحقن المجهري. ثم يقوم البرنامج بحساب المسارات اللازمة لتحريك الماصات داخل الأنسجة. يتم التحكم في جميع الأجهزة من قبل البرنامج الذي قمنا بتطويره من قبل. جميع البرامج مكتوبة بلغة الترميز (على سبيل المثال، بايثون واردوينو) ويمكن تنزيلها من https://github.com/bsbrl/Autoinjector مع التعليمات. واجهة المستخدم الرسومية (GUI) يسمح للمستخدم لتصوير الأنسجة وmicropipette ، وتخصيص مسار الحقن المجهري. ويمكن إنشاء نظامنا باستخدام تعديلات بسيطة نسبيا على مجهر مقلوب مجهزة برايتفيلد ومرشحات الفلورسينسي epi.
أولا، نحن نقدم تعليمات بشأن إعداد شرائح الأنسجة العضوية في الدماغ للخَرَن المجهري. ثم يوضح البروتوكول بدء الروبوت الحقن المجهري متبوعاً بخطوات تحضيرية، مثل معايرة حركة الماصات، التي يجب القيام بها قبل الحقن المجهري. ويتبع ذلك تحديد المعلمات الحقن. بعد ذلك، يمكن للمستخدم تحديد المسار المستخدم من قبل الروبوت الحقن المجهري وبدء إجراء الحقن. يمكن الاحتفاظ النسيج microinjected (في هذه الحالة شرائح الأنسجة العضوية في الدماغ) في الثقافة لفترات زمنية مختلفة اعتمادا على التصميم التجريبي10،11. يمكن معالجة الأنسجة لمتابعة ودراسة هوية ومصير الخلايا المحقونة وذريتها. بدلا من ذلك، يمكن اتباع الخلايا المجهرية باستخدام التصوير الحي. في نطاق هذا البروتوكول، ونحن نبرهن على استخدام الروبوت تلقائيا microinjection الخلايا السلف العصبي في شرائح organotypic من الماوس E14.5 الظهرية التيفينات. الروبوت هو أكثر قدرة على الحقن المجهري في الخلايا العصبية حديثي الولادة في تيلفينسيفالون الماوس، وكذلك في تيلنفالون الجنين البشري12.
باختصار، نحن وصف منصة الروبوتية التي يمكن استخدامها لمتابعة ومعالجة الخلايا الفردية في الأنسجة. منصة يجعل من استخدام الضغط، وبالتالي، هو تنوعا للغاية فيما يتعلق بالطبيعة الكيميائية للمركب لحقن. وبالإضافة إلى ذلك، يمكن تكييفها مع الخلايا المستهدفة غير الخلايا الجذعية. ونتوقع أن يكون نظامنا متكيفا بسهولة مع النظم النموذجية الأخرى أيضا.
Protocol
أجريت جميع الدراسات الحيوانية وفقا للتشريعات الألمانية لرعاية الحيوان، وتم الحصول على التراخيص اللازمة من اللجنة الأخلاقية الإقليمية للتجريب على الحيوانات في دريسدن، ألمانيا (Tierversuchskommission، Landesdirektion Dresden). تم إعداد شرائح Organotypic من E14.5 أو E16.5 C57BL/6 ماوس تلينففالون جنيني (مختبرات جانفييه).
1. تركيب البرمجيات
- اتبع الإرشادات لتثبيت البرنامج من https://github.com/bsbrl/Autoinjector.
2 - إعداد الكواشف والمواص
- Agarose: إعداد 3٪ agarose عن طريق حل منفصل 3 غرام من أغاروز واسعة النطاق و 3 ز منخفضة ذوبان نقطة agarose في 100 مل من خلية ثقافة الصف برنامج تلفزيوني في اثنين من زجاجات زجاجية 200 مل منفصلة، على التوالي. يُحفظ في درجة حرارة الغرفة لمدة تصل إلى 3 أشهر.
- حل التيرود: تذوب 1 غرام من بيكربونات الصوديوم وملح التيرود (استخدام محتوى زجاجة كاملة) و 13 مل من 1 M HEPES في 1 لتر من الماء المقطر. ضبط درجة اله pH إلى 7.4. تصفية الحل من خلال مرشح 0.2 ميكرومتر زجاجة أعلى.
- شريحة ثقافة المتوسطة (SCM): إضافة 10 مل من مصل الفئران، 1 مل من 2 مل الجلوتامين, 1 مل البنسلين-ستريبتوميسين (100x), 1 مل من الملحق N-2 (100x), 2 مل من الملحق B27 (50x) و 1 مل من HEPES (pH 7.3) العازلة في 84 مل من الوسط العصبي. Aliquot 5 مل من SCM في أنابيب 15 مل. يُخزن عند -20 درجة مئوية.
- CO2- مصغرة المتوسطة المستقلة (CIMM): إعداد 5x DMEM تعديل محلول منخفض الجلوكوز (دون الحمراء الفينول) عن طريق حل مسحوق في 200 مل من الماء المقطر. محلول تصفية من خلال 0.2 ميكرومتر زجاجة أعلى مرشح (لمسحوق DMEM، واستخدام محتوى زجاجة كاملة). لإعداد 100 مل من CIMM، مزيج 20 مل من 5x DMEM حل معدلة، 1 مل من العازلة HEPES، 1 مل من الملحق N2 (100x)، 2 مل من الملحق B27 (50x)، 1 مل من البنسلين-ستربتوميسين (100x)، 1 مل من 2 مل الجلوتامين و 74 مل من الماء المقطر. تخزين الحل عند 4 درجة مئوية.
- العازلة إعادة تشكيل: إعداد العازلة إعادة تشكيل عن طريق حل 262 mM NaHCO3،0.05 N NaOH، 200 mM HEPES في الماء المقطر. تعقيم الحل عن طريق الترشيح من خلال زجاجة أعلى 0.22 μm مرشح النظام في زجاجة معقمة. Aliquot 500 ميكرولتر من عازلة إعادة التشكيل إلى أنابيب صغيرة مركزية. يُخزن عند 4 درجة مئوية.
- مخزون صبغة الحقن الدقيق: قم بحل الفلورسنت المسمى Dextran في الماء المقطر المجاني RNase (التركيز النهائي 10 ميكروغرام/ميكرولتر). إعداد 5 ميكرولتر aliquots وتخزينها في -20 درجة مئوية حتى الاستخدام.
- سحب ماصات الحقن المجهري من الشعيرات الدموية الزجاجي borosilicate (1.2 ملم القطر الخارجي، 0.94 ملم القطر الداخلي) باستخدام جرة micropipette. حماية الماصات من الغبار. لا تخزن الماصات لأكثر من 2 – 3 أيام. لهذه التجربة، كانت المعلمات سحب الحرارة: درجة حرارة المنحدر +1 – 5; سحب: 100; VEL: 110؛ ديل: 100. الحرارة وVEL هي المعلمات التي تؤثر على الشكل الأكبر والحجم من الماصات.
ملاحظة: يحتوي ماصة الحقن المجهري الأمثل على طرف طويل ومرن، لتجنب تلف الخلايا أثناء الحقن المجهري.
3. إعداد شريحة الأنسجة
- تذوب في 3٪ نطاق واسع agarose باستخدام فرن الميكروويف قبل تشريح أنسجة الدماغ. لا تدع agarose ترسيخ عن طريق حفظ في حمام مائي في 37 درجة مئوية قبل تضمين. تأكد من حماية الماصات من الغبار. لا تخزن الماصات لأكثر من 2 – 3 أيام.
- ذوبان aliquot من SCM ودافئة 10 - 12 مل CIMM و 20 مل من حل تيرود إلى 37 درجة مئوية باستخدام حمام مائي.
- خلط التتبع الفلورسنت (Dextran-3000 أو Dextran-10000-Alexa مترافق؛ التركيز النهائي 5 – 10 ميكروغرام/ميكرولتر) مع المواد الكيميائية الأخرى التي سيتم حقنها. الطرد المركزي حل الحقن المجهري في 16، 000 س ز لمدة 30 دقيقة في 4 درجة مئوية. جمع المناط ونقلها إلى أنبوب جديد. الحفاظ على حل الحقن المجهري على الجليد حتى الاستخدام.
- استخدم الرؤوس من E13.5 – أجنة الماوس E16.5 لإعداد شرائح الأنسجة العضوية من التيبينسيفالون. إزالة الجلد وفتح الجمجمة باستخدام ملقط، والتحرك على طول خط الوسط. تشريح الدماغ الجنيني من الجمجمة المفتوحة وإزالة السحايا التي تغطي أنسجة الدماغ بدءا من الجانب البطني من الدماغ. ترك الدماغ كامل تشريح في حل تيرود على كتلة التدفئة 37 °C.
ملاحظة: يجب أن يتم تنفيذ كافة خطوات التشريح الموضحة في 3.4 في حل تيرود مسبقًا. - صب مجموعة واسعة من agarose ذاب في قالب التضمين المتاح. عندما يتم تبريد agarose إلى 38 - 39 درجة مئوية، نقل بعناية العقول (بحد أقصى 4) في ذلك باستخدام ماصة باستور. دائما استخدام نصائح قطع لهذه الخطوة.
- يحرك agarose حول الأنسجة إما باستخدام ملعقة أو زوج من ملقط dumont #1 دون لمس الأنسجة. دع الأاغروز يتوطد في درجة حرارة الغرفة. بمجرد أن يتوطد agarose ، تقليم agarose الزائدة المحيطة الأنسجة.
- املأ علبة المخزن المؤقت بـ PBS. توجيه الدماغ مع محور روسترو-dal من الأنسجة عمودي على صينية (استخدام معلما المصابيح الشمية، التي تمثل الجزء الأكثر من الدماغ. قطع 250 μm شرائح باستخدام هزاز.
- املأ طبق بيتري 3.5 سم مع 2 مل من الوسائط المُؤرَّة مسبقًا. باستخدام ماصة باستور البلاستيكية، نقل شرائح (10 -15) إلى هذا الطبق. بمجرد الانتهاء ، تحول طبق بيتري مع الشرائح إلى حاضنة ثقافة الشريحة. حافظ على الشرائح عند درجة حرارة 37 درجة مئوية في جو رطب يحتوي على 40% O2 / 5% CO2 / 55% N2 حتى الاستخدام.
4. الحقن المجهري
- قم بتشغيل الكمبيوتر والمجهر وكاميرا المجهر والمتلاعبين وتلاعب الضغط ومستشعر الضغط. تحميل التطبيق عن طريق النقر على الملف "launchapp.py" في المجلد الرئيسي الذي تم تحميله من GitHub وتحديد إعدادات الجهاز في شاشة منبثقة (انظر الخطوة 1.1 للحصول على تعليمات التثبيت).
- إنشاء ضغط خارجي لمنع انسداد غير المرغوب فيها قبل غمر الماصات في المحلل. لتطبيق الضغط على الماصات، قم بتمرير شريط ضغط التعويض إلى 24 - 45% وانقر على تعيين القيم. بعد ذلك، ضبط الضغط إلى ضغط كاف عن طريق تحويل مقبض صمام الضغط الميكانيكي إلى 1 – 2 PSI (69 – 138 mbar) كما هو مبين من قبل جهاز استشعار الضغط.
- نقل شرائح إلى 3.5 سم طبق بيتري التي تحتوي على 2 مل من CIMM قبل تدفئة. ضع الشرائح لتكون صغيرة في وسط طبق بيتري. نقل طبق بيتري إلى مرحلة الحقن المجهري المُحمّى (37 درجة مئوية).
- قم بتحميل ماصة الحقن المجهرية مع 1.4 -1.6 ميكرولتر من محلول ميكروجينجينكت (من الخطوة 3.3) باستخدام ماصة بلاستيكية طويلة التلميح. إدراج ماصة الحقن الدقيق على حامل الماصات.
- باستخدام أدنى التكبير على المجهر، وجلب شريحة في التركيز وتوجيه micropipette إلى هذا المجال من الرؤية (FOV) بحيث يتم التركيز على نفس الطائرة كما الهدف شريحة. تبديل إخراج المجهر إلى الكاميرا لرؤية FOV في التطبيق.
- انقر فوق زر التكبير في أعلى يسار الواجهة لبدء معايرة الجهاز. سيتم مطالبة إطار لتحديد التكبير. حدد التكبير 10x، أو مهما كان التكبير يتم تعيين العدسة إلى (على سبيل المثال، 4x، 10x، 20x، 40x) واضغط موافق. البرنامج يفترض عدسة الهدف الداخلي هو 10x (التكبير عدسة الهدف الأكثر شيوعا).
- إعادة تركيز رأس ماصة باستخدام عجلة ميكرومترية من المجهر وانقر على رأس ماصة مع المؤشر. بعد ذلك، اضغط على زر الخطوة 1.1 واضغط على موافق في النافذة المنبثقة. سوف تتحرك الماصة في اتجاه Y. انقر على طرف الماصة واضغط على الزر الخطوة 1.2. وأخيرا، أدخل 45 في مربع زاوية الماصات واضغط على زاوية تعيين.
- أدخل المعلمات المطلوبة في لوحة عناصر التحكم التلقائية في الحقن المجهري. لمجهرية في السلفات apical تعيين مسافة الحقن إلى 20 – 40 ميكرومتر وعمق إلى 10 – 15 ميكرومتر. لمجهر في الخلايا العصبية تعيين مسافة الحقن 30 – 40 ميكرومتر من الجانب القاعدي, وعمق إلى 10 – 30 μm اعتمادا على ما يجري استهدافه. دائماً ما تضبط السرعة إلى 100%. انقر فوق تعيين القيم.
ملاحظة: المسافة النهج هو المسافة التي تسحبها الماصات من الأنسجة قبل الانتقال إلى مسافة الحقن التالية ، العمق هو العمق في الأنسجة التي يذهب إليها الحقن المجهري ، والتباعد هو المسافة على طول الخط الفاصل بين الحقن التسلسلي ، والسرعة هي سرعة الماصة في ميكروم / س. - انقر على زر رسم الحافة واسحب المؤشر على طول المسار المطلوب في النافذة المنبثقة لتحديد مسار الحقن. بالنسبة للخلايا الجذعية السلف الدقيقة ، يتم استهداف الجانب البطني من سطح التيلفينفالون كما هو موضح في الشكل 2A. جلب ماصة إلى بداية الخط وانقر على طرف من الماصات. انقر فوق تشغيل مسار لبدء microinjecting. كرر هذه الخطوة لكل طائرة من حقن المستهدفة (عادة ما يتم 3 – 4 طائرات مع 40 – 75 حقن لكل طائرة).
5. زراعة الأنسجة وشريحة الأنسجة معالجة ل المناعةfluorescence
- تحضير خليط الكولاجين (1.5 ملغ / مل): إلى أنبوب إضافة 1.25 مل من حل مصفوفة, 0.5 مل من الماء المقطر, 0.5 مل من 5x DMEM-F12 حل و 0.25 مل من العازلة إعادة تشكيل. يبقيه على الجليد حتى استخدامها.
- الحصول على طبق بيتري التي تحتوي على شرائح microinjected من شريحة ثقافة الحاضنة غرفة غمر شرائح في خليط الكولاجين.
- نقل شرائح جنبا إلى جنب مع 200 - 300 ميكرولتر من خليط الكولاجين في بئر 14 مم من طبق 35 ملم من القاع الزجاجي. تأكد من أن يتم تغطية شرائح في أقل جدا من الكولاجين. هذا الإعداد يسمح للظروف المثلى للمواد الغذائية وامتصاص الأوكسجين.
- توجيه الشرائح مع ضمان وجود مساحة كافية بين الشرائح باستخدام اثنين من أزواج من ملقط. احتضان طبق بيتري لمدة 5 دقائق في 37 درجة مئوية باستخدام كتلة التدفئة للسماح للكولاجين لترسيخ. خذ بعين الاعتبار هذا الوقت كما t = 0 من ثقافة شريحة.
- نقل طبق بيتري مرة أخرى إلى حاضنة ثقافة شريحة لمدة 40 دقيقة إضافية. ثم إضافة 2 مل من SCM مسبقاً. يتم الاحتفاظ شرائح في الثقافة حتى نقطة الوقت المطلوب.
- تأخذ شرائح من شريحة الحاضنة ثقافة وpirate SCM. اغسل شرائح الكولاجين المضمروسة مع PBS 1x. إضافة 4٪ (wt/vol) شبهformaldehyde (في 120 mM الفوسفات العازلة، وhH 7.4) وترك الأنسجة في RT لمدة 30 دقيقة. ثم نقله إلى 4 درجة مئوية للسماح لتثبيت بين عشية وضحاها.
- التعرق حل paraformaldehyde في اليوم التالي وأداء 1x PBS يغسل. لإزالة الشرائح من الكولاجين، استخدم زوجين من ملقط لاستخراج شرائح بلطف تحت منظار مجسم.
- استخدام الميكروويف لإذابة 3٪ (wt / vol) نقطة انصهار منخفضة agarose لمعالجة شرائح microinjected. صب agarose ذاب في قالب التضمين المتاح والسماح لها باردة إلى حوالي 38 – 39 درجة مئوية.
- نقل شرائح الأنسجة من الخطوة 5.7 في هذا القالب الذي يحتوي على أغاروز منخفض الذوبان باستخدام ماصة باستور البلاستيكية. تأكد من أن الجانب المعبّر من الشريحة أعلى وسطح البطيني يواجه لأسفل. إذا لزم الأمر توجيه وفقا لذلك. دع agarose يبرد إلى RT لترسيخ.
- تقليم agarose اضافية المحيطة شرائح. قم بتوجيه كتلة agarose لضمان أن السطح المقطوع يوازي شفرة القطع في الاهتزاز. باستخدام هزاز، وقطع 50 ميكرومتر أقسام سميكة.
- ملء طبق 24 جيدا مع 1X برنامج تلفزيوني. نقل المقاطع في هذا الطبق باستخدام فرشاة الطلاء غرامة تلميح. إجراء الفلورا المناعية وفقا للبروتوكولات القياسية.
النتائج
الحقن المجهري يخدم الغرض من تتبع والتلاعب الخلايا الجذعية العصبية واحدة وذريتها في الأنسجة الحية ومتابعة تطور النسب في بيئة فسيولوجية. في هذه المقالة، لقد أظهرنا استخدام الروبوت microinjection لاستهداف وميكروتينجيكينج تلقائيا شرائح organotypic من الفأر telecephalon. يوضح الشكل 2 الصور التمثيلية للخلايا السلف المحقونة بنجاح ويوضح الشكل 3 الخلايا العصبية الوليدة المحقونة. عندما حقن مع ديكستران اليكسا-488 (أو اليكسا A555) صبغ، تظهر الخلايا مليئة تماما مع الصبغة. أما بالنسبة لذروة apical(الشكل 2) التصوير confocal يسمح إعادة بناء مع ارتفاع دقة المكانية مورفولوجيا الخلية، ووجود -أو غياب- من الملحقات apical والباطن، والجمع بين الاستعلام مورفولوجية مع التعبير علامة. من خلال الجمع بين هذه المعايير، يمكن للمستخدم تعيين مصير خلية محددة للخلايا microinjected وذريتها. أما بالنسبة للحقن العصبي، يمكن للمستخدم إعادة بناء مورفولوجيا الخلايا العصبية، بما في ذلك هيكل وميزات التشعب apical ومحور عصبي. يمكن أن توفر الحقن الآلي أعلى بكثير من الإنتاجية بالمقارنة مع microinjection اليدوي(الشكل 2B). علاوة على ذلك ، تؤكد تسمية EdU أن قابلية الخلية للتطبيق لا تتأثر بالأتمتة(الشكل 2C). حفظ شريحة organotypic في الثقافة يسمح التالية تطور النسب من الخلايا microinjected (أظهرنا 4 - 24h في الشكل 2D). إذا كان الحل الحقن المجهري يحتوي على مادة وراثية (الحمض النووي، مرنا، CRISPR-Cas9 أدلة) أو البروتينات المؤتلفة، ثم يسمح هذا دراسة إذا وكيف يتأثر تطور النسب من التلاعب.
الحقن المجهري في الخلايا الجذعية العصبية واحدة في الأنسجة يوفر ممتازة دقة خلية واحدة ولهذا السبب تم استخدامه لتشريح بيولوجيا الخلية من تطور الخلايا الجذعية العصبية والانتقال مصير(الشكل 3A). الحقن المجهري يسمح بتسليم خليط معقد من المواد الكيميائية. ونحن في السابق استخدام هذه الميزة لدراسة اقتران تقاطعي في الخلايا السلف العصبية عن طريق خلط الفجوة تقاطع نفاذية مع الفجوة اصباغ الفلورسنت غير قابلة للاختزالالفجوة 12. نحن تمديد العمل السابق من خلال دراسة اقتران تقاطع في الخلايا العصبية حديثي الولادة, عن طريق حقن لوسيفر الأصفر جنبا إلى جنب مع Dextran-A555(الشكل 3B). كما هو مبين في الشكل 3B، وتقترن نسبة من الخلايا العصبية الهرمية حديثي الولادة عبر تقاطعات الفجوة إلى الخلايا العصبية المجاورة. هذه الملاحظة تتفق مع فكرة أن الخلايا العصبية غير ناضجة التواصل عبر الفجوة تقاطع13,14. وعلاوة على ذلك، فإن استهداف الخلايا العصبية يظهر أن استخدام الروبوت الحقن المجهري يمكن تعميمه على عدة أنواع من الخلايا في الدماغ الثدييات النامية. هذا الإعداد التجريبي سيكون مفيدا لتشريح بيولوجيا الخلية من الخلايا العصبية في الأنسجة، على سبيل المثال عن طريق تقديم oligopeptides محددة لتتداخل مع البروتين البروتين التفاعلات.
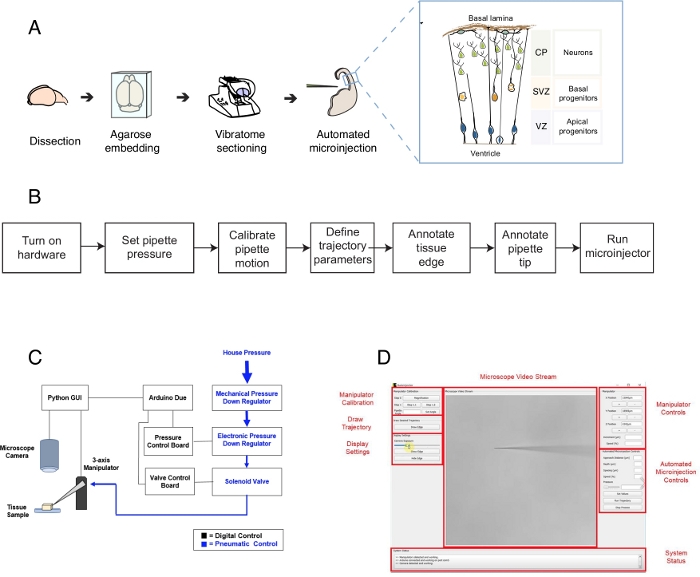
الشكل 1: إعداد وبروتوكول الحقن المجهري الآلي. (أ)البروتوكول العام لإعداد الأنسجة والصغرى الآلي باستخدام الروبوت الحقن المجهري. الحق inset: الرسوم المتحركة التخطيطية من الماوس Telencephalon المستهدفة للمجهر في هذا البروتوكول. (B) مخطط انسيابي من خطوات الحقن المجهري الآلي. (C) التخطيطي للالأجهزة الروبوت microinjection. (د)واجهة المستخدم الرسومية (GUI) من البرنامج المستخدم للسيطرة وتشغيل الروبوت microinjection. وهذا الرقم مقتبس من المرجع12. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
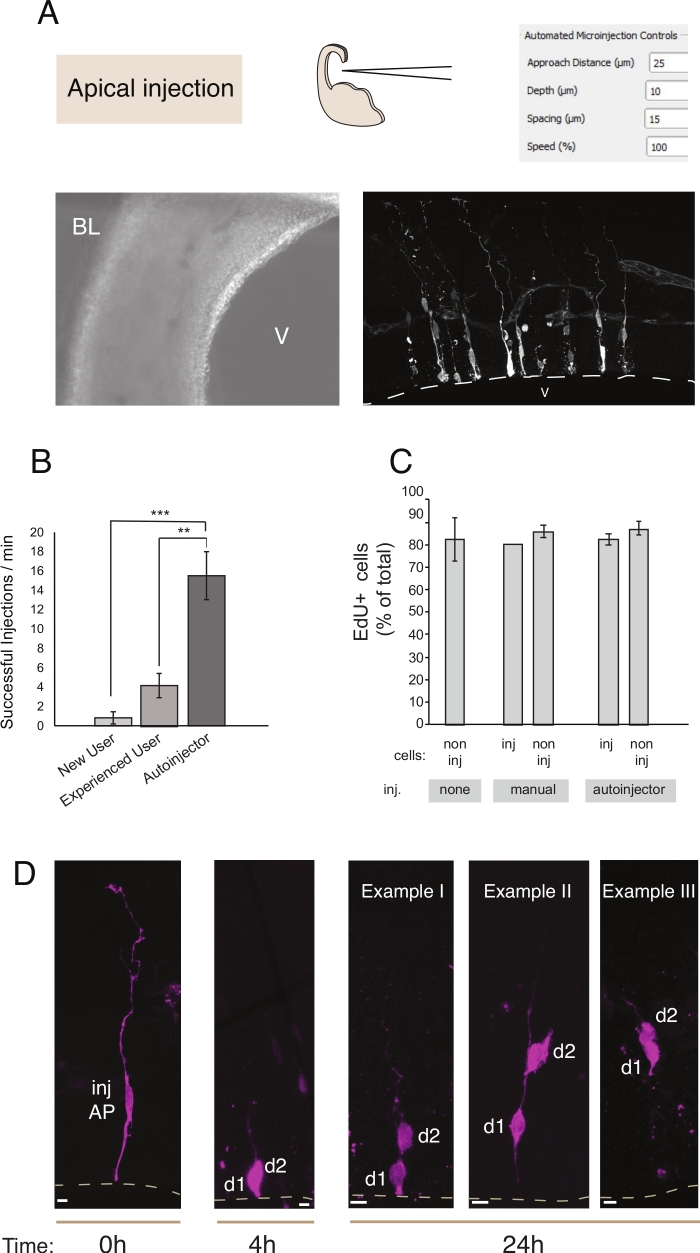
الشكل 2: الحقن المجهري الروبوتي إلى النسل الرقائقي. النتائج التخطيطية والمتوقعة عند استخدام الروبوت الحقن المجهري لاستهداف النسل apical (APs) عن طريق سطح apical (حقنة apical). (A) الصف العلوي. على اليسار: تخطيطي للعملية. على اليمين: واجهة المستخدم الرسومية مع المعلمات ذات الصلة لحقن apical. الصف السفلي. على اليسار: صورة النقيض من المرحلة التي اتخذت أثناء إجراء الحقن (V: البطين; BL: لامينا القاعدية). على اليمين: النتائج التمثيلية التي تظهر برامج ابس مُنبتَة. يمثل الخط المتقطع البطين (V). شريط مقياس: 10 ميكرومتر. (ب) الحقن الناجحة في الدقيقة للمستخدم المبتدئ على نظام الحقن المجهري اليدوي، مستخدم من ذوي الخبرة على نظام الحقن المجهري اليدوي، والروبوت microinjection. (C) دمج EdU في الخلايا المجهرية والخلايا غير المحقونة في المنطقة المحقونة. وكانت شرائح Organotypic من الفأر E14.5 تينencephalon الظهر إما (ط) حقن أو (2) تعرض لمجهرية يدوية أو آلية (شريحة حقن) باستخدام Dextran - A488 (للدليل ولصناعة السيارات). تم الاحتفاظ شرائح في الثقافة في وجود EdU لمدة 24 ساعة، ثم كانت ثابتة وملطخة لDAPI وEdU. تم تسجيل الخلايا المحقونة وغير المحقونة في المنطقة المحقونة من أجل الإيجابية في EdU. (D) استخدام المجهر الروبوت النسب تتبع النسب. يتم حقن صبغة الفلورسنت (Dx3-A555، أرجواني) في خلية جذعية عصبية واحدة (ر = 0 ساعة). يتم تقسيم صبغة الفلورسنت إلى الخلايا ابنة (د1، d2) أثناء الانقسام. وهذا يسمح التالية ذرية من حقن الخلية (ر = 4 ح و 24 ح) والكشف عن تطور النسب مع مرور الوقت. ل ر = 24 ساعة، نعرض عدة أمثلة على ذرية واحد يتوقع أن تجد. قضبان مقياس: 10 μm. وتؤخذ الرسوم البيانية في B و C من المرجع12الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
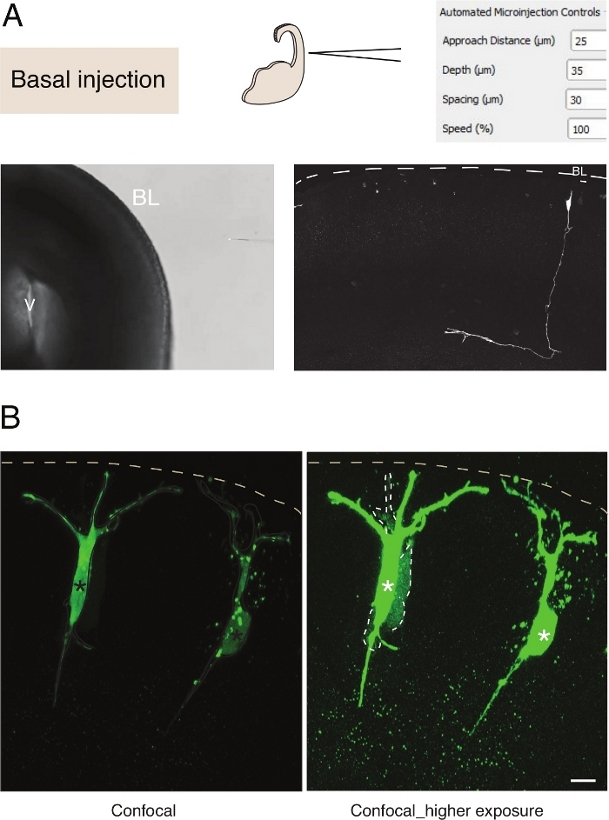
الشكل 3: الحقن المجهري الروبوتي في الخلايا العصبية. النتائج التخطيطية والمتوقعة عند استخدام الروبوت الحقن المجهري لاستهداف الخلايا العصبية الهرمية (N) عن طريق السطح القاعدي (حقن القاعدية). (A) الصف العلوي. على اليسار: تخطيطي للعملية. على اليمين: واجهة المستخدم الرسومية مع المعلمات ذات الصلة للحقن القاعدي. الصف السفلي. على اليسار: صورة النقيض من المرحلة التي اتخذت أثناء إجراء الحقن (V: البطين; BL: لامينا القاعدية). على اليمين: تمثل النتائج التمثيلية التي تظهر خط N. Dashed الصغير الصفيحة القاعدية (BL). شريط مقياس: 10 μm. (ب) استخدام ناينكتور لدراسة الفجوة الاتصالات في الوصلات في الأنسجة. تم حقن الخلايا العصبية الهرمية مع محلول يحتوي على اثنين من الأصباغ: الفجوة تقاطع-منفّق Dx-A555 (لا يظهر) والفجوة تقاطع نفاذية لوسيفر الأصفر (الأخضر). Dx-A555 يقتصر على الخلية المستهدفة (العلامات النجمية)، بينما ينتشر LY إلى الخلايا التي يتم توصيلها عبر وصلة الفجوة إلى الخلية المستهدفة (خطوط متقطعة). اللوحة اليسرى: التعرض المنخفض، فقط الخلايا المجهرية مرئية. اللوحة اليمنى: يتيح التعرض العالي إمكانية عرض الخلايا المحقونة وكذلك الخلايا المقرونة (خطوط متقطعة). شريط مقياس: 10 μm. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملف تكميلي: استكشاف أخطاء شائعة عديدة تنشأ أثناء الحقن المجهري. الرجاء النقر هنا لتحميل هذا الملف.
Discussion
الحقن المجهري في الخلايا الجذعية العصبية واحدة في الأنسجة يوفر ممتازة دقة خلية واحدة ولهذا السبب تم استخدامه لتشريح بيولوجيا الخلية من تطور الخلايا الجذعية العصبية والانتقال مصير(الشكل 2; انظر أيضا10,11,12). يمكن إجراء إجراء الحقن المجهري الآلي على أنواع أخرى من الخلايا في كل من الفئران الجنينية وأنسجة الدماغ البشرية. تظهر النتائج التمثيلية للخَرَن المجهري للخلايا العصبية الوليدة باستهداف السطح القاعدي لـ telencephalon في الشكل 3.
يمكن تطبيق المبدأ الذي تم تأسيسه هنا لاستهداف عدة أنواع مختلفة من الخلايا في أدمغة الماوس الجنينية وأدمغة الإنسان. لقد أظهرنا سابقا أن الروبوت الحقن المجهري يمكن أيضا أن تستخدم لاستهداف الخلايا السلف واحد في الماوس hindbrain وtelencephalon والخلايا العصبية حديثي الولادة في الماوس والإنسان تطوير نيوكورتيكس12. للحصول على أفضل النتائج من إجراء الحقن, ينبغي للمرء أن تحسين جميع الخطوات قبل البدء في الحقن. من المهم أن تدرس بعناية وتحسين إعداد شرائح الأنسجة العضوية من أنسجة المخ(الشكل 1)القابلة للحياة والمحفورة جيداً . ومن الأهمية بمكان أن تكون سريعة في تشريح و تشريح الإجراء يتضح في الشكل 1. لحقن apical التي تستهدف APs، ينبغي للمرء أن يختار شرائح تظهر الاتجاه المثالي للسطح apical. بالنسبة لحقن APs، يكون التوجه المثالي هو عمودي السطح على الجزء السفلي من طبق بيتري. أي اتجاه آخر سوف تكون متساهلة كذلك، ومع ذلك، فإن سطح apical عمودي على طبق بيتري يوفر مساحة أوسع للحقن، وبالتالي زيادة نجاح الحقن. للحقن في الخلايا العصبية, اتجاه شريحة يلعب القليل إلى أي تأثير.
مرة واحدة يتم تحديد شرائح لحقن، وإجراء الحقن لكل شريحة يستغرق حوالي 5 دقائق. بالنظر إلى أن واحدة تعمل مع الأنسجة الحية, ينصح بشدة لتسريع إجراء الحقن. وتحقيقا لهذه الغاية نوصي بوضع جميع المعلمات للحقن عن طريق واجهة المستخدم الرسومية(الشكل 1D)قبل الأنسجة جاهزة، للحد من أي وقت الانتظار لا لزوم لها. لاستكشاف الأخطاء وإصلاحها، الرجاء الرجوع إلى الملف التكميلي.
في حالة ثقافة شريحة طويلة الأجل، والخطوات بعد إجراء الحقن المجهري الآلي يمكن أن تؤثر على صحة الخلايا وبالتالي التجربة. لذلك، فمن المستحسن للغاية لتشغيل اختبار مراقبة الجودة وتحسين شروط ثقافة شريحة. لتقييم صلاحية الخلية بعد تشريح الحقن وإجراء، قمنا EdU وضع العلامات أثناء الثقافة، ونحن كميا عدد من النوى pyknotic (وكيل للخلايا المبرمج) في الثقافات وحقن الأنسجة12. لم تكشف هذه القياسات الكمية عن أي تأثير كبير للضين المجهري على صلاحية الأنسجة (الشكل 2C). نوصي بتشغيل ضوابط الجودة مماثلة مع إنشاء تقطيع الأنسجة العضوية وخط أنابيب الحقن المجهري في المختبر.
بالمقارنة مع الحقن المجهري اليدوي ، يوفر الروبوت الحقن المجهري العديد من المزايا. أولاً، منحنى التعلم للمستخدم أقل حدة بالمقارنة بالحقن اليدوي: سوف يصل المستخدم الجديد إلى كفاءة عالية بعد عدد محدود من الجلسات، عادة 1 أو 2. ثانياً، في حالة الحقن المجهري اليدوي، تتطلب الكفاءة المقارنة شهوراً من التدريب. إجراء الحقن هو أسرع وأكثر كفاءة(الشكل 2B). نحن كمي هذه المعلمات ووجدنا أن الروبوت microinjection تفوقت على المستخدم اليدوي المهرة فيما يتعلق بنجاح الحقن (٪ من الحقن الناجحة / العدد الإجمالي للحقن) وفي العدد الإجمالي للحقن في وحدة الوقت12. وهذا يؤدي إلى زيادة إجمالية 300٪ من كفاءة الحقن (٪ من الحقن الناجح / دقيقة) للروبوت الحقن المجهري مقارنة بالمستخدم الماهر. وكانت الزيادة في الكفاءة أكثر وضوحا عند مقارنة الروبوت الحقن المجهري مع مستخدم مبتدئ ووصلت إلى 700٪. أخيرا وليس آخرا، يمكن بسهولة برمجة الروبوت الحقن المجهري لاستكشاف منهجية جميع المعلمات المكانية. هذا مفيد بشكل خاص عند تكييف الروبوت الحقن المجهري لاستهداف خلايا أو أنسجة جديدة، أو عند استخدام الروبوت الحقن المجهري لأغراض تتطلب دقة مكانية مختلفة.
بناء الروبوت الحقن المجهري يتطلب تغييرات طفيفة على المجهر الفلورية المدى القائمة12. وقد سبق أن قدمنا تعليمات لهذا التكيف في https://github.com/bsbrl/Autoinjector. وبمجرد إعداد الأجهزة، يوفر هذا البروتوكول تفاصيل منهجية رئيسية للقيام بنجاح بعمليات الحقن المجهري الآلي. وعموما، فإن الروبوت الحقن المجهري لديه معدل حقن ناجح يبلغ 15.52 + 2.48 حقن /دقيقة، وهو أكبر بـ 15x من مستخدم عديم الخبرة (1.09 ± 0.67 حقن/دقيقة)، و3x أكبر من مستخدم خبير (4.95 ± 1.05 حقن/دقيقة)12. هذا التحسن في معدل الحقن الناجح يمكّن المستخدمين المبتدئين والخبراء على حد سواء من حقن المزيد من الخلايا في فترة زمنية أقصر وهو أمر ضروري للحفاظ على صلاحية الأنسجة. بالإضافة إلى ذلك، الروبوت الحقن المجهري هو للتخصيص والمسار، وعمق الحقن، وعدد من الحقن، ويمكن ضبطها كل التباعد بين الحقن باستخدام واجهة المستخدم الرسومية. تسمح هذه الميزات باستخدام روبوت الحقن المجهري كأداة لتحسين التجارب الشاقة السابقة ، واستكشاف تجارب جديدة بشكل أساسي تتطلب عائدًا أعلى من الممكن سابقًا.
القيود الرئيسية لإجراء الحقن المجهري التي وصفناها هنا تتعلق بإعداد شرائح الأنسجة ، وهي خطوة حاسمة تحتاج إلى تحسين واسع النطاق. بالإضافة إلى ذلك، يعتمد الحقن المجهري على وجود سطح يمكن الاقتراب منه بواسطة الماصات الزجاجية. هذه الميزة يحد من نوع الأنسجة ومواقع الأنسجة التي يمكن استهدافها عن طريق الحقن المجهري باستخدام الإعداد الحالي.
يستخدم الروبوت الحقن المجهري حاليًا تصوير brightfield وقد تم استخدامه في تحضيرات شريحة الدماغ في المختبر. في المستقبل، يمكن الجمع بين الروبوت الحقن المجهري مع التصوير 2-فوتون لزيادة خصوصية استهداف خلية واحدة في الجسم الحي لوضع العلامات الجزيئية أو الصبغة. وقد بذلت هذه الجهود بالفعل لفيزياء كهربائية خلية واحدة15,16. الجهاز الحالي يتطلب الملاحظة اليدوية من إجراء الحقن المجهري. يمكن أن تشمل الإصدارات المستقبلية استراتيجيات لتنظيف ماصات الحقن المجهري المسدود17 أو دمج الروبوتات مناولة السوائل18 للانكأيشن المجهري متعدد التكسد والمستقل بالكامل. ويمكن لهذه الأجهزة أن تزيد من حجم الحقن المجهري حسب حجمها. يمكن تكييف الخوارزميات للسيطرة المتوازية من ماصات الحقن المجهري متعددة19 تمكين التسليم متعدد العشرات من الأصباغ والكواشف الجزيئية في نفس الخلايا داخل نفس التجارب. وهذا ينطوي على إمكانية فتح سبل جديدة للفحص الجزيئي في الأنسجة.
يمكن استخدام الروبوت الحقن المجهري للإشارة إلى الخلايا المحددة وظيفيًا باستخدام الباركود الحمض النووي أو الحمض النووي الريبي. ويمكن أن يقترن ذلك بدوره مع تقنيات أخرى لتحليل الخلايا، مثل تسلسل الحمض النووي الريبي (scRNAseq) والمجهر الإلكتروني. تظهر نتائجنا الأولية أنه يمكن استرداد الخلايا المجهرية وذريتها وعزلها باستخدام تفكك الأنسجة متبوعًا بفرز FACS (Taverna ، النتائج غير المنشورة). يمكن بعد ذلك استخدام الخلايا التي تم فرزها في FACS لـ scRNAseq. وعلاوة على ذلك، تظهر النتائج الأولية أن قدرات دقة الخلية الواحدة للروبوت المجهري يمكن استخدامها بالاقتران مع التحليل المجهري الإلكتروني لاستكشاف بيولوجيا الخلايا على الخلايا الجذعية العصبية في الأنسجة بدقة مكانية عالية (Taverna و Wilsch-Bräuninger، نتائج غير منشورة). وتشير هذه البيانات إلى أن الروبوت الحقن المجهري يمكن استخدامه كأداة للمجهر الخفيف والإلكتروني المترابط في الأنسجة وبمعنى أوسع، للتحليل المتعدد الوسائط لهوية الخلية وسلوكها في الأنسجة.
يعتمد الحقن المجهري على استخدام الضغط ويمكن للمرء أن يتحمل حلول الحقن ذات التعقيد الجزيئي العالي (على سبيل المثال، نسخة كاملة). وقد استغلت هذه الميزة من الحقن المجهري في الماضي لعزل واستنساخ مستقبلات ليجند مسور20. على طول هذا الخط، يمكن استخدام الروبوت الحقن المجهري لنمائد ودراسة الصفات متعددة الgenic على المستوى الخلوي. جنبا إلى جنب مع استراتيجية تجميع فرعي، الروبوت الحقن المجهري يمكن أيضا أن تستخدم كمنصة لتحديد مجموعة الحد الأدنى من الجينات التي تقود سمة معينة / سلوك الخلوية. حتى الآن، وقد استخدم الروبوت الحقن المجهري للتلاعب الكيمياء الحيوية الخلية عن طريق تسليم مرنا، الحمض النووي أو البروتيناتالمؤتلفة 10،21،22. ونتنبأ بتطبيق الروبوت الحقن المجهري في ابراء الفيزياء الحيوية للفضائيات داخل الخلايا، على سبيل المثال، من خلال تقديم المواد النانوية أو المواد النانوية التي تسمح بالاستشعار و/أو التلاعب في الخصائص الفيزيائية الحيوية للمساحة داخل الخلايا.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
ويود المؤلفون أن يعترفون بمؤسسة نوميس( ET). SBK يعترف الأموال من قسم الهندسة الميكانيكية، كلية العلوم والهندسة، MnDRIVE RSAM مبادرة من جامعة مينيسوتا ، مينيسوتا قسم التعليم العالي ، والمعاهد الوطنية للصحة (NIH) 1R21NS103098 -01 ، 1R01NS111028 ، 1R34NS111654 ، 1R21NS112886 و 1R21 NS11196. وقد تم دعم GS من قبل المؤسسة الوطنية للعلوم لأبحاث الدراسات العليا زمالة و NSF IGERT منحة تدريبية.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose, Low Melt | Carl Roth | Cat# 6351.2 | |
| Agarose, Wild Range | Sigma-Aldrich | Cat# A2790 | |
| Best-CA 221 Glue | Best Klebstoffe GmbH & Co.KG | Cat# CA221-10ml | |
| B-27 Supplement | Thermo Fisher Scientific | Cat# 17504044 | |
| Cellmatrix Type-IA (Collagen, Type !) | FUJIFILM Wako Chemicals | Cat# 637-00653 | |
| Distilled Water | |||
| DMEM-F12, CO2 independent (w/o Phenol red) | Sigma-Aldrich | Cat# D2906 | |
| DMEM-F12, CO2 independent (with Phenol red) | Sigma-Aldrich | Cat# D8900 | |
| HEPES-NAOH, pH 7.2, 1M (HEPES buffer) | Carl Roth | Cat# 9105.3 | |
| L-Glutamine, 200 mM | Thermo Fisher Sientific | Cat# 25030024 | |
| Mowiol 4-88 | Sigma-Aldrich | Cat# 81381 | |
| N-2 Supplement | Thermo Fisher Scientific | Cat# 17502048 | |
| Neurobasal Medium | Thermo Fisher Scientific | Cat# 21103049 | |
| Nuclease-free water | Thermo Fisher Scientific | Cat# AM9937 | |
| O2 (40%), CO2 (5%), N2 (55%) Mix, 50 liters | |||
| Paraformaldehyde | Merck | Cat# 818715 | |
| PBS | |||
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | Cat# 15140122 | |
| Rat serum | Charles River Laboratories | ||
| Japan | |||
| Sodium bicarbonate (NaHCO3) | Merck | Cat# 106323 | |
| Sodium hydroxide (NaOH) | Merck | Cat# 106482 | |
| Tyrode’s salt | Sigma | Cat# T2145-10x1L) | |
| Equipment | |||
| Borosilicate glass capillaries, 1.2 mm outer diameter x 0.94 mm inner diameter | Sutter Instruments | Cat# BF-120-94-10 | |
| Bottle-top filter system, 500 mL | Corning | Cat# 430769 | |
| Computer PC | |||
| Custom pressure rig | Custom pressure rig | ||
| Electronic pressure regulator | Parker Hannifin | Cat# 990-005101-002 | |
| Falcon tubes, 15 mL | Corning | Cat# 430791 | |
| Falcon tubes, 50 mL | Corning | Cat# 430829 | |
| Fine-tip paintbrush | |||
| Flaming/ Brown micropipette puller | Sutter Instruments | Cat# P-97 | |
| Forceps, Dumont no. 3 | Fine Science Tools | Cat# 11231-30 | |
| Forceps, Dumont no. 5 | Fine Science Tools | Cat# 11255-20 | |
| Forceps, Dumont no. 55 | Fine Science Tools | Cat# 11252-20 | |
| Heating block | Labtech International | Cat # Dri block Digi2 | |
| Inverted fluorescence microscope | Zeiss | Cat# Axiovert 200 | |
| Light source | Olympus | Cat# Highlight 3100 | |
| Manual pressure regulator | McMaster Carr | Cat# 0-60 PSI 41795K3 | |
| Microloader Tips | Eppendorf | Cat# 5242956.003 | |
| Microcontroller | Arduino | Cat# Arduino Due | |
| Microscope camera Hamamatsu Orca Flash 4.0 V3 | |||
| Motorized stage XY for microscope | |||
| Multiwell plate, 24 wells | Nunc | Cat# 142475 | |
| Pasteur pipettes, plastic | |||
| Petri dish, 60 x 15 mm | Greiner | Cat# 628102 | |
| Petri dish, 35 x 10 mm | Nunc | Cat# 153066 | |
| Petri dish, 34 x 14 mm, including Microwell no. 1.5 cover glass | MatTek | Cat# P35G-1.5-14-C | |
| Pipette holder | Warner Instruments | Cat# 64-2354 MP-s12u | |
| Pipette and tips | |||
| Puller filament, 3.0-mm square box filament | Sutter Instrument | Cat# FB330B | |
| Slice culture incubation box | MPI-CBG | Cat# custom made | |
| Solenoid valve | Cat# LHDA053321H-A | ||
| Stereomicroscope | Olympus | Cat# SZX12 | |
| Tabletop centrifuge | Heraeus | Cat# 5431622 | |
| Thermometer | |||
| Three-axis Manipulator | Sensapex Inc | Cat# tree-axis uMP | |
| Vibratome | Leica | Cat# VT1000s | |
| Whole-embryo-culture-system incubator | Ikemoto Company | Cat# RKI-10-0310 | |
| Waterbath | |||
| Software and Algorithms | |||
| Arduino | Arduino | ||
| Fiji | RRID: SCR_002285 | ||
| Python | Python Software foundation | Python 2.7.12 | |
| ZEN | RRID: SCR_013672 |
References
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Götz, M., Huttner, W. B. The cell biology of neurogenesis. Nature Reviews Molecular Cell Biology. 6 (10), 777-788 (2005).
- Di Lullo, E., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Lancaster, M. A., Knoblich, J. A. Organogenesisin a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Kretzschmar, K., Clevers, H. Organoids: Modeling Development and the Stem Cell Niche in a Dish. Developmental Cell. 38 (6), 590-600 (2016).
- Pepperkok, R. et al. Automatic microinjection system facilitates detection of growth inhibitory mRNA. Proceedings of the National Academy of Sciences of the United States of America. 85 (18), 6748-6752 (1988).
- Pepperkok, R., Lowe, M., Burke, B., Kreis, T. E. Three distinct steps in transport of vesicular stomatitis virus glycoprotein from the ER to the cell surface in vivo with differential sensitivities to GTPγS. Journal of Cell Science. 111 (13), 1877-1888 (1998).
- Pepperkok, R. et al. β-COP is essential for biosynthetic membrane transport from the endoplasmic reticulum to the Golgi complex in vivo. Cell. 74 (1), 71-82 (1993).
- Ansorge, W., Pepperkok, R. Performance of an automated system for capillary microinjection into living cells. Journal of Biochemical and Biophysical Methods. 16 (4), 283-292 (1988).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nature Neuroscience. 15 (2), 329-337 (2012).
- Wong, F. K., Haffner, C., Huttner, W. B., Taverna, E. Microinjection of membrane-impermeable molecules into single neural stem cells in brain tissue. Nature Protocols. 9 (5), 1170-1182 (2014).
- Shull, G., Haffner, C., Huttner, W. B., Kodandaramaiah, S. B., Taverna, E. Robotic platform for microinjection into single cells in brain tissue. EMBO Reports. 20 (10), e47880 (2019).
- Jabeen, S., Thirumalai, V. The interplay between electrical and chemical synaptogenesis. Journal of Neurophysiology. 120 (4), 1914-1922 (2018).
- Nagy, J. I., Pereda, A. E., Rash, J. E. Electrical synapses in mammalian CNS: Past eras, present focus and future directions. Biochimica et Biophysica Acta - Biomembranes. 1860 (1), 102-123 (2018).
- Suk, H.J. et al. Closed-loop real-time imaging enables fully automated cell-targeted patch-clamp neural recording in vivo. Neuron. 95 (5), 1037-1047 (2017).
- Annecchino, L. A. et al. Robotic automation of in vivo two-photon targeted whole-cell patch-clamp electrophysiology. Neuron. 95 (5), 1048-1055 (2017).
- Kolb, I. et al. Cleaning patch-clamp pipettes for immediate reuse. Scientific Reports. 6, 35001 (2016).
- Holst, G. L. et al. Autonomous patch-clamp robot for functional characterization of neurons in vivo: development and application to mouse visual cortex. Journal of Neurophysiology. 121 (6), 2341-2357 (2019).
- Kodandaramaiah, S. B. et al. Multi-neuron intracellular recording 1 in vivo via interacting autopatching 2 robots. ELife. 7, 24656 (2018).
- Lubbert, H. et al. cDNA cloning of a serotonin 5-HT1c receptor by electrophysiological assays of mRNA-injected Xenopus oocytes (RNA fractionation/hybrid depletion/hybrid selection/choroid plexus/voltage clamp). Neurobiology. 84 (2) 4332-4336 (1987).
- Florio, M. et al. Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science. 347 (6229), 1465-1470 (2015).
- Kalebic, N. et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO Reports. 17 (3), 338-348 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved