Method Article
تبلور البروتينات على رقاقة عن طريق المجهر دراسات الحيود في الموقع بالأشعة السينية
In This Article
Summary
هذه الورقة تفاصيل بروتوكول تصنيع رقائق microfluidic وضعت لبلورة البروتين على رقاقة مع طريقة غسيل الكلى والتجارب في الموقع حيود الأشعة السينية. عملية microfabrication يجعل من الممكن لدمج غشاء غسيل الكلى السليلوز التجديدي شبه قابل للنفاذ مع أي قطع الوزن الجزيئية، بين طبقتين من الرقاقة.
Abstract
يصف هذا البروتوكول تصنيع أجهزة microfluidic قابلة للاستنساخ وغير مكلفة تغطي خط الأنابيب بأكمله لبلورة البروتينات على رقاقة مع طريقة غسيل الكلى والسماح في الموقع تجارب البلورات أحادية البلورة أو المسلسل في درجة حرارة الغرفة. البروتوكول تفاصيل عملية تصنيع الرقائق الدقيقة، والتلاعب في تجارب تبلور على رقاقة ومعالجة البيانات الحيود الأشعة السينية التي تم جمعها في الموقع لتوضيح الهيكلية لعينة البروتين. تكمن السمة الرئيسية لهذا الإجراء microfabrication على التكامل المتاحة تجاريا، شبه قابل للتجديد غشاء غسيل الكلى السليلوز في ما بين طبقتين من رقاقة. يختلف قطع الوزن الجزيئي للغشاء المضمن اعتمادًا على الوزن الجزيئي للجزيئات والذرية. يستغل الجهاز مزايا تكنولوجيا المايكرولويدي ، مثل استخدام كميات دقيقة من العينات (<1 ميكرولتر) وضبط دقيق على ظواهر النقل. الرقاقة تقترن بها مع طريقة غسيل الكلى، وتوفير التحكم الدقيق وعكسها على عملية التبلور ويمكن استخدامها للتحقيق في الرسوم البيانية المرحلة من البروتينات على مقياس microliter. ومنقوشة الجهاز باستخدام راتنج القائمة على ثيولين قابلة لللتصوير مع الطباعة الحجرية بصمة لينة على الركيزة البوليمرية شفافة بصريا. وعلاوة على ذلك، تم تقييم تشتت الخلفية للمواد التي تؤلف الرقائق الدقيقة وتوليد ضوضاء الخلفية مما يجعل الشريحة متوافقة مع تجارب الحيود في الموقع بالأشعة السينية. مرة واحدة تزرع بلورات البروتين على رقاقة تصل إلى حجم كاف وتوحيد السكان، يمكن تركيب رقائق مباشرة أمام شعاع الأشعة السينية بمساعدة حامل مطبوع 3D. ويعالج هذا النهج التحديات الناجمة عن استخدام مواد الحماية من المعادن والمحاصيل اليدوية في تجارب بلورات البروتين التقليدية من خلال طريقة سهلة وغير مكلفة. تم جمع مجموعات كاملة من بيانات الحيود بالأشعة السينية من بلورات lysozyme متعددة isomorphous نمت على رقاقة في درجة حرارة الغرفة لتحديد الهيكل.
Introduction
إن توضيح الهيكل الثلاثي الأبعاد (ثلاثي الأبعاد) للجزيئات الحيوية البيولوجية هو سعي مستمر في علم الأحياء الهيكلي حيث تظل تقنية التصوير البلوري للأشعة السينية هي تقنية التحقيق الرئيسية. تطبيقها لكشف التفاصيل الهيكلية للجزيئات المعقدة، مثل البروتينات، ويهدف إلى تسهيل فهم آليات أعمالهم وإشراكهم في وظائف بيولوجية مختلفة. مصادر الأشعة السينية القوية في السنكروترونات وأشعة إكس ليزر الإلكترون الحر (XFELs) توفر جميع الأدوات اللازمة لنظر أعمق في بنية البروتينات في القرار الذري القريب. على الرغم من المزايا التي تأتي جنبا إلى جنب مع استخدام الأشعة السينية للدراسات الهيكلية، وهناك قيود جوهرية لاشعاع الأشعة السينية وعملية التبلور نفسها. الأضرار الإشعاعية التي تسببها ارتفاع تدفق الأشعة السينية وأوقات التعرض الطويل للبلورات البروتينية أمام شعاع الأشعة السينية هي معلمات تقييدية أن علماء البلورات يجب أن يتجاوزوا استخدام التبريد المبرد1. ومع ذلك، يمكن العثور على ظروف cryocooling الأمثل تكون شاقة منذ التغيرات التشكلية من بنية البروتين الأصلي أو القطع الأثرية يمكن إخفاؤها2،3. وعلاوة على ذلك، تشير الدراسات الحديثة إلى أن إجراء تجارب الحيود في درجة حرارة الغرفة يؤدي إلى انخفاض الضرر الإشعاعي المحدد4. وهناك اختناق آخر في علم الأحياء الهيكلية هو الحصول على بلورات جيدة diffracting مع حجم كاف5. بلورات صغيرة أسهل في الإنتاج، وخاصة في حالة البروتينات الغشاء، ولكن هي أكثر عرضة للتلف الإشعاعي حتى في ظل ظروف cryocooling لأن جرعة إشعاع عالية يجب أن توجه في حجم أصغر بالمقارنة مع حالة بلورات البروتين أكبر6. يمكن لنهج الرواية من البلورات المسلسل7،8 في السنكروترونات وXFELs التحايل على القيود من الأضرار الإشعاعية ، وفي الوقت نفسه استغلال بلورات أصغر (200 نانومتر إلى 2 ميكرومتر)7 عن طريق دمج مجموعات البيانات من متعددة ، بلورات البروتينات ذات الأيزومورف وتوجّه عشوائيًا والاستفادة من التقدم التكنولوجي المرتبط به مثل نبضات الفيمتو ثانية وأوقات التعرض الأقصر والأشعة السينية الدقيقة التركيز5،7،9،10.
تكنولوجيا Microfluidic قيمة للتصوير البلوري بالأشعة السينية، وتظهر مزايا متعددة لبلورة الجزيئات الحيوية البيولوجية والتحقيق الهيكلي. يتطلب إجراء تجارب التبلور في الأجهزة الدقيقة الفلورية كميات صغيرة من عينة البروتين ، وبالتالي تقييد تكلفة إنتاج هذه الجزيئات الحيوية عالية القيمة وتسهيل فحص عالي الإنتاجية وتعظيم ظروف التبلور العديدة. وعلاوة على ذلك، فإن نسبة المساحة السطحية الكبيرة إلى الحجم في النطاق microfluidic وظواهر النقل والانتشار المحدودة تمكن من التحكم الدقيق في التدفقات ودرجة الحرارة أو تركيز التدرجات11،12،13،14، تقديم الأجهزة microfluidic مناسبة لزراعة بلورات ذات حجم موحد واستكشاف الرسوم البيانية المرحلة15،16،17،18،19. وعلاوة على ذلك، فإن أدوات الفلورويديك المجهرية تعرض إمكانية مميزة لمعالجة عقبة أخرى في علم البلورات البروتينية، وهي تسليم العينات، وضرورة التعامل مع بلورات البروتين وجنيها قبل استخدامها في تجارب الحيود بالأشعة السينية. طريقة البلورات على رقاقة وأشعة سينية في الموقع يزيل التلاعب الكريستال والتدهور المحتمل للجودة وضوح الشمس قبل جمع البيانات. وقد تم تصميم مجموعة واسعة من رقائق microfluidic متوافقة في الموقع لبلورات البروتين الأشعة السينية في الموقع ، وضعت ، واختبارها من قبل العديد من المجموعات البحثية التي تواجه القيود ذات الصلة الناشئة عن طبيعة المواد microfabrication وتفاعلاتها مع الأشعة السينية14،19،20،21،22،23. ويجب أن تكون مواد التصنيع شفافة بصريا، خاملة بيولوجيا وأن تظهر شفافية عالية في إشعاع الأشعة السينية، وأن تكون النسبة المثلى للإشارة إلى الضوضاء أثناء جمع البيانات.
معظم طرق التبلور المطبقة في البلورات البروتين التقليدية24،25 كما تم تنفيذها على مقياس microfluidic11،14 لبلورة رقاقة وفي الموقع تحليل الحيود X-ray. بسيطة، هجين، أو متعددة الطبقات microfluidic جهاز دمج بخار نشر26، تبخر27، انتشار واجهة الحرة (FID)28، microbatch26، أو حتى البذر29 وقد استخدمت لبلورة البروتينات القابلة للذوبان والغشاء. يمكن تحقيق فحص الإنتاجية العالية والاستفادة المثلى من ظروف التبلور30،31 في32المستندة إلى جيد ، القائمة على قطرات33، أو صمام-34 الأجهزة. في الموقع وقد أجريت تجارب الحيود بالأشعة السينية لأهداف البروتين الصعبة في درجة حرارة الغرفة في رقائق دقيقة ملفقة من مواد مختلفة مثل PDMS (بوليديميثيلسيلوكسيان)، COC (دوري أوليفين copolymer)، PMMA (بولي (ميثيل ميثاكريلات))2 1,22,26,28,29, أفلام الجرافين23, Kapton35, الايبوكسي الغراء6, أو NOA (Norland لاصق البصري)19 و المواد ' الشفافية في الأشعة السينية وقد تم تقييم مساهمتها في الضوضاء الخلفية. وعلاوة على ذلك، وقد تم تصميم رقائق لزوجين في الموقع والبيانات استراتيجيات جمع المسلسل في أداة واحدة للأشعة السينية تجارب الكريستال البروتين في مصادر سينكروترون23و35و36 و XFELs7.
كما تم تنفيذ جمع البيانات عن درجة حرارة الغرفة في الموقع في مختلف طرق وأجهزة التوصيل. على سبيل المثال، استخدم Nogly etal. 54 حقن مرحلة مكعبة دهنية (LCP) من أجل دراسة بنية مضخة الفوتون الضوئية الضوئية (bR) بواسطة بلورات الفومتوة الثانية التسلسلية (SFX) باستخدام مصدر XFEL. تم حل الهيكل البلوري لـ bR إلى 2.3 Å القرار، مما يدل على توافق حاقن LCP مع التصوير البلوري التسلسلي الذي تم حله في الوقت (TR-SFX). باكستر وآخرون55 صممت شبكة متعددة البلورات عالية الكثافة، ملفقة بواسطة 100 أو 200 ميكرومتر سميكة بولي كربونات البلاستيك مع ثقوب الليزر قطع من مختلف الأحجام. يمكن إصلاح 5 ميكرومتر إضافي سميكة من البولي كربونات الفيلم إلى جانب واحد من الشبكة عند استخدام الجهاز للجلوس - أو شنقا - قطرة تبلور التجارب. ويمكن استخدام هذه الشبكة عالية الكثافة بطرق متعددة كما يمكن تحميل بلورات مباشرة على الموانئ من الجهاز أو يمكن أن تزرع بلورات على الجهاز عن طريق نشر بخار أو طريقة LCP. وعلاوة على ذلك، يمكن تعديل الشبكة في قاعدة مغناطيسية قياسية واستخدامها لجمع بيانات الأشعة السينية في الموقع في ظروف درجة حرارة الغرفة أو في ظروف التبريد. وفي الآونة الأخيرة، طور فيلر وآخرون56 حامل عينة لبلورات الأشعة السينية في الموقع في التصوير الشعاعي الضفي في درجة حرارة التبريد والمحيطة مع الحد الأدنى من مساهمة الضوضاء الخلفية. على وجه التحديد، حامل يتكون من دعم البلاستيك، ورقائق COC شفافة ورقائق البوليميد منظم microporous. تم تصميمه ليحل محل الشرائح غطاء شائعة الاستخدام لإعداد قطرات التبلور، مع السماح في مكان التلاعب مثل نقع ليغاند، تشكيل معقد، وحماية المبردة دون فتح قطرة التبلور أو التعامل مع بلورات يدويا. وعلاوة على ذلك، يمكن إزالة حامل العينة من لوحة التبلور ووضعها على قاعدة مغناطيسية لجمع البيانات في الموقع عند خطوط الشعاع القياسية القائمة على الخيوط القائمة على goniometer. لجمع بيانات درجة الحرارة المحيطة، يتم إزالة احباط COC قبل التجربة وفقط 21 ميكرومتر سميكة رقائق بوليميد يساهم في تشتت الخلفية، والتي في هذه الحالة هو الحد الأدنى. هذه الأمثلة لا تشكل سوى جزء صغير من البحوث الجارية والعديد من الرقائق الدقيقة تنوعا وضعت للتصوير البلوري البروتين الأشعة السينية.
ومع ذلك، لم يتم دمج طريقة تبلور بروتين غسيل الكلى على نطاق واسع داخل microfluidics. غسيل الكلى هو طريقة قائمة على الانتشار تهدف إلى توازن التركيز المشفّر من خلال غشاء شبه نفاذي من أجل الاقتراب من التركيز الاسمي لبلورة البروتين ويمكّن من التحكم الدقيق والواجب على ظروف التبلور24. يمكن اختيار قطع الوزن الجزيئي (MWCO) لغشاء غسيل الكلى شبه القابل للنفاذ اعتمادًا على الوزن الجزيئي للجزيئات الكبيرة والزواطع للسماح بانتشار الجزيئات الصغيرة المثبطة مع الاحتفاظ بالجزيئات الكبيرة من الاهتمام. نظرا لقابلية عكس عملية غسيل الكلى، ويمكن استخدامه في تركيبة مع التحكم في درجة الحرارة للفصل وتحسين النوى ونمو البلور بشكل مستقل37 للتحقيق في الرسوم البيانية المرحلة عن طريق تغيير تركيز حاد أثناء استخدام نفس عينة البروتين. يتم مراجعة دمج الأغشية في microfluidics من قبل دي جونغ وآخرون38 ودراسات الحالة في البيولوجيا زرع غسيل الكلى في رقائق يمكن سردها أساسا في إعداد العينات، تركيز أو تطبيقات الترشيح39،40،41،42 أو دراسات الخلية ذات الصلة43،44. وقد استخدم شيم وآخرون37 التغلغل من خلال نظام إدارة المباني (PDMS) لدراسة نوى ونمو الإكسيلاناز في ظروف مختلفة. تغلغل الماء من خلال غشاء PDMS السميك 15 ميكرومتر في خزان البروتين للجهاز microfluidic، ثم تغيير البروتين والتركيز المتدفع.
البروتوكول الذي وضعه Junius وآخرون19،45 لتصنيع رقاقة microfluidic متوافقة لكل من تبلور البروتين على رقاقة عن طريق التحليل الدقيق وفي الموقع تجارب الحيود الأشعة السينية في درجة حرارة الغرفة. بروتوكول لتصنيع الجهاز مستوحاة مباشرة من العمل الرائد الذي أنجزه Studer وزملاء العمل12،46 لملصقات منقوشة على شكل مصغر من الراتنج القائم على الثيرولين الصورة القائمة NOA 81 تضمين الأغشية المتاحة تجاريا ، وذلك باستخدام الطباعة الحجرية الناعمة بصمة. وأدى تعديل مبتكر للطريقة إلى تمكين الرقائق الدقيقة من استخدام التحليل الدقيق لرصد ومراقبة المعلمات التجريبية لنمو بلورات البروتين على الشريحة واستغلال مزايا ميكروفليديس في وقت واحد، مثل انخفاض استهلاك عينات البروتين لكل تجربة (<1 ميكرولتر). في عمل سابق، مبادئ غسيل الكلى المطبقة على نظام على نطاق كلي (الحجم النموذجي >20 ميكرولتر) لفحص وتحسين ظروف التبلور عن طريق رسم خرائط درجة الحرارة- درجة الحرارة تركيز المرحلة المخططات أظهرت47. في هذا العمل، يتم وصف بروتوكول لإنتاج رقائق غسيل الكلى التي تتضمن أغشية غسيل الكلى السليلوز (RC) من مختلف MWCO من أجل إجراء تحليل التبلور على رقاقة وفي الموقع X-ray جمع البيانات. وقد تم تقييم المواد التي تتألف منها الرقائق الدقيقة من أجل شفافيتها إلى الأشعة السينية19 ويمكن تعيين الأجهزة مباشرة أمام شعاع الأشعة السينية لتجارب درجة حرارة الغرفة في الحيود الموقعي، باستثناء المناولة اليدوية وتقليل تدهور بلورات البروتين الهشة. في دراسة حالة، نمت بلورات البيض البيض lysozyme على رقاقة عن طريق غسيل المجهر توليد سكان موحد الحجم. ثم تم تركيب الشريحة الدقيقة أمام شعاع الأشعة السينية مع دعم مطبوع ثلاثي الأبعاد19 وتم جمع مجموعات كاملة من بيانات الحيود في الموقع في درجة حرارة الغرفة من بلورات متعددة متساوية الشكل ، مما يدل على الإمكانية العالية وأهمية الرقائق لدراسات البلورات التسلسلية السنكروترونية لأهداف الجزيئات الكبيرة الصعبة.
Protocol
1. تصميم قناع وتصنيع الرئيسي
- رسم هندستها المطلوبة من الجهاز microfluidic باستخدام أي برنامج رسم vectorial. لكل طبقة من طبقة من الضوئي التي سيتم استخدامها للخطوة التالية من التصوير الضوئي، وإعداد قناع الفردية: قناع واحد الخطوط العريضة مع القنوات والأعمدة وقناع واحد يحتوي فقط على الأعمدة.
- ترجمة الملفات CIF التي تم إنشاؤها بواسطة برنامج الرسم إلى صور ضوئية الفيلم. ويمكن القيام بذلك من خلال الخدمات التجارية. تتطلب قناع ضوئي مناسب اعتمادا على اختيار من photoresist المستخدمة أثناء التصوير الضوئي.
ملاحظة: بالنسبة لـ جهاز إعادة قراءة الصور SU-8، اطلب أقنعة ذات ميزات سوداء على خلفية شفافة. SU-8 هو ايبوكسي القائم على التصوير الضوئي السلبي، مما يعني أنه أثناء التعرض للأشعة فوق البنفسجية (365 نانومتر) يتم ربط الأجزاء المعرضة للأشعة فوق البنفسجية في حين أن الباقي لا يزال قابل للذوبان. وبالتالي، فإن جميع الأنماط السوداء على القناع لن تكون مشتركة بين ذات ضوء الأشعة فوق البنفسجية خلال التصوير الضوئي. سيتم نقش القنوات والأعمدة على الماجستير. - إعداد اثنين من الماجستير على رقائق السيليكون لتصميم كل رقاقة عن طريق التصوير الضوئي باستخدام سو-8 photoresist السلبية.
ملاحظة: يتم تنفيذ الخطوات 1.3.1-1.3.7 في غرفة نظيفة. والخطوات المبينة أدناه هي الخطوات التقليدية للليثوغرافيا الضوئية التي يتبعها التصوير الحجري اللين لـ PDMS، والتي يرد وصفها في العديد من الكتب المدرسية. جميع قيم المعلمات التجريبية (ضوئي، مدة الوقت، درجة الحرارة، الخ) تعتمد على العديد من المعلمات خفية ويجب أن يكون الأمثل اعتمادا على جهاز مختلف المستخدمة.- استخدام رقاقة السيليكون 3 بوصة وعلاج السطح مع البلازما لمدة 90 s، من أجل تسهيل ترسب وتعلق من ناسخة ضوئية SU-8.
- صب ما يقرب من 3 مل من SU-8 مقاومة على منتصف رقاقة وتدور معطف SU-8 وصولا الى سمك المطلوب(الشكل 1A). ل 50 μm السماكة الاسمية، استخدم SU-8 3050 ومعطف تدور لمدة 10 ق في 500 دورة في الدقيقة وعلى التوالي لمدة 30 s عند 3500 دورة في الدقيقة. خبز لينة photoresist على لوحة ساخنة لمدة 15 دقيقة في 368 K من أجل أن تكون توطدت جزئيا عن طريق السماح للمذيبات الواردة في الراتنج لتتبخر ومنعها من الالتصاق على قناع ضوئي. بعد ذلك، ترك رقاقة في درجة حرارة الغرفة لمدة 2 دقيقة.
- تعريض ضوئي للأشعة فوق البنفسجية(الشكل 1B). استخدام قناع محاذير مع قوة من 35 ميغاواط سم-2 و 8 s وقت التعرض.
- المضي قدما في الخبز ما بعد التعرض. ضع الرقاقة على لوحة ساخنة لمدة 5 دقائق في 368 K لإكمال رد الفعل الضوئي الذي تحتج به الأشعة فوق البنفسجية.
- إزالة جميع المقاومة SU-8 التي لم تكن crosslinked عن طريق وضع رقاقة في حمام يحتوي على البروبيلين غليكول الميثيل خلات الأثير (PGMEA) ويحرك لمدة 15 دقيقة. شطف رقاقة مع ايزبروبانول حتى لا يمكن ملاحظة هطول الأمطار ضبابية. جفف الرقاقة بغاز النيتروجين واخزنها في طبق بيتري (100 مم × 15 ملم الحجم القياسي).
- علاج سطح رقاقة مع سيلان من أجل تسهيل مفرزة من بوليديميثيل سيلوكسان (PDMS) التي سيتم استخدامها لتصنيع 2 الطوابع. إيداع رقاقة على لوحة ساخنة استغلالها في 368 K لمدة 10 دقيقة تحت جو بخار من سداسية ميثيليديسيلازان (HMDS).
ملاحظة: إذا كان تقشير من PDMS من رقاقة يصبح من الصعب بعد عدة استخدامات، وسطح رقاقة ينبغي أن يعامل مرة أخرى مع بخار HMDS. - أول سيد يحتوي على القنوات والأعمدة جاهز. كرر هذه الخطوات وإعداد النقش الرئيسي الثاني فقط الأعمدة.
ملاحظة: أثناء التصوير الضوئي، يكون الهدف هو الحصول على هندسات الجهاز على أسياد SU-8 بارتفاع 50 ميكرومتر. ومع ذلك، بمجرد أن يتم تصنيع اثنين من سادة SU-8، قياس ارتفاع هندستها محفورة على الماجستير مع مقياس التنميط من أجل الحصول على القيمة التجريبية. تبلغ القيمة المقاسة لكل من سادة SU-8 المصنعة لهذا البروتوكول حوالي 45 ميكرومتر.
2. قوالب PDMS تلفيق
ملاحظة: يمكن تنفيذ الخطوات التالية من البروتوكول في أي مختبر طالما يتم استخدام غطاء تدفق لامينر، ويستخدم الضوء الأصفر في الغرفة عند العمل مع راتنج NOA 81 (الخطوات 3.6-3.11) ومصدر للأشعة فوق البنفسجية متاح للتبمر على الراتنج NOA 81 (الخطوتين 3.7 و 3.11).
- إعداد 50 غرام من قاعدة سيليكون PDMS وعامل المعالجة في نسبة كتلة 10:1.
- تخلط كل من المكونات في منقار مع ملعقة ووضع الخليط في غرفة فراغ لإزالة جميع فقاعات الهواء.
- صب 25 غرام من PDMS مختلطة قبل في سيد SU-8 (المخزنة في طبق بيتري) نمط القنوات والأعمدة تصل إلى ارتفاع 5 ملم تقريبا. صب ما تبقى من 25 غرام من PDMS في الثانية SU-8 الرئيسي النقش فقط الأعمدة يصل إلى ارتفاع حوالي 5 ملم(الشكل 1C).
- ضع كل من أطباق بيتري في فرن واعالج طبقات PDMS في 338 K لمدة ساعة واحدة.
- قطع طبقة PDMS الشفاء حول أنماط سادة SU-8 مع مشرط وقشر بلطف قبالة قوالب PDMS من الماجستير (الشكل 1D).
ملاحظة: الإجراء المذكور أعلاه، ودعا صب النسخة المتماثلة، وكثيرا ما تستخدم لإعداد قوالب من PDMS التي سيتم إرفاقها على الأسطح الزجاجية وتكون جزءا من جهاز microfluidic53. في هذا البروتوكول، قوالب PDMS ليست جزءا من رقاقة، ولكن يتم استخدامها كوسيط لتصنيع رقاقة. لكل تصميم، يتم إعداد قوالب PDMS 2 من سادة SU-8(الشكلان 1D و 1E)وسيتم استخدامها وفقًا لذلك (كما هو موضح أدناه) لتصنيع الرقاقة.
3. غسيل الكلى رقاقة تصنيع
- ضع قالب PDMS نقشًا لكل من القنوات والأعمدة على شريحة زجاجية صلبة من المجهر (3 × 1 في الحجم القياسي) مع الأنماط التي تواجه صعودًا (الشكل 1F). الركيزة المركزية التي تتوافق مع خزان البروتين يتجاوز عمودياً بمقدار 45 ميكرومتر من السطح الأفقي لقالب PDMS.
- قطع وفصل قطعة جافة من السليلوز (RC) غشاء غسيل الكلى (RC) وترسب على الركيزة المركزية للقالب PDMS، الذي هو معتمد على الشريحة الزجاجية (الشكل 1F).
ملاحظة: غشاء غسيل الكلى RC هو متاح تجاريا، ويتم اختيار قطع الوزن الجزيئي (MWCO) وفقا لذلك مع الوزن الجزيئي للبروتين قيد الدراسة والزلاجات المستخدمة. حجم قطعة من غشاء غسيل الكلى RC يعتمد على تصميم رقاقة. في هذا البروتوكول، تم تصميم نموذجين أوليين حيث يكون حجم خزان البروتين 0.1 أو 0.3 ميكرولتر. في هذه الحالات، وحجم قطعة غشاء غسيل الكلى هو 2 × 2 مم2 أو 4 × 4 مم2،على التوالي. - ضع قالب PDMS الثاني نقش فقط الأعمدة التي تواجه لأسفل على رأس قالب PDMS المدعوم على الشريحة الزجاجية (الشكل 1F). الركيزة المركزية لهذا القالب يتوافق مع خزان البروتين ويتجاوز عموديا (التي تواجه إلى أسفل) من قبل 45 ميكرومتر من السطح الأفقي.
- محاذاة الركائز المركزية لقوالب PDMS 2. غشاء غسيل الكلى RC هو "تقع" بين 2 قوالب PDMS (الشكل 1G).
ملاحظة: يمكن تحقيق المحاذاة بين الهياكل المجهرية لقوالب PDMS 2 بصريًا، دون أي معدات إضافية. وإلا، يمكن تحقيق هذا التلاعب تحت المجهر. ولا يشكل التحول الطفيف بين الخزانات مشكلة، طالما لم يتم تغطية القناة المائعة ونقاط المدخلات أو المخرجات بالكامل. - Desiccate الجمعية لمدة 30 دقيقة في فراغ غرفة لإزالة جميع فقاعات الهواء المحاصرين في قوالب PDMS وتعزيز إدراج الراتنج خلال الخطوة التالية من تلفيق.
ملاحظة: يتم الاحتفاظ قوالب PDMS 2 في مكانها من قبل التصاق PDMS-PDMS ولا يلزم أي ضغط إضافي أو أي طريقة أخرى للترابط المؤقت. - ملء مساحة فارغة بين 2 قوالب PDMS مع فوتوببليبل، الراتنج القائم على thiolene NOA 81 بواسطة الشعيرات الدموية imbibition (الشكل 1H و 1I).
- علاج الراتنج عن طريق التعرض للأشعة فوق البنفسجية (365 نانومتر) لمدة 8 ق باستخدام مصباح الأشعة فوق البنفسجية collimated (السلطة 35 ميغاواط سم-2).
ملاحظة: يسمح هذا التعرض الأول لراتنج NOA 81 بأن يكون متقاطعًا جزئيًا لأن طبقة رقيقة من NOA 81 على اتصال مع قوالب PDMS على كلا الجانبين لا تزال غير مشذبة. - قطع فائض NOA 81 من الجوانب الخارجية لقوالب PDMS مع مشرط.
- إزالة قالب PDMS العلوي مع 81 NOA متقاطعة جزئيا عالقة على ذلك من العفن PDMS أسفل والشرائح الزجاجية.
- قطع ورقة PMMA سميكة 175 ميكرومتر في الأبعاد القياسية لشريحة زجاجية المجهر (3 × 1 بوصة) وتقشر أوراق الحماية البلاستيكية من كل جانب من قطعة PMMA. اضغط بلطف على الجمعية من العفن PDMS العلوي و NOA الشفاء جزئيا 81 على قطعة PMMA(الشكل 1J).
- علاج مرة أخرى NOA 81 عن طريق التعرض للأشعة فوق البنفسجية لمدة 60 ثانية وإزالة العفن PDMS العلوي(الشكل 1K). الراتنج يتمسك بركيزة PMMA دون أي علاج آخر.
ملاحظة: يمكن إعادة استخدام قوالب PDMS ما يصل إلى 5 مرات تقريبًا بعد غسلها بالإيزوبروبانول والأسيتون ، طالما أن القوالب ليست منحنية. يتم دمج غشاء غسيل الكلى RC في ملصق NOA 81 ولا يلزم أي تلاعب أو لقط ميكانيكي إضافي.
4. موصلات Fluidic
ملاحظة: يتكون تصميم رقاقة microfluidic من قناة سائلة خطية لمحلول التبلور وخزان مركزي لعينة البروتين (خزان البروتين) ، وكلاهما يظهر من أعلى منظر لرقائقين في الشكل 2A. يتم تضمين غشاء غسيل الكلى RC بين هذين microstructures(الشكل 2D)وتتطور عملية التبلور في حين أن الملوثات من محلول التبلور منتشر عبر الغشاء بسبب تدرج التركيز بين مقصورتين من الرقاقة التي يتم فصلها بواسطة الغشاء. microfluidic قناة مطبوع على أسفل PDMS العفن (الشكل 1F). بمجرد الانتهاء من بروتوكول تصنيع الرقائق ، تقع القناة الخطية على الطبقة السفلية من ملصق NOA 81 على اتصال مع الركيزة PMMA ، كما هو موضح في الشكل 1K. يوجد مدخل ونقطة وصول منفذ لمحلول التبلور في كل نهاية القناة الخطية وتبدو وكأنها ثقوب (ارتفاع إجمالي 90 ميكرومتر) كما يمكن رؤيتها في الشكل 2A. لمعالجة حل التبلور، يجب إضافة الموصلات على نقاط الوصول.
- الروابط السندات التي هي متاحة تجاريا (NanoPort) على مدخل ومخرج من قناة microfluidic مع الغراء الايبوكسي سريع(الشكل 2C).
- اختيار القطر المناسب من أنابيب PTFE على أساس حجم الموصلات. سيتم استخدام أنابيب PTFE لإدخال محلول التبلور في القناة المائعة للرقاقة.
ملاحظة: يوصى بمجموعات متوفرة تجارياً للتحكم السهل والدقيق في معدل التدفق وعادة ما يتم دمجها مع أنظمة التحكم الآلي بالضغط أو التدفق (مضخات الحقن) للخلط ومعالجة السوائل. ومع ذلك، يمكن إدخال محلول التبلور يدويًا في القناة الخطية باستخدام حقنة بلاستيكية يمكن التخلص منها. في هذه الحالة، يتم اقتراح الخطوات من 4.3 إلى 4.5. - ملء حقنة 1 مل المتاح مع حل التبلور. بالنسبة للرقائق المعروضة في هذا البروتوكول ، 400 ميكرولتر كافية من أجل ملء القناة الملهية بالكامل.
- قطع اثنين من النصائح ماصة بحيث قطر طرف في جانب واحد يساوي القطر الداخلي للأنبوب PTFE التي سيتم استخدامها للتعامل مع الحل. الغراء النصائح اقتصاص على نقاط الوصول من القناة مع الغراء الايبوكسي سريع(الشكل 2B).
- توصيل حقنة مع النصائح اقتصاص مع قطعة من أنبوب PTFE من الحجم المناسب وإدخال الحل داخل القناة عن طريق دفع باستمرار المكبس حقنة ببطء.
5. التغليف البروتين
ملاحظة: لا يزال نمط الشريحة المخصصة لاستخدامها كمخزن البروتين مفتوحًا حتى الآن على الغلاف الجوي. ويقترح البروتوكول التالي لحصر عينة البروتين بعناية داخل رقاقة microfluidic.
- يدويا ماصة قطرات من عينة البروتين داخل خزان البروتين، وتقع على حق على غشاء غسيل الكلى RC، كما هو موضح في الشكل 2E. حجم عينة البروتين يختلف وفقا لتصميم رقاقة ويمكن أن يكون 0.1 أو 0.3 μL.
- تطبيق طبقة رقيقة من الشحوم سيليكون عالية الفراغ في جميع أنحاء خزان البروتين.
- قطع قطعة صغيرة من ورقة PMMA سميكة 175 ميكرومتر ووضعها بلطف فوق طبقة رقيقة من الشحوم السيليكون. يجب أن تغطي قطعة PMMA السطح الكامل لخزان البروتين حيث يتم إيداع محلول البروتين.
ملاحظة: يتم استخدام الشحوم السيليكون لتعزيز ضيق الهواء ومنع انتشار قطرات البروتين. لا يوجد أي رابطة أو ختم بين قطعة PMMA المستخدمة في تغطية خزان البروتين وملصق NOA 81. الاتصال بينهما هو واجهة صلبة / صلبة. من أجل إنتاج ختم شامل وتغليف الهواء ضيق من عينة البروتين، يتم استخدام قطعة من شريط كابتون كما هو موضح في الخطوة 5.4.
ملاحظة: من الصعب في بعض الأحيان حصر عينة البروتين داخل تجويف مخصص للجهاز (خزان البروتين) عند استخدام نظام يحركه الضغط لإدخال محلول التبلور داخل القناة المائعة (الخطوة 6.4). لتجنب المشكلة المذكورة أعلاه، ينبغي الحفاظ على قيم الضغط المنخفض نسبياً أثناء تعميم حل التبلور. وهناك ضغط حقن من 20-60 mbar لحلول مائي أو 50-150 mbar لأكثر من الحلول اللزجة (PEGs، الجلسرين) ويقترح19. - قطع قطعة من شريط كابتون (20 ميكرومتر سميك) كبيرة بما يكفي لتغطية قطعة PMMA تعيين فوق خزان البروتين والتمسك رقاقة NOA حول جميع الحواف. يتم تغليف عينة البروتين داخل الخزان والرقاقة جاهزة للاستخدام في تجربة التبلور ، كما هو موضح في الشكل 2C.
ملاحظة: يمكن إعادة استخدام الرقائق عدة مرات طالما لم يتم اتدهور غشاء غسيل الكلى والالتصاق من NOA على الركيزة PMMA. إذا كانت هذه الأجزاء من الشريحة معطوبة، يتم ملاحظة التسريبات التحقق من أنه لم يعد من الممكن استخدام الجهاز. غسل رقائق يعتمد على حل التبلور. في حالة حلول اللزوجة المنخفضة (الأملاح، والمخازن)، يمكن غسلها من قبل قناة مائعة فقط إدخال الماء المقطر والسماح لها بالتدفق لبضع دقائق. 400 μL هو الحجم المطلوب من أجل تبادل تماما حل داخل القناة مع حل آخر. في حالة وجود حلول أكثر لزوجة (PEGs، الجلسرين)، لا ينصح بإعادة استخدام الرقائق لأن غسل القناة فقط بالماء غير كافٍ. الجزء العلوي من رقاقة، حيث يقع خزان البروتين، ويمكن أيضا أن يغسل بالماء المقطر وتجفيفها مع الهواء المضغوط.
6. على رقاقة البروتين تبلور
- وزن lyophilized البيض البيض الأبيض lysozyme مسحوق ويذوب في الماء المقطر للحصول على تركيز النهائي من 30 ملغ مل-1.
- تصفية محلول البروتين من خلال مرشح 0.22 ميكرومتر والطرد المركزي لمدة 5 دقائق في أعلى سرعة في 293 K لإزالة جميع الجسيمات الصلبة. استخدام المناط لتجربة التبلور.
- إعداد 500 ميكرولتر من محلول التبلور الذي يحتوي على العازلة والمدفع في التركيزات المقدمة في الجدول 1. تصفية الحل من خلال مرشح 0.22 ميكرومتر.
- حقن الحل في نقطة مدخل من رقاقة مع حقنة أو نظام مائع يحركها الضغط الآلي أو مضخة حقنة، كما هو موضح في الخطوات 4.1-4.5.
ملاحظة: يمكن أن تحدث تجربة التبلور إما تحت حالة ثابتة، إذا كانت القناة microfluidic مليئة بمحلول التبلور وتوضع جانباً، أو تحت ظروف التدفق، إذا تم حقنها باستمرار داخل القناة بمعدل تدفق ثابت. بالنسبة للحالة الأخيرة ، يوصى باستخدام نظام خارجي مدفوع بالضغط أو مضخة حقنة. تحقيق التجربة في ظل ظروف التدفق يوفر أيضا إمكانية تبادل حلول التبلور بشكل حيوي داخل قناة سائلة. وهكذا، يمكن إجراء تجارب متعددة أثناء استخدام عينة البروتين نفسها. - بمجرد أن تمتلئ القناة المائعة بمحلول التبلور ، قم بختم منافذ مدخل ومنافذ توصيل الرقاقة بشريط بارا فيلم.
- الميette الحجم المناسب من محلول البروتين داخل خزان البروتين وتغليف عينة البروتين كما هو موضح في الخطوات 5.1-5.4.
- تخزين الشريحة في 293 K.
ملاحظة: يتبع التبلور عن طريق غسيل الكلى مسارًا حركيًا مختلفًا عن التجارب التي أجريت باستخدام طريقة نشر البخار أو تبلور الدفعة ويعتمد بشكل عميق على طبيعة الجزيئات المتعجلة المشاركة في عملية الانتشار ، وفقًا للبيانات المقاسة51، وقد يستغرق الأمر المزيد من الوقت لبدء النوى. من أجل منع التبخر، إن وجدت، خلال هذه الفترة، وضع رقاقة في جو الرطوبة المشبعة عند 293 K.
7. في الموقع وعلى رقاقة الأشعة السينية حيود
- دعم مطبوع ثلاثي الأبعاد للخطوط الشعاعية
- اطبع الدعم الذي يمكن أن يحمل حتى ثلاثة رقائق في وقت واحد. أبعاد الدعم هي نفس أبعاد لوحات التبلور التجارية (96 جيدا / SBS القياسية) متوافقة مع في تجارب الحيود في لوحة الأشعة السينية.
ملاحظة: يمكن تعيين طباعة الدعم إلى الخدمات التجارية. وقد صمم هذا الدعم باستخدام برنامج تصميم 3D-CAD ويظهر في الشكل 3A أثناء تجارب تبلور البروتين على رقاقة وفي الشكل 3B أثناء جمع بيانات الحيود في الموقع بالأشعة السينية في BM30A-FIP (ESRF). - اثبِ رقاقات غسيل الكلى على الدعم باستخدام شريط أحادي أو مزدوج الوجهين.
- اطبع الدعم الذي يمكن أن يحمل حتى ثلاثة رقائق في وقت واحد. أبعاد الدعم هي نفس أبعاد لوحات التبلور التجارية (96 جيدا / SBS القياسية) متوافقة مع في تجارب الحيود في لوحة الأشعة السينية.
-
في الموقع حيود الأشعة السينية
- جمع بيانات الحيود بالأشعة السينية في درجة حرارة الغرفة من البلورات المزروعة في خزان البروتين. على سبيل المثال، استخدام الأشعة السينية مع طاقة 12.656 كيلوفولت، وتدفق من 3.32 × 1010 فوتوناتق -1 وحجم شعاع 250 × 250 ميكرومتر2. تسجيل الصور الحيود مع كاشف ADSC الكم 315r مع مصفوفة من 3 × 3 CCD لسطح نشط من 315 × 315 مم2 و 9.4 ميجا بكسل القرار.
ملاحظة: تم جمع بيانات الحيود لبلورات الليسوزيم التي نمت على رقائق غسيل الكلى في خط شعاع BM30A-FIP في مرفق الإشعاع السنكروترون الأوروبي (ESRF). ومع ذلك، قد يختلف حجم الشعاع وتدفقها ونوع الكاشف في مصادر الإشعاع الأخرى بالأشعة السينية. يتيح الدعم المطبوع ثلاثي الأبعاد تجميع البيانات بنطاق الزاوي من -40 إلى +40 درجة حول البلورة. ويرد في الجدول 2ملخصاً عدد بلورات اللوزيم المعرضة لجمع البيانات في الموقع، وعدد أنماط الحيود التي تم جمعها لكل بلورة، ونطاق زاوية التذبذب لكل تعرض، ووقت التعرض.
- جمع بيانات الحيود بالأشعة السينية في درجة حرارة الغرفة من البلورات المزروعة في خزان البروتين. على سبيل المثال، استخدام الأشعة السينية مع طاقة 12.656 كيلوفولت، وتدفق من 3.32 × 1010 فوتوناتق -1 وحجم شعاع 250 × 250 ميكرومتر2. تسجيل الصور الحيود مع كاشف ADSC الكم 315r مع مصفوفة من 3 × 3 CCD لسطح نشط من 315 × 315 مم2 و 9.4 ميجا بكسل القرار.
- معالجة البيانات
- معالجة مجموعات البيانات كاملة أو جزئية مع أنماط الحيود لبلورات lysozyme مع برنامج XDS48.
- إنشاء ملف HKL لكل مجموعة بيانات وتحجيمها باستخدام برنامج XSCALE48.
- استخدام الاستبدال الجزيئي مع برنامج Phaser من جناح CPP449 وتحديد مراحل لبناء نموذج. لهذه الخطوة، استخدم إحداثيات 3D المعروفة من lysozyme من إدخال 193L بنك بيانات البروتين (PDB).
- صقل الهيكل باستخدام فينيكس52 وفحص نموذج البروتين النهائي باستخدام COOT50.
النتائج
رقائق microfluidic التي وضعتها Junius وآخرون19،45 متوافقة مع كل من تبلور البروتين على رقاقة مع طريقة غسيل المجهر وفي الموقع في جمع البيانات الحيود الأشعة السينية في درجة حرارة الغرفة. صور من الرقائق الدقيقة، وتصميمها مفصلة، والموصلات fluidic، وغشاء غسيل الكلى RC موضحة في الشكل 2. يتم إعداد تجارب التبلور عن طريق الأنابيب يدويا عينة البروتين مباشرة في خزان البروتين وإدخال حل التبلور في قناة سائلة خطية مع نظام آلي يحركها الضغط أو مضخة حقنة أو يدويا مع المعونة من حقنة. يمكن تمييز خزان البروتين والقناة السائلة في الشكل 2A. تصاميم لتصنيع رقائق مع 0.1 μL أو 0.3 μL الحد الأقصى لحجم خزان البروتين في الشكل 2A على اليسار واليمين ، على التوالي. رقائق مع 0.2 μL أو 0.7 μL أقصى قدرة لعينة البروتين تظهر في مكان آخر19. تسليط الضوء على البروتوكول لتصنيع الجهاز يمكن تضييقها على استخدام فوتوكول القائمة على thiolene الراتنج NOA 81 تضمين أغشية غسيل الكلى RC المتاحة تجاريا من مختلف MWCOs. أثناء تصنيع الأجهزة microfluidic، ومصقول قناة خطية مطبوعة على القالب PDMS السفلي (الشكل 1F)، في حين أن قالب PDMS العلوي يتكون فقط من أعمدة منقوشة لخزان البروتين ومنافذ مدخل ومنفذ (الشكل 1F). مرة واحدة يتم crosslinked NOA 81 ويتم إزالة قوالب PDMS من الجمعية (الشكل 1K)، وتقع القناة سائل في الطبقة السفلى من رقاقة وتوجد قناة البروتين والمنافذ مدخل / منفذ على كلتا الطبقتين. يوضح الشكل 1L تخطيطية جانبية لرقاقة غسيل الكلى حيث يتم الإشارة إلى جميع طبقات الجهاز وسمكها. ارتفاع الأنماط المطبوعة على الطبقة السفلية من رقائق (قناة سائلة) هو ما يقرب من 45 ميكرومتر، في حين أن الارتفاع الإجمالي للمنافذ مدخل ومنافذ مخرج هو حوالي 90 ميكرومتر. كما يُظهر خزان البروتين (ارتفاع 45 ميكرومتر) في الشكل 2D و2E. وقد تم التحقيق في محاذاة الطبقتين تحت المجهر البصري وقطعة من غشاء غسيل الكلى RC دمجها في رقاقة يمكن تمييزها بوضوح في الشكل 2D. في نفس الشكل ، تم محاصرة الهواء داخل القناة المائعة أثناء حقن محلول التبلور ، كما يمكن رؤيته في الجزء العلوي الأيسر من خزان البروتين. الشكل 2E هو صورة عن قرب لخزان البروتين بعد الترسب اليدوي من قطرات البروتين مع ماصة وقبل تغليف القطيرة مع قطعة من PMMA وشريط كابتون، كما هو موضح في الخطوتين 5.2 و 5.3 من البروتوكول. رقاقة microfluidic جاهزة لاستخدامها في تجارب التبلور، بعد تغليف عينة البروتين وإلتصاق الموصلات السوائل، يصور في الشكل 2C. يضمن التجميع محكم الهواء عدم حدوث التسربات. يمكن أن تكون الموصلات السوائل للمنافذ مدخل ومنفذ من قناة microfluidic إما تلك المتاحة تجاريا كما هو موضح في الخطوة 4.1 من البروتوكول والمبين في الشكل 2C، أو نصائح الماصات المختبرية المتاح يمكن استخدامها لنفس الغرض(الشكل 2B، بروتوكول الخطوة 4.4).
ولتصنيع رقائق microfluidic، تم اختيار المواد الشفافة بصرياً وغير واضحة بيولوجياً، مما يدل على توافق عال لتجارب الحيود في الموقع بالأشعة السينية في درجة حرارة الغرفة. التفاعلات من الأشعة السينية، وامتصاص وتشتت، مع المواد التي تؤلف الجهاز microfluidic والغلاف الجوي المحيط (الهواء) تولد إشارة تعرف باسم الضوضاء الخلفية. هذا الضجيج يلخص إشارة الحيود من بلورات البروتين المسجلة بواسطة كاشف، تتحلل نسبة الإشارة إلى الضوضاء وينبغي الحفاظ على أقل قدر ممكن من خلال جمع البيانات الحيود الأشعة السينية. لقد قمنا بتقييم الضوضاء الخلفية الناتجة عن المواد التي تتكون من خزان البروتين ، والذي هو في المسار المباشر لشعاع الأشعة السينية. يتكون خزان البروتين من غشاء غسيل الكلى RC، شريط كابتون وقطعتين من PMMA، واحدة تستخدم كركيزة للرقائق الدقيقة والأخرى تستخدم لتغليف عينة البروتين. سمك PMMA هو 2 × 175 ميكرومتر ، من شريط كابتون 20 ميكرومتر ، وغشاء غسيل الكلى RC هو ما يقرب من 40 ميكرومتر سميكة (الشكل 1L). ويبلغ إجمالي سمك هذه الطبقات حوالي 410 ميكرومتر، ولا توجد طبقة NOA 81 في مسار الأشعة السينية المباشر. وبصرف النظر عن سمك مواد التصنيع، وكثافتها هي أيضا حاسمة لقياس الضوضاء مبعثر الخلفية، كما يزيد تشتت الأشعة السينية مع عدد الذرية عنصري. ولهذا السبب، استخدم تدفق الهيليوم (وهو ميزة مقدمة في BM30A-FIP في ESRF) بدلاً من الهواء أثناء جمع البيانات لتوصيف المواد وتجارب حيود البروتين. يوضح الشكل 3C الضوضاء الخلفية الناتجة عن شريط كابتون، وغشاء غسيل الكلى RC، وورقة PMMA، وتجميعها في الغلاف الجوي للهيليوم. وقد تعرضت كل مادة لمدة 20 s للأشعة السينية من 0.98 الطول الموجي وكانت مسافة الكشف عن العينة 200 ملم. وقد أجريت التجارب على خط الحزم BM30A-FIP في ESRF، كما هو موضح في الخطوة 7 من البروتوكول. يمكن تمييز الحلقات المنتشرة المنسوبة إلى تفاعلات شعاع الأشعة السينية مع المواد لشريط كابتون بدقة أقل من 4 Å ، ورقة PMMA بين 4-8 Å ، وغشاء غسيل الكلى بين 4-5 Å القرار. ويلاحظ أساسا الضوضاء الخلفية الناتجة عن رقاقة غسيل الكلى في قرار أقل من 6 Å التي لا تؤثر على علاج بيانات الحيود عالية الدقة من بلورات lysozyme كبيرة. الخلفية تشتت كثافة كدالة من القرار للرقاقة والمواد منفصلة تظهر في مكان آخر19. في القياس المعروض في الشكل 3C، كانت رقاقة غسيل الكلى فارغة من أي حل (محلول البروتين أو المتعجل) ولم يتم قياس مساهمة وجود حل للضوضاء الخلفية. وقد شنت رقائق أمام شعاع الأشعة السينية مع دعم 3D المطبوعة(الشكل 3B)مصممة لتجارب الحيود في الموقع 19. ومع ذلك ، يمكن استخدام نفس الدعم مع أبعاد مساوية لأبعاد لوحة تبلور قياسية 96-well /SBS ، لتنفيذ تجارب 1 إلى 3 تبلور في وقت واحد ، كما يمكن أن تعقد ما يصل الى 3 رقائق في وقت واحد (الشكل 3A).
أجريت تجارب لتقييم كفاءة الأجهزة microfluidic لبلورة على رقاقة من البروتينات القابلة للذوبان نموذج مع طريقة غسيل المجهر. تم ملء القناة السائلة كما هو موضح في الخطوة 4 من البروتوكول، في حين وصفت الخطوتان 5 و6 كيفية تغليف عينة البروتين داخل خزان البروتين المخصص وكيفية إعداد تجارب التبلور. ويبين الشكل 4 بلورات lysozyme نمت في 293 K تحت 1.5 M كلوريد الصوديوم (NaCl) مع 0.1 M خلات الصوديوم (CH3COONA) 4.0 (A) وتحت 1 M NaCl ، 0.1 م CH3 31555 1999 مع 30٪ البولي ايثيلين جلايكول (PEG) 400 (B). تم حل مسحوق lysozyme lyophilized في الماء إلى تركيز نهائي من ~ 30 ملغ مل-1 أو في 20 مل CH33 150000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 وكان حجم عينة البروتين في كلتا التجارب حوالي 0.3 ميكرولتر و MWCO من غشاء غسيل الكلى RC جزءا لا يتجزأ من الرقائق الدقيقة يكمن في نطاق 6-8 كيلو Da. بلورات lysozyme هو مبين في الشكل 3A نمت في غضون 1 ساعة والبلورات في الشكل 3B نمت في غضون 30 دقيقة من بداية التجربة. وقد أجريت تجارب التبلور في ظل ظروف ثابتة. ومع ذلك، فقد تبين19 أن إجراء التجارب في ظل ظروف التدفق يوفر إمكانية تبادل حيوي لشروط التبلور والرسوم البيانية مرحلة الدراسة، والتحقق من عكس طريقة غسيل المجهر.
في الموقع تم جمع بيانات الحيود بالأشعة السينية من بلورات اللوزيم الموضحة في الشكل 4A لإثبات مدى ملاءمة رقائق غسيل الكلى لمثل هذه التجارب. تم جمع البيانات في خط الحزم BM30A-FIP (ESRF) في درجة حرارة الغرفة، كما هو موضح في الخطوة 7.2.1 من البروتوكول. تم تركيب الرقائق الدقيقة عند خط الشعاع بمساعدة الدعم المطبوع ثلاثي الأبعاد(الشكل 3B)وتم جمع مجموعات كاملة من بيانات الحيود بالأشعة السينية من بلورتين مفردتين مزروعتين على الشريحة تحت الظروف المعطاة في السطر الثاني من الجدول 1. تم معالجة الانعكاسات الملحوظة لمجموعات البيانات وفهرسها ودمجها باستخدام XDS48 وتم إنجاز الاستبدال والصقل الجزيئي باستخدام Phaser49 و Phenix52على التوالي. وترد في الجدول 2الإحصاءات البلورية لمجموعة البيانات الكاملة لكل بلورة lysozyme و لدمج مجموعتي البيانات. لاستبدال الجزيئية، تم استخدام إدخال PDB 193L.
وقد تم الحصول على خرائط كثافة الإلكترون من الكريستال lysozyme واحد ومجموعة البيانات المدمجة من بلورتين في 1.95 Å و 1.85 Å على التوالي، ويتضح في الشكلين 5A و 5B. تُظهر كل من خرائط كثافة الإلكترونات معلومات هيكلية مفصلة يمكن الحصول عليها من خلال تجارب الحيود في الموقع بالأشعة السينية التي أجريت مباشرة على رقاقة غسيل الكلى في درجة حرارة الغرفة من بلورة واحدة أو من بلورات متعددة، مما يجعل الرقائق متوافقة مع دراسات البلورات في الموقع بالأشعة السينية.
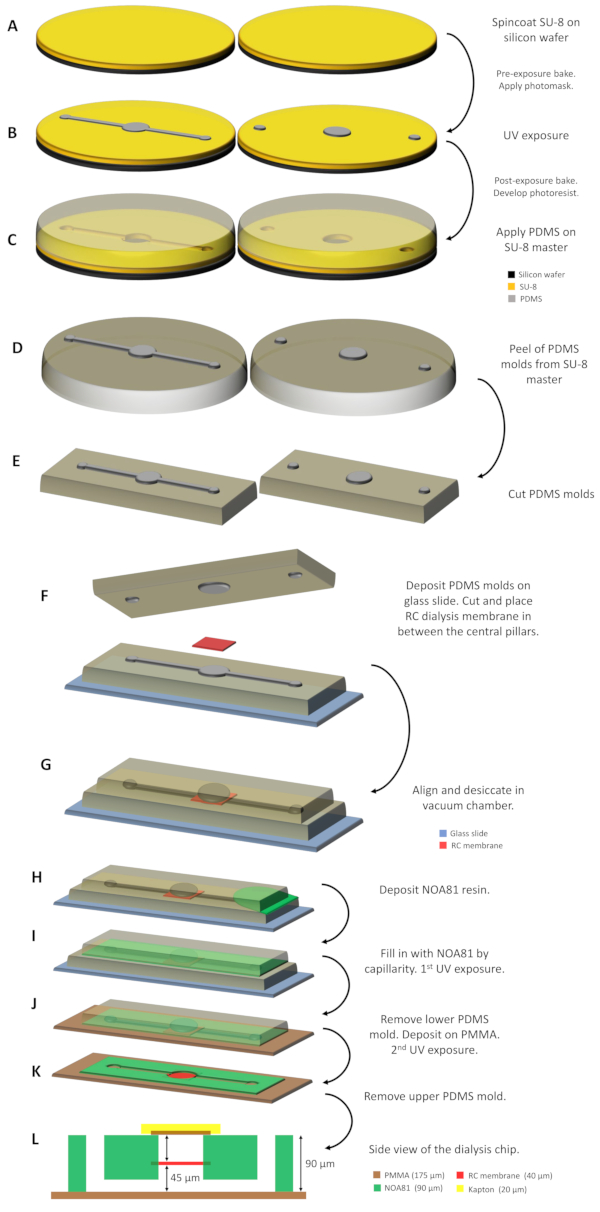
الشكل 1: الرسم التخطيطي لرقائق غسيل الكلى. (A) يتم إيداع راتنج SU-8 على ورقتين من السيليكون ومغلفة. (ب) يتم الحصول على سيد SU-8 بعد تشعيع جهاز التصوير الضوئي مع ضوء الأشعة فوق البنفسجية من خلال قناع ضوئي وتطوير الأجزاء غير المكشوفة. (C) يتم الاستغناء PDMS على سادة SU-8 وبعد أن عالج في 338 K لمدة 1 ساعة،(D)قوالب PDMS 2 التي تنتجها صب النسخ المتماثلة وبصمة يتم تقشير أنماط صغيرة من الماجستير و (E) قطع إلى الحجم المناسب. (F) يتم دعم قوالب PDMS على شريحة زجاجية تتضمن غشاء غسيل الكلى RC بين الركيزتين المركزيتين. (G) ثم يتم محاذاة 2 قوالب PDMS و desiccated لمدة ~ 30 دقيقة في غرفة فراغ. (H) يتم صب الراتنج NOA 81 بين القالبين و (I) يملأ المساحة بواسطة الشعيرات الدموية. (J)بعد التعرض الأول للأشعة فوق البنفسجية، تتم إزالة العفن PDMS السفلي ويتم إيداع التجميع على ورقة PMMA. (K) التعرض للأشعة فوق البنفسجية الثانية يلي من أجل البلمرة بالكامل الراتنج NOA 81 وشريحة غسيل الكلى جاهز للاستخدام بعد إزالة ما تبقى من العفن PDMS العلوي. (L) الجانب عرض المخططات لشريحة غسيل الكلى حيث يشار إلى جميع طبقات الجهاز وسمكها كل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
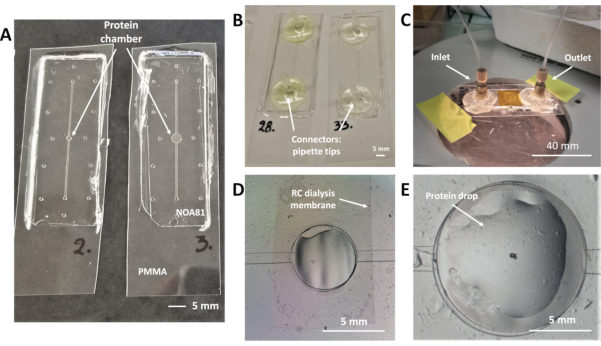
الشكل 2: رقائق غسيل الكلى التي تتضمن غشاء غسيل الكلى RC لبلورة البروتين على رقاقة والتجارب في الموقع حيود الأشعة السينية. (A) NOA 81 رقاقة على 175 ميكرومتر سميكة PMMA الركيزة مع خزان البروتين من 0.1 ميكرولتر (يسار) و 0.3 μL (يمين) الحجم الاسمي. (B) رقائق مع نصائح ماصة كما موصلات مائع لصقها على منافذ مدخل ومنفذ من قناة سائلة. (C) صورة لرقائق خلال تجربة التبلور. يتم تغليف عينة البروتين بقطعة من 175 ميكرومتر ورقة PMMA سميكة وشريط كابتون. يتم استخدام موصلات Nanoport Peek لمنفذ مدخل ومنافذ مخرج القناة المائعة. (D) منظر علوي للخزان البروتيني أثناء دوران محلول التبلور داخل القناة المائعة. الهواء محاصر في الجزء العلوي من الخزان مباشرة تحت غشاء غسيل الكلى RC، والتي يمكن الكشف عنها بوضوح. (E) عرض علوي لخزان غسيل الكلى من خلال المجهر البصري أثناء ترسب عينة البروتين. يتم إيداع قطرات البروتين مباشرة فوق غشاء غسيل الكلى RC المضمنة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: الدعم المطبوع ثلاثي الأبعاد (A) للرقائق الدقيقة المستخدمة أثناء تجارب التبلور و (B) المثبت أمام شعاع الأشعة السينية عند خط شعاع BM30A-FIP في ESRF لتجارب الحيود في الموقع بالأشعة السينية. (C) الضوضاء الخلفية الناتجة عن تفاعل الأشعة السينية مع Kapton، RC غشاء غسيل الكلى، PMMA، ورقاقة غسيل الكلى (من اليسار إلى اليمين). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
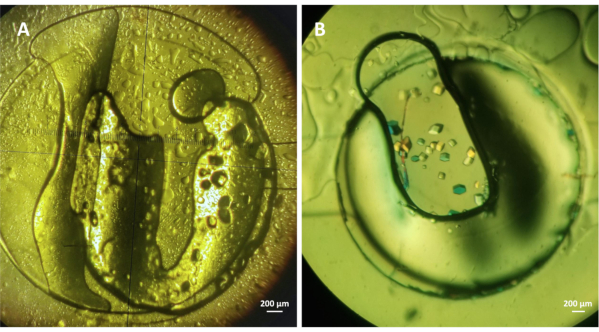
الشكل 4: على رقاقة تبلور lysozyme مع طريقة غسيل الكلى. (A) Lysozyme (~ 30 ملغ مل-1) بلورات نمت على رقاقة تحت 1.5 M NaCl و 0.1 م CH3 11 1 1 50000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 0.1 م CH3COONA pH 4.5، و 30٪ PEG 400. وقد أجريت كلتا التجربتين على 293 K. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: خرائط كثافة الإلكترون من هيكل lysozyme المكرر من (أ) بلورة واحدة و (ب) مجموعة البيانات المدمجة من اثنين من البلورات نمت على رقاقة عن طريق الميكروفات. تم الحصول على الخرائط في 1.95 Å و 1.84 Å، على التوالي، كفاف في 1σ. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| بروتين | تركيز البروتين (ملغ مل-1) | بروتين بوفيفر | التركيز الأولي لـ حل متهور | MWCO من RC غشاء غسيل الكلى (kDa) | درجة الحرارة (كاف) | ||
| ليسوزيمي | ~ 30 | الماء | 1.5 م ناكل 0.1 م CH3COONA pH 4.0 | 6 - 8 | 293 | ||
| ليسوزيمي | ~ 20 | 20 mM CH3COONa pH 4.2 | 1 م ناكل 0.1 م CH3COONA pH 4.5 30٪ وحدة 400 | 6 - 8 | 293 | ||
الجدول 1: تكوين العازلة البروتينية والحل المتعجل لبلورة على رقاقة من lysozyme مع طريقة غسيل المجهر. واستخدمت بلورات اللوزيل التي نمت على الرقاقة مع الظروف المنصوص عليها في السطر الثاني لجمع بيانات الحيود بالأشعة السينية في الموقع.
| بروتين | ليسوزيمي | ليسوزيمي | ليسوزيمي |
| عدد من البلورات | 1 | 1 | 2 |
| عدد إطارات الحيود | 40 | 30 | 70 |
| التذبذب (°) لكل تعرض | 1 | 1 | |
| وقت التعرض (ق) | 30 | 30 | |
| درجة الحرارة (K) | 293 | 293 | 293 |
| مجموعة الفضاء | P43212 | P43212 | P43212 |
| معلمات خلية الوحدة | 78.86 78.86 37.87 90.0 90.0 90.0 | 79.17 79.17 37.95 90.0 90.0 90.0 | 78.47 78.47 37.65 90.0 90.0 90.0 |
| نطاق القرار (Å) | 27.31 - 1.95 (2.02 - 1.95) | 27.39 - 1.96 (2.03 - 1.96) | 27.17 - 1.85 (1.91 - 1.85) |
| الفسيفساء (°) | 0.319 | 0.121 | |
| إجمالي الانعكاسات (لوحظ) | 25127 (3552) | 19991 (3001) | |
| انعكاسات فريدة من نوعها (لوحظ) | 8641 (1357) | 8295 (1321) | 10404 (975) |
| ريدودسي | 2.90 (2.61) | 2.41 (2.27) | |
| اكتمال (٪) | 95.0 (94.8) | 91.9 (93.3) | 98.23 (93.15) |
| يعني i/σ | 6.83 (1.16) | 7.09 (1.66) | 3.7 |
| CC(1/2) | 99.1 (42.4) | 97.9 (37.0) | 97.0 |
| R-دمج | 0.184 | ||
| R-meas | 0.139 | 0.221 | 0.219 |
| R-pim | 0.116 | ||
| تأملات تستخدم في صقل | 8645 (787) | 8451 (857) | 10391 (965) |
| انعكاسات تستخدم لR-free | 864 (78) | 846 (85) | 1039 (96) |
| R-العمل | 0.1988 (0.2968) | 0.1853 (0.2872) | 0.1839 (0.3102) |
| خالية من R | 0.2430 (0.3437) | 0.2297 (0.3622) | 0.2207 (0.3703) |
| عدد ذرات غير الهيدروجين | 1069 | 1071 | 1096 |
| الجزيئات الكبيرة | 1012 | 1012 | 1012 |
| الماء | 55 | 57 | 82 |
| يغاند | 2 | 2 | 2 |
| بقايا البروتين | 131 | 131 | 131 |
| RMS (السندات، Å) | 0.008 | 0.009 | 0.005 |
| RMS (الزوايا، °) | 1.17 | 1.26 | 1.05 |
| يفضل راماشاندران (٪ ) | 98.43 | 97.64 | 99.21 |
| راماشاندران مسموح بها (٪) | 1.57 | 2.36 | 0.79 |
| راماشاندران القيم المتطرفة (٪) | 0.00 | 0.00 | 0.00 |
| عامل أفيغار B | 34.26 | 28.54 | 24.34 |
| بروتين | 33.94 | 28.14 | 23.62 |
| الماء | 40.23 | 35.57 | 33.16 |
| يغاندس | 33.23 | 29.63 | 24.77 |
الجدول 2: بارامترات جمع البيانات، وإحصاءات البلورات والصقل لبلورات الليشائيات المزروعة على الرقاقة عن طريق طريقة التحليل المجهري. القيم المتوفرة بين قوسين تتوافق مع أعلى دقة وضوح. يتوافق العمود الرابع مع القيم التي تم الحصول عليها بعد دمج مجموعات البيانات من العمود الثاني والثالث.
Discussion
وقد تم تطوير جهاز microfluidic لبلورة البروتين على رقاقة مع طريقة غسيل الكلى المجهري وتجارب الحيود في الموقع الأشعة السينية في درجة حرارة الغرفة. يمكن أن تكون ملفقة رقائق NOA 81 دمج أغشية غسيل الكلى RC من أي MWCO من أجل استخدام التحليل الدقيق لبلورة البروتين على رقاقة. واستخدمت مواد تصنيع ذات شفافية عالية نسبياً للأشعة السينية، مما يجعل الرقائق متوافقة مع علم البلورات البروتيني في الموقع. تم تقييم مواد التصنيع التي تؤلف المقصورة لبلورة البروتين من الجهاز (PMMA، Kapton، RC غشاء غسيل الكلى) لتوليد ضوضاء خلفية منخفضة. على وجه التحديد، ويلاحظ أساسا الضوضاء الخلفية الناتجة عن رقاقة غسيل الكلى في دقة منخفضة (> 6 Å) ولا يؤثر على علاج بيانات الحيود عالية الدقة من بلورات lysozyme كبيرة المطلوبة لتحديد بنية البروتين. يتم تضخيم أتمتة جمع البيانات باستخدام دعم مطبوع ثلاثي الأبعاد يمكن تركيبه مباشرة في خطوط شعاع البلورات الجزيئية الصغيرة وتحمل ما يصل إلى ثلاث رقائق في وقت واحد. وبهذه الطريقة، يتم تجنب الحصاد اليدوي والتلاعب ببلورات البروتين الهشة. وعلاوة على ذلك، جمع البيانات تجري في درجة حرارة الغرفة، وتجنب الحاجة إلى cryoprotection التي يمكن أن تكون ذات صلة للتغيرات التكون من بنية البروتين الأصلي2،3.
استخدام المجهر كوسيلة لزراعة البلورات على رقاقة يسمح بدقة رصد ومراقبة عملية التبلور. كما نوقش في المقدمة، وقد تم تنفيذ معظم أساليب تبلور البروتين التقليدية باستخدام الأجهزة microfluidic11،14. ومع ذلك، لم يتم بعد استغلال مزايا غسيل الكلى لبلورة البروتين بشكل كامل في النطاق الصغير. يوفر التحليل المجهري على رقاقة إمكانية لدراسة الرسوم البيانية المرحلة وإجراء الفرز والاستفادة المثلى من ظروف التبلور مع عينة البروتين نفسه19. بالنسبة للنماذج الأولية المعروضة في هذا العمل ، يقتصر استهلاك البروتين لكل شريحة إلى 0.1 أو 0.3 ميكرولتر . يتضمن بروتوكول التصنيع العديد من الخطوات ولكنه مباشر ويمكّن من تصنيع العديد من الأجهزة (20 إلى 30 رقائق) في يوم واحد في الغرفة النظيفة ، مع مواد غير مكلفة نسبيًا. ومع ذلك، يمكن أن يكون تبلور على رقاقة من البروتينات إجراء دقيق نظرا للطبيعة الذاتية العشوائية من التنو ونمو البلورات، وخاصة في النطاق الصغير. وقد وصفت دراسة حالة، حيث استخدمت ظروف راسخة لبلورة اللوزيم الذي أسفر عن بلورات قوية ومحددة جيدا مناسبة لجمع بيانات الحيود بالأشعة السينية في الموقع. ومع ذلك، قد تنشأ صعوبات من استخدام أهداف أكثر تحديا للبروتينات، مثل البروتينات الغشاء، حيث متوسط التبلور هو أكثر تعقيدا بكثير، والرسوم البيانية المرحلة غير معروفة وظروف تبلور العمل الجيد ليست بعد راسخة. تقدم شريحة غسيل الكلى إمكانية تجاوز هذه الصعوبات ودراسة الرسوم البيانية للمرحلة على الشريحة ، دون التخلص من عينة البروتين القيمة والمكلفة في كثير من الأحيان ، من خلال مجرد تبادل محلول التبلور داخل القناة الدقيقة.
براعة الأجهزة microfluidic تنبع من استغلال التحليل الدقيق لبلورة البروتين على رقاقة من أجل السيطرة عكسيا ظروف التبلور وتركيز الخريطة ودرجة الحرارة متنوعة الرسم البياني مرحلة باستخدام انخفاض حجم البروتين. وعلاوة على ذلك، فإن الجهاز متوافق مع تجارب الحيود في الموقع بالأشعة السينية وprototyping من الأجهزة غير مكلفة وسريعة. يمكن أن تزرع العديد من البلورات isomorphous من البروتينات القابلة للذوبان والأغشية (في التحضير) على رقاقة ومن المتوقع أن كل هذه الميزات يمكن استخدامها لدراسات البلورات الأشعة السينية المسلسل من أهداف البروتين الصعبة في المرافق السنكروترون وXFEL. وأخيراً، فإن إجراء دراسات على الشريحة وفي الموقع يتم تحديدها زمنياً هو احتمال مستقبلي يمكن أن يكون ذا أهمية كبيرة للمجتمع البلوري. لذلك ، من خلال زراعة البلورات على رقاقة غسيل الكلى وإدخال الكواشف في قناة microfluidic ، إما يدويًا (باستخدام حقنة) أو تلقائيًا (مع نظام السوائل للتحكم في الضغط أو مضخة الحقنة) ، ستركز الجهود المستقبلية على إثبات أن رقائق microfluidic يمكن استخدامها بنجاح لتحريك التجارب التي تم حلها زمنيًا على خطوط الشعاع السنكروترونية.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
تعترف MBS بدعم MI / CNRS بموجب العقد آلات في حدود 2014-2015. NJ يعترف CEA الدولي برنامج أبحاث الدكتوراه (Irtelis) للحصول على زمالة الدكتوراه. محمد بن سلمان و SJ تعترفان بالتمويل من برنامج الاتحاد الأوروبي للبحوث والابتكار في أفق 2020 تحت اتفاقية منحة ماري سكودودوسكا كوري رقم 722687. MBS، SJ، وNJ أشكر LIPhy (UGA) لإنشاء غرفة نظيفة لتجارب microfabrication. يقر IBS بالاندماج في معهد أبحاث غرونوبل متعدد التخصصات (IRIG, CEA).
Materials
| Name | Company | Catalog Number | Comments |
| 3 in wafer | Silicon Materials Inc. | Silicon wafer | |
| Centrifuge | Eppendorf | Minispin | Bench-top centrifuge |
| CleWin 3.0 | WieWeb software | Designing software | |
| Epoxy glue | Devcon | 5 minutes epoxy glue | |
| Fluidic connectors | Cluzeau Info Lab | N-333 | NanoPort kit for 1/16" OD tubing |
| Hen egg-white lysozyme | Roche | 10 837 059 001 | Lyophilized protein powder |
| High-vacuum silicone grease | Sigma-Aldrich | Z273554 | Dow Corning high-vacuum silicone grease |
| HMDS | Sigma-Aldrich | 440191 | Silane, chemical |
| Hot plate | Sawatec | HP-200-Z-HMDS BM | Hot plate |
| Isopropyl alcohol | Sigma-Aldrich | Solvent | |
| Kapton tape | DuPont | Polyimide tape | |
| Mask aligner | SUSS MicroTec | MJB4 | Mask aligner, UV source |
| Membrane filter | Millipore | GSWP04700 | 0.22 μm pore size filter |
| Microscope glass slide | Fisher Scientific | 12164682 | 3 x 1 in glass slides |
| NOA81 | Norland Products Inc. | NOA81 | Photocurable resin |
| Oven | Memmert | Oven | |
| Parafilm | Sigma-Aldrich | P6543 | Parafilm M roll size 20 in. × 50 ft |
| PDMS | Dow Corning | Sylgard 184 | Silicone |
| PEG 400 | Hampton Research | HR2-603 | Chemical |
| Petri dish | Sigma-Aldrich | P5731 | 100 x 15 mm |
| PGMEA | Sigma-Aldrich | 484431 | Developer |
| Plasma equipment | Diener Electronic | ZEPTO | Plasma treatment |
| PMMA | Goodfellow | 137-745-63 | PMMA sheets 150x150 mm, 0.175 mm thickness |
| Pressure driven system | Elveflow | OB1 MK3+ | Pressure/vacuum controller |
| PTFE tubing | Elveflow/Darwin microfluidics | LVF-KTU-15 | PTFE tubing roll 1/16" OD X 1/32" ID |
| RC dialysis membrane | Spectra/Por | Various MWCOs | |
| Scalpel | Swann-Morton | Carbon steel surgical blades | |
| Sodium acetate | Sigma-Aldrich | S2889 | Chemical |
| Sodium chloride | Sigma-Aldrich | 746398 | Chemical |
| Solidworks | Dassault Systemes | 3D-CAD designing software | |
| Spin coater | SPS | Spin150 | Wafer spinner |
| SU-8 3000 series | MicroChem Corp. | SU-8 3050 | Photoresist |
| Syringe | BD | 309628 | 1 mL Luer-Lok syringe |
| UV crosslinker | Uvitec | CL-508 | UV crosslinker |
References
- Garman, E. F. Radiation damage in macromolecular crystallography: what is it and why should we care. Acta Crystallographica, Section D: Biological Crystallography. 66, 339-351 (2010).
- Henderson, R. The potential and limitations of neutrons, electrons and X-rays for atomic resolution microscopy of unstained biological molecules. Quarterly Reviews of Biophysics. 28 (2), 171-193 (1995).
- Fraser, J. S., et al. Accessing protein conformational ensembles using room-temperature X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16247-16252 (2011).
- Gotthard, G., et al. Specific radiation damage is a lesser concern at room temperature. IUCrJ. 6 (4), 665-680 (2019).
- Martin-Garcia, J. M., Conrad, C. E., Coe, J., Roy-Chowdhury, S., Fromme, P. Serial femtosecond crystallography: A revolution in structural biology. Archives of Biochemistry and Biophysics. 602, 32-47 (2016).
- Gicquel, Y., et al. Microfluidic chips for in situ crystal X-ray diffraction and in situ dynamic light scattering for serial crystallography. Journal of Visualized Experiments: JoVE. (134), e57133 (2018).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470, 73-78 (2011).
- Hunter, M. S., et al. Fixed-target protein serial microcrystallography with an x-ray free electron laser. Science Reports. 4, 6026 (2014).
- Pawate, A. S., et al. Towards time-resolved serial crystallography in a microfluidic device. Acta Crystallographica, Section F: Structural Biology Communications. 71, 823-830 (2015).
- Owen, R. L., et al. Low-dose fixed-target serial synchrotron crystallography. Acta Crystallographica, Section D: Structural Biology. 73, 373-378 (2017).
- Leng, J., Salmon, J. -. B. Microfluidic crystallization. Lab on a Chip. 9, 24-34 (2009).
- Morel, M., Galas, J. -. C., Dahan, M., Studer, V. Concentration landscape generators for shear free dynamic chemical stimulation. Lab on a Chip. 12, 1340-1346 (2012).
- Miralles, V., Huerre, A., Malloggi, F., Jullien, M. -. C. A review of heating and temperature control in microfluidic systems: techniques and applications. Diagnostics. 3, 33-67 (2013).
- Sui, S., Perry, S. L. Microfluidics: from crystallization to serial time-resolved crystallography. Structural Dynamics. 4, 032202 (2017).
- Hansen, C. L., Sommer, M. O. A., Quake, S. R. Systematic investigation of protein phase behavior with a microfluidic formulator. Proceedings of the National Academy of Sciences of the United States of America. 101 (40), 14431-14436 (2004).
- Laval, P., Lisai, N., Salmon, J. -. B., Joanicot, M. A microfluidic device based on droplet storage for screening solubility diagrams. Lab on a Chip. 7, 829-834 (2007).
- Shim, J. -. U., et al. Control and measurement of the phase behavior of aqueous solutions using microfluidics. Journal of the American Chemical Society. 129, 8825-8835 (2007).
- Selimovic, S., Gobeaux, F., Fraden, S. Mapping and manipulating temperature-concentration phase diagrams using microfluidics. Lab on a Chip. 10, 1696-1699 (2010).
- Junius, N., et al. A microfluidic device for both on-chip dialysis protein crystallization and in situ X-ray diffraction. Lab on a Chip. 20, 296-310 (2020).
- Greaves, E. D., Manz, A. Towards on-chip X-ray analysis. Lab on a Chip. 5, 382-391 (2005).
- Dhouib, K., et al. Microfluidic chips for the crystallization of biomacromolecules by counter-diffusion and on-chip crystal X-ray analysis. Lab on a Chip. 9, 1412-1421 (2009).
- Guha, S., Perry, S. L., Pawate, A. S., Kenis, P. J. A. Fabrication of X-ray compatible microfluidic platforms for protein crystallization. Sensors and Actuators B. Chemical. 174, 1-9 (2012).
- Sui, S., et al. Graphene-based microfluidics for serial crystallography. Lab on a Chip. 16, 3082-3096 (2016).
- Russo Krauss, I., Merlino, A., Vergara, A., Sica, F. An overview of biological macromolecule crystallization. International Journal of Molecular Science. 14, 11643-11691 (2013).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica, Section F: Structural Biology and Crystallization Communications. 70, 2-20 (2014).
- Zheng, B., Tice, J. D., Roach, L. S., Ismagilov, R. F. A droplet-based, composite PDMS/Glass capillary microfluidic system for evaluating protein crystallization conditions by microbatch and vapor-diffusion methods with on-chip X-ray diffraction. Angewandte Chemie. 43, 2508-2511 (2004).
- Talreja, S., Kim, D. Y., Mirarefi, A. Y., Zukoski, C. F., Kenis, P. J. A. Screening and optimization of protein crystallization conditions through gradual evaporation using anovel crystallization platform. Journal of Applied Crystallography. 38, 988-995 (2005).
- Hansen, C. L., Classen, S., Berger, J. M., Quake, S. R. A microfluidic device for kinetic optimization of protein crystallization and in situ structure determination. Journal of American Chemical Society. 128, 3142-3143 (2006).
- Schieferstein, J. M., et al. X-ray Transparent microfluidic platforms for membrane protein crystallization with microseeds. Lab on a Chip. 18, 944-954 (2018).
- Ghazal, A., et al. Recent advances in X-ray compatible microfluidics for applications in soft materials and life sciences. Lab on a Chip. 16, 4263-4295 (2016).
- Li, L., Ismagilov, R. F. Protein crystallization using microfluidic technologies based on valves, droplets, and SlipChip. Annual Review of Biophysics. 39, 139-158 (2010).
- Du, W., Li, L., Nichols, K. P., Ismagilov, R. F. SlipChip. Lab on a Chip. 9, 2286-2292 (2009).
- Zhang, S., et al. Microfluidic platform for optimization of crystallization conditions. Journal of Crystal Growth. 472, 18-28 (2017).
- Abdallah, B. G., et al. Protein crystallization in an actuated microfluidic nanowell device. Crystal Growth & Design. 16, 2074-2082 (2016).
- Monteiro, D. C. F., et al. A microfluidic flow-focusing device for low sample consumption serial synchrotron crystallography experiments in liquid flow. Journal of Synchrotron Radiation. 26, 406-412 (2019).
- de Wijn, R., et al. A simple and versatile microfluidic device for efficient biomacromolecule crystallization and structural analysis by serial crystallography. IUCrJ. 6, 454-464 (2019).
- Shim, J. -. U., Cristobal, G., Link, D. R., Thorsen, T., Fraden, S. Using microfluidics to decouple nucleation and growth of protein crystals. Crystal Growth & Design. 7, 2192-2194 (2007).
- de Jong, J., Lammertink, R. G. H., Wessling, M. Membranes and microfluidics: a review. Lab on a Chip. 6, 1125-1139 (2006).
- Paustian, J. S., Nery Azevedo, R., Lundin, S. T. B., Gilkey, M. J., Squires, T. M. Microfluidic microdialysis: spatiotemporal control over solution microenvironments using integrated hydrogel membrane microwindows. Physical Review X. 3, 041010 (2013).
- Kornreich, M., Heymann, M., Fraden, S., Beck, R. Cross polarization compatible dialysis chip. Lab on a Chip. 14, 3700-3704 (2014).
- Song, S., Singh, A. K., Shepodd, T. J., Kirby, B. J. Microchip dialysis of proteins using in situ photopatterned nanoporous polymer membranes. Analytical Chemistry. 76, 2367-2373 (2004).
- Skou, M., Skou, S., Jensen, T. G., Vestergaard, B., Gillilan, R. E. In situ microfluidic dialysis for biological small-angle X-ray scattering. Journal of Applied Crystallography. 47, 1355-1366 (2014).
- Zou, L., et al. A multistage dialysis microdevice for extraction of cryoprotectants. Biomedical Microdevices. 19, 30 (2017).
- Satya Eswari, J., Naik, S. A critical analysis on various technologies and functionalized materials for manufacturing dialysis membranes. Materials Science for Energy Technologies. 3, 116-126 (2020).
- Spano, M., Salmon, J. -. B., Junius, N. FR3044685A1. UJF. , (2015).
- Bartolo, D., Degre, G., Nghe, P., Studer, V. Microfluidic stickers. Lab on a Chip. 8, 274-279 (2008).
- Junius, N., et al. A crystallization apparatus for temperature controlled flow-cell dialysis with real-time visualization. Journal of Applied Crystallography. 49, 806-813 (2016).
- Kabsch, W. XDS. Acta Crystallographica, Section D: Biological Crystallography. 66, 125-132 (2010).
- Winn, M. D., et al. Overview of the CCP4 suite and current developments. Acta Crystallographica, Section D: Biological Crystallography. 67, 235-242 (2011).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and developments of COOT. Acta Crystallographica, Section D: Biological Crystallography. 66, 486-501 (2010).
- Apostolopoulou, V., Junius, N., Sear, R. P., Budayova-Spano, M. Mixing salts and polyethylene glycol into protein solutions: The effects of diffusion across semipermeable membranes and of convection. Crystal Growth & Design. 20, 3927-3936 (2020).
- Liebschner, D., et al. Macromolecular structure determination using X-rays, neutrons and electrons: recent developments in Phenix. Acta Crystallographica, Section D: Structural Biology. 75, 861-877 (2019).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Materials Science. 28, 153-184 (1998).
- Nogly, P., et al. Lipidic cubic phase injector is a viable crystal delivery system for time-resolved serial crystallography. Nature Communications. 7, 12314 (2016).
- Baxter, E. L., et al. High-density grids for efficient data collection from multiple crystals. Acta Crystallographica, Section D: Structural Biology. 72, 2-11 (2016).
- Feiler, C. G., Wallacher, D., Weiss, M. S. An all-in-one sample holder for macromolecular X-ray crystallography with minimal background scattering. Journal of Visualized Experiments. (149), e59722 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved