Method Article
مجهر القوة الذرية جنبا إلى جنب مع التحليل الطيفي بالأشعة تحت الحمراء كأداة للتحقيق في كيمياء البكتيريا الواحدة
In This Article
Summary
القوة الذرية المجهرية الأشعة تحت الحمراء الطيف (AFM-IR) يوفر منصة قوية للدراسات البكتيرية، مما يتيح تحقيق دقة النانو. ويمكن إجراء كل من رسم خرائط للتغيرات دون الخلوية (على سبيل المثال، عند انقسام الخلايا) وكذلك الدراسات المقارنة للتركيب الكيميائي (على سبيل المثال، الناشئة عن مقاومة الأدوية) على مستوى خلية واحدة في البكتيريا.
Abstract
القوة الذرية المجهر بالأشعة تحت الحمراء الطيف (AFM-IR) هو تقنية الجمع بين الرواية، وتمكين التوصيف المتزامن للخصائص الفيزيائية والتركيب الكيميائي للعينة مع قرار نانومتر. من خلال الجمع بين AFM مع الأشعة تحت الحمراء ، يتم التغلب على الحد من الدقة المكانية للأشعة تحت الحمراء التقليدية ، مما يتيح تحقيق دقة من 20-100 نانومتر. وهذا يفتح الباب أمام مجموعة واسعة من التطبيقات الجديدة للأشعة تحت الحمراء نحو عينات التحقيق أصغر من عدة ميكرومترات، لم يكن من الممكن تحقيقها من قبل عن طريق المجهر الأشعة تحت الحمراء التقليدية. AFM-IR مناسب بشكل بارز للبحوث البكتيرية ، وتوفير كل من المعلومات الطيفية والمكانية على مستوى الخلية الواحدة وداخل الخلايا. وقد أدت المخاوف الصحية العالمية المتزايدة والتنبؤ المستقبلي غير المواتي فيما يتعلق بالعدوى البكتيرية، وخاصة التطور السريع لمقاومة مضادات الميكروبات، إلى خلق حاجة ملحة لأداة بحثية قادرة على التحقيق الظاهري على مستوى الخلية الواحدة ودون الخلوية. يوفر AFM-IR إمكانية تلبية هذه الحاجة، من خلال تمكين التوصيف التفصيلي للتركيب الكيميائي للبكتيريا الواحدة. هنا، ونحن نقدم بروتوكول كامل لإعداد العينات والحصول على البيانات من أطياف واحدة ورسم الخرائط طريقة، لتطبيق AFM-IR نحو الدراسات البكتيرية.
Introduction
البكتيريا هي الكائنات الحية prokaryotic خلية واحدة، التي تحدث في مختلف الأشكال والأحجام، وعادة في نطاق عدة مئات من نانومتر إلى ميكرومتر. وهي موجودة في مجموعة متنوعة من الموائل وهي ضرورية لوجود الحياة. داخل جسم الإنسان ، فإن غالبية البكتيريا الموجودة في الأمعاء غير ضارة والعديد منها مفيد في الواقع1. ومع ذلك ، فإن العديد من الأنواع البكتيرية هي مسببات الأمراض وتسبب مجموعة من الأمراض المعدية. يمكن أن تؤدي العدوى البكتيرية إلى تطور الإنتان وصدمة الإنتان: حالة تهدد الحياة ، ناتجة عن استجابة الجسم للعدوى2. الإنتان هو تهديد صحي رئيسي على مستوى العالم، مع ارتفاع معدل الانتشار في جميع أنحاء العالم ومعدلات الوفيات الشديدة. في عام 2017 وحده، تم تسجيل ما يقدر بنحو 50 مليون حالة تعفن الدم في جميع أنحاء العالم، مع 11 مليون منها أدت إلى الوفاة (حوالي 20٪)2. وعلاوة على ذلك، تبين أن انخفاض فرص بقاء المريض على قيد الحياة، بسبب تأخر العلاج، يحدث في الساعة3،4.
يتم علاج العدوى البكتيرية بالمضادات الحيوية. شدة العواقب المحتملة لالتهابات مجرى الدم البكتيرية (BSIs)، جنبا إلى جنب مع أهمية واضحة للبدء السريع في العلاج المضاد للميكروبات، تدفع إلى الحاجة إلى إدارة المضادات الحيوية الفورية. ومع ذلك ، حيث أن النهج التشخيصية الحالية المستخدمة في الممارسة السريرية (على سبيل المثال ، زراعة الدم) تتطلب وقتا طويلا نسبيا ، فإن إدارة المضادات الحيوية غالبا ما تحدث قبل تشخيص BSI الإيجابي5. ويؤدي هذا العامل إلى الإفراط في استخدام المضادات الحيوية على نطاق واسع، الأمر الذي يؤدي – إلى جانب الاستخدام المفرط للمضادات الحيوية في قطاعات أخرى مثلالزراعة– إلى خلق ضغط تطوري شديد نحو تطوير مقاومة مضادات الميكروبات (AMR) 6و7. يعد معدل وفيات الرضع حاليا من أكثر القضايا الصحية العالمية إلحاحا7و8، وبحلول عام 2050، من المتوقع أن يصبح السبب الرئيسي للوفاة9. تطور المقاومة، جنبا إلى جنب مع انتشار سلالات AMR يحدث بوتيرة مثيرة للقلق7،8،9 ويتجاوز ، إلى حد بعيد ، معدل اكتشاف مضادات حيوية جديدة10. تظهر أنماط الظاهرية المقاومة الجديدة باستمرار في جميع أنحاء العالم ، في حين
البحث المكرس لفهم التغيرات المتعلقة بالبحث السنوي غالبا ما يكون بطيئا ومحدودا بالنهج المتاحة11. بالإضافة إلى ذلك، تركز الطرق الشائعة الاستخدام، مثل تفاعل البوليميراز المتسلسل (PCR) وتسلسل الجينات بالكامل (WGS)، فقط على التغيرات الجينية. هذه ليست كافية للكشف عن آليات المقاومة11، مما دفع الحاجة الملحة لأداة بحثية تمكن من فهم التركيب الكيميائي للبكتيريا.
يوفر التحليل الطيفي بالأشعة تحت الحمراء (IR) توصيفا جزيئيا للعينة وبالتالي فهو مرشح واعد للتحقيق البكتيري الظاهري. منذ تطبيقاتهمبكرة 12, برهنت حجم عظيمة أمثلة من إستعماله كان في الأدب13,14. وتشمل هذه تحديد القائم على phenotypic من البكتيريا على جنس15, الأنواع16, وسلالة17,18 مستوى. ومع ذلك ، يقتصر القرار المكاني للأشعة تحت الحمراء التقليدية على عدة ميكرون بسبب الحد الأقصى للدقة المكانية الحيود الطول الموجي19. وبما أن حجم غالبية البكتيريا يقع تحت هذا الحد (على سبيل المثال، المكورات العنقودية الذهبية ≈ قطرها 400 نانومتر)، فإن الأشعة تحت الحمراء التقليدية لا تنطبق على التحقيق على مستوى الخلية الواحدة أو داخل الخلية.
تم التغلب على قيود الدقة المكانية مؤخرا من خلال الجمع بين التحليل الطيفي للأشعة تحت الحمراء مع المجهر للقوة الذرية (AFM-IR). في هذه الحالة ، يتم الكشف عن امتصاص الأشعة تحت الحمراء بشكل غير مباشر ، من خلال التوسع الحراري للمادة19،20،21،22. باختصار، امتصاص الأشعة تحت الحمراء يؤدي إلى زيادة درجة الحرارة المحلية. ويمكن قياس هذا إما مباشرة23 أو من خلال قياس تذبذب التحقيق cantilever AFM، الناجمة عن دفعة القوة التي أنشأتها امتصاص الأشعة تحت الحمراء20،21. تمكن تقنية AFM-IR الجمعية من تحقيق دقة مكانية تقترب من 20 نانومتر ، مما يوفر معلومات متزامنة حول الخصائص الفيزيائية المحلية لعينة (AFM) وتكوينها الكيميائي (AFM-IR). ويمكن جمع كليهما، وأطياف واحدة من بقع مختارة ورسم خرائط لشدة قيم محددة في مجال مختار.
وبالنظر إلى الاستبانة المكانية القابلة للتحقيق من AFM-IR ، فمن الواضح أن هذه التقنية تفتح إمكانية التحقيق الكيميائي / phenotypic من خلية بكتيريا واحدة وتكوينها داخل الخلايا24. حتى الآن، تم عرض عدة أمثلة لتطبيق AFM-IR للبكتيريا المفردة في الأدب19،20،21،22،25،26،27،28. وتشمل هذه التحليل الطيفي واحد19،21،22 ورسم الخرائط في المستوى الفرعي19،22،25،26،27،28. على سبيل المثال، تم وصف القدرة على الكشف عن الحويصلات الدهنية داخل الخلايا27 والفيروسات28 داخل بكتيريا واحدة. هذه النتائج تثبت فائدة AFM-IR للدراسات النانوية من البكتيريا المفردة ومسببات الأمراض ذات الصلةسريريا 19.
ومن ثم، نقدم طريقة إعداد العينة وجمعها لبيانات AFM-IR لعينات بكتيرية متعددة الطبقات ومونو كلين وخلية واحدة. تم تطبيق البروتوكول الموصوف هنا لدراسة أنواع مختلفة من البكتيريا22 والتغيرات في تكوينها الكيميائي. على وجه الخصوص، تم التحقيق في التنمية في الجسم الحي من المقاومة فانكومايسين وdaptomycin غير قابلية في أزواج السريرية من S. أوريوس19. على حد سواء، ظهرت المقاومة المتقطعة فانكومايسين وdaptomycin عدم التعرض في S. أوريوس (فيزا و DpR) في الآونة الأخيرة نسبيا، في أعقاب زيادة استخدام وإدخال هذه المضادات الحيوية إلى العيادات، مما يشكل مشكلة طبية كبيرة. وعلاوة على ذلك، على وجه الخصوص، فإن آلية عدم قابلية دابتومايسين لا تزال بعيدة المنال، مما يعوق تطوير الأدوية البديلة19،29. ويركز البروتوكول المقدم على توفير أطياف موثوقة من البكتيريا المفردة من طراز AFM-IR، والتي يمكن تحليلها باستخدام مجموعة متنوعة من النهج الكيميائية، وفقا للأهداف التجريبية. كما يشمل نهج رسم الخرائط، الذي ينطبق على الدراسات داخل الخلية.
Protocol
وينبغي الاضطلاع بجميع الأعمال التي تجرى باستخدام البكتيريا المسببة للأمراض باتخاذ تدابير السلامة المناسبة. وتشمل هذه العمل في مختبر مع مستوى السلامة البيولوجية الكافية وفي كابينة السلامة الحيوية (PC2) ، فضلا عن تطهير دقيق لمنطقة العمل مع مطهر مناسب ، على سبيل المثال ، 80 ٪ من محلول الإيثانول. يجب ارتداء معدات الوقاية الشخصية المناسبة طوال الوقت.
1. إعداد المذيبات والمواد
- المذيبات: استخدام المياه فائقة البور كمذيب. استخدام المياه النقية، autoclaved قبل التجربة لتجنب أي تلوث محتمل عبر.
- الركيزة: استخدم أي من هذه الركائز ل AFM-IR، على سبيل المثال، ZnSe، CaF2، BaF2، إلخ. بما أن AFM-IR هو ، من حيث المبدأ ، تقنية غير مدمرة ، يمكن للمرء تطبيق مجموعة متنوعة من أدوات البحث الأخرى على نفس العينة بعد تحليل AFM-IR. على سبيل المثال، يمكن إجراء ارتباط النتائج مع التحليل الطيفي رامان إذا تم استخدام رامان الصف CaF2 أو BaF2 الشرائح.
- استخدام قوارير الزجاج بدلا من أنابيب بلاستيكية والبلاستيك يمكن أن تلوث العينة.
2. إعداد عينة لAFM-IR
- نمو/ حضانة العينة
- تنمو البكتيريا في وسائل الإعلام السائلة أو على لوحات صلبة. حدد نوع المتوسطة، وظروف النمو (على سبيل المثال، درجة الحرارة، وتوافر الأكسجين) ووقت النمو وفقا لمتطلبات محددة من أنواع البكتيريا قيد التحقيق. على سبيل المثال، لS. أوريوس ضخ القلب (HI) يمكن استخدام لوحات أجار، مع النمو لمدة 16 ساعة في 37 درجة مئوية في الظروف الهوائية.
ملاحظة: لتحقيق أفضل النتائج، يجب أن ينتج النمو/ الحضانة ما يكفي من البكتيريا التي من شأنها أن تسمح بجمع بيليه صغيرة من العينة. يعتمد العدد المحدد من وحدات تشكيل المستعمرة أو الخلايا البكتيرية على نوع وحجم البكتيريا.
- تنمو البكتيريا في وسائل الإعلام السائلة أو على لوحات صلبة. حدد نوع المتوسطة، وظروف النمو (على سبيل المثال، درجة الحرارة، وتوافر الأكسجين) ووقت النمو وفقا لمتطلبات محددة من أنواع البكتيريا قيد التحقيق. على سبيل المثال، لS. أوريوس ضخ القلب (HI) يمكن استخدام لوحات أجار، مع النمو لمدة 16 ساعة في 37 درجة مئوية في الظروف الهوائية.
- ترسب العينة
- باستخدام حلقة معقمة، وجمع البكتيريا بعناية من المستعمرات على لوحة أجار ونقلها إلى أنبوب زجاجي. جمع البكتيريا فقط من أعلى المستعمرات. إذا جمع عينات من السائل الثقافة، وذلك باستخدام ماصة، نقل ما يقرب من 1 مل من تعليق البكتيرية إلى أنبوب زجاجي. يمكن تعديل مستوى الصوت اعتمادا على الحمل البكتيري.
ملاحظة: من المهم محاولة عدم جمع (أو الحد الأدنى قدر الإمكان من جمع) أي وسيلة من تحت المستعمرة. وتهدف الخطوات اللاحقة لإعداد العينات إلى إزالة أي بقايا محتملة من الوسائط. ويمكن التقليل إلى أدنى حد ممكن من بقايا المتوسطة المحتملة منذ البداية من الحصول الطيفي على البيانات من الخلايا البكتيرية المنقاة. تنطبق الخطوتين 2-2-2 و2-2-3 على العينات المعدة من ألواح أغار. بالنسبة للعينات المعدة من الوسائط السائلة، انتقل إلى الخطوة 2.2.4. - أضف 1 مل من المياه فائقة النبور إلى الأنبوب. دوامة حتى بيليه البكتيرية التي تم جمعها لم تعد مرئية في الجزء السفلي من الأنبوب (عادة 1-2 دقيقة).
- تقدير العكر الخام للحل باستخدام، على سبيل المثال، معايير ماكفارلاند من خلال المقارنة البصرية30 بين الحل المعد ومعايير ماكفارلاند. إذا كان العكر من تعليق البكتيرية ويبدو أن منخفضة جدا، إضافة المزيد من البكتيريا من لوحة باستخدام حلقة معقمة ودوامة مرة أخرى. كرر حتى العكر الخام للحل مماثل لمعايير ماكفارلاند 0.5 و 1. وهذا سوف تسفر عموما كمية لا بأس بها من بيليه البكتيرية.
- الطرد المركزي تعليق البكتيرية في 3، 000 x ز لمدة 5 دقائق للحصول على بيليه.
ملاحظة: يمكن تعديل معلمات الطرد المركزي للحصول على بيليه بكتيري. وينبغي توخي الحذر إذا زيادة قوة ز، لعدم الحث على كسر البكتيريا (وخاصة في حالة البكتيريا السلبية غرام). - باستخدام ماصة، وإزالة بلطف supernatant من فوق بيليه. أضف 1 مل من الماء فائق النبور إلى الأنبوب ودوامة لإعادة تعليق الكريات. وفي وقت لاحق، تقوم أجهزة الطرد المركزي بالطرد المركزي من العينة كما حدث في الخطوة 2-2-4.
- كرر إجراء الغسيل (الخطوتين 2.2.2 و2.2.4) ثلاث مرات على الأقل. في حالة جمع العينة الأولية من الوسائط السائلة، كرر الإجراء أربع مرات على الأقل (إزالة الوسائط متبوعة بثلاث غسلات).
- بعد الغسيل النهائي، قم بإزالة النافورة، وأضف الماء فائق البور ودوامة لمدة دقيقتين على الأقل. بعد ذلك، إيداع 5 ميكرولتر من العينة على الركيزة (على سبيل المثال، رامان الصف CaF2).
- إذا كان سمك العينة المطلوب هو طبقة متعددة من البكتيريا، اترك العينة لتجف في الهواء.
- إذا كان سمك المطلوب هو أحادي الطبقة أو البكتيريا الفردية، مباشرة بعد إيداع العينة (الخطوة 2.2.7) إضافة ما بين 20-100 ميكرولتر من المياه فائقة الشراء وتخلط بلطف مع طرف ماصة. يترك لتجف الهواء.
ملاحظة: يمكن أن يختلف الحجم الدقيق للمياه بين التجارب حيث يعتمد على العديد من العوامل (على سبيل المثال، حجم الكائن الحي، وكثافة الكريات، وما إلى ذلك) وبالتالي، يتم تحديده على أفضل وجه تجريبيا. إعداد سلسلة من العينات مع كميات متفاوتة من المياه فائقة البور المضافة تمكن المرء من اختيار عينة مع سمك المطلوب / كثافة البكتيريا. يمكن تصور سمك / كثافة البكتيريا بسهولة عبر AFM في المراحل اللاحقة. وترد أمثلة من الصور AFM من عينات أحادية الطبقة وخلية واحدة في الشكل 1A-H. - قم بتركيب الركيزة على قرص عينة معدنية AFM باستخدام شريط لاصق على الوجهين.
- باستخدام حلقة معقمة، وجمع البكتيريا بعناية من المستعمرات على لوحة أجار ونقلها إلى أنبوب زجاجي. جمع البكتيريا فقط من أعلى المستعمرات. إذا جمع عينات من السائل الثقافة، وذلك باستخدام ماصة، نقل ما يقرب من 1 مل من تعليق البكتيرية إلى أنبوب زجاجي. يمكن تعديل مستوى الصوت اعتمادا على الحمل البكتيري.
3. إعداد الصك
ملاحظة: الإجراءات الآلية الموضحة هنا هي للصك المدرج في جدول المواد. قد يختلف الإجراء الآلي التفصيلي قليلا عن الإجراء الموضح هنا إذا كان استخدام نموذج أحدث من أداة AFM-IR.
- قم بتشغيل الأداة وتهيئةها بالضغط على زر التهيئة. تأكد من أن مصراع الليزر في وضع الفتح لاختبار الليزر.
- إذا تم إعداد نظام تطهير، قم بتطهير الأداة ب N2 عن طريق تشغيل تدفق N2. ضبط تطهير النيتروجين لتحقيق مستوى رطوبة مستقر (على سبيل المثال، 20٪). تأكد من عدم تقلب الرطوبة أثناء القياسات وبين جمع البيانات الخلفية والعينات. يوصى بالسماح بحوالي 20 دقيقة لتثبيت مستويات الرطوبة.
- قم بتحميل العينة في غرفة العينة بالضغط على زر التحميل. يتم إجراء تحميل العينة من خلال معالج البرامج. أثناء تشغيل معالج البرامج، ركز أولا على الطرف، باستخدام الأسهم لتحريك مرحلة المجهر في اتجاه Z وانقر على التالي. ثانيا، ضبط بقعة جمع البيانات، وذلك باستخدام السهام توجيه الحركة في الطائرة ومحاذاة الليزر AFM وكاشف AFM باستخدام المقابض على الجزء العلوي من رئيس AFM. بعد ذلك، ركز على سطح العينة عن طريق تحريك مرحلة المجهر في اتجاه Z.
ملاحظة: يتم توفير الرسوم التوضيحية التفصيلية لكل خطوة من تحميل العينة في دليل البرامج31. وينبغي إجراء التركيز على العينة بعناية. عند الاقتراب من سطح العينة في اتجاه Z، استخدم سرعة محرك بطيئة. - اقترب من العينة دون الانخراط بالنقر على زر النهج.
4. جمع البيانات
- خلفية
- قبل الحصول على البيانات، جمع الخلفية. لجمع الخلفية، تأكد من أن مصراع الليزر في وضع الفتح. حدد النطاق الطيفي والدقة (اعتمادا على هدف التحليل) وعدد عمليات المسح الضوئي وعدد المتوسطات المشتركة للخلفية. ويوصى عموما أن تكون هذه الفحوصات عالية (على سبيل المثال، 1024 مسح ضوئي و3 متوسطات مشتركة).
ملاحظة: بشكل عام، يوصى بدقة طيفية من 4 سم-1 أو 8 سم-1 ونطاقات طيفية من 3200 سم -1-2800 سم-1 و1800 سم-1-900سم-1. - بعد الحصول على الخلفية، حفظ ملف الخلفية. لا يتم تخزين الملف تلقائيا. تغيير وضع مصراع الليزر لإغلاق.
- قبل الحصول على البيانات، جمع الخلفية. لجمع الخلفية، تأكد من أن مصراع الليزر في وضع الفتح. حدد النطاق الطيفي والدقة (اعتمادا على هدف التحليل) وعدد عمليات المسح الضوئي وعدد المتوسطات المشتركة للخلفية. ويوصى عموما أن تكون هذه الفحوصات عالية (على سبيل المثال، 1024 مسح ضوئي و3 متوسطات مشتركة).
- عينة – أطياف مفردة
- اضغط على الزر Engage (الانخراط) للتفاعل مع العينة. وسيبدأ النظام في الاقتراب من سطح العينة، إلى أن يتم الكشف عن الاتصال المباشر.
ملاحظة: تعيين نقطة المستخدمة في هذا العمل تراوحت بين 0.15-2 V ومكاسب التغذية المرتدة (أنا كسب ومكاسب P) وعادة ما يتم تعيين إلى 3 و 10. تستخدم مسابير الاتصال NIR2 عادة مع نظام nanoIR2 (الطراز: PR-EX-nIR2-10، تردد الرنين (kHz): 13 +/−4 كيلوهرتز، ثابت الربيع (N/m): 0.07−0.4 نيوتن متر-1). - جمع صورة AFM لتصور السطح. في المقام الأول، مسح مساحة أكبر (على سبيل المثال، 50 × 50 ميكرومتر) مع انخفاض الدقة المكانية (على سبيل المثال، 200 × 200 نقطة) (الشكل 1I).
ملاحظة: يتم جمع بيانات AFM-IR دائما في وضع الاتصال، ومع ذلك، يمكن جمع بيانات AFM في وضع الاتصال أو النقر. - من صورة ارتفاع / انحراف AFM ، حدد منطقة معينة من الاهتمام وإعادة تصويرها بدقة مكانية أعلى(الشكل 1J-K). تأكد من أن سرعة جمع البيانات مناسبة، مع حركة تلميح بطيئة (على سبيل المثال، معدل المسح الضوئي 0.2-0.4 هرتز).
- حدد بقعة القياس (مثل البكتيريا المفردة) ونقل الطرف إلى المكان.
- محاذاة ليزر الأشعة تحت الحمراء. لهذا الغرض، استخدم رقم موجة الذي سيتم استيعاب العينة. بالنسبة للمواد البيولوجية يمكن أن يكون هذا ، على سبيل المثال ، amide I (1655 سم-1). تأكد من إيقاف تشغيل عامل تصفية ممر النطاق وانقر على بدء تشغيل الأشعة تحت الحمراء. يجب أن يظهر الرسم البياني الأيمن في متر nanoIR (FFT للانحراف المعروض كسعة مقابل تردد) ذروة واحدة واضحة على الأقل ويجب أن يكون الرسم البياني الأيسر (الانحراف مقابل الوقت) شكل موجي دوري. إذا لم يكن هذا هو الحال، انتقل إلى تحسين البقع الأشعة تحت الحمراء.
ملاحظة: حتى إذا كان تحويل فورييه السريع (FFT) والانحراف تظهر التشكيل الجانبي المتوقع، فمن المستحسن إجراء التحسين من البقع الأشعة تحت الحمراء لعدد من wavenumbers على الأقل، حيث يتوقع النطاقات. - تحسين النقاط الفعالة لجمع بيانات الأشعة تحت الحمراء باستخدام قيم عدد الموجات المحددة. يمكن أن يكون من المفيد استخدام طيف الأشعة تحت الحمراء التقليدية من البكتيريا (على سبيل المثال، طيف ATR من بيليه البكتيرية) لتحديد مواقف العصابات واستخدامها لتحسين النقاط الساخنة. حدد قيم عدد موجات مختلفة (على سبيل المثال، 8-10) من مناطق طيفية مختلفة.
ملاحظة: إذا كان الطيف الأشعة تحت الحمراء التقليدية من البكتيريا ذات الأهمية لا يمكن جمعها قبل جمع البيانات AFM-IR، يمكن استخدام الأطياف البكتيرية المتاحة في الأدب كدليل تقريبي. نتيجة التحسين من بقعة الأشعة تحت الحمراء هي صورة، التي تقدم خريطة لإشارة حجم FFT في كل موقع س و ص. يتم تحديد الموقع الذي به أكبر إشارة تلقائيا. وترد أمثلة من هذه الصور في دليل البرمجيات31. - بعد تحسين البقع الأشعة تحت الحمراء لقيم محددة wavenumber ، وتحديد المعلمات لجمع البيانات الطيفية : المنطقة الطيفية ، والقرار الطيفي ، وعدد من عمليات المسح الضوئي ، وتطبيق السلطة وإدخال هذه في النوافذ المناسبة في البرنامج. وينبغي أن يتطابق الاستبانة الطيفية مع دقة الخلفية، وينبغي أن تكون المنطقة الطيفية داخل المنطقة الطيفية التي جمعت بشأنها المعلومات الأساسية.
ملاحظة: يمكن أن تكون مجموعة أولية عامة من المعلمات: نطاق طيفي: 3200 سم-1-2800 سم-1 و 1800 سم-1-900سم-1، دقة طيفية: 4 سم-1 أو 8 سم-1، عدد عمليات المسح الضوئي: 512-2048. - إذا لزم الأمر، قم بضبط طاقة الليزر اعتمادا على الإشارة. بشكل عام، يجب أن تكون القيم بين 8٪ إلى 10٪ من طاقة الليزر كافية لنوعية جيدة من الإشارات. يمكن استخدام قيم أعلى بحذر، لأنها قد تؤدي إلى تلف العينة.
ملاحظة: يمكن أن تختلف طاقة الليزر في المائة تبعا لنوع ليزر الأشعة تحت الحمراء. القيم المئوية الواردة هنا هي ليزر OPO. - انقر على الحصول على لجمع الطيف AFM-IR.
- إعادة جمع بيانات AFM من نفس المنطقة بعد جمع الطيف AFM-IR. ويوصى بشدة هذا لأنه سوف تكشف عن أي الانجراف المحتملة و / أو تأثير مدمر على العينة.
- إذا كان طيف AFM-IR مرضيا ولم يلاحظ أي تأثير مدمر على العينة ، فامضي قدما في جمع البيانات. إذا لزم الأمر، حدد سلسلة من النقاط لجمع البيانات باستخدام خيار الصفيف وجمع صورة ارتفاع AFM أو انحرافها. يسمح هذا الخيار بجمع الأطياف على التوالي من كل نقطة بنفس المعلمات الطيفية كما هو محدد لطيف واحد.
- إذا كانت صورة AFM التي تم جمعها بعد جمع طيف AFM-IR تكشف عن تأثير مدمر على العينة (عادة بقعة محروقة) ، فقلل من الطاقة؛ حدد بقعة مختلفة وكرر الخطوات 4.3.8-4.3.11.
- إذا كانت الإشارة في طيف AFM-IR غير مرضية، فتحقق من صحة تحسين بقع الأشعة تحت الحمراء (الخطوة 4.3.6). إذا كان صحيحا، قم بزيادة طاقة الليزر قليلا وكرر الخطوات 4.3.7-4.3.11. ويمكن تكرار ذلك إلى أن يتم تحقيق إشارة مرضية.
- اضغط على الزر Engage (الانخراط) للتفاعل مع العينة. وسيبدأ النظام في الاقتراب من سطح العينة، إلى أن يتم الكشف عن الاتصال المباشر.
- عينة – نهج التصوير
ملاحظة: يوصى بشدة بتسجيل طيف AFM-IR واحد من البكتيريا قبل جمع صورة توزيع كثافة لقيمة عدد الموجات المحددة.- تسجيل صورة AFM لمنطقة العينة المختارة. للقيام بذلك، قم أولا بجمع صورة AFM لمساحة أكبر ذات دقة مكانية أقل (على سبيل المثال، 50 × 50 ميكرومتر، 200 × 200 نقطة)، ثم حدد منطقة ذات أهمية وجمع صورة AFM مع زيادة الدقة المكانية (كما هو موضح في الشكل 1I-K).
- حدد قيم عدد الموجات للتصوير بالأشعة تحت الحمراء AFM.
- تأكد من تحسين موضع الأشعة تحت الحمراء لليزر لقيم عدد الموجات المحددة (الخطوة 4.3.6). إذا لم يتم تحسين بقعة الأشعة تحت الحمراء لبعض الموجات (لا يوجد حد أقصى واضح)، قم بتحسينها لهم.
- حدد معلمات المنطقة المصورة: العرض والارتفاع وعدد نقاط البيانات في اتجاه X وY.
ملاحظة: إذا تم تطبيق التحديد المتتالي للبقع من الصور AFM السابقة (كما هو موضح في الشكل 1I-K)،سيتم ملء حقول العرض والارتفاع تلقائيا، عند وضع علامة على المنطقة. - حدد معلمات اكتساب الإشارات الطيفية: الطول الموجي وعدد عمليات المسح الضوئي وطاقة الليزر.
ملاحظة: يجب الاحتفاظ بعدد عمليات الفحص ضمن العقل. 64 أو 32 مسح سيسمح عادة كمية كافية من الإشارة. - حدد معلمات حركة تلميح AFM بالنقر على معدل المسح الضوئي. كلما ارتفع عدد عمليات المسح في الخطوة السابقة وعدد نقاط البيانات في اتجاه X ، كلما كانت حركات البقشيش أبطأ. عدم وجود تعديل بين هذه المعلمات سيؤدي إلى حركة سريعة جدا من طرف، ومنع الحصول الفعلي على عدد محدد من الاشعة من كل نقطة.
ملاحظة: على سبيل المثال، للحصول على مجموعة مناسبة من إشارة الأشعة تحت الحمراء مع 64 إضافات مشتركة و 200 نقطة، تعيين معدل المسح الضوئي ك 0.07 كيلوهرتز. - تأكد من وضع علامة على مربع تمكين التصوير بالأشعة تحت الحمراء.
- بدء التصوير. سيتم جمع AFM-IR من كثافة الإشارة في عدد الموجات المحدد في وقت واحد مع بيانات AFM من تلك المنطقة.
ملاحظة: عند استخدام ليزر OPO، من الممكن جمع صورة تردد الذروة في وقت واحد في وقت واحد. ويمكن استخدام هذا للحصول على معلومات حول صلابة النسبي للعينة في مواقع مختلفة. - استخدم إطار "تسلسل الالتقاط" لتعيين مجموعة متتالية من بيانات AFM-IR من نفس المنطقة بنفس المعلمات، ولكن لقيم مختلفة من أرقام الموجات. للقيام بذلك، افتح إطار "تسلسل الالتقاط"، واكتب في كل رقم موجة، وحدد طاقة الليزر المطبقة (لكل رقم موجة).
- تصدير البيانات التي تم جمعها (AFM وAFM-IR، أطياف واحدة والتصوير) في أشكال مختلفة وتحليلها باستخدام أساليب كافية لأهداف بحثية محددة.
النتائج
ويمكن البروتوكول الموصوف من الحصول على مجموعة من أنواع توزيعات الخلايا من البكتيريا على الركيزة، اعتمادا على التركيز الأولي للعينة وكمية المياه المضافة. يوضح الشكل 1 أمثلة صور AFM (الارتفاع والانحراف) المسجلة من عينات أحادية الخلية وعينات أحادية الخلية تم إعدادها باستخدام البروتوكول الموصوف من البكتيريا الإيجابية للجرام(S. aureus)والغرام السلبي(الإشريكية القولونية).
يمكن استخدام البروتوكول الموصوف هنا لتصوير AFM-IR للهياكل داخل وخارج الخلية من البكتيريا المفردة. يظهر مثال على هذا التطبيق في الشكل 2، والذي يوضح نتائج رصد التغيرات الكيميائية المترجمة مكانيا التي تحدث أثناء تقسيم خلية S. aureus. على الرغم من أن تجفيف الهواء يعتبر عادة نهج تثبيت لإعداد البكتيريا، البكتيريا، بطبيعتها، تظهر مقاومة عالية جدا للعوامل الخارجية مثل درجة الحرارة وأفيد أن البقاء على قيد الحياة الجفاف32. تم الحصول على النتائج المعروضة هنا من عينة مجففة بالهواء. لوحظ تشكيل الحاجز، الذي حدث قبل انقسام الخلية ورصده عن طريق التصوير AFM(الشكل 2A-D)من خلال جمع 12 صورة لنفس المنطقة على التوالي (جمع صورة واحدة ≈ 20 دقيقة). الشكل 2A-D يظهر 4 صور AFM مختارة، مع الوقت بين جمع كل صورة من حوالي 40 دقيقة. هيكل شكلت (الحاجز) هو 45 نانومتر عالية. الحاجز المشكل مرئي بوضوح في ارتفاع AFM وصور الانحراف(الشكل 2E-F). تم تطبيع أطياف AFM-IR المسجلة من منطقة الخلية والحاجز(الشكل 2G، نقاط المنشأ التي تم وضع علامة عليها في الشكل 2F)إلى النطاق amide I قبل المقارنة ، للحد من تأثير سمك العينة المتفاوت بين نقاط جمع البيانات. يتميز طيف AFM-IR للحاجز بكثافة نسبية أعلى للنطاقات عند 1240 و 1090 سم-1 مقارنة بطيف AFM-IR الذي يتم جمعه من منطقة الخلية. ويعزى هذا إلى الكربوهيدرات ومجموعات فوسفوديستر من مكونات جدار الخلية (بما في ذلك على سبيل المثال، peptidoglycan وحمض التيتشيك)22.
ويمكن أيضا استخدام البروتوكول الموصوف لمقارنة أطياف واحدة بين عدد من العينات المختلفة. مثال على هذا التطبيق مع النتائج يظهر في الشكل 3 والشكل 4. والهدف من الدراسة هو تحديد التغيرات الكيميائية التي تحدث نتيجة لتطوير الجسم الحي للمقاومة فانكومايسين المتقطعة في S. أوريوس (VISA). لهذا الغرض، تم جمع أزواج سريرية من العينات من المرضى، مع سلالة الوالدين معزولة عند دخول المستشفى وقبل العلاج بالمضادات الحيوية (فانكومايسين عرضة S. أوريوس، VSSA) وسلالة ابنة معزولة عن نفس المريض بعد دخول المضادات الحيوية والفشل السريري. كذلك نمت عينات على المتوسطة أجار وأعدت وفقا للبروتوكول (الشكل 3A-B). تم جمع أطياف AFM-IR من بكتيريا واحدة متعددة (وعينات متعددة) ل VSSA و VISA وتم تحليلها لاحقا باستخدام العديد من النهج الكيميائية(الشكل 3C).
لم تلاحظ أي اختلافات مورفولوجية بين خلايا VSSA و VISA (الشكل 4A-C). ومع ذلك، فإن أطياف AFM-IR(الشكل 4D،F)ومشتقاتها الثانية(الشكل 4E،G)أظهرت فرقا واضحا في التركيب الكيميائي بين السلالات المقاومة والمعرضة. كثافة النسبية للعصابات المرتبطة الكربوهيدرات ومجموعات فوسفوديستر من مكونات جدار الخلية (على وجه الخصوص، الفرقة في 1088 سم-1)زيادة واضحة في سلالة مقاومة، مقارنة مع نظيره عرضة. وتجدر الإشارة إلى أن جميع الأطياف التي أعيد ترميزها (VISA: 81، VSSA: 88) تظهر انحرافا معياري صغيرا. وهذا يدل على قابلية جيدة لإعادة إنتاج البيانات المسجلة من عينات مختلفة أعدت من نفس السلالة، حيث لم يكن من الممكن التمييز بين الأطياف المسجلة من عينات مختلفة من السلالة نفسها. وأشارت الاختلافات الملحوظة إلى زيادة سماكة جدار الخلية في السلالات المقاومة، مقارنة بالنظير القابل للتأثر، والذي لا يزال متفقا مع تقارير أدبية أخرى33و34.

الشكل 1: صور AFM التمثيلية لعينات بكتيرية مختلفة لقياسات AFM-IR. اعتمادا على التخفيف على الركيزة، يسمح البروتوكول للمرء بالحصول على طبقات متعددة وأحادية الطبقات من البكتيريا وكذلك عينات من خلية واحدة. صور AFM التمثيلية ل: (A-D) أحادي الطبقة و (E-H) عينة أحادية الخلية ل (A, B, E, F) إيجابية الجرام (S. aureus) و (C, D, G, H) الجرام السلبي (E. coli) البكتيريا. (A, C, E, G) إظهار صور الارتفاع و (B, D, F, H) تظهر صور انحراف المقابلة. حجم المناطق المصورة: (A-D, G, H) 20 × 20 ميكرومتر، (E,F) 50 × 50 ميكرومتر (I-K) اختيار متتالي لمنطقة لرسم خرائط AFM-IR. ويتحقق ذلك باستخدام التصوير AFM مع زيادة الدقة المكانية في مثال خلية واحدة S. أوريوس. يتم جمع كل صورة عن طريق أخذ العينات 200 × 200 نقطة ، مع زيادة الدقة المكانية بسبب انخفاض حجم المنطقة المصورة. حجم المناطق المصورة: (I) 40 × 40 ميكرومتر ، (J) 20 × 20 ميكرومتر و (K) 2.24 × 2.24 ميكرومتر. المربع الأسود في (I) يمثل المنطقة في الصورة (J). المربع الأسود في (J) يمثل المنطقة في الصورة (K). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
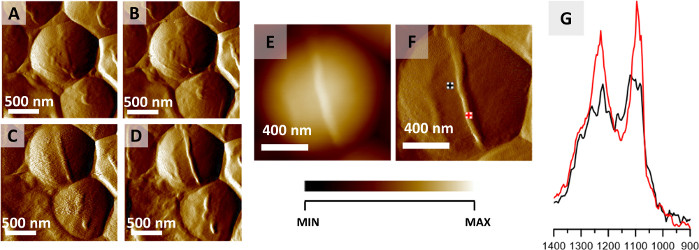
الشكل 2: رصد S. انقسام الخلية أوريوس عبر AFM-IR. (A-D) صور AFM لخلية S. aureus تظهر تشكيل الحاجز السابق لتقسيم الخلية. حجم المنطقة المصورة: 2 × 2 ميكرومتر. تم اختيار الصور من سلسلة أكبر (12 صورة مسجلة كل 20 دقيقة) وتمثل البيانات المسجلة كل 40 دقيقة. (E-F) AFM الارتفاع وصورة انحراف سجلت في نهاية تشكيل الحاجز الخلية مع نقاط ملحوظة لجمع الأطياف AFM-IR. حجم المنطقة المصورة 1.17 × 1.15 ميكرومتر. ارتفاع الهيكل الذي تم تشكيله حديثا هو 45 نانومتر. (G) AFM-IR الأطياف المسجلة من منطقة الخلية (أسود) ومنطقة الحاجز (أحمر) (ملحوظ في (F)), في نطاق 1400-900 سم-1. تم تطبيع كل من الأطياف إلى الفرقة أميدي أنا وإظهار زيادة في الكثافة النسبية لمكونات جدار الخلية من الحاجز. وقد تم تعديل هذا الرقم من ك. كوتشانوآخرون. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
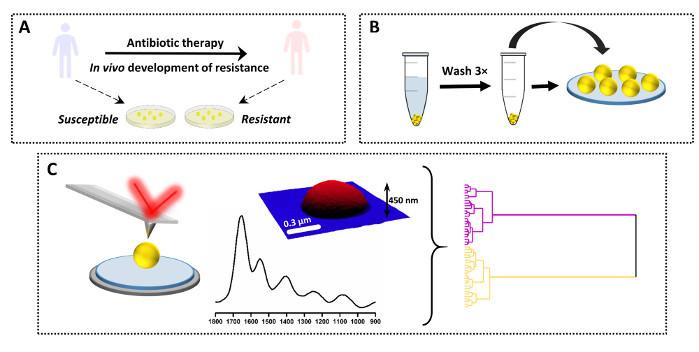
الشكل 3: نظرة عامة على التصميم التجريبي لدراسة AFM-IR لمقاومة مضادات الميكروبات. (أ)عينة الأصل والإعداد الأولي: تم جمع سلالة الأم عرضة من المريض قبل العلاج بالمضادات الحيوية وكان مصدر سلالة مقاومة ابنة من نفس المريض بعد العلاج بالمضادات الحيوية والفشل السريري (في تطور مقاومة الجسم الحي). تم عزل البكتيريا واستزراعها على أجار ضخ القلب (HI) لمدة 16 ساعة في 37 درجة مئوية. (ب) إعداد العينة اللاحقة ل AFM-IR، بما في ذلك جمع العينة تليها غسل البليت البكتيري (3×) وترسب العينة. (ج) جمع وتحليل بيانات AFM-IR: ارتفاع AFM وطيف AFM-IR (1800-900 سم-1). حجم منطقة الصورة AFM: 1.7 × 1.4 ميكرومتر. تم جمع طيف AFM-IR من منتصف الخلية. وتم تحليل البيانات فيما بعد باستخدام نهج القياس الكيميائي، بما في ذلك التحليل الهرمي للمجموعات. وقد تم تعديل هذا الرقم من ك. كوتشان وآخرون19. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
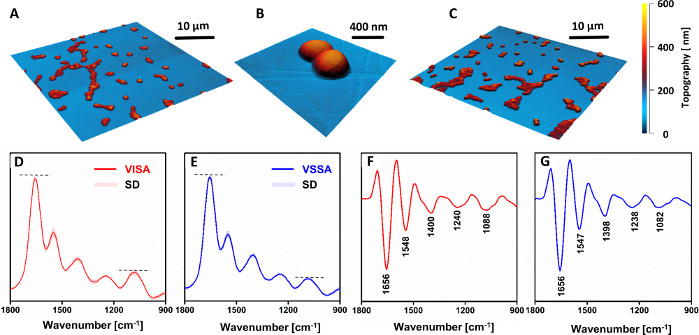
الشكل 4: نتائج AFM و AFM-IR لدراسة التغيرات الكيميائية في فانكومايسين المتوسطة S. أوريوس (VISA) مقارنة مع فانكومايسين عرضة S. أوريوس (VSSA) في أزواج السريرية. AFM صور (A-B) فيزا و (C) VSSA عينات خلية واحدة. حجم المناطق المصورة: (A, C) 40 × 40 ميكرومتر, (B) 2.56 × 2.45 ميكرومتر (D-E) متوسط طيف AFM-IR ومشتقاتها الثانية(F-G)ل: (D, F) VISA و (E,G) VSSA الخلايا, في نطاق الطيفية 1800-900 سم-1. الأطياف المعروضة هي في المتوسط 81 (فيزا) و 88 (VSSA) الأطياف الفردية وتقدم جنبا إلى جنب مع الانحراف المعياري (SD). وقد أجري المتوسط بعد تطبيع جميع الأطياف الفردية معا. يتم وضع علامة على النطاقات الرئيسية في (F-G). وقد تم تعديل هذا الرقم من ك. كوتشان وآخرون19. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: انجراف الصورة على التسجيل المتتالي لخرائط AFM-IR عند قيم محددة للأرقام الموجية لخلية S. aureus. (الصف العلوي):تم تسجيل صور AFM في وقت واحد مع خرائط AFM-IR المطابقة(الصف السفلي)استنادا إلى كثافة إشارة الأشعة تحت الحمراء عند قيم محددة لأرقام الموجات. القيم عدد الموجات (966، 1055، 1079، 1106، 1234، 1398، 1454، 1540، 1656، 1740 سم-1)مشروحة فوق الصف السفلي. تم تسجيل كل مجموعة (صورة AFM وخريطة AFM-IR) مباشرة بعد الصورة السابقة (حوالي 40 دقيقة لكل مجموعة). حجم المنطقة المصورة/المعينة: 1.54 × 1.57 ميكرومتر. يظهر انجراف واضح بين الصور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
10- إن فائدة التحليل الطيفي للأشعة تحت الحمراء في توصيف مجموعة واسعة من العينات البيولوجية في سياق تكوينها الكيميائي راسخة. على مدى العقد الماضي، ظهرت الأشعة تحت الحمراء الطيف كأداة واعدة للدراسات البكتيرية12،13،14،15،16،17. وهي تواصل جذب اهتمام كبير في مجال علم الأحياء المجهرية، باعتبارها واحدة من التقنيات القليلة التي تمكن من توصيف phenotypic من خلال التركيب الكيميائي. وفي هذا السياق، يكمن العيب الرئيسي في الفحص المجهري التقليدي للقوات البرية الدولية للنقل البري في الدقة المكانية المحدودة، مما يمنع الدراسات الفردية للبكتيريا التي أجريت على الخلايا ودون الخلوية. في الواقع ، فإن صغر حجم البكتيريا يمثل عائقا ليس فقط للأشعة تحت الحمراء ، ولكن بالنسبة للغالبية العظمى من التقنيات. وبالتالي، فإن أدوات البحث المتاحة للدراسات أحادية الخلية ودون الخلوية للبكتيريا محدودة بشكل كبير. ويمكن الجمع بين AFM والأشعة تحت الحمراء من التغلب على الحد من الدقة المكانية للتنظير الطيفي للأشعة تحت الحمراء، مما يوفر أداة جديدة للبحوث البكتيرية، قادرة على التحقيق النانوي في التركيب الكيميائي.
لا تقتصر هذه التقنية على دراسات الخلايا المفردة وتسمح للمرء بالتحقيق في مجموعة متنوعة من العينات ، تتراوح في سمكها. مما لا شك فيه، إعداد عينة نظيفة ودقيقة أمر بالغ الأهمية لتحقيق صور ذات جودة عالية. يوفر البروتوكول هنا طريقة لإعداد عينات متعددة الطبقات، أحادية الطبقة، و/ أو خلية واحدة من البكتيريا المختلفة (الشكل 1). تعتمد العينة المعدة على عدة عوامل ، بما في ذلك الحمل البكتيري الأولي ، وتخفيف ما بعد الغسيل بالإضافة إلى مزيد من التخفيف على الركيزة. كمية العينة التي تم الحصول عليها بعد تمييع الكريات المغسولة وقبل الترسب على الركيزة عادة ما يسمح بإعداد العديد من العينات. لذلك ، للحصول على التوزيع المطلوب للعينة على الركيزة ، غالبا ما يكون من المفيد إعداد سلسلة من العينات ، تتراوح في تخفيفها. بالنسبة للدراسات التي تهدف إلى جمع أطياف AFM-IR بدلا من التصوير دون الخلوي ، قد يكون تعديل كمية العينة (على سبيل المثال ، من الطبقة الأحادية إلى الطبقات المتعددة) مفيدا لزيادة كثافة الإشارة.
وثمة جانب هام آخر في إعداد العينات هو إزالة المخلفات المتوسطة بشكل مناسب. اعتمادا على أساليب زراعة العينة المختارة، يتم جمع العينة إما من وسط سائل أو من لوحة أجار. وفي كلتا الحالتين، يرجح أن تكون بقايا الكمية المتوسطة موجودة في العينة، وإن كان ذلك بدرجة أقل بكثير عند جمعها من ألواح أغار. بما أن وسائل الإعلام نمو البكتيريا تحتوي على وفرة من المكونات البيولوجية المختلفة، فمن الأهمية بمكان لضمان إزالة مناسبة من المتوسطة. نوصي بثلاثة يغسل مع المياه فائقة البور لعينات لوحة أجار وأربعة يغسل على الأقل للعينات التي تم جمعها من المتوسطة. يمكن زيادة عدد الغسيل ، إذا لزم الأمر . ومع ذلك، للمقارنة بين عينات مختلفة، من المهم أن يبقيه متسقة بين العينات. يستخدم البروتوكول الواضح الماء، بدلا من المذيبات مثل محلول الفوسفات العازل (PBS) أو المالحة. كل من برنامج تلفزيوني والمالحة تؤدي إلى تشكيل بلورات عند تجفيف الهواء، والتي يمكن أن تلحق الضرر البكتيريا. وبالإضافة إلى ذلك، كلاهما مصدر لعصابات الأشعة تحت الحمراء المكثفة، مع برنامج تلفزيوني، على وجه الخصوص، تحتوي على نطاقات متعددة في منطقة بصمات الأصابع. عدم القدرة على استخدام المالحة أو برنامج تلفزيوني ، يمثل حاليا قيدا هاما لهذه التقنية. عادة، استخدام الماء لغسل لا يسبب أي تأثير مدمر على البكتيريا. ومع ذلك، ينبغي توخي الحذر، وإذا أمكن، ينبغي أن يكون وقت التعرض للمياه محدودا. إذا كان بروتوكول إعداد العينة يحتاج إلى التوقف مؤقتا في مرحلة الغسيل ، فمن المستحسن ترك العينة في شكل بيليه بعد إزالة الماء. وهذا أمر ذو أهمية خاصة بالنسبة للبكتيريا السلبية الغرام، التي تحتوي على جدار الخلية أرق لأنها أكثر عرضة للتمزق.
لضمان بيانات AFM-IR المناسبة وعالية الجودة، هناك جوانب عديدة في بروتوكول جمع البيانات ذات أهمية حاسمة. أولا، إن التجميع الصحيح للخلفية ضروري لاكتساب البيانات. وعلى وجه الخصوص، من الضروري الحفاظ على مستويات الرطوبة المستقرة في جميع أنحاء جمع الخلفية وكذلك بين الخلفية وجمع العينات. لضمان ذلك، نوصي بتطهير الجهاز بالنيتروجين والحفاظ على مستويات الرطوبة التي لا تزيد عن 25٪. يمكن أن يفرض عدم التطهير قيدا كبيرا ، خاصة في الأماكن ذات الرطوبة العالية. ثانيا، ينبغي تسليط الضوء على أهمية التحسين السليم للبقع الأشعة تحت الحمراء. للحصول على أفضل النتائج، يمكن أن تكون المعرفة المسبقة حول موقف الفرقة ماكسيما مفيدة. على سبيل المثال، يمكن استخدام طيف الأشعة تحت الحمراء التقليدي من الكريات البكتيرية لتحديد مواقع النطاقات المتوقعة من العينة. إذا لم يكن ذلك ممكنا للحصول على ، كنهج بديل ، يمكن للمستخدم الاستفادة من أطياف الأشعة تحت الحمراء المتاحة في الأدب أو البدء في التحسين باستخدام موقف الفرقة التي من المعقول أن نتوقع في البكتيريا (على سبيل المثال ، amide الأول وAamie الثاني). ثالثا، بالنسبة لجمع البيانات، من المهم تسليط الضوء على أهمية اختيار الطاقة بعناية (مما يسمح بتحقيق نسبة S/N جيدة)، لأنه يمكن أن يكون له تأثير مدمر. تعتمد الطاقة الموصى بها على سمك العينة ، مع توفر إرشادات تقريبية في دليل الأداة31. نوصي باختبار حالة العينة بعد القياس تجريبيا من خلال جمع صورة AFM ، لأنها ستكشف عن أي تأثير مدمر. وعلاوة على ذلك، فإن جمع صور AFM من نفس المنطقة قبل وبعد جمع أطياف AFM-IR بمثابة تأكيد جيد على أنه لم يحدث أي انجراف وأن الأطياف تنشأ بالفعل من النقطة المختارة في الخلية. إن إمكانية الانجراف مهمة بشكل خاص عند تطبيق طريقة التصوير ، من خلال التصوير المتتالي لكثافة الأشعة تحت الحمراء في قيم محددة. مثال على ذلك موضح في الشكل 5. تم تعريف المنطقة المصورة في بداية التجربة والمقصود بها أن تكون متسقة مع جميع قيم عدد الموجات. ومع ذلك، يظهر انجراف واضح بين كل صورة ارتفاع AFM (وكثافة عدد الموجات الأشعة تحت الحمراء المقابلة)، مع وقت اقتناء كل خريطة من حوالي 40 دقيقة. ونتيجة لذلك ، بالنسبة للمستخدمين الذين يجمعون بيانات التصوير ، نوصي دائما بتحديد منطقة أكبر قليلا من عينة الاهتمام ، لضمان أنه حتى عند وجود الانجراف ، ستبقى عينة الاهتمام داخل المنطقة المصورة.
وتشمل القيود المحتملة للبروتوكول عدم القدرة على جمع البيانات في حالة رطبة في الحلول الفسيولوجية (مثل المالحة أو برنامج تلفزيوني) المذكورة أعلاه. وعلاوة على ذلك، وخاصة في المناطق ذات الرطوبة العالية، غالبا ما تكون هناك حاجة لتطهير النيتروجين. وعلاوة على ذلك، يمكن البروتوكول من استكشاف الكائنات الحية إلى 100 نانومتر في الحجم، باستثناء إمكانية استخدامه للهياكل الأصغر حجما. على الرغم من أنه يمكن التغلب على ذلك باستخدام ليزر مختلف (على سبيل المثال ، ليزر سلسلة الكم مما يسمح بتحقيق الدقة المكانية من 20 نانومتر) ، ويرتبط أيضا مع نطاق طيفي محدود وكذلك صعوبات في الحصول على إشارة جيدة إلى نسبة الضوضاء. وأخيرا، قد يمثل فحص الأسطح الناعمة تحديا مع عدم اكتشاف الطرف للسطح بشكل صحيح وتجاوز نقطة الاتصال، حتى الكسر. على الرغم من أن هذا عادة لا مشكلة مع عينات بكتيرية، فإنه قد يحدث عند قياسات عينات ليونة. في مثل هذه الحالات ، يوصى بمحاولة الانخراط على سطح نظيف من الركيزة بالقرب من العينة.
ويمكن استخدام البروتوكول الموصوف لأنواع عديدة من البحوث البكتيرية، بما في ذلك الدراسات المقارنة بين عينات مختلفة وكذلك الفحص دون الخلوي. يمكن تحليل البيانات باستخدام نهج القياس الكيميائي لأطياف واحدة وطرائق التصوير35، اعتمادا على هدف البحث. وعلاوة على ذلك، يمكن أيضا تعديل البروتوكول لتطبيقه على المواد البيولوجية الأخرى (مثل الفطريات والخميرة والخلايا، وما إلى ذلك)، من خلال إضافة التثبيت.
Disclosures
نود أن نعترف بروكر لدفع رسوم النشر. KK و BRW و AP و PH هم مخترعون على براءة اختراع دولية (PCTIB2020/052339) ، والتي تصف بعض الجوانب الأساسية للنهج.
Acknowledgements
ونود أن نعترف ببروكر لدعمه. وقد دعم هذا العمل منحة نجاح المرأة من جامعة موناش ." تعترف A.Y.P بالدعم المقدم من زمالة ممارسي المجلس الوطني الأسترالي للصحة والبحوث الطبية (APP1117940). تم تمويل هذا العمل من قبل مشروع اكتشاف مجلس البحوث الأسترالي DP180103484. ونود أن نشكر السيد فينلي شانكز على دعمه الفعال والسيدة زينيا كوستولياس على مساعدتها التقنية في العينات.
Materials
| Name | Company | Catalog Number | Comments |
| AFM metal specimen disc | PST ProSciTech Pty Ltd | GA530-15 | Recommended 15 mm |
| Anasys AFM-IR nanoIR2 | Anaysys Instruments | model: nanoIR2 | |
| Contact mode NIR2 Probes for nanoIR 2 | Bruker / Anasys Instruments | - | Model: Model: PR-EX-NIR2 |
| Heraeus Pico 17 Microcentrifuge | Thermo Scientific | - | - |
| Matlab | Mathworks Inc | - | Multivariate data analysis software |
| Micro-centrifuge tubes, 1.5 mL | Heathrow Scientific | HEA4323 | Can be replaced with any other micro-centrifuge tube |
| NanoIR 2 instrument | Bruker / Anasys Instruments | - | - |
| PLS toolbox | Mathworks Inc | - | GUI for Matlab |
| Selected bacterial medium (e.g. HBA Columbia Plates) | Thermo Fisher | PP2001 | Provided type of medium is an example and can be replaced by others, depending on the type of experiment |
| Selected bacterial strain | - | - | The source depends on the aim of research (patient isolates, ATCC strains, etc.) |
| Substrate (e.g. Raman grade CaF2) | Crystran | CAFP13-2R | Recommended size: 13 mm Ø x 2.0 mm |
| Tip pipette 1000 µl | Axygen | T-1000-B | - |
| Tip pipette 200 µl | Axygen | T-200-C | - |
| Tip pipette 0.5-10 µl | Axygen | T-300-R | - |
| Ultrapure water | - | - | - |
References
- Sears, C. L. A dynamic partnership: celebrating our gut flora. Anaerobe. 11 (5), 247-251 (2005).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), 200-211 (2020).
- Seymour, C. W., et al. Time to treatment and mortality during mandated emergency care for sepsis. The New England Journal of Medicine. 376 (23), 2235-2244 (2017).
- Weiss, S. L., et al. Delayed antimicrobial therapy increases mortality and organ dysfunction duration in pediatric sepsis. Critical Care Medicine. 42 (11), 2409-2417 (2014).
- Peker, N., Couto, N., Sinha, B., Rossen, J. W. Diagnosis of bloodstream infections from positive blood cultures and directly from blood samples: recent developments in molecular approaches. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. 24 (9), 944-955 (2018).
- Aminov, R. I. The role of antibiotics and antibiotic resistance in nature. Environmental Microbiology. 11 (12), 2970-2988 (2009).
- Levy, S. B., Marshall, B. Antibacterial resistance worldwide: causes, challenges and responses. Nature Medicine. 10 (12), 122-129 (2004).
- Roca, I., et al. The global threat of antimicrobial resistance: science for intervention. New Microbes and New Infections. 6, 22-29 (2015).
- O'Neill, J. The review on antimicrobial resistance. Tackling drug-resistant infections globally: final report and recommendations. Wellcome Trust. , (2016).
- Perry, J. A., Westman, E. L., Wright, G. D. The antibiotic resistome: what's new. Current Opinion in Microbiology. 21, 45-50 (2014).
- Piddock, L. J. Assess drug-resistance phenotypes, not just genotypes. Nature Microbiology. 1 (8), 16120 (2016).
- Naumann, D., Helm, D., Labischinski, H. Microbiological characterizations by FT-IR spectroscopy. Nature. 351 (6321), 81-82 (1991).
- Zarnowiec, P., Lechowicz, L., Czerwonka, G., Kaca, W. Fourier Transform Infrared Spectroscopy (FTIR) as a tool for the identification and differentiation of pathogenic bacteria. Current Medicinal Chemistry. 22 (14), 1710-1718 (2015).
- Quintelas, C., Ferreira, E. C., Lopes, J. A., Sousa, C. An overview of the evolution of infrared spectroscopy applied to bacterial typing. Biotechnology Journal. 13 (1), 1700449 (2018).
- San-Blas, E., Cubillán, N., Guerra, M., Portillo, E., Esteves, I. Characterization of xenorhabdus and photorhabdus bacteria by Fourier transform mid-infrared spectroscopy with attenuated total reflection (FT-IR/ATR). Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy. 93, 58-62 (2012).
- Sousa, C., et al. Discrimination of the acinetobacter calcoaceticus-acinetobacter baumannii complex species by Fourier transform infrared spectroscopy. European Journal of Clinical Microbiology & Infectious Diseases. 33 (8), 1345-1353 (2014).
- Rodriguez-Saona, L. E., Khambaty, F. M., Fry, F. S., Calvey, E. M. Rapid detection and identification of bacterial strains by Fourier transform near-infrared spectroscopy. Journal of Agricultural and Food Chemistry. 49 (2), 574-579 (2001).
- Dawson, S. E., et al. Implementation of Fourier transform infrared spectroscopy for the rapid typing of uropathogenic Escherichia coli. European Journal of Clinical Microbiology & Infectious Diseases. 33 (6), 983-988 (2014).
- Kochan, K., et al. Detection of Antimicrobial Resistance-Related Changes in Biochemical Composition of Staphylococcus aureus by Means of Atomic Force Microscopy-Infrared Spectroscopy. Analytical Chemistry. 91 (24), 15397-15403 (2019).
- Dazzi, A., Prater, C. B. AFM-IR: Technology and Applications in Nanoscale Infrared Spectroscopy and Chemical Imaging. Chemical Reviews. 117 (7), 5146-5173 (2017).
- Dazzi, A., et al. AFM-IR: combining atomic force microscopy and infrared spectroscopy for nanoscale chemical characterization. Applied Spectroscopy. 66 (12), 1365-1384 (2012).
- Kochan, K., et al. et al. In vivo atomic force microscopy-infrared spectroscopy of bacteria. Journal of the Royal Society, Interface. 15 (140), (2018).
- Katzenmeyer, A. M., et al. Mid-infrared spectroscopy beyond the diffraction limit via direct measurement of the photothermal effect. Nanoscale. 7 (42), 17637-17641 (2015).
- . Bruker Life Science Applications Available from: https://www.bruker.com/products/surface-and-dimensional-analysis/nanoscale-infrared-spectrometers/nanoscale-ir-spectroscopy-applications/life-sciences.html (2020)
- Mayet, C., Dazzi, A., Prazeres, R., Ortega, J. M., Jaillard, D. In situ identification and imaging of bacterial polymer nanogranules by infrared nanospectroscopy. Analyst. 135 (10), 2540-2545 (2010).
- Baldassarre, L., et al. Mapping the amide I absorption in single bacteria and mammalian cells with resonant infrared nanospectroscopy. Nanotechnology. 27 (7), 075101 (2016).
- Vitry, P., et al. Combining infrared and mode synthesizing atomic force microscopy: Application to the study of lipid vesicles inside Streptomyces bacteria. Nano Research. 9 (6), 1674-1681 (2016).
- Dazzi, A., et al. Chemical mapping of the distribution of viruses into infected bacteria with a photothermal method. Ultramicroscopy. 108 (7), 635-641 (2008).
- Steenbergen, J. N., Alder, J., Thorne, G. M., Tally, F. P. Daptomycin: a lipopeptide antibiotic for the treatment of serious Gram-positive infections. The Journal of Antimicrobial Chemotherapy. 55 (3), 283-288 (2005).
- Garcia, L. S. MacFarlan Standards. Clinical Microbiology Procedures Handbook, 3rd Edition. , (2010).
- NanolR-2 System Manual. Anasys Instruments Available from: https://www.anasysinstruments.com/downloadpr/nanoIR2_s_System_Manual.pdf (2020)
- Whelan, D. R., et al. Detection of an en masse and reversible B- to A-DNA conformational transition in prokaryotes in response to desiccation. Journal of the Royal Society, Interface. 11 (97), 20140454 (2014).
- McGuinness, W. A., Malachowa, N., DeLeo, F. R. Vancomycin Resistance in Staphylococcus aureus. The Yale Journal of Biology and Medicine. 90 (2), 269-281 (2017).
- Howden, B. P., Peleg, A. Y., Stinear, T. P. The evolution of vancomycin intermediate Staphylococcus aureus (VISA) and heterogenous-VISA. Infection, Genetics and Evolution: Journal of Molecular Epidemiology and Evolutionary Genetics in Infectious Diseases. 21, 575-582 (2014).
- Perez-Guaita, D., et al. Multispectral Atomic Force Microscopy-Infrared Nano-Imaging of Malaria Infected Red Blood Cells. Analytical Chemistry. 90 (5), 3140-3148 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved