A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في المختبر الوقت الفاصل التصوير بالخلايا الحية لاستكشاف هجرة الخلايا نحو جهاز كورتي
* These authors contributed equally
In This Article
Summary
في هذه الدراسة، نقدم طريقة تصوير في الوقت الحقيقي باستخدام المجهر البؤري لمراقبة الخلايا تتحرك نحو الأنسجة التالفة عن طريق حضانة الجسم الحي السابق مع ظهارة القوقعة التي تحتوي على جهاز كورتي.
Abstract
لدراسة آثار الخلايا الجذعية المتوسطة (MSCs) على تجديد الخلايا وعلاجها ، تتعقب هذه الطريقة هجرة MSC والتغيرات المورفولوجية بعد الثقافة المشتركة مع ظهارة قوقعة. تم شل حركة عضو كورتي على غطاء بلاستيكي عن طريق الضغط على جزء من غشاء ريسنر المتولد أثناء التشريح. هاجرت MSCs المحصورة بواسطة أسطوانة زجاجية نحو ظهارة القوقعة عندما تمت إزالة الأسطوانة. لوحظ توطينها السائد في تعديل جهاز كورتي ، المنحاز في اتجاه مماثل لاتجاه الألياف العصبية. ومع ذلك، تم توطين بعض MSCs في منطقة الحويلجان وأظهرت شكلا ممدودا أفقيا. وبالإضافة إلى ذلك، زادت الهجرة إلى منطقة خلايا الشعر، وتغير مورفولوجيا MSCs إلى أشكال مختلفة بعد علاج الكاناميسين. في الختام، تشير نتائج هذه الدراسة إلى أن الزراعة المشتركة ل MSCs ذات ظهارة القوقعة ستكون مفيدة لتطوير العلاجات عن طريق زرع الخلايا ولدراسات تجديد الخلايا التي يمكن أن تفحص مختلف الحالات والعوامل.
Introduction
يمكن أن يحدث فقدان السمع خلقيا أو يمكن أن يكون سببه تدريجيا عدة عوامل، بما في ذلك الشيخوخة والأدوية والضوضاء. غالبا ما يصعب علاج فقدان السمع لأنه من الصعب للغاية استعادة ضعف الوظيفة بمجرد تلف خلايا الشعر المسؤولة عن السمع1. ووفقا لمنظمة الصحة العالمية، تشير التقديرات إلى أن 461 مليون شخص في جميع أنحاء العالم يعانون من فقدان السمع، وهو ما يمثل 6.1٪ من سكان العالم. ومن بين المصابين بفقدان السمع، هناك 93 في المائة من البالغين، و7 في المائة من الأطفال.
وقد جرت محاولة اتباع عدد من النهج لعلاج فقدان السمع؛ وتجدر الإشارة إلى أن نهج التجديد باستخدام مركبات الكربون الهيدروفلورية قد برز كعلاج واعد. عندما تتلف الأنسجة ، يتم إطلاق MSCs بشكل طبيعي في نظام الدورة الدموية وتهاجر إلى موقع الإصابة حيث تفرز جزيئات مختلفة لتشكيل بيئة دقيقة تعزز التجديد2. ومن ثم، من المهم تطوير طريقة لعلاج الأنسجة التالفة من خلال هجرة MSCs المزروعة خارجيا لاستهداف الأعضاء وإفرازها اللاحق للجزيئات التي تسبب تنظيم المناعة القوية، وتولد الأوعية، ومكافحة موت الخلايا المبرمج لتعزيز استعادةوظيفةالخلية التالفة 3،4،5.
وقد تكون عملية التوجيه التي تهاجر فيها مركبات الكربون الهيدروفلورية إلى الأنسجة التالفة أهم عقبة يتعين التغلب عليها. لدى MSCs آلية توجيه نظامية مع خطوات متتالية من الربط / المتداول ، والتنشيط ، والاعتقال ، والهجرة / diapedesis ، والهجرة6،7،8. وتبذل حاليا جهود لتحديد سبل تحسين هذه الخطوات. استراتيجيات مختلفة، بما في ذلك التعديل الوراثي، هندسة سطح الخلية، فتيلة في المختبر، والتوجيه المغناطيسي، وقد تم اختبار6،7. وبالإضافة إلى ذلك، بذلت عدة محاولات لتعزيز حماية وتجديد خلايا الشعر السمعية عن طريق توجيه MSCs إلى موقع القوقعة التالفة. ومع ذلك ، فإن تتبع MSCs في الجسم الحي يستغرق وقتا طويلا ويتطلب عمالة كثيفة ويتطلب مهارات عالية التخصص9.
لحل هذه المشكلة، تم تطوير طريقة لمراقبة توجيه MSCs في القوقعة من خلال المجهر الكونفوجال الفاصل الزمني الذي يصور هجرة الخلايا على مدى عدة ساعات(الشكل 1). وقد تم تطويره في أوائلالقرن العشرين وأصبح مؤخرا أداة قوية لدراسة هجرة خلايا محددة.
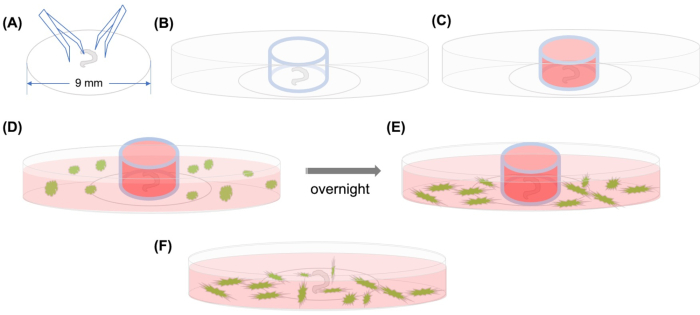
الشكل 1: تجريدي رسومية. (أ) بعد أن يتم الالتزام بالعضو تشريح كورتي على غطاء بلاستيكي باستخدام ملقط، يتم وضع غطاء على طبق مجهري 35 ملم زجاجي القاع، و (ب) يتم وضع اسطوانة الزجاج. (ج)بعد ملء داخل الاسطوانة الزجاجية مع المتوسطة،(D)يتم إضافة MSCs GFP المسمى مع المتوسطة بعناية خارج الاسطوانة. (ه) بعد الحضانة بين عشية وضحاها ، (واو) تتم إزالة اسطوانة الزجاج ، ويتم التقاط الصور مع المجهر confocal. الاختصارات: GFP = بروتين فلوري أخضر. MSCs = الخلايا الجذعية المتوسطة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تمت الموافقة على جميع بروتوكولات البحث التي تشمل فئران ICR من قبل اللجنة المؤسسية لرعاية الحيوان واستخدامه (IACUC) في جامعة يونسي في كلية وونجو للطب. وأجريت التجارب وفقا لمدونة قواعد السلوك للجمعية الطبية العالمية. في هذا البروتوكول، تم الاحتفاظ الفئران ICR الحوامل في دورة خفيفة / مظلمة 12/12 ساعة مع حرية الوصول إلى الغذاء والماء.
1. تشريح القوقعة
- تعقيم غطاء محرك السيارة زراعة الأنسجة تدفق صفح عن طريق تشغيل الأشعة فوق البنفسجية ل ~ 30 دقيقة، ورش جميع الأسطح مع الإيثانول 70٪ قبل الاستخدام. السماح للأسطح لتجف.
- وضع أدوات تشريح في الإيثانول 70٪ لمدة 10 دقيقة، وجافة قبل استخدام.
- استخدام شفرة التشغيل لقطع رأس الفئران بعد الولادة 3-4 يوم من العمر (الشكل 2A).
- ضع الجمجمة تحت منظار مجسم في غطاء تدفق صفح ، وانقع الأنسجة في الإيثانول بنسبة 70٪.
- نقع بسرعة الأنسجة في حل تشريح الأنسجة (1x هانك متوازن محلول الملح، 1 M HEPES) لإزالة الإيثانول.
- قطع خط الوسط من الجمجمة مع شفرة جراحية (الشكل 2B،C).
- فضح الجمجمة عن طريق سحب أسفل الجلد الأمامي وقطع القناة السمعية الخارجية للأذن (الشكل 2D).
- قطع من الأمامي إلى الجزء الخلفي من الجمجمة عبر خط العين (الشكل 2E).
- فتح الجمجمة وإزالة الدماغ الأمامي والمخيخ، وعقل الدماغ مع ملقط حادة (الشكل 2F،G).
- باستخدام ملقط صغير، فصل القوقعة من العظام الزمنية (الشكل 2H).
- نقل القوقعة إلى طبق بيتري يحتوي على محلول تشريح الأنسجة.
- تشريح بعناية كل من كبسولة المجذاف cochlear، وترك فقط الأنسجة الرخوة القوقعة الداخلية (الشكل 2I،J).
- عقد موديولوس من القوقعة مع ملقط والقناة القوقعة مع زوج آخر من ملقط، وفصل ببطء النسيجين(الشكل 2K).
- إزالة الأوعية الدموية ستريا والغشاء tectorial بتقشير بلطف لهم بعيدا (الشكل 2L,M).
- وضع غطاء بلاستيكي معقم في حل تشريح الأنسجة الجديدة، ومن ثم وضع الجهاز من كورتي على غطاء قطره 9 ملم، والتأكد من أن الغشاء باسيلار يواجه إلى أسفل(الشكل 2N-P).
- شل الأنسجة عن طريق الضغط على غشاء ريسنر والأنسجة المعدلة المتبقية على غطاء مع ملقط(الشكل 2N-P).
- نقل غطاء مع الأنسجة جزءا لا يتجزأ من وسط طبق كونفوكوكال من قطر 35 ملم.
- ضع أسطوانة الاستنساخ الزجاجي على الطبق ، مع وضع explant قوقعة في وسط الطبق ، وإضافة 100 ميكرولتر من وسيط الثقافة explant (DMEM / F12 ، 10٪ مصل البقر الجنيني (FBS) ، 1٪ N2 الملحق ، الأمبيسلين (10 ميكروغرام / مل))10 داخل الاسطوانة(الشكل 2Q).
- لوحة 5 × 103 خلايا من نخاع العظم الماوس المستمدة من البروتين الفلوري الأخضر (GFP) الموسومة MSCs في 2 مل من الثقافة المتوسطة (45٪ DMEM + 45٪ DMEM/F12، 10٪ FBS، 1٪ N2 الملحق، 10 ميكروغرام / مل من أمبيسلين) خارج اسطوانة زجاجية(الشكل 2R).
- عندما تكون MSCs التقاء 80-90٪، مرور لهم عن طريق فصل لهم مع حمض التترا الأسيتيك تريبسين-إيثيلينديامين.
- نقل بعناية طبق confocal إلى حاضنة مرطبة واحتضان بين عشية وضحاها في 37 درجة مئوية في جو CO2 5٪.
- يستنشق كل المتوسط داخل وخارج الاسطوانة، ومن ثم إزالة اسطوانة الزجاج من طبق confocal.
- أضف 2 مل من وسط الثقافة الطازجة إلى طبق الكونفوجال، واحتضن طبق زراعة الأنسجة في حاضنة رطبة حتى تصبح جاهزة للتحليل.

الشكل 2. تشريح قوقعة الماوس والزراعة المشتركة لجهاز كورتي وMSCs. (أ) قطع رأس الفأر ، (ب) و (ج) تشريح القوس الوسطي للرأس ، (D) و (E) تشريح تاجي للدماغ ، (F) و (G) إزالة الدماغ والعظام الصدغية ، (H) القوقعة ، (I) إزالة جدار قوقعة الأذن العظمية ، (J) عزل القوقعة ، (K) فصل القناة من القوقعة من (L) فصل الأوعية الدموية الستريا (SV) والرباط الحلزوني (SL) من الجهاز من كورتي،(م)إزالة الغشاء التكفيري،(N-P)تثبيت القوقعة على زلة غطاء بلاستيكي، (س) موقع غطاء واسطوانة زجاجية في طبق confocal، (R) تلقيح MSCs. شريط مقياس أبيض (A-E) = 1 سم؛ البرتقالي (F, G, P) و شريط مقياس أصفر (H,I) = 1 مم; شريط المقياس الأخضر(J-O) = 0.5 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. التصوير الفاصل الزمني
- بالنسبة للتجارب المعروضة هنا، استخدم نظام المجهر البؤري مع نظام حاضنة أعلى مرحلة.
- قم بتشغيل المجهر البؤري والضوء الفلوري والكمبيوتر.
- تعيين شروط حاضنة المرحلة الأعلى وضعت على خشبة المسرح من المجهر confocal إلى 37 درجة مئوية و 5٪ CO2 الغلاف الجوي.
- ضع طبق العينة على وعاء تثبيت الطبق، وغطيه بغطاء تثبيت الطبق، واغلق الغرفة بغطاء المدفأة العلوي.
- ضبط التكبير والتركيز لترجمة الجهاز من كورتي وMSCs في مجال الرؤية.
- افتح برنامج معالجة الصور. ضمن خيار تحديد الموقع، حدد هدف الخطة-أبوكرومات 20x (الفتحة العددية 0.8) ومنطقة المحاصيل 0.5x.
- ضمن الاستحواذ، انقر على الإعداد الذكي وحدد EGFP.
- فتح علامة التبويب قناة تحت الاستحواذ، وتعيين قوة الليزر إلى 0.2 ٪، والثقب إلى 44 ميكرومتر، والكسب الرئيسي إلى 750 V، والكسب الرقمي إلى 1.0.
- انقر على ESID تحت إعداد التصوير، وحدد مكاسب ESID إلى 4 والربح الرقمي إلى 7.5.
- انقر على البلاط وحصة لإنتاج البلاط 210.
- افتح استراتيجية التركيز وحدد وضع التركيز.
- ضمن سلسلة زمنية، حدد المدة إلى 24 ساعة والفاصل الزمني إلى 10 دقائق.
- تحت Acquisition، قم بتعيين حجم الإطار إلى 512 × 512 بكسل ، وسرعة المسح الضوئي إلى 8، والاتجاه إلى ثنائي الاتجاه، والمتوسط إلى 4x، والبتات لكل بكسل إلى 16.
- انقر على بدء التجربة لبدء التجربة.
3. تعديل ملف الصورة
- تحت المعالجة، انقر على خياطة، وتعيين الحد الأدنى من تراكب إلى 5 ٪ والتحول الأقصى إلى 10 ٪.
- انقر على تصدير الفيلم، تعيين غير مضغوط، وتعيين السرعة إلى 7.5.
4. التثبيط المناعي
- يستنشق المتوسط بعناية، ويغسل العينة مرتين مع المالحة العازلة بالفوسفات (PBS) لمدة 5 دقائق.
- إصلاح العينة مع 4٪ الفورمالين في برنامج تلفزيوني لمدة 15 دقيقة، وغسل العينة 3 مرات مع برنامج تلفزيوني لمدة 5 دقائق.
- Permeabilize العينة في 0.1٪ تريتون X-100 في برنامج تلفزيوني لمدة 10 دقيقة، ويغسل 3 مرات مع برنامج تلفزيوني لمدة 5 دقائق.
- إضافة 250 ميكرولتر من phalloidin-iFluor 647 كاشف (1:1000 التخفيف في برنامج تلفزيوني), واحتضان العينة لمدة 1 ساعة في درجة حرارة الغرفة على شاكر.
- غسل العينة 3 مرات مع برنامج تلفزيوني لمدة 5 دقائق.
- نقل غطاء على الشريحة الزجاجية، وإضافة 2 قطرات من حل تصاعد.
- ضع غطاء على الشريحة برفق.
- ختم غطاء مع طلاء الأظافر واضحة وتخزينها في 4 درجة مئوية في الظلام حتى يتم رصد الخلايا.
- صورة الشريحة باستخدام مجهر confocal مع مرشح مناسب في الإثارة / الانبعاثات (Ex/Em)=650/665 نانومتر لphalloidin وفي Ex/Em = 488/507 نانومتر لEGFP.
النتائج
وقد تم تقييم الهجرة في المختبر من MSCs في وضع ثلاثي الأبعاد من قبل نظام ترانسويل أو من خلال طريقة التئام الجروح التقليدية لمراقبة الهجرة في ثنائي الأبعاد (2D) واسطة11. جهاز كورتي هو بنية معقدة تتكون من خلايا مختلفة مثل خلايا بوتشر ، خلايا كلوديوس ، خلايا Deiters ، خلا...
Discussion
وقد تمت دراسة زرع MSCs في المواقع المتضررة لتعزيز تجديد الخلايا التالفة على نطاق واسع ، والتأثير العلاجي واضح. وقد أفيد زرع والتمايز اللاحقة من MSCs لاستعادة السمع في الفئران مع فقدان السمع الناجم عن حمض 3 نيتروبروبيونيك13. على الرغم من أن لي وآخرون تطبيق MSCs على البشر عبر الوريد، ف?...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم دعم هذا العمل من خلال المنح البحثية (NRF-2018-R1D1A1B07050175، HURF-2017-66) من المؤسسة الوطنية للبحوث (NRF) في كوريا وصندوق أبحاث جامعة هاليم.
Materials
| Name | Company | Catalog Number | Comments |
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
References
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved