A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بروتوكول شامل عالي الكفاءة لعزل واستزراع واستقطاب وتوصيف تحلل السكر للضامة المشتقة من نخاع العظام
In This Article
Summary
يوفر هذا البروتوكول طرقا مفصلة وشاملة لعزل وزراعة واستقطاب وقياس حالة التمثيل الغذائي المحلل للسكر للضامة الحية المشتقة من نخاع العظام (BMDMs). توفر هذه الورقة إرشادات خطوة بخطوة مع رسوم توضيحية مرئية واقعية لسير العمل وتقييم تحلل السكر ل BMDMs في الوقت الفعلي.
Abstract
تعتبر البلاعم من بين أهم الخلايا العارضة للمستضد. تم تحديد العديد من المجموعات الفرعية من البلاعم بتوقيعات استقلابية فريدة. تصنف البلاعم عادة على أنها أنواع فرعية شبيهة ب M1 (التهابية) وشبيهة ب M2 (مضادة للالتهابات). البلاعم الشبيهة ب M1 هي ضامة مؤيدة للالتهابات يتم تنشيطها بواسطة LPS و / أو السيتوكينات المؤيدة للالتهابات مثل INF-γ و IL-12 و IL-2. تشارك البلاعم المستقطبة الشبيهة ب M1 في أمراض مختلفة عن طريق التوسط في دفاع المضيف لمجموعة متنوعة من البكتيريا والفيروسات. هذا مهم جدا لدراسة البلاعم الشبيهة ب M1 التي يسببها LPS وحالاتها الأيضية في الأمراض الالتهابية. تعتبر البلاعم الشبيهة ب M2 ضامة مضادة للالتهابات ، يتم تنشيطها بواسطة السيتوكينات والمنشطات المضادة للالتهابات. في ظل الحالة المؤيدة للالتهابات ، تظهر البلاعم زيادة في تحلل السكر في وظيفة تحلل السكر. تم التحقيق في وظيفة تحلل السكر بنشاط في سياق تحلل السكر ، أو القدرة على تحلل السكر ، أو احتياطي تحلل السكر ، أو تحلل السكر التعويضي ، أو التحمض غير المحلل للسكر باستخدام أجهزة تحليل التدفق خارج الخلية (XF).
توضح هذه الورقة كيفية تقييم حالات تحلل السكر في الوقت الفعلي بخطوات سهلة المتابعة عندما تتنفس البلاعم المشتقة من نخاع العظام (BMDMs) وتستهلك الطاقة وتستهلكها. باستخدام مثبطات ومنشطات محددة لتحلل السكر في هذا البروتوكول ، نوضح كيفية الحصول على رؤية منهجية وكاملة لعمليات التمثيل الغذائي المحلل للسكر في الخلايا وتقديم نتائج أكثر دقة وواقعية. لنكون قادرين على قياس الأنماط الظاهرية المتعددة للسكر ، نقدم طريقة تطبيع سهلة وحساسة قائمة على الحمض النووي لتقييم استقطاب BMDMs. تعد الزراعة والتنشيط / الاستقطاب وتحديد النمط الظاهري والحالة الأيضية ل BMDMs من التقنيات الحاسمة التي يمكن أن تساعد في التحقيق في العديد من أنواع الأمراض المختلفة.
في هذه الورقة ، قمنا باستقطاب البلاعم M0 الساذجة إلى البلاعم الشبيهة ب M1 و M2 باستخدام LPS و IL4 ، على التوالي ، وقمنا بقياس مجموعة شاملة من معلمات حال السكر في BMDMs في الوقت الفعلي والطولي بمرور الوقت ، باستخدام تحليل التدفق خارج الخلية والمنشطات والمثبطات المحللة للسكر.
Introduction
البلاعم هي واحدة من أهم الخلايا في الجهاز المناعي الفطري الشبيهة ب M1. يشاركون في إزالة الأمراض المعدية ، والبلعمة ، وعرض المستضد ، وتنظيم الالتهاب2. علاوة على ذلك ، فإن البلاعم مطلوبة لتنظيم الخلايا المناعية الأخرى عبر السيتوكينات المختلفة التيتطلقها 3. هناك طيف كبير في الأنماط الظاهرية للبلاعم4. اعتمادا على الإشارات التي تتعرض لها البلاعم ، فإنها تستقطب نحو حالات التهابية وأيضيةمختلفة 5. تظهر البلاعم تغيرات أيضية في أمراض مختلفة ، اعتمادا على الأنسجة التي توجد فيها الضامة6. تتمتع البلاعم المستقطبة بالقدرة على إعادة برمجة أو تبديل عملية التمثيل الغذائي المحلل للسكر ، واستقلاب الدهون ، واستقلاب الأحماض الأمينية ، والفسفرة المؤكسدة للميتوكوندريا (OXPHOS) 7،8. البلاعم الشبيهة ب M1 التي يتم تنشيطها كلاسيكيا والضامة الشبيهة ب M2 التي يتم تنشيطها بدلا من ذلك هما النمطين الظاهريان الأكثر دراسة للبلاعم3. يشار إلى الضامة الهادئة غير المنشطة باسم البلاعم M0. يمكن إحداث استقطاب البلاعم M0 نحو نمط ظاهري يشبه M1 عن طريق تحفيز BMDMs الساذجة بعديدات السكاريد الدهنية البكتيرية (LPS)9. يمكن تنشيط مسار الإشارات PI3K-AKT-mTOR-HIF1a في البلاعم في وجود السيتوكينات الالتهابية أو الإنترفيرون جاما (IFN γ) أو عامل نخر الورم (TNF) 10. زادت البلاعم الشبيهة ب M1 من مستويات استقلاب تحلل السكر ، وانخفاض مستويات الفسفرة المؤكسدة (OXPHOS) ، مما ينتج عنه السيتوكينات الالتهابية المشاركة في الأمراض المعديةوالالتهابية 8. من ناحية أخرى ، يمكن إحداث الاستقطاب نحو النمط الظاهري الشبيه ب M2 بواسطة Interleukin (IL) -4 ، عبر مسارات JAK-STAT و PPAR و AMPK ، أو عن طريق (IL) -13 و TGFβpathays 11،12.
على عكس البلاعم الشبيهة ب M1 ، فإن الضامة الشبيهة ب M2 قد قللت من تحلل السكر وزادت من OXPHOS وتشارك في الأنشطة المضادة للطفيليات وإصلاحالأنسجة 8،13. BMDMs هي نظام يستخدم على نطاق واسع لدراسة البلاعم المشتقة من الخلايا الجذعية لنخاع العظم. تحلل السكر و OXPHOS هما المساران الرئيسيان لإنتاج الطاقة في الخلايا14. بناء على بيئتها الدقيقة ، يمكن ل BMDMs اختيار استخدام أي من هذه المسارات. في بعض الحالات ، قم بالتبديل من واحد إلى آخر ، أو استخدم كلا المسارين14. في هذه الدراسة ، ركزنا على استقلاب تحلل السكر في الضامة المنشطة المؤيدة للالتهابات. عندما يتم تحويل الجلوكوز الموجود في السيتوبلازم إلى بيروفات ثم اللاكتات ، تنتج الخلايا بروتونات في الوسط تسبب ارتفاعا في معدل التحمض في الوسط المحيط بالخلايا الشبيهة ب M15. تم استخدام محلل التدفق خارج الخلية لقياس معدل تحمض وسائط الخلية. يتم الإبلاغ عن النتائج على أنها معدل تحمض خارج الخلية (ECAR) أو معدل تدفق البروتونات.
تعد الطريقة السريعة والسهلة المحسنة للوصول إلى مستويات تحلل السكر في البلاعم المستقطبة ضرورية لتحديد النمط الظاهري المحلل للسكر وتغيرات المستقلب وتأثيرات المثبطات / المنشطات والأدوية على الضامة المستقطبة. تم تحسين الطريقة الموضحة في هذه المخطوطة لإعطاء معلومات حول عوامل تحلل السكر المحددة (تحلل السكر ، والقدرة على تحلل السكر ، واحتياطي تحلل السكر ، والتحمض غير المحلل للسكر) ، بالإضافة إلى إعادة البرمجة الأيضية لعملية التمثيل الغذائي لتحلل السكر. يستهدف المثبط (2DG) الذي تم استخدامه في هذه الدراسة صراحة مسار تحلل السكر.
تم تعديل هذا البروتوكول المحسن وتحسينه بناء على مزيج من البروتوكولالمنشور 16 ، وتحليل التدفق خارج الخلية لمقايسات حال السكر لأدلة المستخدم الخاصة بالشركة المصنعة ، والتواصل المباشر مع علماء البحث والتطوير في الشركة المصنعة.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم التضحية بالفئران بشكل إنساني وفقا لتقييم واعتماد رعاية المختبر (AAALAC) وإرشادات الجمعية الأمريكية لعلوم المختبر (AALAS) وباستخدام البروتوكولات المعتمدة من قبل لجنة رعاية واستخدام المؤسسية بجامعة تكساس إيه آند إم (IACUC).
1. حصاد نخاع عظم الفئران واستزراع BMDMs
- التضحية بالفأر (6-10 أسابيع من العمر C57Bl / 6 فئران كانت في هذا البروتوكول) ووضعها على جانبه البطني ، وقطع الجلد والطبقة البريتونية وقشر الساقين برفق.
ملاحظة: استخدم التعرض لغاز ثاني أكسيد الكربون2 للقتل الرحيم للماوس. - افصل كلا الساقين الخلفيتين عن الورك لأسفل ، مع الحرص على عدم قطع العظم.
- ضع الساق بأكملها في أنبوب مخروطي فارغ سعة 50 مل (مع توجيه القدمين لأعلى لسهولة سحبها لاحقا) على الجليد واستمر في حصاد كلتا الساقين من الماوس.
2. التعرض لعظم الفخذ
ملاحظة: قم بتنفيذ الخطوات التالية في خزانة السلامة البيولوجية.
- احصد عظم الفخذ عن طريق قطع الساق من كل ساق وإزالة أكبر قدر ممكن من الأنسجة المحيطة بعظم الفخذ بالمقص وورق المختبر.
- ضع عظم الفخذ المحصود "النظيف" في طبق مقاس 10 سم يحتوي على قطعة من ورق المختبر المشبع بوسط زراعة الأنسجة (TC) أو PBS. ضعهم على الثلج.
- استمر في حصاد عظم الفخذ وإزالة الأنسجة من جميع عظم الفخذ قبل الانتقال إلى مرحلة التنظيف (الشكل 1 أ).
3. تدفق النخاع
- لطرد النخاع من عظم الفخذ ، استخدم حقنة سعة 3 مل مملوءة بوسط TC أو PBS بإبرة 23G. املأ المحقنة قبل تعريض النخاع.
- استخدم المقص لفضح النخاع عن طريق قطع نهاية عظم الفخذ عند كلا المشاشية.
- أدخل طرف الإبرة في عظم الفخذ واغسل النخاع برفق في طبق 10 سم.
- مرر الإبرة على طول عظم الفخذ بالكامل ، واشطفها حتى يتحول لون العظام إلى اللون الأبيض. عادة ، يمكن التخلص من معظم النخاع باستخدام 2-3 مل من الوسائط.
- اغسل جميع عظم الفخذ ونخاع عظم البركة في الطبق. استخدم إبرة لتفتيت أي كتل مرئية. صفي النخاع في أنبوب مخروطي سعة 50 مل (الشكل 1 أ).
4. تحلل كرات الدم الحمراء
- تدوير النخاع عند 190 × جم لمدة 10 دقائق. شفط المادة الطافية.
- أعد تعليق الحبيبات في 4 مل من المخزن المؤقت لتحلل ACK باستخدام ماصة. اسمح للمخزن المؤقت لتحلل كرات الدم الحمراء بالعمل لمدة 5 دقائق في درجة حرارة الغرفة.
- أضف 4 مل من TC متوسط RPMI-C 10٪ (RPMI 1640 -GlutaMAX) مكمل ب 2-mercaptoethanol ، gentamicin ، Streptomycin ، و 10٪ FCS إلى تعليق النخاع وتدور عند 1300 × جم لمدة 10 دقائق.
- يصفى مرة أخرى لإزالة بقايا كرات الدم الحمراء وأعد تعليقه في حجم صغير من RPMI-C 10٪ للعد.
- عد الخلايا باستخدام عداد الخلايا (الشكل 1 ب). تم استخدام عداد الخلايا الفيدية لتحديد عدد الخلايا وقابليتها للبقاء في المعلق.
5. الطلاء والثقافة
- أضف 10 مل من RPMI-C 10٪ + 10 نانوغرام / مل لتر M-CSF (عامل تحفيز مستعمرة البلاعم ، وهو منظم أساسي لتكاثر الخلايا الوحيدة / البلاعم والتمايز والبقاء على قيد الحياة) إلى العديد من الألواح 10 سم حسب الرغبة.
- أضف حجما مناسبا من الخلايا التي تم عدها بحيث تحتوي كل لوحة مقاس 10 سم على 1 × 106 خلايا. ضع الألواح في حاضنة 37 درجة مئوية (تعرف باليوم 0).
- في اليوم 3 ، أضف برفق 5 مل من RPMI-C الطازج 10٪ + 10 نانوغرام / مل M-CSF إلى كل طبق.
ملاحظة: في اليوم 7 ، يجب أن تكون BMDMs جاهزة للاختبار (الشكل 1C).
6. الحصاد من الأطباق
- استخدم مجهرا ضوئيا للتأكد من أن معظم الخلايا قد التزمت بالصفائح.
- استنشق الوسائط بلطف. ثم أضف 3 مل من PBS وقم بتدوير اللوحة برفق. استنشق هذا جيدا لإزالة أي خلايا غير ملتصقة متبقية.
- أضف 7-10 مل من PBS البارد إلى اللوحة ، واستخدم ماصة P1000 لغسل قاع الألواح ، وحصاد جميع الخلايا المتبقية في أنبوب تجميع.
ملاحظة: احتفظ بالأنابيب على الجليد لأن البلاعم ملتصقة بإحكام شديد وستلتصق بداخل الأنبوب. إذا ظلت الخلايا باردة ، فستكون أقل إلتصاقا بإحكام. - أجهزة الطرد المركزي ، العد ، وخلايا الألواح للتجارب (الشكل 1 د). باستخدام قياس التدفق الخلوي ، يجب أن تكون الخلايا الناتجة موجبة بنسبة >95٪ ل CD11b و F4 / 80. (تم تحديد استقطاب البلاعم عن طريق التلوين بعلامات تشبه M1 من CD38 و TNF-a و MCP-1 و M2 من CD206.
ملاحظة: قم بتنفيذ الخطوات 6.1-6.3 في خزانة السلامة الحيوية وقم بتنفيذ الخطوة 6.4 على سطح الطاولة. حافظ على تقنيات التعقيم طوال العملية.
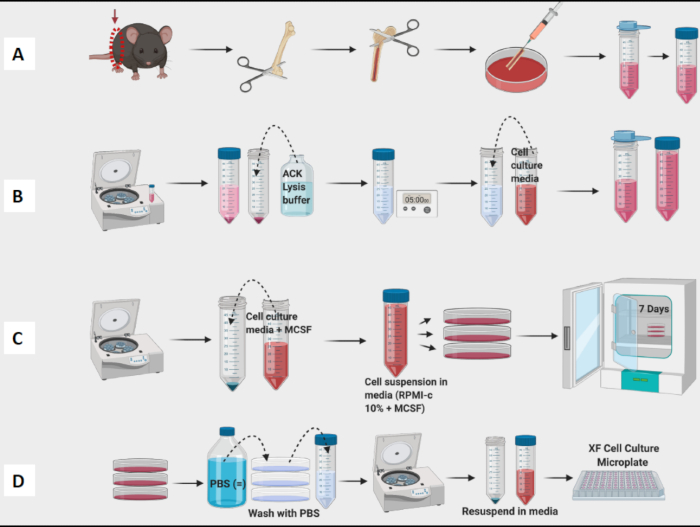
الشكل 1: سير العمل الرسومي لثقافة نخاع عظم الفأر للبلاعم المشتقة من BM. (أ) حصاد الساق ، والتعرض لعظم الفخذ ، وتدفق النخاع ؛ (ب) تحلل كرات الدم الحمراء ؛ (ج) الطلاء والثقافة؛ (د) حصاد الخلايا من اللوحات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
7. في اليوم السابق لمقايسة محلل التدفق الأيضي: بذر واستقطاب الخلايا لاختبار تحلل السكر
- قم بتسخين محلل التدفق الأيضي إلى 37 درجة مئوية عن طريق تشغيل الجهاز.
- قم بترطيب خرطوشة عن طريق إضافة 200 ميكرولتر من محلول Caliberrant واحتضان الخرطوشة في حاضنة غير CO2 طوال الليل (الشكل 2 أ). رطوبة حاضنة غير CO2 ليست مهمة لترطيب الخرطوشة.
- قبل ساعة من التجربة ، قم بغمس اللوحة عدة مرات لأعلى ولأسفل ، مما يساعد على إزالة فقاعات الهواء.
- صمم خريطة اللوحة على البرنامج في اختبار إجهاد تحلل السكر الافتراضي - الحقن الحاد ، باتباع تعليمات الاختبار.
- انقر فوق أيقونة البرنامج ، ثم انقر فوق اختبار الحقن الحاد للإجهاد لتحلل السكر. في أيقونة تعريف المجموعة، قم بإنشاء أسماء المجموعات.
- هناك خمس دورات قياس مدتها 18 دقيقة وأربع حقن. قم بتغيير حقن المنفذ A إلى الجلوكوز ، والمنفذ B إلى Oligomycin ، والمنفذ C إلى Rotenone و antimycin A (Rot / AA) ، والمنفذ D إلى 2DG.
- أعد تعليق الخلايا في RPMI-C 10٪ وسط وبذرة 50 ألف خلية لكل بئر باستثناء الحواف الأربعة للوحة (A1 و A12 و H1 و H12 ؛ أضف الوسائط فقط ، بدون خلايا) في صفيحة دقيقة لمحلل التدفق الأيضي إلى حجم نهائي يبلغ 100 ميكرولتر ، وعادة ما يلزم ما لا يقل عن 40 ألف خلية لإجراء هذا الفحص.
- اسمح للخلايا بالجلوس في درجة حرارة الغرفة لمدة 45 دقيقة لتجنب تأثير حافة الخلايا. يحدث تأثير الحافة عندما يتبخر الوسط من حول محيط اللوحة جزئيا ، مما يتسبب في تغيرات في الحجم والتركيز ويقلل من صلاحية الخلية.
- أضف 10 نانوغرام / مل LPS لاستقطاب البلاعم الساذجة نحو الخلايا الشبيهة ب M1 وأضف 20 نانوغرام / مل من IL-4 لاستعصابها نحو الخلايا الشبيهة ب M2. استخدم ما لا يقل عن 3 إلى 6 آبار لكل حالة (الشكل 2 ب).
- افحص الخلايا الموجودة تحت المجهر وضع اللوحة في حاضنة عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لمدة 24 ساعة.
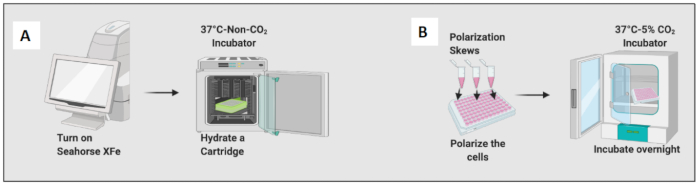
الشكل 2: عرض رسومي للبذر واستقطاب الخلايا. (أ) إعداد محلل التدفق خارج الخلية وترطيب الخرطوشة ؛ (ب) استقطاب الخلايا والحضانة الليلية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
8. يوم الفحص: XF الإعداد المتوسط والمركب
- استكمل 100 مل من وسط فحص XF RPMI (الرقم الهيدروجيني 7.4) مع 2 ملي مولار من الجلوتامين.
- قم بتعقيم الوسائط باستخدام نظام فلتر فراغ 0.2 ميكرومتر.
- ضع وسائط الفحص في حمام مائي بدرجة حرارة 37 درجة مئوية لمدة 20 دقيقة.
- قم بإزالة الخلايا المطلية من حاضنة 37 درجة مئوية ، 5٪ ثاني أكسيد الكربون2 . اغسل الخلايا بوسائط الفحص مرتين واستبدل الوسائط السابقة بوسائط الفحص إلى الحجم النهائي البالغ 180 ميكرولتر.
- استخدم مجهرا للتأكد من أن جميع الآبار تحتوي على خلايا ملتصقة وقم بتمييز أي آبار بها أي خدوش ناتجة عن سحب العينات. إذا كان هناك أي خدوش ، فقم بإزالة تلك اللوحة قبل التحليل.
- ضع اللوحة المحتوية على الخلية في حاضنة غير ثاني أكسيد الكربون2 لمدة 45 دقيقة (الشكل 3 أ).
- استخدام المركبات ووسائط الفحص لصنع محاليل مخزون من الجلوكوز (100 مليمتر) ، أوليغومايسين (100 ميكرومتر) ، روت / AA (50 ميكرومتر) ، و 2DG (500 مليمتر) (الجدول 1).
- اصنع خليط حقن 10x لكل مركب باستخدام وسائط الفحص (الجدول 2).
| مخزون الحقن (متوفر في المجموعات) | إضافة وسائط فحص كاملة (مل) | تركيز المخزون النهائي (ميكرومتر) |
| الجلوكوز | 3 | 100 كيلو |
| أوليغومايسين | 0.72 | 100 |
| 2-DG | 3 | 100 كيلو |
الجدول 1. مخزون الحقن
| المنافذ الموجودة على الخرطوشة | حلول المخزون | إضافة حجم المخزون | إضافة وسائط الفحص | التركيز النهائي للحقن (10x) | إضافة وحدة التخزين هذه إلى المنفذ المعين (ميكرولتر) | التركيز النهائي بعد الحقن في كل بئر |
| A | الجلوكوز (100 مل) | 3000 ميكرولتر + 0 ميكرولتر | 100 ملم | 20 | 10 ملم | |
| B | أوليغومايسين (100 ميكرومتر) | 300 ميكرولتر + 2700 ميكرولتر | 10 ميكرومتر | 22 | 1.0 ميكرومتر | |
| C | روتينون / أنتيمايسين أ (50 ميكرومتر) | 300 ميكرولتر + 2700 ميكرولتر | 5 ميكرومتر | 25 | 0.5 ميكرومتر | |
| D | 2-DG (500 مل) | 300 ميكرولتر + 0 ميكرولتر | 500 ملم | 28 | 50 ملم | |
الجدول 2. تركيزات الحقن النهائية
9. يوم الفحص: إجراء اختبار تحلل السكر الحاد على البلاعم المستقطبة
- افتح قالب مقايسة إجهاد تحلل السكر المحفوظ (الحقن الحاد) من البرنامج. يحتوي اختبار الإجهاد الجليكو الحاد الافتراضي على 3 دقائق من المزج والقياس قبل كل حقنة.
- تحقق من القالب وتفاصيل الفحص ، وعندما تكون جاهزا ، انقر فوق تشغيل واتبع تعليمات الفحص الافتراضي. ومع ذلك ، يمكن تخصيص جميع المعلمات.
- قم بإزالة خرطوشة المستشعر من الحاضنة غير CO2 ، وقم بإزالة الغطاء ، وأدخلها في الجهاز بحيث يقع البئر A1 للوحة الخرطوشة في الزاوية العلوية اليسرى من لوحة الإدخال الخاصة بالماكينة. عادة ، تستغرق المعايرة ما بين 20 إلى 45 دقيقة.
- بعد الانتهاء من المعايرة ، سيقوم الجهاز بإخراج اللوحة التي تحتوي على محلول العيار وسيحمل خرطوشة المستشعر. قم بإزالة المعدن الذي يحتوي على اللوحة.
- قم بإزالة لوحة الخلية من الحاضنة غير المضادة لثاني أكسيد الكربون2 ، وقم بإزالة غطاء اللوحة ، وأدخلها في الجهاز. انقر فوق تشغيل (الشكل 3 ب).
- عند الانتهاء من الفحص ، ستقوم الماكينة بإخراج لوحة الخلية وخرطوشة المستشعر.
- قم بإزالة الوسائط من اللوحة وقم بتجميدها عند -20 درجة مئوية لمزيد من التطبيع.
- استخدم مجموعة مقايسة تكاثر الخلايا التجارية (على سبيل المثال ، CyQUANT) لتطبيع الخلايا.
- أضف 1 مل من المركب B أو المخزن المؤقت للتحلل إلى 19 مل من الماء المقطر الخالي من النوكلياز.
- أضف 100 ميكرولتر من محلول عمل المركب A أو GR إلى الحل المذكور أعلاه.
- تأكد من إذابة الخلايا الموجودة في اللوحة ثم أضف 200 ميكرولتر من المحلول إلى كل بئر.
- احتضن لمدة 5 دقائق في درجة حرارة الغرفة (RT).
- قم بقياس التألق في أطوال موجية انبعاث 480 نانومتر و 520 نانومتر باستخدام قارئ لوحة.
- تطبيع الخلايا الموجودة على لوحة التسوية الخاصة بالبرنامج.
- تطبيع الخلايا بناء على عدد خلايا الضامة الساذجة (الشكل 3 ج). ضع في اعتبارك متوسط البلاعم الساذجة على أنه 1 (بقسمة رقم خلية كل بئر على متوسط عدد خلايا الضامة الساذجة) وقم بتطبيقها على جميع البلاعم.
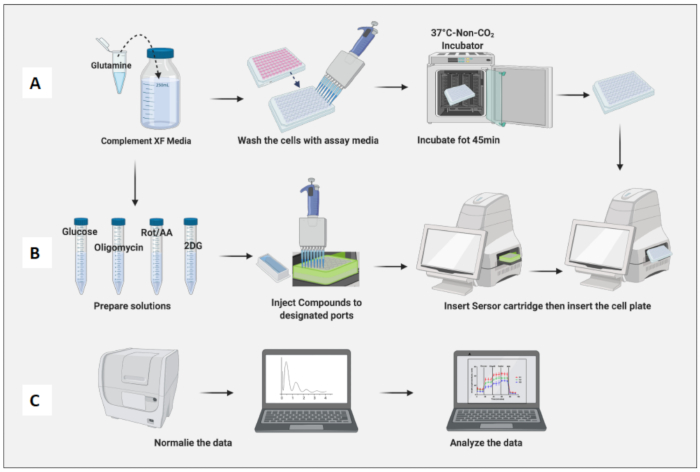
الشكل 3: يوم الفحص: التحضير المتوسط والمركب وتشغيل المقايسة. (أ) تحضير الخلايا للفحص. (ب) تحضير المركبات ومعايرتها وتشغيلها ؛ (ج) التطبيع وتحليل البيانات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
النتائج
تحلل السكر والفسفرة المؤكسدة للميتوكوندريا هما المساران الرئيسيان لإنتاج ATP في الخلايا (الشكل 4 أ). بعض الخلايا لديها القدرة على التبديل بين هذين المسارين لتلبية متطلباتها من الطاقة. يسمى تحويل الجلوكوز إلى بيروفات في السيتوبلازم تحلل ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
كما ذكرنا سابقا ، يمكن لآلة تحليل التدفق خارج الخلية توفير معلومات في الوقت الفعلي حول مسارين رئيسيين لإنتاج الطاقة للخلايا عن طريق قياس OCR (معدل استهلاك الأكسجين) ، ومؤشر لنشاط OXPHOS في الميتوكوندريا ، و ECAR (معدل التحمض خارج الخلية) وهو مؤشر على تحلل السكر. يمكن للبلاعم است...
Access restricted. Please log in or start a trial to view this content.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
نشكر السيدة جوانا روشا على المساعدة التحريرية. تم دعم العمل جزئيا من قبل المعاهد الوطنية للصحة (NIH) R01DK118334 (إلى الدكتورين صن وألانيز) و (المعاهد الوطنية للصحة) R01A11064Z (إلى الدكتورين جايارامان وألانيز).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 23G needles | VWR | BD305145 | |
| 2-mercaptoethanol | Life Technologies | 21985023 | |
| 50ml Conical Tube | VWR | 21008-951 | |
| ACK lysis buffer | Thermo Fisher Scientific | A1049201 | It can be lab-made |
| Agilent Seahorse XF glycolysis stress test kit | Agilent Technologies | 103020-100 | |
| Agilent Seahorse XF Glycolysis Stress Test Kit User Guide | Agilent Technologies | 103020-400 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit User Guide | Agilent Technologies | 103344-100 | |
| Alexa Fluor 488 anti-mouse CD206 (MMR) Antibody | BioLegend | 141710 | |
| anti-mouse CD11b eFluor450 100ug | eBioscience | 48-0112-82 | |
| BD 3ML - SYRINGE | VWR | BD309657 | Other syringes are acceptable too |
| Cell counter-Vi-CELL- XR Complete System | BECKMAN COULTER Life Sciences | 731050 | Cells can be manually counted too |
| Cell Strainer-70µm | VWR | 10199-656 | |
| CyQUANT Cell Proliferation Assay Kit | Thermo Fisher Scientific | C7026 | |
| F4/80 monoclonal antibody (BM8) pe-Cyanine7 | eBioscience | 25-4801-82 | |
| Fetal Bovine Serum | Life Technologies | 16000-044 | |
| Flow cytometer: BD LSFRFortessa X-20 | BD | 656385 | |
| Kim Wipes | VWR | 82003-822 | |
| LPS-SM ultrapure (tlrl-smpls) 5 mg | Invivogen | tlrl-smlps | |
| MCSF | Peprotech | 315-02 | |
| Murine IL-4 | Peprotech | 214-14 | |
| PE Rat Anti-Mouse CD38 | BD Biosciences | 553764 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Petri Dish 100mm x 15 mm | Fisher Scientific | F80875712 | |
| RPMI, Glutamax, HEPES | Invitrogen | 72400-120 | |
| Seahorse Calibrant Solution | Agilent Technologies | 103059-000 | |
| Seahorse XF 200mM Glutamine Solution | Agilent Technologies | 103579-100 | |
| Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Seahorse XFe96 FluxPaks | Agilent Technologies | 102416-100 | |
| XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| XF RPMI Medium, pH 7.4 without phenol Red | Agilent Technologies | 103336-100 |
References
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Disease Models & Mechanisms. 13 (1), (2020).
- Martinez-Pomares, L., Gordon, S. The Autoimmune Diseases. , Elsevier. 191-212 (2020).
- Orecchioni, M., Ghosheh, Y., Pramod, A. B., Ley, K. Macrophage polarization: different gene signatures in M1 (LPS+) vs. classically and M2- (LPS–) vs. alternatively activated macrophages. Frontiers in immunology. 10, 1084(2019).
- Barrett, T. J. Macrophages in atherosclerosis regression. Arteriosclerosis, Thrombosis, and Vascular Biology. 40 (1), 20-33 (2020).
- Ni, Y., et al. Adipose tissue macrophage phenotypes and characteristics: the key to insulin resistance in obesity and metabolic disorders. Obesity. 28 (2), 225-234 (2020).
- Chu, C., et al. Modulation of foreign body reaction and macrophage phenotypes concerning microenvironment. Journal of Biomedical Materials Research Part A. 108 (1), 127-135 (2020).
- Batista-Gonzalez, A., Vidal, R., Criollo, A., Carreño, L. J. New insights on the role of lipid metabolism in the metabolic reprogramming of macrophages. Frontiers in Immunology. 10, 2993(2020).
- Kang, S., Kumanogoh, A. The spectrum of macrophage activation by immunometabolism. International Immunology. , (2020).
- Shi, Y., et al. M1 But Not M0 Extracellular Vesicles Induce Polarization of RAW264. 7 Macrophages Via the TLR4-NFκB Pathway In Vitro. Inflammation. , 1-9 (2020).
- Zhang, L., Li, S. Lactic acid promotes macrophage polarization through MCT-HIF1α signaling in gastric cancer. Experimental Cell Research. 388 (2), 111846(2020).
- Geng, T., et al. CD137 signaling induces macrophage M2 polarization in atherosclerosis through STAT6/PPARδ pathway. Cellular Signalling. , 109628(2020).
- Liu, Q., et al. Combined blockade of TGf-β1 and GM-CSF improves chemotherapeutic effects for pancreatic cancer by modulating tumor microenvironment. Cancer Immunology & Immunotherapy. , 1-16 (2020).
- Rigoni, T. S., et al. RANK Ligand Helps Immunity to Leishmania major by Skewing M2 Into M1 Macrophages. Frontiers in Immunology. 11, 886(2020).
- Viola, A., Munari, F., Sánchez-Rodríguez, R., Scolaro, T., Castegna, A. The metabolic signature of macrophage responses. Frontiers in Immunology. 10, (2019).
- Ivashkiv, L. B. The hypoxia–lactate axis tempers inflammation. Nature Reviews Immunology. 20 (2), 85-86 (2020).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424(2015).
- Van den Bossche, J., et al. Mitochondrial dysfunction prevents repolarization of inflammatory macrophages. Cell reports. 17 (3), 684-696 (2016).
- Liu, P. S., Ho, P. C. Metabolic Signaling. , Springer. 173-186 (2019).
- Wang, F., et al. Glycolytic stimulation is not a requirement for M2 macrophage differentiation. Cell metabolism. 28 (3), 463-475 (2018).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. Quantifying Cellular ATP Production Rate Using Agilent Seahorse XF Technology. , Agilent Technologies, Inc. (2018).
- Mookerjee, S. A., Brand, M. D. Measurement and analysis of extracellular acid production to determine glycolytic rate. Journal of Visualized Experiments. (106), e53464(2015).
- Mookerjee, S. A., Goncalves, R. L., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochimica Et Biophysica Acta-Bioenergetics. 1847 (2), 171-181 (2015).
- Yang, S., et al. Macrophage polarization in atherosclerosis. Clinica Chimica Acta. 501, 142-146 (2020).
- Hörhold, F., et al. Reprogramming of macrophages employing gene regulatory and metabolic network models. PLoS Computational Biology. 16 (2), e1007657(2020).
- Han, X., Ma, W., Zhu, Y., Sun, X., Liu, N. Advanced glycation end products enhance macrophage polarization to the M1 phenotype via the HIF-1α/PDK4 pathway. Molecular and Cellular Endocrinology. , 110878(2020).
- Müller, E., et al. Toll-like receptor ligands and interferon-γ synergize for induction of antitumor M1 macrophages. Frontiers in Immunology. 8, 1383(2017).
- Soto-Heredero, G., Gómez de las Heras, M. M., Gabandé-Rodríguez, E., Oller, J., Mittelbrunn, M. Glycolysis–a key player in the inflammatory response. The FEBS Journal. , (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved