Method Article
التبلور والتصميم الهيكلي للانزيم: مجمع الركيزة بواسطة البلورات التسلسلية في رقاقة Microfluidic متعددة الاستخدامات
In This Article
Summary
يوصف جهاز microfluidic متعدد الاستخدامات الذي يمكّن من تبلور إنزيم باستخدام طريقة الانتشار المضاد ، وإدخال الركيزة في البلورات عن طريق النقع ، وتحديد الهيكل ثلاثي الأبعاد للأنزيم: مجمع الركيزة من خلال تحليل متسلسل للبلورات داخل الشريحة في درجة حرارة الغرفة.
Abstract
إعداد بلورات التألق جيدا والتعامل معها قبل تحليل الأشعة السينية خطوتين حاسمة من الدراسات البيولوجية الاكريكرولوجية. نحن نصف رقاقة microfluidic تنوعا التي تمكن من إنتاج بلورات عن طريق طريقة فعالة لمكافحة نشر. البيئة الخالية من الحمل الحراري التي توفرها القنوات microfluidic مثالية لنمو الكريستال ومفيدة لنشر الركيزة في الموقع النشط للأنزيم البلورية. هنا طبقنا هذا النهج على إنزيم CCA-إضافة من البكتيريا النفسية Planococcus halocryophilus في المثال المقدم. بعد التبلور ونشر الركيزة / نقع، تم تحديد هيكل الكريستال من الانزيم:الركيزة مجمع في درجة حرارة الغرفة عن طريق البلورات التسلسلي وتحليل بلورات متعددة مباشرة داخل رقاقة. يحافظ الإجراء بأكمله على خصائص الحيود الأصلية للعينات لأنه لا يتطلب معالجة بلورية.
Introduction
البلورات هو وسيلة لفك العمارة 3D من الجزيئات الحيوية البيولوجية. هذا الأخير مهم لفهم كيفية اختيار الانزيم ومعالجته ركائزه. يتطلب تحديد بنية بلورية تبلور الجزيئات المستهدفة وتكييف البلورات لتحليلها بواسطة الحيود بالأشعة السينية1. كل من إعداد البلورات والتعامل معها هي خطوات حاسمة ولكن حساسة التي يمكن أن تؤثر على خصائص الجودة والنقود الكريستال، وبالتالي، دقة (أي دقة) من هيكل 3D الناتجة. لتسهيل إعداد بلورات عالية الجودة والقضاء على التعامل غير الضروري للحفاظ على خصائصها الحيود ، قمنا بتصميم جهاز microfluidic سهل الاستخدام ومتعدد الاستخدامات يسمى ChipX2،3،4.
في هذه المقالة، سوف نبين كيفية تحميل محلول البروتين في قنوات ChipX باستخدام المواد المختبرية التقليدية لإعداد البلورات عن طريق مكافحة الانتشار. يوفر أسلوب التبلور هذا فحصًا فعالًا للتشبع الزائد وظروف النوى المحتملة على طول القنوات الدقيقة التي تحتوي على محلول الإنزيم بسبب تدرج التركيز الناتج عن انتشار عامل التبلور5،6.
إعداد رقاقة بسيطة، ويستخدم الأنابيب المختبر القياسية فقط ولا يتطلب أي معدات مكلفة. عندما نمت بلورات في ChipX، يمكن إدخال يغاندس من الانزيم عن طريق الانتشار. ثم يتم جمع بيانات الحيود في درجة حرارة الغرفة على سلسلة من البلورات الموجودة في قنوات الشريحة باستخدام مصدر الأشعة السينية السنكروترون. أدت الدراسة الهيكلية الموصوفة هنا إلى تحديد هياكل إنزيم نضوج الـ TRNA في شكله apo وفي التعقيد مع تناظرية لركيزة CTP التي أدخلتها القعقعة. هذا البروتين يسمى CCA إضافة انزيم البلمرة CCA ثلاثي النوكليوتيد الذيل في نهاية 3 'من tRNAs. المقارنة بين الصورتين ثلاثية الأبعاد التي تم الحصول عليها بواسطة البلورات التسلسلية تكشف عن التغيرات التشكلية المحلية المتعلقة بربط الرباط في الظروف التي هي أكثر فسيولوجية من تلك المستخدمة في البلورات الجليدية. البروتوكول الموصوف في هذا الفيديو ينطبق بشكل عام على أي جزيء حيوي ، أي بروتين أو حمض نووي أو مركب متعدد المكونات.
Protocol
1. إعداد تبلور المقايسات في ChipX
ملاحظة: يمكن الحصول على جهاز ChipX microfluidic من المؤلفين. يتم إعطاء وصف للرقاقة في الشكل 1. الحلول التي تحتوي على البلورة (أو عامل التبلور) المستخدمة في تحريك التبلور قد تكون ذات منشأ تجاري أو من إعداد المجرب.
- تحميل عينة الجزيئات الحيوية
ملاحظة: حجم العينة المطلوبة بالفعل لإجراء فحص مضادة للنشر الفردية في المقطع المستقيم لكل قناة من ChipX هو 300 nL. ولكن من أجل الراحة نقترح تحميل 5 ميكرولتر لملء تماما القنوات الثمانية مع الأخذ في الاعتبار طول متغير من قسم المنحني والأحجام مدخل الميت.- Pipet 5 ميكرولتر من حلول الإنزيم باستخدام 10 ميكرولتر الأنابيب القياسية وتلميح.
- تقديم تلميح عموديا في مدخل العينة وحقن الحل حتى تمتلئ القنوات الثماني حتى نهاية عكسها (دخول خزان crystallant).
- حقن 1 ميكرولتر من زيت البارافين في مدخل العينة من أجل فصل القنوات عن بعضها البعض.
- استعادة حل إضافي في خزان crystallant في أقصى كل قناة باستخدام أنبوب 10 ميكرولتر القياسية.
- ختم مدخل العينة مع قطعة 1 سم × 1 سم من الشريط.
- تحميل حلول التبلور
- Pipet 5 ميكرولتر من محلول التبلور باستخدام 10 ميكرولتر الأنابيب القياسية وتلميح. يبلغ حجم الخزان 10 ميكرولتر، ولكن تحميل نصفه فقط يتجنب تجاوز التجاوز عند الختم بشريط ويسهل إضافة المزيد من ليغاند لإجراء تجارب النقع. إذا تم الحصول على ظروف التبلور الأولية عن طريق نشر البخار ، وزيادة تركيز crystallant بمعامل 1.5 - 2. حلول يمكن أن تكون مختلفة في كل خزان (في القضية المعروضة، 1 M ديامونيوم الهيدروجين الفوسفات، 100 mM خلات الصوديوم، تم استخدام 4.5 pH في جميع أنحاء).
- توجيه تلميح الأنابيب نحو دخول القناة في قمع شكل جزء من الخزان لتجنب تشكيل فقاعة الهواء عند ترسب الحل. هو منع الاتصال بين الاثنان حل وانتشار في القناة.
- حقن حل crystallant في الخزان.
- ختم الخزانات مع 2.5 سم × 1 سم قطعة من الشريط.
- احتضان رقاقة في 20 درجة مئوية (يمكن تعديل درجة الحرارة تبعا للهدف، وعادة بين 4 و 37 درجة مئوية 4).
2. وضع العلامات البروتين مع كاربوإكسيرهودامين للكشف عن الفلوريسنس
ملاحظة: هذه الخطوة اختيارية. يجب أن يتم ذلك قبل تحميل العينة لتسهيل الكشف عن البلورات في رقاقة باستخدام الفلوريسنس. وقد وصفت طريقة مفصلة من الملصقات الفلورية تتبع بوسي وزملاء العمل7. يتم تنفيذ جميع الخطوات في درجة حرارة الغرفة.
- حل 5 ملغ من مسحوق استر كاربوإكسيرهودامين في 1 مل لامائية- ديتيل-فورنامميد، وتقسيم الحل في 0.6 ميكرولتر aliquots ليتم تخزينها في -20 درجة مئوية.
- إعداد 1 M Na-borate حُكم 8.75 الأسهم الحل.
- تخفيف المخزون لإعداد العازلة رد فعل في 0.05 M نا بورات درجة حُك 8.75.
- شطف عمود إزالة التشبع (7 كيلو ادا MWCO، 0.5 مل) مع 800 ميكرولتر من العازلة رد فعل.
- الطرد المركزي العمود لمدة 1 دقيقة في 1400 س ز، وإزالة filtrate.
- كرر هذه العملية مرتين (الخطوات 2.4-2.5) لغسل العمود.
- إيداع 80 ميكرولتر من البروتين في المخزن المؤقت على العمود (يمكن تخفيف البروتين وصولا الى 1 ملغ / مل لزيادة حجم إذا لزم الأمر).
- جهاز طرد مركزي العمود لمدة 1 دقيقة في 1400 x ز. تهدف هذه الخطوة إلى نقل البروتين من المخزن المؤقت إلى المخزن المؤقت للتفاعل.
- استعادة تدفق من خلال (التي تحتوي على البروتين في العازلة رد فعل) ومزجها مع 0.6 ميكرولتر من حل كاربوإكسيرودامين.
- احتضان 5 دقائق في درجة حرارة الغرفة.
- وفي الوقت نفسه، شطف العمود 3 x مع المخزن العازلة، والطرد المركزي العمود لمدة 1 دقيقة في 1400 × ز وتجاهل الترشيح.
- إيداع حل رد الفعل على العمود.
- الطرد المركزي العمود لمدة 1 دقيقة في 1400 س ز واستعادة تدفق من خلال (أي، حل من البروتين المسمى في المخزن المؤقت لها).
- تكملة محلول البروتين الأسهم مع 0.1-1 ٪ (ث / ث) من البروتين المسمى.
- إعداد تبلور ChipX مقايسات كما هو موضح في القسم 1.
- تحقق من وجود بلورات البروتين في المقايسات عن طريق مثيرة التحقيق الفلورسنت مع مصدر ضوء الطول الموجي 520 نانومتر.
3- مراقبة الكريستال
ملاحظة: يمكن معالجة جهاز ChipX دون عناية خاصة، حتى مع وجود بلورات في الداخل، إلا إذا كانت درجة الحرارة تحتاج إلى التحكم فيها.
- استخدم أي منظار مجسم للتأكد من نتائج مقايسات التبلور في ChipX. بصمة لها أبعاد قياسية من شرائح المجهر ومتوافقة مع أي نظام وحامل الشريحة.
- تحقق من محتوى القنوات الدقيقة التي تبدأ من الخزان حيث تركيز crystallant هو الأعلى إلى مدخل العينة حيث التركيز crystallant هو أدنى. المادة ChipX شفافة للضوء المرئي، متوافق مع استخدام المستقطبات، وكذلك مع الإضاءة للأشعة فوق البنفسجية لتحديد الكريستال البروتين من قبل الفلورس8التربتوفان الجوهرية .
- تسجيل مواقع الكريستال باستخدام التسميات تنقش على طول القنوات أو وضع علامة مواقع الكريستال مع علامة دائمة عن طريق رسم نقاط اللون بجانبها على سطح رقاقة.
4. كريستال نقع مع يغاندس
ملاحظة: هذا الإجراء اختياري. يتم استخدامه لإدخال الركائز، ركائز انزيم أو ذرات ثقيلة في بلورات وينبغي أن تنفذ على الأقل 24-48 ساعة قبل تحليل الأشعة السينية للسماح لانتشار المركب على طول القنوات وإلى البلورات.
- قم بإزالة شريط الختم بلطف من الخزانات.
- إضافة ما يصل إلى 5 ميكرولتر من حل ليجوند في واحد أو عدة خزانات باستخدام 10 ميكروبيت ميكروبيت μl (في المثال، 3 ميكرولتر من 10 mM cytidine-5'-[(α,β)-ميثيلينو] تم إضافة حل ثلاثي الفوسفات (CMPcPP) لتحقيق تركيز نهائي من 3.75 mM). CMPcPP هو التناظرية غير المائية من CTP، الركيزة الطبيعية للانزيم.
- ختم الخزانات مع 2.5 سم × 1 سم قطعة من الشريط.
- احتضان رقاقة تحت درجة حرارة تسيطر عليها لمدة 24-48 ساعة للسماح نشر ليغاند على طول قنوات الشريحة.
5. الكريستال التحليل عن طريق البلورات التسلسلي
ملاحظة: يجب أن يتم تكييف هذا الجزء من البروتوكول بناءً على إعداد خط الشعاع وخصائص الانعراج للبلورات. ولا تعطى سوى مؤشرات عامة للتحليل البلوري استنادا إلى التجارب التي أجريت في خط شعاع X06DA (SLS، Villigen، سويسرا).
- ChipX تصاعد على goniometer خط شعاع
ملاحظة: يتم توفير الملف للطباعة ثلاثية الأبعاد حامل ChipX في المرجع4.- إيقاف تشغيل طائرة التبريد من خط شعاع. يتم إجراء التحليل هنا في درجة حرارة الغرفة.
- جبل ChipX على حامل مخصص مع قناة تحتوي على بلورات ليتم تحليلها في مركز الحامل. لا يتطلب حامل ChipX4 أي برغي أو جزء إضافي ، لأنه تم تصميمه لتوفير تناسب مثالي لـ ChipX.
- إرفاق حامل إلى goniometer.
- جمع البيانات
- توجيه طبقة سميكة (الطبقة العليا، الشكل 1)من ChipX (في هذه التسميات التوجه على طول القنوات هي مباشرة للقراءة باستخدام الكاميرا توسيط من شعاع)، نحو شعاع المباشر والوجه أنحف وراء الكريستال لتقليل التوهين من إشارة diffracted كما هو موضح في المرجع3.
- لتجنب اصطدام ChipX مع المواد المحيطة (شعاع، coll)، تقييد حركات الغدد الغدد الغدد العصبية في نطاق ±30 درجة (0° المقابلة للقنوات يجري عمودي على شعاع الأشعة السينية).
- العثور على بلورات الموقف مع مساعدة من التسميات تنقش على طول القنوات.
- حدد موضع الكريستال.
- مركز الكريستال إما عن طريق معيار الشبكة جرعة منخفضة / فحص النقطية أو إجراء بنقرة واحدة (الفيديو يظهر مثالا على فحص الشبكة).
- جمع بيانات الحيود داخل نطاق -30 ° / +30 درجة.
- إعادة تشغيل الإجراء في الخطوات 5.2.4-5.2.6 على بلورة أخرى في نفس القناة بعد ترجمة الشريحة.
- يدوياً إعادة تنظيم قناة ChipX أخرى في مركز حاملها والاستمرار في جمع البيانات على بلورات موجودة في هذه القناة.
- استخدام حزم البلورية القياسية والإجراءات لمعالجة ودمج البيانات، ثم حل وتحسين الهيكل.
النتائج
تم تصميم رقاقة microfluidic الموصوفة هنا لتمكين الإعداد السهل من مقايسات التبلور والتحليل البلوري في درجة حرارة الغرفة. تم تطبيق الإجراء الموصوف أعلاه وفي الفيديو في إطار التوصيف الهيكلي للإنزيمات التي تضيف CCA من البكتيريا المتكيفة مع البكتيريا Planococcus halocryophilus. ينتمي هذا الإنزيم إلى عائلة البوليميراز الأساسية التي تحفز الإضافة المتسلسلة لتسلسل CCA 3 على tRNAs باستخدام CTP و ATP9،10.
تم استخدام الشريحة لأول مرة لإعداد بلورات الإنزيم للتحليل الهيكلي من خلال طريقة الانتشار المضاد. وتحقيقا لهذه الغاية، تم تحميل محلول الإنزيم في القنوات الثمانية microfluidic (غرف التبلور) عن طريق حقنة واحدة في مدخل العينة من رقاقة (انظر الشكل 1). وقد استخدم الانزيم في 5.5 ملغ / مل في المخزن المؤقت يحتوي على 20 mM تريس / HCl 7.5، 200 mM NaCl و 5 mM MgCl2. وقد تم تنفيذ هذه الخطوة يدويا مع معيار 10 ميكروبيت μl. ثم أودعت حلول التبلور (100 mM خلات الصوديوم pH 4.5،1 M ديامونيوم فوسفات الهيدروجين) في الخزانات في الطرف الآخر من القنوات.
الإجراء التحميل هو واضح ولا يستغرق أكثر من خمس دقائق(الشكل 2). ثم ينتشر crystallant في القنوات، ويخلق تدرج التركيز الذي يؤدي نوات الكريستال والنمو. يتطور هذا التدرج بشكل ديناميكي ويستكشف سلسلة متصلة من الدول التشبع الفائق5،6 حتى تصل إلى توازن تركيز crystallant بين القنوات والخزان. وعادة ما يتم فحص الفحوصات البلورية تحت المنظار على مدى فترة 2 -4 أسابيع لتتبع نمو البلورات. ظهرت بلورات Bipyramidal من إنزيم CCA-إضافة في جميع أنحاء القنوات بعد بضعة أيام من الحضانة في 20 درجة مئوية(الشكل 3). اختياري الفلورسنت وضع العلامات7 من البروتين يسهل كثيرا تحديد بلورات البروتين والتمييز ضدهم من بلورات الملح (الشكل 4).
لقد استغللنا البيئة المنتشرة في قنوات الرقائق لتقديم الركيزة إلى الإنزيم الذي يبني البلورات. وفي هذه الحالة، تمت إضافة CMPcPP، وهو تناظري من CTP، إلى حلول الخزانات بتركيز نهائي قدره 3.75 mM(الشكل 5). تم إجراء هذه الإضافة قبل يومين من التحليل البلوري للسماح لـ CMPcPP بالوصول إلى موقع الحفز والإنزيم ، كما أكد في وقت لاحق من قبل البنية البلورية (انظر أدناه).
نحن تصنيع حامل رقاقة (الشكل 6) في حمض polylactic باستخدام طابعة 3D. يتيح الحامل تركيب الشريحة على الـ goniometer باستخدام رؤوس مغناطيسية قياسية. وبالتالي يمكن وضع رقاقة بسهولة وترجمتها في شعاع الأشعة السينية لجلب البلورات في موقف الحيود. وينبغي تكييف استراتيجية جمع البيانات تبعاً لخصائص خط الشعاع وخصائص الكريستال. وفي حالة الإنزيم الذي يضيف CCA، تم جمع البيانات في خطوط الشعاع X06DA وX10SA، ومصدر الضوء السويسري (SLS)، مع طول موجي للأشعة السينية يبلغ 1.0 و بيلاتوس 2M-F و 6M كاشفات بكسل، على التوالي. تم جمع 30-60 درجة من الدوران على كل بلورة في درجة حرارة الغرفة مع صور من 0.1 درجة أو 0.2 درجة و 0.1 s التعرض (انظر الجدول 1). تمت معالجة مجموعات البيانات الجزئية بشكل فردي وتم قطعها عندما بدأت دقة أنماط الانعراج في التحلل بسبب تلف الإشعاع (تم اكتشافها من خلال انخفاض نسبة الإشارة إلى الضوضاء 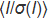 و CC1/2، وزيادة في R meas في القشرة عالية الدقة). وقد أعيد تشكيل مجموعات البيانات الكاملة عن طريق دمج البيانات من 5 بلورات(الجدول 1). تم اشتقاق الهياكل الكريستالية عن طريق الاستبدال الجزيئي باستخدام حزم crystallographic القياسية والإجراءات اللازمة لتجهيز البيانات11 و12. المقارنة بين هياكل الإنزيم ومركبته مع CMPcPP يكشف عن التكيف التشكل المحلية التي ترافق الربط الركيزة في الموقع النشط للانزيم CCA إضافة (الشكل 7).
و CC1/2، وزيادة في R meas في القشرة عالية الدقة). وقد أعيد تشكيل مجموعات البيانات الكاملة عن طريق دمج البيانات من 5 بلورات(الجدول 1). تم اشتقاق الهياكل الكريستالية عن طريق الاستبدال الجزيئي باستخدام حزم crystallographic القياسية والإجراءات اللازمة لتجهيز البيانات11 و12. المقارنة بين هياكل الإنزيم ومركبته مع CMPcPP يكشف عن التكيف التشكل المحلية التي ترافق الربط الركيزة في الموقع النشط للانزيم CCA إضافة (الشكل 7).
الشكل 1: تصميم ChipX. رقاقة يتكون من طبقة أعلى مصنوعة من COC (سمك: 1 مم) التي يتم فيها طبع ثماني قنوات microfluidic والخزانات. يتم إغلاق الشريحة بأكملها مع طبقة من COC (سمك: 0.1 ملم). وترتبط جميع القنوات بمدخل واحد على الجانب الأيسر لحقن العينة في وقت واحد وإلى الخزانات الفردية على الجانب الأيمن التي يتم فيها إيداع حلول التبلور. القنوات، التي تشكل غرف التبلور الفعلي للرقاقة، هي 4 سم طويلة ولها مقطع عرضي من 80 ميكرومتر × 80 ميكرومتر. ChipX لديه حجم شريحة المجهر القياسية (7.5 سم × 2.5 سم). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
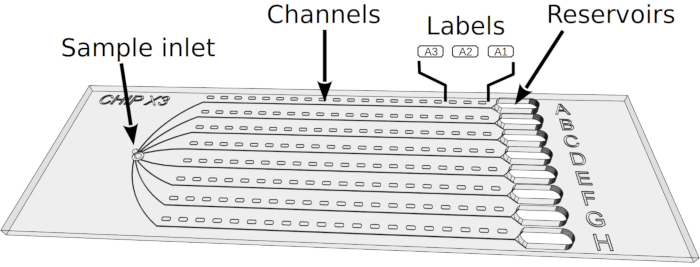
الشكل 2: إعداد تبلور في 1 ChipX. 1) إيداع 5-6 ميكرولتر من حلول انزيم باستخدام معيار 10 ميكرولتر الأنابيب وتلميح. 2) تقديم تلميح عموديا في مدخل العينة وحقن الحل في القنوات الثمانية. 3) Pipet 1 ميكرولتر من زيت البارافين. 4) تقديم تلميح عموديا في مدخل العينة وحقن النفط من أجل فصل القنوات عن بعضها البعض. 5) ختم مدخل مع قطعة من الشريط. 6) Pipet 5 ميكرولتر من حل التبلور باستخدام معيار 10 ميكرولتر الأنابيب وتلميح. يمكن أن تكون الحلول مختلفة في كل خزان (على سبيل المثال، من مجموعة فحص). 7) توجيه تلميح الأنابيب نحو دخول القناة في قمع على شكل جزء من الخزان (لتجنب تشكيل فقاعة الهواء على ترسب الحل) وحقن حل crystallant في الخزان. 8) ختم الخزانات مع قطعة من الشريط واحتضان رقاقة في درجة حرارة تسيطر عليها. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: بلورات من CCA إضافة انزيم نمت عن طريق مكافحة الانتشار في قنوات microfluidic من ChipX. شريط مقياس هو 0.1 ملم.
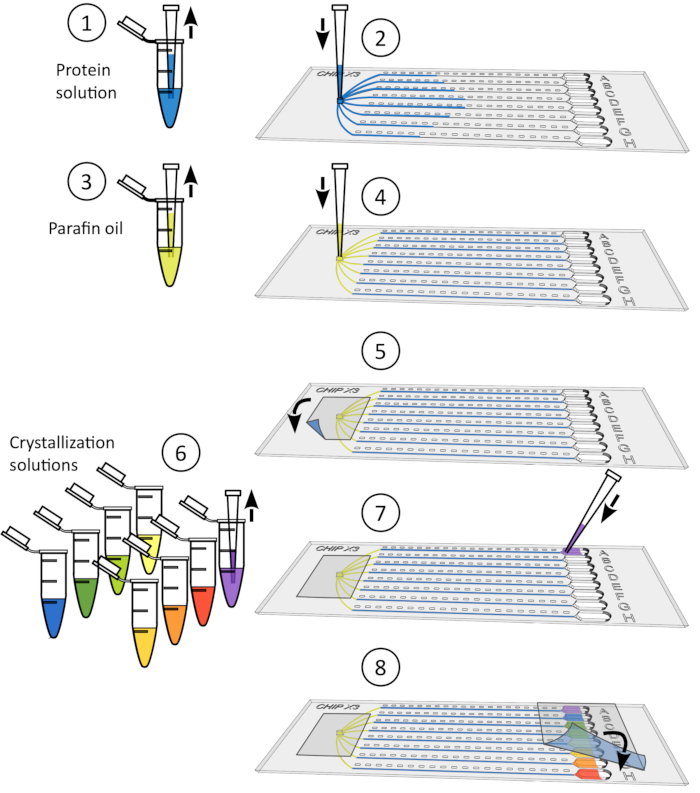
الشكل 4: إجراء البلورة. 1) إزالة الشريط بلطف من الخزانات. 2) إيداع ما يصل إلى 5 ميكرولتر من حل ligand باستخدام 10 ميكروبيت μl. 3) إضافة ليغاند إلى واحد أو عدة خزانات. 4) ختم مرة أخرى الخزانات مع قطعة من الشريط واحتضان رقاقة تحت درجة حرارة تسيطر عليها لمدة 24-48 ساعة قبل جمع البيانات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تتبع الفلورسنت وسم يميز البروتين (يسار) من الملح (يمين) بلورات. يحتوي محلول الإنزيم CCA-إضافة 0.4 ٪ (ث / ث) من البروتين المسمى مع كاربوإكسيرودامين. على اليمين، يتم إضاءة البلورات بمصدر ضوء طول موجي يبلغ 520 نانومتر ويتم التقاط الصورة مع فلتر تمرير منخفض عند 550 نانومتر (LP550); (inset) هيكل كاربوإكسيرهودامين-succinimidyl استر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: (يسار) رسم حامل ChipX و (يمين) ChipX التي شنت على goniometer من خط شعاع X06DA في SLS (Villigen، سويسرا) لتحليل البلورة المسلسل.
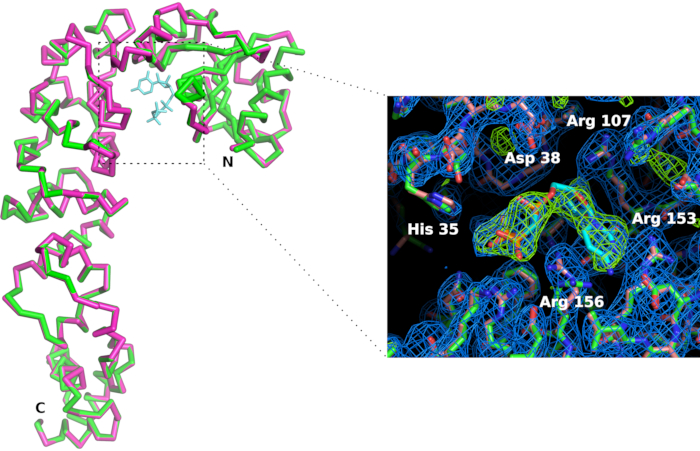
الشكل 7: مقارنة بينCCA-إضافة إنزيم بالموقع في شكل apo (في الوردي) وفي المجمع مع CTP التناظرية (باللون الأخضر). على الرغم من أن التشكل العام للأنزيم لا يتأثر ، فإن ربط ليغاند CMPcPP يصاحبه إعادة تنظيم طفيفة للسلاسل الجانبية في الموقع النشط. خريطة كثافة الإلكترون 2Fo-Fc (باللون الأزرق) هي مخطط 1.2 sigma. يؤكد الاختلاف الإلكترون كثافة خريطة في 4 سيغما (باللون الأخضر) وجود ليغاند في الموقع النشط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| عينة متبلورة | إنزيم CCA-إضافة | إنزيم CCA- إضافة + CMPcPP |
| تحليل الكريستال | ||
| خط شعاع الأشعة السينية | SLS – X06DA | SLS – X10SA |
| الطول الموجي (Å) | 1.000 | 1.000 |
| درجة الحرارة (K) | 293 | 293 |
| كاشف | بيلاتوس 2M-F | بيلاتوس 6M |
| الكريستال للكشف عن بعد (مم) | 300 | 400 |
| بلورات جمعت | 6 | 14 |
| بلورات مختارة | 5 | 5 |
| نطاق الدوران لكل صورة (°) | 0.1 | 0.2 |
| وقت التعرض لكل صورة (ق) | 0.1 | 0.1 |
| لا. من الصور المحددة | 1000 | 540 |
| مجموع نطاق التناوب (°) | 100 | 108 |
| مجموعة الفضاء | P43212 | P43212 |
| أ، ج (Å) | 71.5, 293.8 | 71.4, 293.6 |
| متوسط الفسيفساء (°) | 0.04 | 0.04 |
| نطاق القرار (Å) | 46 – 2.54 (2.6 – 2.54) | 48 – 2.3 (2.4 – 2.3) |
| العدد الإجمالي من انعكاسات | 176105 (9374) | 232642 (32937) |
| لا. من انعكاسات فريدة من نوعها | 23922 (1598) | 34862 (4066) |
| اكتمال (٪) | 90.6 (84.6) | 99.5 (100.0) |
| التكرار | 7.5 (6.0) | 6.7 (8.1) |
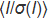 | 8.1 (1.3) | 6.9 (0.7) |
| رِيَس (٪) | 18.6 (126.0) | 18.0 (231.2) |
| CC1/2 (٪) £ | 98.7 (55.0) | 98.7 (46.9) |
| عامل B الإجمالي من مؤامرة ويلسون (Å2) | 57.4 | 60.6 |
| الصقل البلوري | ||
| لا. من الانعكاسات، مجموعة العمل / مجموعة اختبار | 23583 / 1180 | 34840 / 3405 |
| Rcryst النهائي (٪ / Rالحرة (٪) | 18.8 / 21.4 | 20.0 / 22.9 |
| لا. من الذرات غير H: عموما / البروتين / ligand / المذيبات | 2998 / 2989 / 0 / 9 | 3057 / 2989 / 29 / 10 |
| R.m.s. انحرافات للسندات (Å) / زوايا (°) | 0.009 / 1.23 | 0.010 / 1.22 |
| متوسط العوامل B (Å2):إجمالي / بروتين / ليغاند / المذيبات | 60.1 / 60.1 / 0 / 52.7 | 62.5 / 62.6 / 60.1 / 55.5 |
| مؤامرة راماشاندران: الأكثر تفضيلاً (٪) / مسموح به (٪ ) | 98.1 / 1.9 | 97.2 / 2.8 |
| معرف PDB | 6IBP | 6Q52 |
الجدول 1:إحصاءات جمع البيانات وتنقيحها
§ التكرار مستقلة Rmeas = Σhkl(N / N - 1)1 /2Σط | ط(hkl)-- < I(hkl)>| / ΣhklΣط ط(hkl) ، حيث N هو تعدد البيانات 17.
تم تضمين البيانات مع انخفاض في الغلاف الخارجي (<2.0) على أساس معيار CC1/2 (الارتباط بين نصفين عشوائيين من مجموعة البيانات > 50٪). كما اقترح Karplus & ديديريشس 18.
Discussion
البروتوكولات الحالية في البلورات الحيوية تنطوي على إعداد البلورات باستخدام أساليب مثل نشر بخار أو دفعة13،14، ونقلها إلى microloop لتبريد15،16 قبل إجراء تحليل الحيود في طائرة النيتروجين في ظروف التبريد. في المقابل، لا يمكن تبريد الكريستال المباشر في ChipX3 ولا يمكن استخراج البلورات من قناتها microfluidic، والتي يمكن رؤيتها على أنها قيود على هذا الإعداد. ومع ذلك، فإن البروتوكول الموصوف في المقالة يوفر خط أنابيب متكامل تماما لتحديد الهياكل الكريستالية في درجة حرارة الغرفة (أي في ظروف أكثر فسيولوجية). على الرغم من أن جمع البيانات في درجة حرارة الغرفة يسبب زيادة في الأضرار الإشعاعية19، فإن هذا التأثير يقابله وقت الحصول السريع على البيانات (يتم جمع دوران 60 درجة كحد أقصى على كل بلورة) وعن طريق دمج العديد من مجموعات البيانات الجزئية. تم تحسين كل من ChipX تصميم والمادية للحد من خلفية التشتت وإشارة الانعراج التوهين3، ويمكن إجراء جمع البيانات على بلورات مع أبعاد تعادل نصف حجم القنوات (40 μm)4.
لتلخيص، المزايا الرئيسية للبروتوكول هي التالية. يتم إنتاج البلورات في بيئة خالية من الحمل الحراري (قنوات microfluidic) ، وهو أمر موات للغاية لنمو بلورات عالية الجودة. طريقة الانتشار المضاد التي تنفذ في ChipX فعالة جدا في فحص المشهد الفائق التشبع؛ انتشار البلورات في قناة رقاقة يخلق تركيز وموجة التشبع الفائق التي تساعد على تحديد النوي المناسب وظروف النمو5. يتم التعامل مع بلورات أبدا مباشرة، ولكن يتم تحليلها في الموقع، داخل رقاقة، والتي تحافظ على خصائصها الحيود الحقيقي (أي، لا يغير الفسيفساء الكريستال عن طريق التفاعل المادي أو cryocooling)20. ويتم تحليل الحيود على سلسلة من البلورات الموزعة على طول قنوات الشريحة مع التعرض لجرعات منخفضة لتقليل الأضرار الإشعاعية، ويتم تجميع مجموعة بيانات كاملة عن طريق دمج البيانات الجزئية من السلسلة. إن البصمة القياسية والتصميم البسيط لـ ChipX سيسمحان في المستقبل بأتمتة كاملة لجمع البيانات في الموقع باستخدام مرافق السنكروترون أو XFEL. يتم تنفيذ كافة خطوات البروتوكول في ChipX. من وجهة نظر المجرب ، إعداد رقاقة بسيطة وسهلة لتنفيذ مع pipets القياسية ولا يتطلب أي معدات إضافية. إن اتصال القناة الشبيه بالشجرة عند مدخل العينة يقلل من حجم التخزين الميت في النظام، وهو أمر مهم عند العمل مع عينات يصعب تنقيةها أو التي لا تتوفر إلا بكمية محدودة.
في الختام، فإن نهج مختبر على رقاقة تنفيذها في ChipX يبسط و تصغير بكفاءة عملية التبلور عن طريق مكافحة الانتشار وتحديد بنية الكريستال، مما يسمح للانتقال من العينة إلى هيكلها 3D في جهاز واحد. وهو قابل للتطبيق على نطاق واسع ويقدم حلا سهل الاستخدام وفعالا من حيث التكلفة لتحقيقات الروتيني للتحريات الروتينية للبلورات الحيوية في درجة حرارة الغرفة.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
الكتاب الاعتراف المصدر السويسري الخفيفة (Villigen، سويسرا) لتخصيص beamtime للمشروع على شعاع X10SA (PXII) وX06DA (PXIII)، الكسندرا بلوم لمساهمتها في صقل الهيكل، كلاريسا Worsdale لتسجيل الصوت وفرانسوا شنل (جامعة ستراسبورغ) لمساعدته في تحرير الفيديو وSFX. وقد دعم هذا العمل المركز الوطني الفرنسي للبحوث العلمية، جامعة ستراسبورغ، كونسورتيوم LabEx "NetRNA" (ANR-10-LABX-0036_NETRNA)، وهو تمويل دكتوراه لR.dW من مبادرة التميز (IdEx) من جامعة ستراسبورغ في إطار البرنامج الوطني الفرنسي "Investissements d'Avenir"، وهو تمويل للدكتوراه إلى K.R. من الجامعة الفرنسية الألمانية (UFA-DFH، منح لا. CT-30-19)، دويتشه هيرشونغجسجيمينشافت (المنحة رقم Mo 634/10-1). استفاد المؤلفون من برنامج التعاون PROCOPE Hubert Curien (وزارة الشؤون الخارجية الفرنسية ودويتشر أكاديمير أوستاوشدينست).
Materials
| Name | Company | Catalog Number | Comments |
| Axioscope A1 stereomicroscope | Zeiss | Crystal observation (step 3) | |
| Carboxyrhodamine succinimidyl ester | Invitrogen | C-6157 | Protein labeling (step 2) |
| CMPcPP | Jena Bioscience | NU-438 | Crystal soaking (step 4) |
| Crystal clear sealing tape | Hampton research | HR3-511 | ChipX sealing (step 1) |
| Parafin oil | Hampton research | HR3-411 | ChipX loading (step 1) |
| Ultimaker 2 extended+ | Ultimaker | 3D printer - Representative results | |
| UV light source | Xtal Concepts Gmbh | XtalLight100c | Crystal observation (step 3) |
| Zeba spin desalting column 7K MWCO | ThermoFisher Scientific | 89882 | Protein labeling (step 2) |
References
- Giegé, R., Sauter, C. Biocrystallography: past, present, future. HFSP Journal. 4 (3-4), 109-121 (2010).
- Dhouib, K., et al. Microfluidic chips for the crystallization of biomacromolecules by counter-diffusion and on-chip crystal X-ray analysis. Lab on a Chip. 9 (10), 1412-1421 (2009).
- Pinker, F., et al. ChipX: A Novel Microfluidic Chip for Counter-Diffusion Crystallization of Biomolecules and in Situ Crystal Analysis at Room Temperature. Crystal Growth & Design. 13 (8), 3333-3340 (2013).
- de Wijn, R., et al. A simple and versatile microfluidic device for efficient biomacromolecule crystallization and structural analysis by serial crystallography. IUCrJ. 6 (3), 454-464 (2019).
- García-Ruiz, J. M. A supersaturation wave of protein crystallization. Journal of Crystal Growth. 232 (1-4), 149-155 (2001).
- Otálora, F., Gavira, J. A., Ng, J. D., García-Ruiz, J. M. Counterdiffusion methods applied to protein crystallization. Progress in Biophysics and Molecular Biology. 101 (1-3), 26-37 (2009).
- Pusey, M., Barcena, J., Morris, M., Singhal, A., Yuan, Q., Ng, J. Trace fluorescent labeling for protein crystallization. Acta Crystallographica Section F Structural Biology Communications. 71 (7), 806-814 (2015).
- Meyer, A., Betzel, C., Pusey, M. Latest methods of fluorescence-based protein crystal identification. Acta Crystallographica Section F Structural Biology Communications. 71 (2), 121-131 (2015).
- Betat, H., Rammelt, C., Mörl, M. tRNA nucleotidyltransferases: ancient catalysts with an unusual mechanism of polymerization. Cellular and Molecular Life Sciences. 67 (9), 1447-1463 (2010).
- Ernst, F. G. M., Erber, L., Sammler, J., Jühling, F., Betat, H., Mörl, M. Cold adaptation of tRNA nucleotidyltransferases: A tradeoff in activity, stability and fidelity. RNA Biology. 15 (1), 144-155 (2018).
- Kabsch, W. XDS. Acta Crystallographica. Section D, Biological Crystallography. 66 (2), 125-132 (2010).
- Adams, P. D., et al. PHENIX: a comprehensive Python-based system for macromolecular structure solution. Acta Crystallographica. Section D, Biological Crystallography. 66 (2), 213-221 (2010).
- Dessau, M. A., Modis, Y. Protein Crystallization for X-ray Crystallography. Journal of Visualized Experiments. (47), e2285 (2011).
- Sauter, C., Lorber, B., McPherson, A., Giegé, R., Arnold, E., Himmel, D. M., Rossmann, M. G. Crystallization - General Methods. International Tables of Crystallography, Vol. F, Crystallography of Biological Macromolecules. , 99-120 (2012).
- Garman, E. "Cool" crystals: macromolecular cryocrystallography and radiation damage. Current Opinion in Structural Biology. 13 (5), 545-551 (2003).
- Li, D., Boland, C., Aragao, D., Walsh, K., Caffrey, M. Harvesting and Cryo-cooling Crystals of Membrane Proteins Grown in Lipidic Mesophases for Structure Determination by Macromolecular Crystallography. Journal of Visualized Experiments. (67), e4001 (2012).
- Diederichs, K., Karplus, P. A. Improved R-factors for diffraction data analysis in macromolecular crystallography. Nature Structural Biology. 4 (4), 269-275 (1997).
- Karplus, P. A., Diederichs, K. Linking Crystallographic Model and Data Quality. Science. 336 (6084), 1030-1033 (2012).
- de la Mora, E., Coquelle, N., Bury, C. S., Rosenthal, M., Holton, J. M., Carmichael, I., Garman, E. F., Burghammer, M., Colletier, J. -. P., Weik, M. Radiation damage and dose limits in serial synchrotron crystallography at cryo- and room temperatures. Proceedings of the National Academy of Sciences of the United States of America. 117 (8), 4142-4151 (2020).
- Nave, C. A. Description of Imperfections in Protein Crystals. Acta Crystallographica. Section D, Biological Crystallography. 54 (5), 848-853 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved