A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصوير حي عالي الإنتاجية للمستعمرات الدقيقة لقياس التغايرية في النمو والتعبير الجيني
In This Article
Summary
يتم قياس الأنماط الظاهرية لنمو الخميرة بدقة من خلال التصوير المتوازي للغاية للفاصل الزمني للخلايا المشلولين التي تنمو إلى مستعمرات صغيرة. وفي الوقت نفسه، يمكن رصد تحمل الإجهاد، والتعبير عن البروتين، وتوطين البروتين، وتوليد مجموعات بيانات متكاملة لدراسة كيفية تعديل النمو بين الاختلافات البيئية والجينية، فضلا عن عدم التجانس بين الخلايا متساوية المنشأ.
Abstract
القياسات الدقيقة للتباين بين وداخل سلالة في معدلات النمو الميكروبية ضرورية لفهم المدخلات الوراثية والبيئية في تحمل الإجهاد، والإمراض، وغيرها من المكونات الرئيسية للياقة البدنية. تصف هذه المخطوطة المقايسة المستندة إلى المجهر التي تتعقب ما يقرب من 105 ساككروميس سيريفيسيا الألوان الدقيقة لكل تجربة. بعد التصوير الآلي الفاصل الزمني للخميرة معطلة في لوحة متعددة بويل ، يتم تحليل معدلات نمو الألوان الدقيقة بسهولة مع برامج تحليل الصور المخصصة. لكل ميكروكولون، والتعبير وتوطين البروتينات الفلورية والبقاء على قيد الحياة من الإجهاد الحاد يمكن أيضا رصدها. ويسمح هذا المقايسة بتقدير دقيق لمتوسط معدلات نمو السلالات، فضلا عن القياس الشامل لعدم التجانس في النمو، والتعبير الجيني، وتحمل الإجهاد داخل المجموعات السكانية اللاستنساخية.
Introduction
الأنماط الظاهرية للنمو تسهم بشكل حاسم في اللياقة البدنية الخميرة. الانتقاء الطبيعي يمكن أن يميز بكفاءة بين الأنساب مع معدلات النمو تختلف عن طريق عكس حجم السكان الفعال، والتي يمكن أن تتجاوز 108 أفراد1. وعلاوة على ذلك، فإن تقلب معدلات النمو بين الأفراد داخل السكان هو المعلمة ذات الصلة تطوريا، لأنها يمكن أن تكون بمثابة الأساس لاستراتيجيات البقاء على قيد الحياة مثل التحوط الرهان2،3،4،5،6. ولذلك، فإن المقايسات التي تسمح بإجراء قياسات دقيقة للغاية للأنماط الظاهرية للنمو وتوزيعاتها هي محورية لدراسة الكائنات الحية الدقيقة. يمكن أن يولد اختبار نمو الألوان الدقيقة الموصوف هنا قياسات معدل النمو الفردي ل ~105 ميكروكولونات لكل تجربة. ولذلك يوفر هذا المقايسة بروتوكولا قويا لدراسة علم الوراثة التطورية الخميرة وعلم الجينوم. فإنه يفسح المجال بشكل جيد بشكل خاص لاختبار كيف يتم إنشاء التباين داخل السكان من الخلايا المفردة متطابقة وراثيا، والحفاظ عليها، ويساهم في اللياقة البدنية للسكان7،8،9،10.
تستخدم الطريقة الموضحة هنا(الشكل 1)صورا ذات حقول ساطعة يتم التقاطها بشكل دوري ومنخفضة التكبير للخلايا التي تنمو في الوسائط السائلة على لوحة زجاجية قاعية من 96 أو 384 بئرا لتتبع النمو في المستعمرات الدقيقة. تلتزم الخلايا بالكونسانفالين الليكتين A ، الذي يغطي الجزء السفلي من لوحة المجهر ، وتشكل مستعمرات ثنائية الأبعاد. لأن المستعمرات الدقيقة تنمو في طبقة واحدة، ترتبط منطقة الكولون الدقيق ارتباطا وثيقا مع الخلية رقم7. لذلك، يمكن إنشاء تقديرات دقيقة لمعدل نمو الألوان الدقيقة ووقت التأخر مع برنامج مخصص لتحليل الصور يتتبع معدل التغيير في منطقة كل مجموعة صغيرة. وعلاوة على ذلك، يمكن للإعداد التجريبي رصد وفرة وحتى توطين دون الخلوية من البروتينات المسمى fluorescently أعرب في هذه المستعمرات الدقيقة. يمكن تحقيق معالجة المصب للبيانات من هذا المقايسة نمو الألوان الدقيقة عن طريق التحليل المخصص أو عن طريق برامج تحليل الصور الحالية ، مثل معالجة الصور بسهولة (PIE)11، خوارزمية للتعرف على منطقة المستعمرة القوية وتحليل النمو عالي الإنتاجية من التكبير المنخفض ، صور brightfield ، والتي تتوفر عبر GitHub12.
ولأن تقديرات معدل النمو المستمدة من مقايسة نمو المستعمرات الدقيقة يتم توليدها من عدد كبير من قياسات المستعمرة الواحدة، فإنها دقيقة للغاية، مع أخطاء قياسية أصغر بعدة أوامر من الحجم من التقديرات نفسها لتجربة معقولة الحجم. ولذلك، فإن قدرة المقايسة على اكتشاف الاختلافات في معدل النمو بين الأنماط الجينية المختلفة أو العلاجات أو الظروف البيئية عالية. يسمح تنسيق لوحة multiwell العديد من تركيبات البيئة والنمط الجيني المختلفة أن تقارن في تجربة واحدة. إذا كانت السلالات تعبر بشكل أساسي عن علامات فلورية مختلفة ، فقد تكون مختلطة في نفس البئر وتتميز بتحليل الصورة اللاحق ، مما قد يزيد من القوة من خلال السماح بتطبيع البيانات بشكل جيد.
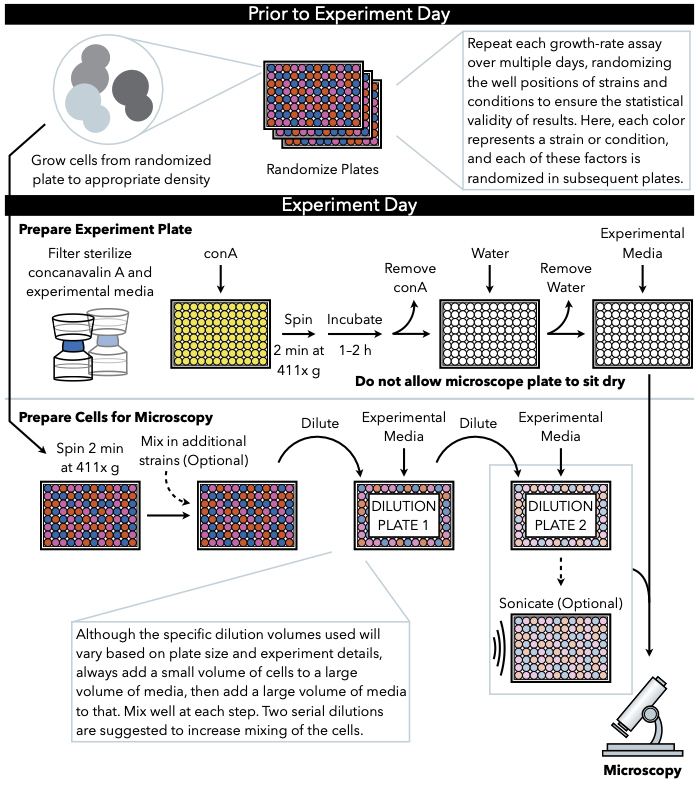
الشكل 1: تمثيل تخطيطي للبروتوكول. يتبع هذا البروتوكول خطوتين رئيسيتين ، وهما إعداد اللوحة التجريبية وإعداد الخلايا للصورة. وينبغي إجراء العشوائية لوحات ونمو الخلايا قبل وحتى يوم التجربة. الخلط المتكرر للخلايا في كل خطوة أثناء التخفيف أمر حتمي في الخطوات حتى الطلاء ، وبالتالي ينصح بإعداد اللوحة التجريبية أولا بحيث تكون جاهزة للطلاء فور الانتهاء من تمييع الخلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. إعداد لوحات معشاة (قبل يوم التجربة)
- تخطيط السلالات والظروف التي سيتم اختبارها مع فحص النمو. عند هذه النقطة، تعيين عشوائيا سلالات وشروط إلى أي بئر.
ملاحظة: عند النظر في إعداد لوحة، فمن المستحسن أن تشمل أكثر من تكرار واحد لكل سلالة وحالة النمو على لوحة واحدة لحساب الضوضاء ذات الصلة جيدا في القياسات. راجع مناقشة لمزيد من التفاصيل. - عشوائيا حسابيا موقع كل سلالة وحالة بيئية لتكرار لوحة التي سيتم تشغيلها في أيام مختلفة.
- تنمو جميع الخلايا التي سيتم استخدامها في التجربة للتشبع في الخميرة استخراج بيبتون دكستروز (YEPD؛ 2٪ الجلوكوز) المتوسطة في شاكر في 30 درجة مئوية (أو أي درجة حرارة مناسبة أخرى).
- إنشاء لوحات الأسهم العشوائية إما يدويا أو مع الروبوت التعامل مع السائل. أضف 10 ميكرولتر من الخلايا المشبعة المعينة إلى كل بئر من لوحة زراعة الأنسجة المعقمة من أسفل U. إذا سيتم اختبار سلالات متعددة في بئر واحد، لا تجمع بينهما في هذه المرحلة. وسيتم هذا الجمع فقط قبل تخفيف الخلية في يوم التجربة لضمان جميع السلالات هي في التركيزات الصحيحة عندما مطلي كخلايا مؤسس الكولونية الدقيقة.
- إضافة 10 ميكرولتر من 30٪ الجلسرين إلى كل بئر من كل لوحة. Pipet صعودا وهبوطا بحيث تصبح الخلايا والجلسرين مختلطة بشكل جيد.
- ختم كل لوحة مع غطاء احباط وتجميد على الفور في -70 درجة مئوية حتى تصبح جاهزة للاستخدام.
ملاحظة: من المهم إنشاء جميع اللوحات العشوائية في نفس اليوم، وتجميدها، بحيث تكون ظروف ما قبل النمو للخلايا في كل لوحة متطابقة ولن تولد تباينا تقنيا في المقايسة لمعدل النمو.
2. ما قبل نمو الخميرة
ملاحظة: عادة، يبدأ هذا قبل يوم التجربة ويعتمد بشكل كبير على السؤال التجريبي. راجع مناقشة للحصول على التفاصيل.
- إزالة لوحة الأسهم (10 ميكرولتر الخميرة، 10 ميكرولتر جلسيرول لكل بئر) من الفريزر -70 درجة مئوية وإضافة 180 ميكرولتر من وسائل الإعلام لاستخدامها في التجربة. إذا كانت التجربة ستجرى باستخدام وسائل الإعلام الحد من المواد الغذائية، لا الخميرة قبل النمو لتشبع في وسائل الإعلام الحد من المواد الغذائية كما يمكن أن يحدث sporulation من الخميرة. بدلا من ذلك ، تنمو مسبقا في وسائل الإعلام غير المقيدة.
- تنمو الخميرة في حين تهتز في 30 درجة مئوية. النظر في ما إذا كان لتشغيل المقايسة بدءا من الخلايا في مرحلة السجل أو في مرحلة ثابتة لتحديد ما إذا كان تمييع الخلايا عدة مرات قبل التجربة سيكون من الضروري. إذا كان من المتوقع أن يكون لسلالات الخميرة أو الظروف في المقايسة معدلات نمو مختلفة بشكل كبير ، فسيكون من الضروري فترة ما قبل النمو لمدة يومين من أجل أن تصل جميع الظروف المختلفة إلى مرحلة ثابتة.
3. إعداد المجهر
- إعداد لوحة المجهر
- التأكد من أن حاضنة المجهر على وتدفئة غرفة المجهر لدرجة حرارة النمو المطلوب للظروف التجريبية. بالنسبة للتجارب القياسية باستخدام خلايا Saccharomyces cerevisiae ، يجب على الحاضنة تسخين غرفة المجهر إلى 30 درجة مئوية لضمان أن ظروف نمو الخلايا ستكون صحيحة أثناء فحص معدل النمو.
- تعقيم منضدة العمل، ماصة، وغيرها من الأدوات مع الإيثانول 70٪. استرداد لوحة المجهر ووضعه على مقاعد البدلاء على رأس مسح الوبر وثابتة خالية.
ملاحظة: لا تلمس أبدا الجزء السفلي من لوحة المجهر، حتى مع القفازات على، ودائما تعيين لوحة المجهر إلى أسفل على رأس مسح الوبر وثابتة خالية في أي وقت أنه يمس أي سطح. وهذا يمنع اللطخات أو الخدوش من إعاقة قياسات معدل النمو بمجرد تصوير التجربة. - تذوب 5 مل من محلول 5x concanavalin A ، وتمييعها إلى 1x بالماء ، وتعقيم الفلتر من خلال حقنة مزودة بتصفية 0.2-μm.
- تصفية تعقيم جميع السوائل الأخرى التي سيتم استخدامها في المقايسة مع مرشح 0.2 ميكرومتر، بما في ذلك وسائل الإعلام التجريبية، لإزالة أي بلورات أو الحطام التي قد تتحقق في الحلول. وجود بلورات من شأنه أن يقلل من جودة الصور المجهرية.
- Pipet 200 ميكرولتر من concanavalin حل في كل بئر من لوحة المجهر.
- الطرد المركزي لوحة لمدة 2 دقيقة في 411 × الجاذبية (ز) مع مسح الوبر وثابتة خالية تحت لوحة، لضمان أن الحل concanavalin A يغطي بالتساوي الجزء السفلي من كل بئر وأنه لا توجد فقاعات الهواء.
- تغطية لوحة مع غطاء والسماح لها الجلوس لمدة 1-2 ساعة. الوقت الدقيق يجلس لوحة مرنة، ولكن من المهم أن تكون متسقة بين أشواط مختلفة من التجربة.
- إزالة كل من concanavalin حل من لوحة إما عن طريق الشفط أو عن طريق تفريغ بقوة بها في الحوض أو وعاء. يجب الحرص على عدم لمس الجزء الزجاجي من لوحة. فمن المقبول إذا كان بعض قطرات من concanavalin حل تبقى في الآبار.
- غسل الآبار لوحة المجهر بإضافة 400 ميكرولتر من المياه العقيمة. إزالة المياه كما فعلت مع concanavalin A في الخطوة السابقة. لا تدع لوحة الجلوس الجافة.
- إضافة فورا 185 ميكرولتر وسائل الإعلام التجريبية النمو في لوحة. سيتم إضافة 15 ميكرولتر من الخلايا المخففة بشكل صحيح إلى هذه اللوحة.
- الخميرة تخفيف الخلية
ملاحظة: تصف الخطوات أدناه تخفيف الخميرة من ثقافة مشبعة (حوالي 108 خلايا / مل) 400 مرة لتحقيق تركيز 250،000 خلية / مل ، سيتم تخفيف 15 ميكرولتر منها إلى 400 ميكرولتر في لوحة الزجاج السفلي ، مما يعطي عددا نهائيا من حوالي 4000 خلية لكل بئر في لوحة من 96 بئرا. إذا كان استخدام لوحة 384 جيدا يجب أن يكون العدد النهائي للخلايا لكل بئر حوالي 700 وينبغي تعديل التخفيفات وفقا لذلك. وينبغي تعديل هذه النسبة للخلايا التي تم جمعها في مرحلة السجل، وتنمو في وسائل الإعلام قبل النمو أغنى أو أفقر، أو من سلالات مختلفة. وينبغي تخفيض الكثافة النهائية للخلايا لكل بئر عند تشغيل تقييم معدل النمو لفترات زمنية أطول من 10 ساعة.- إعداد اثنين من لوحات الثقافة 96 جيدا لتخفيف المسلسل: التسمية كما لوحة 1 و 2، وإضافة 90 ميكرولتر وسائل الإعلام التجريبية النمو (أي، وسائل الإعلام التي سوف تنمو الخميرة في على المجهر) إلى كل لوحة تخفيف المسلسل.
ملاحظة: بغض النظر عن ما يتم استخدام التخفيف النهائي، ينصح على الأقل اثنين من التخفيفات التسلسلية من الخلايا، في كل منها يتم أنبوب حجم صغير من الخميرة في حجم أكبر من وسائل الإعلام التجريبية ومن ثم يتم خلط كمية كبيرة من وسائل الإعلام التجريبية في بقوة مع ماصة (كما هو الحال في الخطوات 3.2.5 و 3.2.6 أدناه). - استرداد لوحة من الخلايا من مرحلة ما قبل النمو والطرد المركزي لوحة لمدة 2 دقيقة في 411 × ز.
ملاحظة: من المهم جدا عدم تلويث الآبار المختلفة في اللوحة. الغرض من هذه الخطوة الطرد المركزي قبل إزالة غطاء احباط من لوحات هو التأكد من أن قطرات مليئة بالخميرة من بئر واحد لا تطير قبالة احباط وينتهي في آبار أخرى. يجب الحرص على عدم إمالة أو هياج لوحات لتجنب الخميرة القادمة في اتصال مع غطاء احباط بعد الطرد المركزي. - قشر بعناية مرة أخرى احباط والخلايا resuspend عن طريق الخلايا pipetting بقوة مع مجموعة pipet إلى ما يقرب من نصف إجمالي حجم في لوحة أثناء تحريك pipet حول البئر لخلط. تأكد من أنه تم إعادة إنفاق جميع الخلايا من أسفل الآبار.
- إذا تم استخدام سلالات متعددة داخل الآبار الفردية ، فيجب خلط السلالات في هذا الوقت بالنسبة اللازمة للتجربة. وإذا استخدمت سلالة مرجعية لتوليد قياسات لمعدل النمو، ينبغي أن تكون نسبة المرجع إلى سلالة الاختبار 1:1.
- Pipet 10 ميكرولتر من الخميرة من وسائل الإعلام النمو إلى تخفيف لوحة 1. أضف 100 ميكرولتر من وسائط النمو التجريبية إلى كل بئر إلى حجم نهائي قدره 200 ميكرولتر لكل بئر. مابيت صعودا وهبوطا بقوة.
- Pipet 10 ميكرولتر من الخميرة من لوحة 1 إلى لوحة 2. إضافة 100 ميكرولتر من وسائل الإعلام التجريبية النمو إلى كل بئر، وماصة صعودا وهبوطا بقوة لخلط.
ملاحظة: هذه الخطوات تخفيف حاسمة للمساعدة في مجموعات منفصلة من الخميرة التي تمسك معا في نهاية مرحلة ما قبل النمو وضمان أن أعداد متساوية تقريبا من خلايا الخميرة في نهاية المطاف في كل بئر. وجود أعداد متسقة من الخميرة في كل بئر يساعد على إزالة الضوضاء التجريبية والتحيزات في قياسات معدل النمو (انظر النتائج التمثيلية).
- إعداد اثنين من لوحات الثقافة 96 جيدا لتخفيف المسلسل: التسمية كما لوحة 1 و 2، وإضافة 90 ميكرولتر وسائل الإعلام التجريبية النمو (أي، وسائل الإعلام التي سوف تنمو الخميرة في على المجهر) إلى كل لوحة تخفيف المسلسل.
- سونيكيشن
ملاحظة: سونيكيشن اختياري، ويحتاج فقط إلى أن يؤديها لسلالات الخميرة التي لديها ميل كبير للالتزام ببعضها البعض (على سبيل المثال ، بعض السلالات البرية). لسلالات المختبر، سونيكيشن عموما ليست ضرورية ويمكن تخطي عن طريق المضي قدما في الخطوة 3.4.- تعقيم رأس سونيكاتور 96 دبوس مع الإيثانول 70٪ عن طريق وضعه في لوحة 96 جيدا مليئة الإيثانول 70٪ والجافة مع مسح الوبر وثابتة خالية.
- تعيين برنامج سونيكيشن التي هي قوية بما فيه الكفاية لكسر خلايا الخميرة flocculated، ولكن لا يقتل الخلايا أو يسبب استجابات الإجهاد مرتفعة. قد تكون هناك حاجة إلى بعض الاختبارات لتحديد أفضل برنامج سونيكيشن لتجربة معينة. برنامج سونيكيشن المستخدمة في هذه التجربة هو: السعة = 10، وقت العملية = 10 ق، نبض على = 1 ق، نبض قبالة = 1 ق. هذا البرنامج الدقيق من المرجح أن لا ينطبق على جميع sonicators حتى يتم اقتراح اختبار قبل يوم التجربة.
- خلط الخميرة في لوحة تخفيف المسلسل 2 مرة أخرى عن طريق الأنابيب صعودا وهبوطا بقوة خمس مرات.
- وضع لوحة التخفيف 2 على المنصة وتأمينه مع دبابيس sonicator في تعليق الخلية ولكن لا تلمس الجزء السفلي من لوحة. تشغيل برنامج سونيكيشن باستخدام حماية الأذن المناسبة.
- بعد تشغيل البرنامج ، قم بتنظيف رأس sonicator بإيثانول بنسبة 70٪ ثم بالماء ، ثم انتقل على الفور إلى إعداد لوحة المجهر بحيث لا تتخثر الخلايا مرة أخرى.
- إعداد لوحة للمجهر:
- Pipet 15 μL من الخميرة من لوحة تخفيف المسلسل 2 في لوحة المجهر إلى حجم 200 ميكرولتر. إضافة 200 ميكرولتر من وسائل الإعلام النمو التجريبي إلى كل بئر إلى حجم نهائي من 400 ميكرولتر لكل بئر، وماصة صعودا وهبوطا بقوة لخلط.
- قم بتغطية اللوحة بغشاء قابل للتنفس. من المهم لختم لوحة جيدا مع هذا الغشاء، على سبيل المثال باستخدام بكرة مطاطية.
- للالتزام خلايا الخميرة إلى concanavalin A على السطح الزجاجي، والطرد المركزي لوحة مع مسح الوبر وثابتة خالية تحته لمدة 2 دقيقة في 411 × ز.
- في المجهر، امسح الجزء العلوي والسفلي من اللوحة بمسحة خالية من الوبر والساكنة، وانفخ الهواء المضغوط على اللوحة للتخلص من الحطام.
- ضع اللوحة على المجهر ، مع التأكد من أنها مستوية وأن بئر A1 في الزاوية اليسرى العليا.
4. قياس معدل نمو المجهر الفاصل زمنيا
ملاحظة: أثناء الفحص المجهري الفاصل زمنيا، يتم التحكم في الميزات التالية بالكمبيوتر: x وy وموضع z ومصاريع ومرشحات مضان. نظام التركيز التلقائي القائم على الأجهزة هو الأمثل لمنع انجراف الطائرة البؤرية أثناء التصوير الفاصل الزمني. بدلا من ذلك، يمكن استخدام حلقة التركيز التلقائي المستندة إلى البرامج. للحفاظ على الرطوبة في غرفة المجهر ، ينصح بالحفاظ على كوب مع مياه نقية في الغرفة طوال مدة التجربة.
- إنشاء قائمة من المواقف (س، ص) إلى الصورة، بحيث يتم تصوير كل المجهر لوحة بشكل جيد تماما. تجنب تداخل الصور بحيث لا يتم تحليل أي خلية عدة مرات.
- صورة في برايتفيلد مع الإضاءة دياسكوبيك (DIA) في تكبير 15x. تعيين التعرض إلى ~ 5 مللي ثانية.
- تكبير الصورة رقميا بحيث تكون الخلايا مرئية بوضوح. استخدام المقابض التركيز لتحديد التركيز المثالي للتجربة في الآبار الأربعة على زاوية لوحة وفي بئر واحد في وسط لوحة. التركيز في مثل هذه الطريقة للحصول على أقصى قدر من التباين من الخلايا.
- قم بتعيين موضع z (أو موضع التركيز البؤري التلقائي) لتكون التجربة متوسطا لمواضع التركيز البؤري التلقائي /z المحددة لكل بئر من هذه الآبار. إذا كانت لوحة المجهر مصنوعة بشكل جيد والقاع الزجاجي لا يحتوي على عيوب ، فيجب أن تكون أوضاع التركيز المثالية متشابهة لكل بئر.
ملاحظة: عند تحليل الصور مع معالجة الصور بسهولة (PIE) خط أنابيب تحليل الصور11،12، من المفيد للخلايا أن تكون قليلا من التركيز على المجهر بحيث يكون هناك حافة داكنة خارج الخلية والداخلية ذات الألوان الفاتحة ، مما يساعد في التعرف الدقيق على المستعمرة وتقديرات الحجم. - إذا كنت تستخدم سلالات الفلورسنت، حدد القنوات والتعرض للصورة، مع التأكد من عدم تعرض وحدات البكسل بشكل مفرط. عند تحديد وقت التعرض للقنوات الفلورية ، قم بإيقاف وضع "الالتقاط المباشر" على المجهر لتجنب تعريض الخلايا للإثارة الفلورية لفترات طويلة من الزمن ، لأن هذا يمكن أن يثير الخلايا ويسبب الإجهاد.
- قم بإعداد الحصول على تسلسل زمني لالتقاط الصور في الفاصل الزمني المطلوب للطول الزمني المطلوب.
- تشغيل التجربة.
النتائج
إن حداثة هذا البروتوكول هي أنه يمكن حساب معدل النمو للخلايا الفردية داخل السكان من خلال تتبع نموها إلى المستعمرات الدقيقة من خلال التصوير الفاصل الزمني(الشكل 2A). لأن المستعمرات الدقيقة تنمو لعدة ساعات بطريقة مستو بسبب وجود concanavalin A ، يمكن تتبع مناطقها طوال التجربة ، ويمكن ?...
Discussion
البروتوكول الموصوف هنا هو اختبار متعدد الاستخدامات يسمح بمراقبة نمو الخلايا والتعبير الجيني في وقت واحد على مستوى الألوان الدقيقة الفردية. والجمع بين هذين الشكلين يسفر عن رؤى بيولوجية فريدة من نوعها. على سبيل المثال، استخدم العمل السابق هذا المقايسة لإظهار ارتباط سلبي بين التعبير عن جين...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نشكر نعومي زيف وساشا ليفي وشوانغ لي على مساهماتهم في تطوير هذا البروتوكول، وديفيد غريشام على المعدات المشتركة، وماريسا نول للمساعدة في إنتاج الفيديو. وقد تم دعم هذا العمل من قبل المعاهد الوطنية للصحة منحة R35GM118170.
Materials
| Name | Company | Catalog Number | Comments |
| General Materials | |||
| 500 mL Bottletop Filter .22 µm PES Sterilizing, Low Protein Binding, w/45mm Neck | Fisher | CLS431154 | used to filter the media |
| BD Falcon*Tissue Culture Plates, microtest u-bottom | Fisher | 08-772-54 | 96-well culture tubes used to freeze cells, pre-grow cells, and dilutions |
| BD Syringes without Needle, 50 mL | Fisher | 13-689-8 | Used to filter the Concanavalin A |
| Costar Sterile Disposable Reagent Reservoirs | Fisher | 07-200-127 | reagent reservoirs used to pipette solutions with multichannel pipette |
| Costar Thermowell Aluminum Sealing Tape | Fisher | 07-200-684 | 96-well plate seal for pre-growth and freezing |
| lint and static free Kimwipes | Fisher | 06-666A | lint and static free wipes to keep microscope plate bottom free of debris and scratches |
| Nalgene Syringe Filters | ThermoFisher Scientific | 199-2020 | 0.2 μm pore size, 25 mm diameter; used to filter concanavalin A solution |
| Media Components | |||
| Minimal chemically defined media (MD; 2% glucose) | alternative microscopy media used for yeast pre-growth and growth during microscopy | ||
| Synthetic Complete Media (SC; 2% glucose) | microscopy media used for yeast pre-growth and growth during microscopy | ||
| Yeast extract-peptone-dextrose (YEPD; 2% glucose) medium | cell growth prior to freezing down randomized plates | ||
| Microscopy Materials | |||
| Breathe-Easy sealing membrane | Millipore Sigma | Z380059-1PAK | breathable membranes used to seal plate during microscopy experiment. At this stage breathable membranes are recommended because they prevent condensation in the wells and allow for better microscopy images |
| Brooks 96-well flat clear glass bottom microscope plate | Dot Scientific | MGB096-1-2-LG-L | microscope plate |
| Concanavalin A from canavalia ensiformis (Jack Bean), lyophilized powder | Millipore Sigma | 45-C2010-1G | Make 5x concanavalin A solution and freeze 5ml of 5x concanavalin A in 50 mL conical tubes at -80 °C |
| Strains Used | |||
| MAH.5, MAH.96, MAH.52, MAH.66, MAH.11, MAH.58, MAH.135, MAH.15, MAH.44, MAH.132 | Haploid mutation accumulation strains in a laboratory background, described in Hall and Joseph 2010 | ||
| EP026.2A-2C | Progeny of the ancestral Hall and Joseph 2010 mutation accumulation strain, transformed with YFR054cΔ::Scw11P::GFP | ||
| Equipment | |||
| Misonix Sonicator S-4000 with 96-pin attachment | Sonicator https://www.labx.com/item/misonix-inc-s-4000-sonicator/4771281 | ||
| Nikon Eclipse Ti-E with Perfect Focus System | Inverted microscope with automated stage and autofocus system |
References
- Geiler-Samerotte, K. A., Hashimoto, T., Dion, M. F., Budnik, B. A., Airoldi, E. M., Drummond, D. A. Quantifying condition-dependent intracellular protein levels enables high-precision fitness estimates. PloS one. 8 (9), 75320 (2013).
- Kussell, E., Leibler, S. Phenotypic diversity, population growth, and information in fluctuating environments. Science. 309 (5743), 2075-2078 (2005).
- Thattai, M., van Oudenaarden, A. Stochastic gene expression in fluctuating environments. Genetics. 167 (1), 523-530 (2004).
- King, O. D., Masel, J. The evolution of bet-hedging adaptations to rare scenarios. Theoretical population biology. 72 (4), 560-575 (2007).
- Acar, M., Mettetal, J. T., van Oudenaarden, A. Stochastic switching as a survival strategy in fluctuating environments. Nature genetics. 40 (4), 471-475 (2008).
- Avery, S. V. Microbial cell individuality and the underlying sources of heterogeneity. Nature reviews. Microbiology. 4 (8), 577-587 (2006).
- Levy, S. F., Ziv, N., Siegal, M. L. Bet hedging in yeast by heterogeneous, age-correlated expression of a stress protectant. PLoS biology. 10 (5), 1001325 (2012).
- van Dijk, D., et al. Slow-growing cells within isogenic populations have increased RNA polymerase error rates and DNA damage. Nature communications. 6, 7972 (2015).
- Ziv, N., Shuster, B. M., Siegal, M. L., Gresham, D. Resolving the Complex Genetic Basis of Phenotypic Variation and Variability of Cellular Growth. Genetics. 206 (3), 1645-1657 (2017).
- Li, S., Giardina, D. M., Siegal, M. L. Control of nongenetic heterogeneity in growth rate and stress tolerance of Saccharomyces cerevisiae by cyclic AMP-regulated transcription factors. PLoS genetics. 14 (11), 1007744 (2018).
- Plavskin, Y., Li, S., Ziv, N., Levy, S. F., Siegal, M. L. Robust colony recognition for high-throughput growth analysis from suboptimal low-magnification brightfield micrographs. bioRxiv. , (2018).
- Ziv, N., Siegal, M. L., Gresham, D. Genetic and nongenetic determinants of cell growth variation assessed by high-throughput microscopy. Molecular biology and evolution. 30 (12), 2568-2578 (2013).
- Hall, D. W., Joseph, S. B. A high frequency of beneficial mutations across multiple fitness components in Saccharomyces cerevisiae. Genetics. 185 (4), 1397-1409 (2010).
- Saleemuddin, M., Husain, Q. Concanavalin A: a useful ligand for glycoenzyme immobilization--a review. Enzyme and microbial technology. 13 (4), 290-295 (1991).
- Geiler-Samerotte, K. A., Bauer, C. R., Li, S., Ziv, N., Gresham, D., Siegal, M. L. The details in the distributions: why and how to study phenotypic variability. Current opinion in biotechnology. 24 (4), 752-759 (2013).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: a practical guide for biologists. Biological reviews of the Cambridge Philosophical Society. 85 (4), 935-956 (2010).
- Bolker, J. A. Exemplary and surrogate models: two modes of representation in biology. Perspectives in biology and medicine. 52 (4), 485-499 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved