Method Article
طريقة تمدد الخلايا القاتلة الطبيعية (NK) و CAR-NK باستخدام خط الخلية B المعدل بالغشاء IL-21
In This Article
Summary
هنا ، نقدم طريقة لتوسيع القاتل الطبيعي للدم المحيطي (PBNK) ، والخلايا القاتلة الطبيعية من أنسجة الكبد ، ومستقبلات المستضد الخيمري (CAR) - الخلايا القاتلة الطبيعية المشتقة من خلايا الدم الطرفية أحادية النواة (PBMCs) أو دم الحبل السري (CB). يوضح هذا البروتوكول توسع خلايا NK و CAR-NK باستخدام خلايا التغذية 221-mIL-21 بالإضافة إلى النقاء الأمثل لخلايا NK الموسعة.
Abstract
أصبح العلاج بالخلايا المناعية المعدلة لمستقبلات المستضد الخيمري (CAR) علاجا ناشئا للسرطانات والأمراض المعدية. يعد العلاج المناعي القائم على NK ، وخاصة خلية CAR-NK ، أحد أكثر التطورات الواعدة "الجاهزة" دون سمية شديدة تهدد الحياة. ومع ذلك ، فإن عنق الزجاجة لتطوير علاج CAR-NK الناجح هو تحقيق أعداد كافية من خلايا CAR-NK غير الشاملة وطويلة العمر "الجاهزة" من طرف ثالث. هنا ، قمنا بتطوير طريقة توسيع CAR-NK جديدة باستخدام خط الخلايا البائية المحول لفيروس Epstein-Barr (EBV) الذي يعبر عن شكل غشاء معدل وراثيا من interleukin-21 (IL-21). في هذا البروتوكول ، يتم توفير إجراءات خطوة بخطوة لتوسيع الخلايا القاتلة الطبيعية و CAR-NK من دم الحبل السري والدم المحيطي ، وكذلك أنسجة الأعضاء الصلبة. سيعزز هذا العمل بشكل كبير التطوير السريري للعلاج المناعي CAR-NK.
Introduction
الخلايا القاتلة الطبيعية (NK) هي مجموعة فرعية مهمة من الخلايا الليمفاوية التي تعبر عن CD56 وتفتقر إلى التعبير عن علامة الخلايا التائية ، CD3 1,2. تصنف الخلايا القاتلة الطبيعية التقليدية على أنها خلايا مناعية فطرية مسؤولة عن المراقبة المناعية للخلايا المصابة بالفيروس والخلايا السرطانية. على عكس الخلايا التائية ، تتعرف الخلايا القاتلة الطبيعية على الخلايا المصابة أو الخبيثة باستخدام CD16 أو مستقبلات تنشيط أخرى ولا تتطلب تكوين مركب بين ببتيدات المستضد وجزيئات معقد التوافق النسيجي الرئيسي (MHC) من الفئة الأولى 3,4. أظهرت التحقيقات السريرية الحديثة باستخدام خلايا مستقبلات المستضد الخيمري (CAR) -NK لعلاج السرطانات المنتكسة أو المقاومة للحرارة CD19 (سرطان الغدد الليمفاوية اللاهودجكين أو سرطان الدم الليمفاوي المزمن [CLL]) مزايا السلامة البارزة لخلايا CAR-NK5. على سبيل المثال ، يرتبط تسريب خلية CAR-NK بالحد الأدنى أو الكسب غير المشروع مقابل مرض المضيف (GVHD) ، والسمية العصبية ، والسمية القلبية ، ومتلازمة إطلاق السيتوكين (CRS) 6،7،8،9،10. ومع ذلك ، أظهرت الطرق التقليدية لتوسيع الخلايا القاتلة الطبيعية البشرية أنماطا ظاهرية شاملة مع قتل قوي بين الأشقاء ونقص في التيلومير ، مما يمثل تحديا كبيرا في الحصول على عدد كاف من الخلايا القاتلة الطبيعية الوظيفية للعلاج المناعي بالتبني11.
للتغلب على هذه التحديات ، تم تطوير طريقة لتوسيع الخلايا القاتلة الطبيعية الأولية مباشرة من خلايا الدم الطرفية أحادية النواة غير المجزأة (PBMCs) أو دم الحبل السري (CB) باستخدام خط خلية 721.221 (المشار إليه فيما يلي ، 221) ، وهو خط خلايا بائية بائية بوية بشرية مع تعبير منخفض عن جزيئات MHC من الفئة الأولى3. أظهرت الدراسات السابقة أهمية IL-21 في توسع الخلايا القاتلة الطبيعية. لذلك ، تم تطوير IL-21 المرتبط بالغشاء المعدل وراثيا والذي يعبر عن نسخة من خط الخلية 721.221 (بدءا من الآن ، 221-mIL-21)11،12،13،14،15. أظهرت النتائج أن 221-mIL-21 الخلايا القاتلة الطبيعية الأولية الموسعة بالخلايا المغذية قد تم توسيعها إلى متوسط >40000 ضعف مع نقاء الخلايا القاتلة الطبيعية العالي المستمر لمدة 2-3 أسابيع تقريبا. يمكن العثور على معلومات إضافية بشأن تطبيق هذا البروتوكول في Yang et al.16.
يهدف هذا البروتوكول إلى إظهار الإجراء التدريجي للتوسع الجديد لخلايا PBNK و CBNK والخلايا المشتقة من الأنسجة NK و CAR-NK خارج الجسم الحي.
Protocol
تتبع الأنسجة البشرية والعمل المتعلق بالدم في هذا البروتوكول إرشادات مجلس المراجعة المؤسسية بجامعة روتجرز (IRB)
1. توسع الخلايا القاتلة الطبيعية من أنسجة الكبد (اليوم 0) ، كما هو موضح في الشكل 1.
ملاحظة: يرتبط رقم الخلية الأولي وصلاحيته ارتباطا وثيقا بالوقت منذ إزالة العضو وكمية عينة الأنسجة الأولية. ومع ذلك ، إذا تم وضع الأنسجة في 30 مل من محلول هانك الملحي المتوازن (HBSS) وحفظها على الثلج أو في الثلاجة عند 4 درجات مئوية طوال الليل ، فلا يزال من الممكن توسيع الخلايا القاتلة الطبيعية بنقاوة عالية وقابلية للحياة حتى 24 ساعة في وقت لاحق.
- تحديد مناطق الأنسجة القابلة للحياة للحصول على الخلايا الليمفاوية من الأنسجة والأقسام باستخدام معدات جراحية معقمة.
- ضع المناديل في 30 مل من HBSS (بدون الكالسيوم أو المغنيسيوم) واحتفظ بها على الثلج حتى تصبح جاهزة للتحضير للعزل.
- فرم المنديل إلى مكعبات بحجم <0.5 سم باستخدام شفرات حلاقة معقمة أو مقص وملقط داخل خزانة السلامة البيولوجية.
- تحضير محلول كولاجيناز وريدي 1x (1 مجم / مل) عن طريق تخفيف مخزون 10x في HBSS (10x كولاجيناز IV: 10 مجم / مل أو ~ 200 وحدة / مل).
- ضع قطع الأنسجة المفرومة في أنابيب تفكيك الأنسجة. املأ الأنابيب بما لا يزيد عن 4 جم من الأنسجة واغمر قطع الأنسجة في ~ 10 مل من 1x كولاجيناز IV.
ملاحظة: لا ينصح باستخدام DNase I لأنه قد يقلل قليلا من صلاحية NK والعائد. يرجى الرجوع إلى جدول المواد لمعرفة أنابيب تفكيك الأنسجة المحددة المستخدمة. - ضع أنابيب تفكيك الأنسجة في جهاز تفكيك الأنسجة واخلطها عند 37 درجة مئوية لفرم الأنسجة جيدا.
ملاحظة: بالنسبة لأنسجة الكبد ، قد يستغرق هذا أكثر من 30 دقيقة. لمزيد من الأنسجة القابلة للتفتيت ، قد تكون حوالي 15 دقيقة كافية. يرجى الرجوع إلى جدول المواد لأنابيب فك الأنسجة المحددة ومفكك الأنسجة المستخدم. - قم بإزالة أنابيب تفكيك الأنسجة وسحنها من خلال مصفاة خلايا النايلون 40 ميكرومتر باستخدام الواجهة الخلفية لحقنة سعة 5 مل. جمع eluent وتجاهل شظايا كبيرة غير مهضوم.
- قم بتدوير المحلول بمعدل 400 × جم لمدة 5 دقائق في درجة حرارة الغرفة. نضح الطاف.
- أعد تعليق كريات الخلايا في 30٪ من السيليكا المطلية بالبولي فينيل بيروليدون (PVP) لإزالة الخلايا الدهنية التي ستلوث الجزء النهائي من الخلايا الليمفاوية.
- لتحضير 1x سيليكا مطلية ب PVP ، استخدم التخفيف 9: 1 من السيليكا المطلية ب PVP في 10x PBS.
ملاحظة: راجع جدول المواد لمعرفة السيليكا المطلية ب PVP المستخدمة. - لتحضير 30٪ من السيليكا المطلية ب PVP ، قم بتخفيف 1x سيليكا مطلية ب PVP باستخدام PBS / HBSS.
- لتحضير 1x سيليكا مطلية ب PVP ، استخدم التخفيف 9: 1 من السيليكا المطلية ب PVP في 10x PBS.
- قم بتدوير حبيبات الخلية بمعدل 400 × جم لمدة 5 دقائق في درجة حرارة الغرفة. نضح الطاف.
- أعد تعليق حبيبات الخلية في 9 مل من وسائط R-10.
ملاحظة: راجع جدول المواد لتكوين وسائط R-10 - ضع بعناية معلق الخلية على 4 مل من وسائط فصل Ficoll أو الخلايا الليمفاوية لفصل الخلايا الليمفاوية عن خلايا الدم الحمراء والخلايا متعددة الأشكال النووية.
- افصل الطبقات عن طريق الطرد المركزي عند 400 × جم لمدة 23 دقيقة في درجة حرارة الغرفة مع إيقاف التسارع والفرامل أو عند أدنى إعداد. صب بعناية الطبقة العليا والمتوسطة وحصاد الطور البيني الذي يحتوي على الخلايا الليمفاوية المتسللة إلى الأنسجة.
- اشطف الخلايا ب 10 مل من الوسائط وانتقل إلى عد الخلايا أو قياس التدفق الخلوي أو اقتباس الخلايا وتجميدها أو بروتوكول توسيع NK الأساسي.
2. توسع الخلايا القاتلة الطبيعية الأولية من PBMCs (أو CB أو أنسجة الأعضاء) (اليوم 0) ، كما هو موضح في الشكل 2.
- قم بإذابة PBMC المجمدة وخلايا التغذية المجمدة والمشعة في حمام مائي 37 درجة مئوية.
- اغسل PBMC و 100 خلية مشععة بأشعة جاما (Gy-irradid) 221-mIL-21 عن طريق الطرد المركزي عند 400 × جم لمدة 5 دقائق مع 10 مل من وسائط R-10 بشكل منفصل.
- احفظ 1 × 106 خلايا من PBMC لقياس التدفق الخلوي.
ملاحظة: نقاء الخلية القاتلة الطبيعية الأولي هو عامل مهم في حساب معدل تمدد الخلايا القاتلة الطبيعية. - أعد تعليق الخلايا في 1 مل من وسائط R-10. عد الخلايا باستخدام Trypan Blue.
- امزج 5 × 10 6 خلايا من PBMC مع 10 × 106 خلايا من 100 خلية 221-mIL-21 مشعة Gy في لوحة خاصة من6 آبار (انظر جدول المواد).
- أضف 30 مل من وسائط R-10 المكملة ب IL-2 البشري (200 وحدة / مل) و IL-15 البشري (5 نانوغرام / مل) (انظر جدول المواد).
- احتضان لوحة 6 آبار خاصة عند 37 درجة مئوية مع 5٪ CO2.
- استبدل الوسائط بوسائط R-10 المكملة ب IL-2 البشري (200 وحدة / مل) و IL-15 البشري (5 نانوغرام / مل) للحفاظ على الخلايا القاتلة الطبيعية كل 3-4 أيام.
ملاحظة: حافظ على أقل من 20 × 106 خلايا لكل بئر لمزيد من التوسع عند كل تغيير للوسائط. للحصول على أفضل قابلية للتطبيق ، تأكد من أن إجمالي عدد الخلايا في كل بئر لا يتجاوز 100 × 106 خلايا. - سجل العدد الإجمالي للخلية وقابليتها للتطبيق وقم بإجراء قياس التدفق الخلوي كل 3-4 أيام لحساب معدل تمدد الخلايا القاتلة الطبيعية.
3. ربط 293 خلية تائية (اليوم 2) ، كما هو موضح في الشكل 2.
- قم بتقسيم خلايا 1.8 × 106 293T في 11 مل من وسائط D-10 لكل لوحة معالجة مقاس 100 مم.
ملاحظة: يرجى الرجوع إلى جدول المواد لتكوين وسائط D-10 - احتضان خلايا 293T عند 37 درجة مئوية مع 5٪ CO2.
4. نقل الفيروس القهقري (اليوم 3)
- في أنبوب سعة 1.7 مل ، امزج 470 ميكرولتر من وسائط المصل المخفضة مع 30 ميكرولتر من كاشف النقل.
ملاحظة: راجع جدول المواد لمعرفة وسائط المصل المخفضة المحددة وكاشف النقل المستخدم. - في أنبوب منفصل سعة 1.7 مل ، أضف 2.5 ميكروغرام من بلازميد pRDF ، و 3.75 ميكروغرام من بلازميد Pegpam3 ، و 2.5 ميكروغرام من بناء CAR في ناقل SFG في وسائط المصل المختزلة بحيث يكون الحجم النهائي 500 ميكرولتر.
- امزج المحاليل في الخطوتين 4.1 و 4.2 بالتنقيط.
- احتضان الأنبوب في درجة حرارة الغرفة لمدة 15 دقيقة.
- أضف 1 مل من الخليط من الخطوة 4.4 إلى صفيحة الخلية 293T في اليوم الأول بطريقة قطرة.
- احتضان اللوحة (اللوحات) عند 37 درجة مئوية مع 5٪ CO2 لمدة 48-72 ساعة.
5. طلاء لوحة Retronectin (اليوم 3)
- تمييع بروتين ريترونيكتين مع محلول ملحي مخزن بالفوسفات (PBS) إلى تركيز نهائي من 50-100 ميكروغرام / مل.
- أضف 500 ميكرولتر من الريترونيكتين المخفف إلى كل بئر من صفيحة غير معالجة مكونة من 24 بئرا (5 آبار لكل بناء CAR). أغلق الطبق باستخدام البارافيلم واحتضن الطبق عند 4 درجات مئوية طوال الليل.
6. النقل (اليوم 4)
- جهاز طرد مركزي للوحة الريترونيكتين عند 2103 × جم لمدة 30 دقيقة عند 4 درجات مئوية. تخلص من المادة الطافية.
- سد كل بئر من لوحة 24 بئر مع 1 مل من وسط R-10.
- احتضان اللوحة عند 37 درجة مئوية مع 5٪ CO2 لمدة 1 ساعة.
- قم بتسخين جهاز الطرد المركزي مسبقا إلى 32 درجة مئوية أثناء انسداد لوحة الريترونيكتين.
- اجمع طاف الفيروس القهقري عن طريق تصفية الخلايا التائية 293T المنقولة باستخدام مرشح 0.45 ميكرومتر.
- القسمة 2 مل من الفيروس القهقري المصفى في كل بئر.
- جهاز طرد مركزي للوحة 24 بئرا عند 2103 × جم لمدة 2 ساعة عند 32 درجة مئوية.
- أثناء الطرد المركزي للصفيحة ، اجمع خلايا PBNK الموسعة من اليوم 0 وعد الخلايا باستخدام Trypan Blue.
ملاحظة: استمر في توسيع خلايا PBNK عن طريق إضافة وسائط R-10 المكملة ب IL-2 (200 وحدة / مل) و IL-15 (5 نانوغرام / مل). - قم بتخفيف خلايا PBNK الموسعة باستخدام وسائط R-10 المكملة ب IL-2 (200 وحدة / مل) و IL-15 (5 نانوغرام / مل) إلى 2.5 × 10 5-5 × 105 خلايا / مل (0.5 × 106-1 × 106 خلايا لكل بئر).
ملاحظة: سجل إجمالي عدد الخلايا وقابليتها للحياة واحفظ 5 × 105 خلايا PBNK موسعة لقياس التدفق الخلوي لأن هذه القيم مهمة في تحديد معدل تمدد الخلايا القاتلة الطبيعية. - بعد الطرد المركزي ، استنشاق جزئيا طاف الفيروس القهقري من كل بئر.
ملاحظة: لا تستنشق تماما ، أي اترك ما يقرب من 100 ميكرولتر من طاف الفيروس القهقري لكل بئر ، لأن هذا سيقلل من كفاءة النقل. - القسمة 2 مل من خلايا PBNK الموسعة المخففة من الخطوة 6.8 إلى كل بئر.
- جهاز طرد مركزي للوحة عند 600 × جم لمدة 10 دقائق عند 32 درجة مئوية. احتضان اللوحة عند 37 درجة مئوية مع 5٪ CO2 لمدة 48-72 ساعة.
ملاحظة: لا تحجب اللوحة.
7. جمع خلايا CAR-NK (اليوم 6 أو 7) ، كما هو موضح في الشكل 2.
- اجمع الخلايا برفق من لوحة 24 بئرا وانقل الخلايا إلى أنبوب طرد مركزي سعة 50 مل
ملاحظة: حاول ألا تولد فقاعات ، لأن هذا سيؤدي إلى انخفاض في صلاحية الخلية. - جهاز طرد مركزي للأنبوب بسرعة 400 × جم لمدة 5 دقائق.
- أعد تعليق الحبيبات باستخدام 1 مل من وسائط R-10 وعد الخلايا باستخدام Trypan Blue.
ملاحظة: احفظ 5 × 105 خلايا لقياس التدفق الخلوي لتحديد كفاءة النقل. - انقل الخلايا المعاد تعليقها إلى لوحة خاصة ذات 6 آبار تحتوي على 30 مل من وسائط R-10 المكملة ب IL-2 (200 وحدة / مل) و IL-15 (5 نانوغرام / مل).
- احتضان لوحة 6 آبار خاصة عند 37 درجة مئوية مع 5٪ CO2.
- استبدل وسائط R-10 المكملة ب IL-2 (200 وحدة / مل) و IL-15 (5 نانوغرام / مل) للحفاظ على الخلايا القاتلة الطبيعية كل 3 - 4 أيام.
ملاحظة: حافظ على أقل من 20 × 106 خلايا لكل بئر لمزيد من التوسع عند كل تغيير. للحصول على أفضل قابلية للتطبيق ، تأكد من أن إجمالي عدد الخلايا في كل بئر لا يتجاوز 100 × 106 خلايا. - سجل إجمالي عدد الخلايا ، والجدوى ، وقم بإجراء قياس التدفق الخلوي كل 3-4 أيام لحساب معدل تمدد الخلية القاتلة الطبيعية.
- استخدم الخلايا للمقايسات المناسبة في المختبر أو في الجسم الحي .
ملاحظة: يمكن استزراع خلايا PBNK الموسعة خارج الجسم الحي وخلايا CAR-NK في حاضنة 37 درجة مئوية لمدة 4 أسابيع تقريبا. - افحص رقم الخلية القاتلة الطبيعية ونقاوتها في اليوم 7 واليوم 11 واليوم 14 واليوم 18 واليوم 21 عن طريق قياس التدفق الخلوي.
النتائج
يظهر في الشكل 1 والشكل 2 سير عمل تخطيطي لعزل الخلايا القاتلة الطبيعية المتسللة إلى الأنسجة وتوسيع خلية PBNK باستخدام منهجية الخلية المغذية 221-mIL-21. تم جمع خلايا PBNK الموسعة كل 3 أو 4 أيام لقياس التدفق الخلوي لتحديد نقاء الخلية القاتلة الطبيعية عن طريق تلطيخ الخلايا ب CD56 المضاد للإنسان و CD3 المضاد للإنسان. تكررت التجربة باستخدام مانحين مختلفين لإظهار قابلية تكرار نظام التمدد (الشكل 3). تبين أن خلايا PBNK التي تم توسيعها بمقدار 221-mIL-21 تتوسع تقريبا 5 × 104 أضعاف (الشكل 3 أ). علاوة على ذلك ، تم الحفاظ على نقاء الخلايا القاتلة الطبيعية بشكل كبير ، حوالي 85٪ طوال فترة التوسع التي استمرت 21 يوما (الشكل 3 ب). باستخدام نظام توسيع الخلايا المغذية 221-mIL-21 ، تراوحت نقاء الخلية القاتلة الطبيعية باستمرار بين 85٪ -95٪ ، بغض النظر عن المتبرعين (البيانات غير معروضة). لإثبات متانة نظام التمدد 221-mIL-21 ، تم تلطيخ PBMCs لمضادات CD56 ومضادات CD3 قبل التوسع ، والتي أظهرت نقاء الخلية بنسبة 7.09٪ للخلايا القاتلة الطبيعية ونسبة عالية من الخلايا التائية (الشكل 4 أ). تم استزراع PBMCs مع 221-mIL-21 لتوسيع الخلايا القاتلة الطبيعية. تم فحص نقاء NK قبل نقل CAR-NK في اليوم 4 (الشكل 4A). تم جمع خلايا CAR-NK وتلطيخها من أجل مكافحة CD56 ومكافحة CD3 ومكافحة hIgG (H + L) F (ab') 2 ، والتي أظهرت ارتفاع عدد الخلايا القاتلة الطبيعية (86.9٪ في اليوم السابع) وكفاءة نقل CAR عالية تبلغ حوالي 70٪ (الشكل 4). كما لوحظت كفاءة نقل أعلى (تصل إلى 95٪) باستخدام نظام تغليف الفيروسات القهقرية. إجمالا ، تظهر هذه البيانات أن الخلايا المغذية 221-mIL-21 يمكن أن توسع بنجاح الخلايا القاتلة الطبيعية والحفاظ على نقاء الخلية القاتلة الطبيعية خارج الجسم الحي.
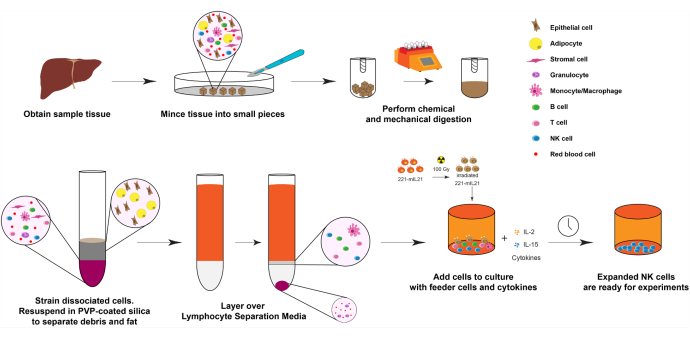
الشكل 1: رسم تخطيطي لتوسع الخلايا القاتلة الطبيعية من عينات الأعضاء البشرية الصلبة. باختصار ، يتم تقطيع عينات الكبد البشري التي تم الحصول عليها إلى مكعبات صغيرة للهضم الميكانيكي. ثم يتم عزل الخلايا المنفصلة باستخدام السيليكا المغلفة ب PVP ووسائط فصل الخلايا اللمفاوية. علاوة على ذلك ، يتم توسيع الخلايا القاتلة الطبيعية باستخدام بروتوكول التوسع الموضح في الشكل 2. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
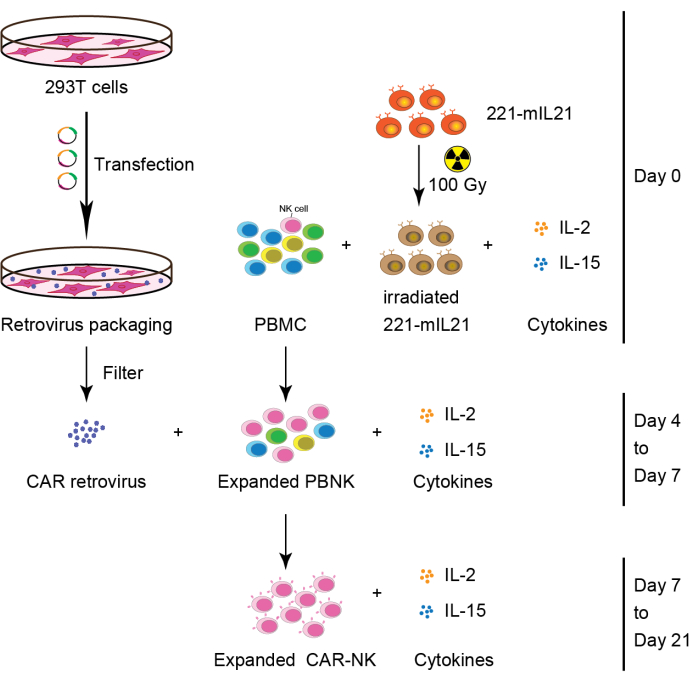
الشكل 2: سير العمل التخطيطي لتوليد خلايا CAR-NK من PBMCs. باختصار ، تم تشعيع خلايا التغذية 221-mIL21 عند 100 جراي قبل الاستزراع مع PBMCs المكملة ب IL-2 و IL-15 في اليوم 0. في موازاة ذلك ، تم نقل خلايا 293T مع نظام تغليف الفيروسات القهقرية لإنتاج الفيروس القهقري CAR الذي تم تحويله بعد ذلك إلى خلايا PBNK الموسعة في وجود IL-2 و IL-15. تم حصاد خلايا CAR-NK الأولية في اليوم 7 واستمرت في التوسع لمدة 21 يوما. تم تعديل هذا الرقم من Yang et al.16. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
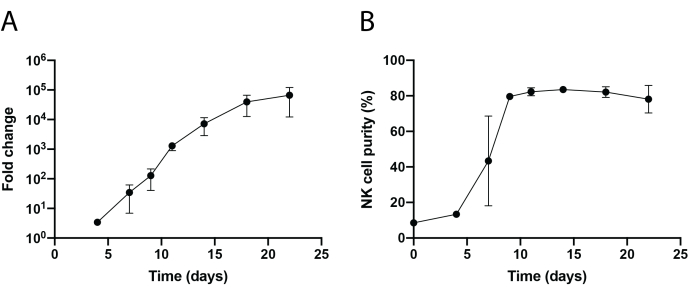
الشكل 3: التوسع الديناميكي المنقضي زمنيا لخلايا PBNK. (أ) توسيع أضعاف PBNK خلال دورة زمنية مدتها 22 يوما. تم تلطيخ الخلايا بمضادات CD56 ومضادات CD3 في الأيام المحددة لقياس التدفق الخلوي. تم تحديد العدد الإجمالي للخلايا القاتلة الطبيعية بضرب نقاء الخلايا القاتلة الطبيعية في إجمالي عدد الخلايا. تم إنشاء معدل التوسع على النحو التالي: (عدد الخلايا القاتلة الطبيعية) Tn / (عدد الخلايا القاتلة الطبيعية) T0 ، حيث عدد الخلايا القاتلة الطبيعية = (النسبة المئوية لنقاء الخلية القاتلة الطبيعية) × (إجمالي عدد الخلايا) ، T 0 هو عدد الخلايا القاتلة الطبيعية في اليوم0 ، و Tn هو عدد الخلايا القاتلة الطبيعية في اليوم n. (B) نقاء الخلية القاتلة الطبيعية خلال دورة زمنية مدتها 22 يوما. تكرر توسع الخلايا القاتلة الطبيعية مرتين مع متبرعين مختلفين. تمثل أشرطة الخطأ ± SEM. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
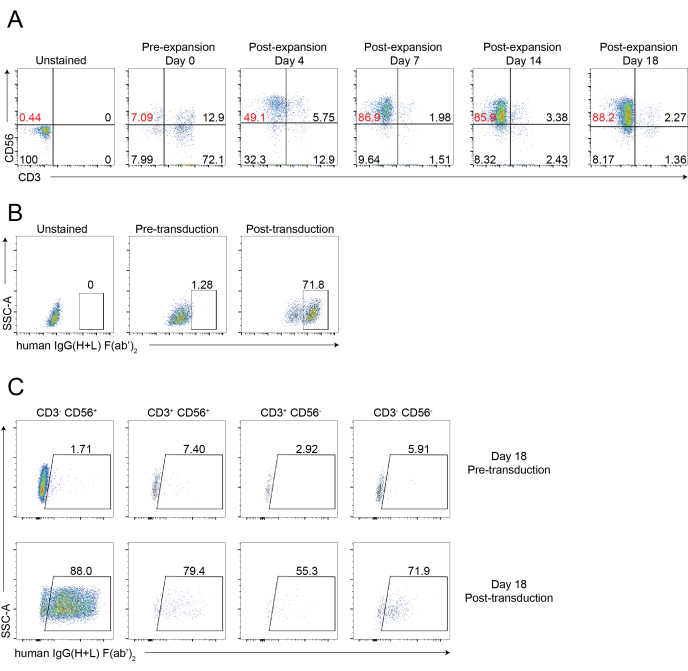
الشكل 4: تحليل التدفق الخلوي التمثيلي لخلايا CAR-NK. (أ) مخططات نقطية تمثيلية توضح الفاصل الزمني الديناميكي لنقاء الخلايا القاتلة الطبيعية لخلايا CAR-NK خلال دورة مدتها 18 يوما. تم تقييم تحليل قياس التدفق الخلوي عن طريق تلطيخ الخلايا بمضادات CD56 ومضادات CD3 في نقاط زمنية محددة. يشير اليوم 0 إلى التوسع المسبق ل PBNK. يشير اليوم 4 إلى ما بعد توسع PBNK وما قبل نقل خلايا CAR-NK. يشير اليوم 7 إلى ما بعد نقل خلايا CAR-NK. (ب) مخططات نقطية تمثيلية توضح كفاءة نقل خلايا CAR-NK باستخدام نظام تغليف الفيروسات القهقرية. تم تلطيخ الخلايا بمضادات CD56 ومضادة CD3 ومضادة hIgG (H + L) F (ab') 2 لقياس التدفق الخلوي. (ج) مخططات نقطية تمثيلية توضح تعبير CAR في مجموعات فرعية مختلفة ، بما في ذلك CD56 + CD3- و CD56-CD3 + و CD56 + CD3 + و CD56-CD3- في اليوم 18. تم تلطيخ الخلايا بمضاد CD56 ومضاد CD3 ومضاد hIgG (H + L) F (ab') 2 (يشير إلى تعبير CAR) لقياس التدفق الخلوي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
تستخدم معظم منتجات CAR-NK الحالية في التجارب السريرية خطوط الخلايا القاتلة الطبيعية 17 ، مثل NK-92 ، وهو خط خلوي معزول من مريض سرطان الغدد الليمفاوية اللاهودجكين18 ، NK-92MI ، IL-2 خط خلية NK-92 المستقل19 ، و NKL ، معزول عن مريض الخلايا الليمفاوية الحبيبية الكبيرة20 ، حيث أن خطوط الخلايا هذه تتكاثر بسهولة للمنتجات "الجاهزة". ومع ذلك ، فإن خطوط الخلايا هذه ، على سبيل المثال ، خلايا NK-92 ، لها كفاءات سريرية هامشية وتوسع في الجسم الحي ، لأنها تتطلب تشعيعا قبل التسريب ، مما يحد من انتشارها وسميتها الخلوية في الجسم الحي21. بالنظر إلى هذه الأسباب ، يتم حاليا استكشاف استراتيجيات مختلفة لتوسيع الخلايا القاتلة الطبيعية الأولية من عدة مصادر ، بما في ذلك الدم المحيطي ، CB ، نخاع العظم (BM) ، الخلايا الجذعية الجنينية البشرية (HSCs) ، الخلايا الجذعية المستحثة متعددة القدرات (iPSCs) ، وأنسجة الورم21،22،23. على سبيل المثال ، يمكن توسيع الخلايا القاتلة الطبيعية خارج الجسم الحي باستخدام الإنترلوكينات بما في ذلك IL-15 و IL-18 و IL-21. خطوط الخلايا الليمفاوية مثل خلايا K562 أو خطوط الخلايا الليمفاوية المحولة لفيروس إبشتاين بار مثل 721.221 خلية ، تستخدم أيضا لتوسيع الخلايا القاتلة الطبيعية16. ومع ذلك ، فإن الاستراتيجيات المذكورة أعلاه غالبا ما تولد عددا غير كاف من الخلايا القاتلة الطبيعية لنقل العلاج المناعي CAR-NKبالتبني 22,24. للمساعدة في حل المشكلة ، تظهر الدراسة هنا بروتوكولا لتوسيع الخلايا القاتلة الطبيعية خارج الجسم الحي باستخدام خط خلية EBV المعدل وراثيا ، 221-mIL-21 خلايا مغذية.
تم تحسين منهجية التوسع باستخدام خلايا التغذية 221-mIL-21 الموضحة في هذا البروتوكول لتوسيع الخلايا القاتلة الطبيعية بمعدل توسع لا يقل عن 10 إلى 100 ضعف أعلى من خطوط خلايا سرطان الدم الأخرى ، بما في ذلك HL-60 و OCl-AML3 التعبير عن الغشاء IL-21 و K562 و K652-mIL21 معبرا عن OX40 ligand22،24،25. يتم تقييم تعبير CAR أيضا لمدة 2 أسابيع تقريبا خارج الجسم الحي. والأهم من ذلك ، يمكن تطبيق استراتيجية توسيع الخلايا المغذية 221-mIL-21 لتوسيع الخلايا القاتلة الطبيعية من مصادر مختلفة ، بما في ذلك PBMCs و CB والأعضاء الصلبة مثل الكبد ، دون خطوة تخصيب NK الأولية. على الرغم من أن نظام التغذية 221-mIL-21 لا يعتمد على المانحين مثل خطوط الخلايا المغذية المذكورة أعلاه ، إلا أنه ليس مستقلا تماما عن الجهات المانحة. في المتوسط ، يمكن لنظام التوسع 221-mIL-21 تحقيق 90٪ من نقاء الخلايا القاتلة الطبيعية مع ارتفاع عدد الخلايا القاتلة الطبيعية ، مع ما يقرب من <5٪ من تلوث الخلايا التائية في اليوم 14 بعد التوسع. لذلك ، للقضاء على احتمالات تلوث الخلايا التائية ، من الضروري عزل الخلايا القاتلة الطبيعية من العينات التي تم الحصول عليها قبل التوسع خارج الجسم الحي أو استخدام نظام اختيار CD3 + للقضاء على الخلايا التائية بعد التوسع خارج الجسم الحي.
أحد الانتقادات في استخدام نظام توسيع الخلايا القاتلة الطبيعية هو أن الخلايا المغذية ربما لم يتم القضاء عليها بالكامل بعد التوسع أو قبل نقل الدم ، مما قد ينطوي على مخاوف تنظيمية كبيرة ؛ لذلك ، فإن الاستئصال الكامل للخلايا المغذية قبل نقل الدم أمر بالغ الأهمية. ومع ذلك ، فإن التجارب السريرية الأخيرة ل CAR-NK التي تم فيها استخدام خلايا التغذية K562-mIL21-4-1BBL لتوسيع خلايا CBNK خارج الجسم الحي 24,25 لم تظهر أي مضاعفات مقلقة. علاوة على ذلك ، أظهرت بياناتنا الأولية انخفاضا تدريجيا في عدد السكان المشععين 221-mIL-21 مع تقدم التوسع (البيانات غير معروضة). ومع ذلك ، هناك حاجة إلى مزيد من الدراسات المكثفة لتنفيذ طريقة التوسع هذه في بيئة سريرية. بشكل جماعي ، يساعد نظام التوسع 221-mIL-21 في حل التحدي المتمثل في توسيع خلايا CAR-NK الأولية ، وبالتالي سيساهم بشكل كبير في الاستخدام الأوسع للعلاج المناعي القائم على الخلايا CAR-NK في المستقبل القريب.
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
نود أن نشكر أعضاء مختبر ليو (الدكتور هسيانغ تشي تسنغ والدكتور شيونينغ وانغ والدكتور تشيه هسيونغ تشن) على تعليقاتهم على المخطوطات. نود أن نشكر الدكتور جيانبيترو دوتي على ناقلات SFG والدكتور إريك لونج على خلايا 721.221. تم دعم هذا العمل جزئيا من HL125018 (D. Liu) و AI124769 (D. Liu) و AI129594 (D. Liu) و AI130197 (D. Liu) و Rutgers-Health Advance Funding (برنامج NIH REACH) و U01HL150852 (R. Panettieri و S. Libutti و R. Pasqualini) و S10OD025182 (D. Liu) وتمويل بدء تشغيل كلية الطب بجامعة روتجرز - نيو جيرسي لمختبر D. Liu.
Materials
| Name | Company | Catalog Number | Comments |
| 100 mm surface treated sterile tissue culture dishes | VWR | 10062-880 | For transfection |
| 293T cells | ATCC | CRL-3216 | For transfection |
| 6-well G-REX plate | Wilson Wolf | 80240M | For NK cell expansion |
| AF647-conjugated AffiniPure F(ab')2 fragment goat anti-human IgG (H+L) | Jackson ImmunoResearch | 109-606-088 | For flow cytometry |
| CAR construct in SFG vector | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Collagenase IV | Sigma | C4-22-1G | For TILs isolation |
| Cryopreserve media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 90% |
| Cryopreserve media Ingredient: Dimethyl sulfoxide (DMSO) | Sigma | D2050 | 10% |
| D-10 media Ingredient: DMEM | VWR | 45000-304 | |
| D-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| D-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| FastFlow & Low Binding Millipore Express PES Membrane | Millex | SLHPR33RB | For transduction |
| Genejuice transfection reagent | VWR | 80611-356 | For transfection |
| gentleMACS C-tubes | Miltenyi Biotec | 130-093-237 | For TILs isolation |
| gentleMACS Octo | Miltenyi Biotec | Quote | For TILs isolation |
| Hank's Balanced Salt Solution (HBSS - w/o calcium or magnesium) | ThermoFisher | 14170120 | For TILs isolation |
| Human IL-15 | Peprotech | 200-15 | For NK cell expansion |
| Human IL-2 | Peprotech | 200-02 | For NK cell expansion |
| Irradiated 221-mIL21 feeder cells | Generated in Dr. Dongfang Liu's lab | Frozen in cryopreserve media | |
| Lymphocyte Separation Media | Corning | 25-072-CV | For TILs isolation |
| OPTI-MEM | ThermoFisher | 31895 | For transfection |
| PE anti-human CD3 clone HIT3a | Biolegend | 300308 | For flow cytometry |
| PE/Cy7 anti-human CD56 (NCAM) clone 5.1H11 | BioLegend | 362509 | For flow cytometry |
| Pegpam3 plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Percoll | GE Healthcare | 17089101 | For TILs isolation |
| Peripheral blood mononuclear cells (PBMCs) | New York Blood Center | Isolated from plasma of healthy donors, frozen in cryopreserve media | |
| Phosphate Buffer Saline (PBS) | Corning | 21-040-CV | For transduction |
| pRDF plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| R-10 media Ingredients: RPMI 1640 | VWR | 45000-404 | |
| R-10 media Ingredient: L-glutamine | VWR | 45000-304 | 1% |
| R-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| R-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| Retronectin | Generated in Dr. Dongfang Liu's lab | home-made | For transduction |
| Trypan Blue | Corning | 25-900-Cl | For cell counting |
| Untreated 24-well plate | Fisher Scientific | 13-690-071 | For transduction |
References
- Van Acker, H. H., et al. CD56 in the immune system: More than a marker for cytotoxicity. Frontiers in Immunology. 8, 892 (2017).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Shimizu, Y., et al. Transfer and expression of three cloned human non-HLA-A,B,C class I major histocompatibility complex genes in mutant lymphoblastoid cells. Proceedings of the Nationall Academy of Sciences of the United States of America. 85 (1), 227-231 (1988).
- Wu, J., Lanier, L. L. Natural killer cells and cancer. Advances in Cancer Research. 90, 127-156 (2003).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. The New England Journal of Medicine. 382 (6), 545-553 (2020).
- Alonso-Camino, V., et al. Efficacy and toxicity management of CAR-T-cell immunotherapy: a matter of responsiveness control or tumour-specificity. Biochemical Society Transactions. 44 (2), 406-411 (2016).
- Bonifant, C. L., Jackson, H. J., Brentjens, R. J., Curran, K. J. Toxicity and management in CAR T-cell therapy. Molecular Therapy Oncolytics. 3, 16011 (2016).
- Kalaitsidou, M., Kueberuwa, G., Schitt, A., Gilham, D. E. CAR T-cell therapy: toxicity and the relevance of preclinical models. Immunotherapy. 7 (5), 487-497 (2015).
- Gust, J., et al. Endothelial activation and blood-brain barrier disruption in neurotoxicity after adoptive immunotherapy with CD19 CAR-T cells. Cancer Discovery. 7 (12), 1404-1419 (2017).
- Hay, K. A., et al. Kinetics and biomarkers of severe cytokine release syndrome after CD19 chimeric antigen receptor-modified T-cell therapy. Blood. 130 (21), 2295-2306 (2017).
- Zhang, Y., et al. In vivo kinetics of human natural killer cells: the effects of ageing and acute and chronic viral infection. Immunology. 121 (2), 258-265 (2007).
- Vidard, L., et al. CD137 (4-1BB) Engagement fine-tunes synergistic IL-15- and IL-21-driven nk cell proliferation. Journal of Immunology. 203 (3), 676-685 (2019).
- Venkatasubramanian, S., et al. IL-21-dependent expansion of memory-like NK cells enhances protective immune responses against Mycobacterium tuberculosis. Mucosal Immunology. 10 (4), 1031-1042 (2017).
- Ojo, E. O., et al. Membrane bound IL-21 based NK cell feeder cells drive robust expansion and metabolic activation of NK cells. Scientific Reports. 9 (1), 14916 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), 30264 (2012).
- Yang, Y., et al. Superior expansion and cytotoxicity of human primary NK and CAR-NK cells from various sources via enriched metabolic pathways. Molecular Therapy. Methods & Clinical Development. 18, 428-445 (2020).
- Liu, S., et al. NK cell-based cancer immunotherapy: from basic biology to clinical development. Journal of Hematology & Oncology. 14 (1), 7 (2021).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell-line (Nk-92) with phenotypical and functional-characteristics of activated natural-killer-cells. Leukemia. 8 (4), 652-658 (1994).
- Tam, Y. K., et al. Characterization of genetically altered, interleukin 2-independent natural killer cell lines suitable for adoptive cellular immunotherapy. Human Gene Therapy. 10 (8), 1359-1373 (1999).
- Robertson, M. J., et al. Characterization of a cell line, NKL, derived from an aggressive human natural killer cell leukemia. Experimental Hematology. 24 (3), 406-415 (1996).
- Hu, Y., Tian, Z. G., Zhang, C. Chimeric antigen receptor (CAR)-transduced natural killer cells in tumor immunotherapy. Acta Pharmacologica Sinica. 39 (2), 167-176 (2018).
- Tseng, H. C., et al. Efficacy of anti-CD147 chimeric antigen receptors targeting hepatocellular carcinoma. Nature Communications. 11 (1), 4810 (2020).
- Easom, N. J. W., et al. IL-15 overcomes hepatocellular carcinoma-induced NK cell dysfunction. Frontiers in Immunology. 9, 1009 (2018).
- Granzin, M., et al. Highly efficient IL-21 and feeder cell-driven ex vivo expansion of human NK cells with therapeutic activity in a xenograft mouse model of melanoma. Oncoimmunology. 5 (9), 1219007 (2016).
- Liu, E. L., et al. Cord blood derived natural killer cells engineered with a chimeric antigen receptor targeting CD19 and expressing IL-15 have long term persistence and exert potent anti-leukemia activity. Blood. 126 (23), (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved