A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
النيوترون تدور صدى الطيف كمسبار فريد لديناميات الغشاء الدهني والتفاعلات الغشاء البروتين
In This Article
Erratum Notice
Summary
تصف هذه الورقة بروتوكولات إعداد العينات، والحد من البيانات، وتحليل البيانات في دراسات صدى الدوران النيوتروني (NSE) للأغشية الدهنية. تمكن وسمة الديوتريوم الحكيمة للدهون من الوصول إلى ديناميكيات غشاء مختلفة على الطول والمقاييس الزمنية بالمنظار ، والتي تحدث عليها العمليات البيولوجية الحيوية.
Abstract
تشكل الطبقات ثنائية الدهون المصفوفة الرئيسية لأغشية الخلايا وهي المنصة الأساسية لتبادل العناصر الغذائية ، والتفاعلات بين البروتين والغشاء ، والفيروسية الناشئة ، من بين عمليات خلوية حيوية أخرى. للنشاط البيولوجي الفعال، يجب أن تكون أغشية الخلايا جامدة بما يكفي للحفاظ على سلامة الخلية ومقصوراتها ولكنها سائلة بما يكفي للسماح لمكونات الأغشية، مثل البروتينات والمجالات الوظيفية، بالانتشراط والتفاعل. هذا التوازن الدقيق لخصائص الأغشية المرنة والسائلة ، وتأثيرها على الوظيفة البيولوجية ، يتطلب فهما أفضل لديناميكيات الأغشية الجماعية على طول الغشاء التنظيري والمقاييس الزمنية للعمليات البيولوجية الرئيسية ، على سبيل المثال ، تشوهات الأغشية وأحداث ربط البروتين. من بين التقنيات التي يمكن أن تحقق بشكل فعال هذا النطاق الديناميكي هو النيوترون صدى دوران (NSE) الطيفية. جنبا إلى جنب مع وضع العلامات الديوتريوم، يمكن استخدام NSE للوصول مباشرة الانحناء وتقلبات سمك، فضلا عن ديناميات التنظير من ميزات غشاء مختارة. تقدم هذه الورقة وصفا موجزا لتقنية NSE وتحدد إجراءات إجراء تجارب NSE على الأغشية الدهنية ، بما في ذلك تفاصيل إعداد العينات ومخططات الديوتر ، إلى جانب تعليمات لجمع البيانات والحد منها. كما تقدم الورقة أساليب تحليل البيانات المستخدمة لاستخراج معلمات الغشاء الرئيسية، مثل معامل صلابة الانحناء، ومعامل ضغط المنطقة، واللزوجة داخل الطائرة. لتوضيح الأهمية البيولوجية لدراسات NSE ، تتم مناقشة أمثلة مختارة من الظواهر الغشائية التي بحثتها NSE ، وهي تأثير الإضافات على صلابة الانحناء الغشائي ، وتأثير تكوين المجال على تقلبات الأغشية ، والتوقيع الديناميكي للتفاعلات بين الغشاء والبروتين.
Introduction
تطور فهم أغشية الخلايا ووظيفتها بشكل ملحوظ على مدى العقود القليلة الماضية. وقد تحولت النظرة السابقة لأغشية الخلايا كثنائيات الدهون السلبية التي تحدد حدود الخلايا وبروتينات غشاء المنزل1 تدريجيا إلى نموذج ديناميكي تلعب فيه الطبقات ثنائية الدهون دورا مهما في تنظيم العمليات البيولوجية الحيوية ، بما في ذلك الإشارات الخلوية والتبادل الجزيئي ووظيفة البروتين - على سبيل المثاللا الحصر2و3و4و5و6. هذا الإدراك بأن أغشية الخلايا ديناميكية للغاية ، وتخضع باستمرار لإعادة العرض وإعادة التوزيع الجزيئي ، وقد حث الاستكشافات العلمية وراء هياكل التوازن للأغشية7و8و9. وبناء على ذلك، تم تطوير نهج متعددة لدراسة مختلف الأنماط الديناميكية في الأغشية الدهنية البيولوجية والحيوى. حتى الآن، ركزت غالبية هذه الدراسات في المقام الأول على نشر الحركات الجزيئية10،11،12،13 وتقلبات الشكل العياني14،15،16، مما يترك فجوة كبيرة في فهم ديناميات الأغشية المتوسطة ، أي التقلبات الجماعية لجمعيات الدهون التي تتكون من عدد قليل من 10-100s من جزيئات الدهون. تحدث هذه الديناميكيات على مقاييس طول من عشرات قليلة إلى عدد قليل من 100 Å وعلى مدى المقاييس الزمنية من ns الفرعية إلى بضع مئات من ns (انظر الشكل 1)، ويشار إليها هنا باسم جداول التنظير. هو حقا على هذا ميزان أن نشاط رئيسية أحيائية يتم في الغشاء مستوى17. وهذا يشمل الفيروسية الناشئة18، قناة gating19، والتفاعلات الغشاء البروتين20. من المهم أيضا الإشارة إلى أن مشهد الطاقة للبروتينات الغشائية21،22 يظهر أن التغيرات التوافقية في البروتينات - الضرورية لدورها التنظيمي - تحدث على مدى المقاييس الزمنية23 من تقلبات الأغشية الجماعية ، مما يؤكد كذلك على أهمية الديناميكيات التنظيرية في الوظيفة البيولوجية لأغشية الخلايا ونظائرها ذات الأغشية الحيوية20. تركز هذه الورقة على الوضعين الديناميكيين الأساسيين بالمنظار في الأغشية الدهنية ، وهما تقلبات الانحناء وتقلبات السماكة.
ويتمثل التحدي الرئيسي في التحقيق المباشر في أوضاع التقلبات هذه في صعوبة الوصول في الوقت نفسه إلى مقاييسها المكانية والزمنية باستخدام أساليب التحليل الطيفي القياسية. والتحدي الآخر هو أن تقنيات الاتصال المباشر يمكن أن تؤثر على نفس التقلبات التي يقصد بها قياس16. ومما يزيد من تفاقم هذا التعقيد التركيبي والهيكلي للأغشية البيولوجية24،25، مما يؤدي إلى ميزات غشاء غير متجانسة ، بما في ذلك تشكيل المجال الدهني26،27،28،29،30 وعدم تناسق الأغشية31،32،33- مما يتطلب تحقيقات انتقائية لفهم ديناميات ميزات الأغشية المختلفة. لحسن الحظ ، يمكن التغلب على هذه التحديات باستخدام طرق التحليل الطيفي النيوتروني غير الغازية ، مثل صدى الدوران النيوتروني (NSE) ، والتي تدخل بطبيعتها إلى الطول والمقاييس الزمنية المطلوبة ، وتمكن من إجراء دراسات حول ميزات الغشاء الانتقائي دون تغيير بيئتها الفيزيائيةالكيميائية 34. في الواقع ، على مدى السنوات القليلة الماضية تطور التحليل الطيفي NSE إلى مسبار فريد وقوي من ديناميكيات الغشاء الجماعي35. وقد أنتجت نتائج دراسات NSE على الأغشية الدهنية رؤى جديدة فيالميكانيكية 36،37 وviscoelastic38،39 خصائص الأغشية الدهنية وألقت ضوءا جديدا على دورها المحتمل في الوظيفة البيولوجية40،41.
تعتمد تقنية التحليل الطيفي NSE على تصميم أداة التداخل ، الذي اقترحه Mezei42لأول مرة ، باستخدام سلسلة من الزعانف الدوارة واللفائف المغناطيسية للتحكم في مقدمة الدوران النيوتروني أثناء اجتياز النيوترونات للجهاز. يعتمد التصميم على النسخ المتطابق المغناطيسي لعناصر المجال المغناطيسي فيما يتعلق بموضع العينة(الشكل 1A). وهذا يعني أنه في غياب تبادل الطاقة بين النيوترون والعينة ، يؤدي النيوترون نفس العدد من السبق الدوراني ، في اتجاهين متعاكسين ، في النصف الأول والثاني من الجهاز (لاحظ π الزعانف بين لفائف السبق). ونتيجة لذلك، تبقى حالة الدوران النهائية للنيوترون دون تغيير بالنسبة للدولة الأولية - وهي ظاهرة يشار إليها باسم الدوران صدى (انظر النيوترون الشفاف في الشكل 1A). ومع ذلك ، عندما يتفاعل النيوترون بنشاط مع العينة ، يعدل تبادل الطاقة عدد السبقات الدورانية في النصف الثاني من الجهاز ، مما يؤدي إلى حالة دوران نهائية مختلفة (انظر الشكل 1A). يتم الكشف عن هذا تجريبيا كخسارة في الاستقطاب ، كما سيظهر لاحقا في هذه الورقة. لمزيد من التفاصيل حول تقنية NSE ، يشار إلى القارئ إلى الأوراق الفنيةالمخصصة 42،43،44،45.
هنا، يتم تقديم وصف مبسط لتقديم تقدير تقريبي للطول والجداول الزمنية التي يمكن الوصول إليها مع NSE. يتم تحديد موازين الطول من خلال نطاق عمليات نقل الموجات القابلة للتحقيق، Q = 4π sin ο/λ، حيث 2ο هي زاوية التشتت و λ هو الطول الموجي النيوتروني. يمكن للمرء أن يرى أن يتم تعيين Q من قبل نطاق الطول الموجي ومدى دوران الذراع الثاني للمطياف (انظر الشكل 1A). نموذجي Q-rangeعلى مطياف NSE هو ~0.02-2 Å-146,47, وحتى 0.01-4 Å-1 مع الترقيات الأخيرة48,49, المقابلة لمقاييس المكانية من ~ 1-600 Å. من ناحية أخرى، يتم حساب مقياس الوقت الذي يمكن الوصول إليه من زاوية السبق الكلية (أو المرحلة) التي يكتسبها النيوترون داخل لفائف السبق المغناطيسي، ووجد أن50: 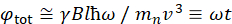 . في هذا التعبير، t هو الوقت فورييه
. في هذا التعبير، t هو الوقت فورييه 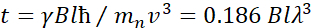 تعريفها بأنها ، حيث
تعريفها بأنها ، حيث 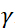 هي نسبة الدوران النيوتروني،
هي نسبة الدوران النيوتروني،  هو طول لفائف،
هو طول لفائف، 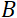 وقوة المجال المغناطيسي لللفائف. تجدر الإشارة إلى أن وقت فورييه هو كمية تعتمد بشكل صارم على هندسة الجهاز ، وقوة المجال المغناطيسي ، والطول الموجي النيوتروني. على سبيل المثال، باستخدام نيوترونات الطول الموجي
وقوة المجال المغناطيسي لللفائف. تجدر الإشارة إلى أن وقت فورييه هو كمية تعتمد بشكل صارم على هندسة الجهاز ، وقوة المجال المغناطيسي ، والطول الموجي النيوتروني. على سبيل المثال، باستخدام نيوترونات الطول الموجي 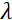 = 8 Å وإعدادات الصك
= 8 Å وإعدادات الصك  = 1.2 متر و
= 1.2 متر و 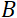 = 0.4 T، يتم حساب وقت فورييه ليكون t ~ 50 ns. تجريبيا، يتم ضبطها الوقت فورييه عن طريق تغيير التيار في لفائف قبل الخراج (أي قوة المجال المغناطيسي) أو باستخدام أطوال موجية نيوترونية مختلفة، مما أدى إلى جداول زمنية NSE نموذجية من ~ 1 PS إلى 100 ns. ومع ذلك، مكنت الترقيات الأخيرة في مطياف NSE الوصول إلى أوقات فورييه أطول، ما يصل إلى ~ 400 ns على مطياف J-NSE-Phoenix في هاينز ماير-ليبنيتز Zentrum51 ومطياف SNS-NSE في مختبر أوك ريدج الوطني48، وما يصل إلى ~ 1000 ns في مطياف NSE IN15 في معهد لو لانجفين (ILL)49.
= 0.4 T، يتم حساب وقت فورييه ليكون t ~ 50 ns. تجريبيا، يتم ضبطها الوقت فورييه عن طريق تغيير التيار في لفائف قبل الخراج (أي قوة المجال المغناطيسي) أو باستخدام أطوال موجية نيوترونية مختلفة، مما أدى إلى جداول زمنية NSE نموذجية من ~ 1 PS إلى 100 ns. ومع ذلك، مكنت الترقيات الأخيرة في مطياف NSE الوصول إلى أوقات فورييه أطول، ما يصل إلى ~ 400 ns على مطياف J-NSE-Phoenix في هاينز ماير-ليبنيتز Zentrum51 ومطياف SNS-NSE في مختبر أوك ريدج الوطني48، وما يصل إلى ~ 1000 ns في مطياف NSE IN15 في معهد لو لانجفين (ILL)49.
وإلى جانب الوصول المباشر إلى طول ديناميات الأغشية ونطاقها الزمني، فإن NSE لديها القدرات الكامنة في حساسية النظائر النيوترونية52. وعلى وجه التحديد، فإن قدرة النيوترونات على التفاعل بشكل مختلف مع نظائر الهيدروجين، وهو العنصر الأكثر وفرة في النظم البيولوجية، تؤدي إلى كثافة مختلفة لطول النيوترونات المتناثرة،34 أو NSLD (أي ما يعادل المؤشر البصري للانكسار50)،عندما يتم استبدال البروتيوم بالديوتريوم. وهذا يمكن من اتباع نهج يعرف باسم التباين التبايني، والذي يستخدم عادة لتسليط الضوء على ميزات غشاء محددة أو إخفاء الآخرين - ويشار إلى السيناريو الأخير على أنه مطابقة التباين. التطبيق المتكرر للتباين / المطابقة هو استبدال الماء (NSLD = -0.56 × 10-6 Å-2)بالماء الثقيل أو D2O (NSLD = 6 .4 × 10-6 Å-2)لتضخيم إشارة النيوترون من الأغشية الدهنية البروتية (NSLD ~ 0 × 10-6 Å-2). هذا النهج فعال للغاية في دراسات بنية الغشاء لأن اختراق D2O في منطقة مجموعة الرأس من الغشاء يسمح بتحديد دقيق لسماكة الغشاء (انظر الشكل 2A، اللوحة اليسرى) وموقع المجموعات الفرعية المختلفة للدهون عندما يتم تطبيق نماذج أكثر تطورا53،54. تسلط هذه الورقة الضوء على بعض الأمثلة على استخدام التباين في دراسات الديناميكيات الجماعية في الأغشية المحاكاة الحيوية وميزات الأغشية المختارة.
هنا ، تتجلى فعالية NSE في توفير رؤى فريدة في خصائص الأغشية الديناميكية والوظيفية من خلال أمثلة ملموسة لدراسات NSE على أنظمة أغشية الدهون النموذجية والوثيقة الصلة بيولوجيا مع التركيز على ديناميكيات مقياس المتوسط في الأغشية القائمة بذاتها ، في شكل تعليق ليبوسومي. بالنسبة لقياسات NSE لديناميكيات الأغشية داخل الطائرة ، يشار إلى القارئ إلى منشورات مخصصة حول التحليل الطيفي للنيوترونات الدورانية الصدى (GINSES)55و56 ودراسات أخرى لمداخن الأغشية متعددة اللاميلار المنحازة57و58و59و60.
للبساطة ، تسلط هذه الورقة الضوء على ثلاثة مخططات مختلفة من الديوتريشن الغشاء يتضح على تشكيل المجال مدروسة جيدا ، أو فصل المرحلة، نظام ثنائي الطبقات الدهون من 1،2-dimyristoyl-sn-glycero-3-فوسفوتشولين (DMPC) و 1،2-distearoyl-sn-glycero-3-فوسفوتشولين (DSPC) خلائط61،62. وتتميز الدهون اثنين من عدم تطابق في طول سلسلة الهيدروكربونات (14 الكربونات / الذيل في DMPC مقابل 18 الكربون / الذيل في DSPC) ودرجة الحرارة انتقال هلام السائل (TM، DMPC = 23 درجة مئوية مقابل Tم، DSPC = 55 درجة مئوية). وهذا يؤدي إلى فصل المرحلة الجانبية في DMPC: DSPC الأغشية في درجات الحرارة بين درجات الحرارة الانتقالية العليا والسفلى من الخليط63. يتم اختيار مخططات الديوتر التي تم النظر فيها هنا لإظهار الأنماط الديناميكية المختلفة التي يمكن الوصول إليها في قياسات NSE على الأغشية الدهنية ، وهي تقلبات الانحناء ، وتقلبات السماكة ، وتقلبات الانحناء / السماكة الانتقائية للمجالات الجانبية. يتم الإبلاغ عن جميع التراكيب الدهنية لDMPC: DSPC الطبقات الثنائية المعدة في جزء الخلد من 70:30، وذلك باستخدام المتغيرات المتاحة تجاريا بروتيات و perdeuterated من DMPC وDSPC. وتستند جميع خطوات إعداد العينة على 4 مل من تعليق الدهون، في D2O، مع تركيز الدهون من 50 ملغم / مل، لكتلة الدهون الإجمالية منتوت M= 200 ملغ لكل عينة.
Protocol
1. مخطط الديوتريشن المطلوب للتجربة
- لقياسات تقلبات الانحناء، قم بإجراء ليبوسومات بروتيات بالكامل في D2O (D 99.9٪) أو D2O-buffer (على سبيل المثال، مخزن الفوسفات المؤقت المعد مع D2O بدلا من H2O). استخدام DMPC بروتيات بالكامل (C36H72NO8P) و DSPC (C44H88NO8P) مع
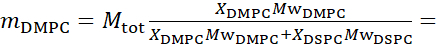 133.4 ملغ, حيث XDMPC و XDSPC هي كسور الخلد من DMPC و DSPC، وهنا تعيين إلى 0.7 و 0.3، على التوالي، وMODMPC وMODSPC هي الأوزان الضرس التي قدمها 677.9 غرام / مول و 790.1 غرام / مول، على التوالي. وبالمثل، MDSPC = 66.6 ملغ. هذا المخطط الديوتريشن يزيد من التباين المتناثر بين الغشاء (NSLD ~ 0 × 10-6 Å-2)والعازل deuterated (NSLD ~ 6.4 × 10-6 Å-2)ويضخم الإشارة من التموج الغشاء (انظر الشكل 2A اللوحة اليسرى).
133.4 ملغ, حيث XDMPC و XDSPC هي كسور الخلد من DMPC و DSPC، وهنا تعيين إلى 0.7 و 0.3، على التوالي، وMODMPC وMODSPC هي الأوزان الضرس التي قدمها 677.9 غرام / مول و 790.1 غرام / مول، على التوالي. وبالمثل، MDSPC = 66.6 ملغ. هذا المخطط الديوتريشن يزيد من التباين المتناثر بين الغشاء (NSLD ~ 0 × 10-6 Å-2)والعازل deuterated (NSLD ~ 6.4 × 10-6 Å-2)ويضخم الإشارة من التموج الغشاء (انظر الشكل 2A اللوحة اليسرى). - لقياس ديناميات الانحناء من ميزات الغشاء الجانبي حدد، على سبيل المثال، ديناميات مصفوفة في المرحلة الفاصلة DMPC: DSPC الأغشية، استخدام DMPC بروتيات (C36H72NO8P) وduterated, DSPC-d83 (C44H5NO8PD83, Mw 873.7 g/mol), مثل أن MDMPC = 128.8 ملغ و MDSPC-d83 = 71.2 ملغ. يقلل مخطط الديوتر من التشتت من المجالات الغنية DSPC غير المرغوب فيها ، مما يتيح قياسات انتقائية لتقلبات الانحناء من المصفوفة الغنية DMPC (انظر الشكل 2B الأوسط).
ملاحظة: للعثور على الديوتر الدهون الأمثل المطلوبة لنظام مطابقة التباين محددة، والاستفادة من الآلات الحاسبة المتاحة على شبكة الإنترنت كثافة طول التشتت (SLD)، مثل تلك التي وضعها مركز NIST للبحوث النيوترونية64. وقد تم تجهيز هذه الواجهات على شبكة الإنترنت مع أدوات سهلة الاستخدام لحساب سهل من SLD من الدهون مع درجات مختلفة من الديوتريشن، فضلا عن أن من الخلائط الدهنية. - بالنسبة لقياسات NSE لمتوسط تقلبات سماكة الأغشية (بدون تباين الجانبي)، استخدم المتغيرات التيل من الدهون المكونة، أي، DMPC-d54 (C36H18NO8PD54, 732.3 g/mol) و DSPC-d70 (C44H18NO8PD70, 860.1 غرام/مول)35,38, بحيث MDMPC-d54 = 133.0 ملغ و مDSPC-d70 = 67.0 ملغ. هذا المخطط التباين(الشكل 2A، لوحة الحق) تضخيم إشارة التشتت من مجموعات الرأس الدهون (NSLD ~ 4.5 × 10-6 Å-2)عن طريق مطابقة التباين بين ذيل المجموعة (NSLD ~ 6.4 × 10-6 Å-2)إلى العازلة deuterated تمكين الكشف عن التقلبات في سمك الغشاء.
- لدراسات تقلب سمك مقصورات غشاء مختارة، على سبيل المثال، مصفوفة DMPC الغنية، استخدم نفس الاستراتيجية الموضحة في الخطوة 1.2 عن طريق استبدال الدهون DMPC بروتيات مع النظير الذيل deuterated، أي DMPC-d54، بحيث المجالات الغنية DSPC هي على النقيض من ذلك إلى المخزن المؤقت deuterated وإشارة التشتت الأولية هي من منطقة المجموعة الرئيسية للمصفوفة DMPC الغنية الذيل deuterated.
2. إعداد تعليق الدهون للقذف
- حساب كتلة كل مكون في العينة، اعتمادا على تكوين العينة. وكقاعدة عامة، لعينات مع مكونات جزيئية متعددة، يتم إعطاء كتلة مكون من كتلة الأضراس لها، ميغاواطi، مرجحة من قبل كسر الخلد، Xi،وتطبيعها على جميع المكونات بحيث:
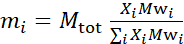 حيث Mتوت هو الكتلة الإجمالية، تعيين هنا إلى 200 ملغ. انظر المثال أعلاه لDMPC-DSPC ثنائيات الدهون مع مخططات deuteration مختلفة.
حيث Mتوت هو الكتلة الإجمالية، تعيين هنا إلى 200 ملغ. انظر المثال أعلاه لDMPC-DSPC ثنائيات الدهون مع مخططات deuteration مختلفة. - باستخدام شبه microbalance الرقمية، تزن الجماهير المحسوبة من الدهون (وغيرها من مكونات العينة، على سبيل المثال، البروتينات والجسيمات النانوية، الخ) وإضافتها إلى قارورة أو قارورة مستديرة القاع - تذكر أن تزن القارورة أو القارورة مسبقا. أضف 1 مل من المذيبات لإذابة المكونات المزنة عن طريق الخلط يدويا داخل غطاء محرك السيارة. لعينات الدهون النقية، استخدم الكلوروفورم أو الإيثانول. بالنسبة للعينات ذات المكونات الإضافية غير الدهنية (مثل الجسيمات النانوية)، اختر مذيبا شائعا يفرق جميع المكونات.
- لكميات الدهون الصغيرة (<10 ملغ)، وإعداد محلول الأسهم وماصة الحجم المطلوب في الخليط.
ملاحظة: لا تضيف كميات مفرطة من المذيبات لأنها سوف تبطئ بشكل كبير من خطوة تجفيف المذيبات الموضحة أدناه.
- لكميات الدهون الصغيرة (<10 ملغ)، وإعداد محلول الأسهم وماصة الحجم المطلوب في الخليط.
- جفف محلول الدهون، داخل غطاء محرك السيارة، عن طريق تدفق غاز خامل برفق (على سبيل المثال، النيتروجين، الأرجون) في القارورة أثناء تدوير القارورة ببطء بزاوية. الحفاظ على قوارير في وضع يميل لخلق فيلم رقيقة من الدهون المجففة على جدران القارورة، والتي سوف تسمح للتجفيف حتى. ضع القارورة بشكل متقطع في حمام مائي عند 35 درجة مئوية للتحايل على التبريد بوساطة التبخر ، مما سيؤدي إلى إبطاء تبخر المذيبات.
- ضع القنينات بين عشية وضحاها في فرن فراغ في ~ 35 درجة مئوية لإزالة المذيب المتبقي بالكامل. بالنسبة للدهون غير المشبعة، قم بتطهير الفراغ باستخدام غاز خامل لتقليل الأكسدة.
- لضمان إزالة المذيبات بالكامل، قم بوزن القارورة بعد تجفيف الدهون وتأكد من عدم وجود كتلة زائدة تتجاوز الكميات المقاسة من المواد. القيام بذلك عن طريق طرح كتلة القارورة من الكتلة المقاسة بعد التجفيف. إذا كان هناك كتلة الزائدة، وتجفيف العينة تحت فراغ لمدة 6 ساعة أخرى. كرر هذه العملية حسب الحاجة.
- هيدرات الفيلم الدهون مع 4 مل من D2O أو D2O-العازلة للحصول على تركيز الدهون من 50 ملغم / مل. بالنسبة للدهون ذات درجات الحرارة الانتقالية العالية، مثل مخاليط DMPC-DSPC، قم بتسخين العازل إلى أعلى درجة حرارة الانتقال (60 درجة مئوية) لضمان الخلط حتى.
ملاحظة: نظرا لأن تجارب NSE تتطلب أحجام عينات كبيرة نسبيا (~4 مل)، فكر في ترطيب العينة باستخدام نصف المخزن المؤقت المطلوب، أي 2 مل، لتقليل عدد البثقات لكل عينة (انظر القسم 3). في هذه الحالة، إضافة النصف المتبقي من البثق وظيفة المخزن المؤقت. لاحظ أن قدرة المحاقن المستخدمة في البثق تقتصر على 1 مل. وبالتالي، فإن الترطيب مع 4 مل من العازلة يتطلب أربع مجموعات من البثق. - دوامة مزيج محلول الدهون رطب حتى يتم حل الفيلم الدهون تماما ولم يعد مرئيا على جدران القارورة. في هذه المرحلة، تشكل الدهون المائية الحويصلات متعددة اللاميلار ومداخن متعددة اللميلار بحجم ميكرون ويظهر التعليق أبيض حليبي.
- لتسهيل كسر مداخن الدهون والحد من تعدد المصابيح، قم بإجراء خمس دورات تجميد/إذابة عن طريق وضع قارورة محلول الدهون المرطب في ثلاجة الصف المختبر (ويفضل أن تكون -80 درجة مئوية الفريزر) حتى يتم تجميدها بالكامل ومن ثم نقل القارورة إلى حمام ماء 35 درجة مئوية حتى يذوب محلول الدهون بالكامل. دوامة الحل المذاب حتى متجانسة. كرر أربع مرات أخرى.
ملاحظة: بدلا من ذلك، يمكن إعداد حمام جليدي جاف للتجميد السريع عن طريق الجمع بين الأسيتون والجليد الجاف.
3. قذف محلول الدهون المرطب
- تجميع الإعداد البثق باستخدام غشاء البولي بين اثنين من يدعم الغشاء وإضافة اثنين من مرشحات الورق على كل جانب لتوفير دعم إضافي. استخدم غشاء بولي كربونات بحجم مسام يطابق حجم الدهون المستهدف (أحجام المسام الشائعة لتجارب NSE هي 50 نانومتر و 100 نانومتر - عادة ، تسمح ليبوسومات قطرها 100 نانومتر بتقلبات غشاء أقل تقييدا ، ولكن يمكن استخدام دهون أصغر 50 نانومتر لدراسات الانحناء). تأكد من أن غشاء البولي هو امتدت تماما قبل الانتهاء من التجميع وتشديد غلاف البثق الخارجي.
- هيدرات غشاء البولي عن طريق تمرير ~ 0.3 مل من D2O أو D2O-العازلة عدة مرات من خلال تجميع الغشاء باستخدام المحاقن الزجاجية محكم. استخدم نفس المخزن المؤقت المستخدم في إعداد العينة. اتركه لمدة 10 دقائق على الأقل ، ثم امتص المخزن المؤقت تماما قبل إدخال العينة.
- ملء حقنة الغاز 1 مل ضيق مع محلول الدهون المعدة وإدراجها في نهاية واحدة من جهاز البثق. ثم أدخل حقنة فارغة في الطرف المقابل. بمجرد توصيل المحاقن بتجميع الطارد ، ضعها في كتلة البثق.
- إذا كانت هناك حاجة إلى درجات حرارة مرتفعة للقذف ، كما هو الحال في الدهون المشبعة ذات درجات حرارة الانتقال العالية (على سبيل المثال ، DSPC ، Tm = 55 درجة مئوية) ، سخن كتلة تسخين البثق فوق درجة حرارة انتقال الدهون (على سبيل المثال ، 60 درجة مئوية) ، عن طريق وضع كتلة التدفئة على طبق ساخن أو باستخدام حمام الدورة الدموية كما هو موضح في الشكل 3A.
ملاحظة: هذه الخطوة حاسمة لضمان خلط متجانسة من الدهون وتجنب ممارسة ضغط شديد أثناء البثق، والتي يمكن أن تمزق غشاء البولي. لعينات الدهون ذات درجات الحرارة الانتقالية المنخفضة (<25 درجة مئوية)، قم بإجراء البثق في درجة حرارة الغرفة. - لقذف محلول الدهون، قم بإرفاق مجموعة الطارد بمضخة حقنة قابلة للبرمجة بإطار من الألومنيوم/الصلب كما هو موضح في الشكل 3A. للقذفات التي يتم التحكم فيها بدرجة الحرارة، أضف قاعدة مقذوفة مصممة خصيصا مع قناة سائلة والتصق بحمام مائي متداول.
- برمجة مضخة حقنة لأداء دورات البثق 15-20 بعد دليل الشركة المصنعة. عندما مقذوف، يتغير لون محلول الدهون من أبيض حليبي إلى أزرق أوبال شفاف(الشكل 3B، C)،مما يشير إلى حجم ليبوسومي نهائي أصغر من الطول الموجي للضوء المرئي، كما هو متوقع. لنوع مضخة الحقنة الموضحة في الشكل 3A، اتبع الخطوات أدناه.
- ابدأ بضبط إعدادات المضخة. اضغط باستمرار على زر Rate وأدخل معدل البثق (50.99 مل/ساعة)، ثم اضغط على زر القطر وأدخل قطر المحقنة (4.606 مم). استخدم الأسهم لأعلى تحت كل رقم على الشاشة لتغيير قيمة الأرقام.
- ضع مجموعة البثق مع حقنة العينة إلى اليمين (انظر الشكل 3A). اضغط على الزر سحب حتى يتم تشغيل ضوء السحب. اضغط على البدء وانتظر حتى تستغني العينة عن المحقنة اليسرى (الفارغة).
- اضغط على زر إيقاف قبل أن تكون حقنة العينة (اليمنى) فارغة تماما. تسجيل وحدة التخزين الاستغناء واستخدامها في برنامج دورة البثق. اضغط باستمرار على زر Rate حتى تظهر المرحلة 1 (PH:01) على الشاشة. اضغط على زر مستوى الصوت لإدخال وحدة التخزين التي تم توزيعها المسجلة سابقا. في هذه المرحلة، تأكد من أن ضوء السحب مطفأ – وهذا يوزع العينة في الاتجاه الصحيح.
- اضغط على زر Rate مرة أخرى واستخدم السهم الموجود في أقصى اليمين للوصول إلى المرحلة 2 (PH:02). اضغط على Volume لإدخال نفس قيمة وحدة التخزين التي تم توزيعها المسجلة سابقا. في هذه المرحلة، اضغط على زر السحب حتى يتم تشغيل ضوء السحب - وهذا يوزع العينة إلى اليسار.
- لتكرار هذه الدورة، اضغط على زر Rate مرة أخرى واستخدم السهم الموجود في أقصى اليمين للوصول إلى المرحلة 3 (PH:03). اضغط على زر وحدة التخزين حتى يظهر LP:SE على الشاشة ثم قم بتعيينه إلى 20. هذا هو عدد الحلقات أو يكرر أن المضخة سوف تؤدي. وأخيرا، اضغط على زر Rate (معدل)، والوصول إلى المرحلة 4 (PH:04)، ثم اضغط على زر مستوى الصوت للوصول إلى وظيفة Stop . تم إعداد المضخة الآن للقذف الآلي.
- اضغط على بدء لبدء دورة البثق.
- إفراغ المحقنة التي تحتوي على تعليق الدهون المقذوف في قارورة نظيفة والاستعداد للتخزين أو القياسات. لعينات الدهون ذات درجة حرارة ذوبان عالية، قم بتخزين العينة فوق مرحلة انتقال السوائل حتى يتم قياسها. خلاف ذلك، والحفاظ على عينات في درجة حرارة الغرفة.
- لا تجميد عينات مقذوف كما تجميد سوف يسبب الحويصلات لتنفجر (تعليق سوف تتحول حليبي أبيض مرة أخرى).
4. قياسات NSE للعينة (العينات) وتقليل البيانات التي تم جمعها
- قبل تجربة NSE، قم بتوصيف عينة الليبوزوما التي تم قذفها من الخطوة 3.7 باستخدام الطرق المتاحة لضمان جودة العينة الكافية. يتم تضمين قائمة بأساليب الشعوذة المحتملة التي يمكن استخدامها لتقييم جودة التعليق الليبوسومالي لتجارب NSE ، على سبيل المثال ، توزيع الحجم ، متعدد المصابيح ، بنية الغشاء الجانبي ، في قسم المناقشة.
- تحديد إعدادات نطاق Q والأجهزة المطابقة المطلوبة للتجربة. لثني قياسات صلابة من الطبقات ثنائية الدهون، استخدم مجموعة Q من ~(0.04 - 0.2) Å-1. لدراسات تقلبات سماكة الأغشية، استخدم نطاق Q من ~(0.04 - 0.2)Å-1 المقابل لسمك الغشاء35،66،67.
ملاحظة: مناقشة الإعداد التجريبي مع عالم الأجهزة قبل بدء التجربة. وكما ذكر سابقا، فإن توصيف SANS للعينة ضروري، خاصة إذا لم تتوفر معلومات مسبقة عن إشارة التشتت، كما هو الحال في الأغشية التي تم خلعها بشكل انتقائي. بدلا من ذلك، قم بتشغيل قياسات ثابتة (تعرف أيضا باسم الحيود) على نطاق Q محدود على أداة NSE، مع التحذير من أن مثل هذه القياسات تستغرق وقتا أطول بكثير مقارنة ب SANS. - باستخدام حقنة أو ماصة نقل، قم بتحميل التعليق (التعليقات) الدهنية المنقذوفة في خلايا العينة المعينة المتاحة في خطوط الحزم NSE. لاحظ أن خلايا عينة NSE القياسية تأتي بسماكة 1 و2 و3 و4 مم. اختر سمك الخلية بطريقة لتحسين إشارة التشتت مع الحفاظ على إشارة الخلفية غير المتماسكة إلى كثافة معقولة.
ملاحظة: كقاعدة عامة، استخدم خلايا العينة ذات الباثلينغث 1 أو 2 مم للليبوسومات المتحامية في العازلة المذابة - يمكن أن تؤدي الخلايا الأكثر سمكا إلى تأثيرات تشتت متعددة يصعب تصحيحها. بالنسبة للليبوسومات ذات المستويات الأعلى من الديوترات (على سبيل المثال، الليبوسومات المطابقة لتباين الذيل أو الليبوسومات غير المميترية ذات المنشورات أحادية البروتيات)، فكر في استخدام خلية عينة أكثر سمكا (على سبيل المثال، 3 أو 4 ملم باثلينغث) لتعزيز إحصاءات العد إذا كانت العينة متوفرة بكميات أكبر - في بعض الأحيان قد يكون هذا باهظ التكلفة. - قم بإعداد خلية عينة متطابقة للمخزن المؤقت. استخدم نفس العازلة كما هو الحال في تعليق liposomal. القياسات على المخزن المؤقت ضرورية لتطبيع الكثافة وتصحيحات الخلفية (BKG).
- ضع خلية العينة (خلاياها) في حامل العينة لمطياف NSE، وابرنامج تشغيل القياس، وجمع بيانات الصدى. التشاور مع عالم الصك حول برمجة القياسات إذا كان مستخدم NSE لأول مرة.
- إجراء مجموعتين إضافيتين من القياسات اللازمة للحد من البيانات: القرار (R) ونقل (T) القياسات.
- إجراء قياس الدقة(R)على مرجع تشتت مرن (مثل الكربون) — ليتم تشغيله في نفس الإعدادات؛ أي نفس الملوحة و فورييه مرات العينة وقياسات العازلة.
- إجراء قياسات الإرسال(T)على العينة والعازل لحساب كثافة شعاع النيوترون المرسل (انظر الخطوة 4.9 أدناه). ويحسب الإرسال كنسبة من عدد النيوترونات من العينة أو المخزن المؤقت مقسوما على تعداد النيوترون لشعاع مفتوح (أي مع موضع عينة فارغ).
- استخدم برنامج تقليل البيانات المخصص لمطياف NSE الذي يتم إجراء القياسات عليه لتقليل البيانات المجمعة.
ملاحظة: قد تستخدم مطيافات مختلفة برامج مختلفة أو واجهات مستخدم مختلفة. وفيما يلي مثال على خفض البيانات NSE باستخدام تحليل البيانات وبيئة التصور (ديف)68 برنامج مكتوب خصيصا لمطياف NSE في مركز NIST لأبحاث النيوترون.- افتح برنامج DAVE وحدد تقليل بيانات NSE من قائمة تقليل البيانات. ستظهر عدة نوافذ منبثقة.
- تحميل ملفات البيانات عبر قيم Q مختلفة باستخدام فتح ملفات .echo من قائمة الملفات. تتوافق هذه الملفات مع ملفات البيانات الأولية مع إشارات صدى الدوران ولها ملحق .echo في اسم الملف. بمجرد اكتمال تحميل الملف، ستظهر الملفات ضمن مجموعات البيانات المتوفرة.
- انقر بزر الماوس الأيمن على الملف المحدد وحدده وفقا للقياس الذي يتوافق معه؛ أي، نموذج أو خلية (لخلية فارغة أو المخزن المؤقت) أو الدقة.
- قم بتجميع كاشف pixles في 2 × 2 لتحسين نسبة الإشارة إلى الضوضاء باستخدام علامة التبويب مجموعة البيانات. تطبيق binning نفس على كافة الملفات; أي الدقة والخلية والعينة.
- فحص البيانات على جميع مجموعات بكسل وإخفاء تلك مع إشارات الفقراء (انظر الشكل 4B)عن طريق الضغط على مفتاح م على لوحة المفاتيح. اضغط Enter للوصول إلى نافذة منبثقة لتطبيق القناع نفسه على جميع مرات فورييه أو مرات فورييه اللاحقة. ويمكن تطبيق هذا أيضا على وحدات البكسل الفردية في أي وقت أثناء تقليل البيانات. سوف بكسل ملثمين تتحول إلى اللون الأخضر.
- تأكد من أن البيانات التي تم جمعها في شكل إشارة صدى، أي وظيفة جيب ال كوين من حيث المرحلة الحالية، على كل بكسل كاشف (انظر الشكل 4A).
ملاحظة: يتناسب تيار المرحلة مع زاوية السبق للدوران النيوتروني؛ ومن ثم، فمن الشائع أن تمثل المرحلة الحالية كزاوية مرحلة كما هو مبين في الشكل 4A. وبالنسبة للقياسات على المصادر النابضة، يتم تطبيق وقت إضافي لحسابات الطيران على البيانات للحصول على إشارات الصدى كدالة للطول الموجي النيوتروني الحادث داخل نبضة نيوترونية. - ابدأ بتركيب ملف الدقة. حدد ملف دقة من قائمة الملفات التي تم تحميلها وانقر بزر الماوس الأيمن على الملف. حدد احتواء العمليات: احتواء أصداء (الدقة) من القائمة المنبثقة.
- تأكد من أن نوبات إشارات الصدى تسفر عن عدد من المعلمات المناسب، بما في ذلك المعلمة، A،المطلوبة في الخطوة 4.8. يتم تنفيذ النوبات تلقائيا باستخدام التعبير التالي.
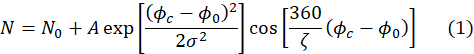
هنا، ζ هي فترة إشارة الصدى (أي وظيفة جيب ال كوين في الشكل 4A)،σ هو عرض المغلف الغاوسي الذي يحدده متوسط الطول الموجي وانتشار الطول الموجي للشعاع النيوتروني الحادث، Φc هو تيار المرحلة، وΦ0 هي نقطة الصدى التي تعتمد على مسار الحقل الذي تعاني منه النيوترونات50. يتم ترميز المعلومات المادية حول العينة في السعة، A،من دالة جيب ال كوين في المعادلة (1).
ملاحظة: عرض المغلف Gaussian يستند إلى قيم محددة مسبقا بواسطة عالم الأجهزة ولا يجب تغيير. البارامترات الأخرى هي متغيرات مثبتة على إشارة صدى محددة فوق كل بكسل. - فحص نتائج تناسب عن طريق النقر على كل بكسل لإظهار المعلمات المناسب الناتجة، ونوعية نوبة، ومتوسط الانحراف المربع للنوبة. لفحص الخطأ المقترن بكل معلمة مناسبة على الكاشف بالكامل، حدد خيارات الصورة ثم حدد المعلمة المناسبة ذات الاهتمام. سيؤدي ذلك إلى إنشاء خريطة بقيمة المظلي المناسب فوق كل بكسل. انقر بزر الماوس الأيمن على صورة الكاشف. ستظهر نافذة منبثقة تعرض خريطة شريط الأخطاء للمعلمة المناسبة المحددة.
- إذا كان الاحتواء على بكسل معين غير مرض (على سبيل المثال، تناسب الببغاء مع أشرطة خطأ كبيرة)، إعادة تجهيز الإشارة على أن بكسل محددة. حدد هذا البكسل،واضغط على علامة التبويب ملائم، ثم اضغط على Fit Pixel. إدخال معلمات بدء جديدة للمرحلة(Φ0)والفترة (ζ) في علامة التبويب المناسب للحصول على نوبة مرضية أكثر.
ملاحظة: من المفيد رسم المرحلة المجهزة كدالة ل Fourier Time. للقيام بذلك، انتقل إلى نافذة المؤامرة الرئيسية وحدد صالح المرحلة ضد فورييه الوقت. يجب أن تكون هذه المؤامرة سلسة ومستمرة. فحص الانقطاعات في هذه المؤامرة وإعادة تجهيز بكسل التي تتوافق معها.
- تقليل ملف نموذج أو الخلية عن طريق تحديد الملف المطابق من قائمة الملفات المحملة والمسمي.
- فحص كافة وحدات البكسل وإخفاء تلك مع إحصائيات سيئة كما هو موضح في الخطوة 4.7.5.
- انقر بزر الماوس الأيمن فوق الملف وحدد عمليات احتواء: استيراد مراحل (عينة، الخلية). هذا استيراد المراحل وقناع تطبيق من ملف الدقة.
- احتواء إشارات الصدى باستخدام نفس الإجراء الموضح من قبل لملف الدقة (الخطوات 4.7.8-4.7.10). في المناسب Sample و Cell الملفات، لا تقم بتغيير قيم الفترة ونقطة مرحلة صدى المستوردة من الحل يناسب. تعتمد هذه المعلمات على إعدادات مفيدة ولا يجب أن تختلف مع العينات.
- قبل الشروع في تقليل البيانات، أدخل مركز الحزمة لكافة ملفات البيانات. حدد ملف البيانات، ثم انتقل إلى علامة التبويب عام وأدخل قيم مركز الحزم X وY. يتم تسجيل هذه القيم أثناء التجربة.
- بمجرد اكتمال النوبات لملفات العينة والخلية والدقة، احسب دالة التشتت الوسيطة التي سيتم استخدامها لاحقا في تحليل البيانات وتفسيرها. للقيام بذلك، انقر بزر الماوس الأيمن على ملف عينة ليتم تخفيضها من قائمة الملفات المجهزة، وحدد حساب I(Q) من القائمة المنبثقة. ستظهر نافذة مع خيارات الإدخال لملفات الدقة والخلية (أي المخزن المؤقت) وعدد أقواس Q (راجع الخطوة 4.9). بعد إدخال جميع المعلومات المطلوبة، اضغط على الزر موافق. ستظهر النتائج في إطار جديد.
ملاحظة: يتم تنفيذ تقليل البيانات وفقا للمعادلة التالية للحصول على الدالة التشتت المتوسطة تسويتها69.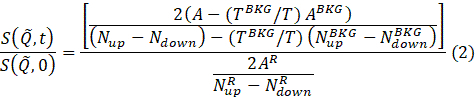
حيث t هو وقت فورييه، Nصعودا و Nأسفل هي التهم النيوترونية في تكوينات غير تدور الوجه وتدور الوجه (تقاس مع π/2-زعانف قبالة و π-زعنفة قبالة وعلى، على التوالي)، وsuperscripts، BKG و R،تتوافق مع قياسات الخلفية والقرار، على التوالي، كما هو محدد في الخطوتين 4.4 و 4.6. لاحظ أن استقطاب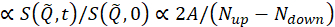 الحزمة ، وبالتالي يتغير في حالة الدوران بسبب تبادل الطاقة بين النيوترون والعينة يتم اكتشافه على أنه انخفاض في الاستقطاب (من الوحدة).
الحزمة ، وبالتالي يتغير في حالة الدوران بسبب تبادل الطاقة بين النيوترون والعينة يتم اكتشافه على أنه انخفاض في الاستقطاب (من الوحدة).
- وأخيرا، قم بتجميع وحدات بكسل الكاشف في أقواس Qكما هو موضح في الشكل 4B للحصول على Q-التبعيةلوظيفة التشتت الوسيطة العادية، S(Q،t) / S(Q, 0). ويشار إلى ذلك تقنيا باسم تجميع البيانات وينبغي أن يتم بحكمة، أي مع مراعاة إحصاءات العد من العينة والانحراف المعياري المتوقع للبيانات على وحدات البكسل المجمعة.
- للنثر بقوة العينات، وتقسيم كاشف إلى أكثر Q-الأقواس مع الحفاظ على أشرطة خطأ معقولة على وظيفة التشتت المتوسطة الناتجة، S(س،ر) / S(س، 0). ينتج عن هذا نقاط بيانات Q أكثر وهو مهم لإجراء تحليل البيانات الموضح أدناه. كن على علم أنه بالنسبة للعينات المتناثرة بشكل ضعيف ، يؤدي binning المفرط إلى إشارات تسوس ضعيفة ، أي أشرطة خطأ كبيرة على S(Q،t) / S(Q، 0) ، مما قد يؤدي إلى شكوك كبيرة.
5. تحليل البيانات وتفسيرها
- تناسب وظائف التشتت المتوسطة العادية، S(Q،t) / S(Q، 0) ، التي تم الحصول عليها من تقليل البيانات أعلاه إلى وظيفة أسية ممتدة مع أس ممتد من 2/370.
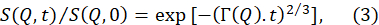
ملاحظة: مثال على هذه اللائم متوفر في الشكل 5B. يناسب S(Q,t) / S(Q,0) إلى المعادلة (3) ينتج عن معدلات الاسترخاء المعتمدة على Q Γ(Q). - رسم Γ(Q)كدالة Q وتناسب نموذجا مناسبا لاستخراج معلمات الغشاء ذات الصلة.
النتائج
عادة ما يتم إجراء دراسات NSE الوصول إلى تقلبات الانحناء على مدى Q من ~ (0.04 - 0.2) Å-1. يتوافق نطاق Q هذا مع مقاييس الطول المتوسطة بين سمك الغشاء ونصف قطر الليبوزوما، حيث تهيمن ديناميكيات الانحناء. يمكن أن يمنح القياس عبر نطاق Q الموسع إمكانية الوصول إلى أوضاع ديناميكية إضافية، بما في ذلك الان...
Discussion
NSE هي تقنية قوية وفريدة من نوعها في قياس الديناميات التنظيرية للأغشية الدهنية في ظل ظروف مختلفة. يعتمد الاستخدام الفعال ل NSE على جودة العينة والتباين النيوتروني ونطاق الديناميكيات التي يمكن الوصول إليها والتي يمكن بحثها لعينة معينة. وبالتالي، هناك العديد من الخطوات الحاسمة المطلوبة لإجر?...
Disclosures
ولا يعلن صاحبا البلاغ عن أي تضارب في المصالح وليس لديهما ما يكشفان عنه.
Acknowledgements
ر. أشقر يشكر م. ناغاو، ل. ر. Stingaciu ، وP. Zolnierczuk لكثير من المناقشات المفيدة ومساعدتهم المتكررة مع التجارب NSE على خطوط الحزم الخاصة بهم. يعترف المؤلفون باستخدام مطياف صدى الدوران النيوتروني في NIST و ORNL. ويدعم مطياف NSE في NIST من قبل مركز تشتت النيوترونات عالية الدقة، وهي شراكة بين المعهد الوطني للمعايير والتكنولوجيا والمؤسسة الوطنية للعلوم بموجب الاتفاق رقم . DMR-1508249. ويدعم مطياف NSE في مصدر النيوترون Spallation ORNL من قبل شعبة مرافق المستخدمين العلميين، مكتب علوم الطاقة الأساسية، وزارة الطاقة الأمريكية. يتم إدارة مختبر أوك ريدج الوطني من قبل UT-Battelle، ذ.م.م بموجب عقد وزارة الكهرباء الأمريكية رقم دي-AC05-00OR22725.
Materials
| Name | Company | Catalog Number | Comments |
| Chloroform (biotech grade) | Sigma Aldrich | 496189 | Biotech. grade, ≥99.8%, contains 0.5-1.0% ethanol as stabilizer |
| Circulating water bath | Julabo | SE-12 | Heating Circulator with smart pump, programmable temperature settings, and external sensor connection for measurement and control |
| Deuterium Oxide | Cambridge Isotopes Laboratories | DLM-4 | Deuterated water; Heavy water (D2O) (D, 99.9%) |
| Digital Semi-Microbalance | Mettler Toledo | MS105 | Semi-micro balance with 120 g capacity, 0.01 mg readability, high resolution weighing cell, ergonomic doors, and pipette-check application |
| Ethanol (molecular biology grade) | Sigma Aldrich | E7023 | 200 proof ethanol for molecular biology applications |
| Glass Pipets | VWR | 36360-536 | Disposable Soda Lime glass Pasteur pipets |
| Glass Vials | Thermo Scientific | B7990-1 | Borosilicate glass vials with PTFE/Silione septum caps |
| Lab grade freezer | Fisher Scientific | IU2886D | Ultra-low temprature freezer (-86 to -50 C) for long-term storage of lipids and proteins |
| Lipids (protaited or perdeuterated) | Avanti Polar Lipids | varies by lipid | Lipids can be purchased from Avanti in powder form or in a chloroform solution with the required amounts and deuteration schemes. |
| Millipore water purifier | Millipore Sigma | ZRQSVP3US | Direct-Q® 3 UV Water Purification System which deliver both pure and ultrapure water with a built-in UV lamp to reduce the levels of organics for biological applications |
| Mini Extruder Set | Avanti Polar Lipids | 610020 | Mini-extruder set includes mini-extruder, heating block, 2 GasTight Syringes, and 2 O-rings, Polycarbonate Membranes, and Filter Supports |
| Quick Connect Fittings | Grainger | 2YDA1 and 2YDA7 | Push-button tube fittings for QuickConnect water circulation applications, e.g. high temperature vesicle extrusion |
| Syringe Pump | SyringePump.com | New Era-1000 | Fully programmable syringe pump for infusion and withdrawal; programs up to 41 pumping phases with adjustable pumping rates, dispensed volumes, and extrusion cycles |
| Ultrasonic bath | Fisher Scientific | CPX2800 | Temperature controlled ultra sonic bath with programmable functionality for degassing and ultrasonic applications |
| Vacuum Oven | Thermo Scientific | 3608 | 0.7 cu ft vaccum oven with built-in-high-limit thermostat guards against overheating |
| Vortex Mixer | Fisher Scientific | 02-215-414 | Variable speed, analog control that allows low rpm start-up for gentle shaking or high-speed mixing for vigorous vortexing of samples |
References
- Singer, S. J., Nicolson, G. L. The fluid mosaic model of the structure of cell membranes. Science. 175 (4023), 720-731 (1972).
- Andersen, O. S., Koeppe, R. E. Bilayer thickness and membrane protein function: an energetic perspective. Annual Review of Biophysics and Biomolecular Structure. 36, 107-130 (2007).
- Lundbæk, J. A., Collingwood, S. A., Ingólfsson, H. I., Kapoor, R., Andersen, O. S. Lipid bilayer regulation of membrane protein function: gramicidin channels as molecular force probes. Journal of The Royal Society Interface. 7 (44), 373-395 (2010).
- Bradley, R. P., Radhakrishnan, R. Curvature-undulation coupling as a basis for curvature sensing and generation in bilayer membranes. Proceedings of the National Academy of Sciences of the United States of America. 113 (35), 117-124 (2016).
- Perozo, E., Cortes, D. M., Sompornpisut, P., Kloda, A., Martinac, B. Open channel structure of MscL and the gating mechanism of mechanosensitive channels. Nature. 418 (6901), 942-948 (2002).
- Jensen, M. &. #. 2. 1. 6. ;., Mouritsen, O. G. Lipids do influence protein function-the hydrophobic matching hypothesis revisited. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1666 (1-2), 205-226 (2004).
- Rajendran, L., Simons, K. Lipid rafts and membrane dynamics. Journal of Cell Science. 118 (6), 1099-1102 (2005).
- Katchalsky, A., Spangler, R. Dynamics of membrane processes. Quarterly Reviews of Biophysics. 1 (2), 127-175 (1968).
- Rheinstädter, M. C. Collective molecular dynamics in proteins and membranes (Review). Biointerphases. 3 (2), 83-90 (2008).
- Fujiwara, T., Ritchie, K., Murakoshi, H., Jacobson, K., Kusumi, A. Phospholipids undergo hop diffusion in compartmentalized cell membrane. The Journal of Cell Biology. 157 (6), 1071-1082 (2002).
- Hac, A. E., Seeger, H. M., Fidorra, M., Heimburg, T. Diffusion in two-component lipid membranes--a fluorescence correlation spectroscopy and monte carlo simulation study. Biophysical Journal. 88 (1), 317-333 (2005).
- Heinrich, M., Tian, A., Esposito, C., Baumgart, T. Dynamic sorting of lipids and proteins in membrane tubes with a moving phase boundary. Proceedings of the National Academy of Sciences of the United States of America. 107 (16), 7208-7213 (2010).
- Hormel, T. T., Kurihara, S. Q., Brennan, M. K., Wozniak, M. C., Parthasarathy, R. Measuring lipid membrane viscosity using rotational and translational probe diffusion. Physical Review Letters. 112 (18), 188101 (2014).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Advances in Colloid and Interface Science. 208, 225-234 (2014).
- Bassereau, P., Sorre, B., Lévy, A. Bending lipid membranes: Experiments after W. Helfrich's model. Advances in Colloid and Interface Science. 208, 47-57 (2014).
- Monzel, C., Sengupta, K. Measuring shape fluctuations in biological membranes. Journal of Physics D: Applied Physics. 49 (24), 243002 (2016).
- Deserno, M. Mesoscopic membrane physics: concepts, simulations, and selected applications. Macromolecular Rapid Communications. 30 (9-10), 752-771 (2009).
- Reynwar, B. J., et al. Aggregation and vesiculation of membrane proteins by curvature-mediated interactions. Nature. 447 (7143), 461-464 (2007).
- Haswell, E. S., Phillips, R., Rees, D. C. Mechanosensitive channels: what can they do and how do they do it. Structure. 19 (10), 1356-1369 (2011).
- Phillips, R., Ursell, T., Wiggins, P., Sens, P. Emerging roles for lipids in shaping membrane-protein function. Nature. 459 (7245), 379-385 (2009).
- Dill, K. A., Chan, H. S. From Levinthal to pathways to funnels. Nature Structural Biology. 4 (1), 10-19 (1997).
- Henzler-Wildman, K., Kern, D. Dynamic personalities of proteins. Nature. 450 (7172), 964-972 (2007).
- Grimaldo, M., Roosen-Runge, F., Zhang, F., Schreiber, F., Seydel, T. Dynamics of proteins in solution. Quarterly Reviews of Biophysics. 52, 7 (2019).
- Lyman, E., Hsieh, C. -. L., Eggeling, C. From dynamics to membrane organization: experimental breakthroughs occasion a "modeling manifesto". Biophysical Journal. 115 (4), 595-604 (2018).
- Arriaga, L. R., et al. Dissipative curvature fluctuations in bilayer vesicles: Coexistence of pure-bending and hybrid curvature-compression modes. The European Physical Journal. E, Soft Matter. 31 (1), 105-113 (2010).
- Honerkamp-Smith, A. R., Veatch, S. L., Keller, S. L. An introduction to critical points for biophysicists; observations of compositional heterogeneity in lipid membranes. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1788 (1), 53-63 (2009).
- Veatch, S. L., Keller, S. L. Organization in lipid membranes containing cholesterol. Physical Review Letters. 89 (26), 268101 (2002).
- Heberle, F. A., et al. Bilayer thickness mismatch controls domain size in model membranes. Journal of the American Chemical Society. 135 (18), 6853-6859 (2013).
- Nickels, J. D., et al. The in vivo structure of biological membranes and evidence for lipid domains. PLOS Biology. 15 (5), 2002214 (2017).
- Simons, K., Ikonen, E. Functional rafts in cell membranes. Nature. 387 (6633), 569-572 (1997).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews. Molecular Cell Biology. 9 (2), 112-124 (2008).
- Liu, S. -. L., et al. Orthogonal lipid sensors identify transbilayer asymmetry of plasma membrane cholesterol. Nature Chemical Biology. 13, 268 (2016).
- Rothman, J., Lenard, J. Membrane asymmetry. Science. 195 (4280), 743-753 (1977).
- Ashkar, R., et al. Neutron scattering in the biological sciences: progress and prospects. Acta Crystallographica Section D. 74 (12), 1129-1168 (2018).
- Woodka, A. C., Butler, P. D., Porcar, L., Farago, B., Nagao, M. Lipid bilayers and membrane dynamics: insight into thickness fluctuations. Physical Review Letters. 109 (5), 058102 (2012).
- Chakraborty, S., et al. How cholesterol stiffens unsaturated lipid membranes. Proceedings of the National Academy of Sciences of the United States of America. 117 (36), 21896-21905 (2020).
- Arriaga, L. R., et al. Stiffening effect of cholesterol on disordered lipid phases: a combined neutron spin echo + dynamic light scattering analysis of the bending elasticity of large unilamellar vesicles. Biophysical Journal. 96 (9), 3629-3637 (2009).
- Nagao, M., Kelley, E. G., Ashkar, R., Bradbury, R., Butler, P. D. Probing elastic and viscous properties of phospholipid bilayers using neutron spin echo spectroscopy. The Journal of Physical Chemistry Letters. 8 (19), 4679-4684 (2017).
- Kelley, E. G., Butler, P. D., Ashkar, R., Bradbury, R., Nagao, M. Scaling relationships for the elastic moduli and viscosity of mixed lipid membranes. Proceedings of the National Academy of Sciences of the United States of America. 117 (38), 23365-23373 (2020).
- Rickeard, B. W., et al. Transverse lipid organization dictates bending fluctuations in model plasma membranes. Nanoscale. 12 (3), 1438-1447 (2020).
- Nickels, J. D., et al. Mechanical properties of nanoscopic lipid domains. Journal of the American Chemical Society. 137 (50), 15772-15780 (2015).
- Mezei, F. Neutron spin echo: A new concept in polarized thermal neutron techniques. Zeitschrift für Physik A Hadrons and Nuclei. 255 (2), 146-160 (1972).
- Hayter, J. B., Penfold, J. Neutron spin-echo integral transform spectroscopy. Zeitschrift für Physik B Condensed Matter. 35 (2), 199-205 (1979).
- Monkenbusch, M., Richter, D., Imae, T., Kanaya, T., Furusaka, M., Torikai, N. . Neutrons in Soft Matter. , 147-182 (2011).
- Pynn, R., Mezei, F., Pappas, C., Gutberlet, T. . Neutron Spin Echo. , 159-177 (2003).
- Holderer, O., et al. The JCNS neutron spin-echo spectrometer J-NSE at the FRM II. Measurement Science and Technology. 19 (3), 034022 (2008).
- Schleger, P., et al. The long-wavelength neutron spin-echo spectrometer IN15 at the Institut Laue-Langevin. Physica B: Condensed Matter. 241-243, 164-165 (1997).
- Holderer, O., Zolnierczuk, P., Pasini, S., Stingaciu, L., Monkenbusch, M. A better view through new glasses: Developments at the Jülich neutron spin echo spectrometers. Physica B: Condensed Matter. 562, 9-12 (2019).
- Farago, B., et al. The IN15 upgrade. Neutron News. 26 (3), 15-17 (2015).
- Ashkar, R. Selective dynamics in polymeric materials: Insights from quasi-elastic neutron scattering spectroscopy. Journal of Applied Physics. 127 (15), 151101 (2020).
- Pasini, S., Holderer, O., Kozielewski, T., Richter, D., Phoenix Monkenbusch, M. J-NSE- Phoenix, a neutron spin-echo spectrometer with optimized superconducting precession coils at the MLZ in Garching. Review of Scientific Instruments. 90 (4), 043107 (2019).
- Svergun, D. I., Koch, M. H. J., Timmins, P. A., May, R. P. . Small Angle X-Ray and Neutron Scattering from Solutions of Biological Macromolecules. , (2013).
- Eicher, B., et al. Joint small-angle X-ray and neutron scattering data analysis of asymmetric lipid vesicles. Journal of Applied Crystallography. 50 (2), 419-429 (2017).
- Heberle, F. A., et al. Model-based approaches for the determination of lipid bilayer structure from small-angle neutron and X-ray scattering data. European Biophysics Journal. 41 (10), 875-890 (2012).
- Jaksch, S., Koutsioubas, A., Mattauch, S., Holderer, O., Frielinghaus, H. Long-range excitations in phospholipid membranes. Chemistry and Physics of Lipids. 225, 104788 (2019).
- Jaksch, S., et al. Influence of ibuprofen on phospholipid membranes. Physical Review E. 91 (2), 022716 (2015).
- Armstrong, C. L., et al. Effect of cholesterol on the lateral nanoscale dynamics of fluid membranes. European Biophysics Journal. 41 (10), 901-913 (2012).
- Rheinstädter, M. C., Häußler, W., Salditt, T. Dispersion relation of lipid membrane shape fluctuations by neutron spin-echo spectrometry. Physical Review Letters. 97 (4), 048103 (2006).
- Armstrong, C. L., Häußler, W., Seydel, T., Katsaras, J., Rheinstädter, M. C. Nanosecond lipid dynamics in membranes containing cholesterol. Soft Matter. 10 (15), 2600-2611 (2014).
- Nickels, J. D., et al. Lipid rafts: buffers of cell membrane physical properties. The Journal of Physical Chemistry B. 123 (9), 2050-2056 (2019).
- Michonova-Alexova, E. I., Sugár, I. P. Component and state separation in DMPC/DSPC lipid bilayers: a Monte Carlo simulation study. Biophysical Journal. 83 (4), 1820-1833 (2002).
- Sugár, I. P., Thompson, T. E., Biltonen, R. L. Monte Carlo simulation of two-component bilayers: DMPC/DSPC mixtures. Biophysical Journal. 76 (4), 2099-2110 (1999).
- Mabrey, S., Sturtevant, J. M. Investigation of phase transitions of lipids and lipid mixtures by sensitivity differential scanning calorimetry. Proceedings of the National Academy of Sciences. 73 (11), 3862-3866 (1976).
- . Neutron activation and scattering calculator Available from: https://www.ncnr.nist.gov/resources/activation/ (2021)
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Ashkar, R., et al. Tuning membrane thickness fluctuations in model lipid bilayers. Biophysical Journal. 109 (1), 106-112 (2015).
- Carrillo, J. -. M. Y., Katsaras, J., Sumpter, B. G., Ashkar, R. A computational approach for modeling neutron scattering data from lipid bilayers. Journal of Chemical Theory and Computation. 13 (2), 916-925 (2017).
- Azuah, R. T. DAVE: a comprehensive software suite for the reduction, visualization, and analysis of low energy neutron spectroscopic data. Journal of Research of the National Institute of Standards and Technology. 114 (6), 341-358 (2009).
- Van Hove, L. Correlations in space and time and born approximation scattering in systems of interacting particles. Physical Review. 95 (1), 249-262 (1954).
- Zilman, A. G., Granek, R. Undulations and dynamic structure factor of membranes. Physical Review Letters. 77 (23), 4788-4791 (1996).
- Kelley, E. G., Butler, P. D., Nagao, M. . Collective dynamics in model biological membranes measured by neutron spin echo spectroscopy. , 131-176 (2019).
- Zheng, Y., Michihiro, N., Dobrin, P. B. Bending elasticity of saturated and monounsaturated phospholipid membranes studied by the neutron spin echo technique. Journal of Physics: Condensed Matter. 21 (15), 155104 (2009).
- Sharma, V. K., Qian, S. Effect of an antimicrobial peptide on lateral segregation of lipids: a structure and dynamics study by neutron scattering. Langmuir. 35 (11), 4152-4160 (2019).
- Boggara, M. B., Faraone, A., Krishnamoorti, R. Effect of pH and Ibuprofen on the Phospholipid Bilayer Bending Modulus. The Journal of Physical Chemistry B. 114 (24), 8061-8066 (2010).
- Lee, J. -. H., et al. Thermal fluctuation and elasticity of lipid vesicles interacting with pore-forming peptides. Physical Review Letters. 105 (3), 038101 (2010).
- Chakraborty, S., Abbasi, A., Bothun, G. D., Nagao, M., Kitchens, C. L. Phospholipid bilayer softening due to hydrophobic gold nanoparticle inclusions. Langmuir. 34 (44), 13416-13425 (2018).
- Hoffmann, I., et al. Softening of phospholipid membranes by the adhesion of silica nanoparticles - as seen by neutron spin-echo (NSE). Nanoscale. 6 (12), 6945-6952 (2014).
- Watson, M. C., Brown, F. L. H. Interpreting membrane scattering experiments at the mesoscale: the contribution of dissipation within the bilayer. Biophysical Journal. 98 (6), 9-11 (2010).
- Seifert, U., Langer, S. A. Viscous modes of fluid bilayer membranes. Europhysics Letters (EPL). 23 (1), 71-76 (1993).
- Bingham, R. J., Smye, S. W., Olmsted, P. D. Dynamics of an asymmetric bilayer lipid membrane in a viscous solvent. EPL (Europhysics Letters). 111 (1), 18004 (2015).
- Rawicz, W., Olbrich, K. C., McIntosh, T., Needham, D., Evans, E. Effect of chain length and unsaturation on elasticity of lipid bilayers. Biophysical Journal. 79 (1), 328-339 (2000).
- Doktorova, M., LeVine, M. V., Khelashvili, G., Weinstein, H. A new computational method for membrane compressibility: bilayer mechanical thickness revisited. Biophysical Journal. 116 (3), 487-502 (2019).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. The Journal of Physical Chemistry. 91 (16), 4219-4228 (1987).
- Lesieur, S., Grabielle-Madelmont, C., Paternostre, M. T., Ollivon, M. Size analysis and stability study of lipid vesicles by high-performance gel exclusion chromatography, turbidity, and dynamic light scattering. Analytical Biochemistry. 192 (2), 334-343 (1991).
- Heberle, F. A., et al. Direct label-free imaging of nanodomains in biomimetic and biological membranes by cryogenic electron microscopy. Proceedings of the National Academy of Sciences of the United States of America. 117 (33), 19943-19952 (2020).
- Cornell, C. E., Mileant, A., Thakkar, N., Lee, K. K., Keller, S. L. Direct imaging of liquid domains in membranes by cryo-electron tomography. Proceedings of the National Academy of Sciences of the United States of America. 117 (33), 19713-19719 (2020).
- Yao, X., Fan, X., Yan, N. Cryo-EM analysis of a membrane protein embedded in the liposome. Proceedings of the National Academy of Sciences of the United States of America. 117 (31), 18497-18503 (2020).
- Kučerka, N., Nieh, M. -. P., Katsaras, J. Fluid phase lipid areas and bilayer thicknesses of commonly used phosphatidylcholines as a function of temperature. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1808 (11), 2761-2771 (2011).
- Nielsen, J. E., Bjørnestad, V. A., Lund, R. Resolving the structural interactions between antimicrobial peptides and lipid membranes using small-angle scattering methods: the case of indolicidin. Soft Matter. 14 (43), 8750-8763 (2018).
- Kučerka, N., et al. Lipid bilayer structure determined by the simultaneous analysis of neutron and X-ray scattering data. Biophysical Journal. 95 (5), 2356-2367 (2008).
- Kelley, E. G., Butler, P. D., Nagao, M. Scaling of lipid membrane rigidity with domain area fraction. Soft Matter. 15 (13), 2762-2767 (2019).
- Brüning, B. -. A., et al. Bilayer undulation dynamics in unilamellar phospholipid vesicles: Effect of temperature, cholesterol and trehalose. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1838 (10), 2412-2419 (2014).
- Kučerka, N., et al. Areas of monounsaturated diacylphosphatidylcholines. Biophysical Journal. 97 (7), 1926-1932 (2009).
- Sharma, V. K., Mamontov, E., Anunciado, D. B., O'Neill, H., Urban, V. S. Effect of antimicrobial peptide on the dynamics of phosphocholine membrane: role of cholesterol and physical state of bilayer. Soft Matter. 11 (34), 6755-6767 (2015).
- Kelley, E. G., Butler, P. D., Nagao, M. Collective dynamics in lipid membranes containing transmembrane peptides. Soft Matter. , (2021).
- Yu, J., et al. Structure and dynamics of lipid membranes interacting with antivirulence end-phosphorylated polyethylene glycol block copolymers. Soft Matter. 16 (4), 983-989 (2020).
- Stingaciu, L. -. R., et al. Revealing the dynamics of thylakoid membranes in living cyanobacterial cells. Scientific Reports. 6 (1), 19627 (2016).
- Stingaciu, L. -. R., O'Neill, H. M., Liberton, M., Pakrasi, H. B., Urban, V. S. Influence of chemically disrupted photosynthesis on cyanobacterial thylakoid dynamics in synechocystis sp. PCC 6803. Scientific Reports. 9 (1), 5711 (2019).
- Miller, I. R. Energetics of fluctuation in lipid bilayer thickness. Biophysical Journal. 45 (3), 643-644 (1984).
- Nagao, M. Observation of local thickness fluctuations in surfactant membranes using neutron spin echo. Physical Review E. 80 (3), 031606 (2009).
Erratum
Formal Correction: Erratum: Neutron Spin Echo Spectroscopy as a Unique Probe for Lipid Membrane Dynamics and Membrane-Protein Interactions
Posted by JoVE Editors on 8/06/2021. Citeable Link.
An erratum was issued for: Neutron Spin Echo Spectroscopy as a Unique Probe for Lipid Membrane Dynamics and Membrane-Protein Interactions. The Introduction, Protocol, and Representative Results sections have been updated.
In the Introduction, the fith pargraph was updated from:
Besides direct access to the length and time scale of membrane dynamics, NSE has the inherent capabilities of neutron isotope sensitivity52. Specifically, the ability of neutrons to interact differently with the isotopes of hydrogen, the most abundant element in biological systems, results in a different neutron scattering length density,34 or NSLD (the equivalent of the optical index of refraction50), when protium is substituted by deuterium. This enables an approach known as contrast variation, which is commonly used to highlight specific membrane features or conceal others — the latter scenario is referred to as contrast matching. A frequent application of contrast variation/matching is the substitution of water (NSLD = -0.56 × 10-6 Å-2) by heavy water or D2O (NSLD = 6.4 × 10-6 Å-2) to amplify the neutron signal from protiated lipid membranes (NSLD ~ 2 × 10-6 Å-2). This approach is highly effective in studies of membrane structure because the penetration of D2O into the headgroup region of the membrane allows accurate determination of the membrane thicknesses (see Figure 2A, left panel) and of the location of different lipid subgroups when more sophisticated models are applied53,54. This paper highlights some examples on the use of contrast variation for studies of collective dynamics in biomimetic membranes and select membrane features.
to:
Besides direct access to the length and time scale of membrane dynamics, NSE has the inherent capabilities of neutron isotope sensitivity52. Specifically, the ability of neutrons to interact differently with the isotopes of hydrogen, the most abundant element in biological systems, results in a different neutron scattering length density,34 or NSLD (the equivalent of the optical index of refraction50), when protium is substituted by deuterium. This enables an approach known as contrast variation, which is commonly used to highlight specific membrane features or conceal others — the latter scenario is referred to as contrast matching. A frequent application of contrast variation/matching is the substitution of water (NSLD = -0.56 × 10-6 Å-2) by heavy water or D2O (NSLD = 6.4 × 10-6 Å-2) to amplify the neutron signal from protiated lipid membranes (NSLD ~ 0 × 10-6 Å-2). This approach is highly effective in studies of membrane structure because the penetration of D2O into the headgroup region of the membrane allows accurate determination of the membrane thicknesses (see Figure 2A, left panel) and of the location of different lipid subgroups when more sophisticated models are applied53,54. This paper highlights some examples on the use of contrast variation for studies of collective dynamics in biomimetic membranes and select membrane features.
In the Protocol, step 1.1 was updated from:
For bending fluctuation measurements, make fully protiated liposomes in D2O (D 99.9%) or D2O-buffer (e.g., phosphate buffer prepared with D2O instead of H2O). Use fully protiated DMPC (C36H72NO8P) and DSPC (C44H88NO8P) with 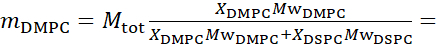 133.4 mg, where XDMPC and XDSPC are the mole fractions of DMPC and DSPC, here set to 0.7 and 0.3, respectively, and MwDMPC and MwDSPC are the molar weights given by 677.9 g/mol and 790.1 g/mol, respectively. Similarly, mDSPC = 66.6 mg. This deuteration scheme increases the scattering contrast between the membrane (NSLD ~ 2 × 10-6 Å-2) and the deuterated buffer (NSLD ~ 6.4 × 10-6 Å-2) and amplifies the signal from membrane undulations (see Figure 2A left panel).
133.4 mg, where XDMPC and XDSPC are the mole fractions of DMPC and DSPC, here set to 0.7 and 0.3, respectively, and MwDMPC and MwDSPC are the molar weights given by 677.9 g/mol and 790.1 g/mol, respectively. Similarly, mDSPC = 66.6 mg. This deuteration scheme increases the scattering contrast between the membrane (NSLD ~ 2 × 10-6 Å-2) and the deuterated buffer (NSLD ~ 6.4 × 10-6 Å-2) and amplifies the signal from membrane undulations (see Figure 2A left panel).
to:
For bending fluctuation measurements, make fully protiated liposomes in D2O (D 99.9%) or D2O-buffer (e.g., phosphate buffer prepared with D2O instead of H2O). Use fully protiated DMPC (C36H72NO8P) and DSPC (C44H88NO8P) with 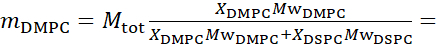 133.4 mg, where XDMPC and XDSPC are the mole fractions of DMPC and DSPC, here set to 0.7 and 0.3, respectively, and MwDMPC and MwDSPC are the molar weights given by 677.9 g/mol and 790.1 g/mol, respectively. Similarly, mDSPC = 66.6 mg. This deuteration scheme increases the scattering contrast between the membrane (NSLD ~ 0 × 10-6 Å-2) and the deuterated buffer (NSLD ~ 6.4 × 10-6 Å-2) and amplifies the signal from membrane undulations (see Figure 2A left panel).
133.4 mg, where XDMPC and XDSPC are the mole fractions of DMPC and DSPC, here set to 0.7 and 0.3, respectively, and MwDMPC and MwDSPC are the molar weights given by 677.9 g/mol and 790.1 g/mol, respectively. Similarly, mDSPC = 66.6 mg. This deuteration scheme increases the scattering contrast between the membrane (NSLD ~ 0 × 10-6 Å-2) and the deuterated buffer (NSLD ~ 6.4 × 10-6 Å-2) and amplifies the signal from membrane undulations (see Figure 2A left panel).
In the Representative Results, the fist pagargaph was updted from:
NSE studies accessing bending fluctuations are typically performed over a Q-range of ~ (0.04 - 0.2) Å-1. This Q-range corresponds to intermediate length scales between the membrane thickness and the liposomal radius, where bending dynamics dominate. Measurement over an extended Q-range can give access to additional dynamic modes, including liposomal diffusion and intramembrane dynamics. For more details on the cross-over in membrane dynamics accessed by NSE, check these relevant publications25,71. It is important to emphasize that NSE signals are proportional to: 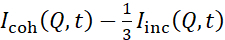 , where Icoh and Iinc are, respectively, the coherent and incoherent scattering intensity from the sample. Therefore, it is advisable to prepare NSE liposomal samples in deuterated buffers (i.e., buffers prepared with D2O instead of H2O) to minimize the incoherent scattering signal, mainly contributed by the hydrogen content of the sample. However, in some cases intermediate deuteration schemes (i.e., using mixtures of D2O and H2O) might be necessary to obtain optimal contrast conditions. Typically, NSE measurements of membrane bending fluctuations are performed on fully protiated liposomes in deuterated buffer, referred to as fully contrasted liposomes in Figure 5. This deuteration scheme results in a large NSLD difference between the membrane core (~2 × 10-6 Å-2) and its deuterated fluid environment (~6.4 × 10-6 Å-2), which significantly enhances the scattering signal from the liposomal membranes and improves the measurement statistics of bending dynamics. This contrast scheme (Figure 2A left panel) is frequently utilized in studies of bending rigidity of lipid membranes with single38,72 and multiple39,66 lipid components and in studies of membrane softening/stiffening by biological inclusions (e.g., cholesterol, drug molecules, peptides/proteins)36,37,73,74,75, and synthetic additives (e.g., nanoparticles)76,77.
, where Icoh and Iinc are, respectively, the coherent and incoherent scattering intensity from the sample. Therefore, it is advisable to prepare NSE liposomal samples in deuterated buffers (i.e., buffers prepared with D2O instead of H2O) to minimize the incoherent scattering signal, mainly contributed by the hydrogen content of the sample. However, in some cases intermediate deuteration schemes (i.e., using mixtures of D2O and H2O) might be necessary to obtain optimal contrast conditions. Typically, NSE measurements of membrane bending fluctuations are performed on fully protiated liposomes in deuterated buffer, referred to as fully contrasted liposomes in Figure 5. This deuteration scheme results in a large NSLD difference between the membrane core (~2 × 10-6 Å-2) and its deuterated fluid environment (~6.4 × 10-6 Å-2), which significantly enhances the scattering signal from the liposomal membranes and improves the measurement statistics of bending dynamics. This contrast scheme (Figure 2A left panel) is frequently utilized in studies of bending rigidity of lipid membranes with single38,72 and multiple39,66 lipid components and in studies of membrane softening/stiffening by biological inclusions (e.g., cholesterol, drug molecules, peptides/proteins)36,37,73,74,75, and synthetic additives (e.g., nanoparticles)76,77.
to:
NSE studies accessing bending fluctuations are typically performed over a Q-range of ~ (0.04 - 0.2) Å-1. This Q-range corresponds to intermediate length scales between the membrane thickness and the liposomal radius, where bending dynamics dominate. Measurement over an extended Q-range can give access to additional dynamic modes, including liposomal diffusion and intramembrane dynamics. For more details on the cross-over in membrane dynamics accessed by NSE, check these relevant publications25,71. It is important to emphasize that NSE signals are proportional to: 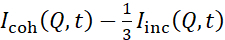 , where Icoh and Iinc are, respectively, the coherent and incoherent scattering intensity from the sample. Therefore, it is advisable to prepare NSE liposomal samples in deuterated buffers (i.e., buffers prepared with D2O instead of H2O) to minimize the incoherent scattering signal, mainly contributed by the hydrogen content of the sample. However, in some cases intermediate deuteration schemes (i.e., using mixtures of D2O and H2O) might be necessary to obtain optimal contrast conditions. Typically, NSE measurements of membrane bending fluctuations are performed on fully protiated liposomes in deuterated buffer, referred to as fully contrasted liposomes in Figure 5. This deuteration scheme results in a large NSLD difference between the membrane core (~0 × 10-6 Å-2) and its deuterated fluid environment (~6.4 × 10-6 Å-2), which significantly enhances the scattering signal from the liposomal membranes and improves the measurement statistics of bending dynamics. This contrast scheme (Figure 2A left panel) is frequently utilized in studies of bending rigidity of lipid membranes with single38,72 and multiple39,66 lipid components and in studies of membrane softening/stiffening by biological inclusions (e.g., cholesterol, drug molecules, peptides/proteins)36,37,73,74,75, and synthetic additives (e.g., nanoparticles)76,77.
, where Icoh and Iinc are, respectively, the coherent and incoherent scattering intensity from the sample. Therefore, it is advisable to prepare NSE liposomal samples in deuterated buffers (i.e., buffers prepared with D2O instead of H2O) to minimize the incoherent scattering signal, mainly contributed by the hydrogen content of the sample. However, in some cases intermediate deuteration schemes (i.e., using mixtures of D2O and H2O) might be necessary to obtain optimal contrast conditions. Typically, NSE measurements of membrane bending fluctuations are performed on fully protiated liposomes in deuterated buffer, referred to as fully contrasted liposomes in Figure 5. This deuteration scheme results in a large NSLD difference between the membrane core (~0 × 10-6 Å-2) and its deuterated fluid environment (~6.4 × 10-6 Å-2), which significantly enhances the scattering signal from the liposomal membranes and improves the measurement statistics of bending dynamics. This contrast scheme (Figure 2A left panel) is frequently utilized in studies of bending rigidity of lipid membranes with single38,72 and multiple39,66 lipid components and in studies of membrane softening/stiffening by biological inclusions (e.g., cholesterol, drug molecules, peptides/proteins)36,37,73,74,75, and synthetic additives (e.g., nanoparticles)76,77.
In the Representative Reults, Figure 2 was updated from:
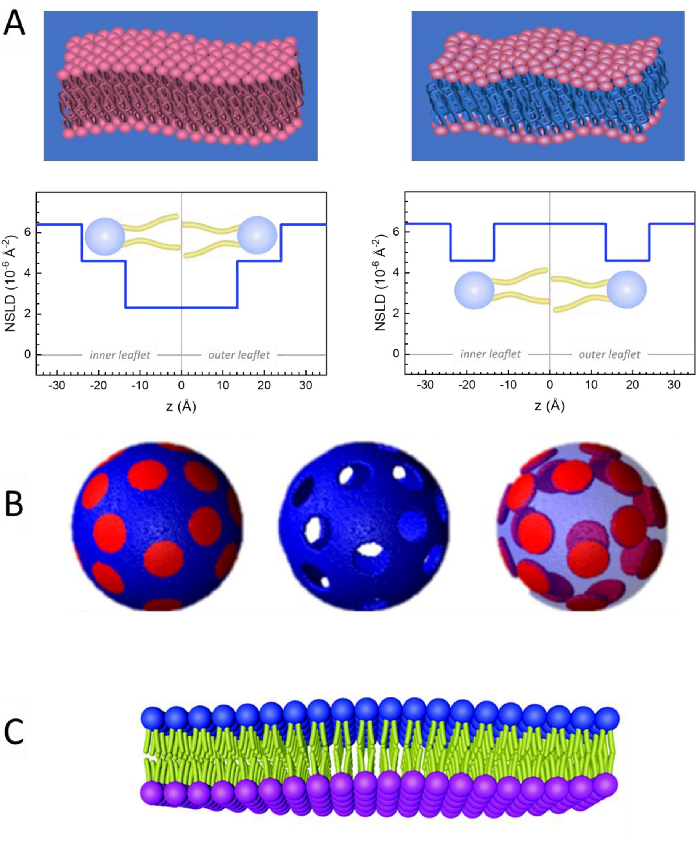
Figure 2: Examples of possible deuteration schemes in NSE experiments on lipid membranes. (A) Left: Fully contrasted membranes, e.g., protiated membranes in deuterated buffer, showing the NSLD profile along the normal to the membrane surface. The difference in the NSLD between the headgroup (~2 × 10-2 Å-2) and tail region (~4.5 × 10-6 Å-2) of the membrane is due to the headgroup hydration with deuterated buffer. Right: Tail-contrast matched membranes such that the hydrocarbon tail region of the membrane has the same NSLD as the buffer, as shown in the corresponding NSLD profile along the membrane normal. (B) Domain-forming membranes with two neutron contrast schemes where the domains (center) or the matrix (left) are contrast-matched to the buffer, enabling selective studies of matrix or domain dynamics, respectively. This figure has been modified from Nickels et al., JACS 201541. (C) Asymmetric membranes prepared by cyclodextrin exchange between protiated and deuterated lipid vesicles, resulting in the deuteration of one membrane leaflet while keeping the other leaflet protiated. This allows studies of the bending dynamics of the protiated leaflet and provides insights into the mechanical coupling between opposing leaflets in asymmetric membranes. This figure has been modified from Rickeard et al., Nanoscale 202040. Please click here to view a larger version of this figure.
to:
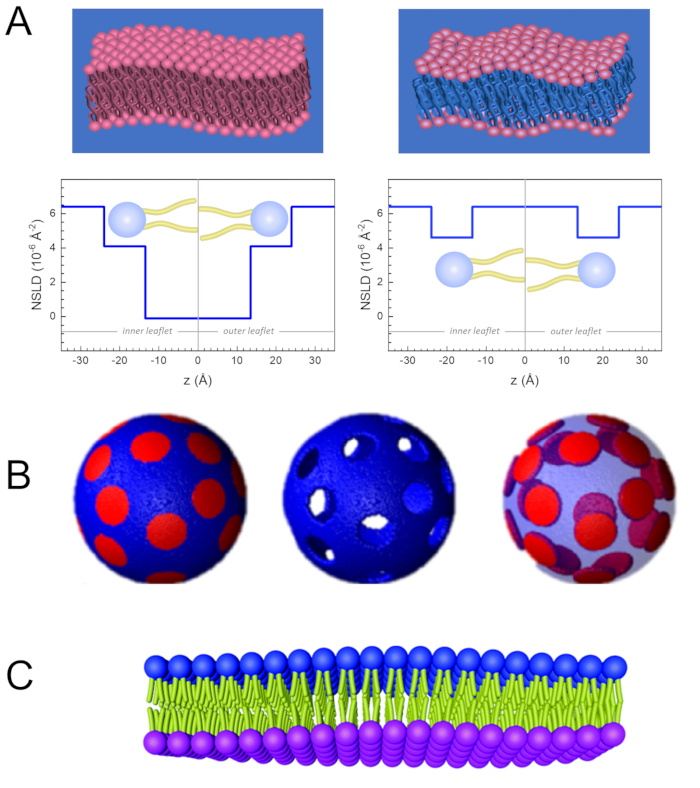
Figure 2: Examples of possible deuteration schemes in NSE experiments on lipid membranes. (A) Left: Fully contrasted membranes, e.g., protiated membranes in deuterated buffer, showing the NSLD profile along the normal to the membrane surface. The difference in the NSLD between the tail region (~0 × 10-2 Å-2) and headgroup region (~4.5 × 10-6 Å-2) of the membrane is due to the headgroup hydration with deuterated buffer. Right: Tail-contrast matched membranes such that the hydrocarbon tail region of the membrane has the same NSLD as the buffer, as shown in the corresponding NSLD profile along the membrane normal. (B) Domain-forming membranes with two neutron contrast schemes where the domains (center) or the matrix (left) are contrast-matched to the buffer, enabling selective studies of matrix or domain dynamics, respectively. This figure has been modified from Nickels et al., JACS 201541. (C) Asymmetric membranes prepared by cyclodextrin exchange between protiated and deuterated lipid vesicles, resulting in the deuteration of one membrane leaflet while keeping the other leaflet protiated. This allows studies of the bending dynamics of the protiated leaflet and provides insights into the mechanical coupling between opposing leaflets in asymmetric membranes. This figure has been modified from Rickeard et al., Nanoscale 202040. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved