A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الاستفادة من التثقيب الكهربائي بعد الولادة في الجسم الحي لدراسة مورفولوجيا الخلايا العصبية الحبيبية المخيخية وتطوير المشبك
In This Article
Erratum Notice
Summary
نصف هنا طريقة لتصور تكوين المشابك العصبية الحبيبية في مخيخ الفأر على مدار فترة نمو الدماغ بعد الولادة عندما تقوم هذه الخلايا بتحسين هياكلها المشبكية وتشكيل نقاط الاشتباك العصبي لدمج نفسها في دائرة الدماغ الكلية.
Abstract
تخضع الخلايا العصبية لتغيرات ديناميكية في بنيتها ووظيفتها أثناء نمو الدماغ لتشكيل روابط مناسبة مع الخلايا الأخرى. مخيخ القوارض هو نظام مثالي لتتبع تطور وتشكل نوع خلية واحدة ، الخلايا العصبية الحبيبية المخيخية (CGN) ، عبر الزمن. هنا ، تم استخدام التثقيب الكهربائي في الجسم الحي لأسلاف الخلايا العصبية الحبيبية في مخيخ الفأر النامي لتسمية الخلايا بشكل ضئيل للتحليلات المورفولوجية اللاحقة. تتجلى فعالية هذه التقنية في قدرتها على عرض المراحل التنموية الرئيسية لنضج CGN ، مع التركيز بشكل خاص على تكوين المخالب المتغصنة ، وهي هياكل متخصصة حيث تتلقى هذه الخلايا غالبية مدخلاتها المشبكية. بالإضافة إلى توفير لقطات من الهياكل المشبكية CGN طوال تطور المخيخ ، يمكن تكييف هذه التقنية لمعالجة الخلايا العصبية الحبيبية وراثيا بطريقة مستقلة عن الخلية لدراسة دور أي جين مهم وتأثيره على مورفولوجيا CGN ، وتطوير المخلب ، وتكوين المشابك.
Introduction
نمو الدماغ هو عملية طويلة تمتد من التطور الجنيني إلى حياة ما بعد الولادة. خلال هذا الوقت ، يدمج الدماغ مزيجا من المحفزات الداخلية والخارجية التي تنحت أسلاك نقاط الاشتباك العصبي بين الزوائد الشجيرية والمحاور العصبية لتوجيه السلوك في النهاية. مخيخ القوارض هو نظام نموذجي مثالي لدراسة كيفية تطور نقاط الاشتباك العصبي لأن تطور نوع واحد من الخلايا العصبية ، الخلايا العصبية الحبيبية المخيخية (CGN) ، يمكن تتبعه أثناء انتقاله من خلية سلفية إلى خلية عصبية ناضجة. ويرجع ذلك جزئيا إلى حقيقة أن غالبية القشرة المخيخية تتطور بعد الولادة ، مما يسمح بسهولة التلاعب الجيني ووضع العلامات على الخلايا بعد الولادة1.
في الثدييات ، يبدأ تمايز CGN في نهاية التطور الجنيني عندما تهاجر مجموعة فرعية من الخلايا التكاثرية في الدماغ الخلفي فوق الشفة المعينية لتشكيل منطقة جرثومية ثانوية على سطح المخيخ2،3،4. على الرغم من أنها ملتزمة تماما بهوية السلف العصبي الحبيبي (GNP) ، إلا أن هذه الخلايا تستمر في التكاثر داخل الجزء الخارجي من طبقة الحبيبات الخارجية (EGL) حتى اليوم 14 بعد الولادة (P14). يؤدي تكاثر هذه الطبقة إلى توسع هائل في المخيخ حيث تؤدي هذه الخلايا حصريا إلى CGNs5. بمجرد خروج CGNs حديثي الولادة من دورة الخلية في EGL ، فإنها تهاجر إلى الداخل نحو الطبقة الحبيبية الداخلية (IGL) ، تاركة وراءها محورا عصبيا يتشعب وينتقل في الطبقة الجزيئية للمخيخ ، مكونا أليافا متوازية تتشابك مع خلايا Purkinje6. يعتمد موضع هذه الألياف داخل الطبقة الجزيئية على توقيت خروج دورة الخلية.
تترك CGNs التي تتمايز أولا أليافها المتوازية باتجاه قاع الطبقة الجزيئية ، في حين أن محاور CGNs التي تتمايز لاحقا تتجمع في أعلى 7,8. بمجرد وصول أجسام خلايا CGN إلى IGL ، فإنها تبدأ في وضع التشعبات وتشكيل نقاط الاشتباك العصبي مع الخلايا العصبية المثبطة والمثيرة القريبة. تعرض الشجرة المتغصنة الناضجة ل CGN بنية نمطية مع أربع عمليات رئيسية. على مدار نضوج CGN ، تشكل الهياكل الموجودة في نهاية هذه التشعبات مخلبا يصبح غنيا ببروتينات ما بعد المشبكي 9,10. تحتوي هذه الهياكل المتخصصة ، التي تسمى المخالب المتغصنة ، على غالبية نقاط الاشتباك العصبي على الخلايا العصبية الحبيبية وهي مهمة لتلقي كل من المدخلات المثيرة من تعصيب الألياف الطحلبية الناشئة من الجسور ، وكذلك المدخلات المثبطة من خلايا جولجي المحلية. بمجرد تكوينها بالكامل ، تسمح الوصلات المشبكية ل CGNs لهذه الخلايا بترحيل المدخلات من نوى ما قبل المخيخ إلى خلايا Purkinje ، والتي تخرج من القشرة المخيخية إلى نوى المخيخ العميقة.
في الجسم الحي ، يعد التثقيب الكهربائي بعد الولادة ل GNPs مفيدا على الطرق الأخرى القائمة على وضع العلامات ، مثل العدوى الفيروسية وتوليد خطوط الفئران المعدلة وراثيا ، لأنه يمكن تحقيق التعبير عن التركيبات المرغوبة في جدول زمني سريع ، وتستهدف الطريقة مجموعة صغيرة من الخلايا ، مفيدة في دراسة التأثيرات المستقلة للخلية. وقد استخدمت هذه الطريقة في دراسات سابقة لدراسة التطور المورفولوجي ل CGNs. ومع ذلك ، فقد ركزت هذه الدراسات إما على نقطة زمنية واحدة أو نافذة زمنية قصيرة9،10،11،12،13. تم إقران طريقة وضع العلامات هذه بتحليل الصور لتوثيق التغييرات في مورفولوجيا CGN التي تحدث طوال الدورة الزمنية لتمايز CGN خلال الأسابيع الثلاثة الأولى من حياة ما بعد الولادة. تكشف هذه البيانات عن ديناميكيات تطور تغصنات CGN التي تكمن وراء بناء الدوائر المخيخية.
Protocol
ملاحظة: تم تنفيذ جميع الإجراءات بموجب البروتوكولات المعتمدة من قبل لجنة رعاية واستخدام الحيوان المؤسسية بجامعة ديوك (IACUC).
1. إعداد الحمض النووي للتثقيب الكهربائي في الجسم الحي أو IVE (يوم واحد قبل الجراحة)
- اجمع المواد التالية: الحمض النووي المنقى (0.5-25 ميكروغرام لكل) ، 3 م أسيتات الصوديوم ، الإيثانول ، صبغة خضراء سريعة ، ماء مقطر عالي النقاء ، محلول عازل للفوسفات (PBS) (انظر جدول المواد).
ملاحظة: بالنسبة للحمض النووي ، تم الحصول على بنية تعبر عن بروتين الفلورسنت الأخضر (GFP) تحت محفز يوبيكويتين بشري من Addgene (FUGW ، https://www.addgene.org/14883/). يجب أن يعمل أي بناء يعبر عن GFP أو بروتين فلوري آخر تحت سيطرة مروج في كل مكان. لا يعتمد وضع العلامات الخاصة ب CGN باستخدام هذه التقنية على البناء ، بل على التثقيب الكهربائي. - تحضير الحمض النووي للتثقيب الكهربائي عن طريق خلط الكمية المطلوبة من الحمض النووي ، 10 ٪ من حجم خلات الصوديوم 3 M و 250 ٪ من حجم الإيثانول المثلج 100 ٪. لاحظ أن الحمض النووي (DNA) سوف يترسب خارج المحلول على الفور.
- استمر في ترسيب خليط الحمض النووي طوال الليل عند -20 درجة مئوية أو لمدة ساعة عند -80 درجة مئوية.
- ترسبت الحبيبات الحمض النووي في جهاز طرد مركزي منضدية عند 16000 × > وغسلها مرتين بنسبة 70٪ من الإيثانول.
- اترك حبيبات الحمض النووي تجف تماما ، وأعد تكوينها في 1x PBS + 0.02٪ محلول Fast Green.

الشكل 1: الحد من عمق الحقن إلى 1.5 مم باستخدام فاصل. (أ) يتم قطع جزء 11.2 مم من ماصة التحميل باستخدام شفرة حلاقة. (ب) يركب الفاصل على طرف محقنة هاملتون (الطول الإجمالي 1.27 سم أو 0.5 بوصة) ويتم تثبيته إما بمادة لاصقة أو بارافيلم. يجب أن يكون طول الطرف المكشوف 1.5 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. التثقيب الكهربائي في الجسم الحي لأسلاف الخلايا العصبية الحبيبية في الفئران بعد الولادة البالغة من العمر سبعة أيام
ملاحظة: تم إجراء جميع جراحات التثقيب الكهربائي في جناح جراحي معقم وعالي التهوية ، وارتدى جميع الموظفين معدات حماية شخصية كاملة بما في ذلك القفازات وقناع الوجه وغطاء الشعر والعباءة وأغطية الأحذية. بدلا من ذلك ، يمكن إجراء العمليات الجراحية في غطاء محرك السيارة جيد التهوية ومعقمة.
- اجمع المواد التالية: الحمض النووي للتثقيب الكهربائي ، مقص جراحي صغير ، ملاقط جراحية صغيرة ، حقنة هاملتون مخصصة ، قضيب طرف قطني ، وسادة تسخين ، بيتادين ، 70٪ إيثانول ، 1x PBS ، بارافيلم ، لاصق الأنسجة (n-butyl-ester cyanoacrylate) ، إيزوفلوران ، إلكتروبوراتور ، وأقطاب كهربائية من نوع الملقط (انظر جدول المواد).
- قم بقطع فاصل من طرف تحميل معقم ليناسب حقنة هاملتون للحد من عمق الحقن إلى 1.5 مم (الشكل 1 أ ، ب). تأمين فاصل مع لاصق أو parafilm.
- تخدير الجرو P7 في غرفة إيزوفلوران بمعدل تسليم 0.8 لتر / دقيقة. تأكيد التخدير الكامل من خلال مراقبة الحيوان لانخفاض التنفس وعدم وجود استجابة قرصة إصبع القدم أو الذيل (الشكل 2 أ).
- بمجرد تخدير الحيوان بالكامل ، ضع الجراء على قاعدة مزودة بمخروط أنف ، مما يوفر إيزوفلوران ثابتا بنسبة 4٪ بمعدل تسليم 0.8 لتر / دقيقة. نظف الجزء العلوي من رأس الجرو 3 مرات بمسحة معقمة من البيتادين ثم 70٪ إيثانول ، بالتناوب بين الاثنين ، لتحضير الموقع. اترك المحلول حتى يجف قبل المتابعة.
- باستخدام مقص معقم ، قم بعمل شق صغير بقطع واحد يمتد المسافة من الأعلى إلى قاعدة الأذنين للكشف عن الدماغ الخلفي (الشكل 2 ب).
- حدد موقع المخيخ (الشكل 2C) ، وأدخل الطرف المكشوف لمحقنة هاملتون عبر الجمجمة ، عموديا على الدماغ ، وحقن 1.5 ميكرولتر من خليط الحمض النووي في الحمة المخيخية عن طريق دفع المكبس الخلفي للمحقنة ببطء. بعد تسليم خليط الحمض النووي ، اسحب الإبرة ببطء للخلف لمنع الانسكابات الخلفية ، واترك محلول الحمض النووي ينتشر لمدة 30 ثانية.
- أطفئ الأيزوفلوران ، وضع الجرو على وسادة تدفئة 37 درجة مئوية. قم بإعداد القطب الكهربائي من نوع الملقط للتثقيب الكهربائي عن طريق غمس كلا الطرفين في 1x PBS معقم.
ملاحظة: ترطيب القطب من نوع الملقط سيمنع حروق التلامس على جلد الجرو أثناء إعطاء النبضات الكهربائية. - قم بتوجيه قطب الملقط فوق موقع الحقن بحيث يكون الطرف الزائد متجها لأسفل والطرف السالب فوق رأس الحيوان (الشكل 2 د). قم بإدارة خمس نبضات كهربائية من جهاز الحفر الكهربائي بالإعدادات التالية: 50 مللي ثانية و 130 فولت و 950 مللي ثانية بين النبضات.
ملاحظة: إذا لزم الأمر ، قم بإجراء حقن اختبار للتأكد من أن موقع الحقن يقع على الفيرميس المخيخي (الشكل 2E). - اضغط على الشق مغلقا ، وأغلق الجرح بلاصق مناديل cyanoacrylate غير سام. نظف الجرح بالإيثانول بنسبة 70٪ لأن أي كمية ضئيلة من الدم تزيد من احتمال وأد الوالدين وأكل لحوم البشر.
- اسمح للحيوان بالتعافي على وسادة تدفئة 37 درجة مئوية قبل إعادة الجرو إلى السد. راقب الجرو (الجرو) كل 30 دقيقة لمدة 2 ساعة على الأقل بعد الجراحة لضمان الشفاء التام.
ملاحظة: وأد الأطفال من قبل أي من الوالدين شائع جدا. لمنع أكل لحوم البشر ، ضع المولى في قفص مختلف قبل البدء في التثقيب الكهربائي ، وأعد دائما الجراء التي تم تنظيفها واستعادتها (أي لا توجد بقع دم ، متحركة بالكامل) إلى القفص الأصلي على الفراش الأصلي. يمكن أيضا مسح الجراء بالفضلات من القفص الأصلي لتقليل رائحة الدم. قد يكون استخدام سد بديل ضروريا إذا استمر السد الأصلي في أكل جروها.
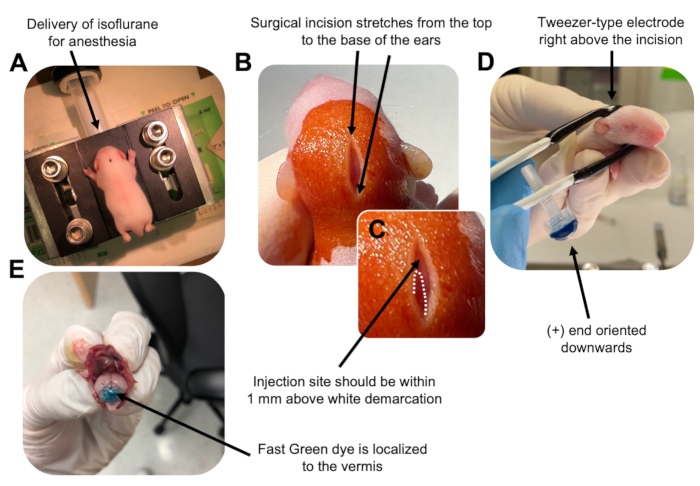
الشكل 2: التثقيب الكهربائي المخيخي في الجسم الحي لأسلاف الخلايا العصبية الحبيبية في جراء الفأر البرية P7. (أ) يتم تخدير الجراء ب 4٪ إيزوفلوران يتم توصيله بمعدل 0.8 لتر / دقيقة لضمان التخدير طوال فترة حقن محلول الحمض النووي. يتم تسليم Isoflurane بمعدل 0.8 لتر / دقيقة. (ب) بعد تعقيم الفأر 3 مرات باستخدام البيتادين والإيثانول بنسبة 70٪ ، يتم إجراء شق يمتد على مسافة الأذنين ، ويكشف عن الدماغ الخلفي. (ج) صورة مكبرة لترسيم أبيض على الجمجمة ، وهو معلم لموقع الحقن. يجب حقن بنية الحمض النووي في حدود 1 مم فوق العلامة ؛ الخطوط المنقطة تحدد ترسيم الحدود ، والسهم الأسود يشير إلى موقع الحقن. قد تكون نتوءات الفيرميس المخيخية مرئية ويمكن أن تكون مفيدة للعثور على موقع الحقن. (د) توجيه قطب كهربائي من نوع الملقط من أجل التثقيب الكهربائي بكفاءة. يجب توجيه طرف زائد (+) لأسفل لسحب الحمض النووي (DNA) السالب الشحنة إلى الحمة المخيخية قبل إعطاء النبضات الكهربية. (ه) يظهر الحقن الاختباري ل 1 ميكرولتر من صبغة Fast Green بنسبة 0.02٪ أن الحقن موضعي في منتصف الفيرميس المخيخي بين الفصيصات 5-7. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. الكيمياء الهيستولوجية المناعية ل CGNs المكهربة
- اجمع المواد التالية: إيزوفلوران ، 1x PBS ، 4٪ بارافورمالدهايد (PFA) ، 30٪ سكروز ، مصل الماعز العادي ، منظف غير أيوني ، شرائح زجاجية ، أغطية زجاجية ، طلاء أظافر ، وسائط تركيب ، صبغة Hoechst النووية ، والأجسام المضادة الأولية والثانوية المناسبة (انظر جدول المواد).
- تخدير التجارب باستخدام الأيزوفلوران ، وتأكيد التخدير الكامل بقرصة إصبع القدم والذيل.
- إجراء نضح عبر القلب عن طريق حقن ببطء 1x PBS و 4٪ PFA في البطين الأيسر من قلب الحيوان. السماح للدم بالتصريف من الحيوان عن طريق قطع الوريد الأجوف.
- إصلاح الدماغ بين عشية وضحاها عن طريق غمره في 4 ٪ PFA عند 4 درجات مئوية. في اليوم التالي ، اشطف الدماغ بسرعة باستخدام 1x PBS ، وانقل الدماغ إلى 30٪ سكروز في 1x PBS للحماية من البرد لمدة 24 ساعة على الأقل.
- إذا لزم الأمر ، قم بتقطيع الدماغ إلى نصفين على طول المحور الذيلي المنقاري ، وتأكد من التعبير عن بناء المراسل المنقول باستخدام مجهر تشريح فلوري مستقيم.
ملاحظة: حافظ على الدماغ مغمورا في 1x PBS في طبق صغير لمنعه من الجفاف. - قم بتركيب الدماغ على ميكروتوم متجمد ، وقطع مقاطع سهمية 25 ميكرومتر ، واسمح للأقسام بالظهور في مزيج 1: 1 من 1x PBS والجلسرين.
ملاحظة: يمكن تخزين المقاطع في هذا المحلول الواقي من التبريد عند -20 درجة مئوية للتخزين طويل الأجل. - اغسل المقاطع ثلاث مرات في 1x PBS لمدة 10 دقائق لكل منها لإزالة الحماية من البرودة ، وسد الأنسجة في 1x PBS + 10٪ مصل الماعز العادي + 0.2٪ منظف غير أيوني على شاكر مداري في درجة حرارة الغرفة لمدة 1 ساعة.
- تحضير محلول الأجسام المضادة الأولي: 1x PBS ، 10٪ مصل ماعز طبيعي ، 0.2٪ منظف غير أيوني ، وجسم مضاد ل GFP ، وأجهزة طرد مركزي المحلول لمدة 5 دقائق عند >16000 × جم. احتضان المقاطع في محلول الأجسام المضادة عند 4 درجات مئوية على شاكر مداري لمدة 48 ساعة.
- اغسل محلول الأجسام المضادة الأساسي لمدة 15 دقيقة خمس مرات باستخدام 1x PBS + 0.2٪ منظف غير أيوني.
- تحضير محلول الأجسام المضادة الثانوي: 1x PBS ، 10٪ مصل الماعز الطبيعي ، 0.2٪ منظف غير أيوني ، وجسم مضاد ثانوي مناسب للكشف عن GFP ؛ أجهزة الطرد المركزي الحل في >16000 × غرام. احتضان أقسام في محلول الأجسام المضادة على شاكر مداري في درجة حرارة الغرفة لمدة 2-3 ساعات. حماية الأقسام من التعرض للضوء لمنع التبييض.
- اغسل محلول الأجسام المضادة الثانوي ثلاث مرات باستخدام 1x PBS + 0.2٪ منظف غير أيوني لمدة 15 دقيقة في كل مرة. احتضان الأقسام في 1x PBS + Hoechst لمدة 5 دقائق لتلطيخ النوى.
- اغسل محلول Hoechst باستخدام 1x PBS + 0.2٪ منظف غير أيوني وقم بتثبيته على شرائح زجاجية. قم بتغطية الأقسام بوسائط التثبيت ، وقم بتغطية الشرائح ، وأغلق الشريحة بطلاء الأظافر لمنع التبخر.
4. التحليلات المورفولوجية ل CGNs - إعادة الإعمار ثلاثية الأبعاد (3D) ومساحة السطح والحجم الخلوي
- قم بتصوير CGNs أحادية الكهرباء على مجهر متحد البؤر عند هدف 63x مع تكبير 2x ، مع التقاط صور z-stack بسرعة 0.5 ميكرومتر لكل مكدس. صورة خلية واحدة لكل نافذة صورة للسماح بسهولة تحليل الصور وإعادة بنائها.
- قم بتثبيت المكون الإضافي Simple Neurite Tracer ل FIJI باستخدام الرابط التالي (https://imagej.net/Simple_Neurite_Tracer:_Basic_Instructions) لتتبع بنية CGNs الكهربائية بسهولة وكفاءة في الفضاء ثلاثي الأبعاد (3D).
ملاحظة: يوجد إصدار محدث من المكون الإضافي (https://imagej.net/SNT). - تحليل طول الخلايا العصبية وتشكيل المخلب التغصني بطريقة عمياء باستخدام Neurite Tracer البسيط. قم بتحميل صور z-stack أحادية القناة لشبكات CGN الكهربائية على FIJI ، وانقر فوق المكونات الإضافية | تجزئة | المقتفي العصبي البسيط (الشكل 3D).
- قم بالوصول إلى القائمة المنسدلة ، وحدد إنشاء عارض ثلاثي الأبعاد جديد (الشكل ثلاثي الأبعاد).
- قم بالتمرير إلى قاعدة التغصنات ، حيث يتصل بالخلية سوما وابدأ مسارا بالنقر فوق التقاطع. تتبع المسار يدويا بالنقر فوق الأقسام التي تكون فيها إشارة تعبئة الخلية أكثر سطوعا، مع الضغط على [y] للاحتفاظ بالتتبع. تتبع حتى نهاية التغصنات إذا لم يكن يحتوي على مخلب أو حتى قاعدة المخلب وتأكيد المسار بالضغط على [f] (الشكل 4D).
- بعد ذلك ، تتبع المخلب عن طريق بدء مسار في قاعدة الهيكل وتتبعه حتى نهاية أطول عصب. تتبع الفروع الثانوية والثالثية عن طريق الضغط باستمرار على [ctrl] على Windows أو [alt] على نظام التشغيل Mac OS والنقر فوق المسار. قم بتأكيد المسار بالضغط على [f].
- لاحظ أن قياسات الآثار مرئية في نافذة منفصلة ؛ اجمع جميع قياسات فروع المخلب (الابتدائية والثانوية والثالثية) للحصول على الطول الإجمالي لكل مخلب.
- لتحليل مساحة السطح والحجم الخلوي ل CGNs المكهربة ، قم بتنزيل برنامج تحليل الخلايا Imaris (https://imaris.oxinst.com/).
ملاحظة: يمكن أيضا استخدام FIJI لإعادة بناء الخلايا في 3D من صور z-stack باستخدام المكونات الإضافية المتاحة بسهولة والمجانية. بالإضافة إلى ذلك ، هناك ميزة عرض حجمي في Simple Neurite Tracer ولكن تم استخدام Imaris للأسباب الموضحة أدناه. - قم بتحميل صورة z-stack ل CGN كهربائي على Imaris. الوصول إلى مجموعة أدوات إعادة الإعمار 3D عن طريق الضغط على تجاوز.
- لإعادة إنشاء CGN، اضغط على Surfaces، وحدد منطقة الاهتمام التي تشمل الخلية بأكملها داخل نافذة الصورة. بمجرد الانتهاء ، اضغط على السهم الأزرق للأمام في الزاوية اليمنى السفلية ضمن إنشاء.
- إذا كانت الصورة تحتوي على قنوات متعددة لإشارات مختلفة، فحدد القناة التي تحتوي على CGN المكهرب، واضغط على السهم الأزرق للأمام.
- باستخدام شريط التمرير ، قم بتعيين الحد المطلوب الذي يناسب إشارة الخلية المكهربة بدقة أكبر. قم بالتكبير بالقرب من سطح الخلية لتحديد العتبة بدقة. بمجرد الانتهاء ، اضغط على السهم الأخضر المزدوج لإعادة بناء الخلية والحصول على مساحة السطح وحجم الحجم من البيانات الوصفية.
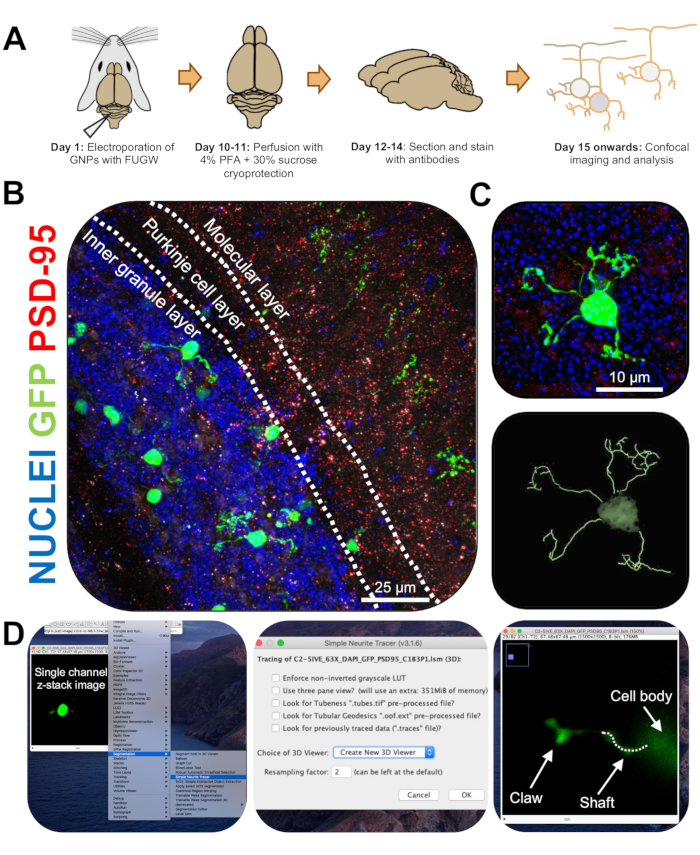
الشكل 3: التحليل الكيميائي المناعي وإعادة البناء ثلاثي الأبعاد للخلايا العصبية الحبيبية الكهربية. تم تزويد الفئران P7 CD-1 بالكهرباء باستخدام بنية تعبر عن GFP. تم جمع الأدمغة وإخضاعها للكيمياء المناعية ، والمجهر متحد البؤر ، وإعادة بناء 3D للتحليل المورفولوجي. (أ) الجدول الزمني من التثقيب الكهربائي إلى معالجة الصور لماوس 10 نقطة في البوصة. (ب) صورة إسقاط قصوى لمقطع عرضي سهمي للمخيخ الكهربائي 10-DPI ؛ تحدد الخطوط البيضاء طبقات المخيخ ، وشريط المقياس 25 ميكرومتر. (C) أقصى صورة إسقاط لخلية عصبية حبيبية واحدة بالكهرباء 10-DPI والتتبع ثلاثي الأبعاد المقابل ، شريط المقياس هو 10 ميكرومتر. (د) تم إنشاء عمليات إعادة البناء ثلاثية الأبعاد باستخدام البرنامج المساعد FIJI Simple Neurite Tracer. تم تتبع جميع القياسات من خلال مكدس z ، بعد إشارة ملء الخلية. تم تتبع قياسات العمود والمخلب بشكل منفصل لكل تغصنات. يشير الخط المنقط إلى جزء من الزوائد الشجيرية داخل المستوى الحالي. الاختصارات: 3D = ثلاثي الأبعاد ؛ GFP = بروتين الفلورسنت الأخضر ؛ DPI = أيام بعد الحقن ؛ PSD-95 = بروتين الكثافة بعد المشبكي 95 ؛ GNPs = أسلاف الخلايا العصبية الحبيبية ؛ PFA = بارافورمالدهيد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
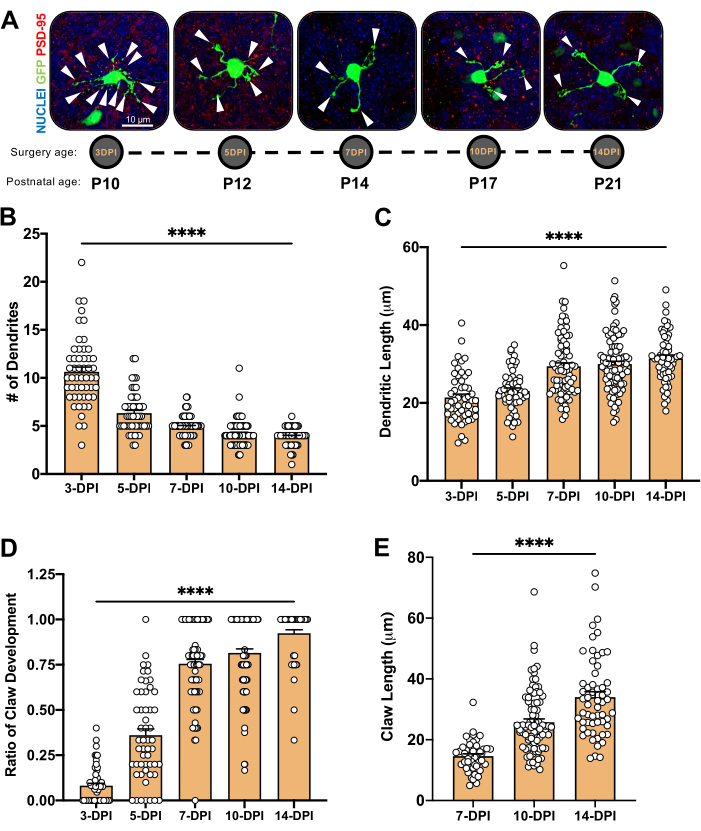
الشكل 4: تحليل مورفولوجيا الخلايا العصبية الحبيبية أثناء نمو المخيخ. (أ) صور الإسقاط القصوى لشبكات CGN المكهربة من 3 DPI إلى 14-DPI (سن ما بعد الولادة P10 إلى P21) ، نوى (أزرق) و GFP (أخضر) ؛ تشير رؤوس الأسهم إلى الزوائد الشج...
Discussion
الخلايا العصبية الحبيبية المخيخية هي الخلايا العصبية الأكثر وفرة في دماغ الثدييات ، وتشكل ما يقرب من 60-70 ٪ من إجمالي عدد الخلايا العصبية في دماغ القوارض 1,14. تم استخدام المخيخ على نطاق واسع لتوضيح آليات الانتشار الخلوي والهجرة وتكوين التغصنات وتطور المشبك
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم العمل من خلال منح المعاهد الوطنية للصحة R01NS098804 (AEW) ، F31NS113394 (U.C.) ، وبرنامج علم الأعصاب الصيفي بجامعة ديوك (D.G.).
Materials
| Name | Company | Catalog Number | Comments |
| Betadine | Purdue Production | 67618-150-17 | |
| Cemented 10 µL needle | Hamilton | 1701SN (80008) | 33 gauge, 1.27 cm (0.5 in), 4 point style |
| Chicken anti-GFP | Millipore Sigma | AB16901 | Our lab uses this antibody at a 1:1000 concentration |
| Cotton-tip applicator | |||
| Donkey anti-chicken Cy2 | Jackson ImmunoResearch | 703-225-155 | Our lab uses this antibody at a 1:500 concentration |
| Ethanol (200 proof) | Koptec | V1016 | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0052 | |
| Fast Green FCF | Sigma | F7252-5G | |
| FUGW plasmid | Addgene | 14883 | |
| Glass slides | VWR | 48311-703 | Superfrost plus |
| Glycerol | Sigma-Aldrich | G5516 | |
| Heating pad | Softheat | ||
| Hoescht 33342 fluorescent dye | Invitrogen | 62249 | |
| Imaris | Bitplane | ||
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Micro cover glass | VWR | 48382-138 | |
| Nail polish | Sally Hansen | Color 109 | |
| Normal goat serum | Gibco | 16210064 | |
| O.C.T. embedding compound | Tissue-Tek | 4583 | |
| Olympus MVX10 Dissecting Scope | Olympus | MVX10 | |
| P200 pipette reach tip | Fisherbrand | 02-707-138 | Used for needle spacer |
| Parafilm | Bemis | PM-996 | |
| PBS pH 7.4 (10x) | Gibco | 70011-044 | |
| Simple Neurite Tracer | FIJI | https://imagej.net/Simple_Neurite_Tracer:_Basic_ Instructions | |
| Sucrose | Sigma | S0389 | |
| Surgical tools | RWD Life Science | Small scissors and tweezers | |
| Triton X-100 | Roche | 11332481001 | non-ionic detergent |
| Tweezertrodes | BTX Harvard Apparatus | 45-0489 | 5 mm, platinum plated tweezer-type electrodes |
| Ultrapure distilled water | Invitrogen | 10977-015 | |
| Vectashield mounting media | Vectashield | H1000 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Zeiss 780 Upright Confocal | Zeiss | 780 |
References
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- Rahimi-Balaei, M., Bergen, H., Kong, J., Marzban, H. Neuronal migration during development of the cerebellum. Frontiers in Cellular Neuroscience. 12, 484 (2018).
- Alder, J., Cho, N. K., Hatten, M. E. Embryonic precursor cells from the rhombic lip are specified to a cerebellar granule neuron identity. Neuron. 17 (3), 389-399 (1996).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annual Review of Neuroscience. 18, 385-408 (1995).
- Ben-Arie, N., et al. Math1 is essential for genesis of cerebellar granule neurons. Nature. 390 (6656), 169-172 (1997).
- Borghesani, P. R., et al. BDNF stimulates migration of cerebellar granule cells. Development. 129 (6), 1435-1442 (2002).
- Espinosa, J. S., Luo, L. Timing neurogenesis and differentiation: insights from quantitative clonal analyses of cerebellar granule cells. Journal of Neuroscience. 28 (10), 2301-2312 (2008).
- Markwalter, K. H., Yang, Y., Holy, T. E., Bonni, A. Sensorimotor coding of vermal granule neurons in the developing mammalian cerebellum. Journal of Neuroscience. 39 (34), 6626-6643 (2019).
- Shalizi, A., et al. PIASx is a MEF2 SUMO E3 ligase that promotes postsynaptic dendritic morphogenesis. Journal of Neuroscience. 27 (37), 10037-10046 (2007).
- Shalizi, A., et al. A Calcium-regulated MEF2 sumoylation switch controls poststynaptic differentiation. Science. 311 (5763), 1012-1017 (2006).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303 (5660), 1026-1030 (2004).
- Holubowska, A., Mukherjee, C., Vadhvani, M., Stegmuller, J. Genetic manipulation of cerebellar granule neurons in vitro and in vivo to study neuronal morphology and migration. Journal of Visualized Experiments: JoVE. (85), e51070 (2014).
- Yang, Y., et al. Chromatin remodeling inactivates activity genes and regulates neural coding. Science. 353 (6296), 300-305 (2016).
- Herculano-Houzel, S. Coordinated scaling of cortical and cerebellar numbers of neurons. Frontiers in Neuroanatomy. 4, 12 (2010).
- Wilson, P. M., Fryer, R. H., Fang, Y., Hatten, M. E. Astn2, a novel member of the astrotactin gene family, regulates the trafficking of ASTN1 during glial-guided neuronal migration. Journal of Neuroscience. 30 (25), 8529-8540 (2010).
- Kokubo, M., et al. BDNF-mediated cerebellar granule cell development is impaired in mice null for CaMKK2 or CaMKIV. Journal of Neuroscience. 29 (28), 8901-8913 (2009).
- Schwartz, P. M., Borghesani, P. R., Levy, R. L., Pomeroy, S. L., Segal, R. A. Abnormal cerebellar development and foliation in BDNF-/- mice reveals a role for neurotrophins in CNS patterning. Neuron. 19 (2), 269-281 (1997).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. Journal of Neuroscience. 15 (7), 4970-4981 (1995).
- Zhou, P., et al. Polarized signaling endosomes coordinate BDNF-induced chemotaxis of cerebellar precursors. Neuron. 55 (1), 53-68 (2007).
- Dhar, M., Hantman, A. W., Nishiyama, H. Developmental pattern and structural factors of dendritic survival in cerebellar granule cells in vivo. Scientific Reports. 8 (1), 17561 (2018).
- Ito, M. Synaptic plasticity in the cerebellar cortex and its role in motor learning. Canadian Journal of Neurological Sciences. 20, 70-74 (1993).
- Jorntell, H., Hansel, C. Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron. 52 (2), 227-238 (2006).
- Nakanishi, S. Genetic manipulation study of information processing in the cerebellum. Neuroscience. 162 (3), 723-731 (2009).
- Chang, C. H., et al. Atoh1 controls primary cilia formation to allow for SHH-triggered granule neuron progenitor proliferation. Developmental Cell. 48 (2), 184-199 (2019).
Erratum
Formal Correction: Erratum: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development
Posted by JoVE Editors on 4/06/2023. Citeable Link.
An erratum was issued for: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development. A figure was updated.
Figure 2 was updated from:
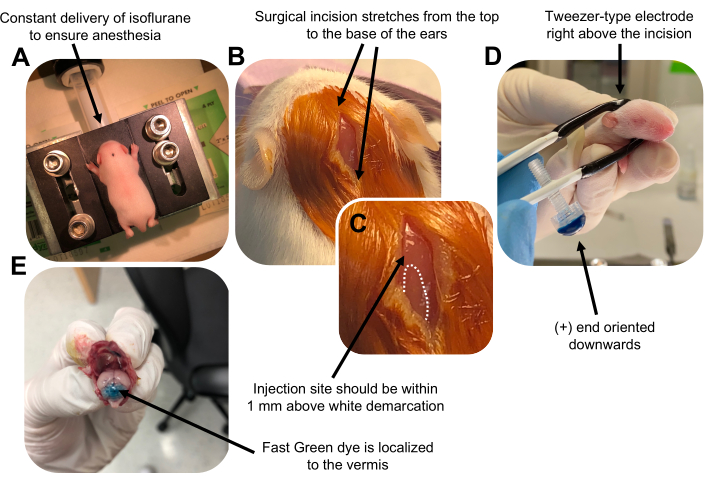
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
to:

Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved