A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج زرع الخلايا الهنترونظيرية الجزئية في الفئران
* These authors contributed equally
In This Article
Summary
تقدم هذه الورقة بروتوكولا جزئيا لزرع اللوحات العظمية النظيرية في الفئران ونتائجه المحتملة في المتابعة في منتصف المدة.
Abstract
تمثل عمليات زراعة الأوعية الدموية المركبة (VCA) خيار إعادة الإعمار الأكثر تقدما للمرضى الذين لا يعانون من إمكانيات جراحية تلقائية بعد عيب معقد في الأنسجة. لقد غيرت عمليات زرع الوجه واليد حياة المرضى المشوهين، مما منحهم جهازا اجتماعيا جماليا وعمليا جديدا. على الرغم من النتائج الواعدة ، لا يزال أداء VCA ضعيفا بسبب الأمراض المرضية المثبطة للمناعة مدى الحياة والمضاعفات المعدية. الجرذ هو نموذج حيواني مثالي للدراسات الحية التي تحقق في المسارات المناعية وآليات رفض الكسب غير المشروع. وتستخدم الفئران أيضا على نطاق واسع في تقنيات جديدة للحفاظ على الكسب غير المشروع الأنسجة المركبة، بما في ذلك التغلغل ودراسات الحفظ بالتبريد. يجب أن تكون النماذج المستخدمة ل VCA في الفئران قابلة للاستنساخ وموثوقة وفعالة مع انخفاض المراضة والوفيات بعد الجراحة. إجراءات زرع الأطراف النظائرية تفي بهذه المعايير وهي أسهل في الأداء من عمليات زرع الأطراف التقويمية. يتطلب اتقان نماذج جراحة القوارض الدقيقة خبرة قوية في الجراحة المجهرية ورعاية الحيوانات. هنا يتم الإبلاغ عن نموذج موثوق به وقابل للاستنساخ لزرع رفرف العظام غير النظائري الجزئي في الفئران، والنتائج بعد الجراحة، ووسائل الوقاية من المضاعفات المحتملة.
Introduction
على مدى العقدين الماضيين، تطورت VCA كعلاج ثوري للمرضى الذين يعانون من تشوه شديد بما في ذلك الوجه1،بتر الأطراف العليا2،القضيب3،وغيرها من عيوب الأنسجة المعقدة4،5. ومع ذلك، فإن عواقب كبت المناعة مدى الحياة لا تزال تعيق تطبيق أوسع لهذه العمليات الجراحية الترميمية المعقدة. البحوث الأساسية أمر بالغ الأهمية لتحسين استراتيجيات مكافحة الرفض. زيادة الوقت الحفاظ على VCA أمر ضروري أيضا لتحسين الخدمات اللوجستية زرع وزيادة تجمع المانحين (كما يجب على المتبرعين VCA تلبية معايير أكثر من المتبرعين بالأعضاء الصلبة، بما في ذلك لون البشرة، وحجم التشريح، والجنس). في هذا السياق ، تستخدم عمليات زرع أطراف الفئران على نطاق واسع في الدراسات حول الرفض المناعي ل allografts6،7، بروتوكولات تحريض التسامح الجديدة8، ودراسات الحفظ9،10،11. وبالتالي، فإن نماذج VCA هذه هي عنصر أساسي لإتقان أبحاث VCA التحويلية.
وقد وصفت اللوحات العظمية في الأدب كنماذج موثوقة لدراسة VCA في الفئران8،12،13،14. على الرغم من أن عمليات زرع الأطراف الكاملة التقويمية تسمح بتقييم طويل الأجل لوظيفة الكسب غير المشروع ، إلا أنه إجراء يستغرق وقتا طويلا مرتبطا بارتفاع معدلات الاعتلال والوفيات بعد الجراحة14. وعلى النقيض من ذلك، فإن نماذج زرع الأطراف غير النظائرية غير وظيفية، ولكنها تمكن من إجراء دراسات قابلة للاستنساخ على VCA. يمكن توقع نتائج ما بعد الجراحة بشكل موثوق قبل بدء دراسة زرع الفئران VCA. تفيد هذه الدراسة عن نموذج جزئي لزرع اللوحات العظمية النظيرية في الفئران يتضمن نتائج ومضاعفات محتملة متكررة يمكن أن تنشأ داخل الجراحة وبعد الجراحة خلال فترة متابعة مدتها ثلاثة أسابيع.
Protocol
وقد تلقت جميع الحيوانات رعاية إنسانية وفقا لدليل المعاهد القومية للصحة لرعاية واستخدام المختبر. وافقت اللجنة المؤسسية لرعاية الحيوانات واستخدامها (IACUC-protocol 2017N000184) ومكتب مراجعة رعاية الحيوانات واستخدامها (ACURO) على جميع بروتوكولات الحيوانات. استخدمت الفئران لويس الذكور الأصيلة (250-400 غرام) لجميع التجارب.
1. الجراحة
- تخدير الفئران لويس باستخدام استنشاق ايزوفلوران. حث التخدير مع 5٪ isoflurane في غرفة التعريفي، والحفاظ على التخدير مع استنشاق isoflurane 1.5-3٪ من خلال مخروط التنفس.
- تطبيق زيوت التشحيم العين قبل الجراحة في إجراءات البقاء على قيد الحياة. حلق موقع الجراحة، وعلاج مع كريم إزالة الشعر، فرك، والستائر مع الستائر العقيمة.
- تأكيد التخدير الكلي مع اختبار قرصة إصبع القدم قبل شق وبانتظام أثناء الإجراء. مراقبة معدلات القلب والجهاز التنفسي طوال العملية بأكملها. لجميع العمليات الجراحية، والحفاظ على ظروف معقمة باستخدام أدوات معقمة، واللوازم، الستائر، والقفازات. انظر جدول المواد للاطلاع على قائمة الأدوات المستخدمة في الإجراءات.
2. المانح الحق في شراء hindlimb الجزئي
- إجراء شق محيطي من الجلد فوق الكاحل في الثلث من الساق البعيدة.
- هيكل عظمي وكى الشريان السابهين والفرع النهائي للشريان البوبلايتال باستخدام ملقط ثنائي القطب. الكي وقطع gastrocnemius، سوليوس، الساق الأمامي، والعضلة ذات الرأسين عضلات femoris حتى يتم الكشف عن العظام الظنبوبية.
- جعل شق 2.5 سم في تجعد الإربية الحق. تشريح لوحة الدهون الأربية والتراجع عن ذلك distally لفضح الأوعية الفخذية. استخدام متراجع fishhook لفهم الرباط الأربي واللقط ملقط لعقد لوحة الدهون الإربية distally.
ملاحظة: يتم تضمين وسادة الدهون الأربية في حصاد الطرف الجزئي. - تشريح الأوعية الفخذية، وتفرد فروع ميرفي (فروع جانبية عضلية عميقة تقع عادة في منتصف الطريق بين الرباط الأربي وفرع epigastric)، وligate مع 8-0 روابط النايلون.
- Heparinize الجرذ المانحة مع 100 وحدة IU /kg الهيبارين، وحقن في الوريد الظهر القضيب باستخدام إبرة 27.5 G.
- أكمل شق الجلد حول الورك.
- الكي العضلة ذات الرأسين femoris وglutes السطحية العضلات باستخدام ملقط ثنائي القطب. الكي وقطع العصب الوركي في منتصف طول عظم الفخذ. فضح عظم الفخذ بشكل قريب على مستوى قمة الفخذ الخلفي.
ملاحظة: يتم ترك العضلات Adductor ورباعية من الشراء. يتم الحفاظ على المصطبة غير المنقوصة. - الأوعية الفخذية Ligate مع 8/0 روابط النايلون على مستوى الرباط الأربي. إجراء عملية استئصال الشرايين على الشريان الفخذي أسفل الرباط وتمدد للسماح بإدخال قسطرة أنجيو 24 G.
- الكي وقطع العضلات المتبقية تحت بيديكل، وفضح الجانب الأمامي من عظم الفخذ.
- قطع الساق وعظم الفخذ باستخدام قطع العظام كما وكيلا وdistally ممكن، على التوالي (منتصف الطول).
- قم بتدفق الجزء الخلفي الجزئي مع 2 مل من محلول الهبارين المالح (100 وحدة/مل) للحصول على تدفق وريدي واضح. تخزين على الجليد في شاش معقم حتى نقل الأوعية الدموية الدقيقة (الشكل 1).
- في حين أن الحيوان تحت التخدير العام ، وأداء القتل الرحيم عن طريق exsanguination حتى الحيوان لا يظهر أي علامة على الحياة (لا حركة الجهاز التنفسي ولا ضربات القلب).

الشكل 1: حصاد الجرذ الخلفي الجزئي. يتم إدخال 24 G angiocath في الشريان الفخذي, جاهزة لنقل الأوعية الدموية الدقيقة النظائرية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. جراحة المتلقي
- قبل الشق، حلق الجزء الخلفي من الرقبة، وإدارة البوبرينورفين 0.01-0.05 ملغم/كغ تحت الجلد. ضع الجرذ في وضعية خفيفة على وسادة التدفئة.
- جعل شق 2.5 سم في تجعد الإربية الحق. تشريح لوحة الدهون الأربية واتكاء عليه distally لفضح الأوعية الفخذية. استخدام هوك لسحب الرباط الأربي واللقط ملقط لعقد لوحة الدهون الأربية distally.
- تشريح الأوعية الفخذية، وتفرد فروع ميرفي، وligate مع العلاقات النايلون 8/0.
- Ligate كلا السفن فوق الأوعية epigastric باستخدام 8 /0 النايلون العلاقات. مكان المشابك التقريبية وكيلا وينتهي السفينة المتوسعة; شطف مع الهيبارين المالحة.
- إجراء شق على الجناح الأيسر فوق الورك، وخلق جيب تحت الجلد مع نفق تحت الجلد إلى تجعد الأربية.
ملاحظة: يتم إجراء شق داخلي فوق نطاق حركة الورك لضمان أن الحيوان يحافظ على حركة الأطراف الخلفية الطبيعية. بالإضافة إلى ذلك ، فإن الحفاظ على جسر جلدي بين مجموعة الكسب غير المشروع وموقع نقل الأوعية الدموية الدقيقة يسمح لتثبيت أفضل للكسب غير المشروع(الشكل 2). - ضع الجزء القريب من الطرف الجزئي ووسادة الدهون الأربية عبر النفق تحت الجلد لنقل الأوعية الدموية الدقيقة. إجراء anastomoses الوريدية والشريانية باستخدام 10/0 الغرز النايلون. إزالة المشابك تقريبا على حد سواء، ومراقبة إعادة الأوعية الدموية من الطرف. إجراء "اختبار الحلب" على كلا الأوعية لتقييم patency من كل التخدير.
ملاحظة: عادة ما تكون الغرز من ثمانية إلى تسعة ضرورية للتأق الوريدي ، 6 خياطات في المتوسط للتأق الشرياني. - إجراء شق الجلد الطولي على الجانب الوسيط من الطرف المزروع، وإدراج الكسب غير المشروع. إزالة الجلد الزائد من الكسب غير المشروع، وإغلاق الجرح مع الغرز منفصلة وخياطة تشغيل باستخدام خياطة قابلة للامتصاص 4/0.
- خياطة معا منصات الدهون الأربية من الطرف المزروع والمتلقي باستخدام اثنين من الغرز قابلة للامتصاص منفصلة، وإغلاق تجعد الأربية في نهاية جدا بعد الفحص الأخير من anastomoses الأوعية الدموية الدقيقة.
ملاحظة: يتم خياطة منصات الدهون الإربية بإحكام لإضافة طبقة واقية من الدهون فوق anastomoses وضمان وضع آمن للكسب غير المشروع وتذيله. إغلاق دقيق هو أفضل للشفاء الجروح; كما أنه يمنع النزيف المتبقي من الجرح ويقلل من خطر تشويه الذات. - تعويض فقدان السوائل تحت الجلد مع 1-3 مل من المالحة وفقا لكمية النزيف في الفترة المحيطة.
- ضع طوق اليزابيث حول عنق الحيوان، وتطبيق 2 الغرز فضفاضة على الجلد للحفاظ عليه في الموقف الصحيح.
- وقف استنشاق isoflurane، ورصد الحيوان باستمرار على لوحة الاحترار حتى واعية تماما والماء.
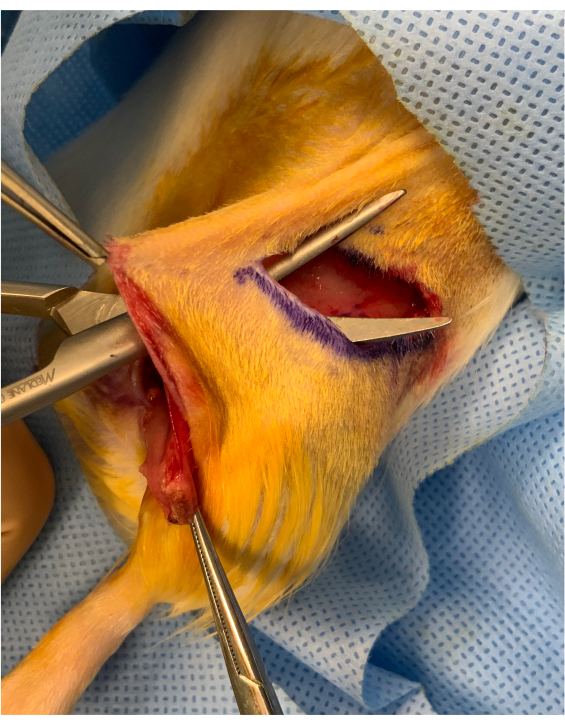
الشكل 2:صورة بيريوبيريتي قبل بدء من الطرف العظمي. يتم الحفاظ على جسر جلدي يبلغ حوالي 1 سم بين شق التجعد الإربي و inset من الكسب غير المشروع فوق الورك. يتم وضع الكسب غير المشروع تحت الجسر ، والحفاظ عليه ثابتا لنقل الأوعية الدموية الدقيقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. الرعاية بعد الجراحة
- مراقبة الحيوان مرتين يوميا لمدة 72 ساعة، ثم مرة واحدة يوميا حتى يوم ما بعد الجراحة (POD) 7، ثم مرتين في الأسبوع.
ملاحظة: يجب تعديل المراقبة لحالة الحيوان والكسب غير المشروع (قد تتطلب العيون الشاحبة سوائل تكميلية ، وتلطيخ البورفيرين كمؤشر على ألم الحيوان ، ولون / درجة حرارة الكسب غير الطبيعي) ، وينبغي مناقشة المزيد من الرعاية مع الطبيب البيطري. مطلوب سكن واحد للفئران المتلقية خلال فترة الدراسة بأكملها لتجنب أي ضرر للكسب غير المشروع. - إجراء مسكن مع الحقن تحت الجلد من البوبرينورفين و / أو غير الستيرويد المضادة للالتهابات المخدرات وفقا للمبادئ التوجيهية IACUC.
- تقييم الكسب غير المشروع، وإجراء الفحص البدني يوميا مع الصور باستخدام نفس الجهاز.
ملاحظة: استخدام كريم إزالة الشعر على الجلد الكسب غير المشروع مفيد لتقييم أفضل لون الجلد من زرع.
النتائج
في هذه الدراسة التي أجريت على مشغل واحد، تم إجراء 30 عملية زرع أطراف غير نظائرية سينجينية. تم تعريف النجاح في اليوم 21 بعد الجراحة على أنه عدم وجود فشل VCA أو مضاعفات تتطلب القتل الرحيم. يتم تمثيل التطور الطبيعي للكسب غير المشروع في الشكل 3. وكان متوسط المدة لشراء أطراف جزئية وت?...
Discussion
وقد وصفت نماذج زرع الأطراف التقويمية في القوارض في الأدب15،16،17؛ ومع ذلك ، فإنها تتطلب إصلاح الأعصاب ، وإعادة ربط العضلات ، و التمثيل العظمي المثالي لعظم الفخذ ، والتي يمكن أن تكون خطوة صعبة للغاية. وترتبط هذه النماذج أيضا مع ارتفاع معدل ال...
Disclosures
ولا يوجد لدى صاحبي البلاغ أي إفصاحات.
Acknowledgements
وقد دعم هذا العمل مكتب مساعد وزير الدفاع للشؤون الصحية من خلال برنامج البحوث الطبية الموجه من الكونغرس بموجب الجائزة رقم W81XWH-17-1-0680. الآراء والتفسيرات والاستنتاجات والتوصيات هي آراء المؤلفين ولا تؤيدها بالضرورة وزارة الدفاع.
Materials
| Name | Company | Catalog Number | Comments |
| 24 GA angiocatheter | BD Insyte Autoguard | 381412 | |
| 4-0 suture Black monofilament non absorbable suture | Ethicon | 1667 | Used to suture the E-collar to the back of the neck |
| 4-0 suture Coated Vicryl Plus Antibacterial | Ethicon | VCP496 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Bipolar cords | ASSI | 228000C | |
| Black Polyamide Monofilament USP 10-0, 4 mm 3/8c | AROSurgical | T04A10N07-13 | Used to perform the microvascular anastomoses |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Dissecting Scissors 15 cm, Round Handle 8 mm diameter, Straight Slender Tapered Blade 7 mm, Lipshultz Pattern | ASSI | ASSI.SAS15RVL | |
| Double Micro Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 18040-22 | |
| Elizabethan collar | Braintree Scientific | EC-R1 | |
| Forceps 13.5 cm long, Flat Handle, 9 mm wide Straight Tips 0.1 mm diameter (x2) | ASSI | ASSI.JFL31 | |
| Halsey Micro Needle Holder | Fine science tools (FST) | 12500-12 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star Elastic Stays | CooperSurgical | 3314-8G | Used to retract the inguinal ligament for femoral vessels dissection |
| Lone Star Self-Retaining Retractors | CooperSurgical | 3301G | |
| Micro-Mosquito Hemostats | Fine science tools (FST) | 13010-12 | Used to retract the inguinal fat pad distally |
| Needle Holder, 15 cm Round Handle, 8 mm diameter, Superfine Curved Jaw 0.2 mm tip diameter, without lock | ASSI | ASSI.B1582 | |
| Nylon Suture Black Monolfilament 8-0, 6.5 mm 3/8c | Ethilon | 2808G | Used to ligate collateral branches on the femoral vessels |
| Offset Bone Nippers | Fine science tools (FST) | 16101-10 | |
| S&T Vascular Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 00398-02 | |
| Walton scissors | Fine science tools (FST) | 14077-09 |
References
- Lanteiri, L., et al. Feasibility, reproducibility, risks and benefits of face transplantation: a prospective study of outcomes. American Journal of Transplantation. 11 (2), 367-378 (2011).
- Park, S. H., Eun, S. C., Kwon, S. T. Hand transplantation: current status and immunologic obstacles. Experimental and Clinical Transplantation. 17 (1), 97-104 (2019).
- Cetrulo, C. L., et al. Penis transplantation: first US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Grajek, M., et al. First complex allotransplantation of neck organs: larynx, trachea, pharynx, esophagus, thyroid, parathyroid glands, and anterior cervical wall: a case report. Annals of Surgery. 266 (2), 19-24 (2017).
- Pribaz, J. J., Caterson, E. J. Evolution and limitations of conventional autologous reconstruction of the head and neck. Journal of Craniofacial Surgery. 24 (1), 99-107 (2013).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. I. Results with syngeneic grafts. Transplantation. 35 (4), 293-299 (1983).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. II. Results with allogeneic grafts. Transplantation. 35 (4), 300-304 (1983).
- Adamson, L. A., et al. A modified model of hindlimb osteomyocutaneous flap for the study of tolerance to composite tissue allografts. Microsurgery. 27 (7), 630-636 (2007).
- Arav, A., Friedman, O., Natan, Y., Gur, E., Shani, N. Rat hindlimb cryopreservation and transplantation: a step toward "organ banking". American Journal of Transplantation. 17 (11), 2820-2828 (2017).
- Gok, E., et al. Development of an ex-situ limb perfusion system for a rodent model. ASAIO Journal. 65 (2), 167-172 (2019).
- Gok, E., Rojas-Pena, A., Bartlett, R. H., Ozer, K. Rodent skeletal muscle metabolomic changes associated with static cold storage. Transplantation Proceedings. 51 (3), 979-986 (2019).
- Brandacher, G., Grahammer, J., Sucher, R., Lee, W. P. Animal models for basic and translational research in reconstructive transplantation. Birth Defects Research. Part C, Embryo Today. 96 (1), 39-50 (2012).
- Fleissig, Y., et al. Modified heterotopic hindlimb osteomyocutaneous flap model in the rat for translational vascularized composite allotransplantation research. Journal of Visualized Experiments: JoVE. (146), e59458 (2019).
- Ulusal, A. E., Ulusal, B. G., Hung, L. M., Wei, F. C. Heterotopic hindlimb allotransplantation in rats: an alternative model for immunological research in composite-tissue allotransplantation. Microsurgery. 25 (5), 410-414 (2005).
- Jang, Y., Park, Y. E., Yun, C. W., Kim, D. H., Chung, H. The vest-collar as a rodent collar to prevent licking and scratching during experiments. Lab Anim. 50 (4), 296-304 (2016).
- Kern, B., et al. A novel rodent orthotopic forelimb transplantation model that allows for reliable assessment of functional recovery resulting from nerve regeneration. American Journal of Transplantation. 17 (3), 622-634 (2017).
- Perez-Abadia, G., et al. Low-dose immunosuppression in a rat hind-limb transplantation model. Transplant International. 16 (12), 835-842 (2003).
- Sucher, R., et al. Orthotopic hind-limb transplantation in rats. Journal of Visualized Experiments. (41), e2022 (2010).
- Fleissig, Y. Y., Beare, J. E., LeBlanc, A. J., Kaufman, C. L. Evolution of the rat hind limb transplant as an experimental model of vascularized composite allotransplantation: Approaches and advantages. SAGE Open Medicine. 8, 2050312120968721 (2020).
- Lindboe, C. F., Presthus, J. Effects of denervation, immobilization and cachexia on fibre size in the anterior tibial muscle of the rat. Acta Neuropathologica. 66 (1), 42-51 (1985).
- Nazzal, J. A., Johnson, T. S., Gordon, C. R., Randolph, M. A., Lee, W. P. Heterotopic limb allotransplantation model to study skin rejection in the rat. Microsurgery. 24 (6), 448-453 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved