A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تجارب NMR عالية الضغط للكشف عن حالات المطابقة منخفضة البروتين
In This Article
Summary
نحن نقدم وصفا مفصلا للخطوات المطلوبة لتجميع خلية الضغط العالي، وإعداد وتسجيل تجارب NMR عالية الضغط، وأخيرا تحليل كل من كثافة الذروة والتغيرات التحول الكيميائي تحت الضغط. يمكن أن توفر هذه التجارب رؤى قيمة في مسارات قابلة للطي والاستقرار الهيكلي للبروتينات.
Abstract
الضغط العالي هو طريقة اضطراب معروفة يمكن استخدامها لزعزعة استقرار البروتينات الكروية ومجمعات البروتين التفكك بطريقة قابلة للعكس. يدفع الضغط الهيدروستاتيكي الاعتدال الديناميكي الحراري نحو الحالة (الدول) مع انخفاض حجم الضرس. زيادة الضغط يوفر، لذلك، الفرص لضبط بدقة استقرار البروتينات كروية والاعتدال أوليغوميرين من مجمعات البروتين. تسمح تجارب NMR عالية الضغط بإجراء توصيف مفصل للعوامل التي تحكم استقرار البروتينات الكروية ، وآليات طيها ، وآليات احتكار القلة من خلال الجمع بين الاستقرار الدقيق في ضبط قدرة اضطراب الضغط ودقة الموقع التي يوفرها التحليل الطيفي NMR الحل. هنا نقدم بروتوكولا للتحقيق في الاستقرار للطي المحلية من البروتين عن طريق مجموعة من التجارب 2D 1H-15N سجلت من 1 شريط إلى 2.5 كيلوبار. وتتجلى الخطوات اللازمة لاكتساب هذه التجارب وتحليلها في البيانات التي تم الحصول عليها في مجال RRM2 التابع ل hnRNPA1.
Introduction
منذ فترة طويلة من المسلم به أن الطاقة العالية، والدول تشكيلية قليلة السكان من البروتينات ومجمعات البروتين تلعب دورا رئيسيا في العديد من المسارات البيولوجية1،2،3. بفضل التجارب القائمة على كار بورسيل-ميبوم-جيل (CPMG)4، نقل تشبع التبادل الكيميائي (CEST)5، ونقل تشبع الصرف في الحالة المظلمة (DEST)6 تسلسلات نبض (من بين أمور أخرى) ، ظهر التحليل الطيفي NMR كحل كطريقة للاختيار لوصف الحالات التوافقية العابرة7. جنبا إلى جنب مع هذه التجارب، يمكن إدخال الاضطرابات مثل درجة الحرارة، ودرجة الحموضة، أو التسخين الكيميائي لزيادة عدد السكان النسبي من الدول الفرعية أعلى تشكيل الطاقة. وبالمثل، يمكن أيضا أن تكون مضطربة توازن البروتين عن طريق تطبيق الضغط الهيدروستاتيكي عالية. اعتمادا على حجم تغيير حجم المرتبطة التغيرات المطابقة تشكيلية, زيادة الضغط من قبل بضع مئات إلى بضعة آلاف من القضبان يمكن أن تستقر بشكل كبير في حالة طاقة أعلى أو يسبب البروتين تتكشف تماما8,9,10. عادة ما تعرض أطياف البروتين NMR نوعين من التغييرات مع الضغط الهيدروستاتيكي: (1) تغييرات التحول الكيميائي و (2) تغيرات كثافة الذروة. تعكس تغييرات التحول الكيميائي التغيرات في واجهة المياه السطحية البروتينية و / أو الضغط المحلي لهيكل البروتين على مقياس زمني سريع (بالنسبة إلى مقياس الوقت NMR)11. Crosspeaks عرض التحولات الكيميائية غير الخطية الكبيرة الاعتماد على الضغط يمكن أن تشير إلى وجود أعلى الدول تشكيل الطاقة12،13. ومن ناحية أخرى، تشير التغيرات في كثافة الذروة إلى تحولات تشكيلية رئيسية على نطاق زمني بطيء، مثل التغيرات في عدد سكان الولايات المطوية/التي تتكشف. يمكن الكشف عن وجود وسيطات قابلة للطي أو حالات طاقة أعلى من اختلافات كبيرة في حجم تغير الحجم عند التكشف قياسها لبقايا مختلفة من بروتين معين14،15،16،17. استنادا إلى تجربتنا، حتى البروتينات الصغيرة التي تصنف عادة على أنها مجلدات من دولتين تظهر استجابات غير موحدة للضغط، والتي توفر معلومات مفيدة حول استقرارها للطي المحلي. وصف هنا هو بروتوكول لاكتساب وتحليل كثافة الذروة وسط و 1H التحولات الكيميائية الاعتماد على الضغط، وذلك باستخدام بروتين نموذج التعرف على الحمض النووي الريبي معزولة عزر 2 (RRM2) من ريبونوكليوبروتين النووية غير متجانسة A1 (hnRNPA1).
Access restricted. Please log in or start a trial to view this content.
Protocol
ملاحظة: يتطلب البروتوكول الموضح هنا (1) مضخة عالية الضغط وخلية مع أنبوب الزركونيا 2.5 كيلوبار مصنف من الألومنيوم18، (2) البرنامج SPARKY19 لتحليل أطياف NMR ، و (3) برنامج تركيب المنحنى.
1. إعداد العينة، وتجميع الخلية ذات الضغط العالي، وإعداد التجارب.
- اختيار المخزن المؤقت: استخدام خليط متساو من المخازن المؤقتة الأيونية والتكونية، مثل الفوسفات وتريش20،21.
ملاحظة: يرتبط pKa من المخازن المؤقتة أنيوني مثل الفوسفات و MES مع حجم رد فعل كبير (أي الفرق في أحجام مولية جزئية من حمض والمنتجات المؤينة). وبالتالي، يمكن أن يتأثر الرقم الحموضة لهذه المخازن المؤقتة بشكل كبير بتغيير الضغط (~ 0.25-0.5 وحدة الحموضة / kbar). - تأكد من أن حجم العينة المطلوب مشابه لحجم أنبوب NMR القياسي قطره 3 مم (~ 300μL).
- أدخل العينة 15N المسمى مع ماصة زجاجية في أنبوب الزركونيا. تأكد من أن عينة المقاعد في الجزء السفلي من الأنبوب. كاملة مع 200 ميكرولتر من النفط المعدني لمنع العينة من الاختلاط مع السائل انتقال (على سبيل المثال، الماء). ملء بقية الأنبوب مع السائل انتقال.
- وضع واحد استخدام O-حلقة على رأس أنبوب الزركونيا والانزلاق أنبوب في قاعدة (الشكل 1A, B). ثم قم بتوصيل الأنبوب بخط الحبل عالي الضغط وشد القاعدة بالخلية مباشرة. ثم, تطبيق 14.7 نيوتن متر من عزم الدوران لمنع تسرب في الضغط المنخفض (الشكل 1C, D).
- للتحقق من سلامة تجميع خلايا الضغط، قم بالضغط على الأنبوب حتى 300 شريط خارج المطياف باستخدام دعم الخلايا ووعاء الاحتواء. انتظر لمدة 15 دقيقة، إعادة تعيين الضغط إلى 1 شريط والتحقق من وجود تسرب مع مسح نظيفة خالية من الوبر.
- أدخل الأنبوب غير المضغوط في المطياف بتوجيه خط الحبل بعناية. حرك الأنبوب في المطياف حتى تصل إلى وضعية الجلوس العينة (الشكل 1E).
- قفل، شيم، المباراة، وضبط 1H و 15N قنوات كالمعتاد.
ملاحظة: Shims لأنابيب الزركونيا ذات الضغط العالي تختلف كثيرا عن أنابيب NMR القياسية. فمن المستحسن لحفظ الشيم الأمثل للاستخدام في المستقبل. - إعداد 1H-15N-HSQC أو TROSY-HSQC وتسجيل تجربة مرجعية في الظروف الجوية (1bar).
2. تسجيل تجارب NMR عالية الضغط
- زيادة الضغط تدريجيا من 1 شريط إلى 2.5 كيلوبار مع 500 شريط زيادات لاختبار الاستقرار العام للبروتين. تعيين سرعة مضخة الضغط افتراضيا في ~ 18 شريط / ثانية. إذا لم تكن معدلات الطي/التكشف الدقيقة معروفة، فدع العينة تتوازى من 15 إلى 20 دقيقة بعد كل زيادة بمقدار 500 بار. سجل طيفا عند 2.5 كيلوبار.
- خفض الضغط تدريجيا مرة أخرى إلى 1 شريط مع 500 خطوات شريط لاختبار عكس اضطراب الضغط. تسجيل طيف آخر في الظروف الجوية ومقارنة التحولات الكيميائية وكثافة الذروة مع الطيف المرجعي المسجل سابقا في نفس الظروف.
ملاحظة: إذا كانت الأرقام المتقاطعة الأصلية أكثر كثافة بعد تشغيل الضغط، فقد يشير ذلك إلى أن المجاميع الصغيرة الموجودة في المحلول عند الضغط الجوي قد تكون قد فصلت وأعيد طيها بشكل صحيح. من ناحية أخرى، تشير الخسارة في الكثافة أو التغيرات الكيميائية الهامة إلى أن البروتين قد يعاني من سوء غير قابل للعكس في ظروف الضغط العالي. - سجل سلسلة من التجارب 2D من شريط واحد إلى 2.5 كيلوبار كل شريط 500. من المستحسن تسجيل تجارب إضافية بالقرب من نقطة انقلاب الانتقال القابل للطي / التكشف لتحسين دقة الملاءمة.
3. تحليل تغيرات كثافة الذروة
- معالجة جميع الأطياف ونقل تعيين العمود الفقري من الطيف المرجعي في شريط 1 إلى الطيف المسجل في شريط 500، ومن ثم نقل التعيين من 500 شريط إلى 1 كيلوبار وهلم جرا.
ملاحظة: لأن الضغط يحفز على تحول غير موحد من 1H و 15N التحولات الكيميائية، لا مجرد نسخ التعيين العمود الفقري من طيف واحد إلى آخر. ضبطه يدويا. - في قائمة Sparky، انقر على قائمة الذروة > الذروة (lt). في إطار قائمة الذروة، انقر فوق خيارات وحدد الخيار لعرض كل من الترددات (ppm) وارتفاع البيانات. حفظ القائمة التي تم الحصول عليها لكل طيف.
- في برنامج تركيب المنحنى، انسخ قيم الهوية عبر peak وقيم شدة الذروة للحصول على قيم الضغط (في شريط) كمتغير محور X والكثافة كمتغير محور ص.
- إذا لوحظ اكتمال أو شبه اكتمال (>80٪) تتكشف، تناسب ملامح كثافة الذروة الفردية لاستخراج الطاقة الحرة وتغيير حجم عند تتكشف، على التوالي، وذلك باستخدام نموذج بسيط من دولتين:
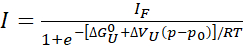 مكافئ 1
مكافئ 1
حيث ، "أنا" هو كثافة لوحظ من crosspeak في ع ضغط معين وأناF هو كثافة نفس crosspeak في حالة مطوية بالكامل. R هو ثابت الغاز، T هو درجة الحرارة المطلقة، ΔGU0 الفرق القياسي جيبس الطاقة الحرة بين الدول التي تكشفت ومطوية في الضغط الجوي ص0 (1 بار)، و ΔVش تغيير حجم عند تتكشف. مع الضغط p في شريط ودرجة الحرارة T في كلفن، R = 1.987 كال / ك، ΔGU0 في كال / مول، و ΔVU هو في كال / مول / بار. ضرب قيمU ΔV التي تم الحصول عليها من صالح من قبل 41.84 لتحويلها إلى مل / مول. ΔVU القيم عادة ما تكون في نطاق -50 إلى -150 مل / مول للبروتينات كروية22. هنا، يتم التعبير عن جميع المعلمات فيما يتعلق برد الفعل تتكشف ولكن يمكن بسهولة تحويلها إلى معلمات رد فعل قابلة للطي (ΔGU0 = -ΔGF0 و ΔVU = -ΔVF).
4. تحليل التغيرات في التحول الكيميائي
- ترتيب الأعمدة في البرنامج من أجل الحصول على نقاط الضغط كمتغير والتحولات الكيميائية 1H المستخرجة من قوائم سباركي كمحور Y.
- تناسب الاعتماد على الضغط من التحولات الكيميائية 1H إلى معادلة تربيعية بسيطة:
δ(ع) = δ0(p0) + B1(p-p0) + B2 (p-p0)2 Eq.
حيث، δ(ع)هو قياس 1H التحول الكيميائي من crosspeak في ضغط معين ف δ0(ص0) التحولات الكيميائية 1H من نفس crosspeak في الطيف المرجعي المسجل في شريط 1. B1 و B2 تمثل المعلمات من الدرجة الأولى والثانية المعبر عنها في ppm/bar وppm/bar2، على التوالي.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم استخدام البروتوكول الموصوف هنا للتحقيق في الاعتماد على الضغط من RRM2 ، وهو ثاني عزر التعرف على الحمض النووي الريبي من hnRNPA1 (المخلفات 95-106) ، والذي يتم كشفه بالكامل تقريبا داخل نطاق 2.5 كيلوبار (>90٪). 1 H-15N تم جمع الأطياف في 1 بار، 500 بار، 750 بار، 1 كيلوبار، 1.5 كيلوبار، 2 كيلوبار، و 2.5 كيل?...
Access restricted. Please log in or start a trial to view this content.
Discussion
تفصل هذه الدراسة بروتوكولا تم تنفيذه للتحقيق في استجابات البنيوية والديناميكا الحرارية للبروتين لاضطرابات الضغط. تثبت تجارب الضغط العالي المسجلة هنا على RRM2 أن الاختلافات الكبيرة في قيم ΔVU ، مما يدل على تطور غير تعاوني بالكامل ، يمكن العثور عليها في بروتين مجال واحد صغير نسبيا. وتنب...
Access restricted. Please log in or start a trial to view this content.
Disclosures
وقد قرأ جميع المؤلفين المخطوطة ووافقوا عليها. وهم لا يعلنون عن أي تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل بأموال من صندوق روي ج. كارفر الخيري لجوليان روش. نشكر ج. د. ليفينغود وب. س. تولبرت على التكرم بتقديم عينة RRM2.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Bruker Nmr Cell 2.5 Kbar | Daedalus Innovations LLC | NMRCELL-B | |
| Sparky3 | University of California San Francisco, CA | N/A | |
| Xtreme-60 Syringe pump | Daedalus Innovations LLC | XTREME-60 |
References
- Alderson, R. T., Kay, L. E. Unveiling invisible protein states with NMR spectroscopy. Current Opinion in Structural Biology. 60, 39-49 (2020).
- Korzhnev, D. M., Kay, L. E. probing invisible, low-populated states of protein molecules by relaxation dispersion NMR spectroscopy: An application to protein folding. Accounts of Chemical Research. 41, 442-451 (2008).
- Loria, P. J., Berlow, R. B., Watt, E. D. Characterization of enzyme motions by solution NMR relaxation dispersion. Accounts of Chemical Research. 41, 214-221 (2008).
- Ishima, R. CPMG relaxation dispersion. Methods in Molecular Biology. 1084, 29-49 (2014).
- Longo, D. L., et al. Chemical exchange saturation transfer (CEST): an efficient tool for detecting molecular information on proteins' behaviour. Analyst. 39, 2687-2690 (2014).
- Fawzi, N. L., Ying, J., Torchia, D. A., Clore, M. G. Probing exchange kinetics and atomic resolution dynamics in high-molecular-weight complexes using dark-state exchange saturation transfer NMR spectroscopy. Nature Protocols. 7, 1523-1533 (2012).
- Anthis, N. J., Clore, M. G. Visualizing transient dark states by NMR spectroscopy. Quarterly Reviews of Biophysics. 48, 35-116 (2015).
- Roche, J., et al. Cavities determine the pressure unfolding of proteins. Proceedings of the National Academy of Sciences of the United States of America. 109, 6945-6950 (2012).
- Chen, C. R., Makhatadze, G. I. Molecular determinant of the effects of hydrostatic pressure on protein folding stability. Nature Communications. 8, 14561(2017).
- Roche, J., Royer, C. A. Lessons from pressure denaturation of proteins. Journal of the Royal Society Interface. 15, 20180244(2018).
- Xu, X., Gagné, D., Aramini, J. M., Gardner, K. H. Volume and compressibility differences between protein conformations revealed by high-pressure NMR. Biophysical Journal. 120, 924-935 (2021).
- Akasaka, K., Li, H. Low-lying excited states of proteins revealed from non-linear pressure shifts in 1H and 15N NMR. Biochemistry. 40, 8665-8671 (2001).
- Akasaka, K. Probing conformational fluctuation of proteins by pressure perturbation. Chemical Reviews. 106, 1814-1835 (2006).
- Kitahara, R., Yokoyama, S., Akasaka, K. NMR snapshots of a fluctuating protein structure: ubiquitin at 30 bar-3 kbar. Journal of Molecular Biology. 347, 277-285 (2005).
- Roche, J., et al. remodeling of the folding free energy landscape of Staphylococcal nuclease by cavity-creating mutations. Biochemistry. 51, 9535-9546 (2012).
- Nucci, N. V., Fuglestad, B., Athanasoula, E. A., Wand, J. A. Role of cavities and hydration in the pressure unfolding of T4 lysozyme. Proceedings of the National Academy of Sciences of the United States of America. 111, 13846-13851 (2014).
- Maeno, A., et al. Cavity as a source of conformational fluctuation and high-energy state: High-pressure NMR study of a cavity-enlarged mutant of T4 lysozyme. Biophysical Journal. 108, 133-145 (2015).
- Peterson, R. W., Wand, J. A. Self-contained high-pressure cell, apparatus, and procedure for the preparation of encapsulated proteins dissolved in low viscosity fluids for nuclear magnetic resonance spectroscopy. Review of Scientific Instruments. 76, 094101(2005).
- Goddard, T. D., Kneller, D. G. Sparky 3. , University of California San Francisco. San Francisco, CA. (2010).
- Caro, J. A., Wand, J. A. Practical aspects of high-pressure NMR spectroscopy and its applications in protein biophysics and structural biology. Methods. 148, 67-80 (2018).
- Kitamura, T., Itoh, J. Reaction volume of protonic ionization for buffering agents. Prediction of pressure dependence of pH and pOH. Journal of Solution Chemistry. 16, 715-725 (1987).
- Royer, C. A. Revisiting volume changes in pressure-induced protein unfolding. Biochimica et Biophysica Acta. 1595, 201-209 (2002).
- Erlach, M. B., et al. Relationship between nonliner pressure-induced chemical shift changes and thermodynamic parameters. Journal of Physical Chemistry B. 118, 5681-5690 (2014).
- de Oliveira, G. A. P., Silva, J. L. A hypothesis to reconcile the physical and chemical unfolding of proteins. Proceedings of the National Academy of Sciences of The United States of America. 112, 2775-2784 (2015).
- Nguyen, L. M., Roche, J. High-pressure NMR techniques for the study of protein dynamics, folding and aggregation. Journal of Magnetic Resonance. 277, 179-185 (2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved