Method Article
المجهر ورقة خفيفة من ديناميات القلب السريع في أجنة حمار وحشي
In This Article
Summary
نحن نصف الأدوات المحسنة لدراسة قلب حمار وحشي في الجسم الحي مع المجهر مضان ورقة الضوء. على وجه التحديد، نقترح خطوط القلب المعدلة وراثيا مشرق وتقديم تقنيات جديدة لطيف تضمين وشل الحركة التي تجنب عيوب النمو والقلب. كما يتم توفير خط أنابيب محتمل للحصول على البيانات وتحليلها يتكيف مع تصوير القلب.
Abstract
استفادت أبحاث القلب الجنينية بشكل كبير من التقدم في المجهر الفلوري للصفائح الضوئية الحية (LSFM). جنبا إلى جنب مع التطور الخارجي السريع، وعلم الوراثة القابلة للسحب، وشفافية حمار وحشي، دانيو ريو، قدمت LSFM رؤى في شكل القلب ووظيفته في قرار المكانية والزمنية عالية دون السمية الضوئية كبيرة أو photobleaching. تصوير قلوب الضرب يتحدى إعداد العينة القائمة وتقنيات المجهر. يحتاج المرء إلى الحفاظ على عينة صحية في مجال الرؤية الضيق والحصول على صور فائقة السرعة لحل نبضات القلب. هنا نحن نصف الأدوات والحلول الأمثل لدراسة قلب حمار وحشي في الجسم الحي. نحن نثبت تطبيقات الخطوط المعدلة وراثيا مشرق لتسمية مكونات القلب وتقديم تقنيات جديدة لطيف التضمين وشل الحركة التي تجنب عيوب النمو والتغيرات في معدل ضربات القلب. كما نقترح خط أنابيب لاكتساب البيانات وتحليلها يتكيف مع التصوير القلبي. يركز سير العمل بأكمله المعروض هنا على تصوير القلب الجنيني لسمك الحمار الوحشي ولكن يمكن تطبيقه أيضا على عينات وتجارب أخرى مختلفة.
Introduction
للكشف عن الأحداث المعقدة والتفاعلات في القلب النابض المبكر ، مطلوب التصوير في الجسم الحي للجهاز بأكمله. مع الحد الأدنى من السمية الضوئية1,2,3, انخفاض photobleaching4, وسرعة عالية, وقد تطورت المجهر ورقة الضوء كأداة التصوير الأولية للتنمية الجنينية والقلب5,6. وقد قدمت رؤى في شكل القلب ووظيفته بدقة مكانية وزمنية عالية7,8,9 وسمحت للباحثين بتصوير وتتبع أجزاء من القلب تحمل علامات فلورية بسرعة عالية، ودراسة القوى الديناميكية الدموية، ومتابعة نمو القلب مباشرة داخل جسم الأجنة النامية6,10,11,12.
ولتقييد سمك الحمار الوحشي على وجه الدقة وعلى نحو مستنسخ في مجال الرؤية، توجد مجموعة متنوعة من بروتوكولات التضمين للصفائح الخفيفة، على المدى القصير والطويل، فضلا عن عينة واحدة أو متعددة العينة13،14،15،16،17،18،19. البروتوكول الأكثر شيوعا ينطوي على شل tricaine وgarose تصاعد داخل أنبوب زجاجي أو بلاستيكي. ومع ذلك ، حيث يمكن أن يتغير معدل ضربات القلب بسبب درجة الحرارة والتخدير والمواد المضمنة المستخدمة 20،21،22 ، يتطلب تصوير القلب حمار وحشي بروتوكولات محددة ولطيفة لضمان صحة العينة 6،8،11،12،20،21،22،23 . للتصوير على المدى القصير (حتى ساعة)، يمكن للمرء تخدير الأسماك في 130 ملغم/لتر تريكين وتضمينها في أنابيب بروبيلين الإيثيلين المفلور (FEP) مع محلول الآغروز بنسبة 0.1٪ وقابس، كما هو موضح في Weber وآخرون. ومع ذلك ، حيث يمكن أن يؤدي tricaine إلى عيوب تنموية20،22 ، يجب استخدام بروتوكولات مختلفة للتصوير على المدى الطويل.
هنا نصف استراتيجية جديدة لتصوير القلب على المدى الطويل. في حين أن العديد من تطبيقات ورقة الضوء exist24، نوصي باستخدام عينة معلقة في المجهر T-SPIM (كشف واحد واثنين من العدسات الإضاءة في مستوى أفقي مع عينة معلقة عموديا في التركيز المشترك). وهذا يعطي حرية الحركة والتناوب اللازمة لتحديد المواقع عينة دقيقة. يتم شل حركة الأسماك عن طريق حقن 30 pg α-bungarotoxin مرنا في مرحلة خلية واحدة أو خليتين. α-bungarotoxin هو سم ثعبان يشل العضلات دون التأثير على نمو القلب والأوعية الدموية أو علم وظائف الأعضاء22. للتصوير الدقيق الخالي من التشويه، نوصي بتركيب الأسماك في أنابيب مصنوعة من FEP، وهو بوليمر مع مؤشر انكسار مطابق تقريبا للماء. نناقش كيفية إعداد أنابيب FEP بشكل أفضل عن طريق استقامتها وتنظيفها قبل التصوير. ثم يتم تركيب الأسماك في هذه الأنابيب ، والرأس إلى أسفل ، في وسائل الإعلام ، ويتم إغلاق الجزء السفلي من الأنبوب مع قابس agarose 2 ٪ ، والتي تقع عليها رؤوس الأسماك. قطع الثقوب في أنبوب FEP يسهل تبادل الغاز ويضمن نمو الأسماك. يمكن الاحتفاظ بالسمك المضمن في الوسائط حتى يتم تركيبه على حامل عينة قبل التصوير مباشرة. كما نقترح الحصول على البيانات وتحليلها للتصوير عالي السرعة القابل للاستنساخ. علاوة على ذلك ، نناقش استخدام خطوط السيتوبلازمية مقابل الغشاء المعدلة وراثيا لوضع علامات قوية على خلايا القلب ، بالإضافة إلى خيارات مختلفة لوقف القلب. تضمن هذه التقنيات المتصاعدة صحة العينة مع السماح بتقييد القلب بدقة واستنساخ في مجال الرؤية.
Protocol
تم التعامل مع جميع البالغين والأجنة من سمك الحمار الوحشي (دانيو ريو) وفقا للبروتوكولات التي وافقت عليها لجنة الرعاية والاستخدام المؤسسية للحيوانات UW-Madison (IACUC).
1. إعداد حمار وحشي
- التعامل مع حمار وحشي وفقا للبروتوكولات المنشأة25،26 والمبادئ التوجيهية المؤسسية. تربية الأسماك الكبار من خط المعدلة وراثيا المطلوب (انظر المناقشة). جمع الأجنة والاحتفاظ بها في 28 درجة مئوية في طبق بيتري مليئة المتوسطة الأسماك، على سبيل المثال، E327.
- اختر طريقة لشل الحركة (راجع مناقشة).
- إذا كنت تستخدم α-bungarotoxin مرنا لشل حركة الأسماك، وحقن 30 pg mRNA22 في صفار واحد أو اثنين من خلية مرحلة الأجنة باستخدام إبرة زجاجية تحمل محمولة على micromanipulator ومتصلة picoinjector28.
- إذا كنت تستخدم tricaine، وجعل 0.4٪ حل الأسهم المخزنة مؤقتا إلى درجة الحموضة 7.0-7.4 مع قاعدة 1 M تريس وتخزينها في -20 درجة مئوية حتى التصوير.
- احتفظ بالبيض في طبق بيتري مملوء E3 عند 28 درجة مئوية ونقل البيض كل 24 ساعة إلى طبق جديد مع E3 الطازج حتى التصوير.
- لمنع تكوين الصباغ، إذا كانت خلفية حمار وحشي ليست ألبينو، نقل الأسماك في 24 ساعة بعد الإخصاب (hpf) إلى طبق E3 جديدة مع 0.2 mM التيروزيناسي مثبط 1- فينيل 2-ثيويريا (انظر المناقشة).
2. إعداد أنابيب FEP
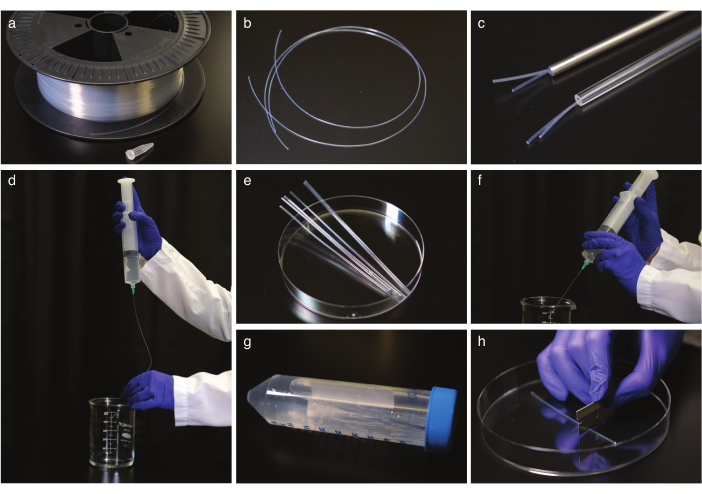
الشكل 1: FEP أنبوب التنظيف وتقويم. (أ) أنابيب FEP على طبل كابل. (ب) أنابيب FEP قبل استقامة. (ج) أنابيب FEP في أنابيب آمنة من الزجاج والصلب. (د) مسح أنابيب FEP بعد استقامة وتهدئة. (ه) أنبوب FEP قطع إلى حجم أنبوب الطرد المركزي ل sonication. (و) مسح أنابيب FEP بعد sonication. (ز) تخزين أنابيب FEP التي تم تنظيفها وتقويمها في أنبوب طرد مركزي. (ح) قطع أنبوب FEP قبل التصوير. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قم بتصويب أنابيب FEP (الشكل 1a، b) عن طريق وضعها في أنابيب آمنة من الزجاج أو الصلب (الشكل 1c) مع القطر الداخلي الصحيح لتناسب أنابيب FEP، وعادة 1.6 أو 2.4 مم، وautclave إلى 180 درجة مئوية لمدة 2 ساعة. دع الأنابيب تبرد في درجة حرارة الغرفة لمدة 5 ساعة على الأقل. ثم، إزالة من أنابيب استقامة.
ملاحظة: استخدم القفازات عند معالجة الأنابيب والعمل مع أنابيب 50 سم في كل مرة. - تنظيف أنابيب FEP.
ملاحظة: يوصى بالمحاقن ذات طرف الإبرة الحادة لحجم أنبوب FEP الداخلي للسلامة ، ولكن ستعمل إبرة عادية.- اغسل الأنابيب ب 1 M NaOH مرتين باستخدام حقنة 50 مل (الشكل 1d).
- قطع أنابيب FEP إلى حجم أنبوب الطرد المركزي 50 مل مع شفرة حلاقة (الشكل 1e)، مكان أنابيب قطع في 0.5 M NaOH شغل أنابيب الطرد المركزي، و بالموجات فوق الصوتية لهم لمدة 10 دقيقة.
- قم بتدفق أنابيب FEP باستخدام H2O المقطر المزدوج ، ثم كرر التنظيف بالإيثانول بنسبة 70٪ (الشكل 1f).
- نقل أنابيب إلى 70٪ الإيثانول والموجات فوق الصوتية لمدة 10 دقيقة.
- قم بغسل الأنابيب باستخدام H2O المقطر المزدوج وتخزينها في أنابيب الطرد المركزي في H2O المقطر المزدوج (الشكل 1g).
3. إعداد طبق الآغاروز 2٪
- في قارورة زجاجية، حل منخفضة ذوبان نقطة مسحوق الآغاروز في E3. سخني المحلول في ميكروويف وحركيه كل 20 ق، حتى يذوب كل مسحوق.
- صب agarose في طبق بيتري الزجاج أو البلاستيك لجعل معطف 1-2 ملم. انتظر حتى يتم ترسيخ الآجروز.
- لتخزين، صب بلطف E3 على الجزء العلوي من أجار لمنع التجفيف. التفاف في فيلم البارافين والحفاظ على 4 درجة مئوية.
4. إعداد وسائل الإعلام المضمنة
- إعداد ما يكفي من E3 لملء غرفة العينة.
ملاحظة: تجنب استخدام الميثيل الأزرق إذا كانت الوسائط على اتصال مع العدسات الموضوعية. - إذا كنت تستخدم tricaine، حل الأسهم ذوبان وإضافة 0.02٪ tricaine إلى E3.
5. تركيب عينة
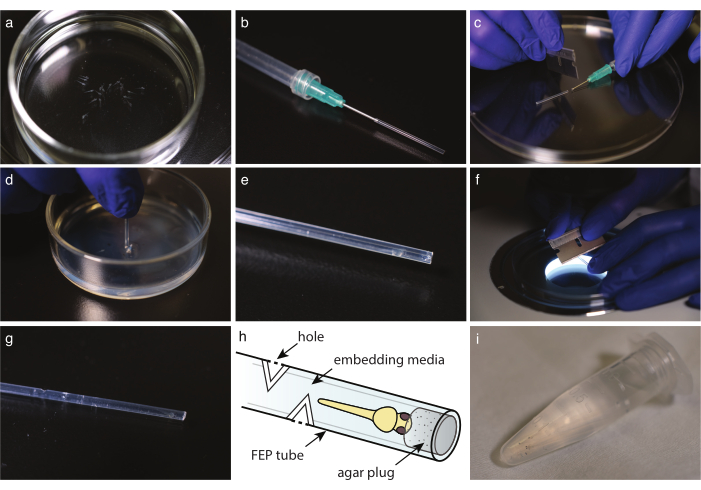
الشكل 2: الجنين المتصاعد في أنبوب FEP. (أ) الأسماك الخالية من الصباغ المخدر في وسائل الإعلام المتصاعدة. (ب) حقنة مع إبرة نهاية حادة وأنبوب FEP المرفقة. (ج) بمجرد تناول الوسائط والأسماك في أنبوب FEP ، اقطع الأنبوب على حافة الإبرة. (د) غمس أنبوب قطع في طبق المغلفة مع 2٪ agarose لسد نهايته. (ه) سمكة حمار وحشي في أنبوب FEP موصول. (و) قطع أنبوب FEP بلطف عند 30 درجة لإنشاء ثقوب لتبادل الغاز. (ز) أنبوب FEP مع أربعة ثقوب فوق حمار وحشي مضمن. (ح) مخطط لسمكة حمار وحشي مضمنة في أنبوب FEP. ويشار إلى الثقوب والمكونات أجار. '1' سمك حمار وحشي متعدد مضمن جاهز للتصوير. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- مع ماصة زجاجية يمكن التخلص منها، نقل الأسماك إلى وسائل الإعلام تضمين (الشكل 2a). إذا كنت تستخدم tricaine، نقل الأسماك إلى طبق بيتري مليئة E3 التي تحتوي على tricaine، 10 دقيقة قبل التصوير. في كلتا الحالتين، عرض تحت مجسم للتحقق من أن الأسماك توقفت عن الحركة وأن القلب ينبض بسرعة مماثلة بالمقارنة مع عنصر التحكم.
- قطع أنبوب FEP إلى الطول المثالي مع شفرة حلاقة (الشكل 1h).
ملاحظة: يجب تعديل الطول على حامل عينة المجهر؛ طول نموذجي حوالي 3 سم. - إعداد حقنة مع قنية نهاية حادة. ملء المحاقن مع الهواء، ثم جبل أنبوب FEP على الإبرة وطرد بلطف من أي المياه المتبقية عن طريق إفراغ الحقنة (الشكل 2b).
ملاحظة: تجنب صنع فقاعات عن طريق التنظيف ببطء من الهواء. - مع أنبوب FEP المثبتة على المحاقن ، أولا ، تناول الوسائط لملء أنبوب FEP ، ثم تناول رأس الجنين لأسفل. إبقاء رأس السمك أقرب إلى نهاية أنبوب ممكن. تجنب صنع أي فقاعات. إذا كانت هناك فقاعة، تجاهل العينة.
- مع شفرة حلاقة، وقطع بعناية أنبوب FEP على حافة قنية نهاية حادة أو إبرة (الشكل 2C).
- تجاهل أي سائل على الجزء العلوي من الطبق المغلفة أجار. يغرق أنبوب FEP مباشرة في أجار (الشكل 2D). تدوير الأنبوب وأخذه إلى الخروج للافراج عن المكونات من سرير agarose.
- تحت مجسمة، تحقق من وجود المكونات أجار في نهاية الأنبوب (الشكل 2e).
- للتصوير على المدى الطويل، وقطع 3-5 ثقوب في أنبوب FEP في كل اتجاه الكاردينال، على الأقل 5 مم فوق نهاية الأسماك.
- تحت مجسمة، استخدم شفرة حلاقة عمودي على محور الأنبوب لإجراء شق 30 درجة في أنبوب FEP حتى الوصول إلى الوسائط المتصاعدة (الشكل 2f).
- جعل قطع الثانية في 180 درجة لخلق حفرة (الشكل 2G، ساعة).
- نقل رأس الجنين المركب إلى أنبوب طرد مركزي صغير سعة 1.5 مل مع وسائط تضمين حتى يصبح جاهزا للصورة (الشكل 2i).
6. عينة تحديد المواقع

الشكل 3: غرفة العينة. (أ) أنبوب FEP مثبت على حامل عينة. (ب) غرفة العينة ذات المراحل والأهداف. (ج) المنظر الأعلى لغرفة العينة المليئة بالوسائط، مع هدف الإضاءة والكشف في تكوين T-SPIM. (د) حامل العينة المثبت على المجهر، مع العينة في الغرفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
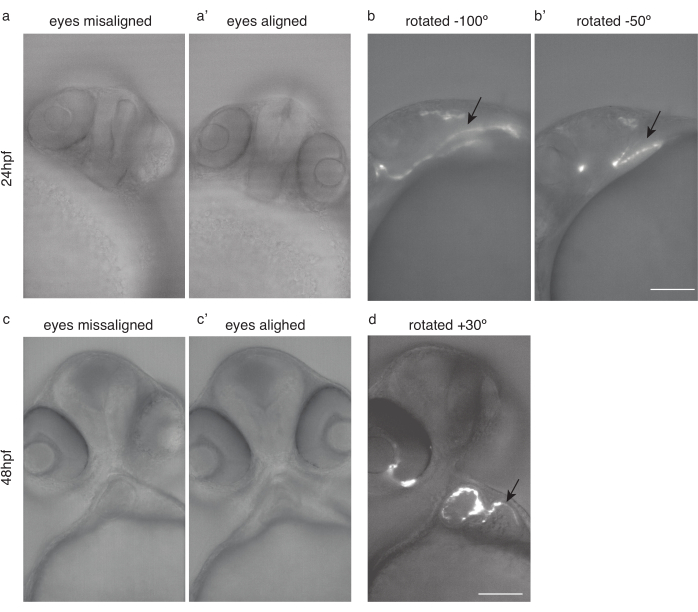
الشكل 4: تحديد موقع الجنين لتصوير القلب. (أ) 24 hpf Tg (kdrl:Hsa.HRAS-mCherry) حمار وحشي مع عيون المنحرفة. (أ') نفس السمكة، مع عيون الانحياز. (ب) نفس السمك استدار -100 درجة و (ب)-50 درجة لتصوير القلب الأمثل. (ج) 48 سمكة حمار وحشي hpf مع عيون المنحرفة. (ج') نفس السمكة، مع عيون الانحياز. (د) نفس السمكة استدارت بمقدار 30 درجة لتصوير القلب الأمثل. السهام السوداء تشير إلى القلب. شريط مقياس 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- في المجهر، قم بتركيب أنبوب FEP في حامل العينة (الشكل 3a) وملء غرفة التصوير بوسائط تضمين (الشكل 3b،c). بعد ذلك، ضع حامل العينة على المسرح مع تراجع العينة في الغرفة (الشكل 3d).
- تحقق من صحة العينة. تقييم بصريا معدل ضربات القلب لتقييم العافية الأسماك عموما، ومعدل ضربات القلب محددة هي مرحلة ودرجة الحرارة تعتمد، من خلال مقارنة مع الأسماك غير محمولة على السيطرة. إذا كانت ضربات القلب بطيئة جدا، تجاهل الأسماك.
ملاحظة: ضمان التعامل لطيف من الأجنة، ونقل دقيق إلى تضمين وسائل الإعلام، والتصوير مباشرة بعد تضمين، وتجنب التغيرات السريعة في درجة الحرارة، وتجنب tricaine، وخفض وقت التعرض لtricaine. - للتصوير القابل للتكرار، استخدم دائما نفس موضع العينة. يوصى بمحاذاة العينين والتصوير بزاوية.
- تدوير الأسماك بحيث كلتا العينين (الشكل 4a، ج) في المستوى البؤري (الشكل 4a'،c')
- من هذا الموقف، مزيد من تدوير الأسماك حوالي 50 °-100 ° في اتجاه عقارب الساعة للتصوير 24 حصان (الشكل 4b، b')، وحوالي 20°-30° عكس عقارب الساعة للتصوير 48 حصان (الشكل 4D).
ملاحظة: القلب المبكر، قبل 30 حصان، يمكن أن يكون من الصعب على الصورة بسبب موقفها الخفي (الشكل 4b).
7. الحصول على صورة
- اختر جانب الإضاءة الذي يمنح أفضل جودة للصورة وتكيف طاقة الليزر مع كل سمكة.
ملاحظة: سجل طاقة الليزر المستخدمة لتحليل الصورة اللاحقة. - في كل طائرة z، سجل 4-5 نبضات القلب في 300 لقطة في الثانية (FPS) أو أكثر.
ملاحظة: يمكن اقتصاص حقل العرض لزيادة سرعة الامتلاك. على سبيل المثال، في 48 حصان قلب حمار وحشي يدق مرتين إلى ثلاث مرات في الثانية الواحدة، وبالتالي، في 300 إطارا في الثانية، ما بين 300 و 600 الإطارات مطلوبة للحصول على أربع إلى ست ضربات القلب. - لتسجيل القلب النابض، قم بتحريك العينة خطوة بخطوة عبر ورقة الضوء. استخدم تباعد z من 1-2 ميكرومتر، يغطي عمق القلب بأكمله.
8. معالجة الصور
- مزامنة الفيلم المسجل لإعادة بناء 4D (x,y,z, الوقت) القلب باستخدام فيجي (صورة J229,30) البرنامج المساعد كما هو موضح سابقا6.
- لاستكشاف البيانات وتوليد أفلام من قلب حمار وحشي المقدمة، تحميل ملف 4D (x، y، z، الوقت) في برنامج تقديم 3D.
النتائج
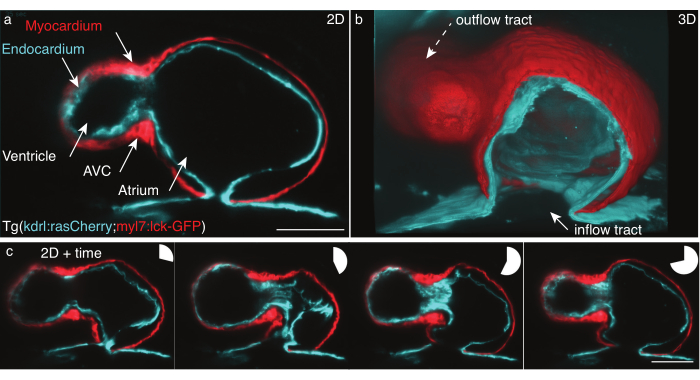
الشكل 5: قلب حمار وحشي 48 حصانف. (أ) لا يزال من واحد Z الإطار، عرض الأمامية البطنية من 48 hpf Tg (kdrl:Hsa.HRAS-mCherry؛ myl7:lck-EGFP) حمار وحشي، في الصورة مع LSFM، (ب) إعادة بناء 3D من أكوام الفيلم، وقطع عرض من خلال الأذين. (ج) مونتاج من أربعة إطارات على نبضة قلب كاملة في طائرة واحدة z. تشير المخططات الدائرية إلى الوقت أثناء نبضات القلب. مقياس شريط 50 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
لقد سجلنا 48 حصان القلب النابض من TG (kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) حمار وحشي وفقا للبروتوكول المفصل أعلاه (الشكل 5). وأضاءت 488 نانومتر وورقة ضوء ليزر 561 نانومتر العينة في وقت واحد. تم الكشف عن الفلورسينس المنبعث عموديا باستخدام عدسة هدف 16x/0.8 W وكاميرا علمية لأشباه الموصلات أكسيد المعادن (sCMOS).
في 48 حصان، خضع القلب للتو حلقات ولها غرفتين، البطين والأذين ولكن لم تتطور الصمامات. في أفلامنا، يمكن تمييز هياكل القلب المختلفة مثل المسالك الداخلة والبطين وقناة البطين (AVC) والأذين ومسار التدفق بسهولة (الشكل 5a، b). تظهر هذه البيانات النبض الدقيق وتكشف عن التشابكات المعقدة بين طبقتي خلايا القلب: عضلة القلب، وطبقة عضلة وحيدة الخلية تتقلص وتولد القوة (الشكل 5c، الأحمر)، والإندروكارديوم، وهي طبقة خلية واحدة تربط القلب بال الأوعية الدموية (الشكل 5c، سماوي).
تم تنفيذ إعادة بناء ضربات القلب في x،y،z (3D) + الوقت (4D) + اللون (5D) وفقا ل Mickoleit وآخرون.6. ويستند إعادة الإعمار على فرضيتين: حركة القلب متكررة، وينبغي الحصول على البيانات مع خطوة z صغيرة. الإخراج هو إعادة بناء نبضة قلب واحدة في 5D، وقياس 30 غيغابايت إلى 80 غيغابايت لكل نبضة قلب. لتقديم البيانات ، استخدمنا الحرة ، أداة مفتوحة المصدر FluoRender لdoRender في عمق rendering31 كما تم تصميمه للتعامل مع مجموعات البيانات متعددة الأبعاد ويجعل بسهولة أفلام 5D من كل من طبقات الخلية والطبقات الفردية (الشكل 5b).
Discussion
خطوط معدلة وراثيا لتصوير القلب
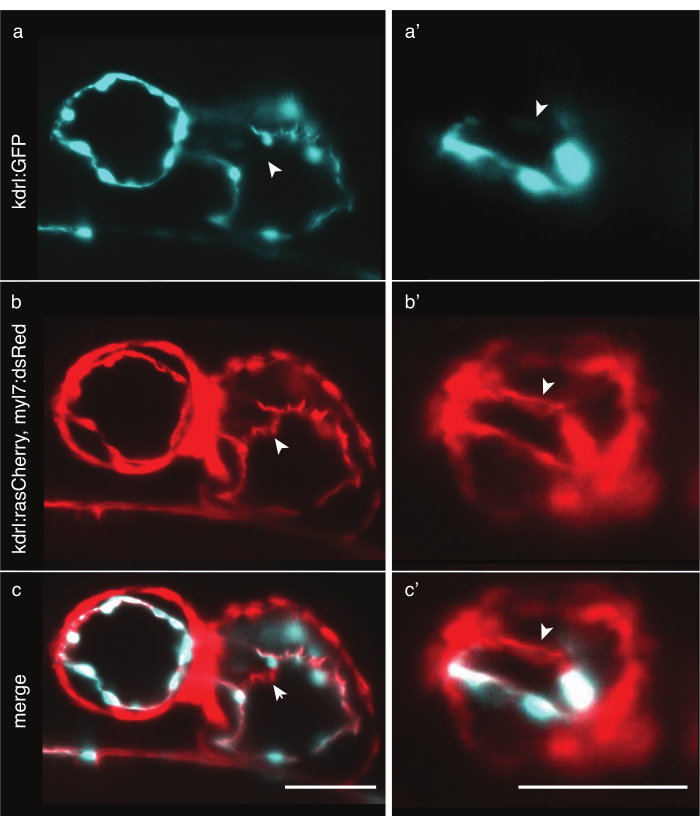
الشكل 6: مقارنة بين خطوط السيتوبلازما وعلامة الغشاء حمار وحشي المعدلة وراثيا. منظر أمامي بطني ل 48 قلب حمار وحشي hpf مصورة مع LSFM. تشير الأسهم البيضاء إلى الهياكل المرئية فقط مع خط معدل وراثيا لعلامة الغشاء. (أ) إشارة TG(kdrl:EGFP)32 في سماوي في القلب و (أ)في البطين. (ب) Tg(kdrl:Hsa.HRAS-mCherry؛ إشارة myl7:dsRed)33 باللون الأحمر في القلب و(ب)في البطين. ( ج،ج') دمج كل من TG (kdrl:Hsa.HRAS-mCherry؛ myl7:dsRed) و TG(kdrl:EGFP) إشارة. مقياس شريط 50 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
تصوير قلب حمار وحشي يتطلب وضع علامات دقيقة على خلايا القلب. في حين أن سمك عضلة القلب ثابت نسبيا في جميع أنحاء الخلايا ، فإن خلايا الشغاف سميكة حول النواة ولكن لديها نتوءات غشاء رقيقة ، في بعض المناطق أرق من 2 ميكرومتر. خطوط السيتوبلازمية المعدلة وراثيا مثل Tg(kdrl:EGFP)32 تسمية فعالة المناطق حول نواة القلب، ولكن بعيدا، السيتوبلازم رقيقة قد لا تنبعث منها فوتونات كافية ليتم الكشف عنها مع مثل هذه الأوقات التعرض القصير، مما يؤدي إلى ثقوب اصطناعية في البيانات (الشكل 6a). في المقابل، يمكن أن علامات الغشاء خطوط المعدلة وراثيا مثل Tg(kdrl:Hsa.HRAS-mCherry)33 تسمية بشكل فعال اندروكارديوم وتكشف عن مزيد من التفاصيل (الشكل 6b، ج). لكل تجربة، اختر بعناية الخط المعدل وراثيا الأنسب.
شل حركة سمك الحمار الوحشي
اختيار تقنية شل الحركة يعتمد على طول التجربة وعمر السمكة إلى الصورة. وقد استخدمت عادة Tricaine لشل حمار وحشي، ويرجع ذلك في الغالب إلى سهولة استخدامه. في الواقع، ببساطة إضافة 130 ملغم/لتر tricaine إلى وسائل الإعلام الأسماك النتائج في تخدير في 10 دقيقة. كما يمكن أن يؤدي إلى عيوب النمو وتؤثر على فسيولوجيا القلب20,22, نوصي باستخدام tricaine فقط للتجارب القصيرة (أقل من 30 دقيقة). للتصوير لفترة أطول، α-bungarotoxin حقن مرنا في مرحلة خلية واحدة أو خليتين يشل الأسماك تصل إلى 3 أيام بعد الإخصاب (dpf) دون التأثير على نمو القلب والأوعية الدموية أو علم وظائف الأعضاء22.
اختيار أنابيب FEP الصحيحة
أنابيب FEP متوفرة في مختلف الأقطار والسماكة. لتصوير السمك 0-5 dpf، 0.8 مم هو قطر داخلي جيد. اختر إما جدار سميك أنابيب 0.8 × 1.6 مم أو جدار رفيع 0.8 × 1.2 مم أنابيب. نوصي أنابيب رقيقة الجدران. ومع ذلك، توفر الجدران سمكا زيادة الاستقرار والصلابة، والتي يمكن أن تكون مهمة إذا كان غرفة العينة قد تدفق وسائل الإعلام التي يمكن أن تعطل وتحريك أنبوب رفيع. بالنسبة للعينات الأكبر حجما، يمكن استخدام 1.6 × 2.4 مم و2 × 3 مم.
تبادل درجات الحرارة والغاز
الجانب الأساسي لرفاه جنين حمار وحشي هو درجة الحرارة. من الناحية المثالية، حافظ على الأسماك عند 28.5 درجة مئوية أثناء التصوير، حيث تؤثر درجة حرارة البيئة على التنمية ومعدل ضربات القلب34.
في تجربتنا، وتبادل الأكسجين من خلال المكونات agarose 2٪ يحافظ فقط على معدل ضربات القلب مستقرة حتى 3-4 dpf. لذلك، قطع ثقوب في الأنبوب يضمن نشر الأكسجين. ويمكن أيضا أن يكون ضروريا لتسليم المخدرات إلى العينة إذا رغبت في ذلك.
تعليق ضربات القلب.
تسمح سرعات الاستحواذ السريعة للمجاهر ذات الصفائح الضوئية المجهزة بشكل مناسب بتسجيل القلب النابض في الجسم الحي. ومع ذلك، للحصول على كومة ض دون عائق، يمكن للمرء أن يبطئ أو وقف القلب. ومع ذلك، فإن إيقاف القلب يؤدي إلى استرخاء عضلة القلب وقد يؤدي إلى انهيار القلب6. يمكن أن يتم تعليق ضربات القلب باستخدام مورفولينوس، وانخفاض درجات الحرارة، مثبط تقلص العضلات أو optogenetics. كل هذه الطرق لها عيوبها ويجب تقييمها بعناية لكل تجربة.
حقن 4 نانوغرام من القلب الصامت (سيه) مورفولينو في مرحلة خلية واحدة يمكن أن توقف ضربات القلب عن طريق استهداف tnnt2a الجينات حاسمة لتشكيل الساركومير35. لا يوجد لدى سمك الحمار الوحشي sih نبض قلب ولا يبقى على قيد الحياة إلا حتى 7 dpf ، عندما تبدأ الأجنة في الاعتماد على الدم المتداول للأوكسجين. كما يحركها مورفوجينيسيس القلب من قبل كل من القوى الوراثية والميكاميكولوجية الحيوية36، هذه الأسماك الحالية تشوهات القلب حول 3 dpf.
كما تدفق Ca2 + حساسة لدرجة الحرارة، ودرجة الحرارة يؤثر على معدل ضربات القلب في حمار وحشي الجنين21. وبالتالي، فإن خفض درجة الحرارة في غرفة التصوير يبطئ ضربات القلب. توقف ضربات القلب يتطلب درجات حرارة أقل من 15 درجة مئوية. وبما أن حمار وحشي عادة ما يبقى عند 28.5 درجة مئوية، لا يمكن الحفاظ على درجات الحرارة المنخفضة هذه إلا لفترات قصيرة (أقل من 10 دقائق).
يمكن إضافة أدوية مثل المثبطات الكيميائية لتقلصات العضلات ، 2،3-Bu-tanedione 2-monoxime (BDM) ، إلى وسائط حمار وحشي (50 nM37،38) لتعليق ضربات القلب مؤقتا. BDM مريحة للاستخدام لأنه يوقف تقلص القلب في أقل من 15 دقيقة، ويمكن غسلها بعيدا لاستعادة وظيفة القلب. ومع ذلك ، كما BDM يغير إمكانات العمل القلبي ، يجب استخدامه بحذر37.
وأخيرا، يمكن التلاعب بقلب سمك الحمار الوحشي المعدل وراثيا الذي يعبر عن قنوات أو مضخات أيونية ذات بوابات خفيفة مثل القناة أو الهالورهودوبسين في عضلة القلب وإيقافه عن طريق إضاءة جهاز تنظيم ضربات القلب في مسار التدفق بالضوء39,7,40,41,9.
توقعات
تتيح الأدوات والحلول المحسنة المقدمة لدراسة قلب الحمار الوحشي في الجسم الحي التصوير الطويل الأمد واللطيف لديناميكيات القلب فائقة السرعة. ويمكن تكييف تضمين العينة ليناسب طرائق التصوير المختلفة، مثل المجهر البؤري، أو المجهر ثنائي الفوتون، أو التصوير المقطعي الإسقاط البصري (OPT). ومع ذلك، من المرجح أن يكون المجهر الضوئي هو التقنية المفضلة التي توفر تقسيما بصريا بسرعة كافية لالتقاط ديناميكيات القلب. في حين أن هذا البروتوكول يركز على تصوير القلب الجنيني حمار وحشي، ونحن نعتقد أنه يمكن أيضا أن تطبق على عينات وتجارب أخرى مختلفة. سيكون من المثير للاهتمام أن نرى في المستقبل ما إذا كان يمكن استخدام تقنيات التضمين والتصوير المماثلة في مراحل لاحقة أثناء التطوير عندما يكون القلب أكثر إخفاء واليرقة أقل شفافة.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نشكر مادلين نيوفيلد على التوضيح في الشكل 2h. وقد دعم هذا العمل كل من جمعية ماكس بلانك، ومعهد مورغريدج للبحوث، ومبادرة تشان زوكربيرغ، وبرنامج علوم الحدود البشرية.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf | Eppendorf | 22364111 | To carry embedded samples |
| 15mL Falcon tubes | Falcon | 352095 | To carry embedded samples |
| 50mL centrifuge tubes | Falcon | 352070 | 50ml tubes for sonication step, and storing cleaned, straightened FEP tubes |
| 50mL syringe | BD | 309654 | 50ml syringe for FEP cleaning |
| Agarose, low gelling temperature | Sigma Aldrich | 39346-81-1 | To make plug |
| Blunt Tip Needles, 21 gauge | VWR | 89500-304 | Blunt end needle for 0.8 inner diameter FEP tube |
| Borosilicate glass tube | McMaster-Carr | 8729K33 | Tubing for FEP tube straightening 9.5mm outer diameter, 5.6 inner diameter, 30cm long, other sizes available |
| Borosilicate glass tube | McMaster-Carr | 8729K31 | Tubing for FEP tube straightening 6.35mm outer diameter, 4mm inner diameter, 30cm long, other sizes available |
| Conventional needles, 21 Gauge | BD | 305165 | Conventional needle for 0.8 inner diameter FEP tube |
| Disposable glass pipette | Grainger | 52NK56 | To transfer fish, use with pipette pump |
| E3 medium for zebrafish embryos | |||
| Ethanol | Sigma Aldrich | 64-17-5 | Ethanol for FEP cleaning |
| FEP tube, 0.8 / 1.2 mm | ProLiquid | 2001048 | FEP tube with thin wall, other sizes available |
| FEP tube, 0.8 / 1.6 mm | Bola | S1815-04 | FEP tube with thick wall, other sizes available |
| FEP tube, 2/3mm | BGB | 211581 | Large FEP tube with thick wall, other sizes available |
| Hot Hand Rubber Mitt | Cole-Parmer | 691000 | To carry hot equipment after autoclaving |
| Omnifix 1mL Syringes | B Braun | 9161406V | 1ml syringe for embedding |
| Petri dish, small | Dot Scientific | PD-94050 | To make agarose plug |
| Pipette pumps | Argos Technologies | 04395-05 | To transfer fish, use with disposable glass pipette |
| PTU | Sigma Aldrich | 103-85-5 | Also known as: N-Phenylthiourea, 1-Phenyl-2-thiourea, Phenylthiocarbamide |
| Razor blades | Azpack | 11904325 | To cut FEP tubes |
| Sodium Hydroxide | Dot Scientific | DSS24000 | NaOH for FEP cleaning |
| Tricaine | Sigma Aldrich | E10521 | Also known as: MS-222, Ethyl 3-aminobenzoate methanesulfonate, Tricaine |
References
- Hoebe, R. A., et al. Controlled light-exposure microscopy reduces photobleaching and phototoxicity in fluorescence live-cell imaging. Nature Biotechnology. 25 (2), 249-253 (2007).
- Jenielita, M., Taormina, M. J., Delaurier, A., Kimmel, C. B., Parthasarathy, R. Comparing phototoxicity during the development of a zebrafish craniofacial bone using confocal and light sheet fluorescence microscopy techniques. Journal of Biophotonics. 6 (11-12), 920-928 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (8), 1700003 (2017).
- Reynaud, E. G., Kržič, U., Greger, K., Stelzer, E. H. K. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. Human Frontier Science Program Journal. 2 (5), 266-275 (2008).
- Weber, M., Huisken, J. Light sheet microscopy for real-time developmental biology. Current Opinion in Genetics & Development. 21 (5), 566-572 (2011).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nat Methods. 11 (9), 919-922 (2014).
- Arrenberg, A. B., Stainier, D. Y., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Trivedi, V., et al. Dynamic structure and protein expression of the live embryonic heart captured by 2-photon light sheet microscopy and retrospective registration. Biomed Optics Express. 6 (6), 2056-2066 (2015).
- Weber, M., Yelon, D., et al. Cell-accurate optical mapping across the entire developing heart. eLife. 6, 28307 (2017).
- Weber, M., Huisken, J. In vivo imaging of cardiac development and function in zebrafish using light sheet microscopy. Swiss Medical Weekly. 145, 14227 (2015).
- Fei, P., et al. Cardiac light-sheet fluorescent microscopy for multi-scale and rapid imaging of architecture and function. Science Reports. 6 (1), 1-12 (2016).
- Felker, A., et al. Continuous addition of progenitors forms the cardiac ventricle in zebrafish. Nature Communication. 9 (1), 1-14 (2018).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Pampaloni, F., Stelzer, E. H. Life sciences require the third dimension. Current Opinion in Cell Biology. 18 (1), 117-124 (2006).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science. 322 (5904), 1065-1069 (2008).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer mounting for long-term light sheet microscopy of zebrafish. Journal of Visualized Experiments. (84), e51119 (2014).
- Berndt, F., Shah, G., Power, R. M., Brugués, J., Huisken, J. Dynamic and non-contact 3D sample rotation for microscopy. Nature Communications. 9 (1), 1-7 (2018).
- Daetwyler, S., Günther, U., Modes, C. D., Harrington, K., Huisken, J. Multi-sample SPIM image acquisition, processing. and analysis of vascular growth in zebrafish. Development. , 173757 (2019).
- Keomanee-Dizon, K., Fraser, S. E., Truong, T. V. A versatile, multi-laser twin-microscope system for light-sheet imaging. Review of Scientific Instruments. 91 (5), 053703 (2020).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Science Reports. 10 (1), 1-12 (2020).
- Swinburne, I. A., Mosaliganti, K. R., Green, A. A., Megason, S. G. Improved long-term imaging of embryos with genetically encoded α-bungarotoxin. PLOS ONE. 10 (8), 0134005-0134015 (2015).
- Taylor, J. M., et al. Adaptive prospective optical gating enables day-long 3D time-lapse imaging of the beating embryonic zebrafish heart. Nature Communication. 10 (1), 1-15 (2019).
- Power, R. M., Huisken, J. A guide to light-sheet fluorescence microscopy for multiscale imaging. Nature Methods. 14 (4), 360-373 (2017).
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish: A Practical Approach. , (2002).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Cold Spring Harbor. E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011, 66449 (2011).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Jin, S. -. W., Beis, D., Mitchell, T., Chen, J. -. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132 (23), 5199-5209 (2005).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes and Development. 22 (6), 734-739 (2008).
- Scott, G. R., Johnston, I. A. Temperature during embryonic development has persistent effects on thermal acclimation capacity in zebrafish. Proceedings of the National Academy of Sciences. 109 (35), 14247-14252 (2012).
- Sehnert, A. J., et al. Cardiac troponin T is essential in sarcomere assembly and cardiac contractility. Nature Genetics. 31 (1), 106-110 (2002).
- Sidhwani, P., Yelon, D., Wellik, D. M. Fluid forces shape the embryonic heart: Insights from zebrafish. Current Topics in Developmental Biology. 132, 395-416 (2019).
- Jou, C. J., Spitzer, K. W., Tristani-Firouzi, M. Blebbistatin effectively uncouples the excitation-contraction process in zebrafish embryonic heart. Cell Physiology and Biochemistry. 25 (4-5), 419-424 (2010).
- Chow, R. W. -. Y., Lamperti, P., Steed, E., Boselli, F., Vermot, J. following endocardial tissue movements via cell photoconversion in the zebrafish embryo. Journal of Visualized Experiments. (132), e57290 (2018).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proccedings of the National Academy of Sciences. 100 (24), 13940-13945 (2003).
- Knollmann, B. C. Pacing lightly: optogenetics gets to the heart. Nature Methods. 7 (11), 889-891 (2010).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved