Method Article
جهاز زرع بسيط وفعال لأجنة حمار وحشي
In This Article
Summary
تعد التلاعبات الجنينية مثل استئصال الخلايا وزرعها أدوات مهمة لدراسة التطور المبكر. يصف هذا البروتوكول جهاز زرع بسيط وفعال لإجراء هذه التلاعبات في أجنة حمار وحشي.
Abstract
إن التلاعبات الجنينية الكلاسيكية، مثل إزالة الخلايا وزرع الخلايا داخل الأجنة أو بينها، هي تقنيات قوية لدراسة عمليات النمو المعقدة. تعد أجنة سمك الحمار الوحشي مناسبة بشكل مثالي لهذه التلاعبات نظرا لأنها يمكن الوصول إليها بسهولة ، وكبيرة نسبيا في الحجم ، وشفافة. ومع ذلك ، فإن الأجهزة التي تم تطويرها سابقا لإزالة الخلايا وزرعها مرهقة للاستخدام أو مكلفة للشراء. في المقابل ، فإن جهاز الزرع المعروض هنا اقتصادي وسهل التجميع وبسيط الاستخدام. في هذا البروتوكول، نقدم أولا التعامل مع جهاز الزرع وكذلك تجميعه من الأجزاء المتاحة تجاريا وعلى نطاق واسع. ثم نقدم ثلاثة تطبيقات لاستخدامها: توليد الحيوانات المستنسخة خارج الرحم لدراسة تشتت الإشارات من مصادر موضعية، وتجث الخلايا لإنتاج أجنة منخفضة الحجم، وزرع الجرثومة لتوليد المسوخ الأم الزيجوتية. وأخيرا، نظهر أن الأداة يمكن أن تستخدم أيضا للتلاعب الجنيني في أنواع أخرى مثل ميداكا أسماك الأرز اليابانية.
Introduction
من التجارب الكلاسيكية مانغولد وسبيمان التي أظهرت وجود منظم تعليمات تشكيل محور الجنين1، زرع الخلايا بين الأجنة أصبح تقنية راسخة لدراسة التطور الجنيني2،3،4،5،6،7،8،9،10 . ويتكون الإعداد الشائع الاستخدام للزرع من حقنة ضيقة بالغاز يتم التحكم فيها بواسطة ميكرومتر متصلة بحامل ميكروبايت من خلال أنابيب مرنة وخزان مليء بالزيت المعدني12,13. في هذا الإعداد، يتم نقل المكبس من الحقنة من خلال المسمار. يتم نقل الضغط المتولد بهذه الطريقة إلى الميكروباينيت ويستخدم لسحب الخلايا من جنين واحد وإيداعها في جنين آخر. ومع ذلك، يتكون هذا الجهاز الذي يعمل هيدروليكيا من أجزاء كثيرة وشاقة لتجميع من الصفر. ويمكن أيضا شراء أجهزة مماثلة كجهاز عمل كامل ، وعادة ما تباع كمقنات دقيقة يدوية ، وتكلف هذه الإصدارات التجارية عادة أكثر من 1500 دولار أمريكي. في كل من النسخة المنزلية والتجارية ، يتم فصل micropipette للتلاعب الجنين من الجهاز توليد الضغط (حقنة الغاز ضيق) من خلال أنابيب مملوءة بالنفط. التلاعب في micropipette وحركة المكبس ، لذلك ، يجب أن تعمل بشكل منفصل مع أيدي مختلفة ، والحد من الإنتاجية والفائدة. وعلاوة على ذلك، فإن الأجهزة مرهقة للتحضير لزرع منذ أنابيب يحتاج إلى أن تكون مليئة بعناية مع النفط مع تجنب تشكيل فقاعات. هنا، نقوم بوصف جهاز بديل يعمل بالهواء المضغوط لإزالة الخلايا وزرعها غير مكلف وسهل التجميع وبسيط الاستخدام.
الجهاز المعروض هنا يتكون من 25 ميكرولتر الغاز ضيق حقنة مزودة حامل micropipette وتكاليف أقل من 80 دولارا أمريكيا تماما. يتم تجميع الجهاز بسهولة عن طريق إدخال حامل micropipette في الحقنة عن طريق تركيب قفل Luer (الشكل 1A). ثم يتم تركيب الجهاز مباشرة على ميكرومانيبولاتور، مما يسمح للمستخدم بالتحكم في كل من موقعه والشفط بيد واحدة مباشرة في المايكرومانيبولاتور. هذا يترك اليد الأخرى حرة لتحقيق الاستقرار ونقل طبق زرع تحتوي على الأجنة المانحة والمضيف. يعمل الجهاز عن طريق الشفط المباشر بالهواء ولا يحتاج إلى ملء بالزيوت المعدنية. نظرا للقوى الجذابة بين الماء وجدران الإبرة الزجاجية ، تترجم حركة كبيرة في المكبس للمحقنة إلى حركة أصغر في مستوى الماء داخل الإبرة ، طالما أن مستوى الماء في النهاية المدببة لل إبرة الزجاج. وهذا يسمح بالتحكم الدقيق في عدد الخلايا المهتتة وموقع إدراجها.
لإثبات فائدة هذا الجهاز، نقدم ثلاثة تطبيقات في أجنة حمار وحشي (دانيو ريو). أولا، نعرض كيفية توليد مصادر مترجمة لجزيئات الإشارات المفرزة، والتي يمكن استخدامها لدراسة تشكيل التدرج2،4،6. هنا، يتم حقن الأجنة المانحة مع مرنا ترميز جزيء إشارة المسمى الفلورسنت. ثم يتم زرع الخلايا المانحة المسماة بالفلورسينس إلى أجنة مضيفة من النوع البري حيث يمكن تصوير تكوين تدرج الإشارة وتحليله. ثانيا، نحن نصف كيف يمكن استخدام الجهاز لإزالة الخلايا عن طريق الخلع من أجل توليد الأجنة ذات الحجم المنخفض5،13. وأخيرا، نظهر كيفية إنتاج المسوخ الأم الزيجوتية بقوة عن طريق زرع خلايا تحمل مراسل الخلايا الجرثومية البدائية في الأجنة المضيفة التي تم فيها استئصال الخط الجرثومي 6,10. في المستقبل، يمكن تكييف جهاز الزرع الموصوف هنا بسهولة مع التلاعبات الجنينية الأخرى التي تتطلب إزالة أو زرع الخلايا.
Protocol
1. تجميع واستخدام جهاز الزرع
- تجميع جهاز الزرع.
- قم بتوصيل طرف Luer 25 ميكرولتر من المحاقن الضيقة بالغاز وحامل micropipette مع تركيب قفل Luer لتجميع جهاز الزرع (الشكل 1A).
ملاحظة: يمكن أن يساعد ترطيب طرف Luer بكمية رقيقة من الماء في تعزيز الاتصال عن طريق عقد الأجزاء معا عن طريق التصاق المياه وتماسكها. - قم بتركيب الجهاز مباشرة على جهاز بصورة دقيقة يدوية (الشكل 1B). يمكن التحكم في الجهاز باليد المهيمنة وحدها ، وتحرير اليد الأخرى لمهام إضافية.
- قم بتوصيل طرف Luer 25 ميكرولتر من المحاقن الضيقة بالغاز وحامل micropipette مع تركيب قفل Luer لتجميع جهاز الزرع (الشكل 1A).
- إعداد إبرة الزرع.
- إنتاج إبرة زرع عن طريق سحب ماصة شعرية زجاجية (دون خيوط) مع سحب micropipette.
- كسر غيض من الإبرة على نحو سلس قدر الإمكان، كما حواف حادة تزيد من فرصة خدش صفار أثناء زرع، وهو أمر قاتل للجنين.
ملاحظة: يمكن كسر الطرف بسهولة باستخدام شفرة حلاقة مستقيمة تحت منظار مجسم. ومع ذلك ، فإن استخدام microforge يسمح بإنشاء فتحة دقيقة للحجم المطلوب. بالنسبة لتوليد المصدر خارج الرحم، يكون القطر الخارجي من حوالي 50-60 ميكرومتر مناسبا. بالنسبة للنبتات وزرع الجرثومة ، يجب أن يقيس القطر الخارجي للإبرة ما يقرب من 80-90 ميكرومتر لزيادة عدد الخلايا المزروعة. - أدخل الإبرة الجاهزة للاستخدام في جهاز الزرع (الشكل 1A).
- استخدام جهاز الزرع.
- ضع المايكرومنيبولاتور مع جهاز الزرع بجانب مجسم (الشكل 1B).
- قم بإزالة المكبس وخفض إبرة الزرع في طبق الزرع المليء بمحلول Ringer (انظر الخطوة 2.2.1) بزاوية 45 درجة حتى يتم غمر طرف الإبرة (الشكل 1B). سوف المياه الاندفاع حتى الإبرة بسبب العمل الشعرية.
- أدخل المكبس في منتصف الطريق تقريبا لطرد حلول Ringer ، تاركا كمية صغيرة فقط من الماء في الجزء الرقيق المدبب من الإبرة (الشكل 1C).
ملاحظة: هذا هو الموقف المحايد، وينبغي أن يكون مستوى المياه مستقرة هناك لفترة من الوقت (>20 دقيقة). إذا كان مستوى المياه غير مستقر، والهواء يتسرب. إعادة تركيب قفل لوير أو استبدال المحقنة. - عند استخدام إبرة زرع لأول مرة، معطف داخلها عن طريق رسم صفار من الجنين التضحية ومن ثم طرد مادة صفار تماما. سيساعد الطلاء على تقليل التزام الخلايا بالزجاج أثناء الإجراءات اللاحقة.
- ضع الجنين المتبرع برفق بمساعدة الإبرة ثم ضع الإبرة التي تفتح متعامدة على سطح الجنين (الشكل 1D).
ملاحظة: الموضع سيكون مختلفا عن المقايسات المختلفة. لتوليد مصدر جزيء الإشارات خارج الرحم واختناق الخلايا ، سيكون هذا الجزء العلوي من القطب الحيواني (الشكل 1E) ؛ لزرع الجرثومة، وهذا سيكون الهامش (الشكل 1D، F). - سحب ببطء وبعناية حتى المكبس لرسم الخلايا في الإبرة.
ملاحظة: إذا تم تناول الخلايا بسرعة كبيرة جدا، يمكن أن تتلف. إذا تم ذلك بشكل صحيح، يجب أن تخرج الخلايا كأعمدة أسطوانية. تجنب تناول صفار في الإبرة، كما صفار المزروعة سامة للجنين المضيف. - وقف الشفط عن طريق دفع بلطف المكبس إلى أسفل قليلا مرة واحدة يتم رسمها في العدد المطلوب من الخلايا. إزالة الإبرة من الجنين عن طريق الرجيج الإبرة إلى الجانب في حركة قصيرة وسريعة. اترك محلول Ringer على جانبي عمود الخلية، واقيد الخلايا إلى نهاية الإبرة المدببة (الشكل 1C، D).
ملاحظة: السائل أمام عمود الخلية سوف يساعد على فرض بصرف النظر عن خلايا الأجنة المضيف عند إيداع عمود الخلية. - مسح أي صفار المتبقية أو حطام الخلية عن طريق تحريك ببطء المكبس صعودا وهبوطا - في حين أن الإبرة لا تزال مغمورة - لغسل الخلايا مع محلول رينغر. إذا تم ذلك بشكل صحيح، ستبقى الخلايا غير التالفة ملتصقة معا في عمود أثناء غسل الحطام.
ملاحظة: يجب توخي الحذر الشديد خلال هذه الخطوة حيث سيرتفع مستوى المياه بعد النهاية المدببة للابرة. وهذا سوف يسبب تدفق مفاجئ للمياه، والتي يمكن استخدامها لغسل الخلايا. ومع ذلك ، بمجرد أن يجتاز مستوى المياه النهاية المدببة ، سيتم تقليل التحكم الدقيق مع المكبس ، ويجب نقل المكبس ببطء وعناية أكبر. - حرك طبق الزرع بيد غير مهيمنة لوضع الإبرة المتعامدة على السطح (إما قطب حيواني أو هامش) الجنين المضيف (الشكل 1D-F).
- ضعي ضغطا طفيفا برفق، ثم قم بإعطاء حركة سريعة وحادة لاختراق الطبقة المغلفة للجنين المضيف. الحرص على عدم خدش صفار مع الإبرة.
ملاحظة: إن الضغط الطفيف على الجنين عن طريق الضغط عليه بعناية على جدران البئر يزيد من التوتر السطحي للجنين وبالتالي يسهل ثقب الطبقة المغلفة. - بمجرد أن تدخل الإبرة ، ادفع المكبس برفق لقذف عمود الخلايا في الجنين مع التراجع ببطء عن الإبرة في نفس الوقت (الشكل 1D-F).
- تنظيف إبرة الزرع.
- شطف الإبرة عن طريق تحريك المكبس صعودا وهبوطا في حين أن الإبرة مغمورة في الماء deionized.
ملاحظة: إذا كانت الإبرة لا تزال قذرة، شطفه مع محلول هيدروكسيد الصوديوم 10 M قبل الشطف مرة أخرى بالماء. - تخزين الإبرة في مربع مناسب لمزيد من الاستخدام.
- شطف الإبرة عن طريق تحريك المكبس صعودا وهبوطا في حين أن الإبرة مغمورة في الماء deionized.
2. توليد مصادر خارج الرحم من جزيئات الإشارات المفرزة في أجنة حمار وحشي
- إعداد الأجنة المضيفة والمتبرعين.
- جمع الأجنة وضعت حديثا عن طريق التزاوج حمار وحشي.
- Dechorionate 1 خلية مرحلة أجنة حمار وحشي عن طريق احتضان ما يصل إلى 100 جنين في 0.5 ملغ / مل من محلول البروناز لمدة 15 دقيقة تقريبا في طبق بيتري زجاجي صغير (تم نشر وصف مفصل لهذا الإجراء من قبل روجرز، K. W. وآخرون.14).
ملاحظة: بدلا من ذلك، قد يتم أيضا إزالة وتر الأجنة في المرحلة العالية قبل الزرع مباشرة (الخطوة 2.2)، ولكن هذا يتطلب إزالة وتر الأجنة المتبرع بها عن طريق الحقن والأجنة المضيفة غير المحقونة بشكل منفصل. - غمر الأجنة في وسط الجنين في كوب 200 مل.
ملاحظة: ديشوريوناتيد الناسفة والأجنة مرحلة gastrula حساسة جدا. سوف الصفار المكشوفة تلتزم السطوح البلاستيكية وتمزق عند ملامسة الهواء. وبالتالي ، يجب أن تظل مغمورة تماما في وسط الجنين ، ونقلها مع ماصة زجاجية ، والحفاظ عليها إما في أطباق بلاستيكية مغلفة بالأغروز (1٪ في المتوسط الجنين) أو أطباق بيتري الزجاجية. - فارغة بعناية من معظم المتوسط الجنين وملء ببطء الكأس مع المتوسطة الجنين الطازج. والهياج المعتدل تسبب بهذه الطريقة تسهيل إزالة الكورات ضعف. كرر هذه الخطوة 2-3 مرات.
- نقل الأجنة dechorionated باستخدام ماصة باستور الزجاج في طبق حقن المغلفة agarose.
ملاحظة: المشتعلة غيض من ماصة باستور الزجاج عن طريق تعريضه لهب الموقد بونسن يمكن أن تذوب وتنعيم الحافة، مما يساعد على منع الأضرار التي لحقت الأجنة. - حقن مرنا ترميز البروتين الموسومة الفلورسنت في مجموعة فرعية من الأجنة (وقد نشرت وصفا مفصلا لهذا الإجراء من قبل روجرز، K. W. وآخرون.14). حقن مرنا في الخلية، وليس صفار، للتعبير شبه متجانسة. وسوف تعمل الأجنة المحقونة كمتبرعين، في حين أن الأجنة غير المحتقنة ستكون بمثابة مضيفين.
ملاحظة: تعتمد كمية ونوع الحمض النووي الريبي المحقون على جزيء الإشارات الذي تتم دراسته ويتراوح عادة من 20 إلى 200 pg2,4,5,6 (ولكن يمكن أن يصل إلى 1000 pg في حالات معينة4). - نقل الأجنة المحقونة إلى طبق مغلف بالأغاروز من ستة آبار مليء بوسط الجنين. احتضان عند 28 درجة مئوية حتى الأجنة تصل إلى مرحلة المجال المبكر.
- زرع الخلايا لتوليد مصادر خارج الرحم.
- ملء طبق زرع (مع الآبار الفردية على شكل إسفين الثلاثي، انظر جدول المواد) مع الحل رينغر (116 mM NaCl، 2.8 mM KCl، 1 MM CaCl2، 5 MM HEPES؛ تخزين العازلة HEPES في 4 درجة مئوية).
ملاحظة: الكالسيوم في محلول Ringer يعزز التصاق الخلايا ويساعد الجنين على الشفاء من عملية الزرع. - نقل الأجنة إلى طبق زرع.
- وضع المضيف والأجنة المانحة في أعمدة بالتناوب، في كل حالة مع القطب الحيواني الموجهة نحو إبرة زرع.
- إجراء عملية الزرع كما هو موضح في القسم 1.3. لزرع المصدر خارج الرحم، خذ خلايا المصدر من أعلى القطب الحيواني وأودعها في نفس الموقع في الجنين المضيف (الشكل 1E).
ملاحظة: غسل الخلايا مع الحل رينغر كما هو مفصل في الخطوة 1.3.8 مهم لتوليد مصدر خارج الرحم للتأكد من أن الجزيئات التي تم إفرازها بالفعل لا يتم ترحيلها إلى المضيف. لا تقم بزرع خلايا كثيرة جدا لضمان عدم تشتيت المصدر. عمود قطره حوالي 80 ميكرومتر وطوله 100 ميكرومتر مناسب للعديد من التطبيقات. - السماح للجنين المضيف بالبقاء في محلول رينغر لمدة 30 دقيقة إلى ساعة واحدة للتعافي.
- فحص ما إذا كانت الخلايا قد تمت زراعتها بنجاح باستخدام مجسم مفلور (الشكل 2).
- بعد التعافي، قم بنقل الأجنة إلى طبق مغطى بست آبار مغلف بالأغاروز مليء بوسيطة الجنين واحتضانها عند 28 درجة مئوية.
- ملء طبق زرع (مع الآبار الفردية على شكل إسفين الثلاثي، انظر جدول المواد) مع الحل رينغر (116 mM NaCl، 2.8 mM KCl، 1 MM CaCl2، 5 MM HEPES؛ تخزين العازلة HEPES في 4 درجة مئوية).
3. توليد الأجنة التي تقلص حجمها عن طريق استئصال الخلايا
- إعداد الأجنة للنضح.
- جمع الأجنة وضعت حديثا من حمار وحشي من النمط الجيني المطلوب.
- احتضان الأجنة عند 28 درجة مئوية حتى تصل إلى المرحلة العالية.
- إزالة المشيمة الأجنة كما هو موضح في الخطوات 2.1.2-2.1.5 عندما الأجنة تصل إلى مرحلة عالية.
ملاحظة: في هذا المثال، يتم تنفيذ استئصال الخلية في مرحلة المجال. وبناء على ذلك، يتم dechorionated الأجنة ما يقرب من 30 دقيقة إلى 1 ساعة في وقت سابق.
- اختياري: وضع علامة على الطبقة المتزامنة للصفار (YSL).
ملاحظة: إذا رغبت في ذلك، حقن dextrans الفلورسنت في YSL قبل الخلايا extirpating. تسمح هذه التقنية بتحديد ما إذا كانت YSL لا تزال سليمة بعد إزالة الخلية ، وهو أمر مهم لنشأة الأجنة الطبيعية15. بدلا من ذلك، في المختبر توليفها mRNAs أو البروتينات يمكن أيضا أن تحقن في YSL.- استخدم ماصة باستور لنقل الأجنة المهتلأة إلى طبق حقن مغلف بالأغاروز مليء بمياه الجنين.
- توجيه الأجنة أفقيا، مع هامش blastoderm مشيرا نحو إبرة الحقن (الشكل 3A).
- حقن 0.5 nL من 1.5 ميكروغرام / ميكرولتر 10 kDa Alexa568-Dextran في YSL، تهدف إلى منطقة بين خلايا blastoderm وصفار على عمق حوالي ثلث قطر الجنين. حقن جميع الأجنة في صف واحد.
ملاحظة: منذ إبرة الحقن لا تحتاج إلى اختراق من خلال المشيمة، صغيرة (~ 4 ميكرومتر) وفتح حاد مفيد. - تدوير الأجنة بنسبة 180 درجة بحيث يشير الجانب الآخر من هامش blastoderm نحو إبرة الحقن (الشكل 3A).
- حقن آخر 0.5 nL من 1.5 ميكروغرام / ميكرولتر 10 كدا Alexa568-Dextran في YSL كما هو موضح في الخطوة 3.2.3, تسفر عن حجم حقن إجمالي 1 nL لكل جنين.
ملاحظة: يتيح الحقن من جانبين توزيعا أكثر التساوي ل dextran الفلوري داخل YSL. - فحص نتيجة الحقن تحت مجسم مفلور. إذا تم ذلك بشكل صحيح، سيتم تقييد إشارة الفلورسنت إلى YSL (الشكل 3B) ولن تكون مرئية في الفضاء بين الخلايا من blastoderm.
- خلايا الستئصال
- املأ طبق الزرع بمحلول Ringer (انظر الخطوة 2.2.1).
- نقل الأجنة إلى طبق الزرع.
- توجيه الأجنة مع القطب الحيواني نحو إبرة زرع (الشكل 3C).
- إزالة الخلايا بعناية من منطقة القطب الحيواني كما هو موضح في الخطوات 1.3.5-1.3.7، وبالتالي تقليل blastoderm إلى الحجم المطلوب.
- تجاهل الخلايا التي تمت إزالتها عن طريق طردهم من إبرة الزرع.
- بمجرد الانتهاء من العملية، اسمح للأجنة بالبقاء في محلول رينغر لمدة 30 دقيقة إلى ساعة واحدة للتعافي.
- اختياري: فحص سلامة YSL تحت مجسم مضان (الشكل 3D).
- نقل الأجنة إلى لوحة مغلفة بالأغاروز مليئة بوسيطة الجنين واحتضانها عند 28 درجة مئوية.
4. خلق المسوخ الأم زيجوتيك عن طريق زرع الجرثومة
- إعداد الأجنة المضيفة والمتبرعين.
- جمع الأجنة وضعت حديثا من كل من متحولة والبرية من نوع حمار وحشي. الأجنة من حمار وحشي مع خلفية متحولة ستكون بمثابة المتبرعين، في حين أن الأجنة من حمار وحشي مع خلفية من النوع البري سوف تكون بمثابة المضيفين.
ملاحظة: يتطلب زرع الجرثومة عددا كبيرا من الأجنة الأولية (~ 50 للمتبرعين ، ~ 500 للمضيفين) لضمان عدد لا جيد من عمليات زرع الجرثومة الناجحة التي تبقى على قيد الحياة حتى سن البلوغ. - نقل الأجنة إلى طبق حقن مغلفة بالنواة مع وسيط الجنين باستخدام ماصة باستور.
ملاحظة: يتم الحقن قبل dechorionation لزيادة الإنتاجية. الإبر للحقن من خلال المشيمة تحتاج إلى أن تكون حادة ولها فتحة أكبر (~ 10 ميكرومتر) لمنع انسداد. - حقن الأجنة المانحة مع 1 nL من 100 نانوغرام / μL مرنا ترميز GFP مع nos1 3'UTR. حقن مرنا في صفار لزيادة الإنتاجية.
ملاحظة: سوف nos1 3'UTR استقرار مرنا في الخلايا الجرثومية البدائية، مما تسبب في الخلايا الجرثومية لتكون الفلورسنت بقوة عندما صورت 1 يوم بعد الإخصاب10. - حقن الأجنة المضيفة مع 1 nL من 0.33 mM (3 ميكروغرام / ميكرولتر) طريق مسدود (dnd) مورفولينو. حقن مورفولينو في صفار لزيادة الإنتاجية.
ملاحظة: يمنع مورفولينو dnd تكوين الخلايا الجرثومية البدائية ، مما يضمن أن الجرثومة الجنين المضيف سيتم ملؤها حصريا بخلايا من المتبرع بعد زرعها10. - نقل الأجنة المحقونة إلى أطباق بيتري البلاستيكية مع متوسطة الجنين. حضانة عند 28 درجة مئوية حتى الأجنة تصل إلى مرحلة عالية.
- إزالة المشيمة الأجنة كما هو موضح في الخطوات 2.1.2-2.1.5 عندما الأجنة تصل إلى مرحلة عالية.
- جمع الأجنة وضعت حديثا من كل من متحولة والبرية من نوع حمار وحشي. الأجنة من حمار وحشي مع خلفية متحولة ستكون بمثابة المتبرعين، في حين أن الأجنة من حمار وحشي مع خلفية من النوع البري سوف تكون بمثابة المضيفين.
- زرع الخلايا الجرثومية
- املأ طبق الزرع بمحلول Ringer (انظر الخطوة 2.2.1).
- نقل الكرة dechorionated- إلى القبة مرحلة الأجنة في طبق زرع.
- ضع الأجنة المضيفة والأجنة المانحة في أعمدة متناوبة لزرع الخلايا من جنين متبرع واحد إلى ستة أجنة مضيفة مختلفة. وهذا يزيد من فرصة أن الخلايا الجرثومية من جنين مضيف معين سيتم زرعها بنجاح.
- توجيه الأجنة مع الهامش نحو إبرة زرع وتنفيذ عملية زرع كما هو موضح في القسم 1.3. بالنسبة لزرع الجراثيم (الشكل 1D، F)، خذ الخلايا المصدرية من الهامش (حيث توجد الخلايا الجرثومية البدائية) وأودعتها في نفس الموقع في الجنين المضيف.
ملاحظة: زراعة عمود كبير (قطره 80 ميكرومتر تقريبا وطوله 600 ميكرومتر) سيزيد من فرصة الحصول على عملية زرع جرثومية ناجحة. - السماح للجنين بالبقاء في محلول رينغر لمدة 30 دقيقة إلى ساعة واحدة للتعافي بمجرد الانتهاء من عملية الزرع.
ملاحظة: إذا لم يكن من المتوقع أن تكون جميع الأجنة المانحة متحولة متجانسة - على سبيل المثال ، إذا كانت ناتجة عن تقاطع heterozygous - فيجب أن تكون جينية بعد زرعها لتحديد النمط الجيني للجراثيم المستقبلية المزروعة للمضيف. في هذه الحالة، تأكد من عدم خلط وضعي الجنين المضيف والأجنة المانحة أثناء المناولة. - استخدم مجسم مجسم مفلور لفحص ما إذا كانت الخلايا قد تم زرعها بنجاح (الشكل 4A، B).
- نقل الأجنة إلى لوحة مغلفة بالgarose 24 جيدا. تجميع جميع الأجنة المضيفة التي تلقت خلايا من نفس المتبرع في نفس البئر وتسميتها وفقا لذلك. احتضانهم حتى اليوم التالي عند 28 درجة مئوية.
- إذا لزم الأمر، نقل الأجنة المانحة إلى شرائط PCR المسمى لل genotyping.
- فحص عمليات زرع الجرثومة الناجحة
- فحص الأجنة المضيفة لعمليات زرع الجرثومة الناجحة تحت منظار مجسم مفلور حوالي 30 ساعة بعد الإخصاب (hpf). توجد الخلايا الجرثومية في الأخدود فوق امتداد الصفار (الشكل 4C).
ملاحظة: التجارب النموذجية مع الجهاز والاستراتيجية المعروضة هنا سيكون لها معدل نجاح من ~ 60٪ -80٪ للحصول على جنين مضيف واحد على الأقل يحمل خلايا جرثومية مزروعة لكل جنين متبرع. ووصف تقرير سابق كفاءة ~ 10 ٪10. - إذا كان ذلك ممكنا، تجاهل الأجنة التي تلقت خلايا من الأجنة المانحة مع النمط الجيني غير صحيحة. زراعة اليرقات مع الخلايا الجرثومية المزروعة بنجاح إلى مرحلة البلوغ وفقا لظروف تربية قياسية واتباع المبادئ التوجيهية المؤسسية.
- فحص الأجنة المضيفة لعمليات زرع الجرثومة الناجحة تحت منظار مجسم مفلور حوالي 30 ساعة بعد الإخصاب (hpf). توجد الخلايا الجرثومية في الأخدود فوق امتداد الصفار (الشكل 4C).
النتائج
النجاح والفشل في استخدام جهاز زرع للتطبيقات الثلاثة المذكورة أعلاه يمكن بسهولة تقييمها عن طريق الفحص البصري تحت منظار مجسم. في عمليات الزرع الناجحة ، يجب أن يبدو الجنين طبيعيا ومشابها في الشكل ووضوح الصفار للأجنة غير المخططة ، دون دموع كبيرة في blastoderm. إذا كان الجنين معطوبا بشكل واضح (الشكل 4B) ، فلن يتطور بشكل طبيعي. من الناحية المثالية، يجب أن تظهر الخلايا المزروعة التي تعبر عن علامة فلورية كأعمدة مستمرة عند النظر إليها تحت منظار مجسم مفلور (الشكل 2A، الشكل 4A). إذا كان العمود مجزأ، فهذا يشير إلى أن الخلايا تم قصها بواسطة الشفط إلى إبرة الزرع أو أن ترسب الخلايا تم بقوة كبيرة. ويمكن منع ذلك عن طريق تحريك المكبس ببطء وبلطف.
على الرغم من أن جهاز زرع قد استخدمت أساسا على أجنة حمار وحشي في مراحل blastula5,6, زرع و استئصال الخلايا العمل فقط كذلك لأجنة مرحلة blastula dechorionated من ميداكا سمك الأرز الياباني (Oryzias latipes) (الشكل 2B). وبصرف النظر عن dechorionation الجنين، الذي وصفه Porazinski، S. R. وآخرون.17، يمكن اتباع نفس الإجراءات كما هو موضح أعلاه.
في حالة زرع الجرثومة على وجه التحديد، فإن عملية زرع جيدة تؤدي إلى جنين مع عمود أفقي طويل من الخلايا مباشرة فوق هامش صفار (الشكل 4A). ومع ذلك، لا يمكن تقييم ما إذا كانت الخلايا الجرثومية قد تمت زراعتها بنجاح إلا في اليوم التالي (الشكل 4C-F) بسبب التعبير الخلفي عن GFP في مراحل blastula (الشكل 1F). ستظهر الخلايا الجرثومية البدائية كمجالات فلورية صغيرة في الأخدود مباشرة فوق امتداد الصفار (الشكل 4C-E). وجود هذه الخلايا في الموقع الصحيح يشير إلى نجاح زرع الجرثومة. الخلايا ذات الشكل المختلف ليست خلايا جرثومية (على سبيل المثال، الخلايا الممدودة هي عادة خلايا عضلية، الشكل 4F). أيضا، إذا تم العثور على الخلايا الجرثومية البدائية خارج الأخدود، وهذا يعني أنها فشلت في الهجرة بشكل صحيح، وأنها لن تكون قادرة على المساهمة في الجرثومة الجنين. وأخيرا، ينبغي أن يظهر الشكل العام للأجنة المزروعة على غرار الأجنة غير المزروعة (الشكل 4D)؛ لا ينبغي أن يكون مشوه الذيل، وينبغي أن لا يكون الرأس تقلصت أو في عداد المفقودين عيون (الشكل 4E). هذه العيوب تنتج عموما من تركيزات مورفولينو عالية بشكل مفرط أو من تلف الجنين أثناء زرع. عادة ما تؤدي تجارب زرع الجراثيم كما هو موضح هنا إلى 1-2 من أصل 6 أجنة مضيفة مع خلايا جرثومية تم زرعها بنجاح ل 60٪ -80٪ من الأجنة المانحة ، اعتمادا على تجربة المجرب. وهكذا، تحتاج الخلايا من 40-50 جنينا مانحا متجانسا إلى زرعها في 200-300 جنين مضيف لتربية ما يقرب من 30 فردا يعانون من خلايا جرثومية متحولة.
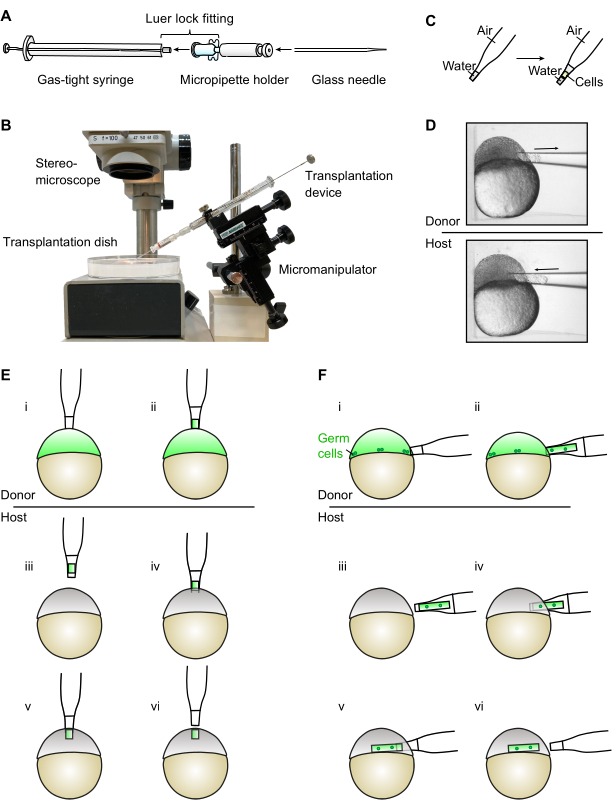
الشكل 1: تجميع واستخدام جهاز الزرع. (أ) يتم تجميع جهاز الزرع عن طريق توصيل حقنة ضيقة بالغاز مع حامل micropipette من خلال تركيب قفل Luer. ثم يتم إدخال الإبرة الزجاجية لزرعها في حامل المايكروبايت. (ب) صورة لجهاز زرع تجميعها محمولة على micromanipulator (يرجى ملاحظة أن الخلفية والتسميات قد أزيلت من الصورة). (ج) عند استخدام جهاز الزرع، من المهم التأكد من أن مستوى الماء في إبرة الزرع يبقى في النهاية مدبب. (د) يستخدم الجهاز تحت منظار مجسم لسحب وإدخال خلايا من الأجنة عن بعد ووضعها في آبار فردية من طبق زرع. (ه) بالنسبة لتوليد المصادر خارج الرحم، تؤخذ الخلايا من القطب الحيواني للجنين المتبرع (i-ii) وتنقل إلى القطب الحيواني للجنين المضيف (III-vi). (و) بالنسبة لزرع الجرثومة، يؤخذ عدد أكبر من الخلايا من هامش الجنين المتبرع (i-ii)، حيث توجد الخلايا الجرثومية. ثم يتم نقل الخلايا إلى هامش الأجنة المضيفة (III-vi). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
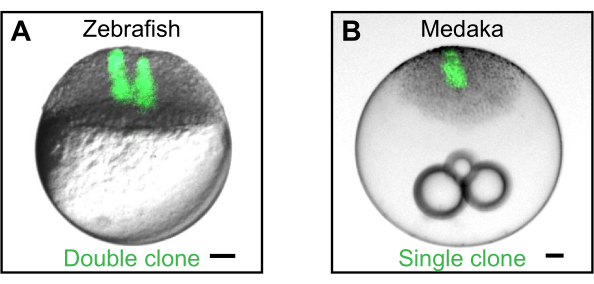
الشكل 2: توليد استنساخ عن طريق زرع الخلايا. (أ) مثال على استنساخ مزدوج يولده زرع متسلسل للخلايا الفلورية (الخضراء) من متبرع حمار وحشي إلى جنين مضيف لسمك الحمار الوحشي. ويمكن استخدام المستنسخين الفرديين والمزدوجين لدراسة كيفية تشكل جزيئات الإشارات المفرزة تدرجات ندواتية2,4,5,6. (ب) مثال على استنساخ واحد تم إنشاؤه عن طريق زرع خلايا من متبرع ميداكا (Wimbledon) عبر عن eGFP معدل وراثيا (Wimbledon)17 في مضيف ميداكا من النوع البري. تمثل أشرطة المقياس 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
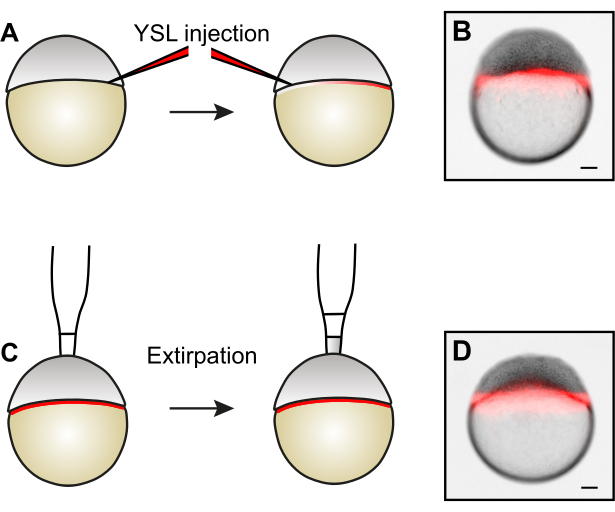
الشكل 3: توليد أجنة مخفضة الحجم عن طريق استئصال الخلايا. (أ) قبل إزالة الخلايا عن طريق الاستئصال ، يمكن تسمية YSL عن طريق حقن الأصباغ الفلورية في جانبين متعارضين من YSL. (ب) مثال على الجنين بعد حقن YSL. (ج) لتوليد الأجنة التي تقلص حجمها، تتم إزالة الخلايا من القطب الحيواني عن طريق extirpation5. (د) مثال على جنين بعد استئصال الخلايا. لاحظ أن YSL يبقى سليما. تمثل أشرطة المقياس 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
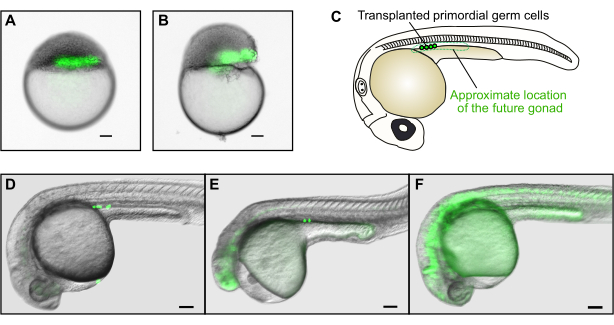
الشكل 4: زرع الجرثومة. (أ) مثال على نجاح زرع الخلايا المانحة (الخضراء) في المنطقة الهامشية للمضيف. (ب) مثال على عملية زرع غير ناجحة. أصيب صفار الجنين المضيف بأضرار بالغة، ولن يتمكن الجنين من النمو بشكل طبيعي. (ج) في 30 حصان، سيتم العثور على الخلايا الجرثومية المزروعة بنجاح فقط في ميسوديرم غدد الغدد التناسلية في المنطقة الأمامية من تمديد صفار. (د) مثال على عملية زرع ناجحة قامت فيها عدة خلايا جرثومية مانحة تحمل اسم GFP بملء الننض المستقبلي للمضيف. (ه) مثال على عملية زرع غير ناجحة. على الرغم من أن الخلايا الجرثومية قد وصلت إلى ميسودرم غدد الغدد التناسلية، إلا أن الجنين المضيف مشوه بشدة ولن يتطور بشكل طبيعي. (و) مثال على عملية زرع غير ناجحة. الخلايا الجرثومية الفلورية التي فشلت في الهجرة إلى الموقع الصحيح لن تعيد إسكان النواد. تمثل أشرطة المقياس 100 ميكرومتر. تم التقاط الصور في D-F في التكبير الكلي من حوالي 50x. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يعتمد نجاح تجربة الزرع بقوة على المهارات الحركية الدقيقة للمجرب. ومن أجل تنفيذ الإجراءات بنجاح، يلزم ممارسة هذه العملية. ومع ذلك ، فإن الأداة المعروضة هنا سهلة التعلم والاستخدام نسبيا مقارنة بالآخرين في السوق ، وبشكل عام ، لا تحتاج إلا إلى بضعة أيام من الممارسة.
يمكن تعزيز نجاح عملية الزرع من خلال اتخاذ العديد من الاحتياطات. خطوة واحدة هي التأكد من أن micromanipulator هو من نوعية جيدة وقادرة على التشغيل السلس. إضافة العين مع التكبير أعلى إلى المنظار المجسم يمكن أن تساعد على وضع الإبرة بدقة بالنسبة للجنين. كما أن استخدام سمك الحمار الوحشي أو ميداكا الذي يتكاثر بشكل جيد للحصول على أجنة سليمة والحرص على عدم إتلاف الأجنة أثناء المناولة (خاصة أثناء وبعد خطوة التخلص من المشيمة) سيعزز أيضا معدل النجاح.
يمكن أن تكون المشاكل المتعلقة بالسمية المتأخرة أكثر صعوبة في استكشاف الأخطاء وإصلاحها. إذا توفي الجنين بعد بضع ساعات - ولكن ليس بعد زرعه مباشرة - فقد يكون الصفار قد تضرر من الإبرة (على سبيل المثال، عن طريق دخول الجنين بعمق شديد)، أو ربما تم إخراج الخلايا بقوة كبيرة. ويمكن أن ينتج تأخر السمية والوفاة الجنينية أيضا عن صفار أو حطام خلايا حقن مع الخلايا المانحة؛ يمكن أن يكون سبب آخر تدهور HEPES المخزن المؤقت في الحل Ringer. يمكن التغلب على هذه المشاكل عن طريق غسل الخلايا (انظر الخطوة 1.3.8) أو ببساطة باستخدام دفعة جديدة من المخزن المؤقت، على التوالي. وعلاوة على ذلك، قد تنتج الأجنة المضيفة المشوهة في تجارب زرع الجرثومة عن تركيزات مورفولينو عالية للغاية. من الأهمية بمكان استخدام ما يكفي من مورفولينو لإبطال الجرثومة البرية للمضيف بشكل كامل ، وبالتالي منع هذه الخلايا من المساهمة في النسل - ولكن في الوقت نفسه ، يجب تجنب تركيزات مورفولينو العالية بشكل مفرط. ولذلك فإن كميات المورفولينو المتسقة عبر جميع الأجنة المضيفة المحقونة (بضع مئات في تجربة نموذجية) هي المفتاح لنجاح عمليات زرع الجراثيم. ويمكن مساعدة هذا عن طريق استكمال مزيج حقن مورفولينو مع dye14 التتبع مرئية بسهولة, والتي يمكن تعقبها تحت مجسم مفلورة لضمان أن جميع الأجنة تلقي نفس حجم الحقن.
تتضمن الإجراءات الموصوفة في هذا البروتوكول حصريا التلاعب بالخلايا في أجنة حمار وحشي أو ميداكا في مرحلة blastula ، ولكن في المستقبل ، من المرجح أن يكون من الممكن تكييف الجهاز مع مراحل وأنواع مختلفة عن طريق تغيير قطر وشكل إبرة الزرع.
Disclosures
ولا يوجد لدى صاحبي البلاغ تضارب في المصالح يعلنانه.
Acknowledgements
وقد تم دعم هذا المشروع من قبل جمعية ماكس بلانك وحصل على تمويل من مجلس البحوث الأوروبي (ERC) في إطار برنامج الاتحاد الأوروبي للأبحاث والابتكار في أفق 2020 (اتفاقية المنحة رقم 637840 (QUANTPATTERN) واتفاقية المنح رقم 863952 (ACE-OF-SPACE)).
Materials
| Name | Company | Catalog Number | Comments |
| 1.0 mm glass capillary, ends cut without filament | To make the transplantation needle | ||
| 1.0 mm glass capillary, ends cut with filament | To make injection needles | ||
| 200 mL glass beaker | For embryo dechorionation | ||
| 24-well plastic plate | To be coated with agarose in order to incubate embryos | ||
| 5 cm diameter glass Petri dish | For embryo dechorionation | ||
| 6-well plastic plate | To be coated with agarose in order to incubate embryos | ||
| Agarose | To coat plastic dishes | ||
| dnd1 morpholino | Gene Tools | Sequence: GCTGGGCATCCATGTCTCCGAC CAT | |
| Embryo medium | 250 mg/L Instant Ocean salt, 1 mg/L methylene blue in reverse osmosis water adjusted to pH 7 with NaHCO3 | ||
| Fluorescence stereomicroscope with GFP/RFP filters and light source | To assess YSL injections and germ-line transplantations | ||
| Glass micropipette puller | Sutter Instrument Company | P-1000 | To make the transplantation needle |
| Glass pasteur pipette | Kimble Chase (via Fisher) | 63A53WT | For pipetting embryos; the tips can be flamed to smoothen out the edge |
| Incubator at 28 °C | For incubating zebrafish embryos | ||
| Luer tip 25 μL Hamilton syringe, 1700 series | Hamilton | Ref: 80201 | Part of the transplantation device |
| Manual micromanipulator with 3 axes of movement | Narishige | M-152 | For controlling the transplantation device |
| Manual pipetting pump | Bio-Tek | Cat. # 641 | For use with the glass pipettes to transfer embryos |
| Metal dissecting probe | For moving and rotating zebrafish embryos | ||
| Microforge | Narishige | MF2 | To make the transplantation needle |
| Microinjection apparatus | For injection of mRNA and morpholino into embryos | ||
| Microinjection molds, triangular grooves | Adaptive Science Tools | TU-1 | To prepare microinjection plates with agarose |
| Microinjection-molds, single wells | Adaptive Science Tools | PT-1 | To prepare transplantation plates with agarose |
| Micropipette holder with Luer fitting for a 1.0 mm glass capillary | World Precision Instruments | MPH6S10 | Part of the transplantation device |
| mMessage mMachine Sp6 transcription kit | Life Technologies | AM1340M | To generate capped mRNA for injection into embryos |
| Plasmid with GFP-nos1 3'UTR | Plasmid that can be transcriped to produce mRNA encoding GFP with the 3'UTR of nos1 | ||
| Plastic petri dish 100 mm | To be coated with agarose in order to make injection and transplantation dishes | ||
| Protease from Streptomyces griseus | Sigma | P5147 | For embryo dechorionation: Make a 5 mg/ml stock and use at 1 mg/ml to dechorionate embryos |
| Ringer’s solution | For 1 L: Add 6.78 g of NaCl, 0.22 g of KCl, 0.26 g of CaCl2 and 1.19 g of HEPES; then fill to 1 L; adjust pH to 7.2; sterilize by filtration | ||
| Stereomicroscope | For injection and transplantation |
References
- Spemann, H., Mangold, H. Induction of embryonic primordia by implantation of organizers from a different species. Archives for Microscopic Anatomy and Developmental Mechanics. 100 (3-4), 599-638 (1924).
- Müller, P., et al. Differential diffusivity of Nodal and Lefty underlies a reaction-diffusion patterning system. Science. 336 (6082), 721-724 (2012).
- Donovan, P., et al. Paracrine Activin-A signaling promotes melanoma growth and metastasis through immune evasion. Journal of Investigative Dermatology. 137 (12), 2578-2587 (2017).
- Pomreinke, A. P., et al. Dynamics of BMP signaling and distribution during zebrafish dorsal-ventral patterning. eLife. 6, 25861(2017).
- Almuedo-Castillo, M., et al. Scale-invariant patterning by size-dependent inhibition of Nodal signaling. Nature Cell Biology. 20, 1032-1042 (2018).
- Soh, G. H., Pomreinke, A. P., Müller, P. Integration of Nodal and BMP signaling by mutual signaling effector antagonism. Cell Reports. 31 (1), 107487(2020).
- Mahalwar, P., Walderich, B., Singh, A. P., Nüsslein-Volhard, C. Local reorganization of xanthophores fine-tunes and colors the striped pattern of zebrafish. Science. 345 (6202), 1362-1364 (2014).
- Frohnhöfer, H. G., Krauss, J., Maischein, H. M., Nüsslein-Volhard, C. Iridophores and their interactions with other chromatophores are required for stripe formation in zebrafish. Development. 140 (14), 2997-3007 (2013).
- Chen, Y., Schier, A. F. The zebrafish Nodal signal Squint functions as a morphogen. Nature. 411 (6837), 607-610 (2001).
- Ciruna, B., et al. Production of maternal-zygotic mutant zebrafish by germline replacement. Proceedings of the National Academy of Sciences of the United States of America. 99 (23), 14919-14924 (2002).
- Westerfield, M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 4th edn. , University of Oregon Press. (2000).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating chimeric zebrafish embryos by transplantation. Journal of Visualized Experiments:JoVE. (29), e1394(2009).
- Capek, D., Müller, P. Positional information and tissue scaling during development and regeneration. Development. 146 (24), 177709(2019).
- Rogers, K. W., Bläßle, A., Schier, A. F., Müller, P. Measuring protein stability in living zebrafish embryos using fluorescence decay after photoconversion (FDAP). Journal of Visualized Experiments: JoVE. (95), e52266(2015).
- Carvalho, L., Heisenberg, C. P. The yolk syncytial layer in early zebrafish development. Trends in Cell Biology. 20 (10), 586-592 (2010).
- Porazinski, S. R., Wang, H., Furutani-Seiki, M. Dechorionation of medaka embryos and cell transplantation for the generation of chimeras. Journal of Visualized Experiments: JoVE. (46), e2055(2010).
- Centanin, L., Hoeckendorf, B., Wittbrodt, J. Fate restriction and multipotency in retinal stem cells. Cell Stem Cell. 9 (6), 553-562 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved