A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس التطور الزمني للمواد النانوية مع تشتت النيوترونات المتوقف والزاوية الصغيرة
In This Article
Summary
يقدم هذا البروتوكول استخدام بيئة عينة التدفق المتوقف لخلط محاليل سائلة متعددة بسرعة في الموقع أثناء قياس تشتت النيوترونات بزاوية صغيرة ودراسة العمليات الحركية على مقاييس طول النانومتر والمقاييس الزمنية الثانية.
Abstract
يقدم هذا البحث استخدام بيئة عينة تشتت النيوترونات صغيرة الزاوية (SANS) ذات التدفق المتوقف لخلط العينات السائلة بسرعة ودراسة العمليات الحركية النانوية على نطاقات زمنية من ثوان إلى دقائق. تستخدم بيئة عينة التدفق المتوقف مضخات الحقن المتاحة تجاريا لخلط الأحجام المطلوبة من العينات السائلة التي يتم حقنها بعد ذلك من خلال خلاط ديناميكي في خلية زجاجية كوارتز في حوالي 1 ثانية. تتم مزامنة الحصول على بيانات SANS التي تم حلها بمرور الوقت مع خلط العينات لمتابعة تطور البنية النانوية في المحلول بعد الخلط.
لتحقيق أقصى استفادة من وقت الحزمة النيوترونية ، نستخدم سلسلة من صمامات محدد التدفق لتحميل الخلية وشطفها وتجفيفها تلقائيا بين القياسات ، مما يسمح بجمع البيانات المتكررة خلال عمليات حقن العينات المتعددة. يتم تكرار حقن العينات حتى يتم جمع إحصاءات كافية عن تشتت النيوترونات. يمكن برمجة إعداد الخلط لتغيير الظروف بشكل منهجي لقياس الحركية بنسب خلط مختلفة وتركيزات العينات وتركيزات المواد المضافة ودرجات الحرارة. الحد الأدنى لحجم العينة المطلوب لكل حقنة هو حوالي 150 ميكرولتر اعتمادا على طول مسار خلية الكوارتز.
يتم تقديم النتائج التمثيلية باستخدام بيئة عينة التدفق المتوقف هذه لحركية التبادل السريع للدهون في وجود مادة مضافة ، سيكلوديكسترين. تتبادل الحويصلات الدهون في الوريقات الخارجية (الخارجية) بترتيب ثوان وتتبادل الدهون الداخلية والخارجية بالكامل في غضون ساعات. يتطلب قياس حركية تبادل الدهون الخلط في الموقع لالتقاط العمليات الأسرع (بالثواني) والأبطأ (بالدقائق) واستخراج ثوابت معدل الحركة. يمكن أيضا استخدام بيئة العينة نفسها لاستكشاف التبادل الجزيئي في أنواع أخرى من العينات السائلة مثل الجسيمات النانوية الدهنية أو البروتينات أو المواد الخافضة للتوتر السطحي أو البوليمرات أو المستحلبات أو الجسيمات النانوية غير العضوية. سيوفر قياس التحولات الهيكلية النانوية وحركية أنظمة التبادل أو التفاعل رؤى جديدة للعمليات التي تتطور على المستوى النانوي.
Introduction
يوفر تشتت النيوترونات بزاوية صغيرة (SANS) طريقة فريدة لقياس أحجام وأشكال وتفاعلات وتنظيم المواد المختلفة على مقاييس الطول من ≈1 نانومتر إلى ≈100 نانومتر1،2،3. الأدوات الحديثة ، بما في ذلك VSANS (تشتت النيوترونات بزاوية صغيرة جدا) مع مرايا التركيز ، تدفع الحدود نحو قياس مقاييس طول أكبر تصل إلى ≈1000 نانومتر 4,5. بشكل عام ، يوفر تباين التشتت الفريد المتأصل في طرق تشتت النيوترونات العديد من المزايا في قياس التطور الزمني للهياكل النانوية ، مثل تجميع المكونات في التركيبات الصيدلانية6 ، تفاعلات التشابك والهلام في أنظمة البوليمر 7,8 ، في التبلور المتوسط للبروتينات الغشائية9,10 ، تدهور البروتينات وكشفها11,12 ، ونمو المواد القائمة على السيليكا13،14،15. يجعل تباين التشتت الفريد SANS (TR-SANS) الذي تم حله بمرور الوقت مكملا مفيدا للقياسات الأخرى القائمة على التدفق المتوقف.
غالبا ما يتم تنفيذ طرق خلط التدفق المتوقف في تشتت الأشعة السينية بزاوية صغيرة (SAXS) 16،17،18،19،20،21 ، مطيافية مضان 22،23،24،25،26 ، وتشتت الضوء27،28،29،30 ، 31,32 تجربة لدراسة العمليات الحركية على المقاييس الزمنية بالمللي ثانية. يتمثل أحد الاختلافات المهمة بين SANS و SAXS في أن تشتت النيوترونات هو تقنية توصيف غير مدمرة ، وعلى هذا النحو ، يمكن استخدام SANS لقياس نفس العينة لساعات أو حتى أيام دون إلحاق ضرر إشعاعي مؤين بالعينة ، والذي يمكن أن يحدث أثناء تجارب تشتت الأشعة السينية عالية التدفق33. نظرا لأن قياسات SANS المتكررة لن تغير التركيب الكيميائي لجزيء المسبار أو العينة ، يمكن دراسة التطور الزمني دون تأثيرات التبييض الضوئي ، على سبيل المثال ، مما قد يعقد قياسات الحركية التي تعتمد على التألق23,24. علاوة على ذلك ، يمكن استخدام SANS لقياس العينات عالية التركيز وغير الشفافة بصريا والتي غالبا ما يصعب توصيفها باستخدام التقنيات القائمة على الضوء مثل تشتت الضوء الديناميكي.
بالإضافة إلى توفير المعلومات الهيكلية على المقياس النانوي ، يمكن استخدام SANS لاستكشاف التركيب المحلي لهذه الهياكل من خلال الاختلاف في تباين كثافة طول تشتت النيوترونات. تختلف كثافة طول التشتت (SLD) للعناصر المختلفة بشكل عشوائي عبر الجدول الدوري وتختلف باختلاف نظائر العنصر نفسه. ومن الأمثلة الشائعة على ذلك الهيدروجين (1H أو H) والديوتيريوم (2H أو D) ، اللذان لهما أطوال تشتت نيوترونية مختلفة إلى حد كبير. لذلك ، يمكن تمييز المواد الغنية بالهيدروجين ، مثل المواد الخافضة للتوتر السطحي والدهون والبروتينات والحمض النووي الريبي والحمض النووي والبوليمرات الأخرى ، عن المذيبات المخففة باستخدام SANS دون تغيير الخصائص الفيزيائية للنظام بشكل كبير. ومع ذلك ، من المهم ملاحظة أن تبادل H / D يمكن أن يؤثر على الكثافة والترابط الهيدروجيني ودرجات حرارة انتقال الطور في العينة. ومع ذلك ، فإن الحساسية الفريدة ل SANS للمواد الغنية بالهيدروجين مفيدة بشكل خاص في أبحاث المادة اللينة حيث يكون للعينات ذات الأهمية تباين وإشارة تشتت أقل في التقنيات القائمة على الأشعة السينية مثل SAXS. كما أن الاستبدال النظيري يجعل SANS أداة قوية لدراسة حركية التبادل الجزيئي في المواد الغنية بالهيدروجين ببساطة عن طريق خلط الجزيئات ذات العلامات H والجزيئات ذات العلامات D. الاستبدال النظيري مفيد بشكل خاص في الأنظمة التي تكون فيها الأصباغ الفلورية الضخمة أكبر من جزيئات الفاعل بالسطح أو الدهون ذات الأهمية ويمكن أن تؤثر على حركية التبادل34,35.
تعد قياسات SANS التي تم حلها بمرور الوقت مفيدة لأن الكثافة المقاسة هي دالة للوقت ومقياس الطول وتباين SLD. على هذا النحو ، يمكن تصميم تجارب TR-SANS لاستكشاف التغييرات المعتمدة على الوقت في التوزيعات المكانية وتركيبات العينات. أدت هذه المزايا الفريدة ل SANS إلى رؤى مهمة في العمليات الحركية في العديد من أنظمة المواد اللينة مثل المواد الخافضة للتوتر السطحي 36،37،38 ، المستحلبات 39،40،41 ، الدهون 34،42،43،44،45،46،47،48،49 ، 50 ، والبوليمرات 51،52،53،54،55،56،57،58،59،60،61،62. ركزت معظم دراسات TR-SANS على المقاييس الزمنية من دقائق إلى ساعات. ومع ذلك ، فإن العديد من العمليات الحركية ذات الأهمية تحدث على مقياس الوقت الثاني وهي ضرورية لفهم الآليات الأساسية. يتطلب التقاط هذه النقاط الزمنية المبكرة خلط الحلول بسرعة وقياسها في الموقع ، حيث تتم مزامنة الخلط مع جمع البيانات أثناء تشتت الضوء المتوقف 27،28،29،30،31،32 ، التألق 22،23،24،25،26 ، والأشعة السينية 16،17،18،19،20،21 تجربة. يصف هذا العمل استخدام بيئة عينة مصممة لخلط عينات سائلة متعددة بسرعة وحقن الخليط في خلية زجاجية كوارتز لقياسات TR-SANS. جهاز الخلط عبارة عن تكيف لجهاز rheoSANS الشعري الذي تم تطويره مؤخرا63 ويستخدم مضخات وصمامات حقن متعددة للتحكم في خلط العينات وأتمتة تنظيف الخلايا. من خلال توصيل مضخات الحقن بسلسلة من صمامات محدد التدفق ، يمكن خلط تيارات المدخل المتعددة وقياسها وشطفها وتجفيفها بشكل متكرر لتسهيل قياسات TR-SANS على مقياس وقت الثواني.
يفترض الإجراء الحالي أن العينات ذات الأهمية قد تم تحديدها وإعدادها. نحن نركز على إعداد الخلط في الموقع وطرق جمع بيانات TR-SANS. تم جمع بيانات تشتت النيوترونات على أداة VSANS في مركز NIST لأبحاث النيوترونات (NCNR) ؛ ومع ذلك ، يجب أن يكون الإجراء قابلا للتطبيق على أدوات SANS الأخرى. يجب على القراء المهتمين بتنفيذ بروتوكولات مماثلة على أدوات SANS الأخرى التشاور مع علماء الأدوات المحليين لتحديد التكوين الأمثل للأداة لزيادة تدفق النيوترونات إلى أقصى حد على مقياس الطول المطلوب والمقياس الزمني الأكثر صلة بالعمليات الحركية ذات الأهمية. تم جمع البيانات المقدمة هنا باستخدام تكوين "الحزمة البيضاء" عالي التدفق على VSANS لزيادة عدد النيوترونات إلى أقصى حد عند فقدان الدقة المكانية5. تم وضع عربات الكاشف لتغطية مجموعة من ناقلات التشتت (q) ، 0.005 Å-1 < q < 0.5 Å-1 ، المقابلة لمقاييس الطول من ≈130 نانومتر إلى ≈13 نانومتر. يتم تعريف متجه التشتت على أنه q = 4π / λ sin (θ / 2) حيث λ هو الطول الموجي النيوتروني ، و θ هي زاوية التشتت.
يتكون جهاز خلط التدفق المتوقف المستخدم في قياسات TR-SANS من مضخات متعددة ، ومحاقن شطف ، ومحاقن عينات ، ومحددات تدفق ، بالإضافة إلى خلاط ديناميكي ، وخلية عينة ، وحاوية عينات مختلطة ، كما هو موضح في الشكل 1. توجد جميع مسارات السوائل المختومة داخل حاوية مكيفة الهواء ، والتي تشمل المحاقن والصمامات وأنابيب التوصيل والخلاط الديناميكي وخلايا العينات. يتم استخدام مكيف هواء حراري قابل للبرمجة للتحكم في درجة حرارة العلبة في النطاق من 10 °C إلى 50 °C في غضون ±1 °C. لاحظ أنه تمت إزالة بعض عزل العلبة لإظهار أجزاء العمل في الجهاز. يتم وضع حاوية جهاز الخلط الرئيسية على مرحلة انتقالية على خط شعاع NG3 VSANS في NCNR. يتم ضبط موضع العلبة باستخدام مرحلة الترجمة لوضع خلية العينة في مسار الحزمة النيوترونية (خط أصفر متقطع).

الشكل 1: مثال على الإعداد للجمع بين خلط التدفق المتوقف وقياسات تشتت النيوترونات ذات الزاوية الصغيرة عند خط شعاع VSANS في مركز NIST لأبحاث النيوترونات. يحتوي الإعداد على أربع مضخات حقنة ، وحقنتين لشطف المذيبات وحقنتين لحقن العينة ، وأربعة صمامات اختيار المضخة ، وصمامين لاختيار الخلاط ، وخلاط ديناميكي ، وخلية كوارتز متدفقة ، وحاوية عينات مختلطة. تشتت النيوترونات الساقطة من العينة المختلطة الموجودة داخل خلية العينة. يتم استخدام حاوية معزولة مع نوافذ كوارتز ووحدة مكيفة بالحرارة للتحكم في العينة وجميع المعدات عند درجة حرارة ثابتة. يوضح الخط الأصفر المتقطع مسار حزمة النيوترونات. شريط المقياس = 10 سم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
يتكون الجهاز الموضح في الشكل 1 من حقنتي عينة، وحقنتي شطف، وخلية عينة واحدة. يوضح الشكل 2 مخططات التدفق المقابلة للخطوات المختلفة للبروتوكول. يتم حقن الأحجام المطلوبة من العينتين المختلفتين في الخلاط وخلية العينة (الشكل 2 أ). بمجرد ملء خلية العينة ، يتم إغلاق صمام تبديل المدخل (ISV) وصمام تبديل المخرج (OSV) لعزل خلية العينة عن الخلاط الديناميكي ولمنع انتشار العينة مرة أخرى في الخلية أثناء جمع بيانات TR-SANS (الشكل 2B). قبل الخلاط الديناميكي ، يختلف طول أنبوب التوصيل من 10 سم إلى 1 متر ولا يؤثر على وقت تأخير الخلط. ومع ذلك ، ستؤثر وصلات الأنابيب بين الخلاط الديناميكي وخلية العينة على وقت تأخير الخلط وحجم حقن العينة المطلوب. يتم استخدام أنابيب الفولاذ المقاوم للصدأ المقطوعة مسبقا بقطر داخلي 0.04 بوصة (1 مم) وطول 100 مم لتوصيل الخلاط الديناميكي وصمامات محدد الخلاط (MSV1 و MSV2) و ISV و OSV. يتم استخدام الأنابيب المفلورة بقطر داخلي 1 مم وطول 115 مم لتوصيل ISV و OSV (أو مخرج الخلاط الديناميكي) بخلية العينة. يتضمن إجمالي حجم الفراغ الذي يؤثر على وقت تأخير الخلط حجم فراغ الخلاط (0.15 مل) ، والأنبوب بين مخرج الخلاط ومدخل خلية العينة (0.09 مل) ، وحجم خلية العينة (0.16 مل). في هذا المثال، حجم الفراغ الكلي يساوي 0.4 mL. أحجام الفراغ الداخلية للصمامات لا تذكر مقارنة بأحجام فراغ الأنبوب والخلاط وعينة الخلية. على سبيل المثال ، تحتوي صمامات اختيار الضغط المنخفض المستخدمة (قطر التجويف 0.75 مم) على أحجام فراغ تقريبية تبلغ 4 ميكرولتر ، بينما تحتوي صمامات اختيار الضغط العالي وصمامات التبديل (قطر التجويف 0.25 مم) على أحجام فراغ تقريبية تبلغ 0.5 ميكرولتر.
بعد اكتمال قياس TR-SANS ، يتم دفع العينة خارج الخلية بالمذيب ، ويتم ضخ مذيب الشطف بشكل متكرر عبر الخلية لإزالة العينة المتبقية وتنظيف خلية العينة (الشكل 2C). لاحظ أن محاقن الشطف متصلة بخزانات مذيب أكبر (مثل الماء والإيثانول) عبر قيم محدد المضخة لضمان توفر أحجام مذيبات كافية لتنظيف خلية العينة بين عمليات القياس. يتم وضع مصادر المذيبات ومصادر العينات وحاويات العينات المختلطة التي تحتوي على سوائل قابلة للاشتعال في حاوية منفصلة بدون معدات كهربائية للتخلص من جميع مصادر الاشتعال المحتملة. بالإضافة إلى ذلك ، يتم استخدام أغطية زجاجات قفل البخار لتقليل الأبخرة القابلة للاشتعال وتبخر المذيبات. أخيرا ، يتم تجفيف خلية العينة بتيار غاز النيتروجين لإزالة مذيب الشطف المتبقي (الشكل 2 د). يتم تنظيم ضغط غاز النيتروجين الداخل إلى صمام محدد الخلاط إلى حوالي 2 بار (0.2 ميجا باسكال ، ضغط المقياس) باستخدام منظم ضغط يدوي موجود على أسطوانة غاز النيتروجين. بمجرد تنظيف خلية العينة وتجفيفها بشكل كاف ، يتم حقن عينة مختلطة حديثا في خلية العينة لدورة القياس التالية (تكرار الخلط والحقن الموضح في مخطط التدفق في الشكل 2 أ).
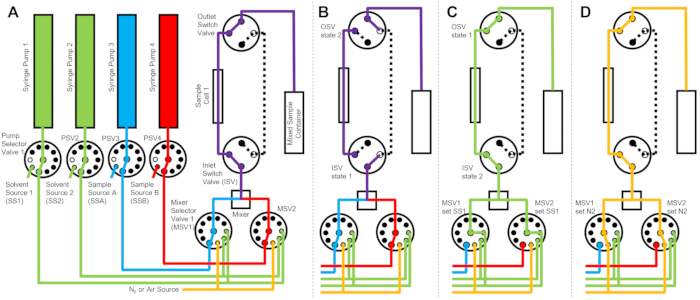
الشكل 2: مثال على مخطط التدفق باستخدام خلية عينة واحدة، وعينتين للخلط، ومذيبين شطف للتنظيف. أ: خلط العينة (أ) والعينة (ب) (الحمراء)، ثم تدفق العينة المختلطة (أرجوانية) إلى خلية العينة. (ب) أثناء جمع البيانات، يشير جهاز التدفق المتوقف إلى إغلاق صمامات تبديل بائعي البرامج المستقلين (ISV) وOSV لعزل خلية العينة ومنع الانتشار العكسي للعينة أثناء جمع البيانات. (ج) خطوات التنظيف حيث يتم شطف خلية العينة بمذيب شطف من SS1 (أخضر) بعد جمع البيانات. د: خطوة التجفيف حيث تجفف خلية العينة بغاز النيتروجين (البرتقالي). الاختصارات: ايندهوفن = صمام اختيار المضخة. MSV = صمام محدد الخلاط ؛ OSV = صمام تبديل المخرج ؛ ISV = صمام تبديل المدخل ؛ SS1 = مصدر المذيب 1 ؛ SSA = مصدر العينة A ؛ N2 = مصدر غاز النيتروجين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يوضح الشكل 3 مخططات التدفق لإصدار مختلف قليلا حيث يتم تكوين إعداد الخلط بخليتي عينة منفصلتين متصلتين بنفس صمامات التبديل (الشكل 3A). بينما يتم جمع بيانات TR-SANS في خلية العينة 1 ، يتم شطف خلية العينة 2 (الشكل 3B) وتجفيفها (الشكل 3C). عند اكتمال جمع البيانات لخلية العينة 1 ، يوجه صمام تبديل المدخل عينة مختلطة حديثا إلى خلية العينة 2 لجمع البيانات (الشكل 3D). بينما يتم جمع بيانات TR-SANS في خلية العينة 2 ، يتم شطف خلية العينة 1 وتجفيفها (الشكل 3E). هذه العملية المتناوبة المتوازية بين خليتين من خلايا العينة تقلل من الوقت بين حقن العينات اللاحقة وتزيد من استخدام وقت الحزمة النيوترونية.
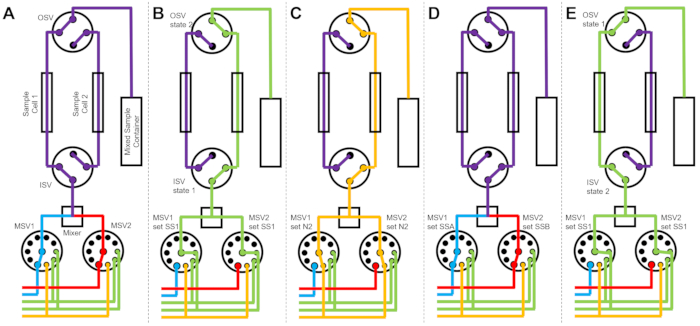
الشكل 3: مثال على مخطط السريان باستخدام خليتين من عينتين، وعينتين مختلطتين، ومذيبين شطف للتنظيف. (أ) خلط العينة A (الزرقاء) والعينة B (الحمراء) ثم تدفق العينة المختلطة (الأرجواني) إلى خلية العينة 1. (ب) حالة جهاز التدفق المتوقف أثناء جمع البيانات في خلية العينة 1 بينما تشطف خلية العينة 2 بمذيب من SS1 (أخضر). (ج) حالة جهاز توقف التدفق أثناء جمع البيانات في خلية العينة 1 بينما تجفف خلية العينة 2 بغاز النيتروجين (البرتقالي). (د) بمجرد اكتمال جمع بيانات خلية العينة 1، تخلط على الفور عينة جديدة (أرجوانية) وتتدفق إلى خلية العينة 2. (ه) حالة جهاز التدفق المتوقف أثناء جمع البيانات في خلية العينة 2 بينما تشطف خلية العينة 1 بمذيب من SS1 (أخضر). أثناء قياس خلية عينة واحدة ، يتم تنظيف خلية العينة الأخرى وتجفيفها. تتناوب عملية قياس التدفق المتوقف بين خليتي عينة لتقليل الوقت بين حقن خلط العينات اللاحقة. الاختصارات: ايندهوفن = صمام اختيار المضخة. MSV = صمام محدد الخلاط ؛ OSV = صمام تبديل المخرج ؛ ISV = صمام تبديل المدخل ؛ SS1 = مصدر المذيب 1 ؛ SSA = مصدر العينة A ؛ N2 = مصدر غاز النيتروجين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يتم وصف بروتوكول خطوة بخطوة أدناه لتوصيل المضخات وخطوط الأنابيب ، وتحضير النظام ، وشطف وتجفيف خلية العينة ، وحقن العينة المختلطة. على الرغم من أن تكوين الخلية الواحدة موضح من أجل البساطة (الشكل 2) ، يمكن تعديل الإعداد المعياري المرن والبروتوكول والبرامج النصية بسهولة لتنفيذ المزيد من مضخات الحقن أو الصمامات أو الخلاطات أو تكوينات خلايا العينة ، مثل تكوين الخلية المكونة من عينتين كما هو موضح في الشكل 3. يوضح الشكل 4 بيانات معدل عدد النيوترونات الخام التمثيلية التي تم جمعها خلال دورات حقن الخلط والتنظيف ، بينما يتم عرض حركية تبادل الدهون المقاسة عند 3 درجات حرارة مختلفة وكثافة التشتت الطبيعية المستخرجة المقابلة لجزء الدهون المتبادلة في الشكل 5 والشكل 6 ، على التوالي.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. قم بإعداد وبدء نظام التدفق المتوقف.
- قم بتشغيل جميع مصادر طاقة المضخة والخلاطات الديناميكية باستخدام مفتاح الطاقة.
- ابدأ تشغيل جميع المضخات والصمامات في واجهة المستخدم الرسومية (GUI) للتحكم في نظام التدفق المتوقف عن طريق إدخال مسار تكوين الجهاز واستخدام الأوامر bus=qmixbus. Bus(), bus.open(), bus.start(), pump=qmixpump. Pump() وpump.enable() والصمام = ViciMultiposSelector() (انظر مثال رمز البدء المتاح في مستودع مفتوح المصدرعبر الإنترنت 64).
- قم بمعايرة المضخات قبل توصيل المحاقن باستخدام الأمر pump.calibrate().
- تأكد من بدء تشغيل الصمامات والانتقال إلى منفذ المحدد الصحيح عند الأمر باستخدام الأمر valve.setPort() و valve.getPort() .
- قم بتعيين نوع المحقنة المراد استخدامها لكل مضخة باستخدام الأمر pump.set_syringe_param (A ، B) ، حيث A هو القطر الداخلي لبرميل المحقنة (مم) ، و B هو أقصى مسافة شوط مكبس للحقنة (مم).
- قم بتوصيل محاقن العينة بمضخات الحقن.
- بعد التأكد من معايرة المضخات ، قم بربط براميل حقنة نظيفة بالوصلة الموجودة أعلى المضخة (رأس تثبيت المحقنة).
- عند استخدام المحاقن الزجاجية ، تأكد من فك رأس حامل المحقنة قبل توزيع حجم التعبئة ، بحيث لا تنكسر المحقنة الزجاجية بسبب القوة المفرطة من مكبس المحقنة.
- المسمار في مكبس حقنة إلى اتصال في الجزء السفلي من المضخة (حقنة جبل الذيل).
- بعد توصيل برميل المحقنة ومكبس المحقنة بالمضخة ، قم بتوزيع حجم التعبئة لنوع المحقنة باستخدام الأمر pump.empty() ، الذي يحرك مكبس المحقنة إلى أعلى برميل المحقنة.
- عند استخدام المحاقن الزجاجية ، شد رأس حامل المحقنة بعد توقف حركة المكبس.
- قم بتوصيل الأنبوب بمصادر العينة والمذيبات والمحاقن والصمامات والخلاطات وخلايا العينات وحاوية العينات المختلطة.
- قم بتوصيل أنبوب مضخة المحقنة بصمامات محدد المضخة.
- قم بتوصيل أنبوب صمام محدد المضخة بمصادر العينة.
- قم بتوصيل أنبوب صمام محدد المضخة بمصادر مذيب الشطف.
- قم بتوصيل أنبوب صمام محدد المضخة بأنبوب صمام محدد الخلاط.
- قم بتوصيل أنبوب صمام محدد الخلاط بمصدر غاز النيتروجين.
- قم بتوصيل أنبوب صمام محدد الخلاط بمداخل الخلاط.
- قم بتوصيل مخرج الخلاط بصمام مفتاح المدخل.
- قم بتوصيل صمام مفتاح المدخل بمدخل خلية العينة.
- قم بتوصيل مخرج خلية العينة بصمام مفتاح المخرج.
- قم بتوصيل صمام مفتاح المخرج بحاوية العينات المختلطة.
- حدد جميع توصيلات الأنابيب والصمامات التي تم إجراؤها (الخطوة 1.7) في واجهة المستخدم الرسومية للتحكم في نظام التدفق المتوقف عن طريق كتابة توصيلات رقم المنفذ المقابلة التي تم إجراؤها لكل صمام (انظر مثال رمز التحكم في مستودع مفتوح المصدرعبر الإنترنت 64).
- احسب حجم الفراغ للأنبوب بين مدخل الخلاط ومخرج خلية العينة ، والذي يحدد الحد الأدنى لكمية العينة اللازمة لملء خلية العينة لكل قياس.
2. تحميل العينة.
- اضبط حجم تعبئة العينة المطلوب وحجم تعبئة المذيبات في واجهة المستخدم الرسومية للتحكم في نظام التدفق المتوقف عن طريق كتابة الأرقام المطلوبة (انظر مثال رمز التحكم في مستودع مفتوح المصدرعبر الإنترنت 64).
- استخدم الأمر pump.aspirate () لسحب (نضح) العينة المطلوبة وأحجام المذيبات من مصادرها إلى محاقن العينة من خلال صمامات اختيار المضخة.
ملاحظة: عند تحميل حقنة فارغة لأول مرة ، سيكون الهواء موجودا في الجزء العلوي من المحقنة التي يجب تطهيرها لتجهيز النظام بالعينة والمذيب في الخطوة 3.
3. رئيس النظام.
- استخدم الأمر pump.dispense( ) لدفع (توزيع) كل الهواء من المحاقن وخطوط الأنابيب والصمامات. تأكد من توزيع كمية كافية من السائل من كل حقنة لإزالة كل الهواء تماما من المحاقن والأنابيب والصمامات. إذا كانت فقاعات الهواء مرئية داخل أي أنبوب ، فاستمر في توزيع المذيب أو العينة حتى تتم إزالة الفقاعات.
- بمجرد تطهير الهواء من النظام ، قم بإجراء حقن عينة واحدة على الأقل وشطفها (بدون جمع بيانات تشتت النيوترونات).
- انقر لتحديد الخلية المسماة بدء تجربة الخلط في واجهة المستخدم الرسومية لعنصر التحكم.
- مع تحديد هذه الخلية بنشاط ، انقر فوق الزر "تشغيل" (مثلث قائم الأيمن) الموجود أعلى واجهة المستخدم الرسومية للتحكم ، أو اضغط على مفتاحي Shift و Enter معا على لوحة المفاتيح.
- افحص خلية العينة بصريا للتأكد من عدم وجود فقاعات هواء.
- في حالة وجود فقاعات هواء ، كرر خطوتي البروتوكول 3.1 و 3.2 لمزيد من تطهير أي هواء من خطوط الأنابيب.
- إذا لم تكن فقاعات الهواء موجودة في خلية العينة، فانتقل إلى الخطوة 4 لتحديد خطوات بروتوكول التجربة المتبقية.
4. حدد بروتوكول خلط التدفق المتوقف في البرنامج النصي للبرنامج (انظر مثال الكود في مستودع مفتوح المصدر عبر الإنترنت64).
- أدخل نقطة ضبط درجة الحرارة لوحدة مكيف الهواء القابلة للبرمجة (AC) التي تتحكم في درجة حرارة العلبة المعزولة المحيطة بجهاز التدفق المتوقف.
- أثناء الضغط على زر النجمة في وحدة التحكم في التيار المتردد ، اضغط على السهمين لأعلى ولأسفل لتغيير درجة حرارة نقطة الضبط. بدلا من ذلك ، اكتب نقطة ضبط درجة الحرارة المطلوبة في واجهة المستخدم الرسومية للتحكم وانقر فوق تشغيل.
- انتظر لمدة 15-30 دقيقة للسماح للحاوية الداخلية بالتوازن عند درجة الحرارة المطلوبة قبل بدء التجارب الحركية.
ملاحظة: يتراوح نطاق درجة الحرارة الذي يمكن الوصول إليه حاليا بين 10 درجات مئوية و 50 درجة مئوية ، واستقرار درجة الحرارة ± 1 درجة مئوية.
- أدخل جميع خطوات تسلسل الشطف عن طريق كتابة وحدات التخزين المناسبة ومعدلات التدفق والأوقات وعدد مرات التكرار في واجهة المستخدم الرسومية لعنصر التحكم.
- حدد حجم كل عينة سيتم حقنها ، والتي تحدد معدل التدفق الكلي (Q).
- حدد حجم كل مذيب يتم حقنه أثناء إجراء الشطف.
- حدد وقت التجفيف بين كل خطوة فرعية للشطف (ر جافة).
- حدد عدد خطوات الشطف الفرعية.
- حدد المذيبات المختلفة لخطوات الشطف اللاحقة.
- حدد عدد مرات تكرار الشطف التي يجب إجراؤها بعد كل قياس (nشطف).
- حدد الوقت اللازم لتجفيف خلية العينة والخلاط بالكامل ، مع توفير خلية عينة نظيفة لحقن العينة اللاحقة (tdry_final).
- حدد جميع خطوات تسلسل حقن العينة عن طريق كتابة الأحجام المناسبة ومعدلات التدفق والأوقات في واجهة المستخدم الرسومية للتحكم في نظام التدفق المتوقف.
- تحديد حجم كل عينة المراد حقنها ومعدل التدفق.
- احسب وقت التأخير(تأخير t) من حجم الفراغ (V void) ومعدل التدفق الإجمالي (tdelay = Vvoid / Q).
ملاحظة: وقت التأخير هو الوقت اللازم لملء خلية العينة بالعينة المختلطة. - حدد وقت الاستحواذ المطلوب لبيانات TR-SANS بحيث تحدث العملية الحركية ذات الاهتمام بالكامل (tscatt).
- اضبط وقت الانتظار بين نهاية تجربة التشتت وبداية دورات الشطف (twait).
ملاحظة: يجب أن يكون وقت الانتظار هذا 100 ثانية على الأقل إذا كان سيتم قياس انتقال النيوترون للعينة قبل شطفها من الخلية. هناك حاجة إلى نقل العينة أثناء معالجة البيانات لتقليل البيانات إلى الكثافة المطلقة. - حدد عدد دورات الحقن التي يجب إجراؤها مع تسلسلات الشطف التي يتم تشغيلها بين كل حقنة محددة في الخطوة 4.2 (دورة n).
- احسب الوقت الإجمالي لدورة جمع بيانات التدفق المتوقف (t cycle) باستخدام المعادلة (1).
دورة t= n شطف × (تأخير t + tجاف) + t تأخير dry_final+ t تأخير + t scatt (1)
حيث nشطف = عدد مرات الشطف (الخطوة 4.2.6) ؛ tdelay = وقت تأخير جهاز التدفق المتوقف (الخطوة 4.3.2) ؛ tdry = وقت التجفيف بين كل خطوة فرعية للشطف (الخطوة 4.2.3) ؛ tdry_final = الوقت اللازم لتجفيف خلية العينة والخلاط بالكامل (الخطوة 4.2.7) ؛ tscatt = وقت الحصول على بيانات TR-SANS المطلوب (الخطوة 4.3.3)
5. تحديد معلمات تشتت النيوترونات ذات الزاوية الصغيرة في واجهة المستخدم الرسومية للتحكم في أداة SANS.
- حدد مقاييس الطول ونطاق q محل الاهتمام لكل عينة.
- حدد تكوين الجهاز لتغطية نطاق الاهتمام q المطلوب ، مع زيادة تدفق النيوترونات في العينة.
- اضبط إجمالي وقت الحصول على بيانات VSANS في واجهة المستخدم الرسومية للتحكم في أداة SANS على وقت الدورة المحسوب في الخطوة 4.4 (وقت الحصول على بيانات تشتت النيوترونات =دورة t).
- اضبط وقت قياس إرسال العينة على 100 ثانية في واجهة المستخدم الرسومية للتحكم في أداة SANS.
- باستخدام واجهة المستخدم الرسومية للتحكم في أداة SANS ، قم بتشغيل جمع بيانات وضع الحدث عن طريق كتابة GenerateEventModeData true في سطر الأوامر.
6. اجمع قياسات التشتت القياسية لتقليل البيانات قبل بدء تجربة التدفق المتوقف لمعالجة بيانات TR-SANS.
- قياس تشتت الخلفية.
- تأكد من إغلاق غالق الجهاز المحلي.
- قم بتوصيل عينة الحزمة المحظورة بالجزء الخلفي من فتحة العينة، وقم بتأمين بيئة الجهاز المحلية، وافتح غالق الجهاز المحلي.
- حدد وقت الحصول على بيانات تشتت الحزمة المحظورة في البرنامج ، واجمع بيانات تشتت الحزمة المحظورة ، مع احتساب نفس المدة مثل أطول وقت للحصول على بيانات التشتت (tscatt).
- بمجرد اكتمال جمع البيانات ، أغلق مصراع الجهاز ، وقم بإزالة عينة الحزمة المسدودة من فتحة العينة.
- قياس تشتت الخلية الفارغة.
- تأكد من شطف خلية العينة وتجفيفها جيدا.
- افتح غالق الأداة المحلية.
- اجمع قياس انتقال الخلية الفارغة لمدة 100 ثانية.
- اجمع قياس تشتت الخلية الفارغة ، مع احتساب أطول وقت اكتساب على الأقل (tscatt).
7. ابدأ تجربة التدفق المتوقف.
- بدء جمع بيانات تشتت VSANS في وضع الحدث .
- تأكد من أن منطقة الجهاز المحلية آمنة ثم افتح غالق شعاع الجهاز المحلي.
- ابدأ في جمع بيانات SANS باستخدام برنامج التحكم في أداة SANS على كمبيوتر الجهاز عن طريق سحب وإسقاط عمليات التشغيل المطلوبة في قائمة انتظار الجهاز.
ملاحظة: لضمان قياس النقاط الزمنية الأولى، ابدأ في جمع البيانات قبل بدء تجربة خلط التدفق المتوقف. ستتم معالجة البيانات لاحقا في خطوة لاحقة لحساب وقت التأخير (tdelay).
- ابدأ تجربة خلط التدفق المتوقف في واجهة المستخدم الرسومية للتحكم .
- حدد خلية دفتر الملاحظات المسماة بدء تجربة الخلط في واجهة المستخدم الرسومية للتحكم في نظام التدفق المتوقف.
- مع تحديد هذه الخلية بنشاط ، انقر فوق الزر "تشغيل" (مثلث قائم الأيمن) الموجود أعلى برنامج التحكم في جهاز التدفق المتوقف ، أو اضغط على مفتاحي Shift و Enter معا على لوحة المفاتيح.
- تأكد من بدء تشغيل بروتوكول خلط التدفق المتوقف المحدد في القسم 4.
- أضف قياس الإرسال 100 ثانية إلى قائمة انتظار أجهزة VSANS بعد تشغيل التشتت باستخدام واجهة المستخدم الرسومية للتحكم في أداة SANS.
- أضف تشغيل قياس تشتت واحد وتشغيل قياس إرسال واحد إلى قائمة انتظار الجهاز لكل دورة خلط متبقية بالتدفق المتوقف (دورة n - 1، الخطوة 4.3.5) في واجهة المستخدم الرسومية للتحكم في جهاز SANS.
8. معالجة البيانات وتقليلها لإزالة جميع الخلفيات ، وتصحيح حساسية الكاشف ، وتصحيح نقل العينات.
- قم بتنزيل ملفات البيانات المبعثرة وملفات الأحداث المقترنة من الخادم.
ملاحظة: سيتم إنشاء ملفات أحداث كاشف منفصلة بعد كل قياس VSANS ، ملف حدث واحد لكل حامل كاشف نشط (على سبيل المثال ، كاشف أمامي و / أو متوسط و / أو خلفي). - قم بتجميع البيانات المبعثرة إلى حاويات الوقت المطلوبة باستخدام الأمر events=Rebin(filename) متبوعا بالأمر e vents.do_rebinning(timebins) ، حيث يتوافق اسم ملف الإدخال مع اسم ملف بيانات SANS المطلوب ، وtimebins هي قائمة بحدود حاوية الوقت المطلوبة بالثواني.
ملاحظة: إذا تم إدخال مفاتيح توقيت الإدخال كرقم واحد بدلا من قائمة، تجميع البيانات في عدد N من الحاويات ذات العروض الزمنية المتساوية، حيث N هي حاويات توقيت الإدخال (انظر البرامج النصية التي يوفرها خط الإرسال والمستودع مفتوح المصدر المتاح عبر الإنترنت64). - تقليل بيانات التشتت المعبأة باستخدام البرنامج المقدم من خط الشعاع65.
9. تحليل بيانات TR-SANS.
- احسب وقت عملية الاهتمام (عملية t) من أوقات القياس باستخدام المعادلة (2).
عملية t = ti - tstop +t تأخير (2)
حيث ti هي صناديق وقت القياس التي تبدأ بعد توقف التدفق ، و tstop هو وقت القياس فور توقف التدفق ، و tdelay هو وقت التأخير. - ارسم الشدة المعتمدة على q I (q) كدالة لوقت العملية باستخدام حاويات الوقت المحددة في الخطوة 8.2وعملية t المحسوبة في الخطوة 9.1.
ملاحظة: يتم تقييد أقرب وقت معالجة يمكن الوصول إليه بسببتأخير t. لقياس النقاط الزمنية السابقة للعملية ، قم بزيادة معدل التدفق الإجمالي (Q) أو تقليل إجمالي حجم الفراغ (V void). - استخراج المعلمات الحركية ذات الأهمية من التغيير في I(q) كدالة لوقت العملية.
10. إنهاء التجربة.
- قم بإيقاف تشغيل الحزمة النيوترونية عن طريق إغلاق مصراع الجهاز المحلي.
- قم بإجراء فحص الإشعاع باستخدام جهاز مراقبة الإشعاع الذي يوفره خط الشعاع قبل فصل أي أجزاء أو أنابيب أو تفريغ أي عينات أو حاويات عينات مختلطة.
- نقل المحاقن والأنابيب وحاوية العينات المختلطة إلى قسم الفيزياء الصحية.
- املأ نماذج الفيزياء الصحية وانتظر التقييم من قبل موظفي الفيزياء الصحية.
Access restricted. Please log in or start a trial to view this content.
النتائج
تقيس بيانات النيوترونات التمثيلية الموضحة هنا حركية تبادل الدهون في وجود ميثيل β سيكلودكسترين (mβCD) ، وهي مادة مضافة تحفز تبادل الدهون بين الحويصلات بسعر الصرف (ke) 66,67. أظهرت الدراسات الفلورية السابقة أن ke يعتمد على تركيز mβCD ، وأن عمر النصف لعملي?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يصف الإجراء الحالي جهاز الخلط وخطوات إجراء قياسات TR-SANS ذات التدفق المتوقف. تم تحسين الجهاز والبروتوكول لعينات السوائل منخفضة اللزوجة حيث تتراوح المقاييس الزمنية ذات الأهمية من ≈1 ثانية إلى 5 دقائق. بالنسبة للمقاييس الزمنية التي تزيد عن 5 دقائق ، قد يكون خلط العينات يدويا وتحميلها في خلايا ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم توفير الوصول إلى NG3 VSANS من قبل مركز تشتت النيوترونات عالي الدقة ، وهي شراكة بين المعهد الوطني للمعايير والتكنولوجيا والمؤسسة الوطنية للعلوم بموجب الاتفاقية رقم DMR-2010792. تقر M.H.L.N بالتمويل المقدم من Mitacs Globalink (كندا). إن تحديد أي منتجات تجارية أو أسماء تجارية هو لتعزيز التفاهم ولا يعني موافقة أو توصية من قبل المعهد الوطني للمعايير والتكنولوجيا.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Dynamic mixer | Analytical Scientific Instruments | 462-0150A | Magnetically coupled rotor, binary dynamic mixer assembly (ternary type available), 0.15 mL dead volume (larger dead volume available) |
| Fluoropolymer tubing | IDEX Health & Science | 1507L | PFA Tubing Natural 1/16 inch OD x 0.040 inch ID x 50 ft |
| Fluoropolymer 1/4-28 flangeless fittings | IDEX Health & Science | XP-245 | PFA flangeless fitting with ferrules, 1/4-28 threading, 1/16 inch OD tubing |
| Glass syringes | Hamilton Company | 81660 | Hamilton 1000 series syringes, 10 mL (81660), model 1010 C syr, 1/4"-28 thread termination, other volumes available |
| High-pressure flow selector valves | Vici Valco | C85X-1570EUTB | Vici 10 position selector valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure switch valves | Vici Valco | C82X-1574EUHB | Vici 4 port switch valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure syringes | Cetoni | A2019000358 | 3 mL stainless steel syringe, 510 bar max, 21 mL/min flow rate max |
| Low-pressure flow selector valves | Vici Valco | C25-3180EUHB | Vici 10 position selector valves, max 250 psi liquid, 0.75 mm bore, 1/16 inch OD tubing, 1/4-28 threaded ports, USB universal actuator |
| neMESYS high-pressure syringe pumps | Cetoni | A3921000103 | Max force 2600 N |
| neMESYS mid-pressure syringe pumps | Cetoni | A3921000131 | Max force 1000 N |
| Power supply | Cetoni | A3921000127 | Base 600, supplies power for up to 4 high pressure pumps |
| Quartz flow-through sample cell | Starna Scientific | 3-2.30-Q-1/TC | Quartz micro flow cells, 2 mm path length (1 mm available), 2 mm by 2 mm by 30 mm internal dimension |
| Quartz windows | Technical Glass Products | NA | GE 124 Clear fused quartz ground and polished plates, 11.75 inch by 23.75 inch by 0.375 inch thick |
| Stainless steel 10-32 coned compression fittings | IDEX Health & Science | U-321X, U-320X | 316 stainless steel ferrule (U-321X) and nut (U-320X) -Valco type, 10-32 coned, for 1/16 inch OD stainless steel tubing |
| Stainless steel tubing | IDEX Health & Science | U-102 | Stainless Steel Tubing 1/16 inch OD x 0.020 inch ID, 10 cm, various precut lengths available |
| Syringe pump control software | Cetoni | T6000000004 | QmixElements software for nemesys pumps, QmixSDK software development kit |
| Thermoelectric air conditioner | EIC Solutions | AAC-140C-4XT-HC | Thermoelectric air conditioner mounted on insulated enclosure to control the pump, valve, mixer, and sample temperature |
| T-slot railing | McMaster-Carr | 47065T103 | Aluminum t-slotted railing (1.5 inch by 1.5 inch) cut to various lengths |
| Vapor locking bottle caps | Cole-Parmer | EW-12018-02 | Four 304 SS port inserts, 1/4"-28 threads, GL45 bottle cap size, PTFE body, SS threads, PP collar |
References
- Melnichenko, Y. B., Wignall, G. D. Small-angle neutron scattering in materials science: Recent practical applications. Journal of Applied Physics. 102 (2), 021101(2007).
- Grillo, I. Small-angle neutron scattering and applications in soft condensed matter. Soft Matter Characterization. Borsali, R., Pecora, R. , Springer. Dordrecht. (2008).
- Hollamby, M. J. Practical applications of small-angle neutron scattering. Physical Chemistry Chemical Physics. 15 (26), 10566-10579 (2013).
- Pipich, V., Fu, Z. KWS-3: Very small angle diffractor with focusing mirror. Journal of large-scale research. 1, 31(2015).
- Kline, S. 2019 NCNR Annual Report, Special Publication (NIST SP). , National Institute of Standards and Technology. Gaithersburg, MD. (2019).
- Gilbert, P. H., et al. Preservative induced polysorbate 80 micelle aggregation. Journal of Pharmaceutical Sciences. 10 (6), 2395-2404 (2021).
- Terashima, T., et al. In situ and time-resolved small-angle neutron scattering observation of star polymer formation via arm-linking reaction in ruthenium-catalyzed living radical polymerization. Macromolecules. 43 (19), 8218-8232 (2010).
- Hashimoto, K., Fujii, K., Nishi, K., Shibayama, M. Ion gel network formation in an ionic liquid studied by time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 122 (40), 9419-9424 (2018).
- Conn, C. E., et al. Membrane protein structures in lipid bilayers; small-Angle neutron scattering with contrast-matched bicontinuous cubic phases. Frontiers in Chemistry. 8, 619470(2021).
- van't Hag, L., et al. Protein-eye view of the in meso crystallization mechanism. Langmuir. 35 (25), 8344-8356 (2019).
- Mahieu, E., et al. Observing protein degradation by the PAN-20S proteasome by time-resolved neutron scattering. Biophysical Journal. 119 (2), 375-388 (2020).
- Ibrahim, Z., et al. Time-resolved neutron scattering provides new insight into protein substrate processing by a AAA+ unfoldase. Scientific Reports. 7 (1), 40948(2017).
- Hollamby, M. J., et al. Growth of mesoporous silica nanoparticles monitored by time-resolved small-angle neutron scattering. Langmuir. 28 (9), 4425-4433 (2012).
- Blin, J. L., Impéror-Clerc, M. Mechanism of self-assembly in the synthesis of silica mesoporous materials: in situ studies by X-ray and neutron scattering. Chemical Society Reviews. 42 (9), 4071-4082 (2013).
- Impéror-Clerc, M., Grillo, I., Khodakov, A. Y., Durand, D., Zholobenko, V. L. New insights into the initial steps of the formation of SBA-15 materials: an in situ small angle neutron scattering investigation. Chemical Communications. 8, 834-836 (2007).
- Narayanan, T., Rüter, A., Olsson, U. SAXS/WAXS investigation of amyloid-β(16-22) peptide nanotubes. Frontiers in Bioengineering and Biotechnology. 9, 654349(2021).
- Angelov, B., et al. DNA/Fusogenic lipid nanocarrier assembly: millisecond structural dynamics. The Journal of Physical Chemistry Letters. 4 (11), 1959-1964 (2013).
- Amann, M., et al. Kinetic pathways for polyelectrolyte coacervate micelle formation revealed by time-resolved synchrotron SAXS. Macromolecules. 52 (21), 8227(2019).
- Varga, Z., Wacha, A., Bóta, A. Osmotic shrinkage of sterically stabilized liposomes as revealed by time-resolved small-angle X-ray scattering. Journal of Applied Crystallography. 47 (1), 35-40 (2014).
- Panine, P., Finet, S., Weiss, T. M., Narayanan, T. Probing fast kinetics in complex fluids by combined rapid mixing and small-angle X-ray scattering. Advances in Colloid and Interface Science. 127 (1), 9-18 (2006).
- Grillo, I. Applications of stopped-flow in SAXS and SANS. Current Opinion in Colloid & Interface Science. 14 (6), 402-408 (2009).
- Gomez-Hens, A., Perez-Bendito, D. The stopped-flow technique in analytical chemistry. Analytica Chimica Acta. 242, 147-177 (1991).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of stopped-flow fluorescence and labeled nucleotides to analyze the ATP turnover cycle of kinesins. Journal of Visualized Experiments: JoVE. (92), e52142(2014).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of stopped-flow kinetics methods to investigate the mechanism of action of a DNA repair protein. Journal of Visualized Experiments: JoVE. (37), e1874(2010).
- Raney, K. D., Sowers, L. C., Millar, D. P., Benkovic, S. J. A fluorescence-based assay for monitoring helicase activity. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6644-6648 (1994).
- Roder, H., Maki, K., Cheng, H. Early events in protein folding explored by rapid mixing methods. Chemical reviews. 106 (5), 1836-1861 (2006).
- Milon, A., et al. Osmotic swelling of unilamellar vesicles by the stopped-flow light scattering method. Influence of vesicle size, solute, temperature, cholesterol and three α,ω-dihydroxycarotenoids. Biochimica et Biophysica Acta (BBA) - Biomembranes. 859 (1), 1-9 (1986).
- Gast, K., Nöppert, A., Müller-Frohne, M., Zirwer, D., Damaschun, G. Stopped-flow dynamic light scattering as a method to monitor compaction during protein folding. European Biophysics Journal. 25 (3), 211-219 (1997).
- Antoun, A., Pavlov, M. Y., Tenson, T., Ehrenberg, M. M. Ribosome formation from subunits studied by stopped-flow and Rayleigh light scattering. Biological Procedures Online. 6, 35-54 (2004).
- Zhu, Z., Armes, S. P., Liu, S. pH-Induced micellization kinetics of ABC triblock copolymers measured by stopped-flow light scattering. Macromolecules. 38 (23), 9803-9812 (2005).
- Ye, J., et al. Comparative study of temperature-induced association of cyclic and linear poly(N-isopropylacrylamide) chains in dilute solutions by laser light scattering and stopped-flow temperature jump. Macromolecules. 41 (12), 4416-4422 (2008).
- Liu, X., et al. Early stage kinetics of polyelectrolyte complex coacervation monitored through stopped-flow light scattering. Soft Matter. 12 (44), 9030-9038 (2016).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garg, S., Porcar, L., Woodka, A. C., Butler, P. D., Perez-Salas, U. Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes. Biophysical Journal. 101 (2), 370-377 (2011).
- Marquardt, D., et al. 1H NMR shows slow phospholipid flip-flop in gel and fluid bilayers. Langmuir. 33 (15), 3731-3741 (2017).
- Egelhaaf, S. U., Olsson, U., Schurtenberger, P. Time-resolved SANS for surfactant phase transitions. Physica B: Condensed Matter. 276-278, 326-329 (2000).
- Tabor, R. F., Eastoe, J., Grillo, I. Time-resolved small-angle neutron scattering as a lamellar phase evolves into a microemulsion. Soft Matter. 5 (10), 2125-2129 (2009).
- Gradzielski, M., Bergmeier, M., Hoffmann, H., Müller, M., Grillo, I. Vesicle gel formed by a self-organization process. The Journal of Physical Chemistry B. 104 (49), 11594-11597 (2000).
- Lee, Y. -T., Li, D. S., Pozzo, L. D. Kinetic analysis of ultrasound-induced oil exchange in oil-in-water emulsions through contrast variation time-resolved small-sngle neutron scattering. Langmuir. 35 (47), 15204-15213 (2019).
- Lee, Y. -T., Pozzo, L. D. Contrast-variation time-resolved small-angle neutron scattering analysis of oil-exchange kinetics between oil-in-water emulsions stabilized by anionic surfactants. Langmuir. 35 (47), 15192-15203 (2019).
- Roger, K., Olsson, U., Schweins, R., Cabane, B. Emulsion ripening through molecular exchange at droplet contacts. Angewandte Chemie International Edition. 54 (5), 1452-1455 (2015).
- Nakano, M., Fukuda, M., Kudo, T., Endo, H., Handa, T. Determination of Interbilayer and Transbilayer Lipid Transfers by Time-Resolved Small-Angle Neutron Scattering. Physical Review Letters. 98 (23), 238101(2007).
- Nakano, M., et al. Flip-flop of phospholipids in vesicles: kinetic analysis with time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 113 (19), 6745-6748 (2009).
- Nguyen, M. H. L., et al. Methanol accelerates DMPC flip-flop and transfer: A SANS study on lipid dynamics. Biophysical Journal. 116 (5), 755-759 (2019).
- Nguyen, M. H. L., et al. Peptide-induced Lipid flip-flop in asymmetric liposomes measured by small angle neutron scattering. Langmuir. 35 (36), 11735-11744 (2019).
- Nguyen, M. H. L., et al. Time-resolved SANS reveals pore-forming peptides cause rapid lipid reorganization. New Journal of Chemistry. 45 (1), 447-456 (2021).
- Xia, Y., et al. Effects of nanoparticle morphology and acyl chain length on spontaneous lipid transfer rates. Langmuir. 31 (47), 12920-12928 (2015).
- Xia, Y., et al. Morphology-induced defects enhance lipid transfer rates. Langmuir. 32 (38), 9757-9764 (2016).
- Maric, S., et al. Time-resolved small-angle neutron scattering as a probe for the dynamics of lipid exchange between human lipoproteins and naturally derived membranes. Scientific Reports. 9 (1), 7591(2019).
- Nielsen, J. E., Bjørnestad, V. A., Pipich, V., Jenssen, H., Lund, R. Beyond structural models for the mode of action: How natural antimicrobial peptides affect lipid transport. Journal of Colloid and Interface Science. 582, 793-802 (2021).
- Willner, L., Poppe, A., Allgaier, J., Mokenbusch, M., Richter, D. TIme-resolved SANS for the determintioan of unimer exchange kinetics in block copolymer micelles. Europhysics Letters. 55 (5), 667(2001).
- Lund, R., Willner, L., Stellbrink, J., Lindner, P., Richter, D. Logarithmic chain-exchange kinetics of diblock copolymer micelles. Physical Review Letters. 96 (6), 068302(2006).
- Lund, R., Willner, L., Richter, D., Dormidontova, E. E. Equilibrium chain exchange kinetics of diblock copolymer micelles: Tuning and logarithmic relaxation. Macromolecules. 39 (13), 4566-4575 (2006).
- Lund, R., Willner, L., Richter, D. Kinetics of block copolymer micelles studied by small-angle scattering methods. in Controlled Polymerization and Polymeric Structures. Advances in Polymer Science. Abe, A., Lee, K. S., Leibler, L., Kobayashi, S. , Springer. Cham. 51(2013).
- Choi, S. -H., Lodge, T. P., Bates, F. S. Mechanism of molecular exchange in diblock copolymer micelles: hypersensitivity to core chain length. Physical Review Letters. 104 (4), 047802(2010).
- Choi, S. -H., Bates, F. S., Lodge, T. P. Molecular exchange in ordered diblock copolymer micelles. Macromolecules. 44 (9), 3594-3604 (2011).
- Lu, J., Bates, F. S., Lodge, T. P. Chain exchange in binary copolymer micelles at equilibrium: confirmation of the independent chain hypothesis. ACS Macro Letters. 2 (5), 451-455 (2013).
- Lu, J., Bates, F. S., Lodge, T. P. Remarkable effect of molecular architecture on chain exchange in triblock copolymer micelles. Macromolecules. 48 (8), 2667-2676 (2015).
- Kelley, E. G., et al. Size evolution of highly amphiphilic macromolecular solution assemblies via a distinct bimodal pathway. Nature Communications. 5 (1), 3599(2014).
- Murphy, R. P., Kelley, E. G., Rogers, S. A., Sullivan, M. O., Epps, T. H. Unlocking chain exchange in highly amphiphilic block polymer micellar systems: influence of agitation. ACS Macro Letters. 3 (11), 1106-1111 (2014).
- Schantz, A. B., et al. PEE-PEO block copolymer exchange rate between mixed micelles is detergent and temperature activated. Macromolecules. 50 (6), 2484-2494 (2017).
- Lantz, K. A., et al. Cavitation enables switchable and rapid block polymer exchange under high-χN conditions. Macromolecules. 51 (17), 6967-6975 (2018).
- Murphy, R. P., et al. Capillary RheoSANS: measuring the rheology and nanostructure of complex fluids at high shear rates. Soft Matter. 16 (27), 6285-6293 (2020).
- Stopped Flow Sans. usnistgov. , Available from: https://github.com/usnistgov/stopped-flow-sans (2021).
- Kline, S. Reduction and analysis of SANS and USANS data using IGOR Pro. Journal of Applied Crystallography. 39 (6), 895-900 (2006).
- Doktorova, M., et al. Preparation of asymmetric phospholipid vesicles for use as cell membrane models. Nature Protocols. 13 (9), 2086-2101 (2018).
- Huang, Z., London, E. Effect of cyclodextrin and membrane lipid structure upon cyclodextrin-lipid interaction. Langmuir. 29 (47), 14631-14638 (2013).
- Sugiura, T., Ikeda, K., Nakano, M. Kinetic analysis of the methyl-β-cyclodextrin-mediated intervesicular transfer of pyrene-labeled phospholipids. Langmuir. 32 (51), 13697-13705 (2016).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Dicko, C., et al. NUrF-Optimization of in situ UV-vis and fluorescence and autonomous characterization techniques with small-angle neutron scattering instrumentation. Review of Scientific Instruments. 91 (7), 075111(2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved