A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل واختيار الفطريات الإنتوموباتية من عينات التربة وتقييم الفوعة الفطرية ضد الآفات الحشرية
In This Article
Summary
هنا نقدم بروتوكولا يستند إلى نظام دودة الوجبات (Tenebrio molitor) الطعم الذي تم استخدامه لعزل واختيار الفطريات المسببة للأمراض (EPF) من عينات التربة. يتم استخدام صيغة رقم كونيديا فعالة (ECN) لاختيار EPF عالية تحمل الإجهاد على أساس الخصائص الفسيولوجية لمكافحة الآفات الميكروبية في هذا المجال.
Abstract
الفطريات النتوموباثوجينية (EPF) هي واحدة من عوامل مكافحة الميكروبات للإدارة المتكاملة للآفات. لمكافحة الآفات المحلية أو الغازية، من المهم عزل واختيار الشراكة بين الشعوب الأصلية. لذلك ، تم استخدام طريقة طعم التربة جنبا إلى جنب مع الطعم الحشري (دودة الوجبات ، Tenebrio molitor) في هذه الدراسة مع بعض التعديلات. ثم خضع صندوق المعاشات التقاعدية المعزول لاختبار الفوعة ضد الآفات الزراعية سبودوبتيرا ليتورا. وعلاوة على ذلك، تعرضت سلالات ال EPF المحتملة لتحديدات مورفولوجية جزيئية. وبالإضافة إلى ذلك، تم إجراء إنتاج كونيديا و المقايسة الحرارية لسلالات EPF واعدة ومقارنتها؛ وقد تم استبدال هذه البيانات كذلك في صيغة رقم كونيديا الفعال (ECN) لتصنيف المختبر. ويمكن تحسين نظام دودة الطعم في التربة وصيغة ال ECN عن طريق استبدال أنواع الحشرات ودمج المزيد من عوامل الإجهاد لتقييم التسويق والتطبيق الميداني. ويوفر هذا البروتوكول نهجا سريعا وفعالا لاختيار الأنظمة الاحيائية، وسيحسن البحوث المتعلقة بعوامل المكافحة البيولوجية.
Introduction
حاليا، الفطريات المسببة للأمراض (EPF) تستخدم على نطاق واسع في مكافحة الميكروبات من الآفات الزراعية والغابات والبستانية. ومزايا صندوق الالشراكة الاقتصادية هي نطاقات مضيفه الواسعة، وقدرته الجيدة على التكيف البيئي، وطبيعته الصديقة للبيئة، وأنه يمكن استخدامه مع مواد كيميائية أخرى لإظهار الأثر التآزري للإدارة المتكاملة للآفات(1)،2. للتطبيق كعامل لمكافحة الآفات ، من الضروري عزل عدد كبير من EPF إما عن الحشرات المريضة أو البيئة الطبيعية.
وتساعد عينات هذه الكائنات الحية من مضيفيهم في فهم التوزيع الجغرافي ومعدل انتشار الكائنات الحية الكهربائية في التجمعات الطبيعية 3,4,5. ومع ذلك ، فإن جمع الحشرات الفطرية المصابة عادة ما تكون محدودة بسبب العوامل البيئية ومجموعات الحشرات في الميدان4. وبالنظر إلى أن مضيفي الحشرات سيموتون بعد عدوى ال EPF ثم يسقطون في التربة، فإن عزل صندوق المعاشات التقاعدية عن عينات التربة قد يكون موردا مستقرا3,6. على سبيل المثال، من المعروف أن saprophytes تستخدم المضيف الميت كمورد للنمو. وقد استخدم الطعم التربة والنظم المتوسطة الانتقائية على نطاق واسع للكشف عن الأنظمة EPF وعزلها عن التربة3,4,7,8,9,10.
في الطريقة المتوسطة الانتقائية ، يتم طلاء محلول التربة المخفف على وسيط يحتوي على مضادات حيوية واسعة الطيف (على سبيل المثال ، الكلورامفينيكول ، التتراسيكلين ، أو ستريبتومايسين) لمنع نمو البكتيريا2،3،9،11. ومع ذلك، فقد أفيد بأن هذه الطريقة قد تشوه تنوع السلالة وكثافتها ويمكن أن تسبب تقديرا مفرطا أو أقل من التقدير للعديد من المجتمعات الميكروبية(6). وعلاوة على ذلك، فإن السلالات المعزولة أقل إمراضا وتتنافس مع الصابورفيت أثناء العزلة. من الصعب عزل EPF عن محلول التربة المخفف3. وبدلا من استخدام وسيلة انتقائية، تعزل طريقة طعم التربة ال EPF عن الحشرات الميتة المصابة، والتي يمكن تخزينها لمدة أسبوعين إلى ثلاثة أسابيع، مما يوفر طريقة فصل أكثر كفاءة ومعيارا للقوة EPF3,4,7,6. لأن الطريقة سهلة التشغيل ، يمكن للمرء عزل مجموعة متنوعة من السلالات المسببة للأمراض بتكلفة منخفضة4. لذلك، يتم استخدامه على نطاق واسع من قبل العديد من الباحثين.
عند مقارنة الأنواع المختلفة من أنظمة الطعم الحشري ، فإن Beauveria bassiana و Metarhizium anisopliae هي أكثر أنواع EPF شيوعا الموجودة في الحشرات التي تنتمي إلى Hemiptera و Lepidoptera و Blattella و Coleoptera6 و 12 و 13 و 14. من بين هذه الطعوم الحشرية ، تظهر جاليريا ميلونيلا (طلب Lepidoptera) و Tenebrio molitor (أمر Coleoptera) معدلات استرداد أعلى من Beauveria و Metarhizium spp. ، بالمقارنة مع الحشرات الأخرى. لذلك ، يتم استخدام G. mellonella و T. molitor عادة لاصطياد الحشرات. على مر السنين، أنشأت وزارة الزراعة في الولايات المتحدة مكتبة EPF (مجموعة خدمات البحوث الزراعية لثقافات EPF، ARSEF) التي تحتوي على مجموعة واسعة من الأنواع، بما في ذلك 4081 نوعا من بوفيريا spp.، 18 نوعا من كلونوستاشيس spp.، 878 نوعا من كورديسيبس spp.، 2473 نوعا من Metarhizium spp.، 226 نوعا من بوربوريوسيليوم spp.، و 13 نوعا من Pochonia spp. من بين أمور أخرى15. تم بناء مكتبة أخرى من EPF من قبل مختبر أبحاث علم الحشرات (ERL) من جامعة فيرمونت في الولايات المتحدة لمدة 30 عاما. ويشمل 1345 سلالة من EPF من الولايات المتحدة وأوروبا وآسيا وأفريقيا والشرق الأوسط16.
10- لمكافحة الآفات المحلية أو الغزوية في تايوان، يلزم عزل واختيار قوات حماية البيئة الأصلية. لذلك ، في هذا البروتوكول ، قمنا بتعديل ووصف إجراء طريقة طعم التربة ودمجها مع الطعم الحشري (دودة الوجبات ، Tenebrio molitor) system17. وبناء على هذا البروتوكول، أنشئت مكتبة للقوة الك000. وأجريت جولتان من الفحص (تحديد كمي للتلقيح) لعزلات EPF الأولية. أظهرت عزلات EPF إمراضية للحشرات. وقد خضعت السلالات المحتملة لتحديدات مورفولوجية جزيئية وخضعت لمزيد من التحليل من خلال فحص الحرارة والإنتاج المخروطي. وعلاوة على ذلك، اقترح أيضا مفهوم رقم كونيديا فعال. وباستخدام صيغة ECN وتحليل المكونات الرئيسية (PCA)، تم تحليل السلالات المحتملة تحت ضغط بيئي محاكاة لإكمال عملية إنشاء مكتبة EPF وفحصها. وفي وقت لاحق، تم اختبار الإمراض من سلالات EPF الواعدة للآفات المستهدفة (مثل Spodoptera litura). ويدمج البروتوكول الحالي بيانات ثيرموتوليرانس والإنتاج الموحد في صيغة ECN وتحليل PCA، والتي يمكن استخدامها كنظام تصنيف قياسي للبحوث ذات الصلة ب EPF.
Protocol
ملاحظة: يظهر المخطط الانسيابي بالكامل في الشكل 1.
1. عزل واختيار الفطريات الإنتوموباتية المحتملة (EPF)
- جمع عينة التربة
- إزالة 1 سم من التربة السطحية، ومن ثم جمع التربة داخل عمق 5-10 سم باستخدام مجرفة من كل موقع أخذ العينات.
ملاحظة: مواقع أخذ العينات ستكون جبلا أو غابة أو مناطق قليلة السكان لتجنب تلوث سلالات EPF التي يتم رشها اصطناعيا. التأكد من تغطية مناطق جمع عينات التربة بالحواس على السطح. التربة الجافة أو التربة الرطبة ليست مناسبة لهذه التجربة. - سجل تفاصيل كل موقع لأخذ العينات، بما في ذلك نظام تحديد المواقع العالمي (GPS)، والارتفاع، ونوع الحقل، ودرجة الحرارة السنوية، وهطول الأمطار السنوي، ووقت التجميع (الموسم)، ونوع التربة، وقيمة درجة الحموضة.
- جمع 100 غرام من عينة التربة في كيس من البلاستيك والحفاظ عليها في درجة حرارة الغرفة إذا أخضعها لبروتوكول العزل الفطرية في المختبر في غضون 3 ساعة.
ملاحظة: إذا كان لا يمكن استخدام العينة في غضون 3 ساعة، تخزين التربة في درجة حرارة الغرفة في ظروف مظلمة. إذا لم يتم إجراء التجربة على الفور، يمكن تخزين عينة التربة عند 4 درجة مئوية لمدة أسبوع واحد حتى بداية البروتوكول18,19.
- إزالة 1 سم من التربة السطحية، ومن ثم جمع التربة داخل عمق 5-10 سم باستخدام مجرفة من كل موقع أخذ العينات.
- الطعم وعزل EPF مع دودة الوجبات (Tenebrio موليتور)
- ضع 100 غرام من عينة التربة في كوب بلاستيكي (قطر الغطاء = 8.5 سم ، الارتفاع = 12.5 سم) ، ثم ضع 5 ديدان وجبة على سطح التربة في درجة حرارة الغرفة في الظلام لمدة أسبوعين.
ملاحظة: يمكن أيضا استخدام أنواع أخرى من حاويات الأكواب البلاستيكية. إذا كانت التربة جافة جدا (متصدع أو رملي)، رش ddH2O المعقمة (حوالي 5-10 مل) على التربة. طول الجسم c.a. 2.5 سم (النجمة الرابعة عشرة ) من يرقات T. موليتور يساعد في شاشات العزل الفطرية20. - مراقبة وتسجيل اليرقات يوميا للوفيات والإصابة بالإصابة بالأمراض العضلية؛ إبقاء اليرقات الميتة في الكأس حتى أسبوعين لعزل الفطرية.
ملاحظة: سوف يلتصق بوغ كونيديا الفطري في عينات التربة بيرقات دودة الوجبات أثناء العملية المذكورة أعلاه. سوف يلاحظ الغشاء الفطري عندما ينمو الغشاء الغشاءي من الغشاء بين الغشاء، ومن ثم سيتم تغطية الجسم كله بالماسيليوم. سيبدأ Sporulation بعد 7 أيام وسيتغير لون العدوى الفطرية إلى لون كتلة كونيديا. - نقل الحشرات الميتة إلى مقعد نظيف واستخدام مسواك معقمة لجمع كونيديا. خط لهم على ربع قوة Sabouraud dextrose أجار المتوسطة (1/4 SDA) لوحة (55 ملم) في المختبر21. احتضان لوحة الثقافة في 25 درجة مئوية لمدة 7 أيام للحصول على الثقافة الأولية للفطريات.
ملاحظة: يتم إعداد لوحة SDA 1/4 على النحو التالي: مزيج 1.5 غرام من مرق Sabouraud dextrose و 3 غرام من أجار في 200 مل من H2O، ومن ثم تعقيم لمدة 20 دقيقة. Aliquot 1/4 SDA في كل طبق بيتري 55 ملم قبل التجسيد. يتم تخزين لوحات SDA الصلبة عند درجة حرارة 4 درجات مئوية حتى الاستخدام. - إعادة خط كل الفطريات الثقافة الأولية على لوحة واحدة 55 ملم 1/4 SDA في تدفق صفح واحتضان لوحة الثقافة في 25 درجة مئوية لمدة 7 أيام للحصول على مستعمرات واحدة من الفطريات.
- كرر هذه إعادة عزل ~ 2-3 مرات ومراقبة تحت المجهر الخفيفة للحصول على مستعمرات فطرية مورفولوجية واحدة ونقية.
ملاحظة: عزل كافة EPF باستخدام T. موليتور الطعم وتخزين كما هو موضح في المقطع التالي. يجب أن يتم الفصل والحفظ والثقافة النقية والشرائط في تدفق صفح في الأقسام اللاحقة.
- ضع 100 غرام من عينة التربة في كوب بلاستيكي (قطر الغطاء = 8.5 سم ، الارتفاع = 12.5 سم) ، ثم ضع 5 ديدان وجبة على سطح التربة في درجة حرارة الغرفة في الظلام لمدة أسبوعين.
- تخزين عزلات EPF
- قطع 3 من كتل أجار 5 ملم على حافة كل لوحة فطرية نقية معزولة مع بورير الفلين ووضعه في أنبوب الطرد المركزي الدقيق 1.5 مل كما تكرار واحد.
ملاحظة: يوصى بثلاث نسخ متماثلة لكل عزل فطري لتخزين سلالات EPF بعد اختبار الفوعة الثاني . يوصى أيضا بتحديد الهوية الجزيئية إذا كانت مساحة التخزين محدودة. - إضافة 250 ميكرولتر من محلول 0.03٪ السطحي (جدول المواد) و 250 ميكرولتر من 60٪ من الجلسيرول في أنبوب الطرد المركزي الصغير 1.5 مل باستخدام ميكروبايت؛ ثم دوامة لمدة 10 s.
- ختم أنبوب الطرد المركزي 1.5 مل الدقيقة مع فيلم البارافين وprecool في ثلاجة -20 درجة مئوية لمدة 24 ساعة. ثم، نقل المخزونات الفطرية المبردة مسبقا إلى ثلاجة -80 درجة مئوية لالتبريد.
ملاحظة: استخدمت لوحات إضافية من الاستزراع الفطري النقي (باستثناء العينات المحفوظة بالتبريد) في القسم 1.4.
- قطع 3 من كتل أجار 5 ملم على حافة كل لوحة فطرية نقية معزولة مع بورير الفلين ووضعه في أنبوب الطرد المركزي الدقيق 1.5 مل كما تكرار واحد.
- شاشة الإمراض الأولى للعزل الفطري
- ضع خمس يرقات T. موليتور مباشرة على سطح كل لوحة ثقافة فطرية نقية عند 25 درجة مئوية.
- مراقبة وتسجيل الإصابة بالأمراض العضلية والوفيات لمدة 10 أيام. حدد عزل الفطرية لمزيد من التحليل.
ملاحظة: يتم اختيار العزلات الفطرية التي تسبب وفيات بنسبة 100٪ لاختبار الفوعة الثاني لتأكيد ضراوتها ليرقات T. موليتور . بدلا من ذلك ، يمكن للباحث ضبط المعايير وفقا لدراسة خاصة به.
- اختبار الفوعة الثاني للعزل الفطري
ملاحظة: استنادا إلى شاشة الإمراض الأولى ، يمكنك استرداد العزلات الفطرية المحددة من -80 درجة مئوية لاختبار الفوعة الثاني . الغرض من اختبار الفوعة الثاني هو تحديد مدى إمراض العزلات الفطرية المختارة بعد الجولة الأولى من الفحص.- حصاد كونيديا من كل عزل الفطرية عن طريق الدوامة لمدة 1 دقيقة وعدد كونيديا باستخدام مقياس الدم.
- ضبط تعليق كونيديا إلى تركيز 1 × 107 كونيديا / مل في محلول 0.03٪ السطحي (جدول المواد).
- انتشار 10 ميكرولتر من التعليق الفطري على 55 مم 1/4 لوحات SDA وتنمو لمدة 7 أيام في 25 درجة مئوية في الظلام.
- ضع خمس يرقات من موليتور T. مباشرة على سطح كل لوحة ثقافة فطرية نقية (c.a. 6 × 107 كونيديا). ختم لوحات مع فيلم البارافين واحتضان في 25 درجة مئوية في الظلام.
- مراقبة وتسجيل الإصابة بالأمراض العضلية والوفيات لمدة 10 أيام.
- كرر الاختبار (من الخطوة 1.51 إلى 1.5.5) في ثلاثية لكل عزل الفطرية.
ملاحظة: يتم اختيار العزلات الفطرية التي تسبب وفيات بنسبة 100٪ لاختبار الفوعة الثالث لتأكيد ضراوتها لاستهداف الآفة.
- اختبار الفوعة الثالث للعزل الفطري للآفات المستهدفة (Spodoptera litura كمثال)
- كرر الخطوات 1.5.2 إلى 1.5.6 مع عزلات مختارة من الفوعة الثانية لاختبار الفوعة ضد الآفات المستهدفة.
- حساب LT50 من كل عزل الفطرية22.
ملاحظة: تم حساب LT50 من كل عزل الفطرية من خلال نماذج خطية معممة (GLMs) باستخدام R الاستوديو (الإصدار 3.4.1); يمكن استخدام توزيع الخطأ شبه الثنائي ووظيفة ارتباط سجل لحساب الإفراط في التشتت.
2. التعريف الجزيئي لEPF
- استخراج الحمض النووي الجينوم الفطري
- جمع c.a. 1 cm2 EPF من لوحة 7 أيام 1/4 SDA.
- استخراج الحمض النووي الجينوم الفطري باستخدام مجموعة استخراج الحمض النووي الجينوم الفطرية وفقا لتعليمات الشركة المصنعة23 (جدول المواد).
- تضخيم PCR وتسلسل الحمض النووي
- تضخيم منطقة ITS الفطرية بواسطة PCR لعينة الحمض النووي21 باستخدام PCR Master Mix (2x) ، ITS1F / ITS4R التمهيدي set24 (الجدول 1) مع برنامج PCR التالي: 94 درجة مئوية لمدة دقيقة واحدة ، ثم 35 دورة من 94 درجة مئوية لمدة 30 ثانية، 55 درجة مئوية لمدة 30 ثانية، و 72 درجة مئوية لمدة دقيقة واحدة، تليها تمديد نهائي لمدة 7 دقائق عند 72 درجة مئوية.
ملاحظة: مجموعة التمهيدي ITS1F/ITS4R هو تعريف مستوى جنس. - تسلسل PCR حسب خدمة التسلسل التجاري.
- استخدام NCBI BLAST البحث عن الفطريات مماثلة في قاعدة بيانات NCBI واختيار نوع الفطرية النسبية الأنواع للتحليل النباتي.
ملاحظة: ينبغي تحديد الأنواع الفطرية التي تنتمي إلى جنس Metarhizium أو Beauveria إلى مستوى الأنواع مع tef-983F/tef-2218R التمهيدي set25 (كرر الخطوات 2.1.1 إلى 2.2.3). بالنسبة للفطريات التي لا تنتمي إلى جنس Metarhizium أو Beauveria ، يمكن استخدام علامات جزيئية أخرى لتحديد الأنواع ، بما في ذلك DNA lyase (APN2) وبيتا توبولين (BTUB) وRNA polymerase II أكبر وحدة فرعية (RPB1) و RNA polymerase II ثاني أكبر وحدة فرعية (RPB2) ، و 3' جزء من معامل استطالة الترجمة 1 ألفا (TEF)25،26 .
- تضخيم منطقة ITS الفطرية بواسطة PCR لعينة الحمض النووي21 باستخدام PCR Master Mix (2x) ، ITS1F / ITS4R التمهيدي set24 (الجدول 1) مع برنامج PCR التالي: 94 درجة مئوية لمدة دقيقة واحدة ، ثم 35 دورة من 94 درجة مئوية لمدة 30 ثانية، 55 درجة مئوية لمدة 30 ثانية، و 72 درجة مئوية لمدة دقيقة واحدة، تليها تمديد نهائي لمدة 7 دقائق عند 72 درجة مئوية.
- التحليل النباتي
- استخدم برنامج ClustalX 2.127 لمحاذاة تسلسلات متعددة من الخطوتين 2.2.2 و 2.2.3. تقليم منطقة التسلسلات المحفوظة يدويا باستخدام GeneDoc28.
- إجراء التحليل النباتي بواسطة برنامج MEGA729 استنادا إلى التطور الأدنى (ME) ، Neighbor-Joining (NJ) ، وأقصى احتمال (ML) الأساليب.
ملاحظة: يمكن أن يساعد تنفيذ كافة الطرق الثلاثة في تأكيد حالة التصنيف وإتمامها بدقة. يتم استخدام العزلات الفطرية التي يتم فحصها بواسطة شاشة الإمراض الأولى لتحديد الهوية الجزيئية على مستوى الجنس. يتم استخدام العزلات الفطرية التي يتم فحصها من خلال اختبار الفوعة الثاني لتحديد الأنواع الجزيئية والمورفولوجية.
3. تحديد شكلي لEPF
- مراقبة مورفولوجيا المستعمرة الفطرية
- استخدام كاميرا لالتقاط نمو مستعمرة الثقافة الفطرية لمدة 7 أيام، وتسجيل النمو، وشكل (رقيق، شركة)، ولون المستعمرات.
- مراقبة كونيديا وكونيديوفوريس
- كشط كونيديا من مستعمرة فطرية الثقافة النقية مع حلقة التطعيم ونقل الجراثيم إلى شريحة زجاجية مع 0.1٪ Tween 80 الحل. ثم، وتغطي مع غطاء للمراقبة المجهرية الخفيفة من كونيديا.
- استخدام مشرط لقطع كتلة أجار 5 mm2 من حبلا الواصلة على حافة مستعمرة الفطرية، ومن ثم نقل كتلة أجار إلى شريحة زجاجية.
- إجراء التنظيف على النحو التالي: إضافة 0.1٪ توين 80 الحل على كتلة أجار مع القطارة البلاستيكية ويغسل معظم كونيديا الزائدة باستخدام ملاقط. ثم، تغطية ذلك مع غطاء للمراقبة الضوئية.
ملاحظة: 0.1٪ Tween 80 يمكن استبدالها مع آخر أكثر فعالية السطحي (جدول المواد) اعتمادا على الأنواع الفطرية والماء. - قياس وتسجيل عرض وطول كونيديا وconidiophores لمقارنة الاختلافات بين عزل الفطرية المختلفة.
- استخدم اختبار ANOVA الخاص ب Welch واختبار Games-Howell (اختبار ما بعد المخصص) لتحليل العرض الطولي والطول لكل سلالة باستخدام استوديو R (الإصدار 3.4.1).
ملاحظة: تحليل البيانات من الأحرف المورفولوجية يمكن تعديلها حسب الحالات. يتم استخدام العزلات الفطرية التي تم فحصها باستخدام اختبار الفوعة الثالثة لتوصيف الفسيولوجية وتصنيف ECN في القسمين 4 و 5.
4. التحقيق في الإنتاجية الزوجية والتولير الحراري
- المقايسة الانتاجية المخروطية
- ثقافة عزل الفطرية المختارة على 1/4 SDA المتوسطة في 25 ± 1 درجة مئوية في الظلام لمدة 10 أيام.
- إعداد 1 مل من تعليق conidial من عزل الفطرية في محلول 0.03٪ السطحي وضبط إلى 1 × 107 كونيديا / مل كما هو موضح أعلاه.
- إسقاط ثلاثة قطرات من 10 ميكرولتر من تعليق مرتبة على 1/4 SDA واحتضان في 25 درجة مئوية في الظلام لمدة 7 و 10 و 14 يوما لحساب sporulation من الفطريات.
ملاحظة: 10 ميكرولتر هو أفضل حجم لجمع كتلة 5 ملم مع sporulation الفطرية حتى بعد النمو الفطري لمدة 7-14 يوما. - استخدام البورر الفلين لفصل كتلة أجار 5 ملم من وسط المستعمرة ونقلها إلى 1 مل من محلول السطحي 0.03٪ (جدول المواد) في أنبوب الطرد المركزي الصغيرة 1.5 مل في كل نقطة زمنية.
- دوامة الأنبوب في 3000 دورة في الدقيقة في درجة حرارة الغرفة لمدة 15 دقيقة واستخدام مقياس الدم لحساب عدد كونيديا.
ملاحظة: الصيغة المستخدمة في العد هي عدد كونيديا لكل 25 مربعا من أصغر خلية (الحجم = 0.025 مم2؛ عمق الغرفة = 0.1 مم):
العدد الإجمالي للكونيديا في 5 مربعات ÷ 80 × (4 × 106) - كرر ثلاث مرات لكل عزل.
- اختبار ثيرموتوليرانس
- ثقافة عزل الفطرية المختارة على 1/4 SDA المتوسطة في 25 ± 1 درجة مئوية في الظلام لمدة 10 أيام.
- إعداد 1 مل من تعليق conidial عزل الفطرية في محلول 0.03٪ السطحي وضبط إلى 1 × 107 كونيديا / مل كما هو موضح أعلاه.
- دوامة تعليق مخروطي وتسخينه في حمام جاف 45 درجة مئوية لمدة 0 و 30 و 60 و 90 و 120 دقيقة. إسقاط ثلاثة قطرات من 5 ميكرولتر من تعليق مرتبة على 55 مم 1/4 SDA المتوسطة في كل نقطة وقت بعد التعرض للحرارة واحتضان في 25 ± 1 درجة مئوية لمدة 18 ساعة.
ملاحظة: تجنب انتشار قطرات الفطرية لتكون قادرة على التركيز بشكل أفضل على المنطقة. - عد عدد جراثيم كونيديا المنبتة مع خمسة حقول مختارة عشوائيا تحت المجهر الخفيف 200x لتحديد معدل الإنبات.
- إجراء ثلاث نسخ متماثلة لكل عزل.
5. رقم كونيديا الفعال (ECN) الترتيب
- حساب ECN
ملاحظة: الحصول على بيانات الإنتاج المخروطي وثيرموتوليرانس لكل سلالة فطرية محتملة قبل حساب ECN21 الكلي.- حساب أضعاف التغيير (FC) من الإنتاج التزامن في كل نقطة زمنية:
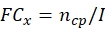
حيث، x = نقطة زمنية لجمع البيانات؛ ncp = عدد كونيديا بعد كل يوم من النمو; وأنا = العدد الأولي من كونيديا المصنف. - حساب عدد كونيديا تحت علاج الإجهاد في كل نقطة زمنية باستخدام الصيغة التالية:

حيث، y = ECN من النقطة الزمنية تحت العلاج؛ TT0 = معدل إنبات كونيديا لا يخضع للإجهاد الحراري (= معدل الإنبات من 0 دقيقة العلاج الحراري)؛ TTz = معامل الإجهاد هو معدل انبات كونيديا في أوقات مختلفة من المعالجة الحرارية (z). - حساب ECN الإجمالي باستخدام الصيغة التالية:

- قارن ECN من كل سلالة فطرية.
- حساب أضعاف التغيير (FC) من الإنتاج التزامن في كل نقطة زمنية:
- تحليل المكون الرئيسي (PCA) للسلالات الفطرية
ملاحظة: يؤكد تحليل PCA ترتيب ECN ويساعد في فهم الارتباط بين قيم الأحرف الفسيولوجية. قارن قيم ECN وحدد عزل EPF الذي له قيم ECN أعلى. - استخدام برامج R لإنشاء PCA عن طريق الترميز:
ملف بيانات PCA #Input
أ = read.table ("PCA.csv", sep=',',رأس=T)- # معالجة بيانات العينة
row.names(a) <-c("NCHU-9"," NCHU-11", "NCHU-64", "NCHU-69", "NCHU-95", "NCHU-113")
X=row.names(أ)
df<- a[2:11] - حساب #PCA
pca <- prcomp(df، مركز = TRUE، مقياس = TRUE)
vars <- (pca$sdev)^2
pc1_percent = vars[1] / مجموع (vars)
pc2_percent = vars [2] / مجموع (vars)
القيمة = pca $x - ملف مرئيات PCA #Output
png(ملف = 'pca.png'، الارتفاع = 2000، العرض = 2000، res = 300)
ملاحظة: استخدم 7 إلى 14 يوما من الإنتاج المتجانس وجميع بيانات إعادة الحرارة لتنفيذ تحليل المكونات الرئيسية (PCA) لتأكيد تصنيف ECN.
- # معالجة بيانات العينة
- حدد السلالات الفطرية الأفضل أداء استنادا إلى ECN أو PCA وإجراء اختبار الفوعة للآفات المستهدفة لمزيد من البحث.
النتائج
عزل واختيار الفطريات الإنتوموباتشيكية المحتملة (EPF)
وباستخدام طريقة بناء مكتبة تينبريو موليتور بوساطة الفطريات الإنتوموباتشيكية ، سيتم استبعاد عدد الفطريات التي لا تحتوي على نشاط لقتل الحشرات ؛ وبالتالي، يمكن زيادة كفاءة اختيار صندوق المعاشات التقاعد?...
Discussion
وقد استخدمت الفطريات Entomopathogenic (EPF) لمكافحة الحشرات. هناك عدة طرق لعزل وتحديد وتعريف EPF30,31,32. وبمقارنة الأنواع المختلفة من أساليب الطعم الحشري، تم العثور على بوفيريا باسيانا وميتاريزيوم أنيسوبرليا عادة في الطعم الحشري6
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح في هذا العمل.
Acknowledgements
تم دعم هذا البحث من قبل غرانت 109-2313-B-005 -048 -MY3 من وزارة العلوم والتكنولوجيا (MOST).
Materials
| Name | Company | Catalog Number | Comments |
| Agar Bacteriological grade | BIOMAN SCIENTIFIC Co., Ltd. | AGR001 | Suitable in most cell culture/molecular, biology applications. |
| AGAROSE, Biotechnology Grade | BIOMAN SCIENTIFIC Co., Ltd. | AGA001 | For DNA electrophoresis. |
| BioGreen Safe DNA Gel Buffer | BIOMAN | SDB001T | |
| Brass cork borer | Dogger | D89A-44001 | |
| Canon kiss x2 | Canon | EOS 450D | For record strain colony morphology |
| Constant temperature incubator | Yihder Co., Ltd. | LE-509RD | Fungal keeping. |
| cubee Mini-Centrifuge | GeneReach | MC-CUBEE | |
| DigiGel 10 Digital Gel Image System | TOPBIO | DGIS-12S | |
| Finnpipette F2 0.2 to 2 µL Pipette | Thermo Scientific | 4642010 | |
| Finnpipette F2 1 to 10 µL Pipette | Thermo Scientific | 4642030 | |
| Finnpipette F2 10 to 100 µL Pipette | Thermo Scientific | 4642070 | |
| Finnpipette F2 100 to 1000 µL Pipette | Thermo Scientific | 4642090 | |
| Finnpipette F2 2 to 20 µL Pipette | Thermo Scientific | 4642060 | |
| Finnpipette F2 20 to 200 µL Pipette | Thermo Scientific | 4642080 | |
| GeneAmp PCR System 9700 | Applied Biosystems | 4342718 | |
| GenepHlow Gel/PCR Kit | Geneaid | DFH100 | |
| Genius Dry Bath Incubator | Major Science | MD-01N | |
| Graduated Cylinder Custom A 100mL | SIBATA | SABP-1195906 | Measure the volume of reagents. |
| Hand tally counter | SDI | NO.1055 | |
| Hemocytometer | bioman | AP-0650010 | Calculate the number of spore |
| Inoculating loop | Dogger | D8GA-23000 | |
| lid | IDEAHOUSE | RS92004 | |
| Micro cover glass | MUTO PURE CHEMICALS CO.,LTD | 24241 | |
| Microscope imaging system | SAGE VISION CO.,LTD | SGHD-3.6C | |
| Microscope Slides | DOGGER | DG75001-07105 | |
| Mupid-2plus DNA Gel Electrophoresis | ADVANCE | AD110 | |
| Nikon optical microscope | SAGE VISION CO.,LTD | Eclipse CI-L | |
| Plastic cup | IDEAHOUSE | CS60016 | |
| Presto Mini gDNA Yeast Kit | Geneaid | GYBY300 | Fungal genomic DNA extraction kit |
| Sabouraud Dextrose Broth (Sabouraud Liquid Medium) | HiMedia Leading BioSciences Company | M033 | Used for cultivation of yeasts, moulds and aciduric microorganisms. |
| Scalpel Blade No.23 | Swann-Morton | 310 | |
| Scalpel Handle No.4 | AGARWAL SURGICALS | SSS -FOR-01-91 | |
| Shovel | Save & Safe | A -1580242 -00 | |
| Silwet L-77 | bioman(phytotech) | S7777 | Surfactant |
| Sorvall Legend Micro 17 Microcentrifuge | Thermo Scientific | 75002403 | |
| Steel Tweezers | SIPEL ELECTRONIC SA | GG-SA | |
| Sterile Petri Dish | BIOMAN SCIENTIFIC Co., Ltd. | 1621 | Shallow cylindrical containers with fitted lids, specifically for microbiology or cell culture use. |
| ThermoCell MixingBlock | BIOER | MB-101 | |
| Tween 80 | FUJIFILM Wako Pure Chemical Corporation | 164-21775 | |
| TwinGuard ULT Freezer | Panasonic Healthcare Holdings Co., Ltd. | MDF-DU302VX | -80°C sample stored. |
| Vertical floor type cabinet | Chih Chin | BSC-3 | Fungal operating culturing. |
| Vortex Genie II | Scientific | SIG560 | |
| Zipper storage bags | Save & Safe | A -1248915 -00 | |
| 100 bp DNA Ladder | Geneaid | DL007 | |
| -20°C Freezer | FRIGIDAIRE | Frigidaire FFFU21M1QW | -20°C sample and experimental reagents stored. |
| 2X SuperRed PCR Master Mix | TOOLS | TE-SR01 | |
| 50X TAE Buffer | BIOMAN | TAE501000 |
References
- Wraight, S. P., Carruthers, R. I. . Biopesticides: use and Delivery. , 233-269 (1999).
- Chase, A., Osborne, L., Ferguson, V. Selective isolation of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae from an artificial potting medium. Florida Entomologist. , 285-292 (1986).
- Meyling, N. V. Methods for isolation of entomopathogenic fungi from the soil environment. University of Copenhagen. , 1-18 (2007).
- Zimmermann, G. The 'Galleria bait method'for detection of entomopathogenic fungi in soil. Journal of applied Entomology. 102 (1-5), 213-215 (1986).
- Schneider, S., Widmer, F., Jacot, K., Kölliker, R., Enkerli, J. Spatial distribution of Metarhizium clade 1 in agricultural landscapes with arable land and different semi-natural habitats. Applied Soil Ecology. 52, 20-28 (2012).
- Hallouti, A., et al. Diversity of entomopathogenic fungi associated with Mediterranean fruit fly (Ceratitis capitata (Diptera: Tephritidae)) in Moroccan Argan forests and nearby area: impact of soil factors on their distribution. BMC Ecology. 20 (1), 1-13 (2020).
- Meyling, N. V., Eilenberg, J. Occurrence and distribution of soil borne entomopathogenic fungi within a single organic agroecosystem. Agriculture, Ecosystems and Environment. 113 (1-4), 336-341 (2006).
- Skalický, A., Bohatá, A., Šimková, J., Osborne, L. S., Landa, Z. Selection of indigenous isolates of entomopathogenic soil fungus Metarhizium anisopliae under laboratory conditions. Folia Microbiologica. 59 (4), 269-276 (2014).
- Veen, K., Ferron, P. A selective medium for the isolation of Beauveria tenella and of Metarrhizium anisopliae. Journal of Invertebrate Pathology. 8 (2), 268-269 (1966).
- Goettel, M., Inglis, D., Lacy, L. . Manual of Techniques in Insect Pathology. , 213-249 (1997).
- Luz, C., Netto, M. C. B., Rocha, L. F. N. In vitro susceptibility to fungicides by invertebrate-pathogenic and saprobic fungi. Mycopathologia. 164 (1), 39-47 (2007).
- Mantzoukas, S., et al. Trapping entomopathogenic fungi from vine terroir soil samples with insect baits for controlling serious pests. Applied Sciences. 10 (10), 3539 (2020).
- Goble, T., Dames, J., Hill, M., Moore, S. The effects of farming system, habitat type and bait type on the isolation of entomopathogenic fungi from citrus soils in the Eastern Cape Province, South Africa. BioControl. 55 (3), 399-412 (2010).
- Nishi, O., Iiyama, K., Yasunaga-Aoki, C., Shimizu, S. Isolation of entomopathogenic fungi from soil by using bait method with termite, Reticulitermes speratus. Enotomotech. 35, 21-26 (2011).
- Castrillo, L. . ARS Collection of Entomopathogenic Fungal Cultures (ARSEF). , (2014).
- Kim, J. C., et al. Tenebrio molitor-mediated entomopathogenic fungal library construction for pest management. Journal of Asia-Pacific Entomology. 21 (1), 196-204 (2018).
- Keyser, C. A., Henrik, H., Steinwender, B. M., Meyling, N. V. Diversity within the entomopathogenic fungal species Metarhizium flavoviride associated with agricultural crops in Denmark. BMC Microbiology. 15 (1), 1-11 (2015).
- Quesada-Moraga, E., Navas-Cortés, J. A., Maranhao, E. A., Ortiz-Urquiza, A., Santiago-Álvarez, C. Factors affecting the occurrence and distribution of entomopathogenic fungi in natural and cultivated soils. Mycological Research. 111 (8), 947-966 (2007).
- Park, J. B., et al. Developmental characteristics of Tenebrio molitor larvae (Coleoptera: Tenebrionidae) in different instars. International Journal of Industrial Entomology. 28 (1), 5-9 (2014).
- Chang, J. -. C., et al. Construction and selection of an entomopathogenic fungal library from soil samples for controlling Spodoptera litura. Frontiers in Sustainable Food Systems. 5, 15 (2021).
- Podder, D., Ghosh, S. K. A new application of Trichoderma asperellum as an anopheline larvicide for eco friendly management in medical science. Scientific reports. 9 (1), 1-15 (2019).
- . Geneaid Biotech Ltd. Presto Mini gDNA Yeast, Ver. 04.27.17 Available from: https://www.geneaid.com/data/files/1605664221308055331.pdf (2021)
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR protocols: A guide to methods and applications. 18 (1), 315-322 (1990).
- Kepler, R. M., Humber, R. A., Bischoff, J. F., Rehner, S. A. Clarification of generic and species boundaries for Metarhizium and related fungi through multigene phylogenetics. Mycologia. 106 (4), 811-829 (2014).
- Kepler, R. M. A phylogenetically-based nomenclature for Cordycipitaceae (Hypocreales). IMA Fungus. 8 (2), 335-353 (2017).
- Thompson, J. D., Gibson, T. J., Plewniak, F., Jeanmougin, F., Higgins, D. G. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research. 25 (24), 4876-4882 (1997).
- Kumar, S., Stecher, G., Tamura, K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution. 33 (7), 1870-1874 (2016).
- Herlinda, S., Mulyati, S. I. Selection of isolates of entomopathogenic fungi and the bioefficacy of their liquid production against Leptocorisa oratorius nymphs. Microbiology Indonesia. 2 (3), 9 (2008).
- Herlinda, S., Irsan, C., Mayasari, R., Septariani, S. Identification and selection of entomopathogenic fungi as biocontrol agents for Aphis gossypii from South Sumatra. Microbiology Indonesia. 4 (3), 137-142 (2010).
- Montes-Bazurto, L. G., Peteche-Yonda, Y., Medina-Cardenas, H. C., Bustillo-Pardey, A. E. Selection of entomopathogenic fungi for the biological control of Demotispa neivai (Coleoptera: Chrysomelidae) in oil palm plantations in Colombia. Journal of Entomological Science. 55 (3), 388-404 (2020).
- Shin, T. -. Y., Choi, J. -. B., Bae, S. -. M., Koo, H. -. N., Woo, S. -. D. Study on selective media for isolation of entomopathogenic fungi. International Journal of Industrial Entomology. 20 (1), 7-12 (2010).
- Sharma, L., Oliveira, I., Torres, L., Marques, G. Entomopathogenic fungi in Portuguese vineyards soils: Suggesting a 'Galleria-Tenebrio-bait method'as bait-insects Galleria and Tenebrio significantly underestimate the respective recoveries of Metarhizium (robertsii) and Beauveria (bassiana). MycoKeys. (38), 1 (2018).
- Rodríguez, M., Gerding, M., France, A. Selección de Hongos Entomopatógenos para el Control de Varroa destructor (Acari: Varroidae). Chilean journal of agricultural research. 69 (4), 534-540 (2009).
- Yang, H., et al. Persistence of Metarhizium (Hypocreales: Clavicipitaceae) and Beauveria bassiana (Hypocreales: Clavicipitaceae) in tobacco soils and potential as biocontrol agents of Spodoptera litura (Lepidoptera: Noctuidae). Environmental entomology. 48 (1), 147-155 (2019).
- Muñiz-Reyes, E., Guzmán-Franco, A. W., Sánchez-Escudero, J., Nieto-Angel, R. Occurrence of entomopathogenic fungi in tejocote (C rataegus mexicana) orchard soils and their pathogenicity against R hagoletis pomonella. Journal of Applied Microbiology. 117 (5), 1450-1462 (2014).
- Lacey, L. A., et al. Goettel Insect pathogens as biological control agents: Back to the future. Journal of Invertebrate Pathology. 132, 1-41 (2015).
- Humber, R. A. . Manual of techniques in insect pathology. , 153-185 (1997).
- Rehner, S. A., Buckley, E. A Beauveria phylogeny inferred from nuclear ITS and EF1-α sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia. 97 (1), 84-98 (2005).
- Quandt, C. A., et al. Phylogenetic-based nomenclatural proposals for Ophiocordycipitaceae (Hypocreales) with new combinations in Tolypocladium. IMA fungus. 5 (1), 121-134 (2014).
- Shah, F. A., Wang, C. S., Butt, T. M. Nutrition influences growth and virulence of the insect-pathogenic fungus Metarhizium anisopliae. FEMS Microbiology Letters. 251 (2), 259-266 (2005).
- Ignoffo, C. Environmental factors affecting persistence of entomopathogens. Florida Entomologist. , 516-525 (1992).
- Rodrigues, I. W., Forim, M., Da Silva, M., Fernandes, J., Batista Filho, A. Effect of ultraviolet radiation on fungi Beauveria bassiana and Metarhizium anisopliae, pure and encapsulated, and bio-insecticide action on Diatraea saccharalis. Advances in Entomology. 4 (3), 151-162 (2016).
- Paula, A. R., Ribeiro, A., Lemos, F. J. A., Silva, C. P., Samuels, R. I. Neem oil increases the persistence of the entomopathogenic fungus Metarhizium anisopliae for the control of Aedes aegypti (Diptera: Culicidae) larvae. Parasites and Vectors. 12 (1), 1-9 (2019).
- Morley-Davies, J., Moore, D., Prior, C. Screening of Metarhizium and Beauveria spp. conidia with exposure to simulated sunlight and a range of temperatures. Mycological Research. 100 (1), 31-38 (1996).
- Rangel, D. E., Braga, G. U., Flint, S. D., Anderson, A. J., Roberts, D. W. Variations in UV-B tolerance and germination speed of Metarhizium anisopliae conidia produced on insects and artificial substrates. Journal of Invertebrate Pathology. 87 (2-3), 77-83 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved