Method Article
إعداد العينة بواسطة طحن شعاع الأيونات المركز 3D للتصوير المقطعي عالي الدقة للإلكترون بالتبريد
In This Article
Summary
هنا ، نقدم خط أنابيب لطحن شعاع الأيونات المركز 3D على توجيه إعداد العينات الخلوية للتصوير المقطعي الإلكتروني بالتبريد. يتم تحديد موقع 3D للبروتينات الموسومة بالفلورسنت ذات الأهمية أولا بواسطة الفحص المجهري الفلوري بالتبريد ، ثم يتم استهدافه للطحن. البروتوكول مناسب للثدييات والخميرة والخلايا البكتيرية.
Abstract
أصبح التصوير المقطعي الإلكتروني بالتبريد (cryo-ET) الطريقة المفضلة للتحقيق في البنية الخلوية والمجمعات الجزيئية في حالتها الأصلية المجمدة المائية. ومع ذلك ، يتطلب cryo-ET أن تكون العينات رقيقة بما يكفي لعدم تشتيت أو منع حزمة الإلكترون الساقط. بالنسبة للعينات الخلوية السميكة ، يمكن تحقيق ذلك عن طريق طحن الحزمة الأيونية المركزة بالتبريد (FIB). يصف هذا البروتوكول كيفية استهداف مواقع خلوية محددة أثناء طحن FIB باستخدام نهج 3D المترابط ، والذي يجمع بين بيانات الفحص المجهري الفلوري ثلاثي الأبعاد مع معلومات من المجهر الإلكتروني الماسح FIB. باستخدام هذه التقنية ، يمكن استهداف الأحداث والهياكل الخلوية النادرة بدقة عالية وتصورها بدقة جزيئية باستخدام المجهر الإلكتروني بالتبريد (cryo-TEM).
Introduction
يسمح طحن الحزمة الأيونية المركزة بإعداد عينات بيولوجية رقيقة من العينات الثابتة بالتبريد دون المشاكل المرتبطة عادة بالمقاطع الميكانيكية مثل علامات السكين والتحف الانضغاطية1. عند إقرانه بالتصوير المقطعي الإلكتروني بالتبريد ، يتيح طحن FIB دراسات بيولوجية عالية الدقة للتشكل الخلوي وتحديد بنية المعقدات الجزيئية مباشرة من داخل الخلايا بدقة دون نانومتر2،3،4. في حين أن الأنواع الوفيرة ، مثل الريبوسومات ، توجد بسهولة في صفائح FIB المقطوعة بشكل عشوائي ، فإن العديد من العمليات الخلوية تعتمد على التمركز المشترك للعديد من المجمعات أو يتم توطينها في مواقع محددة داخل الخلية. وبالتالي ، فإن الاستهداف الفعال مطلوب حتى لا تفقد الميزة البيولوجية ذات الأهمية أثناء عملية الطحن وتقتصر على الضربات العشوائية. لذلك من الضروري اتباع نهج مترابط يجمع بين البيانات من المجهر الإلكتروني الماسح (SEM) -FIB ومجهر الضوء الفلوري بالتبريد (FLM). في حين أنه من الممكن حذف الارتباط الأولي والجمع بين بيانات FLM و cryo-ET فقط بعد الحصول على TEM 5,6 ، فإن طحن الحزمة الأيونية المركزة الموجهة بالفلورة يتيح اختيارا دقيقا لمنطقة الطحن مسبقا ، مما يؤدي إلى الحصول على بيانات أكثر كفاءة. منذ تصورها7 ، كان تطبيق طحن FIB المرتبط ب 3D في الدراسات البيولوجية محدودا حتى أبلغنا مؤخرا عن تحديد حجرة جديدة مفصولة عن الطور السائل السائل (LLPS) في الخميرة باستخدام هذه التقنية8.
الموصوف هنا هو بروتوكول مجهر ضوئي وإلكتروني معمم مرتبط بالتبريد 3D (CLEM) ، والذي يمكن استخدامه لدراسة مجموعة واسعة من العينات التي تتراوح من البكتيريا إلى خلايا الخميرة والثدييات. بينما تم إجراء التجارب باستخدام مجموعة معينة من الأدوات ، فإن الخطوات الفردية ليست مرتبطة بأجهزة معينة ويمكن نقلها بسهولة إلى أنظمة أخرى كامتداد للبروتوكولات الحالية 3,5. يتم توفير قائمة بالمعدات المختبرة والإعدادات المقترحة في جدول المواد والجدول 1. الخطوات الأربع الرئيسية لخط الأنابيب هي (1) تحضير العينة ، (2) توطين الميزات ذات الأهمية بواسطة الفحص المجهري الفلوري بالتبريد ، (3) طحن الحزمة الأيونية المركزة المرتبطة ب 3D ، و (4) توطين الهياكل المستهدفة للحصول على بيانات cryo-ET على الصفائح في المجهر الإلكتروني للإرسال بالتبريد (الشكل 1).
Protocol
الشكل 1: ملخص سير العمل مع مجموعة مختارة من الخطوات الهامة. ينقسم البروتوكول بأكمله إلى أربع مراحل وفقا للمعدات المستخدمة: تحضير العينات ، بما في ذلك تجميد الغطس ، والفحص المجهري الفلوري بالتبريد ، وطحن الحزمة الأيونية المركزة بالتبريد ، والمجهر الإلكتروني بالتبريد. لكل خطوة ، يتم تسليط الضوء على العديد من النقاط الرئيسية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. زراعة الخلايا وتجميد يغرق الشبكات
- استزراع الخلايا المفضلة وتحسين استراتيجيات وضع العلامات والعلاج في درجة حرارة الغرفة قبل الانتقال إلى التجارب بالتبريد. يتم تصنيف الأهداف المثيرة للاهتمام إما باستخدام اندماج البروتين الفلوري أو التلوين الحي (على سبيل المثال ، Halo-Tag ، LysoTracker ، BODIPY ، تلطيخ الأجسام المضادة الحية ، إلخ). إذا كانت هناك حاجة إلى العلاج بالعوامل الكيميائية أو البيولوجية (جزيئات صغيرة ، وسائط خاصة ، siRNA ، إلخ) للتحقيق في العملية البيولوجية ذات الأهمية ، قم بتحسين الظروف (على سبيل المثال ، الوقت ، التركيز) باستخدام تصوير FLM للخلايا الحية.
- تأكد من إمكانية تحديد موقع المواقع ذات الأهمية بنجاح فوق الخلفية في عدد كاف من الخلايا باستخدام إعدادات التصوير التي تتطابق مع ظروف التبريد اللاحقة قدر الإمكان (أي NA ، وقت التعرض ، إلخ).
- اختيار وإعداد الشبكات
- حدد الشبكات ذات حجم الثقب والتباعد المناسب للخلايا والعلامات الائتمانية المستخدمة (انظر الخطوة 1.3.1). لا تستخدم طبقة مستمرة بدون ثقوب لأن هذا قد يؤدي إلى الكثير من المخزن المؤقت المتبقي بعد النشاف وبالتالي يقلل من كفاءة التزجيج ويعيق اكتشاف الخرز الائتماني. للاتصال المطول للخلايا بالشبكات ، تأكد من أن دعم الشبكة ومواد الفيلم متوافقة حيويا.
- قم بتنظيف شبكات cryo-EM بالبلازما لجعلها أكثر محبة للماء. للاستخدام في زراعة الخلايا الملتصقة ، قم بتعقيم الشبكات بعد تنظيف البلازما بالأشعة فوق البنفسجية لمدة 20 دقيقة في غطاء التدفق الصفحي. اختياريا ، يمكن معالجة الشبكات مسبقا بمركبات تساعد في التصاق الخلايا ، مثل poly-L-lysine أو concanavalin A ، كما هو موضح أدناه.
ملاحظة: بشكل عام ، تم استخدام مجموعات الشبكة / العينات التالية بنجاح في سير عمل cryo-FIB المترابط: الخميرة: Cu أو Au ، 200 شبكة ، R1 / 4 كربون أو فيلم SiO2 ، مطلي اختياريا بكونكانافالين أ ؛ الإشريكية القولونية: النحاس أو الاتحاد الأفريقي ، 200 شبكة ، R1 / 4 الكربون أو فيلم SiO2 ؛ Chlamydomonas reinhardtii: Cu أو Au ، 200 شبكة ، R1 / 2 أو R1 / 4 كربون أو فيلم SiO2 ؛ HeLa: Au ، 200 شبكة ، فيلم R1 / 4 SiO2 ، مطلي بولي-L-ليسين ؛ HEK293: Au ، 200 شبكة ، فيلم R1 / 4 SiO2 ، مطلي بولي-L-lysine. - طلاء كونكانافالين أ لتحسين ارتباط خلايا الخميرة:
- قم بإعداد محلول طلاء 1 مجم / مل من كونكانافالين أ في محلول HEPES 10 مللي متر مع 100 ميكرومتر CaCl2 ، درجة الحموضة 8.5. ضع قطرة واحدة (50 ميكرولتر) من محلول الطلاء وقطرتين من الماء المقطر بشكل منفصل على قطعة من فيلم البارافين.
- التقط الشبكة التي تم تنظيفها بالبلازما باستخدام ملاقط ذات قوة عكسية وأدخلها بعناية في قطرة محلول الطلاء ، وتجنب الحركات المتعامدة مع الشبكة لمنع تلف الفيلم.
- بعد ~ 5 ثانية الحضانة ، اغسل الشبكة مرتين عن طريق إدخالها في قطرات الماء بطريقة مماثلة. أخيرا ، امسح السائل الزائد عن طريق وضع ورقة ترشيح على الجزء الخلفي من الشبكة واترك الشبكة تجف تماما قبل إطلاقها من الملقط. استخدم الشبكات المجففة لتجميد الغطس.
- طلاء بولي-L-يسين لثقافة التعليق والخلايا الملتصقة:
- تحضير محلول طلاء من 1 ملغ / مل من بولي-L-يسين في 0.1 M بورات الصوديوم العازلة ، درجة الحموضة 8.5.
- ضع الشبكات التي يتم تنظيفها بالبلازما في طبق مناسب لزراعة الخلايا وقم بتعقيمها لمدة 20 دقيقة بواسطة الأشعة فوق البنفسجية.
- أضف برفق ما يكفي من محلول الطلاء لتغطية جميع الشبكات واحتضانها عند 37 درجة مئوية لمدة 2 ساعة على الأقل. نضح السائل وغسل الشبكات بلطف مرتين مع برنامج تلفزيوني قبل بذر الخلايا إلى التركيز المطلوب.
- تحضير الخلايا والخرز الائتماني
ملاحظة: مطلوب حبات إيمانية لتسجيل 3D للبيانات الفلورية مع الصور التي تم التقاطها في مجهر FIB / SEM للسماح بطحن FIB 3D.- اختر الخرزات التي يمكن التعرف عليها في جميع طرق التصوير ، مثل FLM و SEM و IB (القطر الموصى به 0.5-1 ميكرومتر) ، ولكن تأكد من أنها لا تتفوق على بنية الهدف الخلوي أثناء التصوير الفلوري لتسهيل التمييز بين الخرز والميزة البيولوجية ذات الأهمية. قم بإزالة المواد الحافظة السامة للخلايا في الخرز الائتماني (على سبيل المثال ، NaN3) وفقا لتعليمات الشركة المصنعة.
ملاحظة: لتسهيل التمييز بين السمات البيولوجية ذات الأهمية و fiducials ، من المفيد أن تتداخل أطياف الانبعاث الفلوري جزئيا فقط بحيث يمكن تمييز الإشارات بناء على اختلافات الشدة في قنوات FLM. - إذا تم استخدام ثقافة التعليق ، قم بتنمية الخلايا إلى كثافة مناسبة (على سبيل المثال ، الخميرة OD 600 = 0.8 ، E. coli OD 600 = 0.8-1.0 ، C. reinhardtii 1500 خلية / ميكرولتر) وإجراء العلاجات كما هو مطلوب للتجربة مثل تغيير الوسط ، وإضافة المواد الكيميائية ، والمجاعة ، وما إلى ذلك. قم بتوصيل الشبكات التي تم تنظيفها بالبلازما بالملاقط كما هو مطلوب لطريقة الغطس (يدوي / أوتوماتيكي) ، وقم بتطبيق 4 ميكرولتر من تعليق الخلية الممزوج ب ~ 1 × 105 حبات / ميكرولتر من تعليق الخرزة الائتمانية على جانب الفيلم من الشبكات.
ملاحظة: حدد التخفيف الأمثل للخلايا والعناصر الائتمانية في تجارب المعايرة بالتحليل الحجمي (على سبيل المثال، عن طريق التحقق من cryo-FLM أو FIB/SEM، انظر أدناه). ومع ذلك ، بالنسبة لمعظم الخلايا المزروعة في التعليق ، أثبت التركيز النهائي ~ 1 × 105 حبات / ميكرولتر من حبات 1 ميكرومتر (تخفيف 1:20 من المخزون ؛ انظر جدول المواد للحصول على التفاصيل) نقطة انطلاق جيدة. - إذا تم استخدام ثقافة ملتصقة ، فقم بتنظيف الشبكات وتعقيمها باستخدام الأشعة فوق البنفسجية للثقافة المعقمة. إذا لزم الأمر ، قم بطلاء الشبكات مسبقا بمركبات تساعد على التصاق الخلايا (على سبيل المثال ، بولي ل-ليسين ، فيبرونيكتين ، لامينين ؛ انظر الخطوة 1.2.2). البذور وتنمو الخلايا على الشبكات في أطباق الثقافة العادية أو الأطباق ذات التقسيمات الفرعية للشبكات.
- تعامل مع العينات حسب الضرورة للتجربة وحافظ على الخلايا في الظروف المثلى حتى يغرق التجمد (على سبيل المثال ، 37 درجة مئوية / 5٪ CO2 ل HEK / HeLa). قم بإزالة الشبكات بعناية من طبق الثقافة وإرفاقها بملاقط الغطس. ضع 4 ميكرولتر من وسط الاستزراع الممزوج ب fiducials (1 × 105 حبات / ميكرولتر ل 1 ميكرومتر fiducials) على الجانب الحامل للخلية.
- اختر الخرزات التي يمكن التعرف عليها في جميع طرق التصوير ، مثل FLM و SEM و IB (القطر الموصى به 0.5-1 ميكرومتر) ، ولكن تأكد من أنها لا تتفوق على بنية الهدف الخلوي أثناء التصوير الفلوري لتسهيل التمييز بين الخرز والميزة البيولوجية ذات الأهمية. قم بإزالة المواد الحافظة السامة للخلايا في الخرز الائتماني (على سبيل المثال ، NaN3) وفقا لتعليمات الشركة المصنعة.
- قم بتجميد الخلايا باستخدام إجراء تجميد يدوي أو آلي. إذا أمكن ، قم فقط بمسح الشبكة من الجانب المقابل للخلايا لمنع إتلاف الخلايا ميكانيكيا (الشكل 2 أ). في أنظمة الغطس الآلية ثنائية الذراع ، حقق ذلك عن طريق وضع ورقة Polytetrafluoroethylene (على سبيل المثال ، تفلون) بدلا من نشاف الورق على الوسادة المواجهة للخلايا. انقل الشبكات إلى صناديق التخزين واحتفظ بها في النيتروجين السائل (lN2) حتى الاستخدام.
تنبيه: يمكن أن يسبب lN2 والمبردات الأخرى أضرارا جسيمة للعينين والجلد. استخدم معدات الحماية الشخصية (PPE) واعمل فقط في مكان جيد التهوية لتجنب تراكم تركيزات N2 الخطرة.
ملاحظة: يجب تنفيذ جميع الخطوات اللاحقة على أفضل وجه في المرحلة السائلة من lN2 لتجنب تلوث الخلية وأسطح الصفيحة ، لأن هذا قد يعقد المعالجة النهائية. قلل من ملامسة بلورات الثلج العائمة باستخدام النيتروجين السائل النظيف دائما (على سبيل المثال ، مرشح لإزالة الجليد العائم) ، والقضاء على خطوات النقل غير الضرورية ، وإذا أمكن ، العمل في بيئة يتم التحكم فيها بالرطوبة. - قم بتركيب وقص الشبكات المجمدة في AutoGrids مع انقطاع والخلايا المتجهة لأعلى (الشكل 2A) للتصوير الفلوري بالتبريد اللاحق وطحن FIB. لضمان المحاذاة الصحيحة للعينات في TEM ، يجب أن يكون اتجاه الطحن متعامدا مع محور إمالة cryo-ET. وفقا لذلك ، ضع علامات الاتجاه (على سبيل المثال ، النقش بالليزر أو نقاط العلامة القابلة للإزالة) على AutoGrids قبل القص للمساعدة في هذه المحاذاة (الشكل 2A).
- قم بفحص جودة الشبكة (الشكل 2B) على cryo-FLM و FIB / SEM. قم بتحسين كثافة الخلية ووقت النشاف والقوة للحصول على توزيع متساو للخلايا والخرز. استخدم التصوير بالضوء المنعكس على مجهر مضان بالتبريد أو استخدم cryo-FIB-SEM للتأكد من أن كل من الخلايا والخرز الائتماني مرئيان بوضوح (الشكل 2B ، الأسهم البيضاء).
- إذا لزم الأمر ، كرر الغطس في ظروف أفضل ، على سبيل المثال ، اختلاف تركيز الخلايا و / أو وقت النشاف. بمجرد العثور على معلمات الغطس المناسبة ، لا تكرر فحص الشبكة لكل جولة جديدة من التجارب.

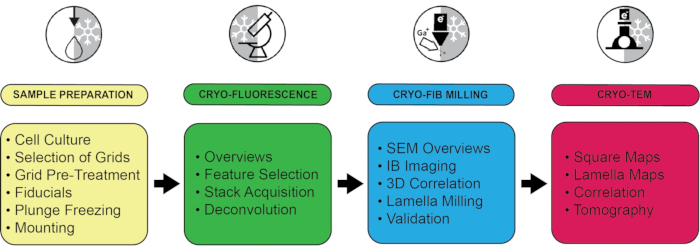
الشكل 2: فحص الشبكات المناسبة باستخدام SEM و IB . (أ) يجب وضع علامات التوجيه على AutoGrids عموديا على اتجاه الطحن لتبسيط التحميل الصحيح في TEM. يتم تثبيت الخلايا متجهة لأعلى في AutoGrid المجمعة. (ب) بعد تجميد الغطس ، يتم فحص الشبكات في SEM لتقييم وتحسين ظروف الغرق: أ) يجب ألا يكون هناك الكثير من الخلايا لكل شبكة. بالنسبة لخلايا HeLa ، على سبيل المثال ، لا تستخدم أكثر من 1-4 خلايا / مربع. بالنسبة للخلايا الأصغر مثل Saccharomyces cerevisiae (كما هو موضح هنا) ، تم العثور على كتل من 4-6 خلايا مفيدة. ب) يجب أن تكون الخرزات الإيمانية (الأسهم البيضاء) مرئية بوضوح ، ويجب ألا يكون هناك الكثير من المخزن المؤقت المحيط بالخلايا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. المجهر الضوئي الفلوري بالتبريد
- لكل شبكة ، احصل على نظرة عامة في التألق (واسع المجال) وتباين التداخل التفاضلي (DIC) أو الوضع المنعكس وحدد مربعات الشبكة المناسبة مع إشارة مضان. اختر حقول العرض التي تحتوي على كل من خلايا الاهتمام وعدد كاف من العلامات الائتمانية (6-12).
- تأكد من أن الخلايا والخرز موزعة بالتساوي ، وليست كثيفة للغاية ، ونحو مركز كل مربع. اختر فقط المربعات التي يمكن الوصول إليها بواسطة كل من أداة FIB-SEM و TEM ، وبالتالي تلك المربعات الثلاثة على الأقل بعيدا عن حافة الشبكة على 200 شبكة شبكية (الشكل 3A ، داخل الدائرة الحمراء).
- في كل مربع من مربعات الشبكة المحددة ، احصل على مكدس فلوري بخطوة تركيز مناسبة لفك الالتفاف لاحقا ، أي <1/2 حد الدقة المحورية. إذا أمكن ، استخدم أهداف الفتحة العددية العالية (NA) لزيادة عدد الفوتونات ودقة التوطين.
- في مجهر متحد البؤر مع هدف NA 0.9 ، احصل على مداخن بحجم خطوة 300 نانومتر ، مع الإفراط في أخذ العينات من قيمة Nyquist. سجل مكدسات ألوان متعددة إذا لزم الأمر (الشكل 2 ب). تخزين الشبكات تحت lN2 حتى استخدام آخر.
ملاحظة: لتحديد حجم الخطوة الأمثل ، اختر القيم المحسوبة بواسطة برنامج التحكم المجهري أو استخدم الأدوات عبر الإنترنت9. تحقق من وجود تسييل للإشارة بين القنوات لأن التسييل المفرط يضر بتجارب التوطين. ومع ذلك ، قد يكون بعضها مفيدا لتصحيح الانحرافات اللونية في مكدسات متعددة الألوان.
- في مجهر متحد البؤر مع هدف NA 0.9 ، احصل على مداخن بحجم خطوة 300 نانومتر ، مع الإفراط في أخذ العينات من قيمة Nyquist. سجل مكدسات ألوان متعددة إذا لزم الأمر (الشكل 2 ب). تخزين الشبكات تحت lN2 حتى استخدام آخر.
- قم بفك مكدسات التجميع باستخدام البرنامج المناسب10,11 وأعد تقطيع7 منها إذا كان حجم البكسل الخواص مطلوبا. يؤدي إزالة الالتفاف - تماما كما هو الحال في درجة حرارة الغرفة - إلى تنظيف إشارة FLM وقد يحسن دقة التوطين (الشكل 3C).

الشكل 3: اختيار المربعات لاكتساب مكدس FLM وتحسين البيانات عن طريق إزالة الالتفاف. (أ) نظرة عامة على شبكة غارقة في خلايا الخميرة التي تعبر عن eGFP-Ede1 (أخضر) و mCherry-Atg8 (أرجواني). اختر المواضع ذات التوزيع الجيد للخرز والخلايا ، ولكن تجنب حواف الشبكة (مظللة باللون الأحمر). تشير المربعات إلى المواضع ذات التوزيعات الجيدة للخلايا حيث تم أخذ مداخن مضانة. (B) إسقاط الكثافة القصوى (MIP) للمكدس متعدد الألوان المأخوذ على المربع الأصفر (من A) بعد الالتفاف. يؤدي فك الالتفاف في مكدسات FLM إلى تنظيف إشارات الخلفية غير المرغوب فيها بشكل كبير ويساعد على تحديد موقع الخرز في z بشكل أكثر دقة ، كما يتضح من نوبات Gaussian قبل (C) وبعد الالتفاف (D) (تم إجراء النوبات في 3DCT ويتم عرضها للخرزة المميزة ب 1). تظهر الصور مناظر MIP مكبرة للقناة الحمراء (الإثارة: 552 نانومتر ، الانبعاث: 585-650 نانومتر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. طحن شعاع أيوني مركز
- قم بتحميل الشبكات في أداة cryo-FIB-SEM واستخدم إما علامات القطع و / أو التوجيه لضمان التوجيه المناسب لوضعها لاحقا في TEM (الشكل 2A). تأكد من أن اتجاه الطحن عمودي على محور إمالة TEM.
- استخدام نظام حقن الغاز (GIS; CpMePtMe3) في مواضع المرحلة المحددة مسبقا بواسطة إعداد FIB-SEM لطلاء الشبكات بطبقة عضوية معدنية واقية. لا تضع الكثير ، لأن هذا قد يتداخل مع توطين حبة إيمانية في TEM لاحقا. استخدم طبقة بلازما لتطبيق البلاتين المعدني لتقليل شحن العينة.
ملاحظة: في حالة عدم توفر إعدادات لطلاء نظم المعلومات الجغرافية ، يمكن العثور عليها بسهولة عن طريق إجراء جولات متتالية من الطلاء القصير (~ 2 ثانية) ، متبوعة بطحن FIB. تأكد من أنه لا يزال من الممكن قطع العينة بنجاح عند التيارات المتوسطة (~ 100 pA) دون تهديب واضح للطبقة المعدنية العضوية الواقية حول حواف الصفيحة. يعد كل من وقت ومسافة إبرة نظم المعلومات الجغرافية (فيما يتعلق بالعينة) معلمات مهمة يجب مراعاتها. لا تقم بتشغيل إبرة GIS في إعدادات درجة حرارة الغرفة (أي 45 درجة مئوية) ، ولكن باردة قدر الإمكان لتوفير طلاء متساو (25-27 درجة مئوية). - تسجيل نظرة عامة على شبكة SEM وإجراء ارتباط 2D مع لمحات عامة FLM للعثور على مربعات الشبكة التي تم تسجيل مكدسات الفلورسنت لها. افحص كلا العرضين يدويا أو استخدم حزم برامج مختلفة7،10،12 للعثور على مربعات الشبكة. هنا ، ينصب التركيز على صندوق أدوات الارتباط ثلاثي الأبعاد (3DCT) 7 ، والذي يستخدم تحويل الجسم الصلب ثلاثي الأبعاد مع التحجيم الخواص بين طرق العرض. تتوفر جولة ممتازة حول وظائف 3DCTs عبر الإنترنت13.
- حدد وضع علامة على أربعة مواضع مقابلة على الأقل ، على سبيل المثال ، معالم مثل أشرطة الشبكة أو الثقوب في فيلم الدعم ، في كل من نظرة عامة على شبكة FLM و SEM (انقر بزر الماوس الأيمن) واحسب التحويل بين النقاط المحددة (ارتباط).
- بعد ذلك ، ضع العلامات في وسط مربعات الشبكة المقابلة التي تم الحصول على مكدسات FLM من أجلها وتوقع موضعها في عرض SEM (correlate; الشكل 4 أ).
- لكل مربع شبكي مرتبط ، التقط صورة شعاع أيوني منخفض التيار (≤10 pA) (IB) بزاوية طحن FIB المختارة (10 ° -25 ° لمكوك ما قبل الإمالة 45 درجة). حدد مجال عرض (أي الموضع والتكبير) يطابق بيانات التألق. بالنسبة ل 200 شبكة شبكية ، احصل على بيانات مضان و FIB / SEM لاحتواء مربعات شبكة واحدة ، بما في ذلك أشرطة الشبكة (انظر الشكل 3A والشكل 4A).
ملاحظة: يجب إجراء الطحن بزاوية ضحلة قدر الإمكان لتجنب فقدان النطاق الزاوي الكبير أثناء cryo-ET وللسماح بتحديد عدد كاف من الخرز الائتماني. على سبيل المثال: مع إمالة المرحلة بمقدار 17 درجة ، والإمالة المسبقة للمكوك بمقدار 45 درجة ، وإمالة شعاع FIB بمقدار 52 درجة بالنسبة إلى الهبوط ، يكون الإمالة المسبقة للصفائح 10 درجات ، والتي تلبي تقريبا النطاق الزاوي المفضل البالغ ±60 درجة في TEM عن طريق الإمالة من -50 درجة إلى +70 درجة ، وهو الحد الأقصى للعديد من حوامل التبريد TEM. - التقط صورة SEM لنفس المربع للمساعدة في تحديد الخرزات المقابلة في عرض التألق والحزمة الأيونية.
- قم بإجراء تسجيل مكدس FLM ثلاثي الأبعاد غير الملتوي وعرض شعاع الأيونات 2D لكل موضع باستخدام 3DCT كما هو موضح في الخطوات التالية (الشكل 4B).
- قم بتحميل عرض مكدس FLM ثلاثي الأبعاد المطابق وعرض الحزمة الأيونية (IB) في 3DCT.
ملاحظة: يمكن تحميل بيانات التألق متعددة الألوان كما يصل إلى ثلاثة ملفات مكدس منفصلة أحادية القناة. - حدد 4 حبات إيمانية في بيانات التألق وانقر بزر الماوس الأيمن على قائمة المواضع لتحديد موقعها ثلاثي الأبعاد عبر التركيب الغاوسي للإشارة في x و y و z. حدد الخرزات المقابلة في صورة IB وقم بإجراء ارتباط 3D أولي (ارتباط).
- قم بإضافة المزيد من الخرز بشكل متكرر في الصورة الفلورية ، وتحسين موضع 3D الخاص بهم ، وتوقع موقعهم في عرض IB لإضافة المزيد من الخرز بسرعة إلى التسجيل والتحقق من دقة الارتباط. في 3DCT ، يتم توفير قيم جذر متوسط مربع الخطأ (RMSE) لتقييم اتساق الارتباط7.
- تأكد من أن قيم RMSE صغيرة وبترتيب دقة الترجمة (~ 300 نانومتر). لتحديد دقة الارتباط ، اترك بعض الخرزات الإيمانية التي يمكن التعرف عليها بوضوح في كل من التألق والشعاع الأيوني عمدا أثناء خطوة التسجيل. قم بذلك عن طريق التحقق من موقعهم المتوقع مقابل الموقع الفعلي في صورة الحزمة الأيونية. إذا كان الموقف المتوقع يختلف اختلافا كبيرا عن الحقيقي ، كرر الارتباط الأولي مع مجموعة جديدة من fiducials.
ملاحظة: ثبت أن ربط 6-8 حبات كاف للتسجيل الدقيق لمكدسات FLM وطرق عرض IB. ومع ذلك ، فإن إضافة المزيد من fiducials (حتى 12-15) على نطاق واسع من قيم z (على سبيل المثال ، عن طريق اختيار الخرز على شريط الشبكة أو في المربعات المجاورة) قد يحسن دقة الارتباط.
- تأكد من أن قيم RMSE صغيرة وبترتيب دقة الترجمة (~ 300 نانومتر). لتحديد دقة الارتباط ، اترك بعض الخرزات الإيمانية التي يمكن التعرف عليها بوضوح في كل من التألق والشعاع الأيوني عمدا أثناء خطوة التسجيل. قم بذلك عن طريق التحقق من موقعهم المتوقع مقابل الموقع الفعلي في صورة الحزمة الأيونية. إذا كان الموقف المتوقع يختلف اختلافا كبيرا عن الحقيقي ، كرر الارتباط الأولي مع مجموعة جديدة من fiducials.
- حدد الإشارات الخلوية المستهدفة ، وقم بتناسب مع موقعها ثلاثي الأبعاد في مكدس FLM وقم بتطبيق التحويل للتنبؤ بالمواضع المستهدفة في عرض IB (الشكل 4B).
ملاحظة: سيتم التعامل مع أي إدخال في قائمة مواقع FLM ، والذي ليس له نظير في قائمة IB ، على أنه إشارة يجب التنبؤ بها.
- قم بتحميل عرض مكدس FLM ثلاثي الأبعاد المطابق وعرض الحزمة الأيونية (IB) في 3DCT.
- لكل مربع مرتبط ، قم بنقل المواضع المتوقعة للميزات ذات الأهمية إلى أداة FIB-SEM ووضع أنماط طحن الصفيحة (الشكل 4C). نقل المواضع يدويا (على سبيل المثال ، عن طريق قياس المسافة إلى المعالم المرئية ، مثل الخلايا أو الخرز الائتماني) أو استخدام الأتمتة والبرمجة النصية كما هو مطبق ، على سبيل المثال ، في SerialFIB14. إذا كانت هناك إشارات متعددة لكل خلية ، فضع الأنماط لتضمين أكبر عدد ممكن من نقاط الاهتمام (POIs) في نفس الصفيحة لزيادة الإنتاجية.
- أولا الخام ، ثم طحن غرامة الصفائح إلى سمك نهائي من 150-250 نانومتر. تجنب الخطوات (على سبيل المثال ، تخفيضات تخفيف التوتر15) التي تسبب ترهل الصفيحة وبالتالي تؤدي إلى حركة الميزة الفعلية المثيرة للاهتمام فيما يتعلق بمداخن FLM المكتسبة مسبقا. استخدم إما إجراءات الطحناليدوية 3 أو الآلية 14،16،17،18 FIB. باستخدام أي من الطريقتين ، تأكد من بقاء ميزة الاهتمام في وسط الصفيحة عن طريق تخفيفها بشكل متماثل من الأعلى والأسفل.
- لتقييم دقة الطحن لكل صفيحة ، قم بإجراء نفس التسجيل كما في الخطوة 3.4. ومع ذلك ، هذه المرة ، استخدم صورة IB النهائية بعد طحن FIB وتحقق مما إذا كانت المواضع المتوقعة للميزات ذات الاهتمام موجودة في الصفيحة النهائية. بدلا من ذلك ، قم بتراكب الإسقاطات الدوارة لمكدسات FLM ، التي تم الحصول عليها من مخرجات 3DCT والبرامج النصية المخصصة19 ، مع صورة IB النهائية (الشكل 4C ، إدراج صغير).

الشكل 4: إجراء طحن FIB المترابط 3D . (أ) يتم استخدام الارتباط 2D-2D لمحات عامة عن FLM (يسار) و SEM (يمين) للشبكة لتحديد مربعات الشبكة التي تم أخذ مداخن الفلورسنت عليها سابقا. (ب) لكل مربع محدد ، بعد تسجيل 3D-2D للمواضع الائتمانية المقابلة في 3DCT (مربعات ملونة) ، يتم اختيار مواضع السمات البيولوجية ذات الأهمية في بيانات FLM. بناء على التنبؤ بالمواضع المقابلة في صورة الحزمة الأيونية (الدوائر الحمراء) ، يتم تحديد مواقع تحضير الصفيحة. (ج) يستخدم المجهر الإلكتروني الماسح (SEM) وصور الحزمة الأيونية (IB) للحفاظ على تمركز الهدف أثناء الطحن. تم العثور على سمك نهائي من 150-250 نانومتر كافية لمزيد من المعالجة النهائية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. TEM المترابطة
- قم بتحميل الشبكات في TEM ، مع التأكد من أن اتجاه الصفيحة (كما هو واضح من علامات القطع أو الاتجاه) عمودي على محور الميل.
ملاحظة: يمكن التحكم في المجاهر من مختلف الشركات المصنعة باستخدام برامج مختلفة ، على سبيل المثال ، Tomo5 أو TOM أو SerialEM20. هنا ، ينصب التركيز على الأخير. - احصل على مونتاج شبكي ولمحات عامة لكل مربع شبكة يحتوي على صفائح. تأكد من أن وقت التكبير والتعرض مناسب لتصور الحبيبات الإيمانية في صور TEM دون إضافة جرعة الإلكترون الإجمالية بشكل كبير. احصل على خرائط TEM عالية الدقة (مونتاج) لكل صفيحة.
- يربط التسجيل و 3D-2D مكدس FLM بمربع شبكة TEM ولمحات عامة عن الصفيحة في 3DCT. استخدم نفس الإجراء كما هو موضح في الخطوة 3.6 عن طريق تحديد مواضع الخرزة المقابلة في التألق (x ، y ، z - ملاءمة غاوسية) وصور المجهر الإلكتروني النافذ. بعد ذلك ، حدد المناصب ذات الأهمية في قنوات FLM وانقلها إلى لمحات عامة عن TEM. إذا لزم الأمر ، استخدم إجراء من خطوتين يشتمل على ارتباط أول بين FLM والتكبير المنخفض TEM ، والثاني من TEM منخفض إلى تكبير مرتفع (الشكل 5).
- نقل المواقع إما يدويا (عن طريق قياس المسافات إلى المعالم) ، وأدوات التسجيل والخريطة المتاحة داخل SerialEM20 ، أو البرامج الخارجية مثل CorRelator21.
- قم بإعداد وتشغيل سلسلة الإمالة في المواضع المرتبطة. استخدم التكبير المناسب وإلغاء التركيز والجرعة الإجمالية (انظر جدول المواد والجدول 1 للحصول على التفاصيل). ابدأ عملية الاستحواذ عند الإمالة المسبقة التي تحددها الصفيحة (انظر أيضا الملاحظة في الخطوة 3.4) واستخدم مخطط الميل المتماثل للجرعة22. استخدم إما الحصول اليدوي أو الدفعي.

الشكل 5: توطين المواضع المترابطة في TEM. بعد نجاح طحن FIB المرتبط ثلاثي الأبعاد ونقله إلى المجهر الإلكتروني النافذ ، يتم إجراء تسجيل 3D-2D لكل مربع مطحون بين الخرز الإيماني (الصناديق الملونة) في مداخن FLM ولمحات عامة عن TEM لتحديد المواقع المحتملة ل cryo-ET (الدوائر الحمراء). يمكن بعد ذلك الحصول على لمحات عامة عن الصفيحة ذات التكبير العالي (التكبير) لإعداد الصور المقطعية بشكل أكثر دقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
يوفر البروتوكول جولة في خط الأنابيب المستخدم لاكتشاف رواسب البروتين الداخلي المعتمدة على مجال EH 1 (Ede1) وتدهورها وحبسها في أجسام الالتهام الذاتي8. END عبارة عن حجرة مفصولة بالطور السائل السائل في S. cerevisiae ، والتي تخزن مجموعة متنوعة من البروتينات المشاركة في التكاثر الخلوي بوساطة clathrin-(CME) بعد فشل الأحداث الداخلية. أحد مكوناته الرئيسية هو Ede1 ، والذي يتضاعف كمكون CME وكمستقبل انتقائي للالتهام الذاتي لتدهور حجرة LLPS الجديدة هذه. وفقا لذلك ، تم استخدام اندماج EGFP ل Ede1 (EGFP-Ede1) تحت سيطرة محفز نازعة هيدروجين الكحول (ADH) لتصور ENDs لأن التعبير المفرط ل Ede1 يتداخل مع المراحل المبكرة من التداخل الخلوي وبالتالي يحفز بشكل أساسي LLPS.
على شبكة مجمدة الغطس مع خلايا الخميرة EGFP-Ede1 المفرطة التعبير وعلامات إيمانية 1 ميكرومتر ، تم اختيار خمسة مواضع لاكتساب مكدس FLM في قناة GFP (الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ ؛ الشكل 6 أ TFS المشاهدة. وضع متحد البؤر ، حجم خطوة تركيز 300 نانومتر ، نطاق 10 ميكرومتر). تم نقل الشبكة إلى أداة FIB (Quanta 3D FEG) ، وتم تحديد مربعات الشبكة التي تم الحصول على مكدسات FLM من أجلها من خلال إجراء ارتباط 2D-2D لمحات عامة عن شبكة التألق و SEM (قارن الخطوة 3.2).
لكل مربع من المربعات المختارة ، تم التقاط صور الحزمة الأيونية بتيار منخفض (10 pA ، تكبير 1200x) ، وتم تسجيل المواضع الائتمانية المقابلة في 3DCT. بعد اختيار المواضع ذات الميزة البيولوجية ذات الأهمية وملاءمة موقعها ثلاثي الأبعاد داخل مكدس FLM ، تم تطبيق التحويل الذي تم العثور عليه على مواقع END المفترضة ، وتم اختيار مواقع تحضير الصفيحة (الشكل 6B). تم استخدام شعاع FIB يميل بمقدار 11 درجة بالنسبة إلى سطح الشبكة في الأمثلة الموضحة هنا (45 درجة مكوك FIB قبل الإمالة ؛ إمالة المرحلة 18 درجة). تم نقل مواقع الاهتمام ، وتم رسم أنماط FIB يدويا (الشكل 6D) عن طريق قياس مسافة المواضع المتوقعة بالنسبة للمعالم البارزة في صورة FIB (على سبيل المثال ، الثقوب ، والتلوث الجليدي ، والخرز الائتماني). تم تقييم دقة التسجيل عن طريق الترك المتعمد للخرز الذي يمكن تحديده بوضوح في صورة FLM و IB ، ثم مقارنة مواقعها الفعلية والمتوقعة في عرض الحزمة الأيونية (على سبيل المثال ، الماس في الشكل 6B ، C). وجد أن ارتباط المربع الموضح في الشكل 6C دقيق (أي أن الموضع المتوقع لمواضع حبة FLM يتطابق تماما مع موقع IB المقابل لها وأبلغت 3DCT عن قيم RMSE فرعية البكسل للتسجيل). وهكذا ، تم قطع الصفائح في المواضع المتوقعة (الموقع ب) وطحنها بدقة إلى سمك ~ 200 نانومتر (إزاحة النمط النهائي).
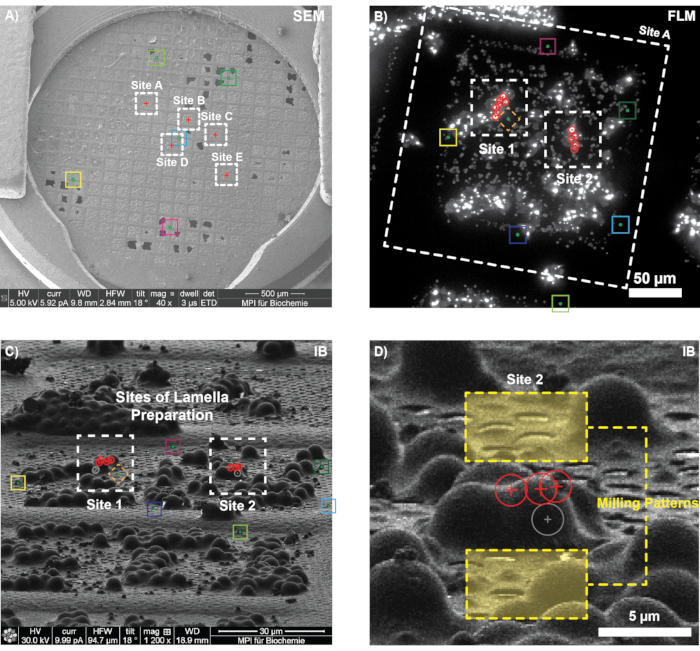
الشكل 6: النتائج التمثيلية للاستهداف الارتباطي ثلاثي الأبعاد لرواسب البروتين الداخلي (END) في الخميرة. (أ) نظرة عامة على SEM للشبكة قبل الطحن. تشير المربعات الملونة إلى مربعات الشبكة التي تم أخذ مداخن مضان لها مسبقا. (B-C) ارتباط 3D في مربع الشبكة. بعد تسجيل العديد من الخرز الإيماني المقابل (الصناديق الملونة) في بيانات FLM (B ، كما هو موضح هنا كإسقاط أقصى كثافة) وصورة الحزمة الأيونية (C) ، تم التحقق من دقة تسجيل 3D من خلال التنبؤ بموضع الخرزة المشار إليها مع الماس. بعد ذلك ، تم التنبؤ بمواقع إشارة الهدف (الدوائر الحمراء) في عرض الحزمة الأيونية لموقعين محتملين للطحن. (د) تكبير الموقع B الذي يوضح المواضع المتوقعة لثلاث نقاط مستهدفة (دوائر حمراء) وأنماط الطحن الأولية (المربعات الصفراء). كان من المتوقع أن تكون نقطة مضان رابعة أقل بكثير من النقاط الأخرى وبالتالي لم يتم استهدافها أثناء الطحن (الدائرة الرمادية). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد نجاح طحن FIB ونقل الشبكة إلى المجهر الإلكتروني للإرسال بالتبريد (يعمل Titan Krios عند 300 كيلو فولت ومجهز بكاشف الإلكترون المباشر Gatan K2 ومرشح طاقة Bioquant) ، تم تسجيل نظرة عامة على الشبكة في SerialEM واستخدامها لتحديد موقع المربعات مع الصفائح. لكل صفيحة ، تم الحصول على صور نظرة عامة ، وتم تسجيل بيانات FLM في 3DCT (3D-2D) باستخدام الخرز الائتماني المقابل. ثم تم التنبؤ بمواقع السمات البيولوجية ذات الأهمية (الشكل 7 أ) باستخدام التحويل المحسوب من الخرز الائتماني. تم خياطة لمحات عامة عن الصفيحة المسجلة بتكبير أعلى ، وارتبطت المواقع ذات الأهمية باستخدام معالم مرئية بوضوح (على سبيل المثال ، الخرز الائتماني). بدلا من ذلك ، يمكن إنتاج لمحات عامة CLEM الكلاسيكية في برامج مختلفة10,12.
بناء على الارتباط ، تم العثور على أربعة مواقع محتملة للحصول على التصوير المقطعي للصفائح الموضحة في الشكل 7 أ. ومع ذلك ، يتضمن هذا أيضا موقعا لم يتم استهدافه أثناء طحن FIB المرتبط ب 3D (قارن الشكل 6D ؛ الدائرة الرمادية) وموقعا محظورا بسبب تلوث الجليد (الشكل 7 ؛ الصناديق الرمادية). وفقا لذلك ، لا يمكن تسجيل التصوير المقطعي إلا لموقعين (الشكل 7 ب). بشكل عام ، تم تحقيق نجاح ارتباط بنسبة ~ 75٪ ، أي الصفائح التي نجت من النقل إلى هياكل TEM و END في المواقع المتوقعة ، (12 موقعا مرتبطا). بعد إعادة بناء التصوير المقطعي والتجزئة ومطابقة القالب ، يمكن تصور هياكل END الفردية في سياقها الأصلي (الشكل 7C ، D). وهذا يشمل الشبكة الإندوبلازمية المحطمة (ER) المحيطة ب END ، وقطرات الدهون التي تتلامس أحيانا ، والريبوسومات ، والتي يتم استبعادها من حجرة LLPS. مجتمعة ، يوضح هذا كيف يمكن لطحن FIB المترابط 3D أن يوفر معلومات على المستوى الجزيئي للعمليات البيولوجية النادرة من الخلايا السليمة.
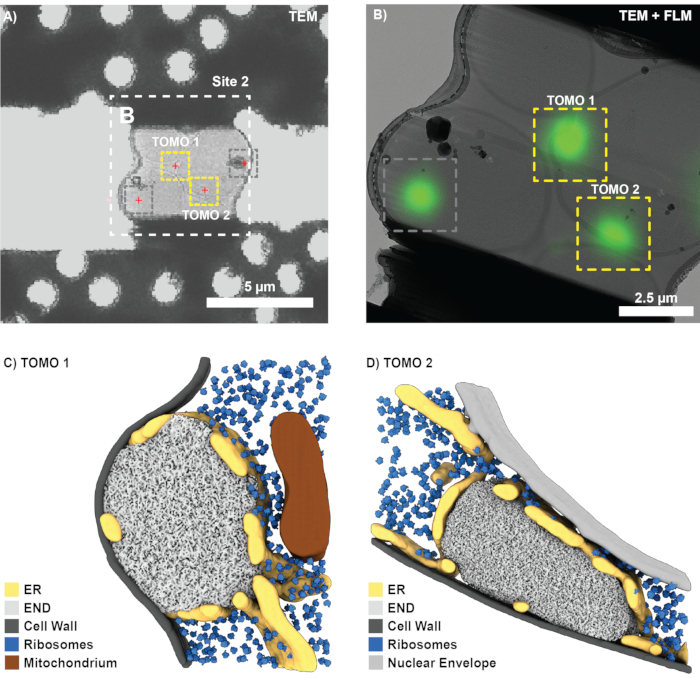
الشكل 7: النتائج التمثيلية لتصور END باستخدام cryo-ET. (أ) يمكن بسهولة ربط نظرة عامة منخفضة التكبير TEM لموقع الطحن الموضح في الشكل 6 بإسقاط الكثافة القصوى FLM (الشكل 6B) لتحديد السمات البيولوجية ذات الأهمية (الصلبان الحمراء). (ب) في الخطوة الثانية، يمكن ربط عرض تكبير أعلى (مخيط)، ويتم إعداد مواضع لاقتناء التصوير المقطعي (المربعات الصفراء). تم تجاهل المواقع الناتجة عن إشارة خارج الطائرة (المربع الرمادي ، قارن الشكل 6D). (ج-د) باستخدام نهج FIB المترابط 3D ، يمكن تصور رواسب البروتين الداخلي (END) في بيئتها الأصلية. يمكن تحديد وتصور تراكيب مثل الشبكة الإندوبلازمية (ER) والريبوسومات والأغشية وقطرات الدهون. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| إعدادات منظف البلازما | |||
| هاريك منظف البلازما PDG-3XG : | تردد الراديو: "HI" ، 30 ثانية ؛ N2 البلازما | ||
| إعدادات المكبس | |||
| TFS فيتروبوتعضو الكنيست الرابع: | رطوبة 100٪ قوة اللطخة = 8 ؛ وقت اللطخة = 10 ثوان ؛ وقت الانتظار 0 ثانية ؛ (يجب أن يعمل هذا مع معظم الخلايا المعلقة والملتصقة) | ||
| مواقع وتوقيتات FIB GIS | |||
| كوانتا 3D FEG: | الميل = 0 ، الدوران = -180 ، موضع Z = 13.5 ، نقطة ضبط درجة الحرارة = 26.15 درجة ، الوقت = 8 ثوان | ||
| TFS Scios: | الميل = 0 ، الدوران = -180 ، موضع Z = 9.8 ، نقطة ضبط درجة الحرارة = 28 درجة مئوية ، الوقت = 7 ثوان | ||
| TFS أكويلوس 1: | موضع محدد مسبقا للبرنامج ، نقطة ضبط درجة الحرارة = 28 درجة ، الوقت = 7 ثوان | ||
| TFS أكويلوس 2: | موضع البرنامج المحدد مسبقا ، نقطة ضبط درجة الحرارة = 28 درجة ، الوقت = 7 ثوان | ||
| إعدادات طلاء الرش FIB | |||
| نظام النصاب: | في غرفة إعداد النصاب: 10 مللي أمبير ، 40 ثانية | ||
| TFS Scios: | 10 واط ، 500 فولت ، 250 مللي أمبير ، 0.2 ملي بار ، 15 ثانية | ||
| TFS أكويلوس 1: | 1 كيلو فولت ، 10 مللي أمبير ، 10 باسكال ، 15 ثانية | ||
| TFS أكويلوس 2: | 1 كيلو فولت ، 10 مللي أمبير ، 10 باسكال ، 15 ثانية | ||
| اقتناء التصوير المقطعي | |||
| تيتان كريوس Gi2 | كاميرا K2 ، فلتر طاقة Gatan Bioquantum | ||
| شق 20 فولت ؛ مخطط الميل المتماثل للجرعة (هاغن) مع خطوات 2 درجة ؛ ابدأ من +10 درجات (الإمالة المسبقة للصفيحة!) إلى +70 درجة و-50 درجة | |||
| تيتان كريوس Gi4 | الصقر 4 ؛ فلتر الطاقة Selectris X | ||
| 10 فولت شق. مخطط الميل المتماثل للجرعة (هاغن) مع خطوات 2 درجة ؛ ابدأ من +10 درجات (الإمالة المسبقة للصفيحة!) إلى +70 درجة و-50 درجة | |||
| استحواذ FLM | |||
| الظهور (الوضع البؤري) | الهدف: خطة زايس EC - نيوفلوار 40×/0.9 NA Pol؛ معلمات اكتساب المكدس: حجم بكسل x-y = 161.25 نانومتر ، حجم خطوة z = 300 نانومتر. | ||
| لايكا SP8 التبريد متحد البؤر | الهدف: لايكا HCX PL APO 50x / 0.90 CLEM ؛ معلمات اكتساب المكدس: حجم بكسل x-y = 84 نانومتر ، حجم خطوة z = 300 نانومتر. | ||
الجدول 1: قائمة المعدات المختبرة والإعدادات المقترحة.
Discussion
1. الخطوات الحاسمة في البروتوكول
يعد تحسين ثقافة الخلية ومعلمات غرق الشبكة أمرا أساسيا لسير العمل هذا. في بداية المشروع ، يجدر استثمار الوقت لتحسين استراتيجيات وضع العلامات ، وتوزيع الخلايا والخرز الائتماني ، واختبار معلمات إعداد الشبكة والنشاف المختلفة. إن العمل مع عينة مجمدة على النحو الأمثل سيسهل بشكل كبير المعالجة النهائية.
بالنسبة لأي تجربة TEM ، يلزم أخذ عينات زجاجية. بالنسبة لخلايا الثدييات الكبيرة مثل HeLa، يفضل استخدام 1-2 خلية لكل مربع شبكي، ولكن قد تظل الخلايا زجاجية بكثافة أعلى. اختياريا ، يمكن تحسين التزجيج في خلايا الثدييات (على سبيل المثال ، HEK293 ، HeLa) عن طريق احتضانها ب 2.5-10٪ (v / v) من الجلسرين المضاف إلى وسط الاستزراع قبل 10 دقائق من الانخفاض23. إذا كان ذلك متاحا ، يمكن استخدام الزخرفة الشبكية لضمان وضع الخلايا وتوزيعها بشكل مثالي ، وبالتالي تحسين التزجيج والارتباط اللاحق24.
بينما يمكن تحديد خلايا معينة أثناء سير العمل ، فإن عددا قليلا جدا من الخلايا التي تظهر الميزة البيولوجية ذات الأهمية سيقلل بشكل كبير من الإنتاجية الإجمالية. لتحسين الارتباط في الخلايا الإيجابية POI ، يجب استخدام الفلوروفورات الساطعة بما فيه الكفاية. هذا مهم بشكل خاص في مستويات التعبير الذاتية. وجدنا أنه في ظل ظروف التبريد ، غالبا ما كان أداء mVenus أفضل من EGFP نظرا لزيادة سطوعه25 والتحول الصوتي ، مما يجعله مناسبا لإعدادات مرشح GFP القياسية في ظل ظروف التبريد26. بالنسبة للهياكل المستهدفة غير الشبيهة بالنقطة ، يجب أيضا مراعاة المفاضلة بين الطول الموجي ودقة التوطين (حد حيود آبي).
يتطلب الارتباط الفعال 3D أيضا أن تكون الشبكات مستقرة ميكانيكيا ويتم التعامل معها بعناية فائقة. بينما يمكن استخدام شبكات الذهب أو النحاس القياسية مع دعم الكربون ، يمكن زيادة معدل النجاح بشكل كبير باستخدام أفلام SiO2 أكثر صلابة اعتمادا على المشروع. ومع ذلك ، لم يتم بعد تحديد ما إذا كان (أ) الاستقرار الميكانيكي أو (ب) مطابقة معاملات التمدد الحراري (الركيزة مقابل الفيلم) لتقليل التجاعيدبالتبريد 27 ، هو العامل الأكثر أهمية لنجاح الارتباط ثلاثي الأبعاد. علاوة على ذلك ، لالتقاط شبكات Au الهشة ، يمكن استخدام الأطباق المطلية بالبولي ثنائي ميثيل سيلوكسان5.
بالإضافة إلى ضمان استقرار العينة، يعد الاختيار الدقيق لمعلمات التصوير FLM ضروريا للحصول على مداخن مضان عالية الجودة مناسبة للاستهداف الأمثل أثناء طحن FIB. في هذا الصدد ، ينصح أيضا باختبار تقنيات مختلفة لتقليل التشويش28 أو إزالة الالتفاف على بيانات FLM ، لأنها قد تحسن بشكل كبير من توطين الإشارات الائتمانية والخلوية. عند ربط إشارة التألق بصور FIB-SEM ، من المهم أخذ عينات جيدة من الخرز الائتماني. يجب أن تكون موزعة بشكل جيد حول الخلايا وربما على ارتفاعات z مختلفة. من الممارسات الجيدة أيضا التحقق من اتساق الارتباط عن طريق التحقق من المواضع المتوقعة مقابل الفعلية للخرز التي تم استبعادها عمدا من النموذج الائتماني ولكن يمكن ربطها بوضوح بالعين. يجب أيضا مراعاة قيم RMSE الخاصة ب 3DCT دائما للتحقق من اتساق التسجيل.
نظرا لأن ترسب المواد المطحونة والمياه المتبقية من غرفة FIB-SEM (أي إعادة التلوث) يزيد من سمك الصفيحة الفعال عن طريق إضافة مادة غير متبلورة إلى كلا جانبيها ، فإن الاحتفاظ بالصفائح المطحونة بدقة في المجهر لفترة طويلة يقلل بشكل عام من جودة بيانات TEM بسبب أحداث تشتت الإلكترون الإضافية. وفقا لذلك ، غالبا ما يتم إجراء الطحن بطريقة من خطوتين: أولا ، يتم طحن جميع المواضع تقريبا (أي إلى حوالي 800 نانومتر) ، ثم ناعما (إلى ~ 150-250 نانومتر) ، ويتم تفريغ الشبكة على الفور بعد اكتمال الصفيحة الأخيرة. ومع ذلك ، يمكن تحقيق نجاح أفضل في الارتباط من خلال معالجة المواقف ذات الاهتمام بطريقة الموقع ، وبالتالي إجراء طحن خشن ودقيق على نفس الصفيحة مباشرة بعد بعضها البعض لأن هذا لا يترك وقتا للانحناء أو التشوه. ومع ذلك ، فإن هذا يقلل من الحد الأقصى لعدد الصفائح التي يمكن إنتاجها لكل شبكة اعتمادا على معدل إعادة تلوث النظام. بمعدل 20 نانومتر / ساعة ، يتم إنتاج 4-6 صفائح في غضون 1-1.5 ساعة.
ستؤدي حركة الشبكة بأكملها أو الصفائح المطحونة الخشنة >300 نانومتر إلى ارتباط ضعيف أو غير ناجح (انظر أيضا القيود التي تمت مناقشتها أدناه). لذلك يجب فحصه بانتظام ، على سبيل المثال ، من خلال مقارنة صور IB قبل وأثناء وبعد طحن FIB. يجب التخلص من المواقع التي تظهر حركة كبيرة (>300 نانومتر). تحسين تحضير العينة (أي اختيار نوع الشبكة وكثافة الخلية ومعلمات الغطس ؛ انظر قسم البروتوكول 1) واستراتيجية الطحن لتجنب هذه الحركات. يمكن تقليل انحناء الصفيحة بشكل كبير عن طريق الطحن في الموقع كما هو موضح في الخطوة 3.6 وتقليل عرض الصفيحة. كما ذكرنا من قبل ، في حين تم تصميم تخفيضات تخفيف التوتر15 لتقليل انحناء الصفيحة ، فإنها غالبا ما تؤدي إلى حركة منسقة للصفائح غير المنفصلة ، وبالتالي تمنع الارتباط بشكل فعال. يمكن استخدام أنظمة FLM المتكاملة لحل هذه المشكلة.
2. التعديلات وحل المشاكل من الطريقة
ينصح بشدة بإجراء توصيف شامل للعينة في تصوير الخلايا الحية قبل الانتقال إلى ظروف التبريد. يمكن أن يؤدي تحسين العينات الخلوية ومخططات العلاج ومعرفة نوع الإشارة المتوقعة قبل الدخول في سير العمل بالتبريد إلى تحسين معدل نجاحها بشكل كبير.
في سير العمل المعروض هنا ، يتم استخدام مجهر مضان مستقل مع مرحلة التبريد لتصوير العينات ، يليه نقل الشبكات إلى مجهر الحزمة الأيونية المركزة. ومع ذلك ، فقد تم اختباره على الأنظمة التي يتم فيها دمج مجهر مضان في غرفة FIB-SEM ، وبالتالي لا يلزم نقل عينة للحصول على صور مضان29،30،31. باستخدام مثل هذه الأنظمة المتكاملة ، يمكن تصوير المواضع ذات الأهمية أثناء وبعد طحن FIB للتحقق من وجود إشارة مضان الهدف دون زيادة خطر تلويث الصفائح النهائية. ومع ذلك ، من المهم أن نضع في اعتبارنا المعلمات البصرية للمجاهر المستخدمة ، على سبيل المثال ، فإن هدف NA المنخفض سيحد من الدقة التي يمكن بها تحديد موقع الخرز الإيماني وإشارات الهدف. ومع ذلك ، ستساعد إعدادات FLM المدمجة أيضا على التعامل بشكل أفضل مع التشوهات الطفيفة للشبكات والصفائح ، حيث يمكن تحديث مكدسات FLM باستمرار ومقارنتها بمناظر SEM و IB الحديثة.
كبديل للتصوير الفلوري للصفائح بين طحن FIB والحصول على بيانات TEM ، يمكن استخدام ارتباط ما بعد TEM للتحقق من الموضع الصحيح وطحن الصفائح 5,6.
خلال جميع خطوات سير العمل المترابط، ولكن بشكل خاص أثناء TEM، يوصى بإنشاء تراكب لبيانات التألق المتوقعة على صور FIB-SEM/TEM. تساعد طرق عرض CLEM الكلاسيكية هذه على فهم جزء الخلايا الموجود داخل الصفائح بشكل أكثر حدسية. يعمل هذا أيضا كفحص مفيد للعقل للتحقق من دقة الارتباط.
3. حدود الطريقة
يتطلب نهج FIB المترابط 3D عينات يمكن تزويدها بالخرز الائتماني. وفقا لذلك ، تقتصر هذه الطريقة حاليا على الشبكات المجمدة للغطس. بالنسبة لعينات الضغط العالي (HPF) المجمدة (الأنسجة) ، في الوقت الحاضر ، يمكن إجراء ارتباطات 2D-2D فقط. من المحتمل أن تكون العلامات الإيمانية الداخلية (على سبيل المثال ، العضيات ، قطرات الدهون الملطخة) حلا لهذه المشكلة32,33. يعتمد معدل نجاح الارتباط النهائي على العديد من العوامل ، بما في ذلك جودة العينة ، وإعداد الفحص المجهري الفلوري ، وسمك الصفيحة ، وحجم الهيكل المستهدف. تقدر دقة الارتباط باستخدام نهج التسجيل ثلاثي الأبعاد الموصوف في حدود 200-300 نانومتر على صورة IB النهائية ، والتي تتوافق تقريبا مع السماكة النموذجية للصفائحالمطحونة FIB 7. وبناء على ذلك، سيكون من الصعب استهداف الهياكل الخلوية الأصغر بكثير من ذلك في الوقت الحاضر. بالإضافة إلى ذلك ، فإن الحركة المفرطة في موقع الطحن (>300 نانومتر) تقلل أيضا من دقة الارتباط ، وهي مشكلة يمكن معالجتها باستخدام إعدادات FLM المدمجة في أدوات FIB / SEM. يجب استبعاد الصفائح التي تظهر تشوها قويا أو انحناءا أثناء الطحن ، على أي حال ، من سير عمل المصب.
بشكل عام ، التصوير الفلوري بالتبريد محدود حاليا بمعيار حيود آبي. مع المزيد من التطبيق الروتيني (والتسويق) لطرق cryo-FLM فائقة الحل ، قد يصبح الاستهداف الأكثر دقة للهياكل الخلوية ممكنا ، خاصة عند دمجها في FIB / SEM للتشغيل أثناء التنقل.
4. أهمية الطريقة
خاصة بالمقارنة مع التقنيات غير المستهدفة وما بعد الارتباط ، يسمح نهج طحن FIB المرتبط ب 3D باختيار المواضع المناسبة قبل خطوة TEM المستهلكة للوقت والموارد. وبالتالي ، فإنه يتيح جمع البيانات وتخطيط المشاريع بشكل أكثر كفاءة. علاوة على ذلك ، تضيف بيانات التألق المترابطة طبقة من المعلومات التي يمكن أن تكون حاسمة لتفسير الصور المقطعية ولدمج نتائج cryo-ET في مشاريع متعددة النطاقات ، خاصة عند التعامل مع مجموعات البروتين غير المهيكلة أو تلك الصغيرة جدا لمطابقة القوالب ومتوسط التصوير المقطعي الفرعي.
5. الأهمية والتطبيقات المستقبلية المحتملة
بالاقتران مع تدفقات العمل المتقدمة مثل الرفع بالتبريد من عينات HPF 34,35 ، وحجم cryo-FIB-SEM36 والتصوير الفلوري فائق الدقة26،37،38،39 ، يوفر إعداد الصفيحة المستهدف ثلاثي الأبعاد إمكانية ليس فقط تشريح العمليات البيولوجية في الخلايا المعزولة ولكن أيضا لجعل عينات الأنسجة والمرضى في متناول طحن FIB والتصوير المقطعي الإلكتروني بالتبريد. على هذا النحو ، سيسمح بتشريح العمليات المرضية بدقة عالية وبالتالي يكون لبنة أساسية نحو خزعة على المستوى النانوي.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نشكر إنغا وولف على دعمها للبنية التحتية لتكنولوجيا المعلومات ، وفلوريان بيك على الدعم الحسابي ، وأودا إتش شيوتز على القراءة النقدية للمخطوطة. تم توفير التمويل جزئيا من خلال زمالة ألكسندر فون هومبولت للعائدين إلى فيليب س. إردمان وزمالة EMBO طويلة الأجل ALTF 764-2014 إلى فلوريان ويلفلينج. حصلت آنا بيبر على دعم من زمالة بوهرنجر إنجلهايم فوندز للدكتوراه.
Materials
| Name | Company | Catalog Number | Comments |
| Autogrids | Thermo Fisher Scientific / Homemade | 1036173 (no cutout), 1205101 (with cutout) | |
| C-rings | Thermo Fisher Scientific | 1036171 | |
| Corrsight with cryo module | Thermo Fisher Scientific | FLM Alternative 1 | |
| Dynabeads MyOne COOH | Thermo Fisher Scientific | 65011 | recommended 1 µm fiducial beads |
| EM Grids R1/4 SiO2 | Quantifoil | N1-S13nAu20-01 | |
| Falcon 4 camera w. post-column Selectris X energy filter | Thermo Fisher Scientific | Camera/Filter Alternative 1 | |
| FIB Aquilos 1 | Thermo Fisher Scientific | FIB Alternative 1 | |
| FIB Aquilos 2 | Thermo Fisher Scientific | FIB Alternative 2 | |
| FIB Quanta 3D FEG | Thermo Fisher Scientific | FIB Alternative 3 | |
| FIB Scios | Thermo Fisher Scientific | FIB Alternative 4 | |
| K2 summit camera w. post-column energy filter 968 Quantum K2 | Gatan | Camera/Filter Alternative 2 | |
| Leica TCS SP8 with cryo module | Thermo Fisher Scientific | FLM Alternative 2 | |
| Plasma Cleaner PDC-3XG | Harrick | ||
| Teflon Sheet (0.25 mm) | plastx24.de | 11645 | Cut to same dimensions as filter paper |
| TEM Titan Krios XFEG 300 kV Gi2 | Thermo Fisher Scientific | TEM Alternative 1 | |
| TEM Titan Krios XFEG 300 kV Gi4 | Thermo Fisher Scientific | TEM Alternative 2 | |
| THUNDER Imager EM Cryo CLEM | Thermo Fisher Scientific | FLM Alternative 3 | |
| Vitrobot Mark IV | Thermo Fisher Scientific | alternativevly, use manaual plunger | |
| Whatman filter paper | Sigma Aldrich | 10311807 | 55 mm diamater; needs to be cut to fit the Vitrobot |
References
- Beck, M., Baumeister, W. Cryo-Electron tomography: Can it reveal the molecular sociology of cells in atomic detail. Trends in Cell Biology. 26 (11), 825-837 (2016).
- Plitzko, M., Villa, E., Schaffer, M., Baumeister, W. Opening windows into the cell focused-ion-beam milling for cryo-electron tomography. Current Opinion in Structural Biology. 23, 771-777 (2013).
- Schaffer, M., et al. Optimized cryo-focused ion beam sample preparation aimed at in situ structural studies of membrane proteins. Journal of Structural Biology. 197 (2), 73-82 (2017).
- Tegunov, D., Xue, L., Dienemann, C., Cramer, P., Mahamid, J. Multi-particle cryo-EM refinement with M visualizes ribosome-antibiotic complex at 3.5 Å in cells. Nature Methods. 18 (2), 186-193 (2021).
- Klein, S., Wachsmuth-Melm, M., Winter, S. L., Kolovou, A., Chlanda, P. Cryo-correlative light and electron microscopy workflow for cryo-focused ion beam milled adherent cells. Methods in Cell Biology. 162, Elsevier Inc. 273-302 (2021).
- Klein, S., et al. Post-correlation on-lamella cryo-CLEM reveals the membrane architecture of lamellar bodies. Communications Biology. 4 (1), 1-12 (2021).
- Arnold, J., et al. Site-Specific Cryo-focused ion beam sample preparation guided by 3D correlative microscopy. Biophysical Journal. 110 (4), 860-869 (2016).
- Wilfling, F., et al. A selective autophagy pathway for phase-separated endocytic protein deposits. Molecular Cell. 80 (5), 764-778 (2020).
- Scientific volume imaging, Nyquist calculator. , Available from: https://svi.nl/NyquistCalculator (2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Huygens Professional version 19.04. , Scientific Volume Imaging. The Netherlands. Available from: http://svi.nl (2021).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- Arnold, J. 3DCT. , Available from: https://3dct.semper.space/ (2021).
- Klumpe, S., et al. A modular platform for streamlining automated cryo-FIB workflows. bioRxiv. , 444745(2021).
- Wolff, G., et al. Mind the gap: Micro-expansion joints drastically decrease the bending of FIB-milled cryo-lamellae. Journal of Structural Biology. 208 (3), 0-3 (2019).
- Buckley, G., et al. Automated cryo-lamella preparation for high-throughput in-situ structural biology. Journal of Structural Biology. 210 (2), 107488(2020).
- Tacke, S., et al. A streamlined workflow for automated cryo focused ion beam milling. bioRxiv. , 963033(2020).
- Zachs, T., et al. Fully automated, sequential focused ion beam milling for cryo-electron tomography. eLife. 9, e52286(2020).
- Fung, H. K. H. tools3dct. , Available from: https://github.com/hermankhfung/tools3dct (2021).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152 (1), 36-51 (2005).
- Yang, J. E., Larson, M. R., Sibert, B. S., Shrum, S., Wright, E. R. CorRelator: Interactive software for real-time high precision cryo-correlative light and electron microscopy. Journal of Structural Biology. 213 (2), 107709(2021).
- Hagen, W. J. H., Wan, W., Briggs, J. A. G. Implementation of a cryo-electron tomography tilt-scheme optimized for high resolution subtomogram averaging. Journal of Structural Biology. 197 (2), 191-198 (2017).
- Bäuerlein, F. J. B., et al. In situ architecture and cellular interactions of polyQ inclusions. Cell. 171 (1), 179-187 (2017).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17 (1), 50-54 (2020).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Kaufmann, R., et al. Super-resolution microscopy using standard fluorescent proteins in intact cells under cryo-conditions. Nano Letters. 14 (7), 4171-4175 (2014).
- Booy, F. P., Pawley, J. B. Cryo-crinkling: what happens to carbon films on copper grids at low temperature. Ultramicroscopy. 48 (3), 273-280 (1993).
- Krull, A., Buchholz, T. O., Jug, F. Noise2void-Learning denoising from single noisy images. Proceedings of the IEEE Computer Society Conference on Computer Vision and Pattern Recognition. 2019, 2124-2132 (2019).
- Gorelick, S., et al. PIE-scope, integrated cryo-correlative light and FIB/SEM microscopy. eLife. 8, 1-15 (2019).
- Delmic METEOR. , Available from: https://www.delmic.com/en/products/cryo-solutions/meteor (2021).
- T. F. Scientific. iFLM. , Available from: https://assets.thermofisher.com/TFS-Assets/MSD/Datasheets/iflm-aquilos-datasheet-ds0366.pdf (2021).
- Mahamid, J., et al. Liquid-crystalline phase transitions in lipid droplets are related to cellular states and specific organelle association. Proceedings of the National Academy of Sciences of the United States of America. 116 (34), 16866-16871 (2019).
- Scher, N., Rechav, K., Paul-Gilloteaux, P., Avinoam, O. In situ fiducial markers for 3D correlative cryo-fluorescence and FIB-SEM imaging. iScience. 24 (7), 102714(2021).
- Mahamid, J., et al. A focused ion beam milling and lift-out approach for site-specific preparation of frozen-hydrated lamellas from multicellular organisms. Journal of Structural Biology. 192, 262-269 (2015).
- Schaffer, M., et al. A cryo-FIB lift-out technique enables molecular-resolution cryo-ET within native Caenorhabditis elegans tissue. Nature Methods. 16 (8), 757-762 (2019).
- Wu, G. -H., et al. Multi-scale 3D cryo-correlative microscopy for vitrified cells. Structure. 28 (11), 1231-1237 (2020).
- Liu, B., et al. Three-dimensional super-resolution protein localization correlated with vitrified cellular context. Scientific Reports. 5, 13017(2015).
- Weisenburger, S., Jing, B., Renn, A., Sandoghdar, V. Cryogenic localization of single molecules with angstrom precision. SPIE NanoScience + Engineering. 8815, (2013).
- Tuijtel, M. W., Koster, A. J., Jakobs, S., Faas, F. G. A., Sharp, T. H. Correlative cryo super-resolution light and electron microscopy on mammalian cells using fluorescent proteins. Scientific Reports. 9 (1), 1-11 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved