Method Article
التهاب العنبية المتفطر (PMU) كنموذج لالتهاب العنبية بعد العدوى
In This Article
Summary
يحدد هذا البروتوكول خطوات إحداث التهاب القزحية المتفطر (PMU) في الفئران. تحدد هذه الطريقة الخطوات للمساعدة في إنتاج التهاب عين موثوق وقوي في نظام نموذج الماوس. باستخدام هذا البروتوكول ، قمنا بتوليد عيون UVEITIC وعيون زميلة غير ملتهبة من مفردة لمزيد من التقييم باستخدام المقايسات المناعية والنسخية والبروتينية.
Abstract
يصف مصطلح "التهاب العنبية" مجموعة غير متجانسة من الحالات التي تتميز جميعها بالتهاب داخل العين. على نطاق واسع ، يتم تعريف التهاب القزحية من خلال المسببات: العدوى أو المناعة الذاتية. يتطلب التهاب العنبية المعدي العلاج بالعوامل المضادة للميكروبات المناسبة، بينما يتطلب التهاب العنبية المناعي الذاتي العلاج بالكورتيكوستيرويدات أو غيرها من العوامل المثبطة للمناعة. التهاب العنبية التالي للعدوى هو شكل من أشكال التهاب العنبية المزمن الذي يتطلب الكورتيكوستيرويدات للسيطرة على عقابيل المناعة بعد العدوى الأولية. التهاب القزحية المرتبط بعدوى المتفطرة السلية (Mtb) هو شكل معترف به جيدا من التهاب القزحية بعد العدوى ، لكن آليات المرض ليست مفهومة تماما. لفهم الدور الذي تلعبه المستضدات الفطرية والروابط الفطرية في تحفيز التهاب العين المزمن بعد الإصابة بالسل ، تم تطوير نموذج التهاب القزحية المتفطر (PMU) للاستخدام في الفئران. توضح هذه المخطوطة طرق توليد PMU ومراقبة المسار السريري للالتهاب باستخدام قاع العين الملون والتصوير المقطعي للتماسك البصري (OCT). يتم تحفيز PMU عن طريق التحصين بمستخلص المتفطرات المقتولة بالحرارة متبوعا بالحقن داخل الجسم الزجاجي لنفس المستخلص في عين واحدة بعد سبعة أيام. تتم مراقبة التهاب العين طوليا باستخدام التصوير في الجسم الحي ويتبعه جمع العينات لمجموعة واسعة من المقايسات ، بما في ذلك الأنسجة ، وقياس التدفق الخلوي ، وتحليل السيتوكين ، و qPCR ، أو تسلسل mRNA. يعد نموذج الماوس الخاص ب PMU أداة جديدة مفيدة لدراسة استجابات العين ل mTB ، وآلية التهاب القزحية المزمن ، ولاختبارات الفعالية قبل السريرية للعلاجات الجديدة المضادة للالتهابات.
Introduction
يصف مصطلح "التهاب العنبية" مجموعة غير متجانسة من الحالات التي تتميز جميعها بالتهاب داخل العين1. تعد النماذج الحيوانية لالتهاب العنبية مهمة لفهم آليات المرض وللاختبار قبل السريري للعلاجات الجديدة. تم إنشاء عدد من النماذج الحيوانية لالتهاب القزحية2. الاثنان اللذان تمت دراستهما على نطاق واسع هما التهاب القزحية المناعي الذاتي التجريبي (أو التهاب الشبكية الدهنية. EAU) والتهاب القزحية الناجم عن السموم الداخلية (EIU). عادة ما يتم إنشاء EAU عن طريق التحصين بمستضدات العين أو يمكن أن يحدث تلقائيا عندما يتعطل التسامح المركزي في غياب جين AIRE 3,4. ومنذ ذلك الحين تم تطوير متغيرات أخرى من النموذج5،6،7 لتشمل الببتيدات العنبية المختلفة. تمت مراجعتها على نطاق واسع8،9،10. EAU هو النموذج الأساسي لأشكال التهاب العنبية المناعي الذاتي المعتمد على الخلايا التائية مثل مرض Vogt-Koyanagi-Harada والتهاب مشيمية الطيور في البشر. يتم إنشاء EIU عن طريق الحقن الجهازي أو المحلي لعديد السكاريد الدهني البكتيري (LPS)10,11. تم استخدام EIU كنموذج لالتهاب العنبية الحاد الناتج عن تنشيط مسارات الإشارات المناعية الفطرية12. كان كلا النموذجين فعالين في الفهم الحالي لمناعة العين، ولكن لا يعد أي منهما نموذجين فعالين لالتهاب العنبية المزمن بعد العدوى. يوفر نموذج التهاب القزحية الفطري (PMU) ، الذي تم إنشاؤه مؤخرا في الفئران ، نهجا لاستجواب وتقييم الجوانب السريرية والخلوية لهذا النوع من التهاب القزحية13.
هناك انتشار مرتفع للعدوى الفطرية في جميع أنحاء العالم ، مع أكثر من 10 ملايين حالة جديدة وأكثر من 1.4 مليون حالة وفاة أبلغت عنها منظمة الصحة العالمية في عام 201914. يشمل المظهر خارج الرئة لعدوى السل النشط (TB) التهاب القزحية وهو سبب معترف به جيدا لالتهاب القزحية المعدي15,16. مظاهر التهاب القزحية المرتبط بالسل هي البروتيان ، والتي من المحتمل أن تعكس آليات متميزة متعددة للمرض لتشمل عدوى العين المباشرة بالإضافة إلى التهاب المناعة الأقل فهما17،18،19. تشمل الآليات المقترحة لهذه العواقب اللاحقة للعدوى استجابة التهابية مزمنة يحفزها استمرار عدوى عصوية في ظهارة الشبكية الصبغية (RPE) ، واستجابة التهابية مزمنة يحفزها وجود أنماط جزيئية متبقية مرتبطة بمسببات الأمراض (PAMPs) من عدوى العين التي تم تطهيرها بنجاح ، والتنشيط غير المناسب للاستجابة المناعية التكيفية ضد مستضدات العين من خلال عملية التقليد الجزيئي أو المستضد. الانتشار الناجم عن عدوى السل الجهازية20،21،22،23.
من أجل الحصول على فهم ميكانيكي أفضل لالتهاب القزحية المزمن بعد العدوى ودراسة دور المستضدات الفطرية في بدء المرض ، تم تطوير نموذج PMU للاستخدام في الفئران13,24. وفقا لذلك ، لاستنباط الالتهاب ، يتلقى الفأر أولا حقنة تحت الجلد من مستضد من سلالة المتفطرة السلية H37Ra المقتولة بالحرارة لتقليد العدوى الجهازية ، تليها بعد سبعة أيام الحقن داخل الجسم الزجاجي لنفس المستضد الذي يتم إعطاؤه للعين اليسرى أو اليمنى لتقليد عدوى العين المحلية. تتم مراقبة شدة ومدة التهاب القزحية التالي عن طريق التصوير المقطعي الطولي للتماسك البصري في الجسم الحي (OCT) والتصوير القاعي للعين25. تتميز PMU بالتهاب العنبية الحاد المهيمن على النخاع والذي يتطور إلى التهاب العنبية الخلفي المزمن المهيمن على الخلايا التائية مع التهاب الزجاجية والتهاب الشبكية حول الأوعية الدموية والمناطق البؤرية لتلف الشبكية الخارجية26. يشير وجود التهاب حبيبي في الجزء الخلفي من العين إلى أنه يمكن استخدام نموذج PMU لدراسة بعض أشكال التهاب القزحية الأمامي (الحبيبي وغير الحبيبي) والتهاب القزحية المتوسط ، الذي يظهر في المرضى الذين يعانون من أدلة مناعية على عدوى Mtb السابقة27. بالإضافة إلى ذلك ، تم اقتراح مكونات Mtb المقتولة بالحرارة المستخدمة في نموذج PMU لتحفيز الاستجابات المناعية الكامنة وراء جوانب التهاب القزحية المتكرر في المرضى الذين يعانون من مرض السل العيني الذين يستجيبون للعلاج المضاد للسل (ATT)28. نظرا للاختلافات في بدء المرض ومسار الالتهاب عند مقارنته ب EAU و EIU ، تمثل PMU نموذجا حيوانيا جديدا لالتهاب القزحية لا يعتمد على التحصين بمستضدات العين وقد يساعد في توضيح آليات المرض لدى المرضى الذين يعانون من التهاب القزحية المزمن. يحدد هذا البروتوكول طرق توليد PMU ، ومراقبة المسار السريري للالتهابات ، وجمع عينات العين لتحليل ما بعد الوفاة مع قياس التدفق الخلوي.
Protocol
تمت الموافقة على جميع الإجراءات التي تم إجراؤها محليا من قبل لجنة رعاية واستخدام الحيوان في جامعة واشنطن (بروتوكول دراسة الحيوان # 4481-02) أو بالتوافق مع ترخيص وزارة الداخلية في المملكة المتحدة (PPL 30/3281) ومجموعة المراجعة الأخلاقية بجامعة بريستول. كانت التجارب التي أجريت في كلتا المؤسستين متوافقة مع بيان جمعية أبحاث الرؤية وطب العيون (ARVO) لاستخدام الحيوانات في أبحاث العيون والبصرية. تم إنشاء PMU في الفئران C57BL / 6J البالغة من العمر 6-10 أسابيع ؛ كان وزن جميع الفئران 18 جراما على الأقل في وقت تحريض التهاب القزحية وتم تأكيد سلبيتها لطفرة RD8 للجينCrb1 29. تم الحفاظ على الفئران مع تشاو القياسية والمياه الطبية (أسيتامينوفين 200-300 ملغم / كغم / يوم) حسب الليبيتوم في ظل ظروف محددة خالية من مسببات الأمراض. تم إجراء القتل الرحيم للحيوانات باستخدام طريقة استنشاق ثاني أكسيد الكربون القياسية30.
1. إعداد مستضد للحقن تحت الجلد
- نفذ جميع الإجراءات في هذا القسم داخل غطاء دخان كيميائي لمنع الاستنشاق أو ملامسة الجلد لمسحوق Mtb H37Ra. تعامل وفقا لسياساتك المؤسسية لمساعد فرويند الكامل (عادة BSL-1). يتضمن ذلك استخدام القفازات المقاومة للمواد الكيميائية ونظارات السلامة وملابس العمل الواقية (معطف المختبر).
- استخدم تقنية معقمة جيدة لمنع تلوث الكواشف التي سيتم إدخالها في التجارب.
- اصنع تعليق Mtb في PBS عن طريق خلط 5 ملغ من مسحوق M. tuberculosis H37Ra المجفف بالتجميد والمقاوم للحرارة مع 2.5 مل من PBS البارد في أنبوب طرد مركزي دقيق سعة 5 مل. دوامة مرة واحدة لمدة 30 ثانية ثم وضعها على الجليد.
- لتوليد تعليق جيد من H37Ra في PBS ، صوتنة التعليق على الجليد لمدة 5 دقائق.
- قم بفك جسم وحدة المحول وتنظيف المسبار بمسحة كحول بنسبة 70٪ (v / v).
- قم بتشغيل الصوتنة ، واضبط إعداد الطاقة على 4 عن طريق تدوير مقبض التحكم في الطاقة وغمر طرف المسبار في مسحوق المتفطرات المحتوي على PBS. تأكد من أن طرف المسبار مغمور بنصف عمق العينة على الأقل وأن طرف المسبار لا يلامس جدار أنبوب الطرد المركزي الدقيق.
- قم بتسخين الخليط على الثلج لمدة 30 ثانية ، وتوقف مؤقتا لمدة 30 ثانية وكرر لمدة 5 دقائق لتفريق المسحوق بالكامل في تعليق متساو دون تسخين السائل.
- أضف 2.5 مل من مساعد Freund's Incomplete إلى الخليط وكرر عملية الصوتنة على الثلج حتى يشكل المستحلب قواما يشبه معجون الأسنان.
- اضبط الطاقة على 0 باستخدام مقبض التحكم وأوقف تشغيل الوحدة لإنهاء الصوتنة. قم بإزالة الطرف من التعليق وامسح المسبار بمسحة كحول.
- قم بتخزين مستحلب المستضد في درجة حرارة 4 درجات مئوية. سيساعد عمل دفعات من المستحلب على ضمان الاتساق عبر التجارب. يمكن تخزين المستحلب في 4 درجات مئوية لمدة تصل إلى 3 أشهر.
2. الحقن تحت الجلد
- إجراء الحقن تحت الجلد قبل أسبوع من الحقن داخل الجسم الزجاجي (المحدد في اليوم -7).
- قم بتحميل حقنة سعة 1 مل (بدون إبرة) مع مستحلب المتفطرات. بسبب لزوجة وعتامة المستحلب ، يمكن لفقاعات الهواء التي يصعب رؤيتها أن تملأ المحقنة.
- لمنع فقاعات الهواء في المحقنة ، بعد تحميل 0.2-0.3 مل من المستحلب ، اقلب المحقنة (الطرف متجها لأعلى) واضغط برفق على المحقنة بشكل متكرر على حافة المنضدة لإحضار الفقاعات إلى السطح.
- طرد الهواء من المحقنة واستمر في ملء المحقنة. اقلب واضغط بشكل متقطع حتى تمتلئ.
- ضع إبرة 25 جم على المحقنة وقدم المستحلب لملء الإبرة. قم بتخزين المحقنة على الثلج حتى يتم استخدامها.
- لإجراء الحقن تحت الجلد بأمان ، إما تخدير الفأر أو استخدام أساليب ضبط النفس الإنسانية التي تسمح بسهولة الوصول إلى مؤخرة الحيوان31.
- لتخدير الحقن تحت الجلد ، ضع الحيوان في غرفة تحريض إيزوفلوران (3٪ -4٪ للتحريض و 1٪ -3٪ للصيانة). بمجرد التخدير ، تأكد من أن معدل تنفس الفأر بطيء ولا تظهر عليه أي علامات ضائقة تنفسية.
- ضع الحقن تحت الجلد إما على السطح الظهري للوركين ، أو على السطح البطني للساقين القريب من منطقة الغدد الليمفاوية الأربية.
- أدخل الإبرة بعناية لمنع الحقن في العضلات. حقن 0.05 مل من مستحلب Mtb في الفضاء تحت الجلد. لا تقم بإزالة الإبرة على الفور للسماح بحقن المستحلب السميك بالكامل.
- كرر الحقن على الجانبين الأيسر والأيمن لما مجموعه 0.1 مل لكل.
- إذا تم تخديرك ، ضع الماوس على وسادة تدفئة دافئة حتى الشفاء التام. لا تترك الماوس دون مراقبة حتى يستعيد وعيه الكافي للحفاظ على راقد القص.
- أعد الماوس إلى قفصه عند الشفاء التام وقم بتسمية بطاقة القفص بتاريخ الحقن تحت الجلد.
- توفير التسكين مع الأسيتامينوفين الفموي (200 ملغ / كغ / يوم) ، ولكن ليس مضادات الالتهاب غير الستيروئيدية كعوامل مضادة للالتهابات يمكن أن تؤثر على تحريض التهاب العنبية.
3. تحضير مخزون المستضد للحقن داخل الجسم الزجاجي
- تنفيذ جميع الإجراءات في هذا القسم في ظل ظروف معقمة مناسبة لمنع تلوث تعليق MTB داخل الجسم الزجاجي.
- جعل تعليق داخل الجسم الزجاجي.
- لتحريض التهاب العنبية الخفيف إلى المتوسط، اصنع المعلق داخل الجسم الزجاجي بتركيز 5 ملغ/مل بإضافة 5 ملغ من مستخلص المتفطرات إلى 1 مل من 1x PBS.
- لتحريض التهاب العنبية المعتدل إلى الشديد ، اجعل المعلق داخل الجسم الزجاجي بتركيز 10 مجم / مل بإضافة 10 مجم من مستخلص المتفطرات إلى 1 مل من 1x PBS.
- دوامة مرة واحدة لمدة 30 ثانية ثم وضعها على الجليد.
- لإنشاء تعليق جيد ل H37Ra في PBS ، صوتنة التعليق على الجليد لمدة 10 دقائق كما هو موضح في الخطوة 1.4. احصل على محلول المخزون هذا في أحجام 100 ميكرولتر وتخزينه عند -20 درجة مئوية.
- قبل الاستخدام ، قم بإذابة الثلج في درجة حرارة الغرفة والدوامة على ارتفاع لمدة 1 دقيقة. الحفاظ على القسمة على الجليد أثناء نقلها إلى منشأة الحيوان.
4. إجراء الحقن داخل الجسم الزجاجي في اليوم 0
- إعداد الحيوانات
- ارتد قفازات فحص مجهزة ، ضع الماوس على ميزان وزن للحصول على وزنه بالجرام.
- إعطاء حقنة داخل الصفاق من 0.02 مل / غرام من وزن الجسم من محلول يحتوي على 100 ملغ / مل الكيتامين و 20 ملغ / مل زيلازين مختلطة مع الماء المعقم لتخدير الحيوان. نهج بديل يشمل الحث باستخدام ~ 1.5٪ إيزوفلوران (استنشاق).
- انتظر حوالي 2 دقيقة حتى ينام الماوس ، ثم ضع الماوس في صندوق تدفئة وقم بتغطية الغطاء. قم بإجراء اختبارات منعكس الألم مثل قرصة الأذن وإصبع القدم والذيل لتقييم عمق التخدير للإجراء32.
- بمجرد النوم ، تخدير القرنية بقطرة واحدة من 0.5٪ (v / v) tetracaine. تجنب الحصول على tetracaine بالقرب من الأنف أو فم الماوس. بعد 10 ثوان ، ربت السائل الزائد.
ملاحظة: لقد لوحظ أن توسيع القزحية وتصور الغرفة الأمامية (AC) يتحسنان عند إعطاء التخدير الموضعي ، ربما بسبب تحسين قمع منعكس القرنية مع التخدير الجهازي والموضعي المشترك. ومع ذلك ، يمكن حذف هذه الخطوة إذا رغبت في ذلك. - توسيع التلميذ مع 1 قطرة من 2.5 ٪ (الخامس / الخامس) فينيليفرين. توخ الحذر لتجنب أي قطرات زائدة قد تدخل الأنف أو الفم. بعد 2-3 دقائق ، ربت السائل الزائد.
- لتقليل خطر التهاب باطن المقلة ، أضف 1 قطرة من 5٪ بيتادين إلى سطح العين والشعر المحيط. اتركيه على العين لمدة 2-3 دقائق.
ملاحظة: نفذ جميع الإجراءات في هذا القسم في ظل ظروف معقمة مناسبة لمنع التهاب باطن المقلة . - قم بإزالة البيتادين وقم بتغطية العين بهيدروكسي بروبيل ميثيل سيلوز (0.3٪) أو جل كاربومر للعين 0.2٪ وزن / وزن) لمنع الجفاف تحت التخدير. هذا سوف يساعد أيضا في منع تشكيل إعتام عدسة العين.
- إعداد نظام الحقن المجهري
- قم بإجراء الحقن داخل الجسم الزجاجي باستخدام مضخة دقيقة متصلة بجهاز تحكم في مضخة microsyringe وحقنة حقن (الشكل 1A-C). بدلا من ذلك ، قم بالحقن بإبرة 33 جم متصلة بحقنة هاملتون كما هو موضح في القسم الفرعي 4.4.
- قم بتوصيل إبرة 34 جم بحامل الحقن لتجميع الحاقن. قم بفك الغطاء اللولبي الفضي في الطرف الأمامي لحامل الحقن وحرك الإبرة في جسم الحامل في منتصف الطريق تقريبا. شد إصبع غطاء المسمار الفضي بإحكام.
- قم بتوصيل الأنبوب بحامل الحقن كما هو مذكور في الخطوات 4.2.4-4.2.5.
- لإدخال الأنبوب على حامل الحقن ، قم بفك المسمار البلاستيكي الموجود في الطرف الخلفي للحامل ، وحرك الأنبوب عبر الحشية بالداخل وأحكم ربط المسمار.
- حافظ على فجوة طفيفة مع نهاية الأنبوب لمنع تلف الأنابيب أثناء الحقن. ارجع إلى الشكل 1 ج.
- قم بإذابة 100 ميكرولتر من تعليق مخزون المتفطرة.
- أضف 3 ميكرولتر من محلول فلوريسئين الصوديوم 1٪ (AK-Fluor) ودوامة جيدا.
- قم بتحميل حقنة سعة 10 ميكرولتر بمزيج المستضد والفلوريسئين دون تضمين أي فقاعات هواء.
- قم بإزالة إبرة التحميل من المحقنة ، وحرك الأنبوب عبر حشية الغطاء اللولبي الفضي حتى يصل الطرف إلى علامة الصفر في جسم المحقنة.
- بمجرد محاذاة طرف الأنبوب بشكل صحيح إلى الموضع المطلوب ، أحكم ربط إصبع الغطاء اللولبي بإحكام.
- اغسل المحلول في المحقنة من خلال أنبوب الحقن لتحميل النظام بالكامل. ثم كرر الخطوات 4.2.8-4.2.11 لإعادة تحميل المحقنة للحقن.
- لتثبيت المحقنة المحملة على المضخة الصغيرة ، اضغط على زر تحرير المشبك في نهاية المضخة الصغيرة لفتح مشابك المحقنة.
- ضع غطاء المكبس في حامل غطاء المكبس في الطرف الخلفي للمضخة الدقيقة.
- ثم حرك طوق المحقنة على توقف الياقة وجسم المحقنة في مشبك المحقنة.
- حرر زر المشبك وشد برغي الاحتفاظ بالمكبس. ارجع إلى الشكل 1 د.
- حرك حامل الحقن والإبرة من خلال المشبك على جهاز الحقن التجسيمي. هذه منصة مخصصة. بدلا من ذلك ، يمكن حمل المحقنة ووضعها يدويا.
- اضبط حجم التسريب ومعدل حجم التسريب على وحدة التحكم في مضخة الحقن الدقيقة لحقن 500 نانولتر لكل دورة بمعدل 40 nL / s ، على التوالي.
ملاحظة: يمكن استخدام معدلات حقن أسرع ، ومع ذلك ، قد يكون هناك المزيد من الارتجاع قبل تحقيق إعادة وضع الإبرة. - اختبر النظام للتأكد من الأداء الصحيح قبل إجراء الحقن داخل الجسم الزجاجي.
ملاحظة: عندما يعمل نظام الحقن بشكل صحيح ، فإن تنشيط دورة الحقن باستخدام دواسة القدم أو وسادة التحكم سيؤدي إلى حركة مرئية لحامل غطاء المكبس وستظهر قطرة صغيرة من السائل الأخضر عند طرف الإبرة. في حالة عدم إنتاج أي سائل ، قم بتنشيط دورات إضافية أو شطف المحقنة وإعادة تحميلها. - قبل حقن العين ، امسح الإبرة برفق باستخدام وسادة إيثانول بنسبة 95٪.
- إجراء الحقن داخل الجسم الزجاجي
- يتم وضع الماوس على جهاز مجسم لإجراء عملية الحقن.
- حافظ على المسرح / المنصة التي يستقر عليها الماوس دافئة عن طريق إرفاق 2-3 مناشف ورقية على سطحه.
- ضع الماوس في وضع الانبطاح على المنصة. استخدم قضبان الأذن اليمنى واليسرى لإصلاح رأس الحيوان برفق. ارجع إلى الشكل 1 ه.
- ضع الماوس وتوجه تحت المنظار بحيث يكون الجانب الأنفي العلوي للعين اليمنى مرئيا.
- استخدم إبرة 30 جم لإزاحة الرموش وكشف الصلبة. تصور الحافة والأوعية الدموية الكعبرية.
- استخدم إبرة معقمة 30 جم لعمل ثقب توجيه في الصلبة 1-2 مم خلف الليمبوس.
- أدخل إبرة 34 G المرفقة بحامل الحقن في العين من خلال فتحة التوجيه بزاوية تتجنب العدسة ، ولكن ضع طرف الإبرة في التجويف الزجاجي.
- باستخدام وحدة التحكم في مضخة microsyringe ، قم بحقن 1 ميكرولتر بعناية من مستخلص Mtb في التجويف الزجاجي. في حالة الارتجاع المستمر ، قم بزيادة حجم الحقن إلى 1.5 ميكرولتر لضمان توصيل الجرعة الكافية.
ملاحظة: بالنسبة للضوابط الوهمية ، قم بحقن 1 ميكرولتر من PBS في عين الحيوان. - تحقق من وضع الجسم الزجاجي عن طريق تصور منعكس مخضر في العين. ارجع إلى الشكل 1F.
- بعد 10 ثوان ، اسحب الإبرة من العين. لاحظ أي ارتجاع.
- قم بإزالة الماوس من المنصة ، ضع 0.3٪ هيدروكسي بروبيل ميثيل سيلوز أو 0.2٪ وزن / وزن مرهم العين على كلتا العينين لحماية القرنية ، وانتقل إلى صندوق تسخين الاسترداد.
- لا تترك الماوس دون مراقبة حتى يستعيد وعيه الكافي للحفاظ على راقد القص. لا تعود إلى صحبة الحيوانات الأخرى حتى تتعافى تماما.
- عندما يكون الفأر مستيقظا تماما ، عد إلى القفص وأضف أسيتامينوفين (200-300 مجم / كجم / يوم) زجاجة ماء طبية. قم بتسمية بطاقة القفص بتاريخ حقن IVT.
- الحقن داخل الجسم الزجاجي جيد التحمل بشكل عام. تشمل العلامات السريرية التي قد تشير إلى الألم والحاجة إلى الإزالة من الدراسة الثعلبة حول العين (التي تشير إلى الصدمة الذاتية) ، وتقرح القرنية ، وفقدان الوزن ، والموقف المنحني.
- طريقة بديلة للحقن داخل الجسم الزجاجي
ملاحظة: يتم تنفيذ هذا الإجراء باستخدام مجهر التشغيل وإبرة 33 G على microsyringe.- قم بتحريك العين واحتفظ بها في موضعها باستخدام ملقط.
- ثم ضعي جل كاربومر للعين 0.2٪ وزن / وزن أو 0.3٪ جل للعين هيدروكسي بروبيل ميلوز وضعي غطاء دائري (قطر 7 مم) على العين.
- قم بتركيب إبرة تحت الجلد 33 جم على حقنة هاملتون سعة 5 ميكرولتر وأدخلها محيطية 2 مم تقريبا في طرف القرنية بزاوية حقن ~ 45 درجة.
- قم بتوجيه شطبة الإبرة إلى الجسم الزجاجي ، والتوقف بين العدسة والقرص البصري (من وجهة النظر النسبية للجراح ، هذا أعلى / يغطي القرص البصري - حوالي 1.5 مم من موقع الإدخال) ، وحقن 2 ميكرولتر من MTB (عند 2.5 ميكروغرام / ميكرولتر في برنامج تلفزيوني) ببطء.
- أمسك الإبرة في مكانها لفترة وجيزة (لتقليل كمية ارتداد الحقن) ثم قم بإزالتها.
- بعد الحقن ، قم بتخزين الكرة الأرضية عن طريق إطلاق الملقط. يمكن إعطاء قطرة من 1٪ وزن / وزن مرهم الكلورامفينيكول للعين في هذا الوقت لتوفير حماية إضافية من التهاب باطن المقلة بعد الحقن.
- بعد الحقن ، انتقل إلى مربع تسخين الاسترداد كما هو مذكور في الخطوات 4.3.11-4.3.13.
5. التصوير المقطعي المحوسب للكشف عن التهاب القزحية وقياسه
- إعداد الحيوانات
- تخدير الماوس كما هو موضح في الخطوات 4.1.2-4.1.4
- توسيع التلميذ مع 1 قطرة من 2.5 ٪ فينيليفرين. توخ الحذر لتجنب أي قطرات زائدة قد تدخل الأنف أو الفم. بعد 2-3 دقائق ، انزع السائل الزائد.
- ضع 0.3٪ هيدروكسي بروبيل ميثيل سيلوز أو 0.2٪ وزن / وزن جل كاربومر على العين لمنع الجفاف أثناء التخدير. هذا سوف يساعد أيضا على منع تشكيل إعتام عدسة العين.
- لف الماوس بطبقة من الشاش الجراحي للحفاظ على دفء الجسم وضعه على كاسيت الحيوانات. ضع الرأس مع شريط اللدغة.
- الحصول على صور OCT للغرف الأمامية والخلفية.
ملاحظة: في حالة الحصول على صور الغرفة الأمامية والخلفية ، احصل على صور الغرفة الخلفية (PC) أولا لمنع تدهور الصورة بعد تكوين إعتام عدسة العين. يمكن منع تكوين إعتام عدسة العين عن طريق التشحيم المتكرر وتطبيق 0.3٪ هيدروكسي بروبيل ميثيل سيلوز أو 0.2٪ وزن / وزن جل كاربومر. للتصوير الممتد (>10 دقائق) ، يساعد أيضا الحفاظ على دفء الماوس (من خلال استخدام وسادة حرارية).- بعد تشغيل نظام التصوير OCT ، قم بتأمين عدسة التصوير الصحيحة واضبط موضع الذراع المرجعي حسب الحاجة.
- افتح برنامج التصوير ، وقم بإنشاء معرف الماوس الفريد وابدأ التصوير وفقا لبروتوكول الشركة المصنعة ل OCT.
- باستخدام خيار Free Run مع بروتوكول المسح السريع ، ضع العين مع العصب البصري المتمركز على صور الغرفة الخلفية أو قمة القرنية على صور الغرفة الأمامية.
ملاحظة: يحتوي الجدول 1 على معلمات بروتوكول التصوير لنظامين متاحين تجاريا لتصوير الحيوانات الصغيرة. راجع جدول المواد لمعرفة مواصفات المنتج. - لتصوير الغرفة الخلفية ، اجعل OCT قريبا من سطح العين. توخ الحذر لتجنب ملامسة سطح العدسة للعين.
- بمجرد وضع العين بشكل صحيح ، أوقف الفحص السريع وحدد بروتوكول مسح وحدة التخزين ، وقم بتنشيط الفحص باستخدام خيار الهدف .
- بالنسبة لصور المقطع الخلفي، اضبط حتى يتمركز العصب البصري في صورة محاذاة B-Scan الأفقية ومحاذاة شبكية العين مع محور المحاذاة الرأسية
- بالنسبة لصور المقطع الأمامي، اضبط الموضع لتوسيط قمة القرنية في كل من صورة محاذاة B-Scan الأفقية وصورة محاذاة B-Scan للمحاذاة الرأسية. سيؤكد وجود قطعة أثرية انعكاسية في كلتا الصورتين المحاذاة الصحيحة. ثم قم بإزاحة الصورة الأفقية بما يكفي لإزالة قطعة الانعكاس. ارجع إلى الشكل 2.
- انقر فوق لقطة لالتقاط صورة مسح وحدة التخزين ثم انقر فوق حفظ.
- بعد ذلك ، احصل على متوسط مسح الخط المركزي. افتح بروتوكول الفحص وانقر على الهدف متبوعا بلقطة. انقر بزر الماوس الأيمن على نفس اللوحة ثم انقر فوق متوسط.
- كرر الخطوات 5.2.1-5.2.9 لكل عين بكلتا العدسات.
- بعد جمع جميع الصور، قم بإزالة الماوس من الدرج وتوفير حماية القرنية أثناء الاسترداد كما هو موضح في الخطوات 4.3.11-4.3.13.
6. تسجيل الالتهاب بواسطة OCT
- سجل صور OCT بمساعدة طلاب الصف الذين تم إخفاءهم لحالة العلاج.
ملاحظة: بالنسبة لوحدة PMU في طراز الماوس ، يوصى باستخدام نظام التسجيل المتوفر في الجدول 2 . - إذا تم الحصول على كل من صور الغرفة الأمامية (AC) والغرفة الخلفية (PC) ، فقم بدمج هذه الدرجات للحصول على النتيجة النهائية لكل عين.
ملاحظة: يزول التهاب الغرفة الأمامية قبل التهاب الغرفة الخلفية.
7. تسجيل الالتهاب عن طريق الأنسجة بعد الوفاة
- في نهاية التجربة ، اجمع العيون الفردية عن طريق الاستئصال ، وقم بإصلاح 4٪ من الفورمالديهايد بين عشية وضحاها ، وتابع تضمين البارافين ، والتقسيم ، وتلطيخ H&E33.
ملاحظة: يوصى بأقسام متعددة 4-8 ميكرومتر على طول محور العصب الحدقة البصري.
ملاحظة: يتم تسجيل ثلاثة أقسام لكل عين بواسطة ممهد مقنع باستخدام نظام التسجيل المقدم في الجدول 3 ، ويتم الإبلاغ عن متوسط درجات الأقسام الثلاثة كدرجة التهاب الأنسجة النهائية.
النتائج
يوضح هذا البروتوكول تحريض التهاب القزحية في الفئران باستخدام نموذج التهاب القزحية الفطري (PMU). يعد ضمان الاتساق في الحقن تحت الجلد ودقة الحقن داخل الجسم الزجاجي من الخطوات الرئيسية في تطوير نموذج التهاب العنبية المتفطر (PMU). يوضح الشكل 1 إجراء الحقن داخل الجسم الزجاجي للفأر باستخدام جهاز مجسم. تساعد قضبان الأذن على وضع الرأس برفق في نفس المكان تحت المجهر (الشكل 1E). كما أنها تحافظ على استقرار الرأس أثناء إجراء الحقن داخل الجسم الزجاجي ، مما يقلل من خطر صدمة الحقن. بعد الحقن الناجح ، ينتج الفلوريسئين في محلول الحقن انعكاسا أخضر من داخل العين يمكن رؤيته تحت المجهر أو من منظر جانبي كما هو موضح في الشكل 1F.
عند إجراء البروتوكول على النحو المبين ، يولد التهاب العنبية الحاد القوي الذي يمكن اكتشافه باستخدام التصوير المقطعي المحوسب وقاع العين في وقت مبكر بعد 10 ساعات من الحقن داخل الجسم الزجاجي. يوضح الشكل 2 المحاذاة الصحيحة للعين لتصوير OCT. يسرد الجدول 1A المعلمات المستخدمة في بروتوكول OCT. سيوفر النهج المنهجي للحصول على الصور صورا عالية الجودة يمكن مقارنتها بمرور الوقت. تتمركز صور الغرفة الأمامية على قمة القرنية باستخدام صورة SLO للوجه (الشكل 2 أ) مع محاذاة القزحية بالتوازي مع كل من المستويين الأفقي والرأسي (الشكل 2 ب ، ج). يتم التقاط عمليات مسح الحجم والخط بمحاذاة رأسية بحيث يمكن عرض المناطق السفلية والعليا في وقت واحد. تتركز صور المقطع الخلفي على العصب البصري باستخدام صورة SLO للوجه (الشكل 2D) ، ويتم استخدام النطاق الساطع ل RPE لمحاذاة شبكية العين بالتوازي مع المستويين الأفقي والرأسي (الشكل 2E ، F).
يوضح الشكل 3 النتائج النموذجية لالتهاب العين PMU باستخدام التصوير OCT. بعد أربع وعشرين ساعة من الحقن داخل الجسم الزجاجي ، تظهر الخلايا الالتهابية في الماء والجسم الزجاجي (الشكل 3 ب). في وجود التهاب معتدل أو شديد ، سيظهر hypopyon في الزاوية السفلية في AC. يمكن تسجيل درجة التهاب العين على صور OCT هذه باستخدام المعايير المدرجة في الجدول 2. يوضح الشكل 4 أمثلة تمثيلية للصور التي توضح السمات الالتهابية النموذجية لكل درجة. يمكن إضافة درجات غرفة AC و PC معا لإنشاء درجة OCT المجمعة. تمثل الدرجات المجمعة >0 ولكن ≤2.5 التهابا خفيفا. يتم تحديد الالتهاب المعتدل من خلال الدرجات >2.5 ولكن ≤4.5. تحدد الدرجات >4.5 الالتهاب الشديد. يبلغ الالتهاب ذروته عادة بعد 48 ساعة من الحقن داخل الجسم الزجاجي مع درجات OCT في AC و PC بين 1 و 3 (الدرجات المجمعة بين 2 و 6). درجات AC و PC من 0.5 أو 4 أقل شيوعا. في حالة مواجهة درجات خارج النطاق النموذجي بشكل متكرر ، قد تكون هناك حاجة لاستكشاف الأخطاء وإصلاحها لتحديد العوامل التي تساهم في الدرجات المتطرفة (انظر قسم المناقشة). تميل درجات الالتهاب في الغرفة الأمامية إلى العودة إلى الصفر في غضون أسبوع واحد بعد الحقن داخل الجسم الزجاجي. في المقابل ، لا تعود الدرجات الخلفية إلى الصفر. بدلا من ذلك ، يستمر الالتهاب المزمن منخفض المستوى في شكل التهاب الزجاجية ، وتتسلل الخلايا الليمفاوية المحيطة بالأوعية الدموية إلى شبكية العين لمدة 1-2 أشهر بعد الحقن داخل الجسم الزجاجي.
يمكن أيضا تحديد درجة الالتهاب في PMU باستخدام الأنسجة. يوضح الشكل 5 أقسام H&E التمثيلية لاستخدامها في تسجيل شدة PMU بواسطة الأنسجة. يتم حساب عدد الخلايا الالتهابية في الماء والجسم الزجاجي واستخدامها لتحديد شدتها باستخدام معايير النتيجة المدرجة في الجدول 3. عادة ما يظهر تسلل الخلايا الالتهابية للجسم الهدبي على جانب واحد من قسم الأنسجة (تورط أحادي الجانب) في التهاب خفيف أو معتدل. عندما يكون الالتهاب شديدا ، ينعكس ذلك من خلال وجود تسلل خلية التهابية في الجسم الهدبي على جانبي العدسة (تسمى المشاركة الثنائية). خلال النقاط الزمنية اللاحقة بعد الحقن داخل الجسم الزجاجي ، يمكن أيضا تحديد مظاهر الالتهاب المزمن ، بما في ذلك وجود كريات الدم البيضاء حول الأوعية الدموية وداخل الشبكية وطيات الشبكية الخارجية. يمكن أن يكون علم الأنسجة مفيدا أيضا في تحديد العيون المتأثرة بتقنيات الحقن السيئة. يمكن التعرف على صدمة العدسة أثناء الحقن داخل الجسم الزجاجي من خلال وجود بروتينات عدسة غير متبلورة باليوزين (وردية) خارج كبسولة العدسة المجاورة لمنطقة الصدمة. سيؤدي ارتجاع mTB داخل الجسم الزجاجي إلى الفضاء تحت الملتحمة إلى حدوث التهاب خارج العين يمكن تحديده من خلال مراجعة دقيقة للهياكل المحيطة بالعين الموجودة على الأقسام. بسبب الفشل في الاحتفاظ بمستخلص mTB داخل العينين ، عادة ما يكون لهذه العيون درجات منخفضة من التهاب OCT.
يمكن أيضا استخدام تصوير قاع العين في برايتفيلد لتحديد الجوانب ذات الصلة سريريا ل PMU ، بما في ذلك تطور نقص البويون والتهاب الزجاجية وتسلل الخلايا الالتهابية في شبكية العين أو حول الأوعية الدموية. يوضح الشكل 6 مثالين حيث يمكن رؤية التهاب الشبكية وحول الأوعية الدموية في صور قاع العين. تظهر هاتان العينان أيضا نطاق الالتهاب الشائع في نموذج PMU. يسرد الجدول 1B المعلمات المستخدمة في نظام تصوير OCT القاع / الشبكية. لاحظ تأثير الالتهاب الشديد على جودة الصورة (الشكل 6 ، اليوم 2 ، صور OCT وقاع العين في الصف العلوي) ومدى المرض الموجود في اليوم 21. يمكن أن تقلل وذمة القرنية أيضا من جودة الصورة أثناء الالتهاب الحاد. ومع ذلك ، فمن غير المألوف أن تكون وذمة القرنية شديدة من الالتهاب وحده. بشكل أكثر شيوعا ، ستتدهور جودة الصورة بسبب الضرر الظهاري الناتج عن الحماية غير الكاملة للسطح أثناء أحداث التصوير والتخدير.
يمكن استخدام نموذج PMU للحث على التهاب القزحية في أي سلالة أو نمط وراثي للفئران. في العيون البيضاء ، لا يزال من الممكن استخدام OCT لتسجيل الالتهاب ، لكن عدم وجود صبغة قاع العين يجعل تصور الالتهاب صعبا عن طريق التصوير الساطع13,34. يمكن إجراء دراسات ما بعد الوفاة على أنسجة العين أو الغدد الليمفاوية الإقليمية أو الطحال. تتضمن بعض الأمثلة فحوصات وجود الخلايا المناعية مثل قياس التدفق الخلوي والكيمياء الهيستولوجية المناعية وقياس السيتوكينات الالتهابية. في جميع النقاط الزمنية التي تم اختبارها بعد بدء الالتهاب باستخدام PMU (اليوم 1 إلى اليوم 56) ، توجد خلايا التهابية CD45 + كافية في العيون الفردية للكشف عن العديد من مجموعات كريات الدم البيضاء الرئيسية في العين عن طريق تحليل التدفق متعدد المعلمات12,35. يمكن جمع الأخلاط المائية (2-5 ميكرولتر) والجسم الزجاجي (5-10 ميكرولتر) من العيون الملتهبة لتحديد تركيز البروتين أو الدراسات البروتينية أو تحديد تركيز السيتوكين36.

الشكل 1: إعداد حقن الفأر داخل الجسم الزجاجي. يتم إجراء الحقن داخل الجسم الزجاجي على عين الفأر باستخدام (A) وحدة تحكم في مضخة microsyringe متصلة ب (B) Micropump و (C) حقنة حقن. يتم تحميل المحقنة وتركيبها على المضخة الدقيقة (D). يتم وضع رأس الماوس باستخدام قضبان الأذن (E) لضمان الاستقرار والاتساق أثناء إجراء الحقن داخل الجسم الزجاجي. (و) ينتج الفلوريسئين الموجود في محلول الحقن انعكاسا أخضر من داخل العين بعد إجراء ناجح. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
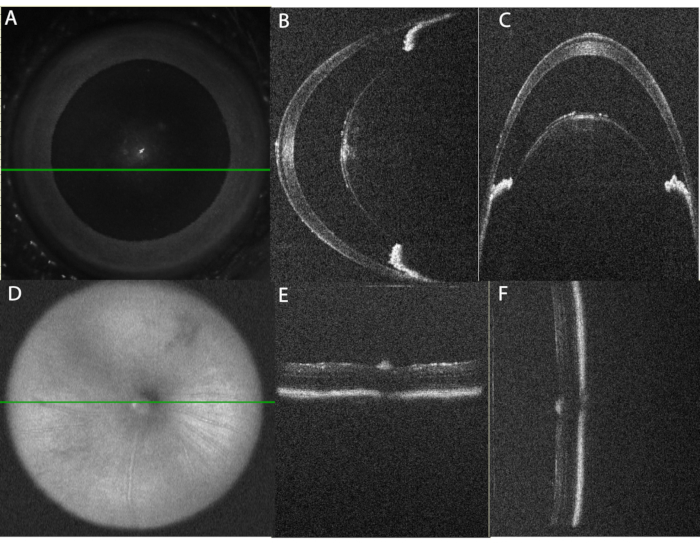
الشكل 2: المحاذاة الصحيحة للعين لتصوير OCT . (أ) باستخدام صورة منظار العين بالليزر (SLO) للمسح الضوئي للوجه ، يتم توسيط العين لتصوير الغرفة الأمامية. يشير الخط الأخضر إلى موضع مسح الخط الأفقي الموضح في اللوحة (B). لاحظ أنه يتم تجنب القرنية المركزية لتقليل انعكاس القطعة الأثرية. (ج) المسح الرأسي B-Scan من خلال الغرفة الأمامية شبه المركزية. يتم الحصول على هذا الفحص بزاوية 90 درجة من المسح الأفقي. لاحظ أن محاذاة أقسام القزحية على كل جانب من جوانب العدسة تكون مستوية في المسح الأفقي (اللوحة B) ومرتبة واحدة فوق الأخرى في المسح الرأسي (اللوحة C). (د) باستخدام صورة SLO ، تتمركز صورة الغرفة الخلفية على العصب البصري. (ه) محاذاة المسح B-scan الأفقية، (F) محاذاة المسح B-scan العمودية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
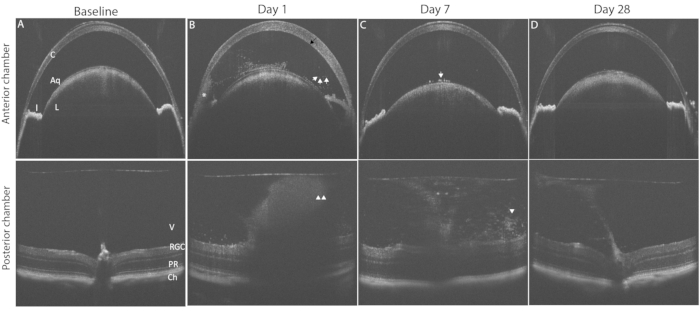
الشكل 3: يؤدي تحريض PMU إلى التهاب العنبية الذي يمكن مراقبته عن طريق التصوير المقطعي المحوسب الطولي. يظهر الصف العلوي الغرفة الأمامية (AC) ؛ يعرض الصف السفلي صور OCT للغرفة الخلفية (PC) لتسليط الضوء على التغيرات المرضية في مسار المرض. (A) صورة OCT الأساسية للتيار المتردد (أعلى) والكمبيوتر الشخصي (أسفل) قبل تحريض التهاب العنبية، وكلاهما يسجل 0. (ب) اليوم 1 بعد الحقن داخل الجسم الزجاجي يظهر وجود وذمة القرنية (السهم الأسود) ، ونقص في البويون (*) خلايا التهابية متعددة حرة عائمة في التيار المتردد (الأسهم البيضاء) ، والتهاب الزجاج (رؤوس الأسهم البيضاء) في جهاز الكمبيوتر. (ج) اليوم 7 بعد الحقن داخل الجسم الزجاجي مع عدد قليل من خلايا التيار المتردد على كبسولة العدسة الأمامية (السهم الأبيض) وانخفاض التهاب الجسم الزجاجي (رأس السهم الأبيض). (د) اليوم 28 بعد الحقن داخل الجسم الزجاجي الغرفة الأمامية مع التهاب AC حل والتهاب الزجاجية خفيف. الاختصارات: C- القرنية ، L - العدسة ، I - القزحية ، Aq - المائي ، V الجسم الزجاجي ، RGC - خلايا العقدة الشبكية ، PR - المستقبلات الضوئية ، Ch- المشيمية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 4: أمثلة على درجات OCT. يتم تعيين درجة OCT بين 0 و 4 لكل صورة AC وصورة كمبيوتر باستخدام النظام الفئوي الموضح في الجدول 2. يتم الجمع بين درجات AC و PC للحصول على درجة OCT النهائية للعين. (أ، د) أمثلة على درجة صفر. (ب، ه) أمثلة على درجة 0.5. (ج، واو) أمثلة على درجة 1. (ز، ي) أمثلة على درجة 2. (ح، ك) أمثلة على درجة 3. (ط، ل) يتم عرض أمثلة على درجة 4 في اللوحتين I و L. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
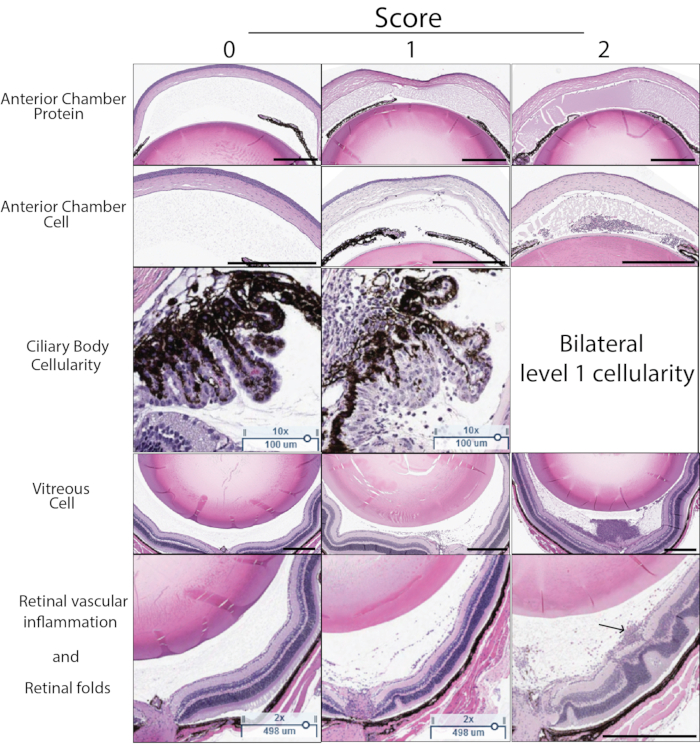
الشكل 5: أمثلة على درجات الأنسجة. يتم تحديد درجة الأنسجة بناء على خمس خصائص مرئية في أقسام H&E: كثافة بروتين الغرفة الأمامية ، وعدد خلايا الغرفة الأمامية ، وتسلل الخلايا المناعية للجسم الهدبي ، وكثافة الخلايا الزجاجية ، والتهاب الأوعية الدموية في شبكية العين ، والتغيرات الهيكلية في شبكية العين. يتم تعيين درجة 0-2 لكل خاصية. تم العثور على وصف لكل درجة في الجدول 3. يتم عرض درجة مثال تمثيلي من 0-2 لكل خاصية في هذا الشكل. يوضح العمود الأيسر درجة الصفر. يعرض العمود الأوسط أمثلة على النتيجة 1. يعرض العمود الأيمن أمثلة على النتيجة 2. يتم تعيين درجة 2 لدرجة الجسم الهدبي إذا كان الجسم الهدبي على جانبي العدسة في نفس القسم يوضح التهابا خلويا. درجة الأنسجة النهائية هي مجموع النتيجة لكل معيار من المعايير الخمسة (الحد الأقصى للدرجة 10). يشير السهم الموجود في اللوحة اليمنى السفلية إلى كريات الدم البيضاء المحيطة بالأوعية الدموية المرتبطة بوعاء شبكي سطحي. يشير شريط المقياس الأسود إلى 500 ميكرومتر. تشير قضبان المقياس الهدبي إلى 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
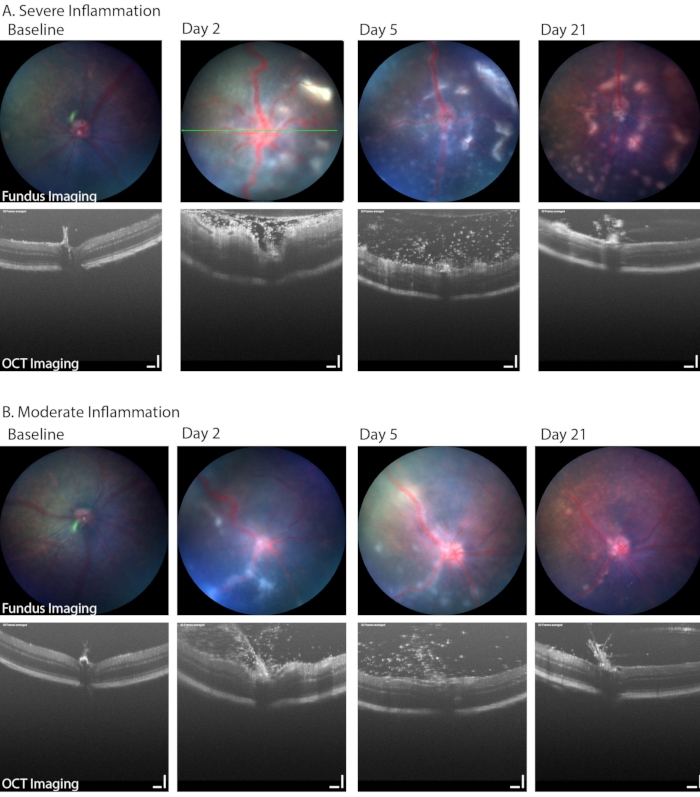
الشكل 6: حدد تصوير قاع العين الطولي في PMU مجموعة من شدة المرض. (أ) تظهر العيون الملتهبة بشدة ارتشاحات بيضاء متعددة في شبكية العين وتعرج الأوعية الدموية في تصوير قاع العين الملون (الصف العلوي) بالإضافة إلى التهاب الجسم الزجاجي الكثيف وذمة الشبكية في OCT (الصف السفلي) في اليوم 2. يمكن ملاحظة التقدم في عدد آفات الشبكية بمرور الوقت بينما يتحسن التهاب الزجاج. يشير الخط الأخضر إلى موضع صورة OCT. (ب) تظهر العيون الملتهبة بشكل معتدل آفات خطية أقل وأكثر تفرقا في قاع العين، وعدد من الخلايا المتسللة في الحيز الزجاجي. شريط المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
| A | |||
| غرفة الماوس الأمامية | مسح سريع | وحدة التخزين الضوئي | المسح الخطي |
| الطول × العرض | 4.0 مم × 4.0 مم | 3.6 مم × 3.6 مم | 3.6 ملم |
| زاوية | 0 | 90 | 90 |
| أ-سكان/ب-مسح | 800 | 1000 | 1000 |
| # ب بالمسح الضوئي | 50 | 400 | 1 |
| إطارات / B-المسح الضوئي | 1 | 3 | 20 |
| غرفة الماوس الخلفية | مسح سريع | وحدة التخزين الضوئي | المسح الخطي |
| الطول × العرض | 1.6 مم × 1.6 مم | 1.6 مم × 1.6 مم | 1.6 ملم |
| زاوية | 0 | 0 | 0 |
| أ-سكان/ب-مسح | 800 | 1000 | 1000 |
| # ب بالمسح الضوئي | 50 | 200 | 1 |
| إطارات / B-المسح الضوئي | 1 | 3 | 20 |
| B | |||
| غرفة الماوس الخلفية | وحدة التخزين الضوئي | المسح الخطي | |
| الطول × العرض | 0.9 مم × 0.9 مم | 1.8 ملم | |
| زاوية | 0 | أي (عادة 0 أو 90) | |
| أ-سكان/ب-مسح | 1024 | 1024 | |
| # ب بالمسح الضوئي | 512 | 1 | |
| إطارات / B-المسح الضوئي | 1 | 30 |
الجدول 1: معلمات المسح. (أ) معلمات المسح الضوئي OCT. (ب) معلمات فحص قاع العين / الشبكية OCT
| أوصاف نقاط OCT | ||||||
| نقاط | الغرفة الأمامية | الغرفة الخلفية | ||||
| غير متوفر | لا رؤية خارج القرنية الأمامية | لا يوجد منظر للجزء الخلفي | ||||
| 0 | لا التهاب | لا التهاب | ||||
| 0.5 | 1-5 خلايا في الماء | خلايا قليلة تشغل أقل من 10٪ من المنطقة الزجاجية | ||||
| أو وذمة القرنية | لا تسلل تحت الشبكية أو داخل الشبكية أو اضطراب في بنية الشبكية | |||||
| 1 | 6-20 خلية في الماء | خلايا منتشرة (بدون كتل كثيفة) تحتل ما بين 10 و 50٪ من المساحة الزجاجية. | ||||
| أو طبقة واحدة من الخلايا على كبسولة العدسة الأمامية | لا تسلل تحت الشبكية أو داخل الشبكية أو اضطراب في بنية الشبكية | |||||
| 2 | 20-100 خلية في الماء | خلايا منتشرة (بدون كتل كثيفة) تحتل > 50٪ من المنطقة الزجاجية | ||||
| أو أقل من 20 خلية ونقص في الصوت | لا تسلل تحت الشبكية أو داخل الشبكية أو اضطراب في بنية الشبكية | |||||
| 3 | 20-100 خلية في الماء | خلايا منتشرة تساوي الصف 2 و 1 | ||||
| و hypopyon أو غشاء حدقة | و عتامة زجاجية كثيفة واحدة على الأقل تشغل 10٪ -20٪ من المنطقة الزجاجية أو وجود خلايا زجاجية تساوي الدرجة 2 وعتامة نادرة (≤ 2) تحت الشبكية أو عتامة الشبكية | |||||
| 4 | أي عدد من الخلايا المائية | عتامة الجسم الزجاجي الكثيفة تحتل > 20٪ من المساحة الزجاجية. | ||||
| و نقص كبير في ضغط العين وغشاء حدقة العين أو فقدان البنية الأمامية بسبب التهاب شديد | أو الخلايا الزجاجية المنتشرة ذات العتامة الكبيرة تحت الشبكية أو داخل الشبكية | |||||
الجدول 2: معايير درجة OCT بجامعة الأمير محمد بن فهد: يتم تسجيل صور OCT وفقا للمعايير المدرجة في الجدول. تتم إضافة درجات AC و PC للحصول على النتيجة النهائية للعين. في الحالات التي لم يتم فيها الحصول على رؤية واضحة للعين ، تم تعيين درجة NA للصور ، وتم استبعادها من الدراسة.
| وصف درجة الأنسجة | |||
| نوعي | 0 | 1 | 2 |
| بروتين الغرفة الأمامية (AC) | جزيئات خلوية ضئيلة تلطيخ مع يوزين في AC | تلطيخ يوزين معتدل ، ولكن ليس متقاربا ، خارج الخلية في أي مكان في مكيف الهواء | تلطيخ يوزين خارج الخلية المتلاهي أو شبه المتلاحم في جميع أنحاء مكيف الهواء |
| خلية الغرفة الأمامية (AC) | لا توجد خلايا | 1-100 خلية ، ولكن لا توجد تجمعات كثيفة من الخلايا | >100 خلية ، أو تجمعات كثيفة من الخلايا |
| التهاب الجسم الهدبي | لا تسلل الكريات البيض من الجسم الهدبي أو الجسم الزجاجي المحيط | وجود أحادي الجانب من الكريات البيض التسلل إلى الجسم الهدبي و / أو الجسم الزجاجي المحيط. | وجود ثنائي من الكريات البيض التسلل الجسم الهدبي و / أو الجسم الزجاجي المحيط. |
| التهاب الأوعية الدموية في شبكية العين | لا الأوعية الشبكية مع الكريات البيض حول الأوعية الدموية | وعاء واحد لكل قسم مع كريات الدم البيضاء المحيطة بالأوعية الدموية | >1 وعاء لكل قسم مع كريات الدم البيضاء المحيطة بالأوعية الدموية |
| طية الشبكية أو تلفها | لا يوجد تلف في الشبكية | 1-3 طيات شبكية لكل قسم | >3 طيات شبكية لكل قسم ، أو أي تدمير آخر لطبقة الشبكية أو نزيف داخل الشبكية |
الجدول 3: معايير درجة الأنسجة بجامعة الأمير محمد بن فهد: تم تسجيل أقسام H&E من العين بناء على المعايير المدرجة في الجدول. تم تسجيل ثلاثة أقسام من نفس العين ومتوسطها للحصول على النتيجة النهائية للأنسجة للعين.
Discussion
لعبت النماذج الحيوانية لالتهاب العنبية دورا أساسيا في فهم آليات التهاب العين والتوازن بالإضافة إلى تمكين التقييم قبل السريري للعلاجات الطبية والجراحية لمرضى التهاب العنبية37. أثبتت كل من متغيرات الأرانب والجرذان لنموذج PMU قيمتها في العلاج قبل السريري من خلال إثبات دراسات المفهوم38،39،40. نظرا لتوافر مجموعة متنوعة من السلالات المعدلة وراثيا في الفئران ، فإن إنشاء نظام نموذج PMU للفأر يسمح الآن بإجراء دراسات ميكانيكية أكثر تفصيلا لتحديد أنواع معينة من الخلايا والمسارات والجينات التي تساهم في أمراض هذا المرض.
يمكن أن تظهر النماذج الحيوانية لالتهاب العنبية التباين من إلى في حدوث الالتهابوشدته 41. في سلالة الماوس C57BL / 6 ، يتم إنشاء PMU بشكل موثوق باستخدام البروتوكول الموضح هنا. تم الإبلاغ عن اختلافات خاصة بالسلالة في مسار التهاب القزحية وشدته لكل من EAU و EIU42,43. في حين أن التأثيرات الخاصة بالسلالة على شدة ومسار PMU لم يتم قياسها تجريبيا ، فقد تم استخدام هذا النموذج في النوع البري C57BL / 6J وكذلك في الفئران البيضاء (B6 (Cg) -Tyrc-2J / J) وأنتج استجابات التهابية مماثلة. عند إنشاء نموذج PMU، يمكن أن يساعد التحكم في الاعتبارات المذكورة أدناه الباحثين الجدد على الحد من التباين وإنتاج التهاب العنبية الأكثر اتساقا وقابلية للتكرار.
ضمان الاتساق في الحقن تحت الجلد:
لتوفير حقن متسق تحت الجلد ، تأكد من إزالة جميع فقاعات الهواء من المستحلب. تشمل الاعتبارات جهاز طرد مركزي قصير (30 ثانية عند 400 × جم) من المستحلب الجاهز قبل تحميل المحقنة. سيؤدي ذلك إلى إزالة الهواء المحبوس في المستحلب. أيضا ، عند تحميل المحقنة ، قم بعكس (تلميح) بشكل دوري واضغط على المحقنة لإزالة أي فقاعات هواء. أثناء الحقن ، لا تضع المحقنة عميقا جدا لتجنب الحقن العضلي. على العكس من ذلك ، يمكن أن يؤدي الحقن الضحل (داخل الأدمة) إلى تآكل المستحلب عبر الجلد. تذكر أن تتوقف لفترة وجيزة قبل إزالة المحقنة من موقع الحقن لضمان الحقن الكامل للمستحلب اللزج السميك ولمنع الارتجاع من الجلد.
بعد سبعة أيام من وضع الحقن تحت الجلد ، تأكد من وجود عقيدات واضحة على جانبي الساقين الخلفيتين. إذا لم يتم تحديد العقيدات ، فمن الممكن أن يكون الهواء قد تم حقنه بدلا من المستحلب. في هذه الحالة ، قد لا يكون الالتهاب الحاد قويا ، وقد لا يتطور الالتهاب المزمن.
منع تطور التهاب باطن المقلة المعدية:
سوف يولد التهاب باطن المقلة البكتيري أو الفطري متغيرا مربكا إذا لم يتم منعه44. من أجل منع التهاب باطن المقلة الجرثومي ، مارس دائما تقنية معقمة جيدة عند إجراء التعليق داخل الجسم الزجاجي ، والتعامل ، وتنظيف جميع الأدوات القابلة لإعادة الاستخدام التي ستتلامس مع العين. من المهم استخدام العناصر المعقمة ذات الاستخدام الواحد أو التعقيم أو التنظيف باستخدام 95٪ من الغسول أو المناديل الكحولية. الاستخدام المناسب للبيتادين المطبق على سطح العين والأغطية والفراء حول العين سيساعد أيضا في منع التهاب باطن المقلة45. من السهل التعرف على العين المصابة بالعدوى حيث سيتم طمس هياكل العين بسبب الالتهاب الشديد أثناء دورة ما بعد الحقن. هذا ليس نموذجيا لجامعة الأمير محمد بن فهد. يمكن أن يشير وجود نزيف داخل العين أيضا إلى التهاب باطن المقلة أو صدمة من الحقن. في مثل هذه الحالات ، استبعد هذه الحيوانات من الدراسة.
ضمان الاتساق في الحقن داخل الجسم الزجاجي:
يعد الحقن داخل الجسم الزجاجي خطوة حاسمة في تحريض الالتهاب الموثوق به والقابل للتكرار في PMU. إن توفير كمية ثابتة من تعليق Mtb مع كل حقنة ، وتجنب الصدمات ، ومنع ارتداد التعليق كلها عوامل يجب مراعاتها عند إجراء الحقن. لضمان تعليق ثابت ، قم بتدوير تعليق المخزون جيدا عند الذوبان وقبل تحميله في المحقنة. نظرا لأن مستخلص Mtb المستخدم لا يشكل حلا ، يمكن أن يخضع التعليق للترسيب بمرور الوقت. لضمان تركيز موحد لمستخلص Mtb في كل حقنة ، استخدم أو طرد وإعادة تحميل المحقنة في غضون 15 دقيقة من التحميل. يستخدم فينيليفرين للتوسع لتوفير مجال رؤية أكبر للعين الخلفية وتقليل خطر حدوث صدمة للعين أثناء الحقن. يولد هذا الانخفاض تراجعا طبيعيا للغطاء وبروبتوزا طفيفا للكرة الأرضية ، مما يسمح بتصور جيد للمنطقة الخلفية 1-2 مم إلى الحافة دون الحاجة إلى إمساك العين بالملقط. يمكن أن يؤدي استخدام الملقط لتقييد العين إلى حدوث صدمة محتملة وزيادة ضغط العين بشكل عابر وخطر ارتجاع تعليق MTB. يمكن أن تحدث الصدمة أيضا بسبب محاولة حقن الكثير من الحجم في العين. يقتصر حجم الحقن على 2 ميكرولتر لمنع الارتفاع الكبير والمطول لضغط العين والصدمات في العين. بالإضافة إلى ذلك ، سيكون للحيوانات الأصغر سنا عيون أصغر من الفئران البالغة. عادة ما توفر الفئران التي تتراوح مدتها بين 6 و 8 أسابيع (20-25 جم) حجما موحدا للعين وتضمن اتساقا أكبر في الالتهاب بعد حقن MTB. لوحظ تواتر أعلى من ارتداد ما بعد الحقن من تعليق المتفطرات في الفئران الأصغر. وهذا بدوره يؤدي إلى التهاب حاد أقل من المتوقع. يتم استخدام محلول الفلوريسئين المخفف لتزويد الحاقن المبتدئ بملاحظات بصرية حول نجاح تقنية الحقن الخاصة بهم. سيسمح التمدد في وقت الحقن بالتصور المباشر للمادة المحقونة في التجويف الزجاجي وفرصة ملاحظة أي دليل على صدمة العدسة. في حالة صدمة العدسة ، يمكن أن يتسبب ذلك في تغيير وضوح العدسة الذي سيؤدي إلى إعتام عدسة العين الذي يمكن تصوره في OCT. في حالة صدمة العين ، يجب استبعاد العينين من الدراسة بسبب احتمال الإصابة بالتهاب القزحية46 الناجم عن العدسة. نوصي بالتوقف لمدة 10 ثوان قبل إزالة المحقنة من العين للسماح بتشتت تعليق Mtb داخل العين وتقليل الارتجاع.
يمكن تعديل نموذج PMU لتغيير شدة الالتهاب الحاد عن طريق تغيير تركيز Mtb في الحقن داخل الجسم الزجاجي. تم اختبار جرعات مختلفة تتراوح من 2.5 ميكروغرام / ميكرولتر إلى 15 ميكروغرام / ميكرولتر سابقا في مختبرنا. ومع ذلك ، تم العثور على جرعات أعلى من 10 ميكروغرام / ميكرولتر تسبب تلفا شديدا للعين ، بما في ذلك تمزق العدسة التلقائي ، وذمة القرنية الشديدة والتندب ، و hyphema. هذه الدرجة من الشدة ليست نموذجية في المرضى الذين يعانون من التهاب القزحية بعد العدوى ، وبالتالي ، لا ينصح بهذه التركيزات. تم العثور على جرعة 5 ميكروغرام / ميكرولتر لإنتاج التهاب حاد خفيف إلى معتدل والتهاب العنبية المزمن الخفيف. تنتج جرعة 10 ميكروغرام / ميكرولتر مرضا حادا معتدلا إلى شديدا ومرضا مزمنا أكثر بروزا. وبالتالي ، فإن تغيير التركيز داخل الجسم الزجاجي يمكن أن يوفر شدة مرض بديلة للاستخدام حسب الحاجة بناء على السؤال التجريبي. يجب اختيار الضوابط للتأكد من أن النتائج ناتجة عن الاستجابة ل mTB وليس الصدمة المرتبطة بالحقن تحت الجلد أو داخل الجسم الزجاجي. في ضوابط الحقن الوهمية ، يمكن استخدام PBS بدلا من مستخلص mTB. بالنسبة للمقارنات مع الحيوانات غير المعرضة ، يجب اعتبار العينات الساذجة الحقيقية لأن عيون الزملاء ليست متكافئة دائما.
نظرا لصغر حجم عين الفأر ، يمكن أن يكون OCT مقايسة أكثر حساسية للكشف عن الالتهاب في الغرفة الأمامية من التصور المباشر أو التصوير المجهري للمجال الساطع. حدد العمل السابق مع PMU في الفئران25 أنه يمكن اكتشاف المزيد من الخلايا عن طريق الأنسجة أكثر من OCT ولكن هناك علاقة جيدة بين الطريقتين. OCT لديه ميزة إضافية أنه يمكن استخدامه لمراقبة الالتهاب طوليا في نفس الحيوان. كما استخدمت نماذج الفئران الرئيسية الأخرى لالتهاب القزحية ، مثل EAU و EIU ، OCT للتحليل الكمي12،47،48. في نموذج PMU للفئران ، تكون خلايا الغرفة الأمامية مرئية فقط في OCT ولا يمكن رؤيتها في الاختبارات السريرية ما لم يكن هناك نقص كبير في البويون. يمكن ملاحظة الالتهاب الزجاجي (التهاب الزجاجية الزجاجي) من خلال تصوير قاع العين الملون ، ولكن لا يمكن اكتشاف التغير الكمي إلا من خلال التصوير المقطعي المحوسب. يمكن التعرف بسهولة على الجوانب الأخرى للنموذج ، مثل التهاب الأوعية الدموية في شبكية العين وتلف الشبكية ، إما من خلال التصوير المقطعي المحوسب والتصوير المجهري لقاع العين الساطع.
عند استخدام OCT ، من المهم التفكير في كيفية تأثر التصوير الموضعي بالاختلافات الإقليمية في درجة الالتهاب. حددت التقارير السابقة توزيعا غير متساو للخلايا في الغرفة الأمامية للبشر ، مع وجود المزيد من الخلايا بشكل أقل شأنا49. في الفئران ، استعداد مماثل أمر شائع. وبالتالي ، فإن المسح الرأسي أو الشعاعي من خلال التيار المتردد سيساعد في ضمان الصور التي تلتقط نطاق الالتهاب. بالإضافة إلى ذلك ، فإن إجراء التصوير في نفس المكان سيوفر أيضا اتساقا للصور التي تم جمعها في نفس العين طوليا. للحصول على صور في نفس الجزء من العين ، استخدم معالم مستقرة ونهج منهجي. بالنسبة لصور الغرفة الأمامية ، يتم توسيط الصورة مباشرة بجوار قمة القرنية وتوجيهها عموديا بحيث يمكن اكتشاف وجود hypopyon في الزاوية السفلية. بالنسبة لصور المقطع الخلفي ، تتمركز الصورة على العصب البصري. يوصى بالتفكير في استخدام 3 عمليات مسح على الأقل للتسجيل لضمان التقاط التباين الإقليمي. في الحالات التي يقتصر فيها الالتهاب على المواقع الطرفية ، يمكن أن يكون الحصول على فحوصات الحجم مفيدا. يمكن أن تساعد مجموعة عمليات فحص الحجم أيضا في التقاط الاختلافات الإقليمية ولكنها ستزيد من متطلبات تخزين البيانات.
تشمل المقايسات الأخرى في الجسم الحي التي يمكن استخدامها لتوصيف الالتهاب في نموذج الماوس PMU التصوير الحيوي13,35. يمكن إجراء فحوصات ما بعد الوفاة مثل تحليل قياس التدفق الخلوي متعدد المعلمات لتحديد وقياس مجموعات الخلايا المناعية المتسللة في الغرفة المائية والخلفية للعين12,26. في نموذج PMU ، يتميز الالتهاب الحاد باستجابة فطرية مع تسلل العدلات السائد ، يليه استجابة مهيمنة للخلايا التائية التكيفية المزمنة والمستمرة والتي تستمر لأكثر من شهر35. تشمل المقايسات الأخرى لوظيفة المناعة التي يمكن إجراؤها على أنسجة ما بعد الوفاة تحليل السيتوكين السائل العيني. بالإضافة إلى ذلك ، يمكن استخدام فحوصات أخرى في اتجاه مجرى النهر مثل تسلسل mRNA والتصوير المناعي لتقييم أنماط التعبير الجيني والبروتيني لمجموعات الخلايا المناعية في شبكية العين في التهاب القزحية50,51.
يمكن تكرار نموذج PMU في أنظمة القوارض الأخرى باستخدام التعديلات المناسبة للأنواع المختلفة. تم استخدام نموذج PMU سابقا في الفئران والأرانب38،39،40. في الفئران ، يتطور التهاب العنبية الحاد بعد الحقن داخل الجسم الزجاجي الذي يزول تلقائيا على مدار 14 يوما دون ظهور علامات التهاب مزمن بواسطة علم الأنسجة24. في الأرانب، يستخدم تحريض التهاب العنبية جولتين من الحقن تحت الجلد قبل الحقن داخل الجسم الزجاجي ولكنه يولد أيضا التهاب العنبية القوي. تتمثل إحدى مزايا استخدام نموذج الماوس في التوافر السهل للعديد من السلالات المعدلة وراثيا والضربة القاضية التي يمكن أن تساعد في فهم الآلية الأساسية لالتهاب القزحية52. يمكن استخدام جميع نماذج القوارض لاختبار العلاج قبل السريري إذا تم إعطاء العامل بشكل منهجي أو كقطرة موضعية. ومع ذلك ، نظرا لحجمها الأكبر ، تعد عيون الفئران والأرانب نماذج أفضل للاستخدام في الدراسات قبل السريرية لخيارات العلاج بالحقن القابلة للزرع أو المحلية لالتهاب القزحية.
باختصار ، يوفر هذا البروتوكول للباحثين المهتمين بدراسة آليات التهاب العين المزمن أداة جديدة لا تعتمد على التحصين المسبق بمستضدات العين.
Disclosures
ليس لدى المؤلفين أي نزاعات مالية للكشف عنها.
Acknowledgements
يتم دعم هذا العمل بتمويل من المعاهد الوطنية للصحة ، بيثيسدا ، ماريلاند ، الولايات المتحدة (KP) K08EY0123998 ، (KP) R01EY030431 ، (KP) R21 EY02939 ، منحة UW Vision Research الأساسية (NEI P30EY01730) ، هدايا من Mark Daily ، صندوق أبحاث MD وصندوق أبحاث كريستوفر وأليدا لاثام ، منحة إدارية غير مقيدة من Research to Prevent Blindness ، وجائزة التطوير الوظيفي من Research to Prevent Blindness (KP). تم دعم العمل الذي تم إجراؤه في بريستول بتمويل إضافي من Sight Research UK و The Underwood Trust.
Materials
| Name | Company | Catalog Number | Comments |
| AK-FLUOR | Akorn Pharmaceuticals, IL, USA | 10% Fluorescein sodium 100 mg/mL in 5 mL vial | |
| AnaSed | Akorn Animal Health, IL, USA | NDC 59399-110-20 | Xylazine 20 mg/mL |
| Betadine 5% Sterile Ophthalmic Prep Solution | Alcon, TX, USA | 8007-1 | |
| B-D Precision Glide Needles -25 G | Becton, Dickinson and Company, NJ, USA | 305122 | |
| B-D Precision Glide needle -30-G | Becton, Dickinson and Company, NJ, USA | 305106 | |
| Bond MAX, Bond Rx | Leica Biosystems, IL,USA | Automated IHC staining system | |
| Chloramphenicol ointment | Martindale Pharma, Romford, UK | 1% w/w Chloramphenicol | |
| EG1150H | Leica Biosystems, IL,USA | Tissue Embedding | |
| Envisu R2300 | Bioptigen/Leica | OCT Machine | |
| Freund's Incomplete Adjuvant | BD Difco, NJ, USA | 263910 | |
| GenTeal lubricant eye ointment | Alcon, TX, USA | --- | |
| GenTeal lubricant eye gel | Alcon, TX, USA | --- | |
| H37Ra lyophilized Mycobacteria extract | BD Difco, NJ, USA | 231141 | |
| Hamilton RN Needle (33/12/2)S | Hamilton, Reno, NV | 7803-05(33/12/2) | 33 G |
| Hamilton syringe | Hamilton, Reno, NV | CAL7633-01 | 5 µL |
| Insulin needle | Exel International, USA | 26029 | 1 mL |
| Isoflurane | |||
| Ketaset | Zoetis, USA | 377341 | Ketamine HCL 100 mg/mL |
| Microinjection Syringe Pump and Micro4Controller | World Precision Instruments, FL, USA | UMP3 | |
| Micron IV | Phoenix Research Laboratories, Pleasanton, CA | Alternative Imaging/OCT Machine | |
| Nanofil 10 µL syringe | World Precision Instruments, FL, USA | NANOFIL | |
| Nanofil Intraocular Injection Kit | World Precision Instruments, FL, USA | IO-KIT | |
| Olympus SZX10 | Olympus | Dissection scope | |
| PBS | Gibco | 14190 | |
| Phenylephrine Hydrochloride Ophthalmic Solution USP 2.5% Sterile 15 mL | Akorn Pharmaceuticals, IL, USA | 17478020115 | |
| RM2255 | Leica Biosystems, IL,USA | Tissue Sectioning | |
| TB Syringe | Becton, Dickinson and Company, NJ, USA | 309602 | 1 mL |
| Tetracaine 0.5% | Alcon, TX, USA | 1041544 | |
| Tissue Tek VIP series | Sakura Finetek USA, Inc.,CA. | Histology Tissue Processing | |
| Tropicamide 1% | Chauvin Pharmaceuticals, Romford, UK | Minims | |
| Tylenol | Johnson & Johnson Consumer Inc, PA, USA | NDC 50580-614-01 | Acetaminophen |
| Viscotears | Novartis Pharmaceuticals, Camberley, UK | Carbomer eye gel 0.2% w/w |
References
- American Academy of Ophthalmology. Aao 2019-2020 Basic and Clinical Science Course, Section 09: Uveitis and Ocular Inflammation. American Academy of Ophthalmology. , (2019).
- Caspi, R. R. Animal models of autoimmune and immune-mediated uveitis. Drug Discovery today. Disease Models. 3 (1), 3-9 (2006).
- DeVoss, J., et al. Spontaneous autoimmunity prevented by thymic expression of a single self-antigen. The Journal of Experimental Medicine. 203 (12), 2727-2735 (2006).
- Caspi, R. R., et al. A new model of autoimmune disease. Experimental autoimmune uveoretinitis induced in mice with two different retinal antigens. Journal of Immunology. 140 (5), 1490-1495 (1988).
- Tang, J., Zhu, W., Silver, P. B., Su, S. -B., Chan, C. -C., Caspi, R. R. Autoimmune uveitis elicited with antigen-pulsed dendritic cells has a distinct clinical signature and is driven by unique effector mechanisms: Initial encounter with autoantigen defines disease phenotype. The Journal of Immunology. 178 (9), 5578-5587 (2007).
- Broekhuyse, R. M., Kuhlmann, E. D., Winkens, H. J. Experimental melanin-protein induced uveitis (EMIU) is the sole type of uveitis evoked by a diversity of ocular melanin preparations and melanin-derived soluble polypeptides. Japanese Journal of Ophthalmology. 40 (4), 459-468 (1996).
- Pennesi, G., et al. A humanized model of experimental autoimmune uveitis in HLA class II transgenic mice. The Journal of Clinical Investigation. 111 (8), 1171-1180 (2003).
- Caspi, R. R. Understanding autoimmune uveitis through animal models. The Friedenwald lecture. Investigative Ophthalmology & Visual Science. 52 (3), 1872-1879 (2011).
- Bansal, S., Barathi, V. A., Iwata, D., Agrawal, R. Experimental autoimmune uveitis and other animal models of uveitis: An update. Indian Journal of Ophthalmology. 63 (3), 211-218 (2015).
- Smith, J. R., Hart, P. H., Williams, K. A. Basic pathogenic mechanisms operating in experimental models of acute anterior uveitis. Immunology and Cell Biology. 76 (6), 497-512 (1998).
- Rosenbaum, J. T., McDevitt, H. O., Guss, R. B., Egbert, P. R. Endotoxin-induced uveitis in rats as a model for human disease. Nature. 286 (5773), 611-613 (1980).
- Chu, C. J., et al. Multimodal analysis of ocular inflammation using the endotoxin-induced uveitis mouse model. Disease Models & Mechanisms. 9 (4), 473-481 (2016).
- Gutowski, M. B., Wilson, L., Van Gelder, R. N., Pepple, K. L. In vivo bioluminescence imaging for longitudinal monitoring of inflammation in animal models of uveitis. Investigative Ophthalmology & Visual Science. 58 (3), 1521-1528 (2017).
- World Health Organization. Global tuberculosis report 2019. World Health Organization. , (2019).
- Biswas, J., Badrinath, S. S. Ocular morbidity in patients with active systemic tuberculosis. International Ophthalmology. 19 (5), 293-298 (1995).
- Donahue, H. C. Ophthalmologic experience in a tuberculosis sanatorium. American Journal of Ophthalmology. 64 (4), 742-748 (1967).
- El-Asrar, M. A., Abouammoh, M., Al-Mezaine, H. S. Tuberculous uveitis. Middle East African Journal of Ophthalmology. 16 (4), 188-201 (2009).
- Bodaghi, B., et al. Chronic severe uveitis: etiology and visual outcome in 927 patients from a single center. Medicine. 80 (4), 263-270 (2001).
- Cunningham, E. T., Forrester, J. V., Rao, N. A., Zierhut, M. Post-infectious uveitis. Ocular Immunology and Inflammation. 24 (6), 603-606 (2016).
- Wroblewski, K. J., Hidayat, A. A., Neafie, R. C., Rao, N. A., Zapor, M. Ocular tuberculosis: a clinicopathologic and molecular study. Ophthalmology. 118 (4), 772-777 (2011).
- Yeh, S., Sen, H. N., Colyer, M., Zapor, M., Wroblewski, K. Update on ocular tuberculosis. Current Opinion in Ophthalmology. 23 (6), 551-556 (2012).
- Tagirasa, R., Parmar, S., Barik, M. R., Devadas, S., Basu, S. Autoreactive T cells in immunopathogenesis of TB-associated uveitis. Investigative Ophthalmology & Visual Science. 58 (13), 5682-5691 (2017).
- Agrawal, R., et al. Insights into the molecular pathogenesis of ocular tuberculosis. Tuberculosis. 126, 102018(2021).
- Pepple, K. L., et al. Primed mycobacterial uveitis (PMU): Histologic and cytokine characterization of a model of uveitis in rats. Investigative Ophthalmology & Visual Science. 56 (13), 8438-8448 (2015).
- Pepple, K. L., Choi, W. J., Wilson, L., Van Gelder, R. N., Wang, R. K. Quantitative assessment of anterior segment inflammation in a rat model of uveitis using spectral-domain optical coherence tomography. Investigative Ophthalmology & Visual Science. 57 (8), 3567-3575 (2016).
- Pepple, K. L., Wilson, L., Van Gelder, R. N. Comparison of aqueous and vitreous Lymphocyte populations from two rat models of experimental uveitis. Investigative Ophthalmology & Visual Science. 59 (6), 2504-2511 (2018).
- Basu, S., Elkington, P., Rao, N. A. Pathogenesis of ocular tuberculosis: New observations and future directions. Tuberculosis. 124, 101961(2020).
- Basu, S., Rao, N., Elkington, P. Animal models of ocular tuberculosis: Implications for diagnosis and treatment. Ocular Immunology and Inflammation. , 1-7 (2020).
- Mattapallil, M. J., et al. The Rd8 mutation of the Crb1 gene is present in vendor lines of C57BL/6N mice and embryonic stem cells, and confounds ocular induced mutant phenotypes. Investigative Ophthalmology & Visual Science. 53 (6), 2921-2927 (2012).
- Underwood, W., Anthony, R. AVMA guidelines for the euthanasia of animals: 2020 edition. 2013 (30), 2020-2021 (2020).
- Donovan, J., Brown, P., et al. Handling and restraint. Current protocols in immunology. Coligan, J. E., et al. , John Wiley & Sons, Inc. Chapter 1, Unit 1.3 (2006).
- Tremoleda, J. L., Kerton, A., Gsell, W. Anaesthesia and physiological monitoring during in vivo imaging of laboratory rodents: considerations on experimental outcomes and animal welfare. EJNMMI Research. 2 (1), 44(2012).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor protocols. 2014 (6), 655-658 (2014).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- John, S., Rolnick, K., Wilson, L., Wong, S., Van Gelder, R. N., Pepple, K. L. Bioluminescence for in vivo detection of cell-type-specific inflammation in a mouse model of uveitis. Scientific Reports. 10 (1), 11377(2020).
- Fortmann, S. D., Lorenc, V. E., Hackett, S., Campochiaro, P. A. Murine Vitreous Tap (MurViTap): a novel technique to extract uncontaminated mouse vitreous humor, quantify retinal vascular permeability, and compare proteins secreted by diseased and normal retina. Investigative ophthalmology & visual science. 58 (8), 5978(2017).
- Caspi, R. R. Understanding autoimmunity in the eye: from animal models to novel therapies. Discovery Medicine. 17 (93), 155-162 (2014).
- Mruthyunjaya, P., et al. Efficacy of low-release-rate fluocinolone acetonide intravitreal implants to treat experimental uveitis. Archives of Ophthalmology. 124 (7), 1012-1018 (2006).
- Jaffe, G. J., Yang, C. S., Wang, X. C., Cousins, S. W., Gallemore, R. P., Ashton, P. Intravitreal sustained-release cyclosporine in the treatment of experimental uveitis. Ophthalmology. 105 (1), 46-56 (1998).
- Pepple, K. L., et al. Uveitis therapy with shark variable novel antigen receptor domains targeting tumor necrosis factor alpha or inducible t-cell costimulatory ligand. Translational Vision Science & Technology. 8 (5), 11(2019).
- Mattapallil, M. J., et al. Characterization of a New epitope of IRBP that induces moderate to severe uveoretinitis in mice with H-2b haplotype. Investigative Ophthalmology & Visual Science. 56 (9), 5439-5449 (2015).
- Silver, P. B., Chan, C. C., Wiggert, B., Caspi, R. R. The requirement for pertussis to induce EAU is strain-dependent: B10.RIII, but not B10.A mice, develop EAU and Th1 responses to IRBP without pertussis treatment. Investigative Ophthalmology & Visual Science. 40 (12), 2898-2905 (1999).
- Li, Q., Peng, B., Whitcup, S. M., Jang, S. U., Chan, C. C. Endotoxin induced uveitis in the mouse: susceptibility and genetic control. Experimental Eye Research. 61 (5), 629-632 (1995).
- Astley, R. A., Coburn, P. S., Parkunan, S. M., Callegan, M. C. Modeling intraocular bacterial infections. Progress in Retinal and Eye Research. 54, 30-48 (2016).
- Lau, P. E., Jenkins, K. S., Layton, C. J. Current evidence for the prevention of endophthalmitis in anti-VEGF intravitreal injections. Journal of Ophthalmology. 2018, 8567912(2018).
- Nche, E. N., Amer, R. Lens-induced uveitis: an update. Graefe's Archive for Clinical and Experimental Ophthalmology. 258 (7), 1359-1365 (2020).
- Chu, C. J., et al. Assessment and in vivo scoring of murine experimental autoimmune uveoretinitis using optical coherence tomography. PLoS ONE. 8 (5), 63002(2013).
- Harimoto, K., Ito, M., Karasawa, Y., Sakurai, Y., Takeuchi, M. Evaluation of mouse experimental autoimmune uveoretinitis by spectral domain optical coherence tomography. The British Journal of Ophthalmology. 98 (6), 808-812 (2014).
- Li, Y., Lowder, C., Zhang, X., Huang, D. Anterior chamber cell grading by optical coherence tomography. Investigative Ophthalmology & Visual Science. 54 (1), 258-265 (2013).
- Bell, O. H., et al. Single eye mRNA-seq reveals normalisation of the retinal microglial transcriptome following acute inflammation. Frontiers in Immunology. 10, 3033(2019).
- Lipski, D. A., et al. Retinal endothelial cell phenotypic modifications during experimental autoimmune uveitis: a transcriptomic approach. BMC Ophthalmology. 20 (1), 106(2020).
- Agarwal, R. K., Silver, P. B., Caspi, R. R. Rodent Models of Experimental Autoimmune Uveitis. Autoimmunity. Methods in Molecular Biology (Methods and Protocols). Perl, A. , Humana Press. Totowa, NJ. 443-469 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved