Method Article
إنتاج متدرج خال من الخلايا وإضافة مساعدة إلى بروتين الغشاء الخارجي الرئيسي المؤتلف من الكلاميديا موريداروم لتطوير اللقاح
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول استخدام مجموعات تعبير البروتين التجارية الخالية من الخلايا لإنتاج بروتينات غشائية مدعومة في القرص النانوي يمكن استخدامها كمستضدات في لقاحات الوحدات الفرعية.
Abstract
توفر لقاحات الوحدات الفرعية مزايا على اللقاحات التقليدية المعطلة أو الموهنة المشتقة من الخلايا الكاملة في السلامة والاستقرار والتصنيع القياسي. لتحقيق لقاح فعال قائم على البروتين ، غالبا ما يحتاج مستضد البروتين إلى تبني شكل يشبه الأصلي. وهذا مهم بشكل خاص لمولدات الضد السطحية المسببة للأمراض التي هي بروتينات محاطة بغشاء. تم استخدام الطرق الخالية من الخلايا بنجاح لإنتاج بروتين غشاء وظيفي مطوي بشكل صحيح من خلال الترجمة المشتركة لجزيئات البروتين الدهني النانوي (NLPs) ، والمعروفة باسم الأقراص النانوية.
يمكن استخدام هذه الاستراتيجية لإنتاج لقاحات الوحدة الفرعية التي تتكون من بروتينات غشائية في بيئة مرتبطة بالدهون. ومع ذلك ، غالبا ما يقتصر إنتاج البروتين الخالي من الخلايا على نطاق صغير (<1 مل). عادة ما تكون كمية البروتين المنتجة في عمليات الإنتاج على نطاق صغير كافية للدراسات البيوكيميائية والفيزيائية الحيوية. ومع ذلك ، يجب توسيع نطاق العملية الخالية من الخلايا وتحسينها واختبارها بعناية للحصول على ما يكفي من البروتين لدراسات اللقاح في النماذج الحيوانية. يجب تحسين العمليات الأخرى التي ينطوي عليها إنتاج اللقاح ، مثل التنقية وإضافة المواد المساعدة والتجفيد ، بالتوازي. تشير هذه الورقة إلى تطوير بروتوكول موسع للتعبير عن لقاح الوحدة الفرعية للبروتين المرتبط بالغشاء وتنقيته وصياغته.
تتطلب التفاعلات الخالية من الخلايا الموسعة تحسين تركيزات ونسب البلازميد عند استخدام ناقلات تعبير البلازميد المتعددة ، واختيار الدهون ، وإضافة المواد المساعدة لإنتاج عالي المستوى لجزيئات البروتين الدهني النانوي المصاغة. يتم توضيح الطريقة هنا مع التعبير عن بروتين الغشاء الخارجي الرئيسي الكلاميديا (MOMP) ولكن يمكن تطبيقه على نطاق واسع على مستضدات البروتين الغشائي الأخرى. يمكن تقييم فعالية المستضد في الجسم الحي من خلال دراسات التحصين لقياس إنتاج الأجسام المضادة ، كما هو موضح هنا.
Introduction
تتوفر محللات بدائية النواة أو حقيقية النواة للتعبير الخالي من الخلايا للبروتينات بسهولة كمنتجات تجارية لتوليف البروتينات ذات الأهمية (للحصول على مراجعة كاملة ، انظر 1). تتوفر أنظمة التعبير هذه على مستويات مختلفة وتستخدم المحللات من الكائنات الحية المختلفة ، بما في ذلك الإشريكية القولونية ونباتات التبغ ومزارع الثدييات. تقدم المحللات الخالية من الخلايا فوائد متعددة مقارنة بأساليب إنتاج البروتين المؤتلف التقليدية ، بما في ذلك سهولة الاستخدام وإنتاج البروتين القوي والسريع. في حين أن هذه الأساليب تستخدم في المقام الأول لإنتاج البروتينات القابلة للذوبان ، فقد كانت هذه المجموعة رائدة في نهج لاستخدامها للتعبير عن البروتينات الغشائية.
يقوم هذا النهج الجديد بإجراء تعديلات طفيفة على أنظمة التعبير الخالية من الخلايا الحالية من خلال تضمين الحمض النووي الذي يشفر منتجين بروتينيين للتعبير ، والبروتين الشحمي والبروتين الغشائي محل الاهتمام. يتفاعل البروتين الشحمي المعبر عنه (مشتقات إما ApoA1 أو ApoE4) مع الدهون المضافة إلى المحللة الخالية من الخلايا لتجميع NLPs تلقائيا (~ 20 نانومتر). عند ترجمته مع بروتين غشاء مهم ، يشكل NLP والبروتين الغشائي مركب جسيمات نانوية قابلة للذوبان حيث يتم تضمين بروتين الغشاء داخل طبقة الدهون المزدوجة NLP. وبالتالي ، فإن البروتين الغشائي يمكن الوصول إليه بشكل أكبر للتطبيقات النهائية ، حيث يتم احتواؤه داخل جزيئات منفصلة قابلة للذوبان. يمكن أن ينتج هذا النهج معقدات بروتين قليل القسيمات وظيفية داخل الطبقة الثنائية من البرمجة اللغويةالعصبية 2 ويمكن أن ينتج مكون المستضد للقاح الوحدة الفرعية ، والذي يتم خلطه لاحقا مع المواد المساعدة المحبة للدهون لتشكيل لقاح للجسيمات النانوية يتميز بمستضد موضعي مشترك ومساعد مناسب للتقييم في الجسم الحي .
تم تعديل هذه الطريقة الحالية من بروتوكول3 تم نشره مسبقا. تركز التعديلات الرئيسية على توسيع نطاق التفاعل الخالي من الخلايا والتنقية اللاحقة لمركب البروتين - البرمجة اللغوية العصبية. يتضمن التعديل الآخر إضافة بوليمر برمائي يعرف باسم telodendrimer ، والذي يتم خلطه أولا مع الدهون قبل إضافته إلى التفاعل الخالي من الخلايا. الترجمة المشتركة للبلازميدات في وجود telodendrimer والدهون تنتج telodendrimer NLP (tNLP). تساعد إضافة telodendrimer أيضا على تعديل حجم وتشتت الجسيمات النانوية tNLP الناتجة4. تم تحسين هذا البروتوكول خصيصا لدراسات اللقاحات واسعة النطاق لإنتاج بروتين مستضد وحدة فرعية مرتبطة بالغشاء ، الكلاميديا MOMP 5,6. تنتج الطريقة MOMP المؤتلف المرتبط ب tNLP لتشكيل مركب MOMP-tNLP عالي الذوبان الذي يحتفظ بقلة MOMP. ينتج إنتاج نموذجي من 3 مل >1.5 مجم من MOMP المنقى. إن MOMP-tNLP المنتج الخالي من الخلايا قابل للإضافة المساعدة السريعة لاختبار المناعة في الجسم الحي.
Protocol
تم إجراء جميع الدراسات على الحيوانات في جامعة كاليفورنيا ، إيرفين ، في مرافق مضمونة لخدمة الصحة العامة (PHS) وفقا للمبادئ التوجيهية التي وضعتها لجنة رعاية واستخدام الحيوان المؤسسية.
1. إعداد الأواني الزجاجية
ملاحظة: جميع المواد المستخدمة في إنتاج تركيبات من فئة اللقاحات للحيوانات خالية من السموم الداخلية.
- لتدمير السموم الداخلية الملوثة ، اخبز الأواني الزجاجية النظيفة التي ستحتفظ بالمخازن المؤقتة في الفرن عند 180 درجة مئوية لمدة 4 ساعات.
2. إعداد العازلة
- تحضير 250 مل من مخازن تنقية تقارب النيكل المدرجة في الجدول 1. قم بتخزينها في درجة حرارة 4 درجات مئوية لمدة تصل إلى 6 أشهر.
3. إعداد رد الفعل
- قم بوزن 20 مجم من 1،2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) في أنبوب طرد مركزي خال من السموم الداخلية سعة 1.5 مل. قم بإذابته في 1 مل من الماء الخالي من السموم الداخلية ، وتحقق من صوتنة أربع مرات على الأقل عند 6 أمبير لمدة دقيقة واحدة ، مع توقف لمدة دقيقة واحدة بينهما ، حتى تصبح صافية. قم بإزالة أي معدن ملوث من المسبار عن طريق الطرد المركزي عند 13000 × جم لمدة دقيقتين عند 22 درجة مئوية ثم انقل الدهون القابلة للذوبان إلى أنبوب جديد خال من السموم الداخلية سعة 1.5 مل.
- قم بوزن 1 مجم من تيلوديندريمر PEG5k-CA8 في أنبوب خال من السموم الداخلية سعة 1.5 مل. يذوب في ماء خال من السموم الداخلية بتركيز 20 مجم / مل. دوامة حتى تذوب تماما وتخفف إلى 2 ملغ / مل.
- في أنبوب جديد خال من السموم الداخلية ، اجمع بين 210 ميكرولتر من محلول DMPC 20 مجم / مل مع 210 ميكرولتر من محلول تيلوديندريمر 2 مجم / مل.
4. إنتاج خال من الخلايا من MOMP-tNLPs لتركيبات لقاح الوحدات الفرعية
- قم بإعداد MOMP-tNLPs باستخدام طرق خالية من الخلايا تم تعديلها من بروتوكول5 تم نشره مسبقا.
- قبل ساعتين من إعداد التفاعل الخالي من الخلايا ، افتح مجموعة التعبير البروتيني الخالي من الخلايا بدائية النواة وقم بإذابة أحد مخازن إعادة التكوين. بمجرد إذابة الجليد ، أضف قرصا واحدا من كوكتيل مثبطات الأنزيم البروتيني الخالي من EDTA واتركه يذوب تماما.
- اتبع هذا البروتوكول باستخدام مجموعة مصممة لتشغيل تفاعلات 5 × 1 مل.
ملاحظة: الإنتاج النموذجي للتوسع هو 3 × 1 مل.- لكل تفاعل 1 مل ، أضف 525 ميكرولتر من المخزن المؤقت لإعادة التكوين إلى زجاجة تحلل الإشريكية القولونية ولفها برفق حتى تذوب. أضف 250 ميكرولتر من محلول إعادة التكوين إلى الزجاجة التي تحتوي على إضافات تفاعل (على سبيل المثال ، ATP ، GTP) ولفها برفق حتى تذوب.
- أضف 8.1 مل من المخزن المؤقت لإعادة التكوين إلى زجاجة تغذية التفاعل ، وأعد التلخيص بسدادة مطاطية (احرص على عدم لمس الجزء الداخلي من السدادة المطاطية) ، واقلبها / لفها برفق حتى تذوب.
- أضف 3 مل من محلول إعادة التكوين إلى زجاجة خليط الأحماض الأمينية ، وأعد تغليفها بسدادة مطاطية ، واقلبها / لفها برفق حتى تذوب.
ملاحظة: احرص على عدم لمس الجزء الداخلي من السدادة المطاطية لأن ذلك قد يؤدي إلى التلوث. - أضف 1.8 مل من المخزن المؤقت لإعادة التكوين إلى زجاجة الميثيونين ، ثم لفها برفق حتى تذوب ، ثم خزنها على الثلج حتى الاستخدام.
- تحضير حل التفاعل.
- إلى زجاجة تحلل الإشريكية القولونية ، أضف 225 ميكرولتر من مزيج التفاعل المعاد تشكيله ، و 270 ميكرولتر من مزيج الأحماض الأمينية المعاد تكوينه بدون ميثيونين ، و 30 ميكرولتر من الميثيونين المعاد تشكيله. بالإضافة إلى ذلك ، أضف 400 ميكرولتر من خليط DMPC / telodendrimer ، و 15 ميكروغرام من بلازميد MOMP ، و 0.6 ميكروغرام من بلازميد Δ49ApoA1. لفة / رج بلطف للخلط.
ملاحظة: تأكد من أن كلا البلازميدات مبنية من نفس العمود الفقري للبلازميد. لا دوامة. - خذ 20 ميكرولتر من المحلول الكلي وضعه جانبا في أنبوب سعة 1.5 مل لتفاعل التحكم المعرب عن GFP (انظر أدناه).
- إلى زجاجة تحلل الإشريكية القولونية ، أضف 225 ميكرولتر من مزيج التفاعل المعاد تشكيله ، و 270 ميكرولتر من مزيج الأحماض الأمينية المعاد تكوينه بدون ميثيونين ، و 30 ميكرولتر من الميثيونين المعاد تشكيله. بالإضافة إلى ذلك ، أضف 400 ميكرولتر من خليط DMPC / telodendrimer ، و 15 ميكروغرام من بلازميد MOMP ، و 0.6 ميكروغرام من بلازميد Δ49ApoA1. لفة / رج بلطف للخلط.
- تحضير حل التغذية. أضف إلى زجاجة مزيج العلف 2.65 مل من مزيج الأحماض الأمينية المعاد تكوينه بدون ميثيونين و 300 ميكرولتر من الميثيونين المعاد تكوينه. لفة / رج برفق ليذوب.
ملاحظة: في هذا الوقت ، يمكن إرجاع المخزن المؤقت لإعادة التكوين غير المستخدم والميثيونين إلى الفريزر للتخزين. - انقل 1 مل من محلول التفاعل إلى غرفة التفاعل الداخلية المتوفرة في مجموعة التفاعل الخالية من الخلايا وأغلقها عند ملئها. نقل 10 مل من محلول التغذية إلى الغرفة الخارجية لوعاء التفاعل والختم.
ملاحظة: لا تملأ الغرف أكثر من اللازم! سيؤثر وجود فقاعات الهواء في الجزء العلوي من كل من غرفة التفاعل الداخلية وغرفة التغذية الداخلية سلبا على التفاعل. يمكن وضع أي محلول تفاعل متبقي في أنبوب حجمه 1.5 mL والسماح له بالاختلاط بجانب الوعاء الرئيسي. - أضف 0.5 ميكرولتر من بلازميد التحكم في GFP (0.5 مجم / مل) إلى خليط تفاعل 20 ميكرولتر المقتبس سابقا.
ملاحظة: يتم تزويد العديد من المجموعات ببلازميد تحكم لأغراض مراقبة الجودة. يمكن أيضا استخدام معظم البلازميد المعبر عن GFP مع مروج T7 وموقع ربط الريبوسوم E.coli (RBS) كبلازميد تحكم. - ضع التفاعل في شاكر عند 300 دورة في الدقيقة ، 30 درجة مئوية لمدة تصل إلى 18 ساعة. للتحقق من نجاح التفاعل ، استخدم مصدر ضوء الأشعة فوق البنفسجية للتحقق من التألق بسبب تخليق GFP الخاضع للتحكم (الشكل 1 أ) بعد أقل من 15 دقيقة من الحضانة.
ملاحظة: قد تحتاج هذه الظروف ، وخاصة درجة الحرارة ، إلى تحسين للتعبير عن بروتينات الغشاء الأخرى.
5. تنقية MOMP-tNLP
- استخدم كروماتوغرافيا تقارب النيكل المجمدة لتنقية مركب الجسيمات النانوية MOMP-tNLP من خليط التفاعل الخالي من الخلايا باستخدام علامة His-tag على بروتين Δ49ApoA1.
- انقل 1 مل من ملاط 50٪ من راتنج تنقية His-Tag إلى عمود كروماتوغرافي سعة 10 مل يمكن التخلص منه وقم بموازنته مع 3 مل من المخزن المؤقت للربط.
- اترك المخزن المؤقت يستنزف ، وقم بتغطية المخرج ، وأضف 250 ميكرولتر من المخزن المؤقت للربط إلى الراتنج.
- قبل إضافة التفاعل الخالي من الخلايا إلى العمود ، احفظ 20 ميكرولتر لتحليلها لاحقا بواسطة SDS-PAGE. امزج التفاعل الخالي من الخلايا مع الراتنج المتوازن واحتضانه على هزاز المختبر عند 4 درجات مئوية لمدة 1 ساعة.
- قم بفك غطاء العمود ، واغسل الغطاء ب 500 ميكرولتر من المخزن المؤقت الإضافي للربط ، وأضف هذا السائل إلى بقية العمود.
- اجمع تدفق السائل من العمود لتحليله لاحقا بواسطة SDS-PAGE.
- اغسل العمود ب 1 مل من محلول الغسيل الذي يحتوي على 20 مللي متر إيميدازول ست مرات واجمع الكسور. احرص على عدم ترك الراتنج يجف بين الغسلات. في الغسلة الثانية ، حرك الراتنج بقوة عن طريق السحب لأعلى ولأسفل باستخدام ماصة سعة 1 مل.
- قم بإزالة MOMP-tNLPs في ستة أجزاء 300 ميكرولتر من المخزن المؤقت للشطف 1 (يحتوي على 250 مللي مول إيميدازول) ، متبوعا بشطف أخير واحد مع 300 ميكرولتر من محلول الشطف 2 (يحتوي على 500 مللي مول إيميدازول). في الشطف الثاني ، قم بتحريك الراتنج بقوة عن طريق السحب لأعلى ولأسفل باستخدام ماصة سعة 1 مل.
6. التحليل بواسطة SDS-PAGE
ملاحظة: يجب تحليل جميع كسور الشطف بواسطة SDS-PAGE لفحص كمية ونقاء البروتين محل الاهتمام.
- قم بتحميل 1 ميكرولتر لكل من إجمالي المحللين والتدفق ثم 5 ميكرولتر لجميع الغسلات المجمعة وكسور الشطف.
- امزج القسوم من MOMP-tNLPs المستخلصة ، والغسيل ، والتدفق ، والتحلل الكلي مع 4x SDS-PAGE المخزن المؤقت لتحميل العينة. امزج العينات وقم بتشويهها بالحرارة باستخدام عامل تقليل عينة 10x ما لم يذكر خلاف ذلك.
- قم بتحليل الكسور عن طريق الرحلان الكهربائي الهلامي باستخدام 1.0 مم ، 4 إلى 12٪ ، جل Bis-Tris SDS-PAGE مع 1x MES-SDS تشغيل المخزن المؤقت ، جنبا إلى جنب مع معيار الوزن الجزيئي المناسب. قم بتشغيل المواد الهلامية لمدة 35 دقيقة عند 200 فولت.
- وصمة عار المواد الهلامية وفقا لتعليمات الشركة الصانعة.
- أخرج الجل من الكاسيت وضعه في 60 مل من صبغة الهلام. ضع الجل في الميكروويف في صبغة الجل لمدة 30 ثانية ، وقم بهز الحاوية برفق لمدة 30 ثانية لتوزيع الحرارة بالتساوي. ضع الجل في الميكروويف في البقعة إلى 80-85 درجة مئوية لمدة 30 ثانية أخرى ، وضع الجل على شاكر مداري للصخرة لمدة 5 دقائق.
- ضع الجل في الميكروويف مرة ثالثة لمدة 30 ثانية ، ثم عد إلى شاكر المداري ليهز لمدة 23 دقيقة أخرى.
- انقل الجل إلى وعاء نظيف واغسله في 100 مل من محلول الغسيل (10٪ ميثانول ، 7٪ حمض أسيتيك) لمدة 30 دقيقة.
ملاحظة: هذه خطوة حاسمة لأنه من الضروري تجنب تسخين محلول الغسيل. يمكن أن يؤدي عدم القيام بذلك إلى تلطيخ الخلفية والمخالفات في صورة الهلام النهائية. - بعد الغسيل ، شطف الجل في ماء عالي النقاء مرتين لمدة 5 دقائق لكل منهما.
- صور المواد الهلامية باستخدام جهاز تصوير هلام عند 600 نانومتر (الشكل 2). استخدم SDS-PAGE لتحديد كمية البروتين الفردي في محلول الجسيمات النانوية إذا كان هناك معيار بروتين للمقارنة.
ملاحظة: في هذا المثال، يتم حل التخفيفات التسلسلية ل MOMP المعبر عنها بشكل مؤتلف بواسطة SDS-PAGE ويتم تحديد كثافات النطاقات باستخدام برنامج الجهاز. - قم بإنشاء منحنى قياسي باستخدام كثافات نطاقات MOMP. حل عينات MOMP-tNLP على نفس هلام SDS-PAGE وحساب مكون MOMP للجسيمات باستخدام منحنى MOMP القياسي (الشكل 3).
7. البقع الغربية والنقاط والتخزين
- بالنسبة للنشاف الغربي ، قم بحل العينات بواسطة SDS-PAGE ونقل المواد الهلامية باستخدام نظام نشاف جاف تجاري مع إعدادات قياسية وفقا لبروتوكول الشركة المصنعة.
- قم بإزالة البقع من المكدس بعد اكتمال النقل ، واحتضان كل لطخة طوال الليل عند 4 درجات مئوية في مخزن مؤقت مناسب يحتوي على 0.2٪ توين 20 وإما 0.5 مجم / مل MAb40 أو 0.2 مجم / مل MAbHIS جسم مضاد مضاد لعلامة HISbHIS موجه ضد علامة His-tag من بروتين Δ49ApoA1.
ملاحظة: تخفيفات الأجسام المضادة المستخدمة في النشاف هي 1: 1000 ل MAb40 و 1: 500-1000 للجسم المضاد MAbHIS. - اغسل كل لطخة 3 مرات لمدة 5 دقائق باستخدام PBS-T (1x PBS ، 0.2٪ Tween 20 ، درجة الحموضة 7.4).
- احتضان البقع لمدة 1 ساعة في حاجز مانع يحتوي على جسم مضاد ثانوي مقترن بالفلوروفور (على سبيل المثال ، IRDye) عند تخفيف 1: 10,000.
- أعد غسل البقع 3 مرات لمدة 5 دقائق باستخدام PBS-T. استخدم جهاز تصوير مضان لتصوير البقع بعد الغسيل النهائي.
- قم بإزالة البقع من المكدس بعد اكتمال النقل ، واحتضان كل لطخة طوال الليل عند 4 درجات مئوية في مخزن مؤقت مناسب يحتوي على 0.2٪ توين 20 وإما 0.5 مجم / مل MAb40 أو 0.2 مجم / مل MAbHIS جسم مضاد مضاد لعلامة HISbHIS موجه ضد علامة His-tag من بروتين Δ49ApoA1.
- بالنسبة للبقع النقطية ، قم بمسح 3 ميكروغرام من MOMP-tNLP المنقى وإفراغ tNLP باستخدام جهاز لطخة نقطة. قم بمنع البقع وتطويرها باستخدام نفس الطرق الموضحة أعلاه للنشاف الغربي.
8. تقييم السموم الداخلية
- تحديد مستويات السموم الداخلية باستخدام نظام اختبار السموم الداخلية على أساس مقايسة Limulus Amebocyte Lysate (LAL). تحضير 25 mM Tris الخالي من السموم الداخلية ، درجة الحموضة 7.4 ، المخزن المؤقت للعينة باستخدام محلول هيدروكلوريد 1 M Tris والماء الخالي من السموم الداخلية.
ملاحظة: عادة ، يجب تخفيف العينات باستخدام هذا المخزن المؤقت للعينة ، وتعديل التخفيفات للعثور على النطاق المناسب للعينات الفردية. هنا ، يتم تخفيف عينات MOMP-tNLP بمقدار 500 ضعف في المخزن المؤقت للعينة ويتم تحميل 25 ميكرولتر في كل بئر من خرطوشة الجهاز بحساسية 0.05 EU / mL. تتراوح مستويات السموم الداخلية من MOMP-tNLP و tNLP الفارغة المستخدمة في دراسات الفئران الموضحة أدناه بين 0.4 إلى 12 بروتين EU/μg اعتمادا على العينة.
9. التجفيد
- تجفيف وتخزين الجسيمات النانوية MOMP-tNLP للاستخدام طويل الأمد (حتى سنوات) عند -20 درجة مئوية. لتحضير معلقات tNLP و MOMP-tNLP للتجفيف بالتجميد ، أضف تريهالوز كواقي أثناء عملية التجميد والتجفيد.
ملاحظة: تم التحقق من صحة هذه العملية على نطاق واسع لمجموعة متنوعة من تركيبات tNLP7،8. - اقسم الحجم الحالي لمحلول MOMP-tNLP على 9 للحصول على حجم 1 M trehalose في الماء المعقم الخالي من السموم الداخلية ومنزوع الأيونات المطلوب للوصول إلى تركيز نهائي قدره 0.1 M trehalose. قم بتدوين الحجم النهائي والقسمة في أنابيب البولي بروبلين الخالية من السموم الداخلية 15 مل أو 50 مل حسب الرغبة.
- قم بتجميد المحلول المختلط على الثلج الجاف وقم بتجفيفه بالتجميد طوال الليل باستخدام مجفف التجميد. تخزن التركيبات المجففة على حرارة -20 درجة مئوية لحين الحاجة.
- إعادة تكوين tNLPs المجففة بالتجميد باستخدام الماء الخالي من السموم الداخلية. لف بلطف حتى تذوب الكعكة المجففة بالتجميد بالكامل وتعيد ترطيبها. لإزالة تريهالوز ، قم بغسيل المحلول ضد PBS باستخدام غشاء غسيل الكلى 3.5 كيلو دالتون.
10. إضافة مساعد
ملاحظة: يمكن لهذه التركيبات وغيرها من تركيبات اللقاح الفرعية القائمة على البرمجة اللغوية العصبية أن تتضمن بسهولة مواد مساعدة محبة للدهون مثل CpG-ODN1826 و FSL-1. CpG-ODN1826 عبارة عن قليل النوكليوتيد المعدل من الفئة B CpG (5'-tccatgacgttcctgacgtt-3') مع العمود الفقري للفوسفورثيوات الكامل الذي يتميز بجزء من الكوليسترول 5 بوصات (5'-chol-C6). يتم التوسط في اقتران CpG-ODN1826 إلى tNLPs من خلال التفاعلات الكارهة للماء بين جزء الكوليسترول وطبقة الفوسفوليبيد المزدوجة في tNLP وقد تم إثباتها وتوصيفها بشكل جيد ، كما تم الإبلاغ عنه سابقا 9,10.
- قبل الدمج في هذه التركيبات ، قم بتنقية CpG المعدل للكوليسترول عن طريق كروماتوغرافيا الطور العكسي لإزالة السموم الداخلية الملوثة وكذلك أي جزيئات CpG غير معدلة.
- عند الاستلام من البائع ، قم بإعادة ترطيب مادة CpG المجففة بالتجميد في ماء خال من السموم الداخلية وتنقيتها على عمود C4 RP-HPLC تحضيري باستخدام تدرج فصل يتكون من 10 مللي متر ثلاثي إيثيل الأمونيوم أسيتات (TEAA) (المرحلة المتنقلة A) والأسيتونيتريل (المرحلة المتنقلة B).
ملاحظة: تتوفر تفاصيل إضافية في الجدول 2. - قم بتجميع وتجفيف الكسور التي تحتوي على CpG المعدل للكوليسترول. لضمان الإزالة الكاملة ل TEAA المتبقية ، أعد تكوين CpG ب 15 مل من الماء الخالي من السموم الداخلية وأعد تجفيفه بالتجميد ثلاث مرات.
- بعد التجفيد النهائي ، أعد تكوين CpG في ماء خال من السموم الداخلية (>20 مجم / مل تركيز CpG النهائي) ، والقسمة ، وقم بتخزينه عند -80 درجة مئوية حتى الحاجة. بالإضافة إلى التركيبات ، قم بتخفيف CpG إلى تركيز 1-2.5 مجم / مل.
ملاحظة: FSL-1 متاح كمسحوق مجفف بالتجميد من فئة اللقاح. يتم إعادة تشكيل هذا باستخدام ماء معقم وخالي من السموم الداخلية بتركيز 1 مجم / مل. يتم إعطاء اللقاح عن طريق الحقن العضلي (i.m.) ، مع كل جرعة تحتوي على 10 ميكروغرام من MOMP في حجم إجمالي قدره 50 ميكرولتر.
- عند الاستلام من البائع ، قم بإعادة ترطيب مادة CpG المجففة بالتجميد في ماء خال من السموم الداخلية وتنقيتها على عمود C4 RP-HPLC تحضيري باستخدام تدرج فصل يتكون من 10 مللي متر ثلاثي إيثيل الأمونيوم أسيتات (TEAA) (المرحلة المتنقلة A) والأسيتونيتريل (المرحلة المتنقلة B).
- لتحقيق جرعة التركيبة المطلوبة ، قم بغسيل الجسيمات النانوية إلى PBS وتركيزها باستخدام مكثف فراغ بالطرد المركزي قبل إضافة مساعد. توخ الحذر عند القيام بذلك لمنع التجفيف الكامل للعينة - تحقق من حجم العينة كل 20-30 دقيقة أثناء الطرد المركزي.
- أضف المادة المساعدة تحت ظروف معقمة في خزانة السلامة البيولوجية. لتقييم الدمج الناجح ، قم بتحليل الصيغ النهائية ومكوناتها عن طريق كروماتوغرافيا استبعاد الحجم التحليلية (SEC).
ملاحظة: بالنسبة لهذه المستحضرات ، تم استخدام عمود SEC في المخزن المؤقت PBS (0.5 مل / م في معدل التدفق) ، وتم الكشف عن الشطف باستخدام كاشف صفيف الصمام الثنائي للأشعة فوق البنفسجية. تم تقييم الدمج من خلال مقارنة امتصاص الجسيمات المساعدة بامتصاص الجسيمات غير المساعدة عند 214 و 280 نانومتر. - قم بتخزين MOMP-tNLP المساعد وإفراغ tNLP عند 4 درجات مئوية قبل استخدام الحيوانات لمدة تصل إلى 14 يوما. لإجراء تقييم كامل لاستقرار تركيبة tNLP الجديدة ، قم بتحليل tNLPs المخزنة بشكل دوري بواسطة SEC.
ملاحظة: يختلف الاستقرار من تركيبة إلى أخرى.
11. اختبار المصل
- احصل على إناث الفئران البالغة من العمر 3 أسابيع (BALB / c ، n = 6).
- تطعيم الفئران في العضل (i.m.) في كل طرف خلفي مع 10 ميكروغرام من MOMP في شكل MOMP-tNLP مساعد مع 5 ميكروغرام من CpG و 1 ميكروغرام FSL-1 (الحجم الكلي لكل حقنة = 50 مل).
- بعد التطعيم ، راقب الفئران حتى تتمكن من الحفاظ على راقد القصة.
- بعد أربعة أسابيع من التطعيم الأولي (الرئيسي) ، قم بتطعيم الحيوانات مرة ثانية (تعزيز) ب 10 ميكروغرام من MOMP في شكل MOMP-tNLP مساعد مع 5 ميكروغرام من CpG و 1 ميكروغرام FSL-1 (الحجم الكلي لكل حقنة = 50 مل).
- في اليوم 56 بعد التطعيم الأولي ، اجمع الدم لتقييم عيار الأجسام المضادة. ابدأ بتخدير الفئران عن طريق حقن محلول من الزيلازين (0.3 مجم / 20 جم من وزن الجسم) والكيتامين (3.0 مجم / 20 جم من وزن الجسم). اضغط على الساقين الأمامية والخلفية للتأكد من عدم حدوث الرجيج. ضع الفازلين حول العينين لمنع جفاف العين أثناء التخدير.
- باستخدام أنبوب شعري الهيماتوكريت الدقيق ، ثقب الضفيرة المدارية الرجعية. جمع 100 مل من الدم في أنبوب الطرد المركزي.
- بعد جمع الدم ، راقب الفئران حتى تتعافى من التخدير ويمكنها الحفاظ على الاستلقاء القصي.
- اترك الدم يتجلط في درجة حرارة الغرفة لمدة 30 دقيقة ثم يدور لأسفل عند 2000 × جم لمدة 10 دقائق. اجمع المصل وجمد عند -80 درجة مئوية.
- في هذا الوقت ، تحدى الحيوانات باستخدام الكلاميديا موريداروم أو القتل الرحيم لهم. القتل الرحيم للفئران عن طريق حقن محلول الزيلازين أولا (0.3 مجم / 20 جم من وزن الجسم) والكيتامين (3.0 مجم / 20 جم من وزن الجسم) متبوعا بخلع عنق الرحم.
- اختبر الأجسام المضادة في المصل الخاصة ب MOMP باستخدام تقنيات النشاف الغربية كما هو موضح أعلاه. اجمع أمصال الفئران من جميع الفئران المحصنة واستخدم المصل المجمع بدلا من الجسم المضاد الأساسي عند تخفيف 1: 5,000.
النتائج
يظهر ملف تعريف SDS-PAGE لتنقية تقارب Ni ل MOMP-tNLP من تفاعل خال من الخلايا سعة 1 مل في الشكل 1B. أدى التفاعل إلى مستويات عالية من التعبير لكل من MOMP وبروتين Δ49ApoA1. أظهرت النتائج السابقة أن التعبير الخالي من الخلايا ل Δ49ApoA1 في وجود DMPC و telodendrimer أدى إلى تكوين جزيئات البروتين الدهني النانوي telodendrimer (tNLPs)4. أشار الشطف المشترك ل MOMP مع Δ49ApoA1 إلى أن MOMP مرتبط ب tNLPs ، حيث أن علامة His-tag موجودة فقط على سقالة tNLP Δ49ApoA1 وليس على MOMP. MOMP هو بروتين غير قابل للذوبان بدرجة عالية لا يمكن استخلاصه إلا من خلال التعقيد مع tNLPs ، والتي ثبت أنها تسهل إذابة البروتينات الغشائية.
تم تجميع أجزاء الشطف التي تحتوي على MOMP-tNLPs وتحديد تركيز البروتين الكلي باستخدام جهاز تكميم قائم على التألق ، أو جهاز يقيس التركيز من خلال الامتصاص عند 280 نانومتر ، باتباع تعليمات الشركة المصنعة لكمية البروتين. للسماح بجرعات دقيقة من لقاح MOMP ، من المهم أيضا تحديد تركيز MOMP في المجمعات المنقى. لقد طورنا طريقة لقياس MOMP بناء على قياس كثافة الهلام (الشكل 2) حيث تم استخدام MOMP المنقى المؤتلف بتركيز معروف كمعيار. من خلال إنشاء المنحنى القياسي ومقارنته بعينة MOMP-tNLP ، يمكن قياس تركيز MOMP بدقة. مكن تحديد تركيز MOMP في العينة المنقاة من تقدير عائد MOMP في تفاعلات خالية من الخلايا على مستويات مختلفة ، وهو أمر مهم لتخطيط إعداد التفاعل المناسب للدراسات النهائية (الجدول 3).
يحتاج MOMP إلى تكوين oligomers لاستنباط استجابة مناعية قوية11. لاختبار حالة oligomeric من MOMP ، تم تحليل MOMP-tNLP في وجود وغياب كل من الحرارة وعامل الاختزال dithiothreitol (DTT ، 50 mM ، الشكل 3A). تم تحديد الأوليغومرات ذات الترتيب الأعلى من MOMP من خلال SDS-PAGE عندما لم تتم معالجة العينات بالحرارة و DTT. وبالمقارنة ، أظهرت العينات المعالجة بالحرارة في وجود DTT في المقام الأول شريطين متميزين على الهلام ، يقابلان MOMP و Δ49ApoA1 (حوالي 40 كيلو دالتون و 22 كيلو دالتون ، على التوالي). تشبه هذه النتائج إلى حد كبير نمط ربط الهلام المنسوب إلى تكوين oligomer ل MOMP ، وهو أمر بالغ الأهمية لفعاليته.
أظهر تحليل اللطخة الغربية الإضافي باستخدام MAb40 ، وهو جسم مضاد ضد الخاتم الخطي على المجال المتغير لبروتين MOMP ، نمطا مشابها للنطاقات ، مما يؤكد تكوين oligomer بواسطة بروتين MOMP في حالته غير المشوهة (الشكل 3B). أحد العوامل المهمة التي تؤثر على تكوين أوليغومر MOMP هو النسبة بين بلازميد MOMP وبلازميد Δ49ApoA1 أثناء إعداد التفاعل الخالي من الخلايا. يسرد الجدول 4 نسبة البلازميدات ومعدل إدخال MOMP الناتج في tNLPs. أشارت الدراسات السابقة إلى أن الكلاميديا MOMP وبروتينات الغشاء الخارجي الأخرى قد توجد في المقام الأول كقادين12. لتعظيم تكوين أداة التشذيب في التفاعل الخالي من الخلايا ، من المستحسن أن يكون معدل الإدخال قريبا من ثلاثة بروتينات MOMP لكل برمجة عصبية ، وهو ما يتوافق مع نسبة البلازميد ~ 25: 1 MOMP إلى Δ49ApoA1.
تم استخدام مقايسة اللطخة النقطية كطريقة أكثر بساطة للكشف عن وجود MOMP و tNLP. تم استخدام الجسم المضاد MAb40 للكشف عن MOMP الكلي. تم استخدام الجسم المضاد MAbHIS المستهدف لعلامة His-tag على سقالة Δ49ApoA1 من tNLP لتقييم وجود tNLP. أشارت الإشارات المشتركة للأجسام المضادة MAb40 و MAbHIS إلى تكوين MOMP-tNLP. أنتج تفاعل التحكم tNLP فارغا ، والذي أظهر فقط إشارة إيجابية من MAbHIS (الشكل 3C). لاختبار مناعة MOMP-tNLPs المنتجة في التفاعل الخالي من الخلايا ، قمنا بمساعدة MOMP-tNLP مع CpG + FSL-1 وحقننا في العضل (i.m) في الفئران في نظام التعزيز الأولي كما هو موضح أعلاه. تم جمع الأمصال من الفئران المحصنة ، وتم قياس الجسم المضاد IgG الخاص ب MOMP باستخدام مقايسة اللطخة الغربية (الشكل 4). أظهرت الأمصال المأخوذة من الفئران المحقونة ب MOMP-tNLP المساعد ارتباطا قويا ب MOMP ، مما يشير إلى أن MOMP-tNLP يمكن أن يثير استجابة مناعية في الجسم الحي.
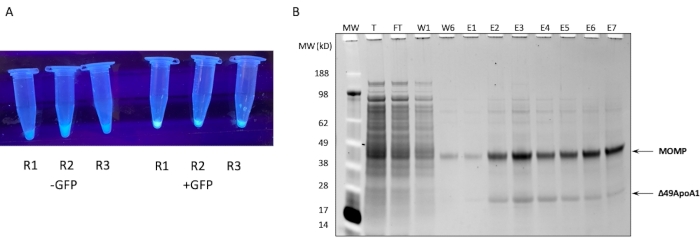
الشكل 1: التعبير عن MOMP-tNLP وتنقيته. (أ) صورة لأنابيب تحتوي على قسومات صغيرة من تفاعل خال من الخلايا يعبر بنجاح عن عناصر تحكم GFP في الإضاءة تحت مصدر ضوء الأشعة فوق البنفسجية (يمين) مقارنة بالمحللين بدون بلازميد GFP (يسار). (ب) جل البروتين الملون ب SYPRO Ruby بعد أن يظهر SDS-PAGE ملف تنقية MOMP-tNLP. يهاجر MOMP عند 40 كيلو دالتون ويهاجر 49ApoA1 عند 22 كيلو دالتون. الاختصارات: MOMP = بروتين الغشاء الخارجي الرئيسي الكلاميدي. tNLP = جسيم البروتين الدهني النانوي تيلوديندريمر ؛ MOMP-tNLP = مجمع MOMP-tNLP ؛ GFP = بلازميد ترميز البروتين الفلوري الأخضر ؛ MW = علامة الوزن الجزيئي ؛ T = إجمالي المحللة الخالية من الخلايا ؛ FT = التدفق من خلال ؛ R1-R3 = حصص التفاعل الخالية من الخلايا ؛ W1 ، W6 = يغسل 1 و 6 ؛ E1-E7 = Elutions من 1 إلى 7 ؛ Δ49ApoA1 = مشتق ApoA1 للماوس الموسوم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: القياس الكمي ل MOMP في عينات MOMP-tNLP . (أ) جل SDS-PAGE ملطخ ب SYPRO Ruby لتحديد كمية MOMP. تم تحميل MOMP المؤتلف بتركيز معروف على الجل للحصول على المنحنى القياسي. يحتوي كل ممر على 0.1 ميكروغرام و 0.5 ميكروغرام و 1.0 ميكروغرام و 2.0 ميكروغرام و 4.0 ميكروغرام من MOMP. تم تحميل عينات MOMP-tNLP التي تم قياسها كميا على نفس الجل. (ب) تم إنشاء منحنى معيار تركيز MOMP باستخدام قياس الكثافة. تم إنشاء معادلة تربط كثافة النطاق الطبيعي ومقدار MOMP. تم استخدام المعادلة لحساب محتوى MOMP في العينات غير المعروفة. الاختصارات: MOMP = بروتين الغشاء الخارجي الرئيسي الكلاميدي. tNLP = جسيم البروتين الدهني النانوي تيلوديندريمر ؛ MOMP-tNLP = مجمع MOMP-tNLP ؛ SDS-PAGE = الصوديوم دوديسيل سلفات بولي أكريلاميد هلام الكهربائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
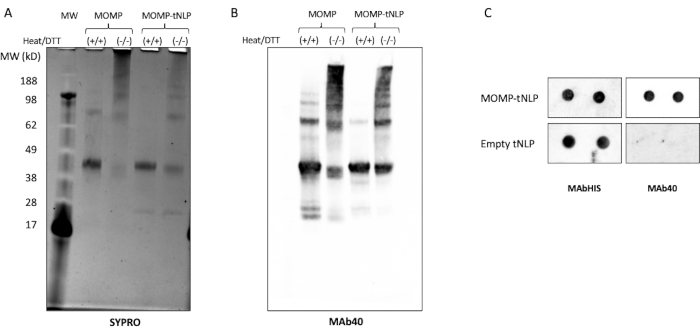
الشكل 3: تسمح MOMP-tNLP المنتجة بدون خلايا ل MOMP بتكوين هياكل أعلى مرتبة. (أ) جل SDS-PAGE من MOMP-tNLP مع وبدون معالجة الحرارة وعامل الاختزال DTT ، ملطخ ب SYPRO Ruby. مع الحرارة و DTT ، ظهر MOMP بشكل أساسي كنطاق مونومر عند ~ 40 كيلو دالتون ، حيث كسرت الحرارة وعامل الاختزال غالبية بنية MOMP ذات الترتيب الأعلى. في غياب الحرارة و DTT ، كانت النطاقات ذات الترتيب الأعلى موجودة ، مما يشير إلى تشكل oligomer MOMP. (ب) اللطخة الغربية من MOMP-tNLP و MOMP وحدها ، غير معالجة ومعالجة بالحرارة و DTT. بعد النقل ، تم فحص الغشاء باستخدام MAb40 (تخفيف 1: 1000). لوحظ نمط ربط مشابه للهلام المصبوغ بالياقوت SYPRO ، مما يؤكد أن نطاقات الوزن الجزيئي الأعلى كانت بالفعل أوليغومرات MOMP. (C) بقعة بقعة من MOMP-tNLP وعينات tNLP فارغة (في نسختين) تم فحصها باستخدام MAb40 و MAbHIS. الاختصارات: MOMP = بروتين الغشاء الخارجي الرئيسي الكلاميدي. tNLP = جسيم البروتين الدهني النانوي تيلوديندريمر ؛ MOMP-tNLP = مجمع MOMP-tNLP ؛ SDS-PAGE = الصوديوم دوديسيل سلفات بولي أكريلاميد هلام الكهربائي. DTT = ديثيوثريتول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 4: MOMP-tNLP المنتج بدون خلايا مناعي للغاية. أظهر المصل من الفئران المحصنة إشارة قوية مضادة ل MOMP IgG. تم استخدام MOMP-tNLP المساعد مع CpG + FSL-1 لتحصين الفئران. تم جمع الأمصال من ستة فئران محصنة وتجميعها واستخدامها لفحص MOMP-tNLP. كان المصل قادرا على الارتباط ب MOMP في مقايسة النشاف الغربية وأظهر إشارة IgG قوية (يسار). أظهرت اللطخة الغربية التي تستخدم MAb40 كجسم مضاد أساسي (يمين) نطاقات مماثلة ، مما يشير إلى أن المصل يحتوي على IgG خاص ب MOMP. الاختصارات: MOMP = بروتين الغشاء الخارجي الرئيسي الكلاميدي. tNLP = جسيم البروتين الدهني النانوي تيلوديندريمر ؛ MOMP-tNLP = مجمع MOMP-tNLP ؛ CpG = مساعد CpG المعدل للكوليسترول ؛ FSL-1 = مساعد محبة للدهون. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم المخزن المؤقت | NaH2PO4 | كلوريد الصوديوم | إيميدازول | الرقم الهيدروجيني |
| عازلة ملزمة | 50 مللي متر | 300 مللي متر | 10 مللي متر | 8.0 |
| غسل العازلة | 50 مللي متر | 300 مللي متر | 20 مللي متر | 8.0 |
| العازلة للشطف 1 | 50 مللي متر | 300 مللي متر | 250 مللي متر | 8.0 |
| العازلة للشطف 2 | 50 مللي متر | 300 مللي متر | 500 مللي متر | 8.0 |
الجدول 1: قائمة المخازن المؤقتة اللازمة لتنقية تقارب النيكل مع تفصيل تركيزات كل مكون ودرجة الحموضة.
| وقت التشغيل | 50 دقيقة |
| معدل التدفق | 6.0 مل / دقيقة |
| نوع التدرج | ثنائي |
| المخزن المؤقت أ | 10 مللي متر TEAA في H20 |
| المخزن المؤقت ب | مكن |
| التدرج | ٪ المخزن المؤقت ب |
| 0 دقيقة | 25% |
| 30 دقيقة | 60% |
| 30.5 دقيقة | 100% |
| 40 دقيقة | 100% |
| 40.5 دقيقة | 25% |
| 50 دقيقة | 25% |
الجدول 2: شروط المرحلة العكسية HPLC تنقية CpG المعدلة للكوليسترول. الاختصارات: TEAA = أسيتات ثلاثي إيثيل الأمونيوم. MeCN = الأسيتونيتريل.
| محللة خالية من الخلايا (مل) | DMPC الدهون (ملغ) | تيلوديندريمر (ملغ) | بلازميد MOMP (ميكروغرام) | العائد المنقى MOMP (ملغ) |
| 1 | 4 | 0.4 | 15 | 0.5 |
| 2 | 8 | 0.8 | 30 | 1.1 |
| 3 | 12 | 1.2 | 45 | 1.6 |
| 5 | 20 | 2 | 75 | 2.7 |
الجدول 3: كمية الليبيدات والتيلوديندريمر والبلازميدات المستخدمة في التفاعلات الخالية من الخلايا ذات القشور المختلفة والعوائد المقابلة. الاختصارات: MOMP = بروتين الغشاء الخارجي الرئيسي الكلاميدي. DMPC = 1،2-ديميريستويل-sn-غليسيرو-3-فوسفوكولين.
| نسب مدخلات البلازميد ، MOMP: Δ49ApoA1 | 1:1 | 5:1 | 10:1 | 25:1 | 50:1 | 100:1 | |
| نسب كمية البروتين المنتجة ، MOMP: Δ49ApoA1 | 0.02 | 0.32 | 0.64 | 3.46 | 6.55 | 20.04 | |
| العدد المقدر لإدخال MOMP لكل tNLP | 0.03 | 0.37 | 0.75 | 4.04 | 7.65 | 23.39 | |
الجدول 4: نسب البلازميد في تفاعل خال من الخلايا ومعدلات إدخال MOMP الناتجة. الاختصارات: MOMP = بروتين الغشاء الخارجي الرئيسي الكلاميدي. tNLP = جسيم البروتين الدهني النانوي تيلوديندريمر ؛ Δ49ApoA1 = مشتق ApoA1 للماوس الموسوم.
Discussion
الكلاميديا هي العدوى المنقولة جنسيا الأكثر شيوعا والتي تؤثر على كل من الرجال والنساء. على الرغم من أن أبحاث اللقاح على الكلاميديا تمتد لعقود ، إلا أن اللقاح الآمن والفعال الذي يمكن توسيع نطاقه إلى الإنتاج الضخم ظل بعيد المنال13. يعتبر الكلاميديا MOMP المرشح الرئيسي كمستضد لقاح وقائي. ومع ذلك ، فإن MOMP شديد الكارهة للماء وعرضة للطي غير الصحيح14,15. كشفت دراسة أخرى أن MOMP موجود في حالات قليلة القسيمات الضرورية لمناعته11. بالتفصيل هنا هو طريقة التعبير المشترك التي تم التحقق من صحتها والخالية من الخلايا والتي تنتج MOMP قليلة القسيمات المتكونة داخل الجسيمات النانوية tNLP كلقاح ، مع غلة تبلغ حوالي 1.5 ملغ من MOMP المنقى لكل 3 مل من المحللات. ويمكن توسيع نطاق هذا الإجراء المقارن بالكامل ليشمل الإنتاج الصناعي، مما يزيد من آفاقه كنهج مفيد لتوليد اللقاحات.
لقد نشرنا سابقا عن استخدام التعبير الخالي من الخلايا لإنتاج بروتينات غشائية مضمنة في البرمجة اللغوية العصبية3،16 ، بالإضافة إلى التعبير في الأقراص المستقرة بالتيلوديندريمر . ومع ذلك ، أنتجت هذه التقنية الأخيرة جزيئات غشاء البروتين مع عدم تجانس أكبر وقابلية ذوبان أقل. 4 بالإضافة إلى ذلك ، فإن الاستمناع لجسيمات MOMP-telodendrimer غير واضح مقارنة بجسيمات MOMP-tNLP6.
يمكن تكييف هذا الإجراء لتوسيع نطاق التعبير عن بروتينات الغشاء البكتيري المرشحة الواعدة كمستضدات للاستخدام في لقاحات الوحدات الفرعية. لا ينتج هذا الإجراء بروتين غشاء بكتيري قابل للذوبان فحسب ، بل إن بنية الجسيمات النانوية الشاملة قابلة لمزيد من التعديل باستخدام مجموعة متنوعة من المواد المساعدة للقاح المحبة للدهون بما في ذلك ، على سبيل المثال لا الحصر ، CpG المترافق مع جزء الكوليسترول أو FSL-1. يعد التعبير عن المستضدات المرشحة الأخرى من البكتيريا أمرا ممكنا ، على الرغم من أن المعلمات مثل درجة حرارة التعبير واختيار الدهون ونوع نظام التعبير قد تحتاج إلى استكشاف لتحقيق الغلة المثلى.
بالإضافة إلى ذلك ، يعد اختيار البلازميد ونسبته أمرا بالغ الأهمية في هذه العملية. يجب بناء كل من البلازميدات المستخدمة من نفس العمود الفقري. إذا كانت الإدخالات بنفس الطول تقريبا ، فيمكن أن تستند النسب إلى كتلة البلازميد المضافة ، كما هو موضح هنا. ومع ذلك ، فإن النسب على أساس الشامات سيعطي نتائج أكثر قابلية للتكرار ، خاصة عند قياس التفاعلات. قد لا تنطبق النسب التي تعمل بشكل جيد في تفاعلات مقياس الشاشة (< 0.5 مل) على التفاعلات الأكبر وقد تتطلب تحسينا إضافيا. لا يزال من الممكن التعبير عن البروتينات غير الغشائية باستخدام مجموعات خالية من الخلايا ولكنها قد لا تتطلب الجسيمات النانوية الدهنية (التعبير المشترك) لإنتاج منتج قابل للذوبان. بالإضافة إلى ذلك ، بينما يصف هذا البروتوكول المساعدة باستخدام CpG و FSL-1 ، فإن هذا النظام قابل للصياغة مع المواد المساعدة الأخرى المحبة للدهون أو الاختلاط مع المواد المساعدة القابلة للذوبان حسب الرغبة.
من الضروري تجنب التلوث عند إعداد تفاعل التعبير الخالي من الخلايا لأن ذلك يمكن أن يؤثر على الغلة. يجب أن تكون أي إضافات للتفاعل ، بما في ذلك البلازميدات نفسها ، نقية للغاية. بالإضافة إلى ذلك ، يجب أن تكون البروتينات المعبر عنها على اتصال فقط بالمواد والمحاليل الخالية من تلوث السموم الداخلية. يمكن أن يؤدي تلوث السموم الداخلية في التركيبات المرشحة إلى نتائج غير متسقة وزائفة للمقايسات المناعية ويمكن أن يكون ضارا بكميات كافية. على الرغم من عدم وصفها هنا ، فقد يكون من الضروري إجراء تنقية إضافية بعد كروماتوغرافيا تقارب النيكل إذا لوحظت العديد من الملوثات في خطوات التحليل اللاحقة مثل من خلال SDS-PAGE. ويمكن تحقيق ذلك مع لجنة الأوراق المالية والبورصات، على الرغم من أن الظروف قد تتطلب التحسين على أساس كل صياغة على حدة.
Disclosures
يعلن المؤلفون أنه ليس لديهم مصالح مالية متنافسة معروفة أو علاقات شخصية يمكن أن يبدو أنها تؤثر على العمل المذكور في هذه الورقة.
Acknowledgements
تم دعم هذا العمل من خلال منحة خدمة الصحة العامة R21 AI20925 و U19 AI144184 من المعهد الوطني للحساسية والأمراض المعدية. تم تنفيذ هذا العمل تحت رعاية وزارة الطاقة الأمريكية من قبل مختبر لورانس ليفرمور الوطني بموجب العقد DE-AC52-07NA27344 [LLNL-JRNL-822525 ، LLNL-VIDEO-832788].
Materials
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) as powder | Avanti Polar Lipids | 850345 | |
| 1.5 mL endotoxin-free centrifuge tubes | Eppendorf | 2600028 | |
| 1 M Trizma hydrochloride solution | Millipore Sigma | T2194 | |
| Acetic acid, glacial, ACS reagent, ≥99.7% | Millipore Sigma | 695092 | |
| Bio-Dot apparatus | Bio-Rad | 1706545 | |
| Buffer Dam for XCell SureLock | Life Technologies | EI0012 | |
| C24 Incubator shaker | New Brunswick Scientific | ||
| Cell-Free Expression System: RTS 500 ProteoMaster E. coli HY Kit | BiotechRabbit | BR1400201 | |
| cOmplete His-Tag Purification Resin | Roche Molecular Diagnostics | 5893682001 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Roche Molecular Diagnostics | 4693132001 | |
| CpG-ODN1826 | Biosearch Technologies | T9449 | |
| D-(+)-Trehalose dihydrate | Millipore Sigma | 71509 | |
| Dialysis tubes D-Tube Dialyzer Maxi | Millipore Sigma | 71508-3 | |
| Disposable, polypropylene fritted columns 10 mL capacity | Bio-Rad | 7311550EDU | |
| Dulbecco’s Phosphate-buffered Saline (PBS) | Millipore Sigma | D8537 | |
| Electrophoresis Power Supply | |||
| Endosafe PTS cartridge | Thermo Fisher Scientific | NC9594798 | |
| Endosafe-PTS Testing System | Charles River | ||
| Gel wash solution: 10% methanol, 7% acetic acid | |||
| HCl and NaOH solutions for pH adjustment | |||
| HPLC with UV-vis diode array detector | Shimadzu | ||
| HyClone HyPure culture-grade water | VWR | 82007-328 | |
| iBlot 2 Dry Blotting System | Life Technologies | ||
| iBlot 2 Transfer Stacks, PVDF | Life Technologies | IB24001 | |
| Image Studio V2.0 software | Li-COR Biiosciences | ||
| Imidazole | Millipore Sigma | I5513 | |
| Immun-Blot PVDF Membrane | Bio-Rad | 1620177 | |
| LI-COR Odyssey Fc imager | Li-COR Biiosciences | ||
| Lyophilizer | Labconco | ||
| Methanol (≥99.9%) | Millipore Sigma | 34860 | |
| Microcentrifuge | |||
| Microwave oven | |||
| NanoDrop One/OneC Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | ND-ONE-W | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm | Life Technologies | NP0321 | |
| NuPAGE LDS Sample Buffer (4x) | Life Technologies | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Life Technologies | NP000202 | |
| NuPAGE Sample Reducing Agent (10x) | Life Technologies | NP0009 | |
| Odyssey Blocking Buffer in TBS containing 0.2% Tween 20 | Li-COR Biosciences | 927-50000 | |
| Orbital Shaker | |||
| PBS-T (1x PBS, 0.2% Tween 20, pH 7.4) | |||
| PEG5K-CA8 Telodendrimer (custom synthesis product) | |||
| pIVEX2.4d vector | Roche Molecular Diagnostics | ||
| Plasmid Maxi Kit | Qiagen | 12162 | |
| Primary antibody: MAb40 (monoclonal antibody to the variable domain 1 (VD1) of C. muridarum MOMP, de la Maza laboratory)4 | |||
| Primary antibody: MAbHIS, Penta-His antibody | Qiagen | 34660 | |
| Probe sonicator | |||
| Qubit 3.0 Fluorometer | Life Technologies | Q33216 | |
| Qubit Protein Assay Kit | Life Technologies | Q33212 | |
| Rainin Pipette tips: LTS 1000 µL | Rainin | 17002428 | |
| Rainin Pipette tips: LTS 20 µL | Rainin | 17002429 | |
| Rainin Pipette tips: LTS 200 µL | Rainin | 17002426 | |
| Rainin Pipettes | Rainin | ||
| Secondary antibody: IRDye 800CW goat (polyclonal) anti-mouse IgG (heavy and light) | Li-COR Biosciences | 926-32210 | |
| SeeBlue Plus2 Pre-stained Protein Standard | Life Technologies | LC5925 | |
| Sodium chloride NaCl | Millipore Sigma | S7653 | |
| Sodium phosphate monobasic NaH2PO4 | Millipore Sigma | S0751 | |
| Superdex 200, 5/150 GL column | Cytiva | GE28-9909-45 | |
| Synthetic diacylated lipoprotein-TLR2/6 FSL-1 | Invivogen | tlrl-fsl | |
| SYPRO Ruby Protein Gel Stain | Life Technologies | S12001 | |
| TWEEN 20 | Millipore Sigma | P1379 | |
| UV light source | |||
| Vacufuge Bench Top Centrifuge | Eppendorf | ||
| Vortexer | |||
| VWR 15 mL conicals (89039-666) | VWR | ||
| VWR 50 mL conicals (89039-656) | VWR | ||
| XCell SureLock Mini-Cell (Life Technologies ) | Life Technologies | EI0001 |
References
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: applications come of age. Biotechnology Advances. 30 (5), 1185-1194 (2012).
- Coleman, M. A., et al. Expression and association of the Yersinia pestis translocon proteins, YopB and YopD, are facilitated by nanolipoprotein particles. PLoS One. 11 (3), 0150166(2016).
- Cappuccio, J. A., et al. Cell-free co-expression of functional membrane proteins and apolipoprotein, forming soluble nanolipoprotein particles. Molecular & Cellular Proteomics: MCP. 7 (11), 2246-2253 (2008).
- He, W., et al. Controlling the diameter, monodispersity, and solubility of ApoA1 nanolipoprotein particles using telodendrimer chemistry. Protein Science. 22 (8), 1078-1086 (2013).
- He, W., et al. Cell-free production of a functional oligomeric form of a Chlamydia major outer-membrane protein (MOMP) for vaccine development. Journal of Biological Chemistry. 292 (36), 15121-15132 (2017).
- Tifrea, D. F., et al. Induction of protection in mice against a Chlamydia muridarum respiratory challenge by a vaccine formulated with the major outer membrane protein in nanolipoprotein particles. Vaccines. 9 (7), 755(2021).
- Cleveland, T. E., et al. Small-angle X-ray and neutron scattering demonstrates that cell-free expression produces properly formed disc-shaped nanolipoprotein particles. Protein Science. 27 (3), 780-789 (2018).
- Fischer, N. O., et al. Conjugation to nickel-chelating nanolipoprotein particles increases the potency and efficacy of subunit vaccines to prevent West Nile encephalitis. Bioconjugate Chemistry. 21 (6), 1018-1022 (2010).
- Fischer, N. O., et al. Colocalized delivery of adjuvant and antigen using nanolipoprotein particles enhances the immune response to recombinant antigens. Journal of the American Chemical Society. 135 (6), 2044-2047 (2013).
- Fischer, N. O., et al. Evaluation of nanolipoprotein particles (NLPs) as an in vivo delivery platform. PLoS One. 9 (3), 93342(2014).
- Pal, S., Peterson, E. M., de la Maza, L. M. Vaccination with the Chlamydia trachomatis major outer membrane protein can elicit an immune response as protective as that resulting from inoculation with live bacteria. Infection and Immunity. 73 (12), 8153-8160 (2005).
- Sun, G., et al. Structural and functional analyses of the major outer membrane protein of Chlamydia trachomatis. Journal of Bacteriology. 189 (17), 6222-6235 (2007).
- Hafner, L. M., Wilson, D. P., Timms, P. Development status and future prospects for a vaccine against Chlamydia trachomatis infection. Vaccine. 32 (14), 1563-1571 (2014).
- Findlay, H. E., McClafferty, H., Ashley, R. H. Surface expression, single-channel analysis and membrane topology of recombinant Chlamydia trachomatis Major Outer Membrane Protein. BMC Microbiology. 5, 5(2005).
- Sun, G., Pal, S., Weiland, J., Peterson, E. M., de la Maza, L. M. Protection against an intranasal challenge by vaccines formulated with native and recombinant preparations of the Chlamydia trachomatis major outer membrane protein. Vaccine. 27 (36), 5020-5025 (2009).
- He, W., et al. Cell-free expression of functional receptor tyrosine kinases. Scientific Reports. 5 (1), 12896(2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved