Method Article
في الموقع تصور نمو المحور العصبي وديناميكيات مخروط النمو في مزارع شرائح الدماغ الجنينية الحادة خارج الجسم الحي
In This Article
Summary
يوضح هذا البروتوكول طريقة مباشرة وقوية لدراسة نمو المحور العصبي في الموقع وديناميكيات مخروط النمو. وهو يصف كيفية إعداد شرائح الدماغ الحادة ذات الصلة من الناحية الفسيولوجية خارج الجسم الحي ويوفر خط أنابيب تحليل سهل الاستخدام.
Abstract
أثناء تطور الخلايا العصبية ، تتنقل المحاور العصبية في البيئة القشرية للوصول إلى وجهاتها النهائية وإنشاء اتصالات متشابكة. تقوم مخاريط النمو - الهياكل الحسية الموجودة في الأطراف البعيدة لتطوير المحاور العصبية - بتنفيذ هذه العملية. تعد دراسة بنية وديناميكيات مخروط النمو أمرا بالغ الأهمية لفهم التطور المحوري والتفاعلات مع الجهاز العصبي المركزي المحيط (CNS) التي تمكنه من تكوين دوائر عصبية. هذا أمر ضروري عند ابتكار طرق لإعادة دمج المحاور العصبية في الدوائر العصبية بعد الإصابة في البحوث الأساسية والسياقات قبل السريرية. حتى الآن ، يعتمد الفهم العام لديناميكيات مخروط النمو في المقام الأول على دراسات الخلايا العصبية المستزرعة في بعدين (2D). على الرغم من أنها أساسية بلا شك للمعرفة الحالية بالديناميكيات الهيكلية لمخروط النمو والاستجابة للمحفزات ، إلا أن دراسات 2D تحرف البيئة الفسيولوجية ثلاثية الأبعاد (3D) التي تواجهها مخاريط النمو العصبي في أنسجة الجهاز العصبي المركزي السليمة. في الآونة الأخيرة ، تم استخدام المواد الهلامية الكولاجين للتغلب على بعض هذه القيود ، مما مكن من التحقيق في تطور الخلايا العصبية في 3D. ومع ذلك ، تفتقر كل من البيئات الاصطناعية 2D و 3D إلى إشارات الإشارة داخل أنسجة الجهاز العصبي المركزي ، والتي توجه الامتداد والبحث عن المسارات للمحاور الجذعية النامية. يوفر هذا البروتوكول طريقة لدراسة المحاور ومخاريط النمو باستخدام شرائح الدماغ العضوية ، حيث تواجه المحاور النامية إشارات فيزيائية وكيميائية ذات صلة فسيولوجيا. من خلال الجمع بين المضبوط بدقة في الرحم وخارج الرحم الكهربائي لتقديم مراسلات الفلورسنت بشكل ضئيل جنبا إلى جنب مع الفحص المجهري فائق الدقة ، يقدم هذا البروتوكول خط أنابيب منهجي لتصور ديناميكيات مخروط المحور العصبي والنمو في الموقع. وعلاوة على ذلك، يتضمن وصفا مفصلا لمجموعة أدوات لتحليل بيانات التصوير الطويل الأجل وبيانات التصوير بالخلايا الحية.
Introduction
الخلايا العصبية هي خلايا شديدة الاستقطاب تمثل الوحدة الحسابية الأساسية في الجهاز العصبي. فهي تتلقى وتصدر معلومات تعتمد على تجزئة مواقع المدخلات والمخرجات: التشعبات والمحاور المحورية، على التوالي1. أثناء التطوير ، تمتد المحاور العصبية أثناء التنقل في بيئة معقدة لا تصدق للوصول إلى وجهتها. تسترشد الملاحة المحورية بمخروط النمو ، وهو هيكل حسي يقع عند طرف المحور المحوري النامي. مخروط النمو مسؤول عن اكتشاف الإشارات البيئية وترجمتها إلى إعادة التنظيم المكاني الديناميكي للهيكل الخلوي 2,3. تقوم التفاعلات المورفولوجية الميكانيكية الناتجة بتوجيه مخروط النمو إلى التمدد أو التراجع عن إشارة التحفيز ، مما يؤدي إلى مناورات محورية محددة.
ينبع الفهم الحالي لديناميكيات مخروط المحور العصبي والنمو من الدراسات التي تقيم نمو المحور العصبي على ركائز ثنائية الأبعاد (2D)2،4،5،6،7. حددت هذه الدراسات الرائدة التفاعل المتطور بين مخاريط النمو وركائز النمو وكشفت عن اختلافات مذهلة تعتمد على خصائص الركيزة مثل الالتصاق والصلابة 8,9. بقيادة هذه الرؤى ، تم افتراض الإشارات البيئية خارج الخلية لإملاء نمو المحور العصبي ، مع الهيكل الخلوي المخروطي للنمو الذي نفذ هذا النمو2،10،11،12. والجدير بالذكر أن الخلايا العصبية يمكنها تمديد المحاور العصبية في ركائز غير لاصقة (على سبيل المثال، بولي ليسين وبولي أورنيثين)13. علاوة على ذلك ، يمكن أن تؤثر صلابة الركيزة على معدل نمو المحور العصبي بشكل مستقل عن المجمعات اللاصقة للخلايا8. وبالتالي ، فإن دراسة ديناميكيات مخروط النمو في ركائز 2D وحدها لا يمكن أن تشكل بدقة توازن القوى التي تنشأ عن تفاعل مخاريط النمو المحورية مع البيئات ثلاثية الأبعاد (3D) ذات الصلة من الناحية الفسيولوجية ، مثل تلك الموجودة في الجسم الحي.
للتغلب على قيود الفحوصات ثنائية الأبعاد ، تمت دراسة نمو المحور العصبي وديناميكيات مخروط النمو في مصفوفات 3D 8,9. تشكل هذه المصفوفات سياقا فسيولوجيا أكثر ولكنها تسمح بدراسة الآليات الجوهرية الخلوية لنمو المحور العصبي. وهو يتيح فحص مخروط النمو بطريقة خلية واحدة في مجموعة متنوعة من الحالات والعلاجات الدوائية9. في مثل هذه البيئات ثلاثية الأبعاد ، أظهرت المحاور العصبية ديناميكيات هيكلية خلوية متميزة ونمت بشكل أسرع من تلك التي لوحظت في الخلايا العصبية المستزرعة 2D9. أظهرت هذه الدراسات الأنيقة تأثير بعد إضافي على إعادة تنظيم الهيكل الخلوي المخروطي للنمو ، وبالتالي على سلوكه.
على الرغم من المزايا الواضحة التي تقدمها مصفوفات 3D على الأسطح 2D في دعم التطور العصبي الشبيه بالسكان الأصليين ونمو المحور العصبي ، إلا أنها تظل سقالة اصطناعية مبسطة لا يمكنها أن تعكس تعقيد الديناميكيات التي لوحظت في أنسجة الجهاز العصبي المركزي (CNS). هنا ، تم الجمع بين تسليم البلازميدات المراسلة عن طريق الرحم الخارجي وفي الرحم الكهربائي مع ثقافة شرائح النمط العضوي في الدماغ والتصوير الحي فائق الدقة في الموقع لتحليل ديناميكيات مخروط النمو في سياق فسيولوجي. تسمح هذه المنهجية بتصور المحاور النامية أثناء تجربة 3-dimensionality في بيئات الجسم الحي وتعقيد تركيبتها الفيزيائية الكيميائية. وأخيرا، يتم وصف الإجراءات سهلة الاستخدام لقياس نمو المحور العصبي وديناميكيات مخروط النمو باستخدام برامج مرخصة بشكل شائع ومتاحة للجمهور.
Protocol
يجب أن تمتثل التجارب على الحيوانات للوائح المؤسسية والفيدرالية ذات الصلة. تم استخدام اليوم الجنيني 15.5 و 12.5 (E15.5 و E12.5) من الفئران الحامل C57BL/6JRj في هذا البروتوكول. أجريت التجارب وفقا لقانون رعاية الحيوان الصادر عن وكالة البيئة الحكومية في شمال راين وستفاليا (Landesamt für Natur, Umwelt und Verbraucherschutz (LANUV)).
1. إعداد البلازميدات للحقن
- اعزل الحمض النووي باستخدام مجموعة Maxiprep الخالية من السموم الداخلية وفقا لبروتوكول الشركة المصنعة (انظر جدول المواد).
- امزج الحمض النووي المختار بالتركيز المطلوب (الجدول 1) والمحلول الأخضر السريع بنسبة 10٪ (انظر جدول المواد) لتصور توصيل خليط الحمض النووي إلى البطينين الدماغيين.
ملاحظة: تم استخدام بلازميدات محددة لوضع علامات متفرقة على الخلايا العصبية القشرية (الشكل 1A) ، وهياكل الأكتين الخيطية (F-actin) في مخروط النمو (الشكل 1B) ، ووضع علامات مزدوجة على مخاريط النمو داخل نفس القشرة (الشكل 1C). وقد ترسبت جميع البلازميدات (الجدول 1) المستخدمة في هذا البروتوكول في Addgene (انظر جدول المواد). - قم بتحضير الشعيرات الدموية الزجاجية باستخدام مجموعة مجتذب القطب الشعري وفقا للبرنامج التالي: الضغط: 500 ، الحرارة: 800 ، السحب: 30 ، والسرعة: 40.
- قم بتحميل 15 ميكرولتر من مزيج الحمض النووي / الأخضر السريع في كل شعيرات شعرية زجاجية باستخدام أطراف ماصة اللودر الصغير.
ملاحظة: تأكد من عدم تشكل فقاعات. - قم بتخزين الشعيرات الدموية المملوءة بالحمض النووي في طبق طوله 10 سم مع قطعة من طين النمذجة عبر قطر الطبق. يمكن تحميل الشعيرات الدموية وتخزينها عند 4 درجات مئوية في اليوم السابق للتجربة. أغلق الطرف الخلفي من الشعيرات الدموية بطبقة مرنة لمنع التجفيف.
2. إعداد الحلول
- تحضير محلول الملح المخزن مؤقتا من هانك مع الجلوكوز (HBSS-G).
- أضف 0.5٪ من 20٪ من مخزون الجلوكوز إلى زجاجة من 1x HBSS. تخلط جيدا وتخزن في 4 درجات مئوية لمدة تصل إلى 2 أسابيع. لاستخراج الجنين ، محلول الفقاعات HBSS-G مع الكاربوجين (95٪ O 2 و 5٪ CO2) باستخدام الحجر الفقاعي قبل وقت قصير من جمع الجنين.
- حل شرائح الوسائط
- قم بإعداد وسائط شرائح طازجة تحتوي على Neurobasal 1x ، مصل الحصان 5٪ ، مصل ربلة الساق الجنينية 5٪ ، ملحق B27 1:50 ، ملحق L-glutamin 1:400 ، البنسلين - الستربتومايسين 1: 200 ، وملحق Neuropan-2 1:100 (عند درجة الحموضة = 7.3) ، في ظل ظروف معقمة (انظر جدول المواد).
- تحضير أطباق 3 سم مع 1 مل من شرائح الوسائط لكل منهما. ضع في الحاضنة على درجة حرارة 35 درجة مئوية مع 5٪ CO2 لمدة 1 ساعة على الأقل قبل التجربة لتحقيق التوازن بين درجة الحموضة في الوسائط من خلال تبادل الغازات.
ملاحظة: يحدث توازن الأس الهيدروجيني للوسائط بسبب تحمض الوسائط بواسطة ثاني أكسيد الكربون2 من الحاضنة. يمكن تخزين وسائط الشرائح عند 4 درجات مئوية لمدة تصل إلى 1 أسبوع.
- محلول الأغاروز منخفض درجة الانصهار (3٪)
- وزن الكمية المطلوبة من مسحوق الأغاروز منخفض درجة الانصهار وتذوب في حجم مناسب من 1x HBSS-G في زجاجة زجاجية. هناك حاجة إلى ما يقرب من 7 مل من محلول الأغاروز لكل دماغ.
- ضع الزجاجة في الميكروويف لمدة 2-3 دقائق ، مع وضع الغطاء بشكل فضفاض ، ورجه كل 10-20 ثانية.
- بمجرد أن يذوب المسحوق تماما ، ضع الزجاجة في حمام مائي أو حمام خرز مضبوط على 37 درجة مئوية قبل 1 ساعة على الأقل من التجربة للسماح للأغاروز بالتبريد.
ملاحظة: يوصى بتسخين الأغاروز مرتين على مدى 15 دقيقة لضمان إذابة مسحوق الأغاروز. هذا أمر بالغ الأهمية للالتصاق السليم للأغاروز بأنسجة المخ. يجب استخدام ميزان حرارة لقياس درجة حرارة محلول الأغاروز أثناء تضمين الأدمغة ، والتأكد من أنها تتراوح بين 37-40 درجة مئوية. أدمغة الحيوانات المسنة المختلفة لها صلابة مختلفة. يوصى باختبار مجموعة من تركيزات الأغاروز للعثور على التجانس بين الأنسجة والأغاروس. - تحضير الفوسفات المخزنة مؤقتا المالحة مع 0.3٪ تريتون X-100 (PBS-T).
- تحضير محلول ملحي مخزنة مؤقتا بالفوسفات مع 0.2٪ أزيد الصوديوم (PBS-NaN3).
ملاحظة: الحلول الموضحة في الخطوات 2.4-2.5 مخصصة للاستخدام في خطوة الكيمياء النسيجية المناعية اللاحقة.
3. تجهيز محطة الجراحة
- قم بتنظيف محطة الجراحة بنسبة 70٪ -96٪ من الإيثانول ووضع عملية التشغيل على سطح المحطة.
- قم بتعقيم أدوات الجراحة عن طريق الشطف بنسبة 70٪ -96٪ من الإيثانول ، يليه التعقيم الجاف في معقم الخرز الساخن.
- نظف أقطاب ملاقط البلاتين (انظر جدول المواد) بنسبة 70٪ -96٪ من الإيثانول قبل الاتصال بمولد النبض.
- أدخل شعيرات دموية زجاجية مملوءة بالحمض النووي / الأخضر السريع في حامل الشعيرات الدموية. قبل الاستخدام مباشرة، اقطع طرف الشعيرات الدموية برفق باستخدام مقص ناعم واختبر تدفق المحلول داخل أنبوب طرد مركزي دقيق سعة 1.5 مل مملوء بمحلول ملحي أو ماء تم تسخينه مسبقا.
ملاحظة: يوضح الشكل 2A,B إعداد محطة الجراحة والأدوات المستخدمة في الكهربية خارج الرحم (EUE) وفي كهربية الرحم (IUE). - بالنسبة ل IUE ، قم بتسخين محلول ملحي إلى 37 درجة مئوية في حمام مائي.
4. استخراج الأجنة
- ضع الفأرة الحامل في غرفة محفز التخدير مع 5٪ من الأيزوفلوران حتى يتم تخدير الفأر بعمق. تأكيد التخدير من خلال عدم وجود منعكس سحب دواسة.
- انقل الماوس إلى أساس العملية وحافظ على الأيزوفلوران بنسبة 1.5٪ -2٪ من خلال مخروط الأنف.
- ضع مرهما على كلتا العينين لمنع تجفيف القرنية.
- حلق بطن الفأر ، ثم استخدم 70٪ -96٪ من الشاش المنقوع بالإيثانول لإزالة الشعر الحليق. تنظيف المنطقة مع البيتادين.
- باستخدام مقص جراحي صغير معقم ، قم بعمل شق جلدي 2 سم على طول خط الوسط البطني ، يليه شق عضلي 1.5 سم.
ملاحظة: يعتمد حجم الشق على حجم الجنين. في الواقع ، ستحتاج الأجنة الأكبر حجما إلى شق أكبر لاستيعاب استخراجها. - قم بقطع ثقب في منتصف الشاش بعرض كاف ليناسب شق الجلد (قطره ~ 2 سم) ، وانقعه بمحلول ملحي دافئ ، وضعه حول فتحة البطن.
- اسحب كلا القرنين الرحميين باستخدام برعم قطني منقوع في محلول ملحي دافئ أو باستخدام ملقط ، مع الاستيلاء بعناية على المسافات بين الأجنة لسحبها. ضع الأجنة على الشاش الرطب (الشكل 2C).
ملاحظة: حتى الضرر الصغير للأوعية الدموية والشعيرات الدموية حول قرون الرحم من المرجح أن يؤدي إلى نزيف غزير. لذلك ، تجنب التعامل المباشر مع هذه المناطق الوعائية في جميع الأوقات. - اقطع كيس الرحم وأزل كل جنين (الشكل 2D).
- القتل الرحيم لكل جنين مباشرة بعد الاستخراج عن طريق قطع قطري تنازلي ، مما يضمن نقل الحبل الشوكي بالكامل (الشكل 2E).
- ضع الأجنة في طبق 10 سم يحتوي على HBSS-G على الثلج.
ملاحظة: يتم تجنب قطع رأس الجنين لمنع تسرب الحمض النووي / الخليط الأخضر السريع من الدماغ وتسهيل وضع الجنين بسهولة في الحامل (انظر خارج الرحم الكهربائي ، الخطوة 5). - التضحية بالأم مباشرة بعد استخراج الأجنة عن طريق إجراء خلع عنق الرحم.
ملاحظة: هنا ، يتم القتل الرحيم للأم تحت التخدير لتجنيبها أي ألم أو معاناة أخرى بعد الإجراء امتثالا للبروتوكول المعتمد بموجب قانون رعاية الحيوان التابع لوكالة البيئة الحكومية في شمال راين وستفاليا (LANUV).
5. خارج الرحم الكهربائي (EUE)
- التقط جنينا وضعه في الحامل.
ملاحظة: يتم استخدام طرف ماصة مقطوع 1 مل متصل بنهاية مكشطة الخلية كحامل جنين. من الضروري إبقاء أذرع الأجنة خارج الطرف أثناء الإجراء لمنعها من الانزلاق إلى الطرف (الشكل 2F-I). قطر طرف الماصة قابل للتعديل بسهولة لاستيعاب الأجنة من مختلف الأحجام. قم بقص طرف ثان بالطول حيث يتطابق قطر الطرف مع حجم الجنين واستخدمه كمدخل محول إلى الحامل المذكور أعلاه. - أدخل بعناية الحمض النووي / الشعيرات الدموية الزجاجية المملوءة باللون الأخضر السريع من خلال جمجمة الجنين في البطين الجانبي وحقن 2-3 ميكرولتر من مزيج بلازميد الحمض النووي (الشكل 1A ، B ؛ الجدول 1) في كل بطين (الشكل 2F).
ملاحظة: استخدم الغرز اللامدوئيدية والسهمية كدليل لموقع حقن الحمض النووي. الغرز اللامدوئيدية والسهمية هي مفاصل ليفية تربط الصفيحة العظمية للجمجمة. الأول ينضم إلى العظم الجداري مع العظم القذالي ، والأخير ينضم إلى العظمتين الجداريتين. - امسك رأس الجنين بين أقطاب ملاقط البلاتين بالزاوية المناسبة لاستهداف منطقة الدماغ المطلوبة (زاوية 60 درجة في هذه الحالة) ، مع مواجهة الكاثود للمنطقة التي يقصد بها نقل الحمض النووي (الشكل 2G-H).
- ضع خمس نبضات عند 30 mV مع فاصل زمني قدره 1 ثانية ومدة 50 مللي ثانية باستخدام مولد نبض موجة مربعة.
ملاحظة: ضع في اعتبارك أن الأدمغة في EUE تواجه مجالا كهربائيا أكثر فعالية من تلك الموجودة في IUE. وبالتالي ، عند تركيز معين من الحمض النووي ، ينتج عن EUE كفاءة أعلى لنقل الحمض النووي من IUE ، ويجب تعديل تركيزات الحمض النووي وفقا لذلك. - إذا كانت هناك حاجة إلى الكهربية الثنائية ، كرر الخطوات 5.3-5.4 مع الكاثود والأنود الذي يعكس الموضع السابق لاستهداف القشرة المقابلة.
ملاحظة: نظرا لأن كلا البطينين تم حقنهما بالحمض النووي ، فقد تم استهداف قشور نصفي الكرة الأرضية. - ضع الجنين الكهربائي في طبق بحجم 6 سم يحتوي على HBSS-G البارد المثلج. كرر الخطوات من 5.1 إلى 5.6 لكافة الأجنة المطلوبة.
6. في الرحم الكهربائي (IUE)
- حقن الفأر الحامل مع مسكن. 50 ميكرولتر من البوبرينورفين (0.1 ملغم / كغ) (انظر جدول المواد) تحت الجلد ، قبل 20 دقيقة من الإجراء.
- نفذ الخطوات من 4.1 إلى 4.8 من قسم استخراج الأجنة.
ملاحظة: تجنب ترك الأجنة مكشوفة دون داع عن طريق تغطيتها بشاش معقم منقوع في محلول ملحي دافئ. - باستخدام أطراف الأصابع، قم بتدوير الجنين بلطف داخل الرحم حتى يتم العثور على خيوط لامدويدال وسهمية (الشكل 2J). أدخل بعناية الحمض النووي / الشعيرات الدموية الزجاجية الخضراء السريعة من خلال جدار الرحم وجمجمة الجنين في البطين الجانبي وحقن 2-3 ميكرولتر من مزيج بلازميد الحمض النووي (الشكل 1A ، C) في أحد البطينين أو كليهما حسب الرغبة (الشكل 2K-L).
ملاحظة: يمكن أن يؤدي الضغط المفرط بالإصبع على قرون الرحم إلى انهيار الكيس الأمنيوسي. - امسك رأس الجنين بين أقطاب ملاقط البلاتين بالزاوية المناسبة لاستهداف منطقة الدماغ المطلوبة (زاوية 60 درجة في هذه الحالة) ، مع مواجهة الكاثود للمنطقة التي يقصد بها نقل الحمض النووي. تجنب الضغط على الرحم لأنه قد يسبب انهيار الكيس الأمنيوسي (الشكل 2M).
- ضع خمس نبضات عند 35 مللي فولت بفاصل زمني قدره 600 مللي ثانية ومدة 50 مللي ثانية باستخدام مولد نبض موجة مربعة.
- إذا تم حقن كلا البطينين الجانبيين، كرر الخطوات 6.5-6.6 مع الكاثود والأنود اللذين يعكسان الموضع السابق لاستهداف القشرة المقابلة.
- كرر الخطوات من 6.3 إلى 6.6 لكافة الأجنة المطلوبة.
- بمجرد أن يتم وضع جميع الأجنة المطلوبة بالكهرباء ، استخدم برعم قطني منقوع بمحلول ملحي لوضع قرون الرحم مرة أخرى داخل تجويف البطن بلطف.
ملاحظة: إضافة محلول ملحي إلى التجويف البريتوني سيساعد قرون الرحم على الانزلاق مرة أخرى إلى موضعها. - خياطة العضلات وشقوق الجلد باستخدام 5-0 مادة خياطة. استخدم مشابك خياطة لتأمين الجرح وتطهير جرح الخياطة عن طريق رشه بالبيتادين (الشكل 2N-P).
- حقن الماوس مع 200 ميكرولتر من الجلوكوز 5 ٪ تحت الجلد.
- حقن الفأر بمضاد حيوي ؛ 50 ميكرولتر من إنروفلوكساسين (5 مغ/كغ) تحت الجلد (انظر جدول المواد).
- ضع الماوس مرة أخرى في قفص الاسترداد وحافظ على الدفء باستخدام ضوء الاحترار بالأشعة تحت الحمراء البعيدة أو وسادة التدفئة لمدة 20 دقيقة على الأقل بعد الإجراء (الشكل 2Q).
- راقب الفأر يوميا ، وحقن ميلوكسيكام بعد الإجراء لتخفيف الألم باتباع الإرشادات المؤسسية والفيدرالية.
- استخراج الأجنة بعد يومين من الإجراء (أي E17.5) بعد الخطوة 4.
7. استخراج الدماغ وتضمينه في الأغاروز
ملاحظة: يوصى بتنفيذ الخطوات التالية تحت مجهر التشريح للحصول على دقة أفضل. تجنب تلف الدماغ أمر بالغ الأهمية لنجاح الإجراء.
- قم بإعداد أدوات الاستخراج في مساحة عمل معقمة تحت غطاء تشريح (الشكل 3A).
- افصل رأس الجنين عن بقية الجسم باستخدام مقص التشريح.
- ثبت الرأس كما هو موضح في الشكل 3C ، ثم قم بإزالة الجلد والجمجمة عن طريق القطع على طول خط الوسط ، بدءا من قاعدة الرأس نحو الأنف (الشكل 3D).
- قشر الجلد والجمجمة أفقيا ، مما يجعل فجوة كبيرة بما فيه الكفاية (~ 1 سم) لاستئصال الدماغ.
- لإزالة الدماغ، أدخل الطرف المغلق من مقص التشريح المعقم، بدءا من تحت المصباح الشمي الذي يتحرك نحو جذع الدماغ (الشكل 3E).
- اقطع جذع الدماغ وقم بتقليم أي قطع فضفاضة من السحايا حول الدماغ (الشكل 3F).
ملاحظة: غالبا ما تتسبب السحايا الرخوة في بقاء الشرائح متصلة بكتلة الأغاروز بعد القطع، مما يؤدي إلى فصل الأنسجة عن الأغاروز أثناء جمع الشرائح. - كرر الخطوات 7.1-7.6 لجميع الأجنة وحافظ على الأدمغة على الجليد (من الناحية المثالية لا تزيد عن 30 دقيقة) حتى خطوة التضمين.
ملاحظة: تشير الخطوات التالية 7.7.1-7.7.4 إلى استخراج الدماغ من أدمغة E12.5.- اعزل الجزء العلوي من الرأس أسفل العين مباشرة ، كما هو موضح في الشكل 3G.
- قطع الجلد والجمجمة فوق جذع الدماغ ، باتباع الخط المتقطع كما هو موضح في الشكل 3H ، دون إزالة جذع الدماغ.
- قم بعمل شق في الجلد والجمجمة مقاس 2 مم في الجزء الخلفي من الرأس ، كما هو موضح في الشكل 3I (انظر الرسومات للوضوح).
ملاحظة: يوفر هذا الشق نقاط إمساك أولية لتقشير طبقات الجلد والجمجمة. عادة ، فإنها تأتي كطبقة واحدة. حجم الشق النموذجي هو 2 مم ، وهو ما يتوافق مع طول حافة القطع لمقص الزنبرك الصغير المستخدم. - ابدأ في تقشير طبقات الجلد والجمجمة عن طريق تأمين جانب واحد من الشق وسحب الآخر بعناية. بنفس العناية ، قم بالانتهاء من ذلك عن طريق تقشير قاعدة الرأس حتى تحرير الدماغ (الشكل 3J).
ملاحظة: يجب أن يتم ذلك بعناية فائقة ، مع ملاحظة أن الدماغ لا يتم سحبه على طول طبقات الأنسجة. جوانب بديلة لإزالة الأنسجة التي تغطي الدماغ.
- صب الأغاروز الدافئ (عند 37-40 درجة مئوية) في طبق 3 سم.
- التقط الدماغ باستخدام ملعقة مثقوبة وأزل السائل الزائد عن طريق وضع الجزء السفلي من الملعقة على ورق المناديل الجافة. ضع الدماغ في طبق الأغاروز.
ملاحظة: من الضروري إزالة أكبر قدر ممكن من السوائل من جميع أنحاء الدماغ للسماح بالتصاق الأغاروز بشكل أفضل بالأنسجة. - ضع الطبق مع الأغاروز السائل على الثلج. باستخدام ملعقة أصغر ، اخلطي الأغاروز لمدة 10 ثوان للتبريد. مناورة الدماغ إلى منتصف الطبق. ضع الدماغ أفقيا في الطبق مع الجانب الظهري لأعلى ، مع ضمان تغطيته بالكامل بالأغاروز من جميع الاتجاهات (الشكل 3K).
ملاحظة: غالبا ما تغرق الأدمغة في قاع الطبق بمجرد وضعها في الأغاروز. ارفع الدماغ باستخدام ملعقة صغيرة حتى يتم إنشاء فجوة 1-2 مم تحت الدماغ. - كرر الخطوات من 7.8 إلى 7.10 لكافة العقول.
- بمجرد بلمرة الأغاروز ، أضف 500 ميكرولتر من HBSS-G فوق كتلة الأغاروز لمنع التجفيف. ثم ، قم بتغطية الطبق بالثلج.
ملاحظة: احتفظ بالعينة على الجليد لمدة 5 دقائق قبل تقسيمها للسماح لدرجة حرارة الدماغ بالوصول إلى 4 درجات مئوية.
8. زراعة شرائح النمط العضوي
ملاحظة: نظف الاهتزاز والأسطح المحيطة به بنسبة 70٪ -96٪ من الإيثانول لتجنب تلوث الشريحة. ويبين الشكل 3 باء إعداد محطة العمل الاهتزازية (انظر جدول المواد).
- املأ صينية العازلة الاهتزازية ب HBSS-G البارد والدرج الخارجي بالثلج للحفاظ على برودة HBSS-G طوال الإجراء.
- قم بتزويد HBSS-G باستمرار في صينية التخزين المؤقت بالكاربوجين باستخدام حجر فقاعي.
- باستخدام شفرة جديدة ، قم بعمل قطع كبير (~ 2 × 2 سم) حول الدماغ وإزالة كتلة من الأغاروز تحتوي على الدماغ ، مع ما يكفي من الأغاروز المحيطة لتقليم الأغاروز إلى كتلة مستطيلة صغيرة.
ملاحظة: تسمح هذه الخطوة بضبط زاوية الكتلة بحيث يكون المحور السهمي للدماغ عموديا على الصفيحة الاهتزازية ومحاذاة المحور الإكليلي بالتوازي مع الشفرة. اترك حوالي 5 مم من الأغاروز في الجانب الظهري من الدماغ لسهولة التعامل مع الشرائح. - ضع قطرة صغيرة من الغراء الفائق سريع اللصق الخالي من المذيبات في منتصف حامل العينة وانتشر إلى منطقة تغطي الجزء السفلي من كتلة الأغاروز.
- التقط كتلة الأغاروز بلطف وجفف الجزء السفلي عن طريق التدليك على المناديل الورقية. ضع الكتلة على المنطقة الملصقة من حامل العينة ، مع رفع الجانب السطحي من الدماغ. ضع حامل العينة على الجليد واترك الغراء يجف لمدة 1 دقيقة.
- بمجرد أن يجف الغراء ، ضع حامل العينة في الدرج العازل.
- قطع الدماغ في شرائح إكليلية بزاوية 15 درجة.
ملاحظة: يمكن أن يختلف سمك الشرائح حسب التطبيق. هنا ، تم تقطيع الأدمغة بسماكة 150 ميكرومتر. اضبط سرعة الاهتزاز على 1.0-1.5 مم / ثانية لتقليم الأغاروز الزائد في الأعلى وتقليم المصابيح الشمية. قلل من سرعة القطع إلى 0.5 مم / ثانية لجمع الشرائح القشرية لتحليلها. يمكن إيقاف معظم الاهتزازات مؤقتا لجمع كل شريحة. إذا كانت جودة الشرائح المنخفضة أو فصل الأنسجة عن الأغاروز من ذوي الخبرة ، فإن تقليل سرعة القطع أو استبدال شفرة الاهتزاز يمكن أن يساعد. - باستخدام ملاعق نظيفة ، قم بجمع شرائح الدماغ ووضعها على غشاء Polytetrafluoroethylene (PTFE) ، الذي تم تثبيته في طبق زجاجي 35 مم باستخدام البارافين (ما يصل إلى خمس شرائح / غشاء دماغي) (الشكل 3L-M).
ملاحظة: قم بإصلاح غشاء PTFE داخل طبق ذو قاع زجاجي 35 مم باستخدام الشمع. سيؤدي ذلك إلى استقرار الغشاء عند إضافة وسائط ثقافة الشرائح وأيضا أثناء التصوير. - باستخدام ماصة 200 ميكرولتر ، قم بإزالة HBSS-G الزائد من حول الشرائح الموجودة على غشاء PTFE ، تاركا الشرائح شبه جافة.
- أضف 500 ميكرولتر من وسائط الشرائح (تم تسخينها مسبقا إلى 35 درجة مئوية) مباشرة إلى المساحة الموجودة أسفل غشاء PTFE.
ملاحظة: يجب ألا تتشكل فقاعات تحت الغشاء عند إضافة الوسائط. سيؤدي ذلك إلى ترك شرائح كاملة أو جزئية بدون تبادل للوسائط. استبدال 200 ميكرولتر من الوسائط كل يومين في الثقافة أو بعد كل جلسة تصوير. - احتضن الشرائح عند 35 درجة مئوية مع 5٪ CO2.
9. الكيمياء النسيجية المناعية
- إصلاح شرائح مع 1 مل من 4٪ بارافورمالديهايد (PFA) - تستكمل مع 4٪ السكروز لكل طبق. احتضان في RT لمدة 30 دقيقة.
تنبيه: عند التعامل مع PFA ، ارتد معطفا مختبريا وقفازات. قم بتنفيذ خطوات التثبيت تحت غطاء كيميائي ، وتخلص من نفايات PFA بشكل مناسب. - اغسل الشرائح مرتين باستخدام 300 ميكرولتر PBS لمدة 5 دقائق. انقل الشرائح إلى طبق مكون من 24 بئرا.
ملاحظة: يمكن إيقاف التجربة مؤقتا في هذه المرحلة. أضف PBS-NaN3 إلى الشرائح وخزنها على درجة حرارة 4 درجات مئوية. NaN3 هو مركب سام. عند التعامل مع الحلول معها ، ارتد معطف المختبر والقفازات. الخطوات 9.3-9.10 يجب تنفيذها في شاكر مداري. - قم بإخماد الشرائح ب 300 ميكرولتر من 0.1 مليون جليسين عند 4 درجات مئوية بين عشية وضحاها.
- اغسل الجلايسين مع PBS في RT 3x لمدة 10 دقائق.
- تخلل الشرائح ب 300 ميكرولتر من PBS-T في RT لمدة 2 ساعة.
- حظر باستخدام مصل الماعز 10٪ في PBS-T في RT لمدة 2 ساعة.
- أضف 300 ميكرولتر من الأجسام المضادة الأولية (الأجسام المضادة المضادة للفيمنتين عند تخفيف 1:200 ؛ انظر جدول المواد) المخففة في مصل الماعز بنسبة 10٪ في محلول PBS-T عند 4 درجات مئوية بين عشية وضحاها.
ملاحظة: في الخطوات 9.8-9.12 ، كانت الشرائح محمية بالضوء لمنع فقدان التألق. - اغسل الجسم المضاد الأساسي باستخدام PBS في RT 3x لمدة 20 دقيقة.
ملاحظة: تم استخدام PBS بدلا من PBS-T لغسل Triton X-100. - أضف 300 ميكرولتر من الأجسام المضادة الثانوية (إما Alexa Fluor 488 أو 647 عند تخفيف 1:400 ؛ انظر جدول المواد) في PBS في RT لمدة 2 ساعة.
ملاحظة: يضاف DAPI مباشرة بعد إزالة الجسم المضاد الثانوي عند تخفيف 1:10,000 لمدة 5 دقائق. - اغسل الجسم المضاد الثانوي باستخدام PBS في RT 3x لمدة 20 دقيقة. يغسل بالماء المقطر 2x لمدة 1 دقيقة.
- انقل الشرائح إلى شريحة زجاجية باستخدام فرشاة دقيقة ، ثم جففها على درجة حرارة 30 درجة مئوية لمدة 20 دقيقة.
- قم بتركيب الشرائح باستخدام وسط تركيب مائي. احتفظ بالشرائح في RT طوال الليل حتى تتمكن وسائط التركيب من تنظيمها.
10. اقتناء التصوير
ملاحظة: بغض النظر عن نهج توصيل الحمض النووي (IUE أو EUE) ، تم تحليل الشرائح في نفس الفئة العمرية التنموية (E17.5-E18.5). يسمح IUE للأسلاف العصبيين بالانقسام والتطور لمدة يومين آخرين في الجسم الحي. من ناحية أخرى ، يسمح EUE بتتبع الأحداث التنموية المبكرة.
- قم بتشغيل حاضنة الغرفة واضبطها على 35 درجة مئوية مع 5٪ CO2 - من الناحية المثالية 4 ساعات قبل التصوير - للسماح لمكونات المجهر بالتوازن عند 35 درجة مئوية.
- للتصوير العميق للشرائح، استخدم أهداف الغمر بالماء لتقليل عدم التطابق في معامل الانكسار بين الأنسجة والهدف.
ملاحظة: هنا، تم استخدام وضع التصوير فائق الدقة. يتطلب التصوير من خلال غشاء PTFE هدفا بمسافة عمل طويلة (~ 1 مم). إذا لم يكن هدف مسافة العمل الطويلة متاحا ، فقد يتم نقل الشرائح إلى طبق ذو قاع زجاجي من 8 آبار. لنقل الشرائح ، أضف 1 مل من وسائط الشريحة إلى الجزء العلوي من الغشاء ، ثم استخدم ملعقة لرفع شريحة ونقلها إلى بئر يحتوي على 200 ميكرولتر من الوسائط. قم بإزالة الوسائط الزائدة باستخدام طرف ماصة 1 مل مع ترك الشرائح شبه جافة. - لتصوير نمو المحور العصبي، حدد موقع منطقة من القشرة ذات كثافة خلايا منخفضة إلى متوسطة. لتصوير ديناميكيات مخروط النمو، حدد موقع مخروط النمو في المنطقة الوسيطة للقشرة أو المنطقة تحت البطينية.
- حدد حجم مكدس z في برنامج معالجة الصور (راجع جدول المواد). لنمو المحور العصبي في مكدس z كبير، قم بتعيين حجم خطوة 2 ميكرومتر. بالنسبة لمخاريط النمو في مكدس z أصغر، اضبط حجم خطوة 1 ميكرومتر.
ملاحظة: ضع في اعتبارك دائما الحركة المحتملة لمخروط النمو والمحور العصبي عبر المستويات x و y و z. تنمو المحاور بمعدل أعلى بكثير في الثقافات العضوية مقارنة بالثقافات المختبرية . هنا ، كان مكدس z من حوالي 80 ميكرومتر لنمو محور الصورة كافيا. بالنسبة لديناميكيات مخروط النمو ، كانت مكدسة z من ~ 6 ميكرومتر كافية. - لتصوير نمو الخلايا العصبية في منطقة أكبر، حدد فحص البلاط.
- استخدم أقل طاقة ليزر ممكنة لتقليل فرص تبييض مخاريط النمو أثناء الاستحواذ.
- لنمو محور التصوير ، احصل على فواصل زمنية لمدة 2 ساعة مع فاصل زمني قدره 5 دقائق. لتصوير ديناميكيات مخروط النمو، احصل على فواصل زمنية لمدة 2-5 دقائق مع فاصل زمني يتراوح بين 2.5 و3 ثوان.
11. تحليل البيانات
- قياس سرعة نمو المحور العصبي باستخدام الكيموجراف
- افتح ملف الصورة في فيجي14 من خلال ملف > افتح وحدد الصورة.
- احصل على أقصى إسقاط كثافة للفاصل الزمني من خلال مكدسات > الصور > Z-Projection > الحد الأقصى للكثافة.
- انتقل عبر الفاصل الزمني وحدد موقع محور عصبي متنامي.
- بمجرد تحديد الموقع ، ارسم خطا من خلال المحور العصبي. ابدأ من طرف المحور العصبي في الإطار الأول، واتبع المحور العصبي خلال الفاصل الزمني بأكمله.
- قم بإنشاء kymograph باستخدام المكون الإضافي KymoResliceWide.
- اضبط مقياس الكيموجراف بالانتقال إلى خصائص > الصورة. اضبط المسافة بالميكرومتر في عرض البكسل واضبط الوقت ب s أو min في Pixel Height.
- انتقل إلى تحليل > القياس.
ملاحظة: سيتم إعطاء زاوية بالنسبة للمحور x. - احسب سرعة نمو المحور العصبي عن طريق استبدال الزاوية في المعادلة التالية: SIN(RADIANS (θ))/COS(RADIANS(θ)) في جدول بيانات.
- قم بقياس حجم مخروط النمو باستخدام برنامج تحليل الصور (انظر جدول المواد).
- افتح ملف الصورة في برنامج تحليل الصور من خلال ملف > فتح وحدد الملف محل الاهتمام.
- حدد معالج إضافة أسطح جديدة .
ملاحظة: سيظهر مقطع في الزاوية السفلية اليمنى يحتوي على ست خطوات للتحرير اليدوي. - في الخطوة 1 - ضمن إعدادات الخوارزمية - حدد تقسيم منطقة اهتمام واحدة فقط. في الخطوة 2 ، قم بقص الإطار ليناسب مخروط النمو بالكامل في جميع الإطارات.
- حافظ على العتبة إلى الكثافة المطلقة في الخطوة 3 ، وتأكد من أن منطقة مخروط النمو بأكملها قد تم تحديدها في الخطوة 4.
- في الخطوة 5، حدد عدد Voxels lmg = 1 ضمن نوع التصفية.
ملاحظة: في الخطوة الأخيرة، قد يتم إنشاء مجموعات قياس متعددة. هنا ، تم إنشاء قياس واحد فقط للحجم. - حدد الزر تنفيذ لتنفيذ كافة خطوات الإنشاء وإنهاء معالج إضافة أسطح جديدة.
- في علامة التبويب إحصائيات في أعلى نافذة المعالج، حدد قيم ووحدات تخزين محددة ضمن علامة التبويب تفصيل.
النتائج
يتم عرض النتائج التمثيلية التي تم الحصول عليها باستخدام سير عمل الطريقة الموصوفة. تم استخدام الفئران E15.5 في هذا العرض التوضيحي ، على الرغم من أن هذا البروتوكول قابل للتكيف بسهولة مع جميع الأعمار الجنينية تقريبا التي تتراوح من E11 إلى أواخر E17. في هذا البروتوكول ، إما خارج الرحم الكهربائي (EUE; الشكل 2A ، 2C-I) أو في كهربية الرحم (IUE; تم استخدام الشكل 2B و C و 2J-Q) لتوصيل البلازميدات إلى الخلايا العصبية السلفية المبطنة للبطينين الجانبيين. هذه السلف هي مصدر الخلايا العصبية القشرية المستقبلية (CPN) 15,16. تم إعداد خلطات البلازميد لدفع التعبير المتناثر الخاص بالخلايا العصبية إما عن غشاء مستهدف (Lyn)-mNeonGreen (الشكل 1A) أو تعزيز LifeAct-(E)GFP (الشكل 1B) لتقييم السلوك العام وديناميكيات الأكتين في مخاريط النمو ، على التوالي. علاوة على ذلك ، تم تضمين مزيج بلازميد يهدف إلى تسمية الخلايا العصبية الفردية إما ب turbo (t) - RFP أو zoanthus sp. (Zs) بروتين الفلورسنت الأخضر (ZsGreen) (الشكل 1C). هذا يسهل مراقبة سلوك مخروط النمو من الخلايا العصبية المجاورة المستقلة.
يعد تشريح الدماغ من الأجنة المكهربة خطوة حاسمة يجب إجراؤها بعناية للحصول على شرائح عالية الجودة ، والحفاظ على بنية الدماغ الأصلية. تم إعداد أدوات التشريح والاهتزاز مسبقا وتعقيمها بعناية بالإيثانول (الشكل 3A و B). بعد ذلك ، تم تشريح رؤوس الأجنة الكهربائية بعناية وتم استخراج الأدمغة. هنا ، يتم عرض تشريح تمثيلي للأدمغة من الأجنة المعرضة ل EUE في E15 (الشكل 3C-F) و E12.5 (الشكل 3G-J). يتم تغليف الأدمغة على الفور في مصفوفة أغاروز ، وتقطيعها ، ووضعها على غشاء PTFE داخل طبق زجاجي سفلي للحضانة (الشكل 3K-M).
تعد الحالة الصحية لشرائح الدماغ نقطة مهمة للتحكم لضمان نتائج موثوقة. ويجري يوميا فحص بصري للكشف عن أي تلوث. بالإضافة إلى ذلك ، بمجرد الانتهاء من الثقافة ، يتم إصلاح شرائح الدماغ وإخضاعها للكيمياء النسيجية المناعية. هنا ، تم استخدام 4 ′ ، 6-diamidino-2-phenylindole (DAPI) للتحكم في التنظيم الخلوي العام وتلطيخ vimentin للكشف عن التنظيم الدبقي ؛ على وجه الخصوص ، سقالة الدبقية الشعاعية (RG). عادة ما تظهر شرائح الدماغ المستزرعة بنجاح المشتقة من IUE أو EUE توزيعا خلويا طبيعيا كما هو موضح في DAPI ومجموعة منظمة إلى حد ما من RG مع عمليات اتصال Pial الموجهة بشكل قمي17 (الشكل 4A ، B على التوالي). في بعض الأحيان ، لوحظت اضطرابات ملحوظة في سقالات RG في شرائح الدماغ المستزرعة ، خاصة في تلك المشتقة من كهربية EUE (الشكل 4C). تظهر شرائح الدماغ ذات سقالة RG غير المنظمة للغاية ضعف الهجرة العصبية ونمو المحور العصبي المعيب (غير معروض). وبالتالي ، فإن التحكم في سقالة RG هو طريقة سهلة لما بعد الثقافة لفرز البيانات التي تم الحصول عليها من شرائح الدماغ الموثوقة.
شرائح الدماغ المشتقة إما من IUE أو EUE مع مزيج البلازميد المعبر عن Lyn-mNeonGreen تؤدي إلى وضع علامات مماثلة على الخلايا العصبية المتناثرة. يظهر على سبيل المثال CPN هرمي تمثيلي يعبر عن Lyn-mNeonGreen والسلوك الديناميكي لمخروط نموه (الشكل 5A والفيديو التكميلي 1 ، أعلى اليسار). بالإضافة إلى ذلك ، تم تصنيف الخلايا العصبية باستخدام بلازميد يعبر عن مسبار أكتين لتحليل ديناميكيات الأكتين لمخاريط النمو المحورية في الموقع (الشكل 5B والفيديو التكميلي 1 ، أسفل اليسار). وأجريت أيضا تجارب في الموقع باستخدام تصميم بلازميد مزدوج الفلوروفور يعبر عن الكري / Dre (الشكل 1C والفيديو التكميلي 1 ، على اليمين). يمكن تنشيط الفلوروفورات tRFP أو ZsGreen في هذا البلازميد بشكل خاص وفردي إما عن طريق المؤتلفات Dre أو Cre ، على التوالي ، في الخلايا العصبية المجاورة (الشكل 5C). تسمح هذه التشكيلة التجريبية بالتحليل جنبا إلى جنب لمخاريط النمو من الخلايا العصبية الضابطة مع الخلايا العصبية المعدلة المجاورة (أي فقدان أو مكاسب معينة للوظيفة). هذا يتحايل على التباين الناشئ عن استخدام شرائح مختلفة لاختبار التحكم والظروف التجريبية.
تم تحليل Kymographs التي تم إنشاؤها من الفيلم المسجل ، والتي يمكن من خلالها الحصول بسهولة على معلمات النمو الديناميكي مثل النشاط البارز بمرور الوقت وطول النمو (الشكل 6A). لاحظ أن التعديل البسيط في الدقة الزمنية للفاصل الزمني يسمح بقياس سرعة استطالة المحور العصبي لمدة 2 ساعة (الشكل 6A). وعلاوة على ذلك، يمكن بسهولة الحصول على تباين حجم مخروط النمو بمرور الوقت - وهو مقياس للنشاط الديناميكي لمخروط النمو العام - في هذه الحالة باستخدام برمجيات مرخصة (الشكل 6B والشكل 6E,F). يمكن استخدام هذا لتقييم سرعة طحن الأكتين وتوازن الفيلوبوديا / الصفيحة أثناء نشاط استكشاف مخروط النمو.
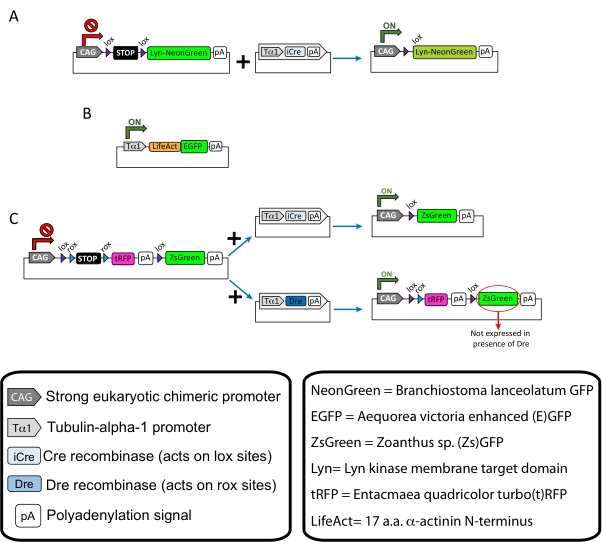
الشكل 1: مخططات البلازميدات المستخدمة في البروتوكول . (أ) pCAG-lox-STOP-lox-Lyn-mNeonGreen. (ب) p-Tub-alpha-1-LifeAct-GFP. (ج) pCAG-lox-rox-STOP-rox-tRFP-pA-lox-ZsGreen-pA. تم العثور على المعلومات ذات الصلة المتعلقة بمكونات البلازميد وأصل الفلوروفور في الصناديق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
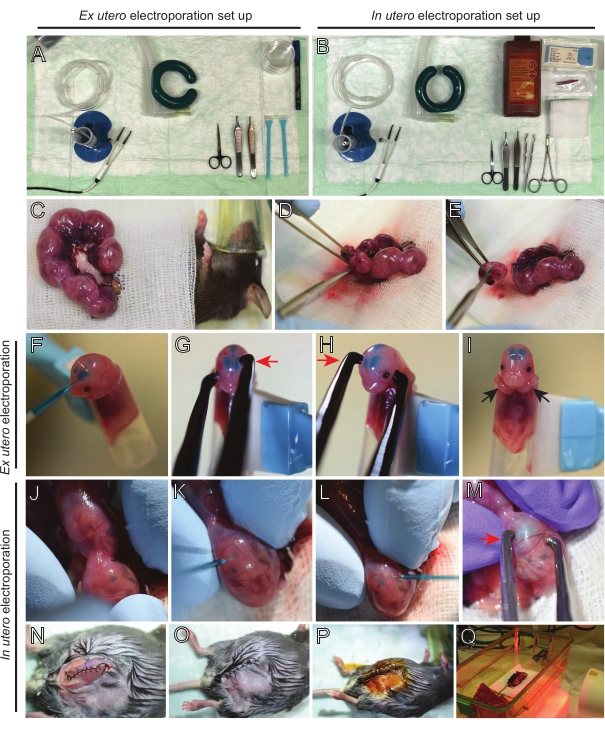
الشكل 2: سير العمل خارج الرحم وفي الرحم الكهربائي للفئران E15.5. (أ) إنشاء محطة جراحية للكهربية خارج الرحم. (ب) إنشاء محطة جراحية للكهربية في الرحم. (ج) قرون الرحم التي تم سحبها خارج تجويف البطن للفأر المخدر. (د) استخراج الجنين من كيس الرحم. (ه) التضحية بالأجنة عن طريق نقل الحبل الشوكي بالكامل عن طريق شق قطري؛ لاحظ أنه تم تجنب قطع الرؤوس. (و) وضع الجنين في الحامل وحقنه بخليط الحمض النووي/الأخضر السريع في البطين الجانبي الأيسر. (ز، ح) ضع رأس الجنين بين أقطاب ملاقط البلاتين مع الكاثود (السهم الأحمر) فوق القشرة بزاوية 60 درجة. (I) وضع أذرع الجنين (الأسهم السوداء) خارج الحامل لمنع انزلاق الجنين أثناء العملية. (ي) دوران الجنين داخل كيس الرحم لفضح الرأس. (K,L) حقن الحمض النووي / خليط أخضر سريع في البطينين الجانبيين للجنين من خلال جدار الرحم. (M) ضع رأس الجنين بين أقطاب ملاقط البلاتين مع كاثود (سهم أحمر) فوق القشرة بزاوية 60 درجة. (ن) شق العضلات المخيط عن طريق خياطة قفل الجري. (O) شق الجلد المخيط عن طريق خياطة متقطعة. (ع) تأمين الجرح باستخدام مشابك الجرح الجراحية والتطهير باستخدام البيتادين. (س) وضع الماوس في قفص الاسترداد مع ضوء الاحترار بالأشعة تحت الحمراء البعيدة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: استخراج أدمغة E15.5 و E12.5 وإجراء زراعة الشرائح العضوية. (أ) الأدوات المستخدمة في عملية استخراج الدماغ. (ب) إنشاء محطة للاستزراع العضوي. (C-F) استخراج الدماغ E15.5. (G-J) استخراج الدماغ E12.5. الخطوط المنقطة تسلط الضوء على موقع الشقوق. تشير الأسهم الحمراء إلى اتجاه السحب بواسطة الملقط. (K) تضمين الدماغ في طبق 3 سم يحتوي على 3٪ من الأغاروز منخفض الذوبان ، تاركا فجوة تباعد الأغاروز 1-2 مم تحت الدماغ. (L) جمع شريحة دماغية 150 ميكرومتر. (م) وضع شرائح الدماغ على غشاء PTFE المدرج في طبق 35 مم باستخدام فيلم البارافين (السهم الأزرق). تشير علامة النجم الأحمر إلى مجموعة معينة من شرائح الدماغ من الاهتزاز (L) ونقلها إلى غشاء PTFE (M). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
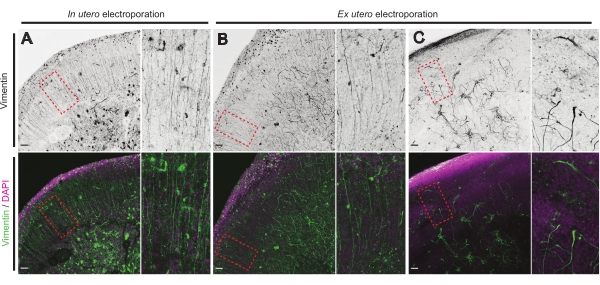
الشكل 4: الحفاظ على بنية الخلايا الدبقية الشعاعية في شرائح عضوية صحية. صور متحدة البؤرة لشرائح الدماغ E17.5 التي تكشف عن مصفوفة RG (vimentin؛ أخضر) وتنظيم الخلية الكلي (DAPI؛ أرجواني) بعد IUE (A) و EUE (B,C). لاحظ الاضطرابات القوية في صفيف RG التي قد تنتج أحيانا عن EUE (C). تتوافق التكبيرات مع الإطارات الحمراء المنقطة في الشكل الرئيسي: أشرطة المقياس ، 10 ميكرومتر .
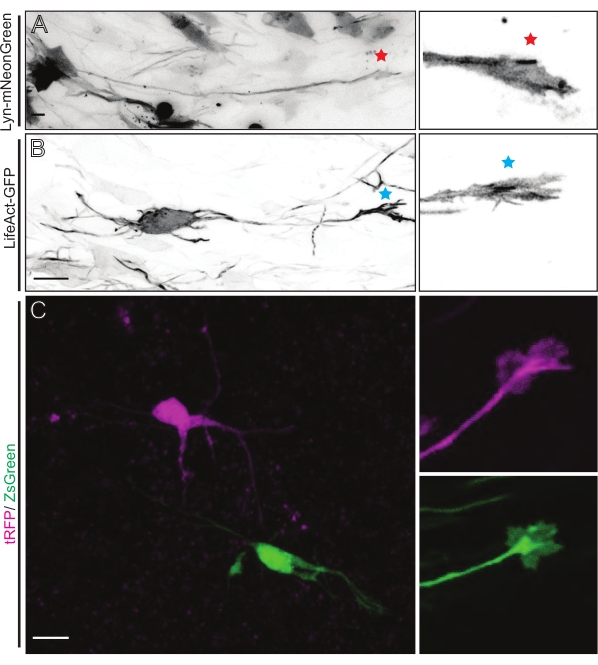
الشكل 5: التصور في الموقع لديناميات مخروط النمو في شرائح النمط العضوي الحاد. (أ، ب) الخلايا العصبية ومخاريط النمو المقابلة لها الموسومة ب Lyn-mNeonGreen و LifeAct-GFP ، على التوالي. نجمة حمراء تميز مخروط النمو من Lyn-mNeonGreen معبرا عن الخلايا العصبية. علامة النجمة الزرقاء تشير إلى مخروط النمو من LifeAct-GFP الذي يعبر عن الخلايا العصبية. (ج) الخلايا العصبية المجاورة الموسومة بنظام البلازميد المزدوج الذي يحتوي على tRFP (أرجواني) و ZsGreen (أخضر) ومخاريط النمو المقابلة لها. كانت مخاريط النمو المصورة (يمين) خارج الإطار الملتقط (يسار) ، والتي تم الحصول عليها بعد فترة وجيزة من الحصول على الفاصل الزمني لمخروط النمو ؛ أشرطة المقياس ، 5 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
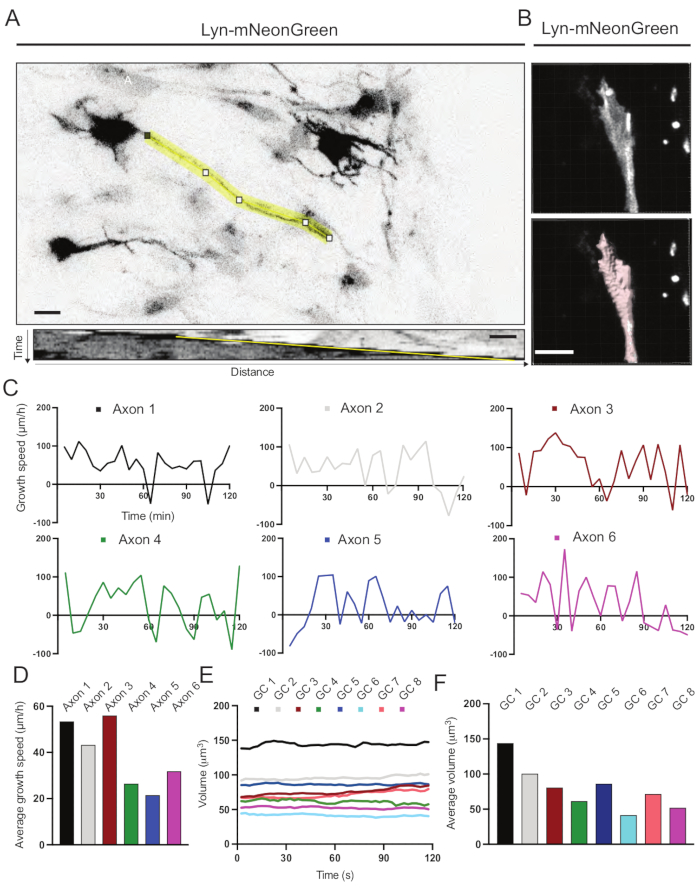
الشكل 6: تحليل سرعة نمو المحور العصبي وحجم مخروط النمو . (أ) تتبع المحور العصبي على خلية عصبية تعبر عن Lyn-mNeonGreen (أعلى) و kymograph المقابل لها (أدناه) التي تم إنشاؤها باستخدام ImageJ. (ب) إعادة بناء فيديو z-stack لمخروط النمو باستخدام برنامج تحليل الصور (أعلى) ونفس مخروط النمو الذي تم تمييزه باستخدام أداة قياس الأسطح (أدناه). (ج) رسوم بيانية تبين التغيرات في سرعة النمو بمرور الوقت لعدة محاور عصبية. (د) يتم قياس متوسط سرعة نمو المحاور في (C). (ه) رسم بياني يوضح التغيرات في حجم مخروط النمو بمرور الوقت. (و) يقدر متوسط حجم مخاريط النمو كميا في الفقرة (هاء)؛ شريط المقياس ، 5 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
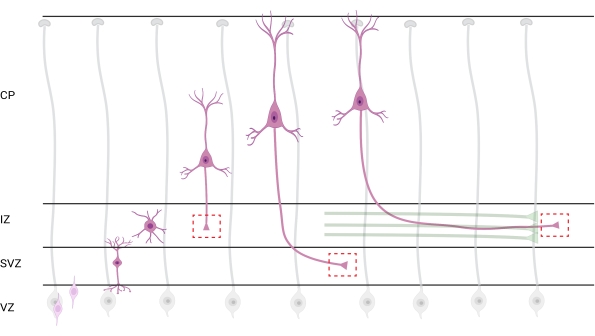
الشكل 7: الهجرة الشعاعية والاستقطاب العصبي للخلايا العصبية القشرية الهرمية. رسم بياني يوضح تطور الخلايا العصبية القشرية الهرمية (الوردي) المهاجرة شعاعيا من المنطقة البطينية الجرثومية (VZ) نحو سطح بيا. تسترشد الخلايا العصبية المستقطبة المهاجرة بعمليات الدبقية الشعاعية (الرمادية) ، وتنشئ عملية رائدة ، التشعبات المستقبلية ، والعملية الزائدة ، المحور العصبي المستقبلي ، التي تستمر في التمدد لأسفل نحو المنطقة الوسيطة (IZ). تمثل الصناديق الحمراء المتقطعة المناطق القشرية حيث تم تصوير مخاريط النمو. على وجه التحديد في IZ، المنطقة تحت البطينية (SVZ)، أو الانضمام إلى حزم المحور العصبي (الأخضر). تم إنشاء الرسم التوضيحي باستخدام أداة تستند إلى الويب ، BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| البلازميد | التركيز (ميكروغرام/ميكرولتر) | الاستخدام المقصود |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | 0.25 | وضع العلامات على البروتين المستهدف بالأغشية (Lyn) |
| + | + | |
| p-Tub-alpha-1-iCre | 0.08 | |
| p-Tub-alpha-1-LifeAct-GFP | 0.125 | وضع العلامات على الأكتين الخيفي (F-actin) في مخاريط النمو |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | 1 | وضع علامات مستقلة على مجموعتين من الخلايا العصبية المجاورة |
| + | + | |
| p-Tub-alpha-1-iCre | 0.004 | |
| + | + | |
| p-Tub-alpha-1-Dre | 0.2 |
الجدول 1: قائمة البلازميدات المستخدمة في البروتوكول. الاسم والتركيز والاستخدام المقصود لكل بلازميد مستخدم.
فيديو تكميلي 1: تصور في الموقع لديناميكيات مخروط النمو في شرائح النمط العضوي الحاد. ديناميكيات مخاريط النمو الموسومة ب Lyn-mNeonGreen (أعلى اليسار) و LifeAct-GFP (أسفل اليسار). يتم تصنيف مخاريط النمو المجاورة بشكل مختلف مع نظام البلازميد المزدوج الذي يحتوي على tRFP (أرجواني ؛ أعلى اليمين) و ZsGreen (أخضر ؛ أسفل اليمين). فاصل التصوير ، 2.5 ثانية. أشرطة المقياس ، 5 ميكرومتر. يرجى النقر هنا لتنزيل هذا الملف.
Discussion
كيف تستشعر مخاريط النمو وتتفاعل مع البيئة المحيطة بها لتنسيق تمديد وتوجيه المحور العصبي في وقت واحد لا تزال مسألة نقاش 3,18. قدمت الدراسات الرائدة في الركائز ثنائية الأبعاد لمحة عن الآليات الجزيئية الأساسية التي تولد القوى التي تدفع ديناميكيات مخروط النمو أثناء تكوين المحور العصبي والنمو والملاحة2،10،11،12،19. في الآونة الأخيرة ، كشفت الدراسات في مصفوفات 3D عن مدى تأثير البعد الثالث في سلوك مخروط النمو وبالتالي في نمو المحور العصبي 8,9. ومع ذلك، فإن الآليات المعقدة التي توجه ديناميات مخروط النمو في الجسم الحي لا تزال بحاجة إلى دراسة دقيقة.
يستخدم إعداد ثقافات شرائح النمط العضوي من أدمغة IUE أو EUE على نطاق واسع وموثق جيدا. لقد أصبح معيارا ذهبيا يسمح للعلماء باكتساب رؤى ثاقبة حول تطور وسلوك الخلايا العصبية في أنسجة المخ الحية20,21. في الواقع ، تم استخدام هذه التقنية بنجاح في تركيبة مع العديد من تقنيات التصوير عالية الدقة لتصور عمليات جزيئية محددة وأحداث مورفولوجية في الموقع. وتشمل هذه الدراسات ، على سبيل المثال لا الحصر تكوين المحور العصبي وامتداده 19،22 ، والهجرة العصبية القشرية 19،22،23،24 ، والديناميات المركزية 25،26 ، وديناميات الأنابيب الدقيقة27 ، وكذلك الديناميكيات الوظيفية للمقصورات قبل وبعد المشبكي28،29.
يعالج هذا البروتوكول فجوة في البيولوجيا العصبية التجريبية ، وتصور ديناميكيات مخروط النمو لتطوير الخلايا العصبية القشرية في الموقع ، في ثقافات شرائح الدماغ الحادة خارج الجسم الحي ، والأدوات اللازمة لتحليل البيانات التي تم الحصول عليها.
تم استخدام ثقافات شرائح الدماغ الحادة لإنشاء هذا البروتوكول لأنها (1) مع بعض الممارسة ، يسهل توليدها. (2) تقديم نظام يمكن الوصول إليه لدراسة مخاريط النمو المضمنة في بيئة شبه فسيولوجية كاملة ، ولكنها شفافة بما يكفي للسماح بتصوير الخلايا الحية عالي الدقة ؛ (3) يمكن توسيعها لاستخدامها مع عدد لا يحصى من خطوط الماوس المعدلة وراثيا ؛ (4) جنبا إلى جنب مع IUE أو EUE ، توفر إمكانات غير محدودة تقريبا لتقديم أدوات جزيئية لتقييم أداء مخاريط النمو والمحاور العصبية في الجسم الحي في ظل فقدان / كسب أنظمة الوظائف ، جنبا إلى جنب مع مراسلي الفلورسنت ومجسات الهيكل الخلوي.
وقد وصفت هذه المنهجية في سياق كل من الاتحاد الأوروبي والجامعة الإسلامية في أوروبا. على الرغم من أنها لا تزال طريقة موثوقة للغاية ، إلا أن EUE أدت إلى زيادة حدوث شرائح الدماغ التي تظهر شبكة RG غير منظمة مقارنة بتلك التي تم الحصول عليها باستخدام IUE كطريقة تسليم (الشكل 4C). تؤثر الاضطرابات في مصفوفة RG بشدة على هجرة الخلايا العصبية ونمط استطالة المحور العصبي30,31. هذه هي المعلمات الرئيسية التي تتنبأ بمكان العثور على محاور محورية للتحليل في وقت معين ونوع البيئة التي يتنقلون فيها. عادة ما تعاني شرائح الدماغ ذات شبكة RG المعطلة بشكل كبير من ضعف التقسيم الطبقي للخلايا العصبية القشرية . وهذا بدوره ينتج محاور ذات مسارات فوضوية. لذلك ، يوصى بشدة بالتحكم في السلامة الهيكلية لشبكة RG. ومن المثير للاهتمام أن ضعف السلامة الهيكلية يرتبط بزيادة عمر الدماغ الجنيني. في الواقع ، لم يتم ملاحظة مثل هذه الآثار في أجنة E12.5-E13.5 الأصغر سنا عادة19.
والبروتوكول الحالي شامل ومباشر. ومع ذلك ، هناك بعض الخطوات الحاسمة التي يجب فيها توخي الحذر والاهتمام الخاصين للحصول على أفضل النتائج. وقد أشير إلى ذلك صراحة في البروتوكول ويشمل (1) ضبط كمية الحمض النووي المستخدمة في المعالجة الكهربائية للحصول على علامات متفرقة؛ و (2) ضبط كمية الحمض النووي المستخدمة في المعالجة الكهربائية للحصول على علامات متفرقة؛ و (2) ضبط كمية الحمض النووي المستخدمة في المعالجة الكهربائية للحصول على علامات متفرقة؛ و (2) ضبط كمية الحمض النووي المستخدمة في المعالجة الكهربائية للحصول على علامات متفرقة؛ و (2) ضبط كمية الحمض النووي المستخدمة في المعالجة الكهربائية للحصول على علامات متفرق (2) تجنب الضرر أثناء استخراج الأدمغة ؛ (3) التحكم في درجة حرارة الأغاروز أثناء غلاف الدماغ ؛ (4) استكشاف الأخطاء وإصلاحها النسبة المئوية المثالية من الأغاروز لأدمغة عمر معين ؛ و (5) اختيار الفلوروفورات ، التي تتبع تجربتها. أثناء تحسين البروتوكول ، تم اختبار أداء العديد من الفلوروفورات في التصوير بالخلايا الحية في الموقع. تم اختيار متغيرات GFP الأحادية EGFP و NeonGreen لإعداد البلازميدات الموسومة LifeAct- و Lyn لهذا البروتوكول (الشكل 5A ، B). بالإضافة إلى ذلك ، تم اختبار متغير RFP mScarlet ووجد أنه مناسب للغاية لهذا الإعداد (البيانات غير معروضة). كما تم اختبار tRFP متعدد الوسائط (dimer) و ZsGreen (tetramer) (الشكل 5C والفيديو التكميلي 1 ، إلى اليمين). يوصى باستخدام هذه الفلوروفورات فائقة السطوع سريعة الطي عندما تتطلب الطريقة توليد إشارة فلورسنت سريعة بعد تسليم الحمض النووي.
من الممارسات الشائعة في استخدام مزارع الشرائح استخدام شرائح من أدمغة مختلفة لاختبار التحكم والظروف التجريبية. وهذا يمثل مصدرا متأصلا للتقلبات غير المرغوب فيها. هنا ، تم استخدام نظام تعبير يتيح تعديلا مستقلا للخلايا العصبية المجاورة وتعبير المراسلين لتحديد الهوية. لاحظ أنه في هذا العرض التوضيحي (الشكل 5C) ، لم تكن هناك اختلافات بين الخلايا العصبية التي تعبر عن أي من الفلوروفورات. ومع ذلك ، على سبيل المثال ، فإن مثل هذا المزيج من البلازميد جنبا إلى جنب مع خط الفأر المعدل وراثيا الذي يؤوي جينا حساسا ل Cre سوف يحمل الخلايا العصبية tRFP (الحساسة للدرد) التي بقيت كنوع بري. في المقابل ، فإن ZsGreen (أيضا Cre-sensitive) سوف يصنف الخلايا العصبية المعاد تجميعها. وبالتالي ، يمكن دراسة مخاريط النمو للنمطين الوراثيين المختلفين ، ومن المحتمل أيضا الأنماط الظاهرية ، جنبا إلى جنب في وقت واحد في نفس شريحة الدماغ.
يعد توطين المحاور ومخاريط النمو للتحليل أحد الاعتبارات المهمة. تستقطب الخلايا العصبية القشرية أثناء الهجرة شعاعيا من المنطقة البطينية (VZ) نحو الصفيحة القشرية (CP). خلال هذه العملية ، تشكل الخلايا العصبية عملية رائدة (تشعبات مستقبلية) وعملية زائدة ستصبح المحور العصبي ، وتنضم في النهاية إلى محاور رائدة في المنطقة الوسيطة (IZ) ، وإنشاء مسارات محورية32. لذلك ، لالتقاط مخاريط النمو المحوري ، تم إجراء التصوير على الألياف المحورية في IZ ، بما في ذلك المحاور العصبية الخارجة من CP والمحاور العصبية التي تم إنشاؤها مبكرا والمرتبطة بالفعل بالحزم المحورية ؛ أو في نهاية المطاف ، في الألياف التي تستعرض IZ وتمتد تحتها (الشكل 7).
يجعل هذا البروتوكول من الممكن إجراء تصوير فائق الدقة للخلايا العصبية داخل شرائح النمط العضوي. تاريخيا ، كان تشتت الضوء مشكلة كبيرة تواجه عند تصوير عينات سميكة. على مدى العقدين الماضيين ، جعلت التطورات الواسعة في التقنيات البصرية تصوير العينات السميكة ممكنا. هنا ، تم استخدام هدف مسافة العمل الطويلة لتصور الهياكل الأصغر بشكل أفضل ، مثل مخاريط النمو. لا مفر من أن هذا البروتوكول لا يلتقط أحداثا أكثر تفصيلا مثل تدفق الأكتين الرجعي أو ديناميكيات الأنابيب الدقيقة. يحافظ هدف مسافة العمل الطويلة، الذي يتطلب فتحة عدسة رقمية أقل (NA)، على المعلومات من الشرائح السميكة. ومع ذلك، كان من الممكن أيضا تكييف هذا البروتوكول لاستخدامه مع أهداف تقصير مسافة العمل. وهذا يتطلب نقلا سلسا للشرائح إلى طبق ذو قاع زجاجي للحفاظ على السلامة الهيكلية. ومع ذلك ، أدى استخدام هذه الطريقة إلى بقاء أقصر - ~ 15 ساعة - بسبب فقدان تبادل الغازات (البيانات غير معروضة). على عكس ثقافات 2D ، تحتل مخاريط النمو في 3D حجما أكبر وتتطلب تعويضا عن الحركة والقطع الأثرية في المحور z. لزيادة القدرة على تصوير الأحداث التفصيلية ، يجب استخدام التكنولوجيا البؤرية الحديثة. لذلك ، يوصى باستخدام محرك z-stack سريع المسح الضوئي ، مثل z-Galvo المتوفر على المجاهر البؤرية شديدة الحساسية33.
وتجدر الإشارة إلى أن هذا البروتوكول يقدم ثلاثة قيود رئيسية. أولا ، غالبا ما يكون من الصعب التحكم في مستويات التعبير / عدد الخلايا المعبرة عن أي بلازميد معين في الجسم الحي. هذا يدخل التباين بين جميع الشرائح حتى عند الحفاظ على نفس تركيز البلازميد. لذلك ، يجب تحديد اختيار العناصر التنظيمية في ناقلات التعبير المستخدمة مسبقا بعناية. ثانيا ، تصوير الأحداث التفصيلية باستخدام إدراج الغشاء غير ممكن حاليا. ويمكن التغلب على هذا القيد الثاني بالتحديثات المنهجية المقترحة في الفقرة السابقة. وأخيرا ، فإن مخاريط النمو حساسة للغاية للضوء ويمكن أن تصبح مبيضة ضوئيا بسرعة. لذلك ، فإن التصوير المتكرر لمخاريط النمو ، لمدة تقل عن 5 دقائق باستخدام المجاهر الماسحة بالليزر يمكن أن يؤدي في كثير من الأحيان إلى انهيار مخاريط النمو. في هذا الصدد ، يمكن تكييف التقدم الجديد في الأجهزة التي تم إنشاؤها بواسطة المجهر الضوئي للتصوير طويل الأجل لشرائح الدماغ34.
ومن المتوخى أن تفتح بروتوكولات من هذا القبيل طرقا بحثية جديدة، مما يسمح بفهم أفضل لما يتطلبه الأمر حتى يقرأ مخروط النمو ويتفاعل مع بيئة معقدة في الجسم الحي ، والأهم من ذلك، كشف آليات هذا التفاعل المتطور.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نود أن نشكر ماريا يوجينيا بيرنيس على تصوير الإجراءات. كما نشكر إميلي بيرنسايد وإميلي هاندلي وثوربن بيترالا وماكس شيلسكي وسينا ستيرن على قراءة المخطوطة ومناقشتها. نحن ممتنون لمساعدينا الفنيين المتميزين ، جيسيكا جونير ، بلانكا راندل ، وآن توان فام. نحن نعترف بالدعم القيم لمرفق المجهر الضوئي ومرفق الحيوانات في DZNE. تم دعم هذا العمل من قبل Deutsche Forschungsgesellschaft (DFG) ، والمؤسسة الدولية للبحوث في الشلل النصفي (IRP) ، وأجنحة من أجل الحياة (إلى F.B). F.B. هو عضو في مجموعة التميز ImmunoSensation2 ، SFBs 1089 و 1158 ، وهو حاصل على جائزة Roger De Spoelberch.
Materials
| Name | Company | Catalog Number | Comments |
| Adson Forceps | Fine Science Tools | 11006-12 | |
| Alexa Fluor 488 | Invitrogen | A21202 | Goat Anti-Mouse |
| Alexa Fluor 647 | Invitrogen | A21236 | Goat Anti-Mouse |
| Anti-Vimentin antibody | sigma-Aldrich | V2258-.2ML | Monoclonal mouse, clone LN-6, ascites fluid |
| B27 supplement | ThermoFisher Scientific | 17504044 | |
| Betadine | B. Braun | 3864154 | |
| Biozym Sieve GP Agarose | Biozyme | 850080 | |
| Braunol, Sprühflasche | B. Braun | 3864073 | |
| Buprenorphine (Temgesic) | GEHE Pharma | 345928 | |
| DAPI | sigma-Aldrich | D9542 | |
| DMZ unevirsal electrode puller | Zeitz | NA | |
| Electric razor | Andes | NA | ProClip UltraEdge Super 2-Speed model |
| Enrofloxacin (Baytril) | Bayer | 3543238 | 2,5% (wt/vol) |
| Eppendorf microloader pipette tips | FischerScientific | 10289651 | |
| Fast Green FCF | Sigma-Aldrich | F7252-5G | Dye content ≥ 85 % |
| Fetal Bovine Serum | ThermoFisher Scientific | 10500064 | |
| Fiji 2.1.0 | NIH | NA | https://imagej.net/software/fiji/downloads |
| Fine Scissors | Fine Science Tools | 14058-09 | ToughCut/Straight/9cm |
| FluoroDish Cell Culture Dish | World Precision Instruments | FD5040-100 | |
| Fluoromount Aqueous Mounting Medium | sigma-Aldrich | F4680-25ML | |
| Glucose | MedPex | 3705391 | 5% |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Glycine | Sigma-Aldrich | G8898 | |
| HBSS | Life Technologies | 14025092 | calcium, magnesium, no phenol red |
| Horse serum | Pan-Biotech | P30-0711 | |
| Imaris 9.7.2 | Bitplane | NA | https://imaris.oxinst.com/products/imaris-for-neuroscientists |
| Isoflurane | Virbac | NA | |
| Isotonic saline solution | B. Braun | 8609261 | 0.90% |
| Leica VT1200 S vibratome | Leica | 14048142066 | |
| LSM 880 with Airyscan | Zeiss | NA | |
| Metacam | Venusberg Apotheke | 8890217 | 5 mg/ml |
| Mice | Janvier Labs | NA | C57BL/6JRj |
| Micro-Adson Forceps | Fine Science Tools | 11018-12 | |
| Micropipette Storage Jar | World Precision Instruments | E210 | 16.16.27 |
| Microsoft Excel | Microsoft | NA | https://www.microsoft.com/en-us/microsoft-365/p/excel/cfq7ttc0k7dx?activetab=pivot:overviewtab |
| Millicell Cell Culture Insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm |
| Moria Perforated Spoons | Fine Science Tools | 10370-18 | |
| Moria Spoon | Fine Science Tools | 10321-08 | |
| Neurobasal Medium, minus phenol red | ThermoFisher Scientific | 12348017 | |
| Neuropan-2 supplement | Pan-Biotech | P07-11010 | |
| Normal goat serum | Abcam | ab138478 | |
| Olsen-Hegar Needle Holder with Scissors | Fine Science Tools | 12002-12 | |
| p-Tub-alpha-1-Dre | Addgene | 133925 | |
| p-Tub-alpha-1-iCre | Addgene | 133924 | |
| p-Tub-alpha-1-LifeAct-GFP | Addgene | 175437 | |
| Parafilm | VWR | 52858-000 | |
| Paraformaldehyde | sigma-Aldrich | P6148 | |
| PBS | Sigma-Aldrich | P3813-10PAK | |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | Addgene | 175438 | |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | Addgene | 175257 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| PicoNozzle Kit v2 | World Precision Instruments | 5430-ALL | |
| Platinum Tweezertrodes | Harvard Apparatus | 45-0487 | 1 mm / 3 mm |
| QIAGEN Maxi kit | QIAGEN | 12162 | |
| Reflex wound closure Clip | World Precision Instruments | 500344-10 | 7 mm |
| Sekundenkleber Pattex Mini Trio | Lyreco | 4722659 | |
| Square wave electroporation system ECM830 | Harvard Apparatus | W3 45-0052 | |
| Sterile gauze | Braun Askina | 9031216 | |
| Sterile lubricant eye ointment | Bayer Vital | PZN1578675 | |
| Sterile surgical gloves | Sempermed | 14C0451 | |
| Sucrose | Roth | 4621.2 | |
| Supramid 5-0 surgical silk sutures | B. Braun | NA | |
| Thin-wall glass capillaries | World Precision Instruments | TW100-4 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| µ-Slide 8 Well Glass Bottom | Ibidi | 80827 |
References
- Schelski, M., Bradke, F. Neuronal polarization: From spatiotemporal signaling to cytoskeletal dynamics. Molecular and Cellular Neurosciences. 84, 11-28 (2017).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews: Molecular Cell Biology. 10 (5), 332-343 (2009).
- Stoeckli, E. T. Understanding axon guidance: are we nearly there yet. Development. 145 (10), (2018).
- Bradke, F., Dotti, C. G. The role of local actin instability in axon formation. Science. 283 (5409), 1931-1934 (1999).
- Neukirchen, D., Bradke, F. Cytoplasmic linker proteins regulate neuronal polarization through microtubule and growth cone dynamics. Journal of Neuroscience. 31 (4), 1528-1538 (2011).
- Witte, H., Bradke, F. The role of the cytoskeleton during neuronal polarization. Current Opinion in Neurobiology. 18 (5), 479-487 (2008).
- Witte, H., Neukirchen, D., Bradke, F. Microtubule stabilization specifies initial neuronal polarization. Journal of Cell Biology. 180 (3), 619-632 (2008).
- Nichol, R. H., Catlett, T. S., Onesto, M. M., Hollender, D., Gomez, T. M. Environmental elasticity regulates cell-type specific RHOA signaling and neuritogenesis of human neurons. Stem Cell Reports. 13 (6), 1006-1021 (2019).
- Santos, T. E., et al. Axon growth of CNS neurons in three dimensions is amoeboid and independent of adhesions. Cell Reports. 32 (3), 107907 (2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1 (9), 761-772 (1988).
- Lin, C. H., Thompson, C. A., Forscher, P. Cytoskeletal reorganization underlying growth cone motility. Current Opinion in Neurobiology. 4 (5), 640-647 (1994).
- Myers, J. P., Gomez, T. M. Focal adhesion kinase promotes integrin adhesion dynamics necessary for chemotropic turning of nerve growth cones. Journal of Neuroscience. 31 (38), 13585-13595 (2011).
- Turney, S. G., et al. Nerve growth factor stimulates axon outgrowth through negative regulation of growth cone actomyosin restraint of microtubule advance. Molecular Biology of the Cell. 27 (3), 500-517 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nature Neuroscience. 7 (2), 136-144 (2004).
- Ferent, J., Zaidi, D., Francis, F. Extracellular control of radial glia proliferation and scaffolding during cortical development and pathology. Frontiers in Cell and Developmental Biology. 8, 578341 (2020).
- Dent, E. W., Gupton, S. L., Gertler, F. B. The growth cone cytoskeleton in axon outgrowth and guidance. Cold Spring Harbor Perspectives in Biology. 3 (3), (2011).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29 (22), 3874-3886 (2019).
- Azzarelli, R., Oleari, R., Lettieri, A., Andre, V., Cariboni, A. In vitro, ex vivo and in vivo techniques to study neuronal migration in the developing cerebral cortex. Brain Sciences. 7 (5), (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Namba, T., et al. Pioneering axons regulate neuronal polarization in the developing cerebral cortex. Neuron. 81 (4), 814-829 (2014).
- Shah, B., et al. Rap1 GTPases are master regulators of neural cell polarity in the developing neocortex. Cerebral Cortex. 27 (2), 1253-1269 (2017).
- Wiegreffe, C., Feldmann, S., Gaessler, S., Britsch, S. Time-lapse confocal imaging of migrating neurons in organotypic slice culture of embryonic mouse brain using in utero electroporation. Journal of Visualized Experiments: JoVE. (125), (2017).
- de Anda, F. C., Meletis, K., Ge, X., Rei, D., Tsai, L. H. Centrosome motility is essential for initial axon formation in the neocortex. Journal of Neuroscience. 30 (31), 10391-10406 (2010).
- Sakakibara, A., et al. Dynamics of centrosome translocation and microtubule organization in neocortical neurons during distinct modes of polarization. Cerebral Cortex. 24 (5), 1301-1310 (2014).
- Schatzle, P., Kapitein, L. C., Hoogenraad, C. C. Live imaging of microtubule dynamics in organotypic hippocampal slice cultures. Methods in Cell Biology. 131, 107-126 (2016).
- Qu, X., Kumar, A., Bartolini, F. Live imaging of microtubule dynamics at excitatory presynaptic boutons in primary hippocampal neurons and acute hippocampal slices. STAR Protocols. 2 (1), 100342 (2021).
- Tonnesen, J., Katona, G., Rozsa, B., Nagerl, U. V. Spine neck plasticity regulates compartmentalization of synapses. Nature Neuroscience. 17 (5), 678-685 (2014).
- Buchsbaum, I. Y., Cappello, S. Neuronal migration in the CNS during development and disease: insights from in vivo and in vitro models. Development. 146 (1), (2019).
- Rigby, M. J., Gomez, T. M., Puglielli, L. Glial cell-axonal growth cone interactions in neurodevelopment and regeneration. Frontiers in Neuroscience. 14, 203 (2020).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annual Review of Neuroscience. 32, 347-381 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved