A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل وتنقية الحويصلات خارج الخلية من الإشريكية القولونية والبكتيريا الأخرى قابلة للتطوير
In This Article
Summary
تفرز البكتيريا حويصلات خارج الخلية بحجم النانومتر (EVs) تحمل جزيئات بيولوجية نشطة بيولوجيا. تركز أبحاث EV على فهم تكوينها الحيوي ، ودورها في تفاعلات الميكروب والميكروب والميكروب المضيف والمرض ، بالإضافة إلى تطبيقاتها العلاجية المحتملة. يتم تقديم سير عمل للعزل القابل للتطوير للمركبات الكهربائية من البكتيريا المختلفة لتسهيل توحيد أبحاث المركبات الكهربائية.
Abstract
تفرز الأنواع البكتيرية المتنوعة ~ 20-300 نانومتر حويصلات خارج الخلية (EVs) ، تتكون من الدهون والبروتينات والأحماض النووية والجليكان والجزيئات الأخرى المشتقة من الخلايا الأبوية. تعمل المركبات الكهربائية كناقلات اتصال داخل الأنواع وفيما بينها بينما تساهم أيضا في التفاعل بين البكتيريا والكائنات المضيفة في سياق العدوى والاستعمار. نظرا للعديد من الوظائف المنسوبة إلى EVs في الصحة والمرض ، هناك اهتمام متزايد بعزل EVs للدراسات في المختبر وفي الجسم الحي . تم افتراض أن فصل المركبات الكهربائية على أساس الخصائص الفيزيائية ، أي الحجم ، من شأنه أن يسهل عزل الحويصلات من الثقافات البكتيرية المتنوعة.
يتكون سير عمل العزل من الطرد المركزي والترشيح والترشيح الفائق وكروماتوغرافيا استبعاد الحجم (SEC) لعزل المركبات الكهربائية عن الثقافات البكتيرية. تم دمج خطوة ترشيح التدفق العرضي (TFF) التي تعمل بالمضخة لتعزيز قابلية التوسع ، مما يتيح عزل المواد من لترات زراعة الخلايا الأولية. تم استخدام الإشريكية القولونية كنظام نموذجي يعبر عن نانولوسيفيراز المرتبط ب EV و mCherry غير المرتبط ب EV كبروتينات مراسلة. تم استهداف nanoluciferase إلى EVs عن طريق دمج نهايته N مع cytolysin A. كانت كسور الكروماتوغرافيا المبكرة التي تحتوي على 20-100 نانومتر EVs مع السيتوليسين A - nanoLuc المرتبط بها متميزة عن الكسور اللاحقة التي تحتوي على البروتينات الحرة. تم تأكيد وجود نانولوسيفيراز المرتبط ب EV من خلال وضع العلامات المناعية والمجهر الإلكتروني المرسل. ينطبق سير عمل عزل EV هذا على الأنواع البكتيرية الأخرى سالبة الجرام وإيجابية الجرام المرتبطة بالأمعاء البشرية. في الختام ، يتيح الجمع بين الطرد المركزي والترشيح والترشيح الفائق / TFF و SEC عزلا قابلا للتطوير للمركبات الكهربائية من الأنواع البكتيرية المتنوعة. سيؤدي استخدام سير عمل عزل موحد إلى تسهيل الدراسات المقارنة للمركبات الكهربائية الميكروبية عبر الأنواع.
Introduction
الحويصلات خارج الخلية (EVs) هي هياكل تشبه الجسيمات الشحمية بحجم النانومتر تتكون من الليبيدات والبروتينات والجليكان والأحماض النووية ، تفرزها كل من الخلايا بدائية النواة وحقيقية النواة1. منذ الدراسات المبكرة التي تصور إطلاق EVs من البكتيريا سالبة الجرام2 ، كان عدد الوظائف البيولوجية المنسوبة إلى EVs البكتيرية (قطرها 20-300 نانومتر) ينمو باستمرار في العقود الماضية. وتشمل وظائفها نقل مقاومة المضادات الحيوية3 ، وتشكيل الأغشية الحيوية4 ، واستشعار النصاب5 ، وتوصيل السموم6. هناك أيضا اهتمام متزايد باستخدام المركبات الكهربائية البكتيرية كعلاجات ، خاصة في علم اللقاحات7 وعلاج السرطان8.
على الرغم من الاهتمام المتزايد بأبحاث المركبات الكهربائية ، لا تزال هناك تحديات تقنية فيما يتعلق بطرق العزل. على وجه التحديد ، هناك حاجة إلى طرق عزل قابلة للتكرار وقابلة للتطوير ومتوافقة مع الكائنات الحية المتنوعة المنتجة للمركبات الكهربائية. لإنشاء مجموعة موحدة من المبادئ لتخطيط والإبلاغ عن عزل EV وطرق البحث ، تقوم الجمعية الدولية للحويصلات خارج الخلية بنشر وتحديث ورقة موقف MISEV9. علاوة على ذلك ، يوفر اتحاد EV-TRACK منصة مفتوحة للإبلاغ عن المنهجيات التفصيلية لعزل EV المستخدمة في المخطوطات المنشورة لتعزيز الشفافية10.
في هذا البروتوكول ، تم تكييف المنهجيات السابقة المستخدمة لعزل EVs من زراعة خلايا الثدييات11,12 لتمكين عزل EVs من زراعة الخلايا البكتيرية. سعينا إلى استخدام الأساليب التي تمكن من عزل EV من مجموعة متنوعة من الميكروبات ، والتي يمكن أن تكون قابلة للتطوير ، وتحقيق التوازن بين نقاء EV والعائد (كما تمت مناقشته في ورقة موقف MISEV9). بعد إزالة الخلايا البكتيرية والحطام عن طريق الطرد المركزي والترشيح ، يتركز وسط الاستزراع إما عن طريق الترشيح الفائق لجهاز الطرد المركزي (لحجم يصل إلى ~ 100 مل) أو TFF الذي يحركه المضخة (للأحجام الأكبر). ثم يتم عزل المركبات الكهربائية بواسطة SEC باستخدام أعمدة محسنة لتنقية المركبات الكهربائية الصغيرة.
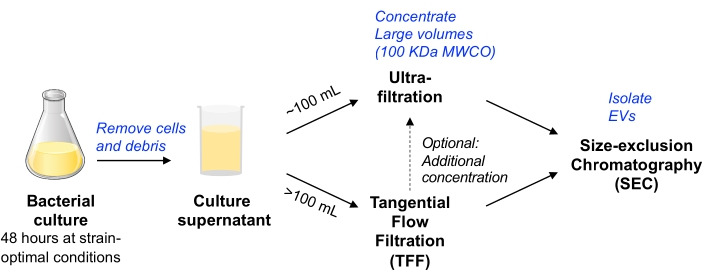
الشكل 1: نظرة عامة تخطيطية على سير عمل عزل EV البكتيري. الاختصارات: EV = حويصلة خارج الخلية ؛ TFF = ترشيح التدفق العرضي ؛ SEC = كروماتوغرافيا استبعاد الحجم ؛ MWCO = قطع الوزن الجزيئي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
تم استخدام سلالة فأر كومنسال من Escherichia coli (أي E. coli MP113) ككائن نموذجي وتم تعديلها للتعبير عن نانولوسيفيراز المرتبط ب EV عن طريق الاندماج مع cytolysin A ، كما ورد سابقا14. يمكن للطرق المستخدمة هنا معالجة ما يصل إلى عدة لترات على الأقل من الثقافات البكتيرية وفصل البروتينات المرتبطة ب EV عن البروتينات غير المرتبطة ب EV بشكل فعال. أخيرا ، يمكن أيضا استخدام هذه الطريقة للأنواع البكتيرية الأخرى إيجابية الجرام وسالبة الجرام. تم تقديم جميع البيانات ذات الصلة بالتجارب المبلغ عنها إلى قاعدة معارف EV-TRACK (EV-TRACK ID: EV210211)10.
Access restricted. Please log in or start a trial to view this content.
Protocol
ملاحظة: تأكد من أن جميع الأعمال التي تنطوي على البكتيريا والحمض النووي المؤتلف تتبع أفضل الممارسات لاحتواء السلامة الأحيائية المناسبة لمستوى خطر السلامة البيولوجية لكل سلالة. وينبغي أن يتم العمل وفقا للوائح السلامة الأحيائية المحلية والوطنية والدولية.
1. السلالات البكتيرية وظروف الزراعة
ملاحظة: السلالات البكتيرية المستخدمة في هذه الدراسة هي الإشريكية القولونية MP113 ، Akkermansia mucinophila ، Bacteroides thetaiotaomicron ، Bifidobacterium breve ، و Bifidobacterium dentium.
- بالنسبة للإشريكية القولونية ، استخدم حلقة معقمة لتلقيح مستعمرات مفردة إلى 250 إلى 1000 مل من مرق لوريا بيرتاني (LB) واحتضانها هوائيا في حاضنة اهتزاز عند 300 دورة في الدقيقة و 37 درجة مئوية لمدة 48 ساعة قبل معالجة الثقافة. بالنسبة لسلالة E. coli MP1 المؤتلفة التي تأوي p114-mCherry-Clyluc (الطريقة التكميلية والشكل التكميلي S1) ، أضف الكلورامفينيكول إلى أجار LB والمرق بتركيز نهائي قدره 17 ميكروغرام / مل.
- بالنسبة إلى A. mucinophila و B. thetaiotaomicron و B. breve و B . dentium ، قم بخط على ألواح أجار ضخ قلب الدماغ (BHI) واحتضانها لاهوائيا داخل غرفة لاهوائية من الفينيل. تلقيح مستعمرات مفردة في 100 مل من مرق BHI المختزل مسبقا واحتضانها لمدة 48 ساعة لاهوائيا.
2. عزل EV
- توضيح وسط الاستزراع البكتيري عن طريق الطرد المركزي والترشيح
- انقل مزارع الخلايا البكتيرية الملقحة في الخطوة 1 لتنظيف زجاجات الطرد المركزي من مادة البولي بروبيلين سعة 250 مل أو 500 مل عن طريق الصب. قم بالطرد المركزي للزجاجات في دوار كبير السعة وثابت الزاوية عند 4 درجات مئوية و 5000 × جم لمدة 15 دقيقة. انقل المادة الطافية لتنظيف زجاجات الطرد المركزي عن طريق الصب الدقيق ، وأجهزة الطرد المركزي مرة أخرى بسرعة 10000 × جم لمدة 15 دقيقة.
ملاحظة: أعد استخدام الزجاجات بعد التنظيف وإزالة التلوث المناسبين للسلامة البيولوجية.- في حالة وجود كريات كبيرة من الخلايا البكتيرية بعد الطرد المركزي الثاني ، كرر الطرد المركزي في زجاجة نظيفة لإزالة الخلايا بشكل أكبر.
- انقل المادة الطافية إلى جهاز مرشح يحركه الفراغ من البولي إيثر سلفون 0.22 ميكرومتر بحجم مناسب عن طريق الصب. قم بالتصفية عن طريق توصيل جهاز الترشيح بمصدر جدار فراغ. إذا انخفض معدل الترشيح بشكل كبير ، فما عليك سوى نقل أي مادة غير مفلترة إلى جهاز جديد. قم بتخزين الوسط المصفى عند 4 درجات مئوية طوال الليل ، واستمر في البروتوكول في اليوم التالي إذا رغبت في ذلك.
ملاحظة: تسمح أجهزة الطرد المركزي أعلاه عادة بمعالجة ~ 2x الحجم المشار إليه لثقافة الخلية من خلال كل جهاز. على سبيل المثال ، يمكن لجهاز مرشح واحد سعة 500 مل تصفية ~ 1000 مل من ثقافة الطرد المركزي المسبق. لا يتم عادة إعادة استخدام هذه الأجهزة. لا ينصح باستخدام مرشحات المحاقن في هذه الخطوة دون تحسين ، حيث لوحظت خسائر كبيرة في النماذج التي تم اختبارها. هذه نقطة توقف محتملة. - تحقق من الإزالة الكاملة للخلايا القابلة للحياة في هذه المرحلة عن طريق نشر حصص من المادة الطافية المفلترة على ألواح أجار مناسبة وتأكد من عدم وجود أي مستعمرات بعد الحضانة في الظروف المثلى للسلالة البكتيرية. إذا تم الكشف عن البكتيريا ، فقم بتحسين الإجراء أعلاه عن طريق إجراء عمليات طرد مركزي و / أو ترشيحات إضافية.
- انقل مزارع الخلايا البكتيرية الملقحة في الخطوة 1 لتنظيف زجاجات الطرد المركزي من مادة البولي بروبيلين سعة 250 مل أو 500 مل عن طريق الصب. قم بالطرد المركزي للزجاجات في دوار كبير السعة وثابت الزاوية عند 4 درجات مئوية و 5000 × جم لمدة 15 دقيقة. انقل المادة الطافية لتنظيف زجاجات الطرد المركزي عن طريق الصب الدقيق ، وأجهزة الطرد المركزي مرة أخرى بسرعة 10000 × جم لمدة 15 دقيقة.
- تركيز الوسط المصفى
- إذا كنت تعمل مع وحدات تخزين >100 مل بشكل كبير ، فانتقل إلى الخطوة 2.2.2. في حالة العمل بأحجام ~ 100 مل ، قم بتحميل 90 مل من وسط الاستزراع المصفى على خزان جهاز الترشيح الفائق بالطرد المركزي ذو السعة 100 كيلو دالتون (MWCO) باستخدام الماصات المصلية. قم دائما بالتوازن باستخدام جهاز ترشيح فائق مطابق ، وأجهزة طرد مركزي في دوار الجرافة المتأرجح عند 4 درجات مئوية و 2000 × جم لفترات 15-30 دقيقة ، حتى يتم تركيز حجم الوسط في الخزان العلوي إلى <0.5 مل.
- قم بتعبئة الخزان بأي وسيط استزراع مفلتر متبقي. في حالة "التعبئة" ، قم بإزالة التدفق في الجزء السفلي من الجهاز وأعد توازن أي أجهزة.
ملاحظة: لوحظ أن الحد الأقصى لحجم وسط الاستزراع المصفى الذي يمكن تركيزه باستخدام هذه الأجهزة هو <2 ضعف الحجم الموصى به. - إذا زادت لزوجة الوسط المركز في الخزان بشكل واضح (مادة داكنة ولزجة) ، قم بتخفيفها بمحلول ملحي مخزن بالفوسفات (PBS) وأعد التركيز عن طريق الطرد المركزي لتخفيف أي بروتينات غير EV أصغر من MWCO البالغ 100 كيلو دالتون.
ملاحظة: هذه نقطة توقف محتملة. - انقل الوسط المركز إلى أنبوب منخفض البروتين ، واحفظه في درجة حرارة 4 درجات مئوية طوال الليل ، واستمر في البروتوكول في اليوم التالي إذا رغبت في ذلك.
- قم بتعبئة الخزان بأي وسيط استزراع مفلتر متبقي. في حالة "التعبئة" ، قم بإزالة التدفق في الجزء السفلي من الجهاز وأعد توازن أي أجهزة.
- إذا كنت تعمل مع وحدات تخزين >100 مل بشكل كبير ، فحدد جهاز TFF بحجم مناسب (100 كيلو دالتون MWCO) لاستيعاب الحجم المراد معالجته.
ملاحظة: تتوفر أجهزة الترشيح لمعالجة 100 مل إلى >1000 مل تجاريا. سيحدد التوافر المحلي والتكلفة والتوافق مع المضخة والأنابيب / التوصيلات الطرز المعينة التي ستكون أكثر فائدة. تمت معالجة ما يصل إلى 2 لتر من وسط الاستزراع باستخدام الجهاز المشار إليه في جدول المواد قبل الحاجة إلى تنظيف الفلتر (انظر الخطوة 2.3 أدناه لمعرفة بروتوكول التنظيف).- قم بتجميع دائرة ترشيح باستخدام # 16 أنابيب منخفضة الربط / منخفضة الترشيح ، وخرطوم 1/8 بوصة إلى محولات Luer ، وجهاز TFF ، ومضخة تمعجية ، كما هو موضح في الشكل التكميلي S2.
ملاحظة: قم بإجراء TFF داخل خزانة السلامة الحيوية لتقليل مخاطر تلويث مستحضر EV بالبكتيريا البيئية. - في درجة حرارة الغرفة ، ابدأ في تدوير الوسط المصفى والمكيف بحوالي 200 مل / دقيقة (بحد أدنى 100 مل / دقيقة). حدد عدد الدورات في الدقيقة المناسب المقابل لمعدل التدفق المطلوب عن طريق ضخ 200 مل من PBS في وعاء مدرج. عند تدوير الوسط المصفى والمكيف ، اجمع الجزيئات <100 كيلو دالتون التي تعبر غشاء الترشيح الفائق كنفايات في وعاء منفصل.
ملاحظة: سيفترض المثال أدناه حجما أوليا قدره 2 لتر من الثقافة. - استمر في تدوير الوسط المكيف حتى يتم تقليل حجمه إلى ~ 100-200 مل. انتقل إلى أوعية أصغر حسب الحاجة. تمييع 2 أضعاف مع PBS ، والاستمرار في تعميم مع المضخة ، مع التركيز وصولا الى 75-100 مل. تمييع 2 أضعاف مع PBS ، والاستمرار في تعميم إلى حجم نهائي من 25 مل. تمييع 2 أضعاف مع PBS والاستمرار في تعميم حتى <10 مل.
- ارفع أنبوب التغذية من خزان العينة ، واستمر في الضخ لتطهير المرشح واستعادة أكبر قدر ممكن من العينة.
ملاحظة: هذه نقطة توقف محتملة. - انقل العينة المركزة إلى أنبوب مخروطي وخزنها طوال الليل عند 4 درجات مئوية إذا رغبت في ذلك. بدلا من ذلك ، تابع البروتوكول.
- انقل العينة المركزة إلى جهاز ترشيح فائق بالطرد المركزي بسعة 15 مل 100 كيلو دالتون MWCO. جهاز طرد مركزي في دوار دلو متأرجح عند 4 درجات مئوية و 2000 × جم لفترات 15-30 دقيقة حتى يتم تركيز حجم الوسط في الخزان العلوي إلى <2 مل.
ملاحظة: هذه نقطة توقف محتملة. - انقل الوسط المركز إلى أنبوب منخفض البروتين ، واحفظه في درجة حرارة 4 درجات مئوية طوال الليل ، مع الاستمرار في البروتوكول في اليوم التالي إذا رغبت في ذلك.
- قم بتجميع دائرة ترشيح باستخدام # 16 أنابيب منخفضة الربط / منخفضة الترشيح ، وخرطوم 1/8 بوصة إلى محولات Luer ، وجهاز TFF ، ومضخة تمعجية ، كما هو موضح في الشكل التكميلي S2.
- إذا كنت تعمل مع وحدات تخزين >100 مل بشكل كبير ، فانتقل إلى الخطوة 2.2.2. في حالة العمل بأحجام ~ 100 مل ، قم بتحميل 90 مل من وسط الاستزراع المصفى على خزان جهاز الترشيح الفائق بالطرد المركزي ذو السعة 100 كيلو دالتون (MWCO) باستخدام الماصات المصلية. قم دائما بالتوازن باستخدام جهاز ترشيح فائق مطابق ، وأجهزة طرد مركزي في دوار الجرافة المتأرجح عند 4 درجات مئوية و 2000 × جم لفترات 15-30 دقيقة ، حتى يتم تركيز حجم الوسط في الخزان العلوي إلى <0.5 مل.
- تنظيف جهاز TFF (اختياري)
ملاحظة: ينخفض معدل الترشيح عندما يبدأ جهاز TFF في "الانسداد" أثناء العملية (القاذورات). إذا لزم الأمر ، يمكن تنظيف جهاز المرشح لتسهيل ترشيح عينات إضافية في نفس عملية التنقية. على الرغم من أنه ممكن نظريا ، إلا أنه لم يتم استخدام مرشح TFF نظيف لتشغيل تنقية مختلف لتجنب التلوث المتبادل.- للتنظيف ، قم بإزالة جميع الأنابيب والأغطية من جهاز TFF واستنزاف أي سائل متبقي.
- استخدم المضخة التمعجية والأنابيب لإغراق كل من المقصورات الداخلية والخارجية لجهاز TFF (أي عبر المنافذ المتوازية والعمودية في النموذج المدرج في جدول المواد) ب ~ 100 مل من الماء المقطر. قم بإزالة جميع الأنابيب / الأغطية واستنزاف جهاز TFF.
- قم بتغطية المنافذ الخارجية (العمودية ، المرشحة) وقم بتدوير 250 مل من الإيثانول بنسبة 20٪ في الماء المقطر عند >200 مل / دقيقة لمدة 10 دقائق عبر المقصورة الداخلية. استنزاف ، غمر بالماء المقطر ، واستنزاف مرة أخرى على النحو الوارد أعلاه.
- قم بتدوير 250 مل من محلول هيدروكسيد الصوديوم الطازج 0.5 نيوتن لمدة 30 دقيقة عبر الحجرة الداخلية وصفيها مرة أخرى.
- أعد توصيل جميع الأنابيب والأغطية بمنافذ المدخل والمخرج والترشيح ، كما في الشكل التكميلي S2 ، وقم بتدوير محلول 0.5 N NaOH مرة أخرى حتى يتخلل حجم NaOH > 1 مل / سم2 مساحة سطح المرشح عبر غشاء المرشح ويتم تجميعه كمرشح / نفايات.
- شطف جهاز TFF بالماء المقطر على النحو الوارد أعلاه. استخدم جهاز TFF على الفور أو قم بإغراق الجهاز ب ~ 100 مل من الإيثانول بنسبة 20٪ وتخزينه طوال الليل عند 4 درجات مئوية.
ملاحظة: إذا تم تخزينها في الإيثانول ، فتأكد من تصريفها وشطفها بالماء واستنزاف وتدوير 250 مل من PBS عبر الجهاز حتى يتخلل حجم >1 مل / سم2 مساحة سطح المرشح من خلال غشاء المرشح ويتم جمعها كمرشح / نفايات لإزالة الإيثانول المتبقي قبل معالجة العينة.
- كروماتوغرافيا استبعاد الحجم (SEC)
ملاحظة: يستخدم SEC لزيادة نقاء EVs وإزالة البروتين غير الحويصلي.- استخدم عمود SEC صغير (حجم سرير 10 مل) لعزل المركبات الكهربائية من <100 مل من مواد البدء وعمود أكبر (حجم سرير 47 مل) لعزل المركبات الكهربائية من >100 مل من مواد البدء.
ملاحظة: سيسرد المثال أدناه وحدات التخزين للعمود الأكبر ، مع وحدات التخزين للعمود الأصغر بين قوسين. - أحضر عمود SEC و PBS إلى درجة حرارة الغرفة على مدار عدة ساعات. ثبت عمود SEC في وضع رأسي باستخدام حامل وحامل مختبر قياسي. بدلا من ذلك ، استخدم حوامل أعمدة الكروماتوغرافيا التجارية.
- قبل الاتصال بعمود SEC ، قم بترطيب خزان العينة عن طريق السماح ل 5 مل من PBS بالتدفق عبر الفريت إلى حاوية النفايات. قم بفك غطاء مدخل عمود SEC ، وأضف 2 مل من PBS إلى خزان العينة ، وقم بتوصيل الخزان بعناية بالعمود حيث يقطر PBS من خلال frit (لا ينطبق على أعمدة SEC الصغيرة).
ملاحظة: تمنع هذه الخطوة السابقة أي فقاعات هواء من الوقوع في الجزء العلوي من عمود SEC. إذا كان الهواء محاصرا ، فقم بإزالة الخزان ، وانقر فوق العمود لإخراج فقاعة الهواء ، وكرر إجراء التوصيل. بالنسبة للعمود الأصغر ، ما عليك سوى إلغاء الغطاء العلوي لعمود SEC ، وإرفاق قادوس العينة. - أضف 47 مل (10 مل) من PBS إلى خزان العينة وقم بإلغاء الغطاء السفلي لعمود SEC. اسمح لكل المخزن المؤقت للعينة المحملة بالتدفق عبر العمود للتوازن. تخلص من التدفق من خلال.
- قم بتحميل 2 مل (0.5 مل) كحد أقصى من العينة على خزان العينة ، وتخلص من التدفق ، واترك العينة تدخل العمود تماما.
- أضف PBS على الفور إلى خزان العينة أو القادوس بحجم 14.25 مل مطروحا منه حجم العينة (3 مل مطروحا منه حجم العينة ، للعمود الصغير). اسمح للحل بالتدفق عبر العمود وتجاهل هذا المبلغ الذي يساوي حجم فراغ العمود.
ملاحظة: بالنسبة لعينة نموذجية سعة 2 مل ، ستكون كمية PBS المراد إضافتها إلى خزان العينة أو القادوس 12.25 مل. - ضع أنبوبا صغيرا منخفض الربط سعة 2 مل أسفل عمود SEC مباشرة. أضف على الفور 2 مل (0.5 مل) من PBS إلى خزان العينة واسمح له بدخول العمود. قم بتسمية أول 2 مل (0.5 مل) من التدفق عبر الكسر 1. استمر في إضافة 2 مل (0.5 مل) في المرة الواحدة إلى خزان العينة لجمع كل جزء لاحق.
ملاحظة: معظم EVs البكتيرية تلاشى في أول 5 كسور. أثناء التحسين ، تم جمع أول 12 كسورا. - قم بتخزين الكسور عند 4 درجات مئوية للتخزين قصير الأجل (أيام) أو -80 درجة مئوية للتخزين طويل الأجل.
- تنظيف وتخزين أعمدة SEC القابلة لإعادة الاستخدام
ملاحظة: يمكن إعادة استخدام أعمدة SEC الموضحة في هذا البروتوكول حتى 5 مرات وفقا للشركة المصنعة. إذا انخفض معدل تدفق أعمدة SEC بعد استخدامات <5 ، توصي الشركة المصنعة بالطرد المركزي للعينات المركزة عند 10000 × جم لمدة 10 دقائق لإزالة أي مجاميع قبل SEC. ثم قم بتحميل طافع جهاز الطرد المركزي هذا على عمود SEC لعزل EV.- لتنظيف عمود SEC وتخزينه بعد كل استخدام ، أضف 2 مل (0.5 مل) من 0.5 M NaOH واتركه يدخل العمود بالكامل. قم بتشغيل 100 مل (20 مل) من الإيثانول بنسبة 20٪ عبر العمود وتخزينه عند 4 درجات مئوية حتى الاستخدام التالي. قبل الاستخدام التالي ، قم بموازنة الإيثانول مع درجة حرارة الغرفة على النحو الوارد أعلاه ، وقم باستبداله بمخزن PBS المؤقت عن طريق تشغيل 150 مل (30 مل) أخرى من PBS عبر العمود.
- لتنظيف عمود SEC وإعادة استخدامه على الفور بعد كل استخدام ، أضف 2 مل (0.5 مل) من 0.5 M NaOH واتركه يدخل العمود بالكامل. قم بتشغيل ما يقرب من 150 مل (30 مل) من المخزن المؤقت لبرنامج PBS لغسل هيدروكسيد الصوديوم. عندما يكون الرقم الهيدروجيني للشطف مساويا ل PBS (~ 7) ، يمكن تحميل عينة جديدة.
- استخدم عمود SEC صغير (حجم سرير 10 مل) لعزل المركبات الكهربائية من <100 مل من مواد البدء وعمود أكبر (حجم سرير 47 مل) لعزل المركبات الكهربائية من >100 مل من مواد البدء.
3. مراقبة جودة إعداد EV
- اختبار العقم
ملاحظة: نظرا لأن هذه المركبات الكهربائية تأتي من مزارع بكتيرية ، فمن الأهمية بمكان ضمان العقم قبل الاستخدام النهائي.- الحصول على 100 ميكرولتر (20 ميكرولتر) من الكسور لاستخدامها في المقايسات وتلقيح 3 مل من الوسط المستخدم لزراعة البكتيريا المصدر. الثقافة في ظل الظروف المثلى المعنية لمدة 3 أيام على الأقل ومراقبة التعكر. بدلا من ذلك ، قم بتطبيق عينات الكسور على ألواح أجار تحتوي على الوسط المستخدم لزراعة البكتيريا المنتجة والبحث عن تكوين مستعمرة.
ملاحظة: إذا تم الكشف عن تلوث بكتيري ، فلا يوصى باستخدام مستحضر EV للتجربة. بدلا من ذلك ، كرر العزل ، مع الحرص على تقليل مخاطر التلوث البكتيري عن طريق (أ) إجراء طرد مركزي / ترشيح كاف لوسط زراعة الخلايا البكتيرية المكيف ، (ب) استخدام زجاجات نظيفة ، وأنابيب ، ومرشحات ، وأعمدة كروماتوغرافيا ، و (ج) استخدام تقنيات التعقيم المناسبة.
- الحصول على 100 ميكرولتر (20 ميكرولتر) من الكسور لاستخدامها في المقايسات وتلقيح 3 مل من الوسط المستخدم لزراعة البكتيريا المصدر. الثقافة في ظل الظروف المثلى المعنية لمدة 3 أيام على الأقل ومراقبة التعكر. بدلا من ذلك ، قم بتطبيق عينات الكسور على ألواح أجار تحتوي على الوسط المستخدم لزراعة البكتيريا المنتجة والبحث عن تكوين مستعمرة.
- تحديد كمية البروتين
ملاحظة: تم استخدام مجموعة قياس كمية البروتين عالية الحساسية والقائمة على التألق (انظر جدول المواد). تعمل المجموعة مع مقياس فلوري مطابق عند أطوال موجية للإثارة / الانبعاث تبلغ 485/590 نانومتر.- أحضر جميع الكواشف والمعايير والعينات إلى درجة حرارة الغرفة.
- قم بإعداد مزيج رئيسي من كاشف البروتين والمخزن المؤقت بإضافة 1 ميكرولتر من الكاشف إلى 199 ميكرولتر من المخزن المؤقت لكل عينة ومعيار ليتم فحصه. باستخدام أنابيب PCR رقيقة الجدران سعة 0.5 مل ، أضف 10 ميكرولتر قياسي + 190 ميكرولتر من المزيج الرئيسي لكل أنبوب قياسي.
ملاحظة: لتكون ضمن نطاق الفحص ، تعتمد كمية كل جزء يتم إضافته إلى كل أنبوب عينة على محصول البروتين المتوقع للتنقية. عادة ، تم استخدام 5 ميكرولتر من كل جزء + 195 ميكرولتر من المزيج الرئيسي. يجب أن يكون الحجم النهائي للعينة + المزيج الرئيسي 200 ميكرولتر. - دوامة أنابيب الفحص ، واحتضان لمدة 15 دقيقة على الأقل في درجة حرارة الغرفة في الظلام.
- قم بقياس المعايير على مقياس الفلور المناسب (انظر جدول المواد) عن طريق تحديد خيار فحص البروتين باستخدام أزرار الأسهم والضغط على زر GO للتأكيد. اتبع التعليمات التي تظهر على الشاشة ، وأدخل كل أنبوب قياسي واضغط على GO.
- أدخل أنبوب العينة التجريبي ؛ اضغط على GO للقراءة ؛ ولاحظ النتيجة المعروضة ، وهي تركيز البروتين الفعلي في خليط المخزن المؤقت / العينة للفحص. للحصول على تركيز البروتين في العينة، استخدم مفاتيح الأسهم لتحديد خيار حساب تركيز العينة ، واضغط على GO، واستخدم مفاتيح الأسهم لتحديد حجم العينة المضاف إلى مخزن الفحص المؤقت للعينة المحددة. اضغط على GO وسجل تركيز البروتين في العينة. كرر هذه الخطوة لكل عينة ليتم تحليلها.
- عد الجسيمات وتوزيع الحجم
ملاحظة: تم استخدام استشعار النبض المقاوم للموائع الدقيقة (MRPS) لتحديد تركيز EV وتوزيع الحجم.- تمييع العينات في PBS تستكمل مع 1 ٪ Tween-20 التي تم ترشيحها من خلال مرشح حقنة 0.02 ميكرومتر إلى تركيز البروتين من حوالي 0.1 ميكروغرام / مل.
ملاحظة: الهدف من التخفيف هو الوصول إلى تركيز الجسيمات المتوقع في حدود 1010 جسيمات / مل في الكسور المحتوية على EV. قد يلزم تحديد التخفيف الأمثل تجريبيا. من المتوقع وجود عدد قليل من المركبات الكهربائية للكسور اللاحقة (بعد الكسر 6). وبالتالي ، من المحتمل أن يكون تركيز الجسيمات <1010 جسيمات / مل على الرغم من التحليل عند التخفيفات المنخفضة. - قم بتحميل 3 ميكرولتر من كل عينة في خرطوشة الموائع الدقيقة التي تستخدم لمرة واحدة باستخدام ماصة دقيقة ، وأدخل الخرطوشة في أداة MRPS ، واضغط على الزر المعدني بحافة زرقاء مضيئة.
- انقر فوق Go! على برنامج الاستحواذ وانتظر حتى يتم تحليل العينة بواسطة الأداة. الحصول على 1000 إلى 10000 حدث جسيمي لتقليل الخطأ الإحصائي الفني للتحليل. في هذه المرحلة، انقر فوق إيقاف وإنهاء التشغيل لإكمال الحصول على العينة.
ملاحظة: جنبا إلى جنب مع ملفات البيانات الأولية ، تقوم الأداة بإخراج جدول بيانات موجز يسرد تركيز الجسيمات في العينة. قم بتصحيح هذه القيمة وفقا لتخفيف العينة الذي تم إجراؤه. - باستخدام برنامج التحليل ، قم بتحميل البيانات الأولية وإنشاء رسوم بيانية مخصصة لتوزيع الحجم.
- تمييع العينات في PBS تستكمل مع 1 ٪ Tween-20 التي تم ترشيحها من خلال مرشح حقنة 0.02 ميكرومتر إلى تركيز البروتين من حوالي 0.1 ميكروغرام / مل.
4. تخزين EV
- قم بتقسيم الكسور الفردية أو المجمعة إلى 25-50٪ من حجم الكسر الفردي (اعتمادا على حجم العمود المستخدم) في أنابيب منخفضة البروتين وتخزينها عند -80 درجة مئوية لتجنب دورات التجميد والذوبان.
ملاحظة: قد تتطلب التطبيقات المختلفة حصصا أصغر أو أكبر اعتمادا على الكمية المتوقعة المستخدمة في كل تجربة. يجب تحديد ذلك تجريبيا. يمكن التخلص من الكسور غير المحتوية على EV إذا لم تكن قابلة للتطبيق على أهداف البحث.
5. المجهر الإلكتروني النافذ
- تلطيخ سلبي
- أضف 5 ميكرولتر من عينة EV إلى شبكة 400 النحاسية المطلية بالكربون واحتضانها في درجة حرارة الغرفة لمدة 10 دقائق. اغسل جانب العينة ب 5 قطرات من 5 mM Tris buffer (درجة الحموضة 7.1) ثم ب 5 قطرات من الماء المقطر.
- جانب عينة وصمة عار مع 5 قطرات من خلات اليورانيل 2 ٪. امسح أي كمية إضافية من البقع بورق الترشيح ، واترك الشبكة تجف تماما لعدة ساعات أو طوال الليل. تصور العينات باستخدام مجهر إلكتروني يعمل بجهد 80 كيلو فولت.
- وضع العلامات المناعية
- ضع 10 ميكرولتر من تعليق EV على شبكة شبكة فورمفار / كربون 400 واحتضانها في درجة حرارة الغرفة لمدة 1 ساعة. اغسل الشبكة في PBS ثلاث مرات ، ثم ضع 4٪ بارافورمالدهيد لمدة 10 دقائق لإصلاح العينة. اغسل الشبكات خمس مرات باستخدام برنامج تلفزيوني.
- سد الشبكة بثلاث غسلات من PBS تحتوي على 0.1٪ ألبومين مصل بقري (BSA). بعد ذلك ، ضع 10 ميكرولتر من الجسم المضاد الأولي لمدة 40 دقيقة في درجة حرارة الغرفة (هنا ، 1 ميكروغرام / مل من الجسم المضاد nluc). اغسل ثلاث مرات مرة أخرى باستخدام برنامج تلفزيوني يحتوي على 0.1٪ BSA.
- أضف 10 ميكرولتر من الجسم المضاد الثانوي المسمى بالذهب إلى الشبكة واحتضانه لمدة 40 دقيقة في درجة حرارة الغرفة. اغسل الشبكات ثلاث مرات باستخدام برنامج تلفزيوني.
ملاحظة: هنا ، تم استخدام جسم مضاد مضاد للفأر من الماعز مقترن بجسيمات نانوية ذهبية 10 نانومتر بعد تخفيف 1:10 في حجب المخزن المؤقت. إذا كان وضع العلامات الذهبية يحجب تصور EV ، فيمكن استخدام الأجسام المضادة الثانوية ذات الجسيمات النانوية الذهبية الأصغر (على سبيل المثال 5 نانومتر) بدلا من ذلك. - بعد إصلاح الشبكة مع 10 ميكرولتر من 2.5 ٪ جلوتارالدهيد لمدة 10 دقائق في درجة حرارة الغرفة. يغسل ثلاث مرات في برنامج تلفزيوني. إجراء تلطيخ سلبي مع 2 ٪ خلات اليورانيل (10 ميكرولتر) لمدة 15 دقيقة. قم بتضمين العينات في 10 ميكرولتر من أسيتات اليورانيل 0.5٪ ومحلول ميثيل السليلوز 0.13٪ لمدة 10 دقائق.
- اترك شبكات العينات تجف طوال الليل في درجة حرارة الغرفة قبل التصوير على المجهر الإلكتروني.
- في برنامج الحصول على المجهر ، حدد التعرض تجريبيا للحصول على الجودة المثلى للصورة (على سبيل المثال ، 0.80851 ثانية في هذا الإعداد المحدد) واضبطها عن طريق كتابة هذه القيمة في مربع خيار وقت التعرض . حدد خيار 80 كيلو فولت ، وانقر فوق بدء الاستحواذ لالتقاط الصورة.
Access restricted. Please log in or start a trial to view this content.
النتائج
لتقييم أجزاء كروماتوغرافيا SEC التي تم إثراؤها ل EVs ، تم تحميل عمود SEC ب 2 مل من وسيط الاستزراع المشروط E. coli MP1 الذي تم تركيزه 1000 ضعف بواسطة TFF ، وتم جمع الكسور المتسلسلة. باستخدام MRPS ، وجد أن الكسور 1-6 تحتوي على معظم المركبات الكهربائية (الشكل 2 أ). احتوت الكسور اللاحقة على عد...
Access restricted. Please log in or start a trial to view this content.
Discussion
في البروتوكول أعلاه ، يتم وصف طريقة قابلة للتطوير وتعزل المركبات الكهربائية بشكل موثوق من مختلف البكتيريا سالبة الجرام / الإيجابية والهوائية / اللاهوائية. لديها العديد من نقاط التوقف المحتملة طوال الإجراء ، على الرغم من أنه من الأفضل تجنب أخذ أكثر من 48 ساعة لعزل المركبات الكهربائية عن وسا...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح يعلنونه.
Acknowledgements
تم دعم البحث الموصوف أعلاه من خلال منحة تدريب NIH TL1 TR002549-03. نشكر الدكتور جون سي تيلتون وزاكاري تروير (جامعة كيس ويسترن ريزيرف) لتسهيل الوصول إلى أداة تحليل حجم الجسيمات. Lew Brown (Spectradyne) للمساعدة التقنية في تحليل بيانات توزيع حجم الجسيمات ؛ الدكتور ديفيد بوتنام في جامعة كورنيل لتوفير البلازميد pClyA-GFP14 ؛ والدكتور مارك جوليان من جامعة بنسلفانيا لتزويدنا ب E. coli MP113.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 mL flat cap, thin-walled PCR tubes | Thermo Scientific | 3430 | it is important to use thin-walled PCR tubes to obtain accurate readings with Qubit |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron microscopy sciences | 15700 | |
| 250 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1495 | |
| 500 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1493 | |
| 65 mm Polypropylene Round-Bottom/Conical Bottle Adapter | Beckman Coulter | 392077 | Allows Vivacell to fit in rotor |
| Akkermansia mucinophila | ATCC | BAA-835 | |
| Amicon-15 (100 kDa MWCO) | MilliporeSigma | UFC910024 | |
| Avanti J-20 XPI centrifuge | Beckman Coulter | No longer sold by Beckman. Avanti J-26XP is closest contemporary model. | |
| Bacteroides thetaiotaomicron VPI 5482 | ATCC | 29148 | |
| Bifidobacterium breve | NCIMB | B8807 | |
| Bifidobacterium dentium | ATCC | 27678 | |
| Brain Heart infusion (BHI) broth | Himedia | M2101 | After autoclaving, Both BHI broth and agar were introduced into the anaerobic chamber, supplemented with Menadione (1 µg/L), hematin (1.2 µg/L), and L-Cysteine Hydrochloride (0.05%). They were then incubated for at least 24 h under anaerobic conditions before inoculation with the anaerobic bacterial strains. |
| C-300 microfluidics cartridge | Spectradyne | ||
| Chloramphenicol | MP Biomedicals | ICN19032105 | |
| Electron microscope | FEI company | Tecnai G2 SpiritBT | |
| Escherichia coli HST08 (Steller competent cells) | Takara | 636763 | |
| Escherichia coli MP1 | Dr. Mark Goulian (gift) | commensal bacteria derived from mouse gut | |
| Fiberlite 500 mL to 250 mL adapter | ThermoFisher | 010-0151-05 | used with Fiberlite rotor to enable 250 mL bottles to be used for smaller size of starting bacterial culture |
| Fiberlite fixed-angle centrifuge rotor | ThermoFisher | F12-6x500-LEX | fits 6 x 500 mL bottles |
| Formvar Carbon Film 400 Mesh, Copper | Electron microscopy sciences | FCF-400-CU | |
| Glutaraldehyde (EM-grade, 10% aqeous solution) | Electron microscopy sciences | 16100 | |
| Hematin | ChemCruz | 207729B | Stock solution was made in 0.2 M L-histidine solution as 1.2 mg/mL |
| Infinite M Nano+ Microplate reader | Tecan | This equibment was used to measure the mCherry fluorescence | |
| In-Fusion HD Cloning Plus | Takara | 638909 | For cloning of the PCR fragements into the PCR-lineraized vectors |
| JS-5.3 AllSpin Swinging-Bucket Rotor | Beckman Coulter | 368690 | |
| Lauria Bertani (LB) broth, Miller | Difco | 244620 | |
| L-Cysteine Hydrochloride | J.T. Baker | 2071-05 | It should be weighed and added directly to the autoclaved BHI media inside the anaerobic chamber |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer - special | HV-30800-08 | connection adapters for filtration tubing circuit |
| Masterflex Fitting, Polypropylene, Straight, Male Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer - special | HV-30800-24 | connection adapters for filtration tubing circuit |
| Masterflex L/S Analog Variable-Speed Console Drive, 20 to 600 rpm | Masterflex | HV-07555-00 | |
| Masterflex L/S Easy-Load Head for Precision Tubing, 4-Roller, PARA Housing, SS Rotor | Masterflex | EW-07514-10 | |
| Masterflex L/S Precision Pump Tubing, PharmaPure, L/S 16; 25 ft | Cole Palmer | EW-06435-16 | low-binding/low-leaching tubing |
| Menadione (Vitamin K3) | MP | 102259 | Stock solution was made in ethanol as 1 mg/mL |
| MIDIKROS 41.5CM 100K MPES 0.5MM FLL X FLL 1/PK | Repligen | D04-E100-05-N | TFF device we have used to filter up to 2 L of E. coli culture supernatant |
| Nano-Glo Luciferase Assay System | Promega | N1110 | This assay kit was used to measure the luminescence of the nluc reporter protein |
| NanoLuc (Nluc) Luciferase Antibody, clone 965808 | R&D Systems | MAB10026 | |
| nCS1 microfluidics resistive pulse sensing instrument | Spectradyne | ||
| nCS1 Viewer | Spectradyne | Analysis software for particle size distribution | |
| OneTaq 2x Master Mix with Standard Buffer | NEB | M0482 | DNA polymerase master mix used to perform the routine PCR reactions for colony checking |
| Protein LoBind, 2.0 mL, PCR clean tubes | Eppendorf | 30108450 | |
| Q5 High-Fidelity 2x Master Mix | NEB | M0492 | DNA polymerase master mix used to perform the PCR reactions needed for cloning |
| qEV original, 35 nm | Izon | maximal loading volume of 0.5 mL | |
| qEV rack | Izon | for use with the qEV-original SEC columns | |
| qEV-2, 35 nm | Izon | maximal loading volume of 2 mL | |
| Qubit fluorometer | ThermoFisher | Item no longer available. Closest available product is Qubit 4.0 Fluorometer (cat. No. Q33238) | |
| Qubit protein assay kit | ThermoFisher | Q33211 | Store kit at room temperature. Standards are stored at 4 °C. |
| Sorvall Lynx 4000 centrifuge | ThermoFisher | 75006580 | |
| SpectraMax i3x Microplate reader | Molecular Devices | This equipment was used to measure the nanoluciferase bioluminescence | |
| Stericup Quick-release-GP Sterile Vacuum Filtration system (150, 250, or 500 mL) | MilliporeSigma | S2GPU01RE S2GPU02RE S2GPU05RE | One or multiple filters can be used to accommodate working volumes. In our experience, you can filter twice the volume listed on the product size. |
| Uranyl acetate | Electron microscopy sciences | 22400 | |
| Vinyl anaerobic chamber | Coy Lab | ||
| Vivacell 100, 100,000 MWCO PES | Sartorius | VC1042 | |
| Whatman Anotop 10 Plus syringe filters (0.02 micron) | MilliporeSigma | WHA68093002 | to filter MRPS diluent |
References
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066(2015).
- Chatterjee, S. N., Das, J. Electron microscopic observations on the excretion of cell-wall material by Vibrio cholerae. Journal of General Microbiology. 49 (1), 1-11 (1967).
- Ciofu, O., Beveridge, T. J., Kadurugamuwa, J., Walther-Rasmussen, J., Hoiby, N. Chromosomal beta-lactamase is packaged into membrane vesicles and secreted from Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 45 (1), 9-13 (2000).
- Yonezawa, H., et al. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation. BMC Microbiology. 9, 197(2009).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Petousis-Harris, H., et al. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet. 390 (10102), 1603-1610 (2017).
- Kim, O. Y., et al. Bacterial outer membrane vesicles suppress tumor by interferon-gamma-mediated antitumor response. Nature Communications. 8 (1), 626(2017).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Consortium, E. -T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Watson, D. C., et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 105, 195-205 (2016).
- Watson, D. C., et al. Scalable, cGMP-compatible purification of extracellular vesicles carrying bioactive human heterodimeric IL-15/lactadherin complexes. Journal of Extracellular Vesicles. 7 (1), 1442088(2018).
- Lasaro, M., et al. Escherichia coli isolate for studying colonization of the mouse intestine and its application to two-component signaling knockouts. Journal of Bacteriology. 196 (9), 1723-1732 (2014).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. Journal of Molecular Biology. 380 (1), 51-66 (2008).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. Journal of Bacteriology. 181 (16), 4725-4733 (1999).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12, 628801(2021).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved