Method Article
تحليل مبسط وعالي الإنتاجية لانقباض الخلية الواحدة باستخدام اللدائن المطاطية ذات الأنماط الدقيقة
In This Article
Summary
يقدم هذا العمل بروتوكولا مرنا لاستخدام تكنولوجيا الأسطح المرنة القابلة للانكماش (FLECS) ذات العلامات الفلورية في شكل ميكروويل من أجل تحديد كمي مبسط وغير مباشر لقوى الانقباض أحادية الخلية استنادا إلى الإزاحة المرئية للأنماط الدقيقة للبروتين الفلوري.
Abstract
توليد قوة الانقباض الخلوي هو سمة أساسية مشتركة بين جميع الخلايا تقريبا. هذه القوى الانقباضية ضرورية للتنمية السليمة ، وتعمل على كل من المستويات الخلوية والأنسجة ، وتنظيم الأنظمة الميكانيكية في الجسم. تعتمد العديد من العمليات البيولوجية على القوة ، بما في ذلك الحركة والالتصاق وانقسام الخلايا المفردة ، بالإضافة إلى تقلص واسترخاء أعضاء مثل القلب والمثانة والرئتين والأمعاء والرحم. نظرا لأهميته في الحفاظ على الوظيفة الفسيولوجية المناسبة ، يمكن أن يؤدي الانقباض الخلوي أيضا إلى دفع عمليات المرض عند المبالغة فيه أو تعطيله. الربو وارتفاع ضغط الدم والمخاض المبكر والتندب الليفي والمثانة غير النشطة كلها أمثلة على عمليات المرض المدفوعة ميكانيكيا والتي يمكن تخفيفها من خلال التحكم السليم في قوة الانقباض الخلوية. هنا ، نقدم بروتوكولا شاملا لاستخدام تقنية جديدة لفحص الانقباض القائم على الصفائح الدقيقة تعرف باسم الأسطح القابلة للانكماش المطاطي (FLECS) ، والتي توفر تحليلا مبسطا وبديهيا لانقباض الخلية الواحدة بطريقة واسعة النطاق. هنا ، نقدم بروتوكولا تدريجيا للحصول على منحنيين من ست نقاط للجرعة والاستجابة يصفان تأثيرات اثنين من مثبطات الانقباض على تقلص خلايا العضلات الملساء الأولية للمثانة البشرية في إجراء بسيط باستخدام صفيحة دقيقة واحدة فقط من فحص FLECS ، لإظهار التقنية المناسبة لمستخدمي الطريقة. باستخدام تقنية FLECS ، يمكن لجميع الباحثين الذين لديهم مختبرات بيولوجية أساسية وأنظمة الفحص المجهري الفلوري الوصول إلى دراسة هذا النمط الظاهري الأساسي للخلية الوظيفي ولكن يصعب تحديده كميا ، مما يقلل بشكل فعال من حاجز الدخول إلى مجال بيولوجيا القوة والفحص الظاهري لقوة الخلية الانقباضية.
Introduction
القوى الميكانيكية الناتجة عن الخلايا ضرورية للوظيفة المناسبة في مختلف الأعضاء في جميع أنحاء الجسم مثل الأمعاء والمثانة والقلب وغيرها. يجب أن تولد هذه الأعضاء أنماطا مستقرة من تقلص الخلايا والاسترخاء للحفاظ على حالة الاستتباب الداخلية. يمكن أن يؤدي تقلص خلايا العضلات الملساء غير الطبيعي (SMC) إلى ظهور اضطرابات مختلفة، بما في ذلك، على سبيل المثال، خلل الحركة المعوي، الذي يتميز بأنماط غير طبيعية من تقلص العضلات الملساء المعوية1، فضلا عن الظروف البولية لفرط النشاط2 أو المثانة غير النشطة3. داخل الشعب الهوائية، يمكن أن تؤدي SMCs التي تظهر أنماط انكماش غير منتظمة إلى فرط الاستجابة الربوية4، مما قد يؤدي إلى تشديد الشعب الهوائية وتقليل تدفق الهواء من الأكسجين إلى الرئتين. وهناك حالة جسدية أخرى واسعة الانتشار، وهي ارتفاع ضغط الدم، ناجمة عن تقلبات في تقلص العضلات الملساء داخل الأوعية الدموية5. من الواضح أن آليات الانقباض داخل الخلايا والأنسجة يمكن أن تؤدي إلى أمراض تتطلب خيارات علاجية. نظرا لأن هذه الحالات تنبع بشكل لا لبس فيه من السلوكيات الانقباضية المختلة وظيفيا للخلايا ، يصبح من المنطقي والضروري قياس وظيفة انقباض الخلية نفسها ، عند فحص الأدوية المرشحة المحتملة.
إدراكا للحاجة إلى أدوات لدراسة قوة الانقباض الخلوي ، تم تطوير العديد من طرق فحص الانكماش الكمي من قبل الباحثين الأكاديميين بما في ذلك الفحص المجهري لقوة الجر (TFM) 6 ، و TFM7 المجهري ، ومقايسات الجل العائم 8 ، والمقايسات المجهرية المطاطية 9. وقد استخدمت هذه التقنيات في شكل طبق واحد وكذلك شكل متعدد الصحون في العديد من الدراسات وحتى تم اقتراحها لقياسات القوة ثلاثية الأبعاد10،11،12،13،14. في حين أن هذه التقنيات قد مكنت من إجراء أبحاث رائدة في المجال الواسع لبيولوجيا قوة الخلية ، فقد اقتصرت جميعها إلى حد كبير على المختبرات التي تمتلك قدرات وموارد محددة ، على وجه الخصوص: القدرة على تصنيع ركائز TFM ، والقدرة على تطبيق خوارزميات معقدة وغير بديهية بشكل صحيح لحل خرائط إزاحة TFM ، وأنظمة الفحص المجهري الدقيقة نسبيا التي يمكنها تسجيل الصور الملتقطة قبل وبعد إزالة العينات من المرحلة (لتفكك الخلايا). وبالتالي ، بالنسبة للباحث غير المدرب ، يمكن أن يكون حاجز الدخول لاستخدام هذه الأساليب مرتفعا جدا نظرا لمجموعة واسعة من المتطلبات لتطبيق هذه التقنيات. بالإضافة إلى ذلك، فإن دقة التصوير المطلوبة للعديد من التقنيات الحالية (أهداف 40x أو أكثر) يمكن أن تحد بشكل كبير من الإنتاجية التجريبية، في حين أن تقنيات القياس السائبة يمكن أن تخفي مساهمات الخلايا المتطرفة وتمنع اكتشاف اختلافات انقباضية أكثر اعتدالا. ومن الجدير بالذكر أنه على حد علم المؤلفين، فإن نهج فحص الجل العائم منخفض الإنتاجية وشبه الكمي هو الوحيد الذي نضج بما فيه الكفاية ليصبح متاحا للباحثين (انظر الشكل 1).

الشكل 1: المخطط العام لطريقة تقنية FLECS . (أ) يتم الالتزام بالخلايا بالأنماط الدقيقة للبروتين اللاصق التي يتم تضمينها تساهميا في طبقة مرنة رقيقة مدعومة بالزجاج. (ب) عرض علوي لمختلف أشكال الأنماط الدقيقة المحتملة وانفجار خلية تتقلص على شكل نمط مجهري على شكل حرف "X". (ج) تراكب الأنماط الدقيقة الفلورية وصور تباين الطور للخلية المتعاقدة. (د) صور زمنية لخلية متعاقدة واحدة. أشرطة المقياس = 25 ميكرومتر. تم تكييف هذا الرقم بإذن من بوشكارسكي وآخرون15. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد التطورات الحديثة في التكنولوجيا الدقيقة ، طور المؤلفون تقنية قائمة على الصفائح الدقيقة تمكن من إجراء قياسات كمية لتقلص الخلية الواحدة في مئات الآلاف من الخلايا تسمى FLECS (الأسطح القابلة للانكماش المطاطي الموسومة بالفلورسنت) 15،16،17،18،19،20 ، كبديل ل TFM. في هذا النهج ، يتم تضمين الأنماط الدقيقة للبروتين الفلورسنت في الأفلام اللينة التي تشوه وتتقلص عندما تطبق الخلايا قوى الجر عليها ، بطريقة بديهية وقابلة للقياس. الأهم من ذلك ، أن الأنماط الدقيقة للبروتين تقيد موضع الخلية وشكلها ومنطقة انتشارها ، مما يؤدي إلى ظروف اختبار موحدة. تسمح هذه القياسات البسيطة بناء على تغييرات الأبعاد الخاصة بها فقط ، والتي يتم حلها بشكل كبير مكانيا حتى في صور التكبير 4x. تتضمن هذه الطريقة وحدة تحليل صور قائمة على المتصفح وتمكن من التحليل المباشر لقوة الخلايا الانقباضية دون الحاجة إلى إجراءات معالجة دقيقة أو تسجيل علامات ائتمانية ، بحيث يجب أن تكون قابلة للتشغيل من قبل أي باحث لديه مرفق أساسي لزراعة الخلايا ومجهر فلورسنت بسيط مع تكبير منخفض (الشكل 2 ). تم تصميم هذه التكنولوجيا ، الجاهزة على الرف والمتاحة تجاريا ، مع وضع المستخدم النهائي في الاعتبار وتهدف إلى تقليل حاجز الدخول أمام أي عالم مختبر لدراسة بيولوجيا القوة الخلوية.

الشكل 2: مخطط لشكل لوحة 24 بئرا لفحص انقباض الخلية الواحدة. تم استخدام هذا التنسيق في التجارب الموضحة هنا والموضحة في جزء الفيديو من المقالة. أشرطة المقياس = 25 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
في هذا العمل ، نقدم بروتوكولا لتطبيق تنسيق لوحة البئر 24 لمنصة FLECS Technology لتحديد آثار الأدوية المعدلة بالقوة على الانقباض الخلوي في خلايا العضلات الملساء الأولية للمثانة. يمكن تكييف هذا البروتوكول للأغراض العامة وتعديله حسب الحاجة لمراعاة مختلف الجداول الزمنية الأخرى وأنواع الخلايا وظروف العلاج ذات الأهمية ، وتوسيع نطاقه للإجابة على أسئلة أخرى في بيولوجيا القوة.
Protocol
1. اليوم الأول: إعداد لوحة البئر 24
- ابدأ الإجراء بإضافة 20 مل من وسط زراعة الخلايا إلى أنبوب مخروطي سعة 50 مل. في هذه التجربة ، يتم استخدام الوسط القائم على F12 Ham مع 10٪ من مصل الأبقار الجنيني (FBS).
- احصل على لوحة بئر 24 مصممة لفحص انقباض الخلايا. اضبط الماصة على 500 ميكرولتر واحصل على مصفاة خلية لتمرير الخلايا.
ملاحظة: اللوحة متاحة من المؤلفين عند الطلب. - ارفع اللوحة وأمسكها بيد واحدة واستمر في تقشير الفيلم البلاستيكي بلطف من أعلى اللوحة. ثم اضبط اللوحة بعناية مرة أخرى.
- قم بتشغيل شفاط فراغ وقم بشفط الطبقة العليا من المياه المالحة العازلة بالفوسفات (PBS) من الآبار لمنع الانسكاب. قم بإزالة PBS صف واحد في كل مرة. بمجرد أن تصبح الآبار غير ممتلئة تماما ، أمسك اللوحة بيد واحدة وقم بإزالة بقية PBS بعناية من الآبار. املأ بسرعة 500 ميكرولتر من وسط زراعة الخلايا. احرص على تجنب الاتصال بين الشافط وأسفل البئر.
- رج الطبق بلطف واضغط على الجانب لضمان تغطية الجزء السفلي بالكامل من البئر بالمحلول. بمجرد ملء جميع الآبار بالوسط ، اضبط اللوحة على الجانب.
2. اليوم الأول: بذر الخلايا
- استرجع قارورة المزرعة باستخدام الممر 7 أو أقل من خلايا العضلات الملساء البشرية الأولية (BSM) من حاضنة 37 درجة مئوية. تحت المجهر ، تحقق من مورفولوجيا الخلايا وتأكد من نمو الخلايا إلى 90٪ على الأقل من الالتقاء ولكن أقل من 100٪ من التقاء.
- إجراء بروتوكول تفكك الخلية. داخل خزانة السلامة البيولوجية المعقمة، قم بالتربسين في الخلايا لمدة 2.5 دقيقة حتى يتم فصل الخلايا قبل إخمادها بوسط مكمل بالمصل (10٪ FBS).
- بمجرد انفصال الخلايا ، استخدم مقياس الدم لحساب الخلايا وتخفيف تعليق الخلية إلى ما يقرب من 50000 خلية / مل في وسط مكمل بالمصل. الأهم من ذلك ، تتطلب الخلايا مصل 2٪ على الأقل للالتصاق بالأنماط الدقيقة.
- قبل البذر ، قم بإجهاد تعليق الخلية بسرعة من خلال مصفاة خلية 40 أو 100 ميكرومتر في أنبوب مخروطي 50 مل مع ماصة مصلية لتفتيت كتل الخلايا إلى خلايا واحدة.
- أضف بعناية 500 ميكرولتر من تعليق الخلايا 50,000 / مل في كل بئر من الآبار ال 24 الموجودة على اللوحة باستخدام ماصة P1000 عن طريق توزيع المحلول بقطرة عبر مواقع مختلفة في الآبار.
- بعد بذر الخلايا ، دع اللوحة تجلس في درجة حرارة الغرفة لمدة 1 ساعة للسماح للخلايا بالاستقرار مباشرة على الأنماط الدقيقة دون أن تتأثر بالتيارات الدقيقة الناتجة عن التبخر. بعد 1 ساعة ، ضع اللوحة في حاضنة 37 درجة مئوية بين عشية وضحاها. سوف تتجمع الخلايا ذاتيا وتنتشر على الأنماط الدقيقة اللاصقة خلال هذا الوقت وتبدأ في ممارسة مستويات الانكماش القاعدي.
3. اليوم الثاني: إضافة دواء الاختبار
ملاحظة: لا يمكن أن يتجاوز التركيز النهائي لثنائي ميثيل سلفوكسيد (DMSO) في الآبار التي تحتوي على خلايا ملتصقة 1٪ ولا يمكن إضافة الدواء / DMSO مباشرة إلى الخلايا ولكن يجب أولا تخفيفه وخلطه في محلول وسيط من وسط الخلية.
- قم بإنشاء سلسلة تخفيف دوائية من ست خطوات وثمانية أضعاف عن طريق نقل 30 ميكرولتر من عقار المخزون إلى أحجام متتالية من 210 ميكرولتر من DMSO والخلط الدقيق بين كل خطوة نقل. في هذا العمل ، يتم تحضير سلسلة تخفيف من ست خطوات وثمانية أضعاف من blebbistatin بجرعات تتراوح من 40 ميكرومتر إلى 1 نانومتر ، في DMSO.
- لكل محلول دوائي مخزون (من الخطوة 3.1) ، امزج 30 ميكرولتر من الدواء في 470 ميكرولتر من وسط زراعة الخلايا. ينتج عن المحلول الوسيط تخفيف 16.7 ضعف DMSO.
- انقل 200 ميكرولتر من كل محلول وسيط إلى البئر المناسب على لوحة البئر 24 (التي تحتوي بالفعل على 100 ميكرولتر من الوسط في كل بئر). وهذا يؤدي إلى تخفيف إضافي بمقدار ستة أضعاف ل DMSO.
- تسفر الخطوتان 3.2 و 3.3 مجتمعتين عن تركيز نهائي بنسبة 1٪ من DMSO في الآبار.
- ضع اللوحة المعالجة في حاضنة 37 درجة مئوية للمدة المناسبة. لهذه التجربة ، يتم استخدام حضانة لمدة 30 دقيقة.
- قبل التصوير مباشرة ، أضف محلول البقع النووية الحية Hoechst 33342 إلى كل بئر (1: 10000 تخفيف نهائي). اسمح لها بالاحتضان لمدة 15 دقيقة إضافية لتسمية نوى الخلية.
4. اليوم الثاني: تصوير لوحة البئر
- الوصول إلى مجهر مجهز لتصوير القنوات لكل من نوى الخلية (DAPI) والأنماط الدقيقة (TRITC).
- قم أولا بتصوير الخلايا باستخدام DMSO فقط.
- ثم ركز على كل من الأنماط الدقيقة ونوى الخلايا المصنفة وصورها من أجل تحديد الخلايا المفردة وضمان محاذاة كلتا القناتين تماما لتمكين التحليل الآلي للصور.
- كرر في مواضع متعددة في كل بئر من الآبار ال 24 على اللوحة. يمكن التقاط الصور بهدف 4x (أو أعلى اختياريا لتسريع التصوير والحصول على أقصى نقاط بيانات لكل صورة).
- قم بتصدير الصور كملفات TIF وافتحها على جهاز كمبيوتر متصل بالويب باستخدام ImageJ لتحليل البيانات.
5. ما بعد التجربة: تحليل الصور
ملاحظة: تم إجراء تحليل الصور باستخدام بوابة Biodock.ai وبرنامج التصوير.
- قم بتحميل الصور التي تم الحصول عليها إلى جهاز كمبيوتر.
- تأكد من تسمية الأزواج المقابلة من الصور الدقيقة والنووية بشكل صحيح.
- تأكد من أن جميع أسماء الصور ذات الأنماط الدقيقة تأخذ شكل "sharedCoreName_pt.tif".
- تأكد من أن جميع أسماء صور النوى تأخذ شكل "sharedCoreName_dapi.tif".
- تحويل الصور من TIF إلى PNG باستخدام ImageJ.
- بمجرد فتح ImageJ ، قم بالتحميل في قناة واحدة في كل مرة. بالنسبة لهذه التجربة، قم أولا بتحميل صور الأنماط الدقيقة كمكدس في ImageJ.
- باستخدام Image > ضبط سطوع / تباين > ، اضبط سطوع الصورة للتأكيد على الأنماط الدقيقة وتقليل الخلفية إلى اللون الأسود. بالإضافة إلى ذلك ، قم بتنعيم الصور.
- باستخدام نوع > الصورة > 8 بت، قم بتحويل الصور إلى 8 بت.
- ثم قم بتصدير الصورة إلى نوع PNG وحدد مستوى شريحة المربع كاسم ملف. الآن قم بإنشاء مجلد جديد PNGs واحفظ ملفات PNG هناك بنفس الاسم.
- كرر هذه العملية لصور النوى.
- قم بتحميل أزواج صور PNG إلى برنامج معالجة الصور للتحليل.
- إنشاء الحساب والتحقق من صحته. يمتلك المؤلفون حسابا لتمكين الوصول المفتوح للمستخدمين الأكاديميين.
- تحقق من صحة الحساب عن طريق الاتصال بالمؤلفين.
- قم بتسجيل الدخول إلى البرنامج.
- ضمن علامة التبويب بيانات على يمين الصفحة، انقر على تحميل الدفعة.
- قم باستيراد الصور عن طريق سحب وإسقاط أزواج الصور في النافذة التي تنبثق وتسمية الدفعة. انقر فوق موافق.
- حدد المربع المجاور لاسم الدفعة وانقر على تحليل.
- في الشاشة التالية، مرر لأسفل وحدد المربع المجاور لتحليل الانقباض وانقر فوق تحديد. أسفل الصفحة، حدد 10x كتكبير تم استخدامه للتصوير من قائمة منسدلة.
- انقر على إرسال. بمجرد أن يقرأ تحليل البيانات مكتمل ، انقر فوق اسم الدفعة. في الشاشة التالية، انقر فوق تنزيل البيانات على الجانب الأيسر من الصفحة.
ملاحظة: ستحتوي الملفات التي تم تنزيلها على صور تم تحليلها، ونتائج ملخصة تبلغ عن متوسط الانكماش في كل صورة، وتحليل مفصل لكل نمط مجهري تم اكتشافه في أي صورة، مع الإبلاغ عن أحجامها ومواقعها وعدد الخلايا التي تم الالتزام بها وانكماشها. - رسم قيم الانكماش مقابل تركيزات الدواء لتوليد منحنى استجابة التركيز وتحديد القدرات النسبية للعلاجات المختلفة.
- انقر على إرسال. بمجرد أن يقرأ تحليل البيانات مكتمل ، انقر فوق اسم الدفعة. في الشاشة التالية، انقر فوق تنزيل البيانات على الجانب الأيسر من الصفحة.
النتائج
ويبين الشكل 3 مناطق الصور التي تم الحصول عليها من الآبار التي عولجت ب DMSO فقط وتلك التي عولجت ب 40 ميكرومتر من البليبيستاتين. يمكن ملاحظة بوضوح أن الخلايا المعالجة ب DMSO فقط تظهر مستوى كبيرا من الانكماش بناء على التشوهات البارزة جدا للأنماط الدقيقة التي تلتزم بها خلايا العضلات الملساء في المثانة (BSMCs) في هذا البئر. وعلى العكس من ذلك، في صورة المعالج جيدا ب 40 ميكرومتر بليبيستاتين، لوحظ استرخاء كبير للخلايا7 حيث أن الأنماط الدقيقة التي تلتزم بها BSMCs لا يمكن تمييزها تقريبا في الحجم عن الأنماط الدقيقة التي لا تلتزم بها الخلايا، مما يشير إلى الحد الأدنى من الانقباض. توضح هذه الصور التمثيل البصري البديهي والواضح لانقباض الخلية الواحدة الذي توفره طريقة النقش المجهري الفلورية. على عكس الطرق القائمة على TFM ، حيث تهدف الحركة متعددة الاتجاهات للعديد من جزيئات الفلورسنت الموزعة عشوائيا تحت طبقة أحادية الخلية الكثيفة إلى نقل قوة الانقباض النسبية ، هنا ، توفر الهندسة التعاقدية الموحدة والملحوظة للأنماط الدقيقة معلومات نوعية فورية وسهلة التفسير حول تقلص الخلايا الفردية. يمكن تحديد هذه الكمي مباشرة من خلال تطبيق عمليات الكائنات الثنائية القياسية على الصور.
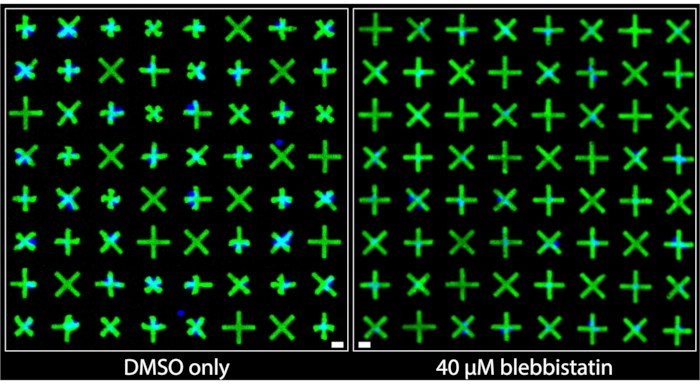
الشكل 3: مقارنات جنبا إلى جنب للصور الملتقطة للآبار التي تحتوي إما على 1٪ فقط من معالجة DMSO (يسار) أو تحتوي على 40 ميكرومتر من blebbistatin (يمين). يمكن ملاحظة بوضوح أن العلاج باستخدام blebbistatin يقلل بشكل كبير من انقباض الخلايا المفردة كما هو موضح في الأنماط الدقيقة الأكبر وغير المتعاقد عليها. تشير النوى الزرقاء إلى الأنماط الدقيقة التي ترتبط بالخلايا. شريط المقياس = 25 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
من خلال تطبيق وحدة التحليل القائمة على المتصفح لتحليل أزواج الصور المكتسبة من الأنماط الدقيقة ونوى الخلايا ، يتم الحصول على توزيعات انقباض الخلية الواحدة لكل مجموعة سكانية كما هو موضح في الشكل 4. ويعمل التحليل، الموصوف بالتفصيل في تقرير سابق عن منهجية FLECS15، من خلال تحديد مواقع واتجاهات كل نمط مجهري على شكل حرف "X"، وحساب عدد النوى الملتصقة مباشرة فوق مركز كل نمط مجهري، وحساب متوسط طول كل نمط مجهري، وحساب مسافة البكسل لتقلص كل نمط مجهري فيما يتعلق بمتوسط طول الأنماط الدقيقة الفارغة (مرجع الانكماش الصفري). لذلك ، تخدم الأنماط الدقيقة الفارغة غرضا مهما لتطبيع بيانات الانكماش. الأهم من ذلك ، أن الخلايا التي لا ترتبط بالأنماط الدقيقة سوف تتراكم على حدود البئر بسبب التيارات الدقيقة حيث لن تؤثر على تحليل الصور. كما رأينا في هذه المؤامرات ، فإن الانقباض غير المضطرب لسكان الخلايا الذين تتم معالجتهم فقط بعناصر تحكم DMSO يمتد على نطاق كبير يصل إلى 20 بكسل ، مع وجود مركز عند حوالي 10 بكسل. وفي الوقت نفسه ، تنقبض الخلايا المعالجة ب blebbistatin بشكل أقل بكثير ويتم دفع توزيعها إلى مركز يزيد قليلا عن 6 بكسل. الأهم من ذلك ، يتم تمثيل كل نمط مجهري واحد موجود في الصورة التي ترتبط بالضبط على الخلية في هذه التوزيعات. هذا يدل على قدرة الطريقة على نقل الاستجابات الخلوية التفاضلية للعلاجات الدوائية.
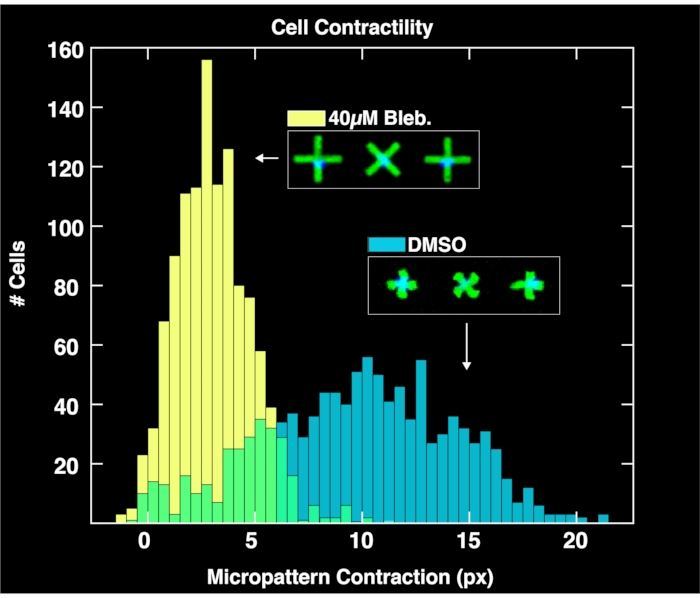
الشكل 4: رسم بياني يصور بيانات انقباض الخلية الواحدة التي تم الحصول عليها من تحليل الصور الملتقطة للآبار التي تحتوي على 1٪ DMSO فقط (أزرق) أو 40μM blebbistatin. توزيع الخلايا المعالجة ب DMSO واسع ويتمركز عند قيمة انكماش أكبر بكثير (~ 10 بكسل) من التوزيع المعالج ب blebbistatin ، مما يدل على الآثار الكمية لعلاج الخلايا مع blebbistatin. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
من خلال استخدام جميع الآبار على صفيحة واحدة من 24 بئرا وتصوير ما لا يقل عن 3 مواقع لكل بئر ، يتم إنشاء منحنيات استجابة الجرعة المكونة من ست نقاط في وقت واحد لمركبين دوائيين. ويبين الشكل 5 بيانات التركيز والاستجابة ل BSMCs المعالجة بنفس النطاق من جرعات blebbistatin أو cytochalasin D (كلاهما مثبطات انقباض معروفة). كما هو واضح من ملامح استجابة التركيز ، فإن cytochalasin D هو المثبط الأكثر فعالية للتقلص المنشط في هذه الخلايا. من خلال تركيب منحنى سيني مع نقاط البيانات ، يمكن حساب قيم IC50 لكل دواء. تشير تجاربنا إلى أن IC50 هي 7.9 ميكرومتر و 100 نانومتر للبليبيستاتين والسيتوكالاسين D ، على التوالي ، بعد حوالي 30 دقيقة من التعرض للأدوية. الأهم من ذلك ، بشكل عام ، أن هذه القيم تتوافق مع التقارير السابقة ، مما يؤكد الدقة الكمية للطريقة لتحديد فعالية مثبطات الانكماش7,21.
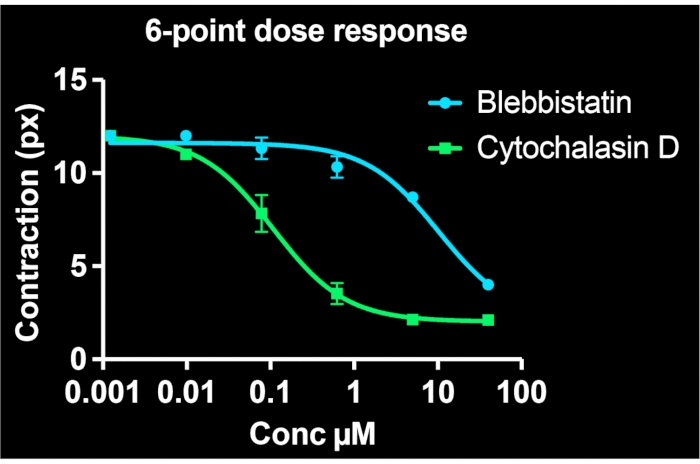
الشكل 5: منحنيات استجابة التركيز التي تصور آثار blebbistatin و cytochalasin D على الانقباض الخلوي في الخلايا المفردة. تتكون كل نقطة بيانات من ثلاث صور لهذه الحالة. كان المنحنى السيني مناسبا لكل مجموعة من البيانات. تشير النتائج إلى أن cytochalasin D أكثر قوة ، وله قيمة IC50 أقل. هذه البيانات قابلة للجمع من لوحة FLECS واحدة من 24 بئرا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
توفر هذه الطريقة المبسطة لقياس الانكماش كميا في مئات الآلاف من الخلايا في وقت واحد في ظل ظروف معالجة مختلفة واستخدام أدوات الفحص المجهري القياسية فقط بديلا يمكن الوصول إليه ل TFM التقليدي للباحثين لدراسة بيولوجيا القوة الخلوية. نظرا لأن التكنولوجيا المقدمة توفر عرضا مرئيا لتقلص الخلية من خلال تحليل التغيرات في الأنماط الدقيقة الفلورية ذات الشكل المنتظم ، فإن حجم الانكماش الذي تنتجه أي خلية معينة مفهوم بشكل حدسي - كلما كان النمط المجهري أصغر ، زادت قوة الانقباض التي تمارسها الخلية.
ومن الجدير بالذكر أنه من خلال توفير السيطرة على عوامل مثل الشكل ومنطقة الانتشار وجزيء الالتصاق الذي يضم الأنماط الدقيقة (جميع العوامل المعروفة بتنظيم انقباض الخلايا22،23،24) ، فإن التكنولوجيا المقدمة تقضي بشكل منهجي على المتغيرات الإضافية التي قد تربك تفسيرات دراسات تقلص الخلايا.
في هذه التجربة ، تم استخدام صلابة 10 كيلو باسكال في الجل وتم استخدام نمط مجهري 70 ميكرومتر (طول قطري) يتكون من الكولاجين من النوع الرابع. إلى جانب هذه المعلمات ، يمكن استبدال الجزيء اللاصق بالعديد من الكولاجين والفيبرونيكتين والجيلاتين والمصفوفة الأخرى خارج الخلية (ECM). يمكن ضبط صلابة الجل إلى 0.1 كيلو باسكال ، وحتى في نطاق MPa. يمكن تصميم هندسة micropattern de novo لتكون أي شكل مع الحد الأدنى من حجم الميزة من ~ 5 ميكرومتر. يتم فصل هذه المعلمات ويمكن تحسينها بشكل مستقل لسياق بيولوجي معين.
تم التحقق من صحة هذه التقنية على نطاق واسع لتكون متوافقة مع أنواع الخلايا شديدة اللصق والانقباض من النمط الظاهري الوسيط بما في ذلك أنواع مختلفة من خلايا العضلات الملساء (المثانة البشرية الأولية ، الأمعاء ، القصبة الهوائية ، الشعب الهوائية ، الرحم ، الأبهري ، والشرايين) ، والخلايا الجذعية الوسيطة وذريتها المتمايزة ، والخلايا الليفية المختلفة (الرئوية والجلدية والقلبية) ، والخلايا الليفية العضلية ، والخلايا البطانية. بالإضافة إلى ذلك ، ستنتج البلاعم المشتقة من الخلايا الأحادية أيضا قوة بلعمة كبيرة قابلة للقياس على الأنماط الدقيقة ، خاصة إذا كان النمط الدقيق يتكون من أوبسونين معروف. يمكن أيضا فحص خطوط السرطان المختلفة باستخدام الطريقة.
قد تشكل هذه الطريقة بعض التحديات للاستخدام مع الخلايا التي تكون إما صغيرة نسبيا مثل الخلايا التائية والعدلات ، أو أنواع الخلايا ذات النمط الظاهري الظهاري في الغالب. السبب الرئيسي لذلك هو أن الطريقة تعتمد على الالتصاق القوي والانتشار الكامل للخلايا عبر النمط المجهري من أجل توليد إشارة الانقباض القابلة للقياس. الخلايا التي ترتبط بشكل ضعيف ، أو ترتبط ببعضها البعض ، أو لا تنتشر تماما لن تنتج إشارات انقباضية قابلة للقياس. يمكن تخفيف هذه السلوكيات ، النادرة نسبيا ، عن طريق ضبط حجم النمط الدقيق ليكون أصغر ، أو باستخدام جزيئات لاصقة بديلة داخل الأنماط الدقيقة التي من شأنها تعزيز الالتصاق والانتشار بشكل أفضل في تلك الخلايا.
يجب على مستخدمي التكنولوجيا تقييم مختلف التركيبات المتوسطة المحتملة لزراعة الخلايا بعناية لنوع الخلية الخاص بهم ، حيث أن المكونات المختلفة وعوامل النمو ومستويات المصل وحساسيات الأس الهيدروجيني قد تؤدي إلى سلوكيات متغيرة في خلايا مختلفة. يجب أن يسبق تحسين البروتوكول توسيع نطاق أي سير عمل تجريبي ، ويجب أن تكون مكونات الوسائط دائما جديدة ومعقمة ومتسقة مع الدفعات السابقة.
في نهاية المطاف، إذا لم تكن دقة الخلية الواحدة ضرورية لأهداف المستخدم، أو إذا كان نوع الخلية المستهدفة لديه الحد الأدنى من القدرة على الانتشار، فقد تكون TFM التقليدية مناسبة بنفس القدر أو أكثر لمثل هذه التجارب. هدف المؤلفين وأملهم هو أن توفر هذه الأداة وسيلة إضافية لعلماء الأحياء الخلوية لدراسة الانكماش الخلوي ، لا سيما في سياق شاشات الأدوية الظاهرية الآلية عالية الإنتاجية.
خاصة بالاستخدامات المستقبلية في شاشات الأدوية ، يمكن استخدام لوحات إنتاجية أعلى مثل لوحة FLECS ذات 384 بئرا. في مثل هذه الصفائح ، يمكن لأهداف 4x على العديد من المجاهر التقاط بئر واحد كامل في مجال رؤيتها ، مما يضمن التقاط جميع الاستجابات الانقباضية الخلوية. باستخدام نظام تصوير عالي الإنتاجية ، يمكن تصوير لوحة كاملة من 384 بئرا في حوالي 5 دقائق ، مما يجعل هذا النظام أسرع بشكل كبير من الخيارات الأخرى ، وبالتالي ، مناسب لاكتشاف الأدوية ذات النمط الظاهري عالي الإنتاجية. في الواقع ، يقوم المؤلفون بشكل روتيني بتشغيل شاشات الأدوية الأسبوعية على حوالي 50 384 بئرا (يبلغ مجموعها أكثر من 19000 بئر) باستخدام الأتمتة.
Disclosures
I.P. هو مخترع في عائلة براءات اختراع صادرة تحمي أساليب وأنظمة تكنولوجيا FLECS. I.P., Y.W., J.Z., E.C., and R.H. جميعهم موظفون في Forcyte Biotechnologies, Inc. R.D. هو أستاذ في جامعة كاليفورنيا في لوس أنجلوس وأحد مؤسسي Forcyte Biotechnologies, Inc. I.P., Y.W., J.Z., و R.D. لديهم مصالح مالية في Forcyte Biotechnologies, Inc., وهو المرخص له الحصري لبراءات الاختراع المذكورة أعلاه ويقوم بتسويق FLECS Technology.
Acknowledgements
تم إجراء العمل المختبري بدعم من مورد الفحص الجزيئي المشترك بجامعة كاليفورنيا في لوس أنجلوس (MSSR) حيث ترعى Forcyte الأنشطة البحثية ، وحاضنة Magnify في معهد California NanoSystems Institute (CNSI) ، حيث Forcyte Biotechnologies، Inc. هي شركة مقيمة. سيمنح المؤلفون إمكانية الوصول إلى وحدة تحليل FLECS Biodock.ai لجميع الباحثين الأكاديميين عند الطلب. ساهم L.H. و I.P. بالتساوي في هذا العمل.
Materials
| Name | Company | Catalog Number | Comments |
| Bladder smooth muscle cell culture | Sciencell | #4310 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Cell culture media | Thermofisher | 11765054 | Ham's F12 medium supplemented with 10% FBS and 1% p/s |
| Cell strainer | Fisher Scientific | 7201432 | |
| Conical Tube | Fisher Scientific | 05-539-13 | |
| Culture flask | Fisher Scientific | FB012941 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| DMSO (Dimethyl sulfoxide) | Fisher Scientific | D1284 | |
| Eppendorf tubes | Fisher Scientific | 05-402-31 | |
| Fluorescent microscope | Molecular Devices | ImageXpress Confocal | |
| Forcyte-manufactured 24-well plate | Forcyte Biotechnologies | 24-HC4R-X1-QB12 | |
| Hoescht 3342 Live Nuclear Stain | Thermofisher | 62249 | |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP39920 |
References
- Ohama, T., Hori, M., Ozaki, H. Mechanism of abnormal intestinal motility in inflammatory bowel disease: How smooth muscle contraction is reduced. Journal of Smooth Muscle Research. 43 (2), 43-54 (2007).
- Peyronnet, B., et al. A comprehensive review of overactive bladder pathophysiology: On the way to tailored treatment. European Urology. 75 (6), 988-1000 (2019).
- Aldamanhori, R., Osman, N. I., Chapple, C. R. Underactive bladder: Pathophysiology and clinical significance. Asian Journal of Urology. 5 (1), 17-21 (2018).
- Sanderson, M. J., Delmotte, P., Bai, Y., Perez-Zogbhi, J. F. Regulation of airway smooth muscle cell contractility by Ca2+ signaling and sensitivity. Proceedings of the American Thoracic Society. 5 (1), 23-31 (2008).
- Brozovich, F. V., et al. Mechanisms of vascular smooth muscle contraction and the basis for pharmacologic treatment of smooth muscle disorders. Pharmacological Reviews. 68 (2), 476-532 (2016).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophysical Journal. 80 (4), 1744-1757 (2001).
- Tseng, Q., et al. A new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab on a Chip. 11 (13), 2231-2240 (2011).
- Bell, E., Ivarsson, B., Merrill, C. Production of a tissue-like structure by contraction of collagen lattices by human fibroblasts of different proliferative potential in vitro. Proceedings of the National Academy of Sciences. 76 (3), 1274-1278 (1979).
- Tan, J. L., et al. Cells lying on a bed of microneedles: an approach to isolate mechanical force. Proceedings of the National Academy of Sciences. 100 (4), 1484-1489 (2003).
- Rokhzan, R., et al. high-throughput measurements of cell contraction and endothelial barrier function. Laboratory Investigation. 99 (1), 138-145 (2019).
- Park, C. Y., et al. High-throughput screening for modulators of cellular contractile force. Integrative Biology. 7 (10), 1318-1324 (2015).
- Kaylan, K. B., Kourouklis, A. P., Underhill, G. H. A high-throughput cell microarray platform for correlative analysis of cell differentiation and traction forces. Journal of Visualized Experiments. (121), e55362 (2017).
- Huang, Y., et al. Traction force microscopy with optimized regularization and automated Bayesian parameter selection for comparing cells. Scientific Reports. 9, 539 (2019).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLOS ONE. 6, 17833 (2011).
- Pushkarsky, I., et al. Elastomeric sensor surfaces for high-throughput single-cell force cytometry. Nature Biomedical Engineering. 2 (2), 124-137 (2018).
- Pushkarsky, I. FLECS technology for high-throughput single-cell force biology and screening. ASSAY and Drug Development Technologies. 16 (1), 7-11 (2017).
- Koziol-White, C. J., et al. Inhibition of PI3K promotes dilation of human small airways in a rho kinase-dependent manner. British Journal of Pharmacology. 173 (18), 2726-2738 (2016).
- Orfanos, S., et al. Obesity increases airway smooth muscle responses to contractile agonists. American Journal of Physiology-Lung Cellular and Molecular Physiology. 315 (5), 673-681 (2018).
- Tseng, P., Pushkarsky, I., Carlo, D. D. Metallization and biopatterning on ultra-flexible substrates via dextran sacrificial layers. PLOS ONE. 9, 106091 (2014).
- Yoo, E. J., et al. Gα12 facilitates shortening in human airway smooth muscle by modulating phosphoinositide 3-kinase-mediated activation in a RhoA-dependent manner. British Journal of Pharmacology. 174 (4), 4383-4395 (2017).
- MacGlashan, D., Vilariño, N. Polymerization of actin does not regulate desensitization in human basophils. Journal of Leukocyte Biology. 85 (4), 627-637 (2009).
- Hocking, D. C., Sottile, J., Langenbach, K. J. Stimulation of integrin-mediated cell contractility by fibronectin polymerization. Journal of Biological Chemistry. 275 (14), 10673-10682 (2000).
- Tolić-Nørrelykke, I. M., Wang, N. Traction in smooth muscle cells varies with cell spreading. Journal of Biomechanics. 38 (7), 1405-1412 (2005).
- Ye, G. J. C., et al. The contractile strength of vascular smooth muscle myocytes is shape dependent. Integrative Biology. 6 (2), 152-163 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved