Method Article
استخدام الفحص المجهري 2-فوتون لتحديد آثار انسداد الحالب المزمن من جانب واحد على العمليات الكبيبية
In This Article
Summary
هنا ، نقدم بروتوكولا باستخدام الفحص المجهري 2-فوتون في فئران ميونيخ ويستار فروتر مع الكبيبات السطحية لتحديد آثار انسداد الحالب لفترات طويلة على ديناميكيات الكبيبات ووظيفتها.
Abstract
لا يزال تطبيق طرق الفحص المجهري الجديدة على نماذج الأمراض الحيوانية المناسبة لاستكشاف علم وظائف الأعضاء الديناميكي للكلية يمثل تحديا. توفر الفئران ذات الكبيبات السطحية فرصة فريدة للتحقيق في العمليات الفسيولوجية والفيزيولوجية المرضية باستخدام الفحص المجهري 2-الفوتون داخل الجسم. القياس الكمي لتدفق الدم الشعري الكبيبي وتضيق الأوعية والتوسيع استجابة للأدوية والنفاذية والالتهاب ليست سوى بعض العمليات التي يمكن دراستها. بالإضافة إلى ذلك ، توفر الفئران المحورة وراثيا ، أي الخلايا المحورة وراثيا الموسومة بأصباغ الفلورسنت وغيرها من مناهج العلامات الحيوية الجزيئية ، دقة متزايدة لمراقبة تفاعلات البروتين والبروتين وقياسها بشكل مباشر وتأثيرات التغيرات الجزيئية المحددة.
في الفئران ، التي تفتقر إلى الكبيبات السطحية بعد أربعة أسابيع من العمر ، تم استخدام انسداد الحالب من جانب واحد (UUO) لعدة أسابيع للحث على الكبيبات السطحية. نظرا لأن نموذج الحث هذا لا يسمح بإجراء دراسات أساسية ، فقد قمنا بقياس تأثيرات UUO على العمليات الكبيبية في نموذج UUO في فئران Munich Wistar Frömter (MWF) ، والتي تحتوي على كبيبات سطحية في ظل الظروف الفسيولوجية. أحدث نموذج UUO لمدة خمسة أسابيع أو أكثر تغييرات كبيرة في مورفولوجيا الكلى الإجمالية ، والأوعية الدموية الدقيقة المحيطة بالأنبوبي والكبيبي ، بالإضافة إلى بنية ووظيفة الظهارة الأنبوبية. انخفض تدفق خلايا الدم الحمراء الكبيبية والمحيطة بالأنبوب (RBC) بشكل ملحوظ (p < 0.01) ، ربما بسبب الزيادة الكبيرة في التصاق خلايا الدم البيضاء (WBCs) داخل الشعيرات الدموية الكبيبية والمحيطة بالأنابيب. ارتفع معامل الغربلة الكبيبي للألبومين من 0.015 ± 0.002 في MWFs غير المعالجة إلى 0.045 ± 0.05 في فئران UUO MWF البالغة من العمر 5 أسابيع. أدى اثنا عشر أسبوعا من UUO إلى مزيد من الزيادات في الكثافة الكبيبية السطحية ومعامل الغربلة الكبيبية (GSC) للألبومين. لم يتم إعادة امتصاص الألبومين الفلوري المصفى عبر الكبيبات بواسطة الأنابيب القريبة. تشير هذه البيانات إلى أن استخدام UUO للحث على الكبيبات السطحية يحد من القدرة على دراسة وتفسير العمليات الكبيبية الطبيعية وتغيرات المرض.
Introduction
كان فهم العمليات الكبيبية ، وخاصة بيولوجيا الخلايا الخيطية ، هدفا لأكثر من 50 عاما. لعبت فئران ميونيخ ويستار ذات الكبيبات السطحية دورا مركزيا في هذه الدراسات ، بما في ذلك دراسات البزل الدقيق ، لفهم العديد من جوانب العمليات الفسيولوجية والمرضية1،2،3. كان استخدام الفحص المجهري لدراسة المكونات الكبيبية داخل الجسم محدودا بسبب تأثيرات السمية الضوئية حتى ظهور الفحص المجهري ثنائي الفوتون الذي قلل من هذا التعرض السام وزاد من عمق الاختراق 1,2. جنبا إلى جنب مع التقدم السريع في أجهزة الكمبيوتر والبرمجيات ، وقد سمح هذا لدراسات ثلاثية الأبعاد (3D) وأربعة الأبعاد (الوقت) لساعات في إعداد واحد1،4،5.
إن القياس الكمي لتدفق الدم الشعري الكبيبي ، وتضيق الأوعية والتوسع استجابة للأدوية ، والنفاذية ، وتأثيرات الشحنة على النفاذية والالتهاب ليست سوى بعض العمليات الكبيبية التي تمت دراستها. بالإضافة إلى ذلك ، يمكن تحديد الجزء S1 من النبيب القريب ، ويمكن تحديد الاختلافات في سلوك الظهارة الأنبوبية S1 و S2 1,4. أدت الدراسات التي أجريت على الفئران ، خاصة مع التوافر العالمي للمرافق المعدلة وراثيا للفئران ، إلى تقدم سريع في فهم البيولوجيا الجزيئية لعمليات أمراض الكبيبات. البروتينات الفردية هي المسؤولة عن الخلل الكبيبي في دراسات خروج المغلوب ، وخاصة فيما يتعلق ببروتينية6،7،8. ومع ذلك ، فإن استخدام نماذج الفئران لدراسات التصوير الكبيبي كان محدودا لأن الكبيبات أكثر من 100 ميكرومتر تحت السطح في السلالات العديدة التي تمت دراستها9.
وقد أدى ذلك إلى قيام الباحثين بتطوير واستخدام نماذج الفئران مما أدى إلى كبيبات سطحية يمكن دراستها. النموذج الأكثر شيوعا هو استخدام UUOالكامل 10،11،12. في نهاية فترة UUO الممتدة ، هناك العديد من الكبيبات السطحية في كلى الفئران التي يمكن دراستها وقد تمت دراستها13,14. لم تكن هناك دراسة أساسية أو مراقبة في دراسات الفئران هذه لتحديد آثار UUO المطولة على بيولوجيا الكبيبات. نظرا لأن هذا نموذج شديد وطويل الأمد للإصابة مما يؤدي إلى التليف السريع والتدمير القشري10،11،12 ، فقد افترضنا أنه ستكون هناك تأثيرات على العمليات الكبيبية ووظيفتها. للإجابة على هذا السؤال ، تم استخدام فئران ميونيخ Wistar Fromter (MWF) مع الكبيبات السطحية لدراسة معلمات التحكم / خط الأساس ، وتمت مقارنة النتيجة الأساسية مع الدراسات الكبيبية في الفئران MWF بعد خمسة أسابيع من UUO. درسنا أيضا فئران Sprague Dawley (SD) التي لا تحتوي على كبيبات سطحية بعد UUO. تشير النتائج إلى أن 5 أسابيع من UUO في الفئران MWF و SD تزيد بالفعل من عدد الكبيبات السطحية. ومع ذلك ، كانت هذه الكبيبات غير طبيعية مع تغيرات ملحوظة في تدفق الدم الكبيبي ، والالتهاب ، ونفاذية الجزيئات الكبيرة وحجمها.
Protocol
اتبعت جميع التجارب دليل رعاية واستخدام المختبر وتمت الموافقة عليها من قبل لجنة رعاية واستخدام الحيوان في كلية الطب بجامعة إنديانا.
1. إعداد ميونيخ Wistar Frömter أو SD الفئران لجراحة UUO
- تخدير الفئران باستخدام إيزوفلوران (تحريض 5٪ ، صيانة 1.5-2.5٪) ، ثم حلق وغسل وتطهير المنطقة الجراحية عدة مرات بحركة دائرية باستخدام كل من المقشر القائم على اليود أو الكلورهيكسيدين والكحول. تطبيق مسكن طويل المفعول / بطيء الإطلاق لإدارة الألم وفقا لإرشادات IACUC المؤسسية.
- جعل شق على طول خط الوسط باستخدام مشرط. حدد موقع الكلية اليسرى وحررها من الأعضاء البريتونية المحيطة.
- حدد موقع عنيق الكلى بعناية ، والذي يتكون من الشريان الكلوي والوريد الكلوي والحالب. افصل الحالب عن الهياكل الأخرى ، مع اتخاذ الاحتياطات اللازمة لعدم إتلاف الهيكل الدقيق.
- باستخدام ملقط ناعم ، قم بلف خياطة 3-0 بعناية حول الحالب واربطه ، مع الحرص على عدم تمزيقه. كرر هذا الإجراء بضعة ملليمترات على جانبي العقدة الأولى لربط عقدة ثانية وضمان انسداد كامل.
- بمجرد اكتمال الإجراء ، أغلق طبقات العضلات المتتالية بعناية. قبل إغلاق الطبقة النهائية ، أضف 2 مل من محلول ملحي دافئ ومعقم بنسبة 0.9٪ إلى البطن قبل إغلاقه تماما. أغلق الجلد الخارجي بدبابيس جراحية.
- تطبيق مسكن طويل المفعول / بطيء الإطلاق لإدارة الألم ومراقبة الشفاء عن كثب وفقا لإرشادات IACUC المؤسسية. يجب المراقبة بشكل دوري بعد ذلك والاستعداد للتصوير في نهاية الأسبوع الخامس.
2. توليف ألبومين مصل الفئران الأحمر في تكساس (TR-RSA)
- قم بوزن 100 مجم من ألبومين مصل الفئران وقم بإذابته في 6.67 مل من محلول بيكربونات الصوديوم 0.1 M عند درجة حموضة 8.4 في أنبوب مخروطي سعة 50 مل.
- إلى قارورة من 5 ملغ من استر تكساس Red-X-succinimidyl ، أضف 100 ميكرولتر من ثنائي ميثيل فورماميد (DMF ، جودة عالية) ودوامة حتى تذوب كل الصبغة.
- ضع محلول ألبومين مصل الفئران على دوامة في إعداد منخفض / متوسط ، بحيث يدور حجم المحلول أسفل الجزء العلوي من الأنبوب المفتوح.
- أضف الصبغة المذابة أثناء دوامة الأنبوب.
- خذ الأنبوب المخروطي سعة 50 مل ، ولفه بورق ، وضع الأنبوب على أي هزاز أو بكرة ، وقم بتحريكه ببطء لمدة 1 ساعة في درجة حرارة الغرفة (RT).
- في دلو سعة 5 لتر من 0.9٪ كلوريد الصوديوم مع قضيب تقليب تحت التحريك اللطيف ، بلل أغشية جهاز غسيل الكلى المناسب للوزن الجزيئي 50 كيلو دالتون (الغشاء الذي يحتوي على مشابك أو أنابيب غشاء مغلقة أو أشرطة غسيل الكلى كلها مناسبة).
- قم بتحميل محلول TR-RSA في نظام الغشاء وقم بإرفاقه بملحقات التعويم المضمنة عادة مع النظام. ضع الحاوية سعة 5 لتر مع محلول ملحي 0.9٪ / TR-RSA طوال الليل عند 4 درجات مئوية (في غرفة باردة) مع تقليب لطيف على طبق تقليب. قم بتغيير محلول غسيل الكلى ثلاث مرات على الأقل خلال ال 36 ساعة القادمة.
- سيؤدي تورم الغشاء إلى زيادة حجم محلول TR-RSA الواضح الآن. قسم 100 ملغ الأصلية على الحجم للحصول على تركيز تقريبي: نسبة الصبغة: البروتين ستكون 1: 1. القسمة إلى أحجام مناسبة والتجفيد للتخزين طويل الأجل.
3. التحضير للتصوير داخل 2 فوتون على المجهر المقلوب
- قم بإزالة غطاء الطبق السفلي 50 مم (بقطر انزلاق الغطاء 40 مم) وضع 8 قطع من شريط الأوتوكلاف على الجزء السفلي الداخلي بجانب الحافة. اصنع نافذة فارغة على شكل هرم ، باستخدام 4 قطع لكل جانب للسماح للكلية الخارجية بالتناسب بشكل مريح في هذه المساحة مع الحفاظ على الاتصال المحيطي بشريط الأوتوكلاف ، مما يساعد على تقليل الحركة. اضبط التباعد وفقا لحجم الجرذ لضمان أفضل اتصال بالكلى.
- ضع 1 وسادة حرارية على كل جانب من الطبق السفلي 50 مم. تأكد من أن وسادة التسخين تغطي المسرح.
- استخدم هدف الغمر في الماء 40x عند تكبير / تصغير 0.75x وتكبير 1.5x لإنشاء صور 30x و 60x ، على التوالي ، مما يسمح بصور تكبير أقل وأعلى. إذا لزم الأمر ، أضف الماء إلى الهدف باستخدام حقنة سعة 1 مل مع قطعة طويلة من أنابيب PE-200 التي يمكن أن تصل إلى قمة الهدف بزاوية هبوطية لمنع فتل قطرة الماء أسفل الأنبوب.
- استخدم نفاذية الليزر بنسبة 2٪ ، مع ضبط أجهزة الكشف الزرقاء والخضراء والحمراء على مستويات محددة مسبقا لضمان الاتساق في الصور بين الدراسات. اضبط الطول الموجي للإثارة على 800 نانومتر على الليزر المشار إليه (انظر جدول المواد) ، والذي سيثير بكفاءة جميع الفلوروفورات المستخدمة في هذه الدراسة.
- استخدم كاشفات خارجية (غير ممسوحة ضوئيا) لجمع الانبعاثات الزرقاء باستخدام أنبوب مضاعف ضوئي (PMT) (420-490 نانومتر ، كسب 950).
- استخدم كاشف Hyd لالتقاط الانبعاثات الخضراء (500-550 نانومتر ، كسب 100).
- استخدم كاشف Hyd لالتقاط الانبعاثات الحمراء (590-660 نانومتر ، كسب 200).
- اضبط الإزاحة في PMT (الانبعاثات الزرقاء) بحيث يكون لبضع بكسلات فقط في المناطق الفارغة من الأنسجة قيمة صفر.
ملاحظة: كاشفات HyD للانبعاثات الخضراء والحمراء لها ضبط إزاحة تلقائي ؛ يمكن تعيين المكسب فقط. - اضبط عمق البت على 12 بت لإعطاء الصور مقياس كثافة 4096 بين الأسود والأبيض.
ملاحظة: من الضروري تعيين الحدود الدنيا لأجهزة الكشف (الإزاحة في PMT) لعدم استبعاد هذه القيم لضمان جمع الانبعاثات منخفضة الكثافة داخل مساحة بومان. إذا كان إعداد الحساسية منخفضا جدا ، فستشير علامات التحذير المرئية إلى ذلك ؛ تعطى هذه القيم قيمة شدة تساوي صفرا.
- قم بتخفيف ما يقرب من 6 ملغ من ألبومين مصل تكساس-الأحمر-X-Rat إلى حجم إجمالي قدره 1 مل ، وقم بتحميل المحلول في حقنة سعة 1 مل ، وضعه على القسطرة الوريدية الساكنة في الخطوة 4.1 بعد ضخ Hoechst 33342 في الخطوة 9.1.
4. التحضير الجراحي للتصوير داخل الجسم 2-الفوتون
- ضع الجرذ الذي تم تخديره مسبقا مع خط وصول وريدي ساكن (الفخذ أو الوداجي) على جانبه بحيث يكون الجناح الأيسر المحلوق متجها لأعلى بشكل مسطح ومستقيم على الطاولة. تأكد من أن الكفوف الأمامية تلمس بعضها البعض ، وكذلك الكفوف الخلفية.
- اشعر برفق بالجانب الأيسر أسفل الأضلاع مباشرة لتحسس الكلى لتحديد الوضع الطبيعي في البطن. إذا لزم الأمر ، ارسم خطا باستخدام علامة دائمة على طول المنطقة المحلوقة ، مع تقسيم مركز الكلى في اتجاه من الأنف إلى الذيل.
- باستخدام زوج من الملقط المسنن ، أمسك الجلد وارفعه لأعلى لتسهيل قرص خط العلامة الدائم بزوج من المرقئ لسحق الأوعية الدموية الأساسية ومنع النزيف عند إجراء شق بمقص جراحي. كرر هذا لطبقة العضلات الخارجية الرقيقة لتقليل النزيف.
- لعمل الشق النهائي لطبقة عضلات البطن الداخلية الرقيقة ، أعد جس الكلى لتقدير الحجم والموقف. ارفع طبقة العضلات الداخلية بعناية باستخدام ملقط وسحق خطا يقسم الجلد فوق الكلى باستخدام مرقئ يبلغ حوالي 1/3ثلث الحجم المقدر للكلية.
- الحفاظ على قبضة على طبقة العضلات مع ملقط ، وجعل شق النهائي.
ملاحظة: من الأفضل إجراء شق أصغر وتوسيعها حسب الحاجة بدلا من جعلها كبيرة جدا ، الأمر الذي يتطلب إغلاقا جزئيا بخياطة. - أمسك الكلى برفق بالدهون المحيطة. باستخدام كلتا اليدين مع ملقط في كل يد ، اعمل على الإمساك بالدهون في القطب السفلي للكلية باستخدام تقنية اليد فوق اليد للإمساك بدهون الكلى والاحتفاظ بها ، والعمل لأسفل.
- وجود قبضة قوية على الدهون في القطب السفلي من الكلى بيد واحدة ، وسحب الدهون برفق ، وإذا لزم الأمر ، اضغط بلطف شديد على الكلى من خلال شق. إذا لم تمر الكلى بسهولة ، فقم بتوسيع الشق.
5. وضع الجرذ للتصوير
- ضع الكلى المكشوفة بعناية على حافة الطبق ، مع دوران طفيف بحيث يلامس الجانب البطني من الكلية الغطاء والجانب الظهري متجها بعيدا عن الحافة.
- لتقليل الحركة بشكل أكبر ، خذ وسادتين معقمتين من الشاش 2 × 2 ، رطبهما بالمحلول الملحي ، وقم بتعبئتهما على الجانب الظهري من الكلى ، مما يعزز ملامسة الجانب البطني من الكلى إلى الحافة.
- انظر من خلال عدسة المجهر تحت إضاءة التألق باستخدام مكعب Rhodamine / FITC مزدوج التمرير. إذا تم الكشف عن حركة ، فقم بإجراء تعديلات طفيفة على الموضع واضبط الشاش بعناية ، وتأكد من أنه لا يدفع تحت الكلى. لتقليل الحركة بشكل أكبر ، قم بلف الجرذ قليلا ، بحيث يكون الصدر بعيدا عن الطبق.
6. الحصول على الصور للتحليل الكمي
- مسح سطح الكلى باستخدام إضاءة epifluorescence (الخطوة 5.3) ووضع علامة على موضع (مواقع) الكبيبات باستخدام البرنامج المرتبط بوحدة التحكم في المسرح الآلية (إحدى ميزات الأنظمة الحديثة).
- لكل قناة ملونة تحت إضاءة 2-فوتون ، خذ حجم 3D ضحل للجزء العلوي من كل كبيبة مميزة ، والتي ستكون بمثابة صور الخلفية. استخدم لوحة ألوان زائفة في خيار العرض لبرنامج التصوير لتصور أفضل للشدة الخافتة لمضان الخلفية للحلقات الشعرية الكبيبية.
- باستخدام وعاء دموي سطحي كنقطة محورية ، قم بضخ الألبومين الفلوري ببطء ، مما يتيح الوقت لمراقبة صعود وهبوط التألق بسبب التوزيع الجهازي. قم بضخ ما يكفي من TR-RSA لتحقيق كثافة في الأوعية الدموية المحيطة بالحلقات الشعرية التي تقل قليلا عن التشبع.
ملاحظة: عادة ما يكون هناك تأخير لمدة 5 ثوان بين ضخ المادة وظهورها في مجرى الدم عندما يكون التروية الكلوية طبيعية. - انتظر حوالي 10 دقائق قبل الحصول على وحدات تخزين ثلاثية الأبعاد (فواصل زمنية 1 ميكرومتر) لجميع الكبيبات المميزة والمصورة من الخطوة 6.2.
ملاحظة: تحتوي فئران سيمونسن في ميونيخ ويستار على عدد أقل من الكبيبات السطحية. ومع ذلك ، نظرا لأن سلالة Frömter من فئران MW تحتوي على عدد أكبر من الكبيبات السطحية ، يمكن في كثير من الأحيان تصوير ما يصل إلى 10 كبيبات. - القتل الرحيم للفأر عن طريق جرعة زائدة من الأيزوفلوران في نهاية الدراسة. إجراء استرواح الصدر المزدوج لضمان القتل الرحيم.
7. حساب نفاذية الكبيبة
- باستخدام برنامج عرض الصور المرتبط بنظام المجهر ، قم بتصدير الصور إلى صور أولية 12 بت للمعالجة والتحليل.
- قم بتحميل وحدات التخزين ثلاثية الأبعاد الخلفية ووحدة التخزين ثلاثية الأبعاد الخام التي تحتوي على الألبومين الفلوري المتداول. حدد موقع المستوى البؤري في حجم 3D مع ألمع حلقة شعرية سطحية في الكبيبات مع مساحة كافية لحافة كبسولة بومان المحيطة.
- باستخدام المعالم المرئية ، حدد موقع نفس المستوى البؤري الموجود في وحدة تخزين الخلفية. حدد منطقة في الملف الشعري وأخرى داخل فضاء بومان مع ملاحظة متوسط قيم الشدة لكل منها. استخدم قيم الكثافة هذه كقيم خلفية.
- حدد منطقة (على الأقل 20 × 20 بكسل في المساحة) داخل مساحة بومان في الصورة التي تحتوي على الألبومين ولاحظ قراءة الكثافة (حدد منطقة غير مجاورة لحلقة شعرية أو كبسولة بومان لضمان أنظف قياس لكثافة مساحة بومان). حرك المنطقة المرسومة فوق منطقتين أخريين لأخذ قيمة متوسطة لمتوسط الكثافة داخل مساحة بومان.
- حدد ألمع كثافة فلورسنت البلازما داخل قسم الحلقة الشعرية وقم بوضع دائرة حول هذه المنطقة. باستخدام وظيفة العتبة ، قم بتمييز القيم الساطعة (الموجودة عادة عند حواف جدران الحلقة الشعرية) ، وتجنب تدوير ظلال كرات الدم الحمراء ، وسجل القيمة.
ملاحظة: نظرا لأن العوامل داخل الدم ستؤدي إلى التقليل من مستويات مضان البلازما ، فمن المهم اختيار المناطق الأكثر سطوعا. - أدخل القيم في جدول بيانات لحساب GSC باستخدام مكافئ (1):
GSC = (1)
(1)
8. حساب تدفق خلايا الدم الحمراء في الحلقات الشعرية الكبيبية السطحية والأوعية الدموية الكلوية باستخدام وظيفة مسح الخطوط
- ابحث عن وعاء مناسب (إما حلقة شعرية أو وعاء محيطي). نظرا لأن وظيفة مسح الخطوط في برنامج الحصول على الصور المشار إليه (انظر جدول المواد) تتطلب أن يكون الوعاء عموديا ، قم بتدوير الصورة باستخدام وظيفة التدوير .
- بمجرد تدوير السفينة والاستلقاء بشكل مسطح ، حدد وظيفة XT في قائمة الاستحواذ . قم بالإعداد لمسح 4000 سطر ضوئيا. ضع الخط عبر السفينة المراد فحصها ؛ تأكد من أن المستوى البؤري عند الحد الأقصى لقطر المقطع المراد تصويره.
- انقر بزر الماوس الأيسر على الصورة المركبة الملونة وحدد Take Snapshot لإنشاء صورة مرجعية للمنطقة التي تم التقاط linecan فيها. انقر على الفور فوق الزر " ابدأ " لالتقاط مسح خطوط السفينة.
- لتحديد معدل تدفق كرات الدم الحمراء، قم باستيراد الخطوط إلى برنامج معالجة الصور (انظر جدول المواد). افتح مربع الحوار إظهار إحصائيات المنطقة ضمن القائمة المنسدلة قياس . حدد أداة رسم خط واحد وارسم خطا يطابق ميل ظلال RBC. لاحظ قيم العرض والارتفاع.
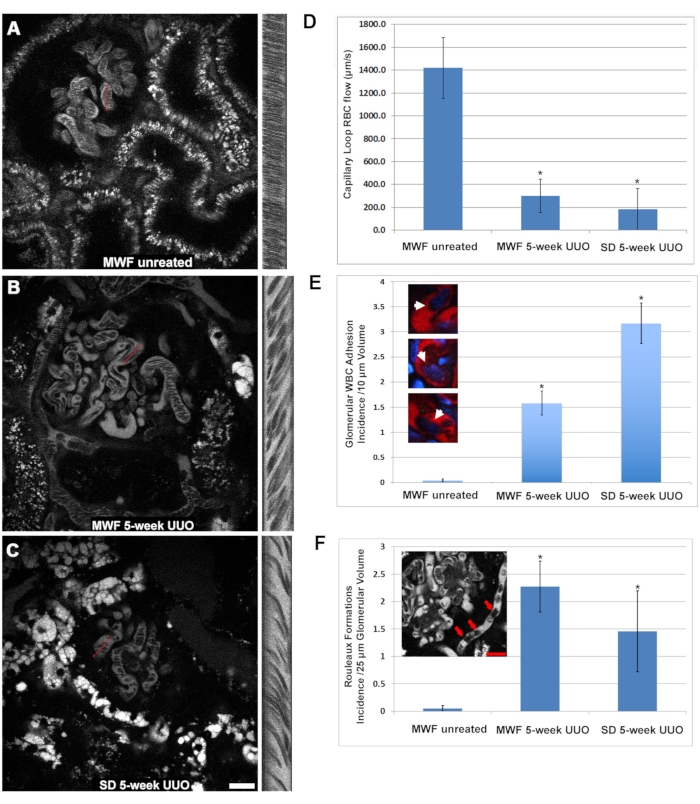
ملاحظة: تتوافق قيم البكسل التي تم الحصول عليها للعرض مع المسافة; تتوافق وحدات البكسل للارتفاع مع الوقت. - استخدم الصيغة التالية (مكافئ (2)) لحساب السرعة.
معدل تدفق كرات الدم الحمراء بالميكرومتر / ثانية =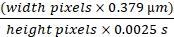 (2)
(2)
ملاحظة: يتوافق هذا مع معلمات الاكتساب عند تكبير 60x ومعدل مسح ضوئي 400 هرتز باستخدام المجهر المشار إليه (انظر جدول المواد).- قم بإجراء خمس عمليات حسابية على الأقل ومتوسطها للإبلاغ عن السرعة لكل خط.
ملاحظة: ستعتمد هذه المعلمات على بعد البكسل وسرعة اكتساب نظام المجهر.
- قم بإجراء خمس عمليات حسابية على الأقل ومتوسطها للإبلاغ عن السرعة لكل خط.
9. حساب انسداد كرات الدم البيضاء في الحلقات الشعرية الكبيبية
- قم بإعطاء صبغة Hoechst 33342 النووية (عند ~ 8 ميكروغرام / كجم من وزن الفئران) عبر خط وصول وريدي ساكن لتحديد كرات الدم البيضاء الموجودة في الحلقات الشعرية.
ملاحظة: سيكون العمق القابل للاستخدام محدودا بسبب تشتت الفوتون وامتصاصه بواسطة الهيموجلوبين ، خاصة بالنسبة للانبعاثات الزرقاء ذات الطول الموجي الأقصر. - توسيط الكبيبة في مجال التصوير وأخذ مجموعة بيانات ثلاثية الأبعاد تبدأ من السطح الكبيبي وتنتهي البيانات على الأقل 30 إلى 35 ميكرومتر. استخدم حجم خطوة 1 ميكرومتر في الاتجاه Z.
- تحديد كرات الدم البيضاء من خلال مقارنة قناة Hoechst الزرقاء بقناة الألبومين الأحمر في تكساس ؛ ابحث عن استبعاد الصبغة الحمراء في الحلقة الشعرية والبقعة النووية المقابلة لتحديد كرات الدم البيضاء بشكل إيجابي. حدد خلايا الدم البيضاء على أنها "ملتصقة" إذا بدت ثابتة على 3 أقسام بصرية. أبلغ عن القيم كحدوث / 10 مقاطع بصرية من أعلى الكبيبة ، مأخوذة على فترات 1 ميكرومتر.
10. تسجيل وجود تشكيلات رولو في الكبيبات السطحية
- اتبع نفس الإرشادات للخطوة 9.3 واحصل على مجموعة بيانات ثلاثية الأبعاد. ابحث عن تشكيلات رولو التي تظهر على شكل كرات الدم الحمراء المكدسة في حزم تقاوم التفكك أثناء تحركها على طول الحلقات الشعرية. استخدم فلوروفور أحمر لتصور أفضل للهيكل على أعماق أكبر بسبب تشتت الفوتون الأقل للانبعاثات الحمراء ذات الطول الموجي الأطول. أبلغ عن القيم كحدوث / 25 مقطعا بصريا من أعلى الكبيبة ، مأخوذة على فترات 1 ميكرومتر.
11. عزل الكبيبات
- عزل ثلاث مجموعات من الكبيبات من الكلى الطازجة باستخدام تقنية غربلة قياسية تؤدي إلى نقاء ما يقرب من 90٪ من كبيبات الفئران15.
- ضع قشرة الكلى في محلول ملحي بارد مخزن بالفوسفات (PBS) وقم بفرمها باستخدام مقص دقيق متعدد أو شفرات حلاقة.
- أضف المنديل المفروم إلى مصفاة خلايا معقمة 100 ميكرومتر وادفعه برفق باستخدام مكبس حقنة سعة 5 مل و 50-100 مل من PBS البارد.
ملاحظة: يتم الاحتفاظ بمعظم الأنابيب أثناء مرور الكبيبات. - ضع جزء الكبيبات المخصب على مرشح 70 ميكرومتر واغسله على نطاق واسع باستخدام PBS البارد. اغسل الفلتر ب 100-200 مل من PBS البارد لإزالة معظم الأنابيب المتبقية.
- اجمع الكبيبات من المرشح باستخدام 1-2 مل من PBS البارد ، وأجهزة الطرد المركزي (10000 × جم ، 2 دقيقة ، 4 درجات مئوية) وقم بتجميدها في النيتروجين السائل حتى عزل الحمض النووي الريبي.
ملاحظة: نقاء الكبيبات الذي يحدده الفحص المجهري لتباين الطور هو >90٪ ، والعائد حوالي 10 ملغ من 2 كلية.
12. عزل الحمض النووي الريبي الكبيبي
- قم بتجانس حبيبات الكبيبات المجمدة باستخدام كاشف عزل الحمض النووي الريبي عن طريق إضافة 400 ميكرولتر من الكاشف وتفتيت الحبيبات باستخدام طرف ماصة 200 ميكرولتر ، تليها دوامة قصيرة و 5 دقائق من الحضانة عند RT16.
- أضف 40 ميكرولتر من 1-برومو-3-كلوروبروبان (BCP) ، دوامة لمدة 15 ثانية ، واحتفظ بها عند RT لمدة 15 دقيقة.
- جهاز طرد مركزي عند 12000 × جم ، 15 دقيقة ، 4 درجات مئوية. قم بإزالة الطبقة المائية ، وقم بتخفيف الطبقة السفلية بحجم متساو من الإيثانول بنسبة 70٪ ، وقم بتحميلها مباشرة على عمود الدوران (انظر جدول المواد).
- بعد الغسيل ، يتكون كل منها من إضافة المحلول المعني إلى العمود متبوعا بالطرد المركزي عند 12000 × جم ، 15 ثانية ، 26 درجة مئوية [إجمالي 3 ، أول 2 مع 500 ميكرولتر من RPE (مخزن غسيل معتدل خاص مع الإيثانول لإزالة آثار الأملاح ، غسيلثالث مع 500 ميكرولتر من 80٪ EtOH] ، قم بتخفيف الحمض النووي الريبي بإضافة 15 ميكرولتر من H2 O وأجهزة الطرد المركزي ، أما بالنسبة للغسيل. تحقق من تركيز ونقاء الحمض النووي الريبي ونقل عينات الحمض النووي الريبي إلى المرفق الأساسي لتحليل الأوتار النانوية17,18.
ملاحظة: إجمالي إنتاج الحمض النووي الريبي حوالي 1-2 ميكروغرام. هنا ، احتوت العينات ال 24 على 200 نانوغرام من الحمض النووي الريبي عند 30 نانوغرام / ميكرولتر.
13. تحليل الأوتار النانوية
ملاحظة: تعتمد تقنية Nanostring على الكشف الرقمي والترميز الشريطي الجزيئي المباشر للجزيئات المستهدفة التي تستخدم أزواج مسبار مرمزة بالألوان. يحمل مسبار الالتقاط مجموعة من البيوتين في الطرف 3 ، ويحمل مسبار المراسل الإشارة في نهايته 5.
- اشحن أزواج مسبار الجينات Nanostring ومجموعات الشفرات إلى المرفق الأساسي الجينومي لولاية ميشيغان واستخدمه وفقا لتوجيهات NanoString.
ملاحظة: هناك ستة مواضع لرموز الألوان، ويمكن أن يكون كل موضع واحدا من أربعة ألوان، مما يتيح تنوعا كبيرا من العلامات التي يمكن حل كل منها وتحديدها بشكل فردي أثناء جمع البيانات. - احصل على البيانات التي تم جمعها من قبل موظفي منشأة Genomic Core باستخدام محلل Nanostring nCounter Digital الخاص ، والذي يجمع مجالات الرؤية باستخدام هدف مجهر وكاميرا CCD ويقوم بجدولة وعرض عدد الباركود.
- استيراد البيانات الأولية إلى برنامج nSolver من Nanostring للتحليل. قم بتطبيع البيانات التي تمت تسويتها باستخدام إعداداتها الافتراضية وقارن البيانات بين المجموعات كما هو موضح في دليلها.
ملاحظة: كان الهدف هو مراقبة التغيرات الجينية التي تبين سابقا أنها تغيرت في الأنسجة القشرية من نموذج UUO19 ، أمراض الكلى17،20،21،22،23،24،25،26. تم تحليل ما مجموعه 126 جينا ، بما في ذلك الضوابط الإيجابية والسلبية الموصى بها ، في كل مجموعة كبيبية (CONT ، SHAM ، & UUO).
النتائج
تم عزل ثلاث مجموعات من الكبيبات باستخدام تقنية غربلة قياسية تؤدي إلى نقاء ما يقرب من 90٪ من كبيبات الفئران15. كانت المجموعة الكبيبية الأولى من الكلية اليسرى لفئران SD التي خضعت لمشبك الحالب الأيسر لمدة 5 أسابيع ، UUO (5 ذكور ، 3 إناث). تم عزل مجموعة الكبيبات الثانية من كلية التحكم المقابلة من نفس الجرذ ، CONT (5 ذكور و 3 إناث). تم عزل المجموعة الثالثة من الكبيبات من الفئران SD التي خضعت لعملية SHAM ، وتم استخدام الكلية اليسرى لعزل الكبيبات بعد 5 أسابيع ، SHAM (4 ذكور ، 4 إناث).
التغيرات المورفولوجية
كشف إخراج الكلى المسدودة للتصوير عن تضخم الكلى بشكل كبير ، ما يقرب من أربعة أضعاف الحجم الطبيعي ، مع ظهارة رقيقة مرئية من خلال داخل الكلى المملوء بالسوائل. من خلال هدف 20x ، باستخدام إضاءة epifluorescence ومكعب FITC / Rhodamine ثنائي التمرير ، كان التغيير الأكثر وضوحا هو ترقق الظهارة الأنبوبية والانهيار المنتظم للتجويف الأنبوبي على طول الأنبوب بأكمله. تم وصف الأنسجة بشكل جيد وهي شديدة بأسبوع واحد من UUO10،11،12. زاد عدد الكبيبات المرئية على السطح في الفئران MWF و SD بعد خمسة أسابيع من انسداد الحالب من جانب واحد. يوضح الشكل 1A الطريقة المستخدمة لإنشاء نموذج UUO. لم تمسها الكلية اليمنى وتوفر معدل ترشيح كبيبي مناسب للفئران. تم حساب عدد الكبيبات لكل حقل باستخدام هدف 20x (363 ميكرومتر × 363 ميكرومتر) ويظهر في رسم بياني في الشكل 1B. ارتفع عدد الكبيبات السطحية في فئران MWF من 1.08 ± 0.11 / حقل في الفئران غير المعالجة إلى 2.97 ± 0.65 / حقل في مجموعة UUO لمدة خمسة أسابيع. انتقلت فئران SD من عدم وجود كبيبات سطحية إلى 2.02 ± 0.37 / حقل بعد 5 أسابيع من UUO.
تم التقاط صور 2-فوتون داخل الجسم لهذه الفئران بعد الحقن مع TR-RSA (أحمر) ، ديكستران 10 كيلو دالتون كاسكيد الأزرق (10 كيلو دالتون-CB) ، و Hoechst 33342 لتسمية النوى (سماوي). تظهر هذه لفئران MWF العادية (الشكل 1C) ، وفئران MWF بعد خمسة أسابيع من UUO (الشكل 1D) ، وفئران SD بعد خمسة أسابيع من UUO (الشكل 1E). تسلط هذه الصور الضوء على التغيرات الدراماتيكية التي تحدث في الظهارة الأنبوبية. تصبح الجسيمات الحالة النبيبية القريبة ، والتي عادة ما تكون تراكمات صغيرة برتقالية اللون في فئران MWF و SD غير المعالجة ، هياكل فراغية مفردة كبيرة تملأ غالبية الخلية الأنبوبية المنكمشة. كما هو موضح في ألبومين TR-RSA ، بدا الأوعية الدموية مستقيما ، وفي العديد من الأوعية ، خالية من كرات الدم الحمراء المتدفقة ، تظهر فقط تدفق البلازما. كشف تثبيت الكلى أن القشرة قد ضعفت إلى جلد ليفي لا يزيد سمكه عن ملليمتر. تتفق هذه الملاحظات مع الأدبيات المبكرة باستخدام هذا النموذج3،10،11،12.
التغيرات في ديناميات الأوعية الدموية الكلوية ونفاذية الكبيبات
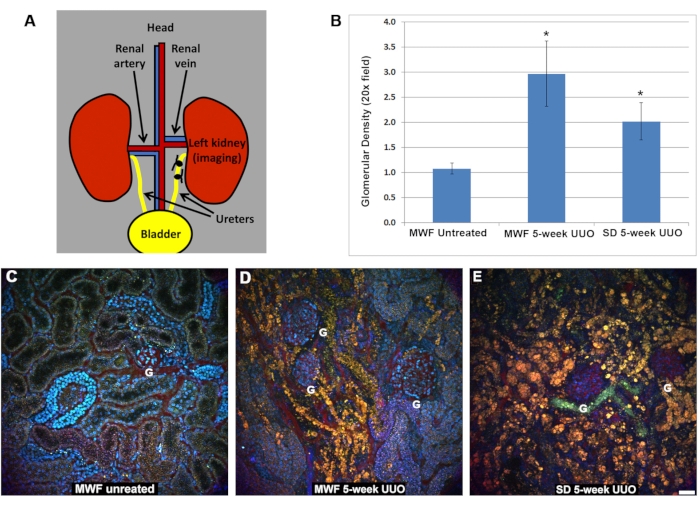
انخفض تدفق الدم الكلوي بشكل ملحوظ في كل من مجموعات UUO MWF و SD لمدة خمسة أسابيع مقارنة بالفئران غير المعالجة (الشكل 2). كان لدى فئران MWF التي تديرها الشام معدل تدفق RBC حول الأنبوب يبلغ 885 ± 25 ميكرومتر / ثانية. انخفض تدفق كرات الدم الحمراء حول الذات في فئران UUO MWF و SD لمدة خمسة أسابيع إلى 250 ± 100 ميكرومتر / ثانية و 200 ± 125 ميكرومتر / ثانية ، على التوالي. تم حساب هذه القيم من خلال جمع مسح الخط عبر الأوعية المحيطة بالأنبوب لحساب سرعة كرات الدم الحمراء. يوضح الشكل 2D تمثيلا بيانيا لهذه البيانات.
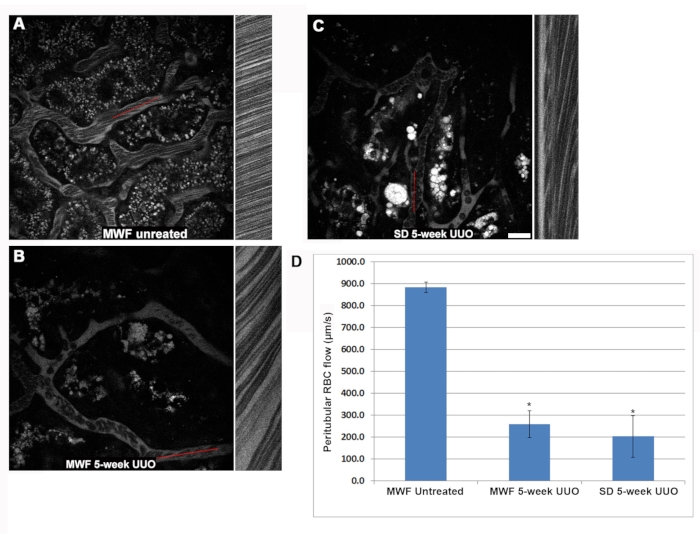
انخفضت سرعة كرات الدم الحمراء داخل الحلقات الشعرية الكبيبية بشكل ملحوظ في فئران UUO MWF و SD لمدة خمسة أسابيع مقارنة ب MWF غير المعالج (الشكل 3). في كثير من الحالات ، وجد أن الكبيبات لديها حلقات شعرية خالية تماما من كرات الدم الحمراء المتدفقة. كانت معدلات تدفق RBC للحلقة الشعرية 1,405 ± 425 ميكرومتر / ثانية ، و 250 ± 220 ميكرومتر / ثانية ± ، و 190 ± 200 ميكرومتر / ثانية أو MWF غير المعالج ، و UUO MWF لمدة خمسة أسابيع ، وفئران UUO SD لمدة خمسة أسابيع ، على التوالي (الشكل 3D). داخل الحلقات الشعرية لمجموعات UUO لمدة خمسة أسابيع ، كشف التدفق البطيء لكرات الدم الحمراء عن وجود كرات الدم البيضاء الملتصقة ، إما بإبطاء التدفق أو منعه ، مع تصور تدفق البلازما فقط في اتجاه مجرى النهر من الانسداد الجزئي أو الكلي. لتحديد هذه الملاحظة ، تم حساب عدد كرات الدم البيضاء الملتصقة الموجودة في حجم ثلاثي الأبعاد ثم تم تسويتها لتحدث لكل 10 ميكرومتر من عمق الحجم ثلاثي الأبعاد. يمكن تمييز بنية الخلية البيضاء الملتصقة باستخدام مضان الصبغة النووية السماوية من Hoechst 33342. لسوء الحظ ، فإن تشتت الفوتون الأكبر للأضواء الباعثة للأزرق حد من التعرف الموثوق به على كرات الدم البيضاء من خلال نواتها إلى المقاطع البصرية العشرة العليا من الأعلى ، والتي تم التقاطها على خطوات 1 ميكرومتر من الحجم الكبيبي. كان لدى فئران MWF غير المعالجة أقل من 0.125 ± 0.05 كرات الدم البيضاء / 10 أقسام بصرية من الأعلى ، مأخوذة بحجم خطوات 1 ميكرومتر بينما زاد هذا الرقم إلى 1.5 ± 0.5 و 3.25 ± 0.7 في 5 أسابيع UUO MWF و 5 أسابيع UUO SD الفئران ، على التوالي (الشكل 3E).
كان التغيير الوعائي الآخر الذي قد يفسر أيضا انخفاض تدفق كرات الدم الحمراء في مجموعات UUO لمدة 5 أسابيع هو المظهر المنتظم لتكوينات Rouleaux (كرات الدم الحمراء المجمعة التي يتم الالتزام بها في تكوين "عملة مكدسة" ، انظر الجزء الداخلي من الشكل 3F). تتدفق تكوينات Rouleaux بشكل أبطأ ويمكن إيقافها بواسطة WBC ملتصق. لا تحتوي فئران WMF غير المعالجة على أي تكوينات رولو تقريبا في الشعيرات الدموية الكبيبية ، حيث تحتوي فقط على 0.05 ± 0.05 تكرار لكل 25 قسما بصريا من الأعلى ، مأخوذة بخطوات 1 ميكرومتر. شهدت فئران UUO MWF و SD لمدة خمسة أسابيع زيادة ملحوظة في تكوينات Rouleaux 2.27 ± 0.46 و 1.46 ± 0.73 لكل 25 قسما بصريا بدءا من الأعلى ، مأخوذة بخطوات 1 ميكرومتر ، على التوالي (الشكل 3F).
بالإضافة إلى انخفاض معدلات تدفق كرات الدم الحمراء الكبيبية التي شوهدت مع UUO ، شوهدت زيادة في نفاذية الألبومين. كان هناك عدم تجانس أكبر في نفاذية الألبومين بين الكبيبات. في بعض الأحيان ، كان تراكم الألبومين داخل مساحة بومان شديدا بما يكفي لرؤيته بوضوح (الشكل 4 ب ، علامة النجمة). ارتفع معامل الغربلة الكبيبي للألبومين من 0.015 ± 0.002 في MWFs غير المعالجة ، إلى 0.045 ± 0.05 في UUO MWF لمدة 5 أسابيع و 0.052 ± 0.075 في فئران UUO SD لمدة خمسة أسابيع.
تغيير وظيفة النبيبات القريبة
ومن المثير للاهتمام ، أنه لا يمكن اكتشاف الألبومين المصفى في خلايا النبيبات القريبة بعد UUO. عادة ما يقوم الجزء S1 بإدخال خلايا داخلية بكميات كبيرة من الألبومين27،28،29،30 ، كما هو موضح هنا في ظل الظروف الفسيولوجية في فئران MWF غير المعالجة (الشكل 5 أ). لا يمكن رؤية هذا الامتصاص نفسه في MWF أو SD PT بعد 5 أسابيع من UUO (الشكل 5B ، C). تم تسجيل الأنابيب القريبة المحيطة بالكبيبات التي تم تصويرها بين 45 و 60 دقيقة بعد ضخ TR-RSA إما لوجود (1) أو غياب (0) من الألبومين. من المهم ملاحظة أنه في ظل الظروف الفسيولوجية ، يربط الجزء S1 الألبومين ويستوعبه بشدة مع وصول القليل من الألبومين إلى الأنابيب البعيدة أو القنوات المجمعة. لذلك ، من المنطقي أن أجزاء النبيبات القريبة الأخيرة قد لا تحتوي على الألبومين مما يؤدي إلى إيجابية كسرية لامتصاص الألبومين أقل من 1.0. يوضح الشكل 5D تمثيلا بيانيا يحتوي على نتائج تسجيل امتصاص الألبومين القريب للأنيبيب. كان لدى MWF غير المعالج قيمة امتصاص كسور النبيبات القريبة من 0.556 ± 0.126. كان لكل من فئران UUO MWF و SD لمدة خمسة أسابيع قيم أقل بكثير من 0.049 ± 0.126 و 0.00 ±0.00 ، على التوالي.
كما تم الانتهاء من الدراسات على فئران UUO MWF لمدة 12 أسبوعا (الجدول 1). اثنا عشر أسبوعا من UUO هو الوقت القياسي المستخدم لدراسات الفئران للحث على الكبيبات السطحية. تم تصوير ثلاثة فئران ذكور UUO ، وزادت الكثافة الكبيبية إلى 6.16 ± 1.83 كبيبة لكل حقل 20x في هذه الفئران. كان معدل تدفق RBC 293 ± 67 ميكرومتر / ثانية ، وكان التصاق WBC 1.47 ± 1.12 ، وكلاهما مشابه لبيانات UUO لمدة 5 أسابيع. كما زاد GSC للألبومين مقارنة بفئران UUO لمدة 5 أسابيع إلى 0.109 ± 0.04.
تغيرات mRNA الكبيبية الناجمة عن UUO المزمن
يوضح الجدول 2 جميع الجينات (المجسات) مع تعبيرها المجمع وقيم الانحراف المعياري. ملاحظة ، تم اختيار الجينات للتحليل بناء على الوثائق السابقة للتغيير في أمراض الكلى ، بما في ذلك UUO كما هو موضح في ملاحظة قسم البروتوكول 13. الشكل 6 عبارة عن خريطة حرارية للبيانات تسلط الضوء على التغيرات الدراماتيكية في التعبير الجيني لمعظم الجينات في كبيبات UUO مقارنة بالكبيبات الضابطة أو الوهمية.
الشكل 1: زيادة في عدد الكبيبات السطحية وتحريض الكبيبات السطحية في الفئران SD بعد UUO لمدة 5 أسابيع في الفئران MWF. (أ) رسم تخطيطي جراحي للحالب الموجود في الكلية اليسرى تم تحريره بعناية من الشريان الكلوي والوريد قبل إغلاقه برباطين باستخدام الخياطة الجراحية. (ب) رسم بياني يشير إلى الزيادة في عدد الكبيبات السطحية الموجودة في فئران MWF قبل وبعد خمسة أسابيع من UUO جنبا إلى جنب مع عدد الكبيبات السطحية في فئران SD ، والتي عادة لا تحتوي على كبيبات سطحية. زاد عدد الكبيبات السطحية في فئران MWF من 1.08 ± 0.11 / حقل في الفئران غير المعالجة إلى 2.97 ± 0.65 / حقل في مجموعة UUO لمدة 5 أسابيع. انتقلت فئران SD من عدم وجود كبيبات سطحية إلى 2.02 ± 0.37 / حقل. تظهر الصور ثلاثية الأبعاد المعاد بناؤها السطح الكلوي ل MWF (C) غير المعالج ، MWF بعد 5 أسابيع UUO (D) ، و SD بعد خمسة أسابيع UUO (E). لاحظ ظهور الهياكل الفراغية البرتقالية الكبيرة التي اندمجت من الجسيمات الحالة الفردية الصغيرة إلى أجسام كبيرة غير طبيعية. لم ينتج عن UUO لمدة 5 أسابيع في فئران SD مناطق تشبه الظهارة الأنبوبية الطبيعية التي شوهدت في C وجزئيا في D. بدت الأوعية الدموية مستقيمة في بعض المناطق ، وفي العديد من المناطق ، كان لها انسداد جزئي يسمح بتدفق البلازما ولكن ليس كرات الدم الحمراء. (ن = 3 ذكور فئران لكل مجموعة) قضبان المقياس = 40 ميكرومتر. تشير أشرطة الخطأ إلى الانحراف المعياري. الاختصارات: UUO = انسداد الحالب من جانب واحد. SD = سبراغ داولي ؛ MWF = ميونيخ ويستار فرومتر; G = الكبيبة. كرات الدم الحمراء = خلايا الدم الحمراء. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الشكل 2: انخفاض في تدفق كرات الدم الحمراء داخل الأوعية الدموية السطحية المحيطة بالأنبوب بعد 5 أسابيع UUO. تم جمع Linescans في الأوعية الدموية المحيطة بتحديد سرعة تدفق كرات الدم الحمراء بالميكرومتر / ثانية. باختصار ، تمثل الخطوط المرجعية الحمراء الموضحة في A و B و C منطقة صغيرة تم فيها مسح نفس مساحة البكسل الواسعة بشكل متكرر ، والصور مكدسة في عمود لتصور التشويه الناجم عن كرات الدم الحمراء المتدفقة ، والتي تنتقل أسرع مما يمكن للمجهر الحصول عليها. العمود المجاور للشكل المرجعي هو linecan ، مع استخدام ميل تشويه RBC لحساب السرعة (المحور x = المسافة والمحور y = الوقت). هنا ، تتوافق المنحدرات الأكثر انحدارا تدريجيا مع سرعات RBC الأبطأ لأنها تظل أطول في منطقة linescan. لاحظ الفرق في مظهر كرات الدم الحمراء في فئران MWF غير المعالجة (A) مقارنة بصور UUO لمدة خمسة أسابيع لفئران MWF (B) و SD (C). سرعات تدفق كرات الدم الحمراء لمجموعات الفئران الثلاث موضحة بالحرف (د). بلغ متوسط تدفق كرات الدم الحمراء حول القفص في MWFs غير المعالجة 885 ± ميكرومتر / ثانية. انخفضت هذه القيم بشكل ملحوظ بعد خمسة أسابيع من UUO في الفئران MWF و SD إلى 250 ± 100 ميكرومتر / ثانية و 200 ± 125 ميكرومتر / ثانية ، على التوالي. شريط المقياس = 20 ميكرومتر ، ن = 3 ذكور فئران لكل مجموعة. تشير أشرطة الخطأ إلى الانحراف المعياري. الاختصارات: UUO = انسداد الحالب من جانب واحد. SD = سبراغ داولي ؛ MWF = ميونيخ ويستار فرومتر; RBC = خلايا الدم الحمراء. WBC = خلايا الدم البيضاء. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الشكل 3: انخفاض كبير في تدفق RBC للحلقة الشعرية الكبيبية والتنشيط المستحث لالتصاق WBC بواسطة UUO لمدة 5 أسابيع. تم استخدام نفس نهج مسح الخطوط المستخدم لتحديد تدفق كرات الدم الحمراء حول الأنبوب للتحقيق في التغيرات في تدفق الدم الشعري الكبيبي. تظهر اللوحات A و B و C تخطيطا مشابها للشكل 2 وتركز على الكبيبة في MWF التي تعمل بالخداع ، و UUO MWF لمدة خمسة أسابيع ، و UUO SDs لمدة خمسة أسابيع ، على التوالي. (د) رسم بياني يكشف عن معدل تدفق كرات الدم الحمراء المرتفع من الناحية الفسيولوجية في الحلقات الشعرية من فئران MWF التي تعمل بالشام والتي يبلغ متوسطها 1405 ± 425 ميكرومتر / ثانية ± 425 ، انخفض إلى 250 ± 220 ميكرومتر / ثانية و 190 ± 200 ميكرومتر / ثانية لفئران UUO MWF لمدة 5 أسابيع و UUO SD لمدة 5 أسابيع ، على التوالي. عند فحص الحلقات الشعرية الكبيبية ، كانت كرات الدم البيضاء الملتصقة مرئية بسهولة أثناء التركيز من خلال الكبيبة. تم أخذ المقاطع البصرية ثلاثية الأبعاد من الكبيبات الفردية ، وتم استخدام أول 10 أقسام بصرية ، على بعد 1 ميكرومتر ، لقياس عدد كرات الدم البيضاء الملتصقة. لم يكن لدى فئران MWF غير المعالجة أي كرات بيضاء بيضاء مرئية في أحجامها ، بمتوسط أقل من 0.125 ± 0.05 كرات الدم البيضاء / 10 أقسام بصرية من الأعلى ، مأخوذة بخطوات 1 ميكرومتر. في فئران UUO MWF و SD لمدة 5 أسابيع ، زادت هذه الأرقام إلى 1.5 ± 0.5 و 3.25 ± 0.7 WBCs / 10 أقسام بصرية من الأعلى ، مأخوذة بخطوات 1 ميكرومتر ، على التوالي. تظهر هذه النتائج في الرسم البياني في اللوحة E ، مع إدخالات ملونة تظهر كرات الدم البيضاء التي تسد الحلقات الشعرية. تظهر تشكيلات Rouleaux (الأسهم ، أقحم في اللوحة F) على شكل كرات الدم الحمراء المرتبطة بإحكام معا في تكوين "عملة مكدسة" والتي تحتفظ إلى حد كبير بتجميعها المجمعة حتى في اضطراب تدفق الدم. كانت هذه الهياكل المرضية يمكن تمييزها بسهولة على أعماق أكبر داخل الكبيبة. كانت فئران MWF التي تديرها الشام خالية إلى حد كبير من هذه الهياكل ، حيث كان لها فقط 0.05 ± 0.05 مرة 25 مقطعا بصريا من الأعلى ، مأخوذة بخطوات 1 ميكرومتر من الحجم الكبيبي. في المقابل ، كان لدى UUO لمدة 5 أسابيع في كل من الفئران MWF و SD زيادة ملحوظة في تكوينات Rouleaux مع حدوث 2.27 ± 0.46 و 1.46 ± 0.73 / 25 مقاطع بصرية من الأعلى ، مأخوذة بخطوات 1 ميكرومتر ، على التوالي. قضبان المقياس = 20 ميكرومتر ، ن = 3 ذكور فئران لكل مجموعة. تشير أشرطة الخطأ إلى الانحراف المعياري. الاختصارات: UUO = انسداد الحالب من جانب واحد. SD = سبراغ داولي ؛ MWF = ميونيخ ويستار فرومتر; RBC = خلايا الدم الحمراء. WBC = خلايا الدم البيضاء. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
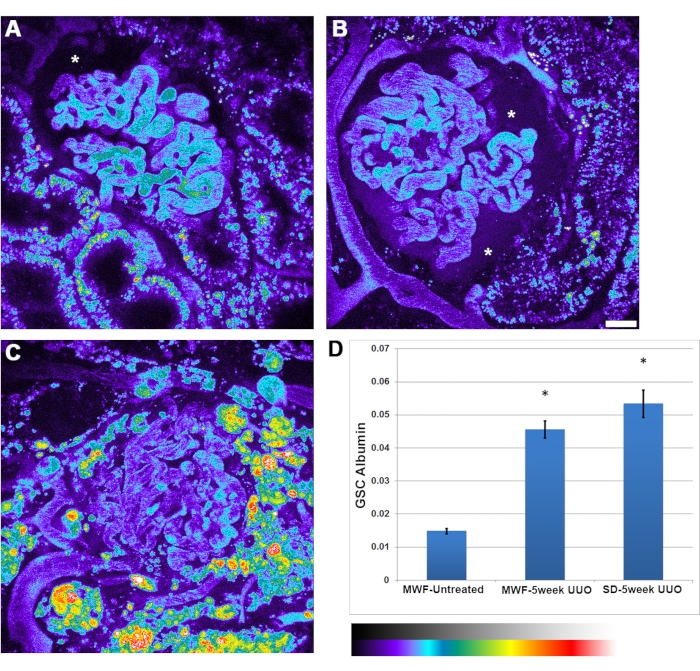
الشكل 4: زيادة كبيرة في نفاذية الألبومين الشعري الكبيبي بعد UUO لمدة 5 أسابيع. تعرض اللوحات A و B و C صورا بالألوان الزائفة لحجم 3D لقناة ألبومين مصل الفئران في MWF غير المعالج ، و UUO MWF لمدة 5 أسابيع ، وفئران UUO SD لمدة خمسة أسابيع ، على التوالي. يتم تقديم الصور في لوحة ألوان زائفة لتسليط الضوء على الكمية الملموسة من الألبومين المصفى الذي شوهد في مساحة بومان ، لا سيما في اللوحة B (علامة النجمة). (أ) تظهر مساحة بومان (علامة النجمة) المستوى الطبيعي للألبومين الذي يظهر عادة في فئران MWF غير المعالجة ، ولا يمكن تمييزه للعين. تم التقاط صور الكبيبات قبل ضخ الألبومين لطرح قيم مضان الخلفية من تلك التي تم التقاطها بعد إعطاء الألبومين. د: رسم بياني بمعامل الغربلة الكبيبي للألبومين في فئران MWF غير المعالجة، بقيمة 0.015 ± 0.002. زادت هذه القيمة بشكل ملحوظ إلى 0.045 ± و 0.05 في فئران UUO MWF لمدة 5 أسابيع و 0.052 ± 0.075 في فئران UUO SD لمدة خمسة أسابيع. هذه المعلمة هي قيمة نسبية لشدة الفلورسنت لفضاء بومان مقسومة على قيمة البلازما وليس لها وحدة قياس مرتبطة. شريط المقياس = 20 ميكرومتر ، ن = 3 ذكور فئران لكل مجموعة. يقع مقياس كثافة الألوان الزائفة أسفل اللوحة D. تشير أشرطة الخطأ إلى الانحراف المعياري. الاختصارات: UUO = انسداد الحالب من جانب واحد. SD = سبراغ داولي ؛ MWF = ميونيخ ويستار فرومتر; RBC = خلايا الدم الحمراء. WBC = خلايا الدم البيضاء. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
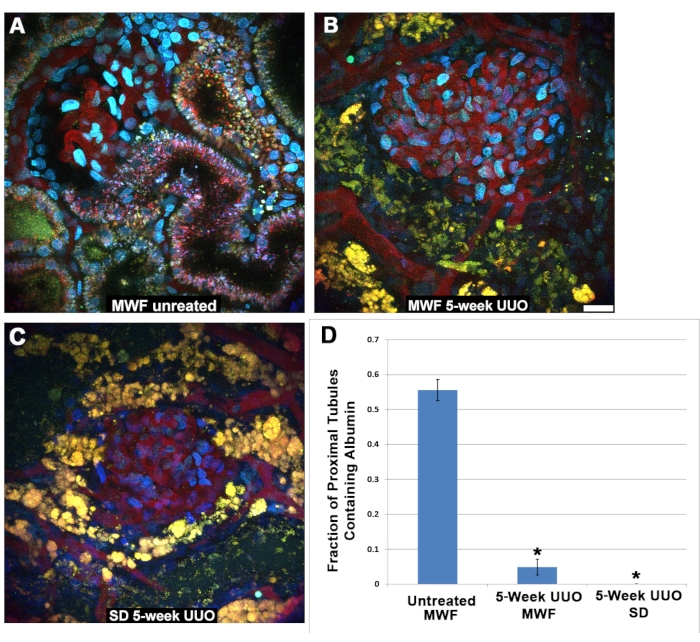
الشكل 5: انخفاض الوظيفة في الأنابيب القريبة بعد UUO لمدة 5 أسابيع. (أ) صورة لكبيبة سطحية ومقطع S1 من فأر عادي في ميونيخ Wistar Frömter تم التقاطها بعد 40 دقيقة من ضخ TR-RSA و Cascade Blue dextran. يمكن رؤية استيعاب TR-RSA في الجزء S1 والنبيب القريب. في تناقض حاد ، تظهر فئران MWF (B) وفئران SD (C) ، التي تعرضت ل UUO لمدة 5 أسابيع ، أنابيب قريبة متغيرة بشدة مع الحد الأدنى من امتصاص TR-RSA أو عدم امتصاصه. تصبح الليزوزومات الفلورية الذاتية الصغيرة عادة (A) هياكل صفراء برتقالية كبيرة وفراغية ، غالبا مع انهيار كامل للتجويف الأنبوبي ، والذي لا يمكن العثور عليه في مجموعات البيانات ثلاثية الأبعاد. (ج) تحتوي الأنيبيبات البعيدة الخالية عادة من أي شكل من أشكال التألق الذاتي الآن على تراكمات فلورية ذاتية. أظهر تسجيل الأنابيب القريبة المحيطة بالكبيبات في صور مماثلة تم التقاطها بعد 45-60 دقيقة من التسريب ، لامتصاص الألبومين ، فرقا كبيرا بين مجموعة MWF التي تعمل بالوهمية ومجموعتي UUO لمدة 5 أسابيع. كان لفئران MWF غير المعالجة قيمة امتصاص كسرية للنبيب القريب تبلغ 0.556 ± 0.126. كان لكل من فئران UUO MWF و SD لمدة خمسة أسابيع قيم أقل بكثير من 0.049 ± 0.126 و 0.00 ±0.00 ، على التوالي. شريط المقياس = 20 ميكرومتر ، ن = 3 ذكور فئران لكل مجموعة. تشير أشرطة الخطأ إلى الانحراف المعياري. الاختصارات: UUO = انسداد الحالب من جانب واحد. SD = سبراغ داولي ؛ MWF = ميونيخ ويستار فرومتر; RBC = خلايا الدم الحمراء. WBC = خلايا الدم البيضاء. TR-RSA = ألبومين مصل الفئران الأحمر في تكساس. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
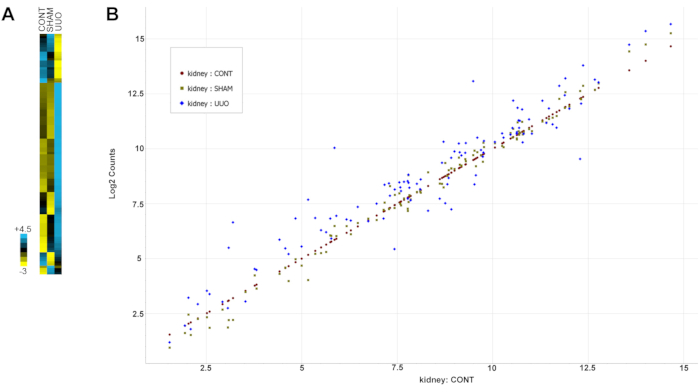
الشكل 6: تغيرات التعبير الجيني مع UUO. أ: خريطة حرارية للبيانات. ب: التغيرات الجينية الطبيعية لجميع البيانات في مخطط التشتت. تم رسم التعبير عن الجينات في الكلى الضابطة من التعبير المنخفض إلى العالي ، وتمت مقارنة الجينات من كل من كليتي SHAM و UUO بمستويات التعبير الضابط. تشير نقاط بيانات الجينات القريبة من القيمة القطرية للجينات الضابطة إلى مستويات تعبير مماثلة لكلا المجموعتين ، بينما تشير نقاط البيانات أعلى أو أسفل القطر إلى مستويات تعبير أعلى أو أقل ، على التوالي. لاحظ أن مجموعة جينات SHAM أقرب إلى التعبير القطري للتحكم من جينات UUO ، والتي تكون أكثر متغيرا. اختصار: UUO = انسداد الحالب من جانب واحد. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الجدول 1: تطور الإصابة من 5 إلى 12 أسبوعا من UUO. مقارنة بين معلمات تصوير UUO لمدة 5 و 12 أسبوعا في ثلاثة ذكور من فئران MWF وثلاثة فئران SD من الذكور في كل نقطة زمنية. بيانات خمسة أسابيع هي نفسها كما في الأرقام السابقة. لاحظ الزيادة في الكثافة الكبيبية و GSC للألبومين مع استمرار UUO. الاختصارات: UUO = انسداد الحالب من جانب واحد. SD = سبراغ داولي ؛ MWF = ميونيخ ويستار فرومتر; GSC = معامل الغربلة الكبيبي. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 2: تحليل علامات الالتهاب في الكبيبات من UUO والفئران الضابطة. تم تصميم أزواج مسبار الجينات ومجموعات الشفرات واستخدامها وفقا لتوجيهات NanoString. تم تحليل أكثر من 100 جين ، بالإضافة إلى الضوابط الإيجابية والسلبية على النحو المحدد بواسطة Nanostring. يتم عرض جميع الجينات (المجسات) مع تعبيرها المجمع وقيم SD في الجدول. الشكل 6 أ عبارة عن خريطة حرارية للبيانات ، بينما يعرض الشكل 6 ب التغيرات الجينية لجميع البيانات في مخطط مبعثر. لاحظ أوجه التشابه بين عناصر التحكم و SHAM والتغيرات المميزة لمعظم الجينات في UUO. الاختصارات: UUO = انسداد الحالب من جانب واحد. SD = الانحراف المعياري. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
شهدت دراسة فسيولوجيا الكبيبات العديد من الأساليب المختلفة ، وأبرزها استخدام البزل الدقيق ، ونضح الكبيبات المعزولة ، والفحص المجهري. سمح توافر الكبيبات السطحية في فئران ميونيخ ويستار ، سلالات فروتر وسيمونسن ، بإجراء دراسات ديناميكية في الجسم الحي . إحدى الملاحظات المهمة للباحثين الذين يتبنون هذه التقنية هي الحاجة إلى تعيين معلمات اكتساب للحفاظ على صور متسقة بين الدراسات ، بحيث يظل التألق الذاتي في الأنسجة ثابتا. إن استخدام مكعب الفلوريسئين / الرودامين ثنائي التمرير وضبط إعدادات الكسب على قنوات الانبعاث الخضراء والحمراء لتقليد ما يتم رؤيته من خلال العدسات على شاشة الكمبيوتر سيضمن توقيعا لونيا متسقا في التألق الذاتي حتى بين أنظمة المجهر المختلفة.
تم استخدام سلالة فرومتر على نطاق واسع لأنها تحتوي على عدد أقل من الكبيبات الكلية ، ~ 75٪ طبيعية ، ويصاب الذكور تلقائيا بارتفاع ضغط الدم في حوالي 12 أسبوعا من العمر ، مع بيلة بروتينية تدريجية وتصلب كبيبي بؤري لاحق ، يموت في النهاية بسبب الفشل الكلوي12. إن استخدام هذه الفئران وإضافة الفحص المجهري 2-الفوتون مع انخفاض السمية الضوئية ، وتحسين عمق الاختراق ، والقدرة على عرض مجسات الفلورسنت المتعددة في وقت واحد مهد الطريق لاكتشافات جديدة1،4،5. مع تطور أجهزة وبرامج الكمبيوتر ، أصبحت البيانات الكمية الآن هي المعيار لجميع مختبرات الفوتون 2. تم تطوير تقنيات كمية متعددة وتطبيقها على العمليات الكبيبية والنبيبية القريبة والأوعية الدموية والخلالية في ظل الظروف الفسيولوجية والمرضية1،4،5،27،28،29،30.
أضافت مرافق توليد الفئران المعدلة وراثيا بعدا جديدا لدراسة فسيولوجيا الكلى وعلم الأمراض ، وكانت مسألة وقت فقط حتى تم دمج ذلك مع الفحص المجهري 2-فوتون لتحديد أهمية منتجات جينية محددة في بنية الكلى ووظيفتها. ومع ذلك ، تقع كبيبات الماوس ، باستثناء الفئران الصغيرة جدا ، على بعد أكثر من 100 ميكرومتر من سطح الكلى9. من الأفضل إجراء الفحص المجهري ثنائي الفوتون على عمق يتراوح بين 20 و 50 ميكرومتر كدقة ، وتتضاءل شدة التألق بسرعة بعد ذلك بسبب تشتت الضوء المنبعث والامتصاص من التفاعل مع الهيموجلوبين. لذلك ، كان من الضروري حث الكبيبات السطحية. النهج المستخدم بشكل شائع هو نموذج عرقلة أحادية مطولة لمدة 12 أسبوعا. وبما أن هذه النماذج لا تسمح بتحديد خط الأساس، فإن فصل آثار UUO عن العملية قيد الدراسة غير ممكن.
باستخدام فئران MWF ، يمكن للمرء مقارنة دالة الكبيبات الأساسية مع تلك التالية UUO. من المعروف أن نموذج UUO هذا يحفز الالتهاب ومعدل التليف السريع وقد تم استخدامه لدراسة مرض الكلى المزمن والتليف10،11،12. كما هو متوقع ، كانت هناك زيادة في الكبيبات السطحية في كل من الفئران MWF و SD. علاوة على ذلك ، كانت النتائج الكمية التي تم الحصول عليها بعد UUO لفئران MWF و SD قابلة للمقارنة للغاية. تم الإبلاغ سابقا عن انخفاض تدفق الدم المسجل هنا مقارنة البيانات المجهرية بعد UUO ببيانات البزل الدقيق3. كان من المعروف أيضا أن الأنسجة الأنبوبية والخلالية قد تغيرت بشكل ملحوظ ، وأن PTs في الغالب غير وظيفية ، كما هو مذكور هنا ، مع نقص في الألبومين الخلوي. تظهر الدراسات في الشكل 2 والشكل 3 انخفاضا كبيرا في معدل تدفق كرات الدم الحمراء في الشعيرات الدموية الكبيبية والمحيطة بالأنبوب وتعزيز التصاق كرات الدم البيضاء. من المحتمل أن يكون الانخفاض في التدفق بسبب انسداد الشعيرات الدموية من التصاق WBC وتشكيلات الرولو.
لمزيد من تقييم الالتهاب ، قمنا بقياس نفاذية الألبومين وأظهرنا أنها تزيد عشرة أضعاف. بالإضافة إلى ذلك ، أظهرت الكبيبات المعزولة أن تعبير mRNA زاد للعديد من الجينات المعروفة سابقا بأنها تزداد في التهاب الكلى في مجموعة متنوعة من حالات أمراض الكلى17،19،20،21،22،23،24،25،26 . كانت الزيادات في كثافة سطح الكبيبات ونفاذية الألبومين تقدمية ، كما هو موضح في بيانات UUO لمدة 12 أسبوعا. البيانات الحالية هي الأولى التي تظهر بشكل مباشر أن الكبيبات تتعرض لأضرار هيكلية كبيرة والتهاب وتغيرات جزيئية في نموذج UUO. تتوافق النتائج مع دراسة سابقة لأنسجة الكلى الكاملة التي حللت خزعات كلى الأغنام بعد UUO ، ووجدت علامات التهاب متعددة مرتفعة19. تشير النتائج الحالية إلى وجود التهاب ملحوظ داخل الكبيبات ، وكان معروفا سابقا فقط بالأنسجة القشرية.
تختلف البيانات الحالية عن الدراسات السابقة في الفئران حيث لم يتم العثور على تغييرات في تعبير جزيء الالتصاق ، وترسب المكملات ، وتسلل العدلات بين 12 أسبوعا بعد استسقاء الكلية والكبيبات الطبيعية31. بالإضافة إلى ذلك ، استخدم مختبر هيكي نموذج UUO لمدة 12 أسبوعا لدراسة ردود الفعل المناعية في كبيبات الفئران. لم يجدوا أي اختلافات في تسلل العدلات بين كبيبات الفئران البالغة من العمر أربعة أسابيع والكبيبات التاليةللانسداد 32,33. أجريت هذه الدراسات اللاحقة بعد تصريف حوض الكلى المسدودة من البول. لم نفعل ذلك لأننا أردنا تحديد تأثير UUO على وظيفة الكبيبات كما سيكون في الجسم الحي ، دون إزالة السائل المسبب للانسداد بشكل مصطنع. أخيرا ، يتم استبدال استخدام UUO في الفئران بتصوير الكبيبات عند أكثر من 100 ميكرومتر تحت السطح. في حين أن ذلك ممكن ، هناك مقايضة في الدقة والشدة ، وكلاهما ينخفض بشكل كبير مع تجاوز واحد 50 ميكرومتر34.
النتائج المقدمة ليست مفاجئة إذا قام المرء بتجميع البيانات من الأدبيات الموجودة حول التغيرات النسيجية ، وتشكيل الكبيبات الأنبوبية ، والالتهاب ، والتليف ، وديناميكا الدم10،11،12. تشير البيانات المقدمة ، بما في ذلك التصاق WBC ، وتشكيلات الرولو ، وعلامات الالتهاب الجزيئي الكبيبي ، وزيادة نفاذية الألبومين ، إلى الالتهاب الشامل المستمر في نموذج UUO هذا حتى في خمسة أسابيع وموجود أيضا في اثني عشر أسبوعا. من الواضح أن UUO المزمن ليس حالة فسيولوجية ، واستخدام UUO للحث على الكبيبات السطحية يمثل نموذجا للإصابة. يمكن دراسة فئران MWF ، التي تحتوي على كبيبات سطحية في ظل الظروف الفسيولوجية ، طوليا عند حدوث الإصابة. من الممكن توليد فئران معدلة وراثيا ، ويقوم العديد من الباحثين بإنشائها باستخدام أجهزة استشعار حيوية لطرح أسئلة محددة. على وجه الخصوص ، تمتلك كلية الطب في ويسكونسن الآن مستعمرة من الفئران MWF وصنعت الفئران المعدلة وراثيا لغرض دراسة العمليات الكبيبية في ظل الظروف الفسيولوجية والمرضية. توفر فئران MWF هذه فرصة رائعة لدراسة العمليات الكبيبية في الفئران الطبيعية والمريضة والمعدلة وراثيا.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل المعهد الوطني للسكري ومنح أمراض الجهاز الهضمي والكلى RO1DK091623 و P30DK079312 (إلى B.A.M.). نشكر الموظفين في مرفق الجينوم الأساسي التابع لمرفق دعم تكنولوجيا الأبحاث (RTSF) في جامعة ولاية ميشيغان لإجراء تحليل الأوتار النانوية.
Materials
| Name | Company | Catalog Number | Comments |
| 70 µm sterile cell strainer | Corning | #421751 | |
| 100 µm sterile cell strainer | Corning | #421752 | |
| CA Micro scissors Model 1C300 | Electron Microscopy Sciences | Cat# 72930 | |
| Electric heating pad | Sunbeam | Kroger | |
| Handling Forceps | Electron Microscopy Sciences | Cat# 72962 | |
| Kelly Hemostatic Forceps (straight) | Electron Microscopy Sciences | Cat#72930 | |
| Leica Dive SP-8 Multi-Photon Inverted Microscope | Leica Microsystems | Note: Version 7.1r1 | |
| MaiTai DeepSee titanium-sapphire laser | Spectra-Physics | NA | |
| Mayo Dissecting Scissors | Electron Microscopy Sciences | Cat# 78180-1C3 | |
| Metamorph Image processing Software | Molecular Dynamics | Cat# 78266-04 | |
| Microsoft Excel | Microsoft Corportation | 2007 version | |
| Quant-iT RNA Assay Kit | Invitrogen/ThermoFisher | Q33140 | |
| Reptitherm Undertank Heater | Zoomed | Amazon | |
| RNeasy MinElute Cleanup Kit (Spin columns) | Qiagen | 74204 | |
| RPE buffer | Qiagen | 1018013 | |
| Strate-Line Autoclave Tape | Fisher Scientific | Cat# 11-889-1 | |
| TRI Reagent | Sigma | T9424 | |
| Willco-dish Coverslip Bottom Dishes (50 mm/40 mm coverslip) | Electron Microscopy Sciences | Cat# 70665-07 |
References
- Dunn, K. W., Molitoris, B. A., Dagher, P. C. The Indiana O'Brien center for advanced renal microscopic analysis. American Journal of Physiology-Renal Physiology. 320 (5), 671-682 (2021).
- Dunn, K. W., et al. Functional studies of the kidney of living animals using multicolor two-photon microscopy. American Journal of Physiology-Cell Physiology. 283 (3), 905-916 (2002).
- Eisenbach, G., Liew, J., Boylan, J., Manz, N., Muir, P. Effect of angiotensin on the filtration of protein in the rat kidney: a micropuncture study. Kidney International. 8 (2), 80-87 (1975).
- Sandoval, R. M., Molitoris, B. A. Intravital multiphoton microscopy as a tool for studying renal physiology and pathophysiology. Methods. 128, 20-32 (2017).
- Sandoval, R. M., Molitoris, B. A., Palygin, O. Fluorescent imaging and microscopy for dynamic processes in rats. Methods in Molecular Biology. 2018, 151-175 (2019).
- Huber, T., et al. Molecular basis of the functional podocin-nephrin complex: mutations in the NPHS2 gene disrupt nephrin targeting to lipid raft microdomains. Human Molecular Genetics. 12 (24), 3397-3405 (2003).
- Kawachi, H., Koike, H., Kurihara, H., Sakai, T., Shimizu, F. Cloning of rat homologue of podocin: expression in proteinuric states and in developing glomeruli. Journal of the American Society of Nephrology JASN. 14 (1), 46-56 (2003).
- Roselli, S., et al. Early glomerular filtration defect and severe renal disease in podocin-deficient mice. Molecular and Cellular Biology. 24 (2), 550-560 (2004).
- Schießl, I., Bardehle, S., Castrop, H. Superficial nephrons in BALB/c and C57BL/6 mice facilitate in vivo multiphoton microscopy of the kidney. PloS One. 8 (1), 52499 (2013).
- Chevalier, R., Forbes, M., Thornhill, B. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney International. 75 (11), 1145-1152 (2009).
- Forbes, M., Thornhill, B., Chevalier, R. Proximal tubular injury and rapid formation of atubular glomeruli in mice with unilateral ureteral obstruction: a new look at an old model. American Journal of Physiology. Renal physiology. 301 (1), 110-117 (2011).
- Yang, H. -. C., Zuo, Y., Fogo, A. B. Models of chronic kidney disease. Drug Discovery Today. Disease Models. 7 (1-2), 13-19 (2010).
- Hackl, M. J., et al. Tracking the fate of glomerular epithelial cells in vivo using serial multiphoton imaging in new mouse models with fluorescent lineage tags. Nature Medicine. 19 (12), 1661-1666 (2013).
- Kitching, A., Kuligowski, M., Hickey, M. In vivo imaging of leukocyte recruitment to glomeruli in mice using intravital microscopy. Methods in Molecular Biology. 466, 109-117 (2009).
- Savin, V. J., Terreros, D. A. Filtration in single isolated mammalian glomeruli. Kidney International. 20 (2), 188-197 (1981).
- Chomczynski, P., Sacchi, N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on. Nature Protocols. 1 (2), 581-585 (2006).
- El Karoui, K., et al. Endoplasmic reticulum stress drives proteinuria-induced kidney lesions via Lipocalin 2. Nature Communications. 7, 10330 (2016).
- VA, M., et al. Multiplexed measurements of gene signatures in different analytes using the Nanostring nCounter Assay System. BMC Research Notes. 2, 80 (2009).
- Springer, A., et al. A combined transcriptome and bioinformatics approach to unilateral ureteral obstructive uropathy in the fetal sheep model. The Journal of Urology. 187 (2), 751-756 (2012).
- Braun, F., Becker, J., Brinkkoetter, P. Live or let die: Is there any cell death in podocytes. Seminars in Nephrology. 36 (3), 208-219 (2016).
- Kim, W. The role of angiopoietin-1 in kidney disease. Electrolyte & Blood Pressure E & BP. 6 (1), 22-26 (2008).
- Liu, F., Zhuang, S. Role of receptor tyrosine kinase signaling in renal fibrosis. International Journal of Molecular Sciences. 17 (5), 972 (2016).
- Martini, S., et al. Integrative biology identifies shared transcriptional networks in CKD. Journal of the American Society of Nephrology: JASN. 25 (11), 2559-2572 (2014).
- Mühlberger, I., et al. Integrative bioinformatics analysis of proteins associated with the cardiorenal syndrome. International Journal of Nephrology. 2011, 809378 (2010).
- Satirapoj, B., et al. Periostin: novel tissue and urinary biomarker of progressive renal injury induces a coordinated mesenchymal phenotype in tubular cells. Nephrology, Dialysis, Transplantation. 27 (7), 2702-2711 (2012).
- Fengxin, Z., et al. Numb contributes to renal fibrosis by promoting tubular epithelial cell cycle arrest at G2/M. Oncotarget. 7 (18), 25604-25619 (2016).
- Sandoval, R. M., Molitoris, B. A. Quantifying glomerular permeability of fluorescent macromolecules using 2-photon microscopy in Munich Wistar rats. Journal of Visualized Experiments: JoVE. (74), e50052 (2013).
- Russo, L. M., et al. Impaired tubular uptake explains albuminuria in early diabetic nephropathy. Journal of the American Society of Nephrology: JASN. 20 (3), 489-494 (2009).
- Russo, L. M., et al. The normal kidney filters nephrotic levels of albumin retrieved by proximal tubule cells: retrieval is disrupted in nephrotic states. Kidney International. 71 (6), 504-513 (2007).
- Sandoval, R. M., Wang, E., Molitoris, B. A. Finding the bottom and using it: Offsets and sensitivity in the detection of low intensity values in vivo with 2-photon microscopy. Intravital. 2 (1), 23674 (2014).
- Kuligowski, M. P., Kitching, A. R., Hickey, M. J. Leukocyte recruitment to the inflamed glomerulus: a critical role for platelet-derived P-selectin in the absence of rolling. Journal of Immunology. 176 (11), 6991-6999 (2006).
- Devi, S., et al. Multiphoton imaging reveals a new leukocyte recruitment paradigm in the glomerulus. Nature Medicine. 19 (1), 107-112 (2013).
- Finsterbusch, M., et al. Patrolling monocytes promote intravascular neutrophil activation and glomerular injury in the acutely inflamed glomerulus. Proceedings of the National Academy of Sciences of the United States of America. 113 (35), 5172-5181 (2016).
- Shroff, U. N., Gyarmati, G., Izuhara, A., Deepak, S., Peti-Peterdi, J. A new view of macula densa cell protein synthesis. American Journal of Physiology. Renal Physiology. 321 (6), 689-704 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved