A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استكشاف استقلاب طاقة الميتوكوندريا من كرويات الأنسجة الدقيقة 3D واحدة باستخدام تحليل التدفق خارج الخلية
In This Article
Erratum Notice
Summary
ستساعد هذه البروتوكولات المستخدمين على التحقيق في استقلاب طاقة الميتوكوندريا في الكرويات المشتقة من خط الخلايا السرطانية 3D باستخدام تحليل التدفق خارج الخلية من فرس البحر.
Abstract
أصبحت المجاميع الخلوية ثلاثية الأبعاد (3D) ، والتي يطلق عليها كرويات ، في طليعة زراعة الخلايا في المختبر في السنوات الأخيرة. على النقيض من زراعة الخلايا كطبقات أحادية ثنائية الأبعاد وأحادية الخلية (ثقافة 2D) ، فإن زراعة الخلايا الكروية تعزز وتنظم وتدعم البنية الخلوية الفسيولوجية والخصائص الموجودة في الجسم الحي ، بما في ذلك التعبير عن بروتينات المصفوفة خارج الخلية ، وإشارات الخلية ، والتعبير الجيني ، وإنتاج البروتين ، والتمايز ، والانتشار. تم الاعتراف بأهمية ثقافة 3D في العديد من المجالات البحثية ، بما في ذلك علم الأورام والسكري وبيولوجيا الخلايا الجذعية وهندسة الأنسجة. على مدى العقد الماضي ، تم تطوير طرق محسنة لإنتاج الكرويات وتقييم وظيفتها الأيضية ومصيرها.
تم استخدام محللات التدفق خارج الخلية (XF) لاستكشاف وظيفة الميتوكوندريا في الأنسجة الدقيقة ثلاثية الأبعاد مثل الكرويات باستخدام إما لوحة التقاط جزيرة XF24 أو صفيحة كروية XFe96. ومع ذلك ، لم يتم وصف البروتوكولات المتميزة وتحسين استقلاب طاقة الميتوكوندريا في الكرويات باستخدام تقنية XF بالتفصيل. يقدم هذا البحث بروتوكولات مفصلة للتحقيق في استقلاب طاقة الميتوكوندريا في كرويات 3D واحدة باستخدام لوحات كروية كروية مع محلل XFe96 XF. باستخدام خطوط الخلايا السرطانية المختلفة ، أثبتت تقنية XF أنها قادرة على التمييز بين التنفس الخلوي في كرويات 3D ليس فقط بأحجام مختلفة ولكن أيضا بأحجام مختلفة وأرقام خلايا ومحتوى الحمض النووي ونوعه.
يتم استخدام تركيزات مركب تأثير الميتوكوندريا الأمثل من oligomycin, BAM15, rotenone, and antimycin A للتحقيق في معلمات محددة من استقلاب طاقة الميتوكوندريا في كرويات ثلاثية الأبعاد. تناقش هذه الورقة أيضا طرق تطبيع البيانات التي تم الحصول عليها من الكرويات وتتناول العديد من الاعتبارات التي يجب مراعاتها عند استكشاف التمثيل الغذائي الكروي باستخدام تقنية XF. سيساعد هذا البروتوكول في دفع البحث في النماذج الكروية المتقدمة في المختبر .
Introduction
التقدم في النماذج المخبرية في البحوث البيولوجية قد تقدم بسرعة على مدى السنوات ال 20 الماضية. وتشمل هذه النماذج الآن طرائق العضوية على رقاقة ، والأعضاء العضوية ، وكرويات الأنسجة الدقيقة 3D ، وكلها أصبحت تركيزا مشتركا لتحسين الترجمة بين الدراسات في المختبر وفي الجسم الحي. يمتد استخدام النماذج المتقدمة في المختبر ، وخاصة الكروية ، إلى العديد من المجالات البحثية ، بما في ذلك هندسة الأنسجة ، وأبحاث الخلايا الجذعية ، والسرطان ، وبيولوجيا الأمراض1،2،3،4،5،6،7 ، واختبار السلامة ، بما في ذلك علم السموم الوراثي8،9،10 ، علم السموم للمواد النانوية 11 ، 12,13,14، واختبار سلامة الأدوية وفعاليتها 8,15,16,17,18,19.
مورفولوجيا الخلية الطبيعية أمر بالغ الأهمية للنمط الظاهري البيولوجي والنشاط. تسمح زراعة الخلايا في كرويات الأنسجة الدقيقة 3D للخلايا باعتماد مورفولوجيا ، ووظيفة النمط الظاهري ، والهندسة المعمارية ، أقرب إلى تلك التي لوحظت في الجسم الحي ولكن من الصعب التقاطها باستخدام تقنيات زراعة الخلايا أحادية الطبقة الكلاسيكية. في كل من الجسم الحي والمختبر ، تتأثر الوظيفة الخلوية بشكل مباشر بالبيئة الدقيقة الخلوية ، والتي لا تقتصر على الاتصالات الخلوية والبرمجة (على سبيل المثال ، تكوينات تقاطع الخلايا الخلوية ، وفرص تشكيل منافذ الخلية) ؛ تعرض الخلايا للهرمونات وعوامل النمو في البيئات المباشرة (على سبيل المثال ، التعرض الخلوي للسيتوكين كجزء من الاستجابة الالتهابية) ؛ تكوين المصفوفات الفيزيائية والكيميائية (على سبيل المثال ، ما إذا كانت الخلايا تزرع في البلاستيك المزروع بالأنسجة الصلبة أو بيئة الأنسجة المرنة) ؛ والأهم من ذلك ، كيف يتأثر التمثيل الغذائي الخلوي بالتغذية والحصول على الأكسجين وكذلك معالجة منتجات النفايات الأيضية مثل حمض اللاكتيك.
تحليل التدفق الأيضي هو وسيلة قوية لفحص التمثيل الغذائي الخلوي داخل أنظمة المختبر المحددة. وعلى وجه التحديد، تسمح تقنية XF بتحليل التغيرات الحية في الوقت الفعلي في الطاقة الحيوية الخلوية للخلايا والأنسجة السليمة. بالنظر إلى أن العديد من الأحداث الأيضية داخل الخلايا تحدث في غضون ثوان إلى دقائق ، فإن النهج الوظيفية في الوقت الفعلي لها أهمية قصوى لفهم التغيرات في الوقت الفعلي في التدفق الأيضي الخلوي في الخلايا والأنسجة السليمة في المختبر.
تقدم هذه الورقة بروتوكولات لزراعة خطوط الخلايا المشتقة من السرطان A549 (السرطان الغدي الرئوي) ، HepG2 / C3A (سرطان الخلايا الكبدية) ، MCF-7 (سرطان الثدي الغدي) ، و SK-OV-3 (سرطان المبيض الغدي) كما هو الحال في نماذج كروية ثلاثية الأبعاد في المختبر باستخدام نهج التجميع القسري (الشكل 1). كما يصف (i) بالتفصيل كيفية التحقيق في استقلاب طاقة الميتوكوندريا للكرويات ثلاثية الأبعاد المفردة باستخدام محلل Agilent XFe96 XF ، (ii) يسلط الضوء على طرق تحسين اختبارات XF باستخدام كرويات 3D واحدة ، و (iii) يناقش الاعتبارات والقيود المهمة للتحقيق في التمثيل الغذائي الكروي ثلاثي الأبعاد باستخدام هذا النهج. الأهم من ذلك ، تصف هذه الورقة كيفية جمع مجموعات البيانات التي تسمح بحساب معدل استهلاك الأكسجين (OCR) لتحديد الفسفرة التأكسدية وبالتالي وظيفة الميتوكوندريا في الكرويات الخلوية. على الرغم من عدم تحليله لهذا البروتوكول ، إلا أن معدل التحمض خارج الخلية (ECAR) هو معلمة أخرى يتم قياسها جنبا إلى جنب مع بيانات OCR في تجارب XF. ومع ذلك، غالبا ما يتم تفسير ECAR بشكل سيئ أو غير صحيح من مجموعات بيانات XF. نحن نقدم تعليقا على قيود حساب ECAR باتباع الأساليب الأساسية من الشركة المصنعة للتكنولوجيا.
Access restricted. Please log in or start a trial to view this content.
Protocol
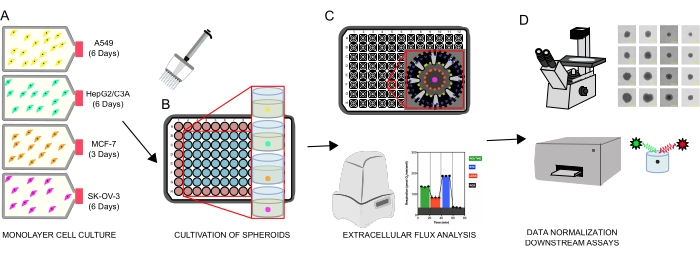
الشكل 1: سير العمل الرسومي لتوليد الكرويات الخلوية وتحليل التدفق خارج الخلية والمقايسات النهائية. تم استزراع أربعة خطوط خلايا سرطانية بشكل انتقائي كطبقات أحادية (A) ، منفصلة عن قوارير زراعة الأنسجة ، وزرعت في صفائح دقيقة منخفضة للغاية من 96 بئرا لتشكيل كرويات (B). تم زرع سرطان الرئة A549 ، وسرطان الكبد HepG2 / C3A ، وسرطان المبيض الغدي SK-OV-3 ، وخلايا سرطان الثدي MCF-7 في 1 × 10 3-8 × 103 خلايا / بئر ونمت لمدة تصل إلى 7 أيام لتشكيل كرويات واحدة وتحسين كثافة البذر الكروي ووقت الزراعة عن طريق المراقبة المستمرة والقياسات المستوية. بمجرد تشكيلها ، تم غسل الكرويات المفردة في وسط XF خال من المصل وزرعها بعناية في صفائح دقيقة للفحص الكروي ، مغلفة مسبقا ب poly-D-lysine (C). خضعت الكرويات لتحليل التدفق خارج الخلية باستخدام محلل XFe96 باستخدام عدة بروتوكولات لمعالجة: (1) الحجم الكروي الأمثل لاستجابة التنفس الميتوكوندريا القاعدية. (2) المعايرة المحسنة لمثبطات الجهاز التنفسي الميتوكوندريا ؛ (3) تحسين وضع الكروية داخل الآبار الصغيرة. (د) استخدمت تحليلات ما بعد XF، والفحص المجهري لتباين الطور، وتحديد كمية الحمض النووي الكروي لتطبيع البيانات وغيرها من الفحوص المخبرية في المراحل النهائية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. زراعة خطوط الخلايا السرطانية كما 3D في كرويات المختبر
| خط الخلية | وصف | الوسط الثقافي | مصدر |
| إيه 549 | خط خلايا سرطان الرئة | RPMI 1640 | المجموعة الأوروبية من مزارع الخلايا الموثقة (ECACC) |
| بيروفات الصوديوم (1 ملليمتر) | |||
| البنسلين - الستربتومايسين - (100 U / مل - 100 ملغ / مل) | |||
| 10٪ (v/v) FBS | |||
| HepG2/C3A | خط خلايا سرطان الكبد ، وهو مشتق نسيلي من خط خلية HepG2 الأصلي | DMEM | مجموعة زراعة الأنسجة الأمريكية (ATCC) |
| البنسلين - الستربتومايسين - (100 U / مل - 100 ملغ / مل) | |||
| 10٪ (v/v) FBS | |||
| MCF7 | خط خلايا سرطان الثدي الغدي | RPMI 1640 | المجموعة الأوروبية من مزارع الخلايا الموثقة (ECACC) |
| بيروفات الصوديوم (1 ملليمتر) | |||
| البنسلين - الستربتومايسين - (100 U / مل - 100 ملغ / مل) | |||
| 10٪ (v/v) FBS | |||
| SK-OV-3 | خط خلايا سرطان المبيض الغدي | RPMI 1640 | المجموعة الأوروبية من مزارع الخلايا الموثقة (ECACC) |
| بيروفات الصوديوم (1 ملليمتر) | |||
| البنسلين - الستربتومايسين - (100 U / مل - 100 ملغ / مل) | |||
| 10٪ (v/v) FBS | |||
| مكون | متوسط فحص RPMI (حجم نهائي 50 مل) | ||
| قاعدة متوسطة | فرس البحر الرقيق XF RPMI، درجة الحموضة 7.4 | ||
| الجلوكوز (1 مليون مخزون معقم) | 11 مللي متر (0.55 مل من محلول المخزون) | ||
| L-الجلوتامين (200 مللي متر مخزون معقم) | 2 ملليمتر (0.5 مل من محلول المخزون) | ||
| بيروفات الصوديوم (مخزون معقم 100 ملليمتر) | 1 ملليمتر (0.5 مل من محلول المخزون) |
الجدول 1: وسائط خط الخلايا السرطانية وتركيبات وسائط XF.
- استزرع جميع خطوط الخلايا باستخدام تقنية زراعة الأنسجة المعقمة القياسية وتأكد من خلوها من الميكوبلازما باستخدام مجموعة فحص مناسبة.
- استزرع خطوط الخلايا في قوارير زراعة الأنسجة T75 أو ما يعادلها ، باستخدام الوسط الموصى به (الجدول 1). قم بزراعة خطوط الخلايا إلى 65-80٪ من الالتقاء ومرورها بانتظام بحد أقصى 25 مقطعا.
- اشطف قوارير زراعة الخلايا مرتين في محلول ملحي معدل مخزن بالفوسفات (DBPS) من دولبيكو.
- افصل الخلايا عن القوارير ب 3 مل من كاشف تفكك الخلية (انظر جدول المواد) لمدة 5 دقائق عند 37 درجة مئوية وتأكد من الانفصال عن طريق الفحص المجهري.
- قم بشفط تعليق الخلية المنفصل بلطف لضمان تعليق خلية واحدة وإلغاء تنشيط كاشف تفكك الخلية باستخدام 7 مل من وسط زراعة الأنسجة الكامل.
- جمع الخلايا عن طريق الطرد المركزي في 300 × غرام لمدة 5 دقائق، والتخلص من supernatant، وإعادة تعليق الخلايا في وسط كامل.
- عد الخلايا باستخدام مقياس الدم أو عداد الخلايا الآلي ومعايرة كثافة الخلايا المطلوبة المطلوبة للبذر.
ملاحظة: لزرع صفيحة كاملة من 96 بئرا عند 100 ميكرولتر / بئر عند 4 × 103 خلايا / بئر ، يجب معايرة الخلايا إلى 4 × 104 خلايا / مل في حجم موصى به من 12 مل. - قم بصب تعليق الخلية في خزان معقم وقم بتوزيع 100 ميكرولتر من تعليق الخلية في كل بئر من صفيحة صغيرة طاردة للخلايا باستخدام ماصة متعددة القنوات.
ملاحظة: يجب فقط زرع 60 بئرا داخلية من صفيحة صغيرة وملء الباقي ب DPBS. سيشكل هذا حاجزا للتبخر ، ويضمن التجانس الكروي عبر اللوحة ، ويقلل من تأثيرات حافة اللوحة. - الصفائح الكروية المجهرية لأجهزة الطرد المركزي عند 300 × جم لمدة 15 دقيقة لإجبار الخلايا على الدخول في مجاميع فضفاضة.
- احتضان الألواح عند 37 درجة مئوية ، 5٪ CO2 لمدة لا تقل عن 3 أيام لضمان تكوين كروية.
- إجراء الفحص المجهري لتباين الطور باستخدام الممارسات المختبرية الموحدة لمراقبة نمو الكرويات. قم بتجديد وسط زراعة الخلايا كل 3 أيام أو مرتين أسبوعيا عن طريق إجراء تبادل متوسط نصف حجم.
2. فحص استقلاب طاقة الميتوكوندريا للكرويات المفردة باستخدام تقنية التدفق خارج الخلية (XF)
- إعداد الفحص (قبل يوم واحد)
- تحقق من الجدوى الكروية باستخدام مجهر ضوئي مقلوب مع تباين الطور عند تكبير 4x لضمان بنية كروية سليمة ومورفولوجيا وتوحيد عام بين العينات.
- قم بترطيب خرطوشة المستشعر.
- Aliquot ~ 20 مل من المعايرة في أنبوب مخروطي.
- ضع الأنبوب المخروطي الذي يحتوي على المعايرة في حاضنة غير CO2 37 °C بين عشية وضحاها.
- قم بإزالة المحتويات من مجموعة أدوات الفحص.
- قم بإزالة خرطوشة المستشعر من لوحة الأداة المساعدة وضعها رأسا على عقب على سطح العمل بجوار لوحة الأداة المساعدة.
- ماصة 200 ميكرولتر من DDH2O المعقمة في كل بئر من لوحة الأداة المساعدة لخرطوشة المستشعر باستخدام ماصة P300 متعددة القنوات.
- ضع خرطوشة المستشعر أعلى لوحة الأداة المساعدة.
- تحقق من أن مستوى المياه في كل بئر مرتفع بما يكفي لغمر مجسات الاستشعار.
- انقل خرطوشة المستشعر المجمعة إلى حاضنة غير CO2 37 درجة مئوية واتركها طوال الليل.
ملاحظة: يمكن تنفيذ هذه الخطوة قبل 12-72 ساعة من بدء الفحص.
- معطف كروية فحص microplate
- باستخدام تقنيات التعقيم ، أضف 30 ميكرولتر / بئر من محلول Poly-D-Lysine المعقم (0.1 mg / mL) إلى الصفيحة الدقيقة الكروية واحتضنها لمدة 30 دقيقة في درجة حرارة الغرفة.
- قم بشفط المحلول من كل بئر من الصفيحة الدقيقة الكروية ، وعكس اللوحة ، واضغط عليها بقوة على المناديل الورقية لإزالة أي محلول متبقي.
- اغسل الطبق مرتين باستخدام 200 ميكرولتر / بئر من DDH2O المعقم.
- بعد الغسيل النهائي ، اقلب الصفيحة الدقيقة واضغط عليها بقوة على المناديل الورقية لإزالة أي ماء متبقي.
- اترك اللوحة لتجف في الهواء لمدة 30 دقيقة قبل استخدامها أو تخزينها عند 4 درجات مئوية للاستخدام في المستقبل.
ملاحظة: يجب طلاء الصفيحة الدقيقة للفحص الكروي بمادة لاصقة جزيئية لضمان تثبيت الكرويات في الجزء السفلي من الصفيحة الدقيقة. بدون مادة لاصقة جزيئية ، يمكن أن يتم إزاحة الكرويات وتتداخل مع نتائج الفحص. يمكن أيضا استخدام مواد لاصقة جزيئية أخرى كبديل ل Poly-D-Lysine لألواح الطلاء المسبق. يمكن تخزين الألواح المطلية مسبقا عند 4 درجات مئوية ولكن يجب تركها لتوازن درجة حرارة الغرفة قبل بدء الفحص.
- إعداد XF فحص المتوسطة
- تحضير وسيط XF RPMI، كما هو مفصل في الجدول 1، ومرشح معقم بفلتر حقنة 0.22 ميكرومتر
- إعداد الفحص (1 ساعة قبل الفحص)
- قم بتسخين فحص XF RPMI المكمل بدرجة حرارة متوسطة إلى 37 درجة مئوية.
- قم بتسخين صفيحة الفحص الكروية المطلية مسبقا في حاضنة غير CO2 37 °C أو حمام جاف.
- قم بإعداد خرطوشة المستشعر.
- أخرج الأنبوب المخروطي الذي يحتوي على المعايرة وخرطوشة المستشعر من حاضنة الهواء.
- قم بإزالة خرطوشة المستشعر من لوحة الأداة المساعدة وضعها رأسا على عقب على سطح العمل.
- باستخدام ماصة P300 متعددة القنوات ، استنشق الماء من لوحة المرافق وتخلص منها.
- صب محلول المعايرة في خزان كاشف معقم وأضف 200 ميكرولتر / بئر من المعايرة المسخنة مسبقا إلى لوحة المرافق باستخدام ماصة P300 متعددة القنوات.
- التقط خرطوشة المستشعر وضعها مرة أخرى أعلى لوحة الأداة المساعدة، مما يضمن غمر المستشعرات جيدا في العيار.
- انقل خرطوشة المستشعر المجمعة مرة أخرى إلى الحاضنة غير CO2 37 °C حتى تصبح جاهزة لتحميل حلول حقن المنفذ.
- اغسل الكرويات باستخدام وسيط الفحص.
- قم بإزالة لوحة الاستزراع الكروي من حاضنة 37 درجة مئوية ، 5٪ CO2 وراقب الكرويات تحت المجهر لضمان سلامتها قبل خطوات النقل الكروية.
- قم بتحميل جميع آبار اللوحة الكروية ب 180 ميكرولتر / بئر من وسط الفحص المحمي مسبقا ، بما في ذلك أي آبار تصحيح الخلفية.
- املأ جزئيا طبق بتري 7 سم ب 3 مل من وسط الفحص.
- باستخدام ماصة متعددة القنوات محملة بأطراف ماصة فتحة عريضة ، انقل الكرويات من لوحة الاستزراع 96 بئرا إلى أطباق بتري 7 سم عن طريق ضبط الماصة على حجم شفط يتراوح بين 10 و 50 ميكرولتر.
- كرويات البذور في الصفائح الدقيقة لفحص كروي مغلف مسبقا.
- باستخدام مجهر تشريح وجهاز لايت بوكس، انقل الكرويات من طبق بتري إلى صفيحة الفحص الكروية كما هو مفصل أدناه.
- اضبط حجم ماصة أحادية القناة مزودة بطرف ماصة فتحة عريضة على 20 ميكرولتر وقم بشفط كروي واحد بعناية. ضع الطرف مباشرة في وسط كل بئر من الصفيحة الدقيقة للفحص الكروي واسمح للجاذبية بإخراج كروي واحد في وسط كل بئر ، أي لا تطرد أي وسط من طرف الماصة وتسمح للعمل الشعري بسحب الكروية من طرف الماصة. لتأكيد الاستخلاص ، يمكن إعادة محتويات الماصة إلى طبق بتري 7 سم تحت المجهر.
ملاحظة: عادة ما يستغرق إزالة الجاذبية من كروي واحد 15-30 ثانية اعتمادا على حجم/كثافة الكروي. خلال هذا الوقت ، لا ينبغي إزالة الماصة. يجب أن تكون أي آبار تصحيح خلفية خالية من الكرويات وتحتوي فقط على وسيط مقايسة. تحت المجهر ، تأكد من موضع كل كروي. يجب وضع كل كروي بشكل مثالي داخل وسط كل بئر. - بمجرد نقل جميع الكرويات إلى الصفيحة الدقيقة للفحص الكروي ، انقل اللوحة إلى حاضنة غير CO2 عند 37 درجة مئوية لمدة لا تقل عن 1 ساعة قبل الفحص.
- اضبط حجم ماصة أحادية القناة مزودة بطرف ماصة فتحة عريضة على 20 ميكرولتر وقم بشفط كروي واحد بعناية. ضع الطرف مباشرة في وسط كل بئر من الصفيحة الدقيقة للفحص الكروي واسمح للجاذبية بإخراج كروي واحد في وسط كل بئر ، أي لا تطرد أي وسط من طرف الماصة وتسمح للعمل الشعري بسحب الكروية من طرف الماصة. لتأكيد الاستخلاص ، يمكن إعادة محتويات الماصة إلى طبق بتري 7 سم تحت المجهر.
- باستخدام مجهر تشريح وجهاز لايت بوكس، انقل الكرويات من طبق بتري إلى صفيحة الفحص الكروية كما هو مفصل أدناه.
3. إعداد وتحميل المركبات في خرطوشة الاستشعار لاختبارات XF
| استراتيجية الحقن | كمبوند (ميناء) | XFe96 حجم بدء تشغيل البئر الصغير (ميكرولتر) | تركيز البئر النهائي المطلوب | حجم المنفذ (ميكرولتر) | النهائي XFe96 ميكروويل حجم ما بعد الحقن (ميكرولتر) | تركيز المخزون العامل |
| 1 | أوليغوميسين (أ) | 180 | 3 ميكروغرام/مل | 20 | 200 | 30 ميكروغرام/مل |
| روتينون (ب) | 200 | 2 ميكرومتر | 20 | 220 | 22 ميكرومتر | |
| أنتيميسين أ (ب) | 200 | 2 ميكرومتر | 20 | 220 | 22 ميكرومتر | |
| 2 | BAM15 (أ) | 180 | 5 ميكرومتر | 20 | 200 | 50 ميكرومتر |
| روتينون (ب) | 200 | 2 ميكرومتر | 20 | 220 | 22 ميكرومتر | |
| أنتيميسين أ (ب) | 200 | 2 ميكرومتر | 20 | 220 | 22 ميكرومتر |
الجدول 2: تركيزات مركبات الميتوكوندريا للتحقيق في استقلاب طاقة الميتوكوندريا للكرويات ثلاثية الأبعاد المفردة باستخدام محلل XFe96.
- قم بإعداد تركيزات مخزون العمل لكل مركب كما هو مذكور في الجدول 2 باستخدام وسيط فحص XF RPMI المكمل بالكامل والمسخن مسبقا.
- قم بتوجيه لوحة الخرطوشة (مقترنة بلوحة الأداة المساعدة) من الناحية العمودية ، 1-12 من اليسار إلى اليمين.
- في حالة استخدام دليل تحميل، ضعه فوق لوحة الخرطوشة وفقا لإجراء التحميل الجيد، على سبيل المثال، إذا تم تحميل المنفذ A أولا، فتأكد من أن A مرئي في الزاوية العلوية اليمنى من الدليل.
- انقل محلول العمل لكل مركب إلى خزان مناسب ، وباستخدام ماصة P100 متعددة القنوات معايرة ، قم بتوزيع 20 ميكرولتر في جميع المنافذ المقابلة. كرر لكل مركب في المنافذ المتبقية.
ملاحظة: إذا لم يتم استخدام أي منافذ على لوحة خرطوشة المستشعر، فيمكن تركها فارغة أو تعبئتها بوسيط الفحص. إذا تم استخدام مجموعة مختارة فقط من خطاب منفذ معين ، فتأكد من تحميل المنافذ الأخرى المقابلة لذلك الحرف بوسيط فحص ؛ خلاف ذلك ، سيتم حقن الهواء في البئر ، مما يعرض للخطر النتائج في تلك الآبار. - بعد تحميل المنفذ، قم بإزالة أدلة تحميل اللوحة (إذا تم استخدامها) وقم بإعداد المحلل لتحميل خرطوشة المستشعر.
ملاحظة: إذا لم يتم تشغيل الفحص مباشرة بعد تحميل المنافذ، فضع الغطاء مرة أخرى على خرطوشة المستشعر وضع اللوحة مرة أخرى في حاضنة الهواء التي تبلغ درجة حرارتها 37 درجة مئوية حتى تصبح جاهزة للتحميل في الماكينة.
4. تصميم المقايسة واستراتيجيات الحقن والحصول على البيانات
- إجراء الفحص
- قم بتشغيل المحلل والاتصال بوحدة التحكم (الكمبيوتر).
ملاحظة: يمكن التحقق من ذلك من خلال حالة اتصال الجهاز في لوحة عنصر واجهة المستخدم في برنامج Wave Controller. - انتقل إلى صفحة القوالب في برنامج WAVE ، وابحث عن ملف قالب الفحص للتجربة وانقر نقرا مزدوجا فوقه لفتحه.
ملاحظة: إذا لم يظهر قالب الفحص في طريقة عرض القوالب ، فقم باستيراد ملف القالب إلى مجلد القالب من محرك أقراص شبكة مشترك أو محرك أقراص USB محمول. - لبدء الفحص، انقر فوق علامة التبويب تشغيل المقايسة .
ملاحظة: إذا تم تخصيص تعريفات المجموعة بشكل صحيح داخل خريطة اللوحة، فسيكون الفحص جاهزا للتشغيل كما هو موضح في العلامة الخضراء على الجانب الأيمن من الصفحة. في هذه المرحلة ، يمكن إدخال أي معلومات إضافية في صفحة ملخص الفحص أو الصفحة التي تركت فارغة ؛ انتقل إلى الخطوة التالية. نظرا لتأخر اختراق معدلات الميتوكوندريا في كرويات الأنسجة الدقيقة ثلاثية الأبعاد (الشكل 2) ، استخدم معلومات بروتوكول القياس الموضحة في الجدول 3.
- قم بتشغيل المحلل والاتصال بوحدة التحكم (الكمبيوتر).
| فترة القياس | رقم الحقن والمنفذ | تفاصيل القياس | مدة الفترة (h:min:s) |
| المعايره | لا ينطبق | يقوم محللو XF دائما بإجراء هذه المعايرة للتأكد من دقة القياسات | 00:20:00 (هذا متوسط ويمكن أن يختلف بين الآلات) |
| التكافؤ | لا ينطبق | يحدث التوازن بعد المعايرة ويوصى به. | 00:10:00 |
| القاعديه | لا ينطبق | الدورات = 5 | 00:30:00 |
| مزيج = 3:00 | |||
| الانتظار = 0:00 | |||
| القياس = 3:00 | |||
| أوليغوميسين / BAM15 | الحقن 1 (المنفذ A) | الدورات = 10 | 01:00:00 |
| مزيج = 3:00 | |||
| الانتظار = 0:00 | |||
| القياس = 3:00 | |||
| روتينون + مضاد للمايسين أ | الحقن 2 (المنفذ B) | الدورات = 10 | 01:00:00 |
| مزيج = 3:00 | |||
| الانتظار = 0:00 | |||
| القياس = 3:00 | |||
| مجموع الوقت: | 03:00:00 | ||
الجدول 3: إعداد البروتوكول للتحقيق في استقلاب طاقة الميتوكوندريا للكرويات ثلاثية الأبعاد المفردة باستخدام محلل XFe96.
- انقر فوق بدء التشغيل لإظهار مربع الحوار حفظ الموقع .
- أدخل موقع الحفظ لملف النتيجة، وضع خرطوشة المستشعر المجمعة على الدرج الحراري الذي يظهر من الباب على جانب المحلل. انتظر حتى يتم فتح الدرج الحراري تلقائيا والشاشة لعرض رسالة لوحة الأداة المساعدة معايرة التحميل . قبل اتباع المطالبات التي تظهر على الشاشة، تأكد من أ) الملاءمة المناسبة لخرطوشة المستشعر على لوحة الأداة المساعدة، وب) إزالة الغطاء من خرطوشة المستشعر، و ج) الاتجاه الصحيح لخرطوشة المستشعر على لوحة الأداة المساعدة.
- اتبع الأوامر التي تظهر على الشاشة لبدء معايرة خرطوشة المستشعر.
ملاحظة: الوقت المستغرق لإكمال المعايرة هو حوالي 10-20 دقيقة (للمقايسات عند 37 درجة مئوية). - بعد معايرة خرطوشة المستشعر، قم بتحميل الصفيحة الدقيقة الكروية في المحلل باتباع الإرشادات التي تظهر على الشاشة على وحدة تحكم الموجة لبدء خطوة التوازن لمدة 12 دقيقة.
ملاحظة: تشير المربعات الخضراء ذات العلامات البيضاء إلى معايرة "جيدة" لهذا البئر. إذا فشلت أي آبار في توفير معايرة "جيدة" ، الإشارة إليها بصندوق أحمر وصليب أبيض. يجب ملاحظة هذه الآبار واستبعادها من أي تحليل بعد اكتمال الفحص باستخدام علامة التبويب فحص التعديل . - انتظر حتى يبدأ المحلل تلقائيا في الحصول على قياسات خط الأساس بعد أن يكمل الجهاز خطوة التوازن (كما هو موضح في بروتوكول الأداة).
- لإكمال التجربة، اتبع الأوامر التي تظهر على الشاشة على وحدة تحكم WAVE.
ملاحظة: بمجرد إزالة الصفيحة الدقيقة الكروية من المحلل ، تخلص من خرطوشة المستشعر واترك اللوحة الكروية جانبا لمزيد من التحليل إذا لزم الأمر (على سبيل المثال ، تحديد كمية الحمض النووي المزدوج (ds). إذا لم تكن اللوحة الدقيقة مطلوبة لمزيد من التحليل ، فيمكن التخلص منها مع خرطوشة المستشعر. - انتظر حتى يظهر مربع حوار الفحص وعرض النتائج أو العودة إلى طريقة عرض القوالب .
5. استراتيجيات تطبيع البيانات وتحليلها - تطبيع ما بعد الفحص والمقايسات النهائية (خطوات اختيارية)
- تطبيع البيانات
- لتطبيع البيانات الكروية، ارجع إلى سلسلة البروتوكولات ذات الصلة باستراتيجيات تطبيع البيانات لحساب حجم الكروية وحجمها وتحديد حجم dsDNA كميا في الفحوصات الكروية. وقد أدرجت هذه الملفات كملفات تكميلية؛ انظر الملف التكميلي 1 والملف التكميلي 2.
- تحليل البيانات
- لتصدير البيانات إلى أحد مولدات التحليل التلقائي، اتبع أوامر تصدير البيانات الموجودة على وحدة تحكم WAVE وحدد مولد التصدير الذي يطابق نوع المقايسة. بدلا من ذلك ، قم بتصدير ملف البيانات وتحميله إلى تحليلات Seahorse.
ملاحظة: الجانب السلبي لمولدات التقارير وتحليلات Seahorse هو أن تحليل البيانات يقتصر على كيفية تصميم اختبار XF ولا يسمح بأخذ المتوسطات عبر دورات القياس. يسمح التصدير اليدوي لمجموعات البيانات من برنامج الأداة بتفضيل المستخدم في هذا الصدد. بالنظر إلى أن استراتيجية الحقن لتقييم التنفس الميتوكوندريا للكرويات 3D من المرجح أن تختلف عن تلك الخاصة باختبار "MitoStress" النموذجي ، فقد تم تطوير سلسلة من قوالب جداول البيانات للمساعدة في تحليل مجموعات البيانات هذه ، الخاصة بمزارع الخلايا 3D وسيتم توفيرها عند الطلب. ستوفر ملفات قوالب البيانات هذه بيانات عن المعلمات التنفسية الرئيسية للميتوكوندريا المفصلة والمفسرة في الشكل 2. - لتحليل البيانات، قم بتصدير البيانات كتقرير جدول بيانات من برنامج وحدة تحكم WAVE واستخدم قالب جدول بيانات مستقل للتحليل.
- لتصدير البيانات إلى أحد مولدات التحليل التلقائي، اتبع أوامر تصدير البيانات الموجودة على وحدة تحكم WAVE وحدد مولد التصدير الذي يطابق نوع المقايسة. بدلا من ذلك ، قم بتصدير ملف البيانات وتحميله إلى تحليلات Seahorse.
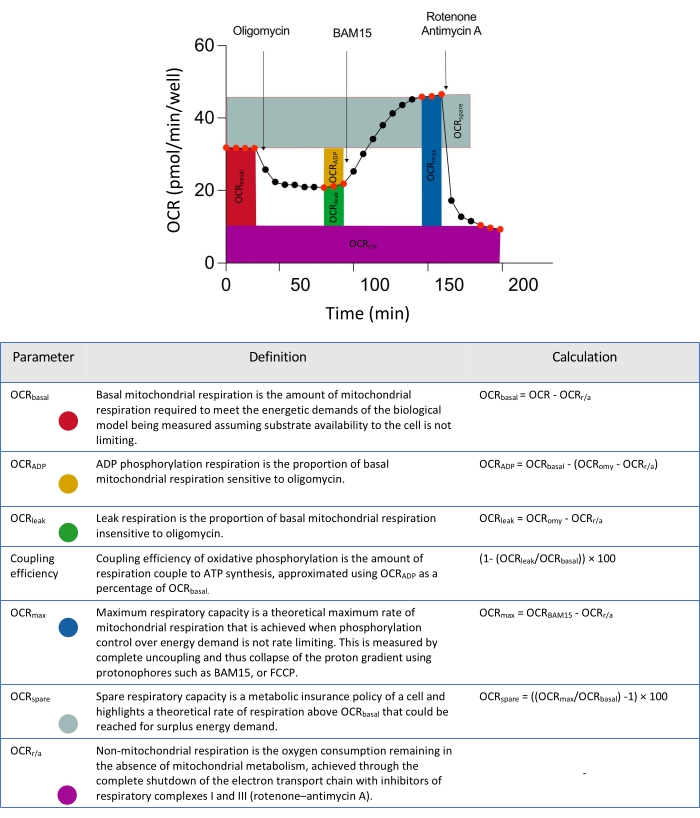
الشكل 2: الواصفات التخطيطية للمعلمات المستمدة من تحليلات بيانات التدفق خارج الخلية. اختصار: OCR = معدل استهلاك الأكسجين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
النتائج
للحصول على كرويات مدمجة جيدة التكوين ، تم تحسين كل خط خلية بشكل فردي لكثافة البذر ومدة الزراعة (الشكل 3). شكلت خطوط الخلايا A549 و HepG2 / C3A و SK-OV-3 في البداية مجاميع فضفاضة لم تتطور إلى كرويات مستديرة ذات محيط محدد بوضوح إلا بعد 7 أيام في الثقافة. على العكس من ذلك ، يمكن أن تشكل خلاي?...
Access restricted. Please log in or start a trial to view this content.
Discussion
ثالثا - النتائج والنواتج الرئيسية
توفر هذه الورقة بروتوكولا مفصلا للتحقيق في استقلاب طاقة الميتوكوندريا للكرويات المفردة 3D باستخدام سلسلة من خطوط الخلايا المشتقة من السرطان مع محلل XFe96 XF. تم تطوير ووصف طريقة للزراعة السريعة للكرويات الخلوية A549 و HepG2 / C3A و MCF7 و SK-OV-3 باستخدام تقني?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان.
Acknowledgements
تم دعم N.J.C بجائزة قضية BBSRC MIBTP مع Sygnature Discovery Ltd (BB / M01116X / 1 ، 1940003)
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| A549 | ECACC | #86012804 | Lung carcinoma cell line |
| Agilent Seahorse XF RPMI Medium, pH 7.4 | Agilent Technologies Inc. | 103576-100 | XF assay medium with 1 mM HEPES, without phenol red, sodium bicarbonate, glucose, L-glutamine, and sodium pyruvate |
| Agilent Seahorse XFe96 Extracellular Flux Analyzer | Agilent Technologies Inc. | - | Instrument for measuring rates of spheroid oxygen uptake in single spheroids |
| Antimycin A | Merck Life Science | A8674 | Mitochondrial respiratory complex III inhibitor |
| BAM15 | TOCRIS bio-techne | 5737 | Mitochondrial protnophore uncoupler |
| Black-walled microplate | Greiner Bio-One | 655076 | For fluorescence-based assays |
| CELLSTAR cell-repellent surface 96 U well microplates | Greiner Bio-One | 650970 | Microplates for generating spheroids |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | Assay for the determination of cell viability in 3D microtissue spheroids |
| Cultrex Poly-D-Lysine | R&D Systems a biotechne brand | 3439-100-01 | Molecular cell adhesive for coating XFe96 spheroid microplates to facillitate attachment of spheroids |
| D-(+)-Glucose | Merck Life Sciences | G8270 | Supplement for cell culture growth and XF assay medium |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 11885084 | Culture medium for HepG2/C3A spheroids |
| EVOS XL Core Imaging System | Thermo Fisher Scientific | AMEX1000 | Phase-contrast imaging microscope |
| EZ-PCR Mycoplasma test kit | Biological Industries | 20-700-20 | Mycoplasma screening in cell cultures |
| FIJI Is Just Image J | Analysis of collated images | ||
| Foetal bovine serum | Merck Life Science | F7524 | Supplement for cell culture medium |
| HepG2/C3A | ATCC | #CRL-10741 | Hepatic carcinoma cell line, a clonal derivative of the parent HepG2 cell line |
| Lactate-Glo | Promega | J5021 | Assay for measurement of lactate within spheorid culture medium |
| L-glutamine (200 mM solution) | Merk Life Sciences | G7513 | Supplement for cell culture growth and XF assay medium |
| M50 Stereo microscope | Leica Microsytems | LEICAM50 | Stereo dissection micrscope; used for spheorid handling |
| MCF-7 | ECACC | #86012803 | Breast adenocarcinoma cell line |
| Oligomycin from Streptomyces diastatochromogenes | Merck Life Science | O4876 | ATP Synthase Inhibitor |
| Penicilin-Streptomycin | Gibco | 15140122 | Antibiotics added to cell culture medium |
| Quant-iT PicoGreen dsDNA Assay Kit | Initrogen | P7589 | Analysis of dsDNA in spehroids |
| Rotenone | Merck Life Science | R8875 | Mitochondrial Respiratory Complex I Inhibitor |
| RPMI 1640 | Gibco | 21875091 | Culture medium for A549, MCF7, and SK-OV-3 spheroids |
| Seahorse Analytics | Agilent Technologies Inc. | Build 421 | https://seahorseanalytics.agilent.com |
| Seahorse XFe96 Spheroid FluxPak | Agilent Technologies Inc. | 102905-100 | Each Seahorse XFe96 Spheroid FluxPak contains: 6 Seahorse XFe96 Spheroid Microplates (102978-100), 6 XFe96 sensor cartridges, and 1 bottle of Seahorse XF Calibrant Solution 500 mL (100840-000) |
| Serological pipette: 5, 10, and 25 mL | Greiner Bio-One | 606107; 607107; 760107 | Consumables for cell culture |
| SK-OV-3 | ECACC | #HTB-77 | Ovarian adenocarcinoma cell line |
| Sodium pyruvate (100 mM solution) | Merck Life Science | S8636 | Supplement for cell culture growth and XF assay medium |
| T75 cm2 cell culture flask | Greiner Bio-One | 658175 | Tissue culture treated flasks for maintaining cell cultures |
| TrypLExpress | Gibco | 12604-021 | Cell dissociation reagent |
| Wave controller software | Agilent Technologies Inc. | - | |
| Wide orifice tip | STARLAB International GmbH | E1011-8400 | Pipette tips with wide opening for spheroid handling |
References
- Correa de Sampaio, P., et al. A heterogeneous in vitro three dimensional model of tumour-stroma interactions regulating sprouting angiogenesis. PLoS One. 7 (2), 30753(2012).
- Amann, A., et al. Development of an innovative 3D cell culture system to study tumour-stroma interactions in non-small cell lung cancer cells. PLoS One. 9 (3), 92511(2014).
- Russell, S., Wojtkowiak, J., Neilson, A., Gillies, R. J. Metabolic profiling of healthy and cancerous tissues in 2D and 3D. Scientific Reports. 7 (1), 15285(2017).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: a systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103(2016).
- Song, Y., et al. Patient-derived multicellular tumor spheroids towards optimized treatment for patients with hepatocellular carcinoma. Journal of Experimental and Clinica Cancer Research. 37 (1), 109(2018).
- Courau, T., et al. Cocultures of human colorectal tumor spheroids with immune cells reveal the therapeutic potential of MICA/B and NKG2A targeting for cancer treatment. Journal for ImmunoTherapy of Cancer. 7 (1), 74(2019).
- Ivanova, E., et al. Use of ex vivo patient-derived tumor organotypic spheroids to identify combination therapies for HER2 mutant non-small cell lung cancer. Clinical Cancer Research. 26 (10), 2393-2403 (2020).
- Mandon, M., Huet, S., Dubreil, E., Fessard, V., Le Hegarat, L. Three-dimensional HepaRG spheroids as a liver model to study human genotoxicity in vitro with the single cell gel electrophoresis assay. Scientific Reports. 9 (1), 10548(2019).
- Stampar, M., et al. Hepatocellular carcinoma (HepG2/C3A) cell-based 3D model for genotoxicity testing of chemicals. Science of the Total Environment. 755, 143255(2020).
- Coltman, N. J., et al. Application of HepG2/C3A liver spheroids as a model system for genotoxicity studies. Toxicology Letters. 345, 34-45 (2021).
- Tchoryk, A., et al. Penetration and uptake of nanoparticles in 3D tumor spheroids. Bioconjugate Chemistry. 30 (5), 1371-1384 (2019).
- Leite, P. E. C., et al. Suitability of 3D human brain spheroid models to distinguish toxic effects of gold and poly-lactic acid nanoparticles to assess biocompatibility for brain drug delivery. Partical Fibre Toxicology. 16 (1), 22(2019).
- Elje, E., et al. Hepato(Geno)toxicity assessment of nanoparticles in a HepG2 liver spheroid model. Nanomaterials. 10 (3), 545(2020).
- Conway, G. E., et al. Adaptation of the in vitro micronucleus assay for genotoxicity testing using 3D liver models supporting longer-term exposure durations. Mutagenesis. 35 (4), 319-330 (2020).
- Wang, Z., et al. HepaRG culture in tethered spheroids as an in vitro three-dimensional model for drug safety screening. Journal of Applied Toxicology. 35 (8), 909-917 (2015).
- Proctor, W. R., et al. Utility of spherical human liver microtissues for prediction of clinical drug-induced liver injury. Archives of Toxicology. 91 (8), 2849-2863 (2017).
- Basharat, A., Rollison, H. E., Williams, D. P., Ivanov, D. P. HepG2 (C3A) spheroids show higher sensitivity compared to HepaRG spheroids for drug-induced liver injury (DILI). Toxicology and Applied Pharmacology. 408, 115279(2020).
- Benning, L., Peintner, A., Finkenzeller, G., Peintner, L. Automated spheroid generation, drug application and efficacy screening using a deep learning classification: a feasibility study. Scientific Reports. 10 (1), 11071(2020).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Frontiers in Oncology. 7, 293(2017).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. The Biochemical Journal. 435 (2), 297-312 (2011).
- Benz, R., McLaughlin, S. The molecular mechanism of action of the proton ionophore FCCP (carbonylcyanide p-trifluoromethoxyphenylhydrazone). Biophysical Journal. 41 (3), 381-398 (1983).
- Kasianowicz, J., Benz, R., McLaughlin, S. The kinetic mechanism by which CCCP (carbonyl cyanide m-chlorophenylhydrazone) transports protons across membranes. The Journal of Membrane Biology. 82 (2), 179-190 (1984).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2013).
- Mitchell, P. Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism. Nature. 191, 144-148 (1961).
- Alexopoulos, S. J., et al. Mitochondrial uncoupler BAM15 reverses diet-induced obesity and insulin resistance in mice. Nature Communications. 11 (1), 2397(2020).
- Chen, S. -Y., et al. Mitochondrial uncoupler SHC517 reverses obesity in mice without affecting food intake. Metabolism - Clinical and Experimental. 117, 154724(2021).
- Goedeke, L., Shulman, G. I. Therapeutic potential of mitochondrial uncouplers for the treatment of metabolic associated fatty liver disease and NASH. Molecular Metabolism. 46, 101178(2021).
- Hill, B. G., et al. Integration of cellular bioenergetics with mitochondrial quality control and autophagy. Biological chemistry. 393 (12), 1485-1512 (2012).
- Demine, S., Renard, P., Arnould, T. Mitochondrial uncoupling: a key controller of biological processes in physiology and diseases. Cells. 8 (8), 795(2019).
- Wang, J., et al. Uncoupling effect of F16 is responsible for its mitochondrial toxicity and anticancer activity. Toxicological Sciences. 161 (2), 431-442 (2018).
- Tretter, L., Chinopoulos, C., Adam-Vizi, V. Plasma membrane depolarization and disturbed Na+ homeostasis induced by the protonophore carbonyl cyanide-p-trifluoromethoxyphenyl-hydrazon in isolated nerve terminals. Molecular Pharmacology. 53 (4), 734-741 (1998).
- Connop, B. P., Thies, R. L., Beyreuther, K., Ida, N., Reiner, P. B. Novel effects of FCCP [carbonyl cyanide p-(trifluoromethoxy) phenylhydrazone] on amyloid precursor protein processing. Journal of neurochemistry. 72 (4), 1457-1465 (1999).
- Stöckl, P., et al. Partial uncoupling of oxidative phosphorylation induces premature senescence in human fibroblasts and yeast mother cells. Free Radical Biology and Medicine. 43 (6), 947-958 (2007).
- Firsov, A. M., et al. Protonophoric action of BAM15 on planar bilayers, liposomes, mitochondria, bacteria and neurons. Bioelectrochemistry. 137, 107673(2021).
- Dranka, B. P., Hill, B. G., Darley-Usmar, V. M. Mitochondrial reserve capacity in endothelial cells: The impact of nitric oxide and reactive oxygen species. Free Radical Biology and Medicine. 48 (7), 905-914 (2010).
- Eilenberger, C., Rothbauer, M., Ehmoser, E. K., Ertl, P., Kupcu, S. Effect of spheroidal age on sorafenib diffusivity and toxicity in a 3D HepG2 spheroid model. Scientific Reports. 9 (1), 4863(2019).
- vanden Brand, D., Veelken, C., Massuger, L., Brock, R. Penetration in 3D tumor spheroids and explants: Adding a further dimension to the structure-activity relationship of cell-penetrating peptides. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1860 (6), 1342-1349 (2018).
- Niora, M., et al. Head-to-head comparison of the penetration efficiency of lipid-based nanoparticles into tumor spheroids. ACS Omega. 5 (33), 21162-21171 (2020).
- Millard, M., et al. Drug delivery to solid tumors: the predictive value of the multicellular tumor spheroid model for nanomedicine screening. International Journal of Nanomedicine. 12, 7993-8007 (2017).
- Ruas, J. S., et al. Underestimation of the maximal capacity of the mitochondrial electron transport system in oligomycin-treated cells. PLoS One. 11 (3), 0150967(2016).
- Benton, G., DeGray, G., Kleinman, H. K., George, J., Arnaoutova, I. In vitro microtumors provide a physiologically predictive tool for breast cancer therapeutic screening. PLoS One. 10 (4), 0123312(2015).
- Hirpara, J., et al. Metabolic reprogramming of oncogene-addicted cancer cells to OXPHOS as a mechanism of drug resistance. Redox Biology. 25, 101076(2019).
- Ware, M. J., et al. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Engineering. Part C, Methods. 22 (4), 312-321 (2016).
- Song, Y., et al. TGF-β-independent CTGF induction regulates cell adhesion mediated drug resistance by increasing collagen I in HCC. Oncotarget. 8 (13), 21650-21662 (2017).
- Wrzesinski, K., et al. HepG2/C3A 3D spheroids exhibit stable physiological functionality for at least 24 days after recovering from trypsinisation. Toxicology Research. 2 (3), 163-172 (2013).
- Gaskell, H., et al. Characterization of a functional C3A liver spheroid model. Toxicology Research. 5 (4), 1053-1065 (2016).
- Takahashi, Y., et al. 3D spheroid cultures improve the metabolic gene expression profiles of HepaRG cells. Bioscience Reports. 35 (3), 00208(2015).
- Hendriks, D. F. G., Puigvert, L. F., Messner, S., Mortiz, W., Ingelman-Sundberg, M. Hepatic 3D spheroid models for the detection and study of compounds with cholestatic liability. Scientific Reports. 6, 35434(2016).
- Leung, B. M., Lesher-Perez, S. C., Matsuoka, T., Moraes, C., Takayama, S. Media additives to promote spheroid circularity and compactness in hanging drop platform. Biomaterials Science. 3 (2), 336-344 (2015).
- Cavo, M., et al. A synergic approach to enhance long-term culture and manipulation of MiaPaCa-2 pancreatic cancer spheroids. Scientific Reports. 10 (1), 10192(2020).
- Carlsson, J., Yuhas, J. M. Liquid-overlay culture of cellular spheroids. Recent Results in Cancer Research. 95, 1-23 (1984).
- Costa, E. C., Gaspar, V. M., Coutinho, P., Correia, I. J. Optimization of liquid overlay technique to formulate heterogenic 3D co-cultures models. Biotechnology and Bioengineering. 111 (8), 1672-1685 (2014).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Zhang, X. D., et al. The use of strictly standardized mean difference for hit selection in primary RNA interference high-throughput screening experiments. Journal of Biomolecular Screening. 12 (4), 497-509 (2007).
- Yepez, V. A., et al. OCR-Stats: Robust estimation and statistical testing of mitochondrial respiration activities using Seahorse XF Analyzer. PLoS One. 13 (7), 0199938(2018).
- Silva, L. P., et al. Measurement of DNA concentration as a normalization strategy for metabolomic data from adherent cell lines. Analytical Chemistry. 85 (20), 9536-9542 (2013).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Exploring Mitochondrial Energy Metabolism of Single 3D Microtissue Spheroids using Extracellular Flux Analysis
Posted by JoVE Editors on 3/11/2022. Citeable Link.
An erratum was issued for: Exploring Mitochondrial Energy Metabolism of Single 3D Microtissue Spheroids using Extracellular Flux Analysis. The Representative Results section was updated.
Figure 5 was updated from:
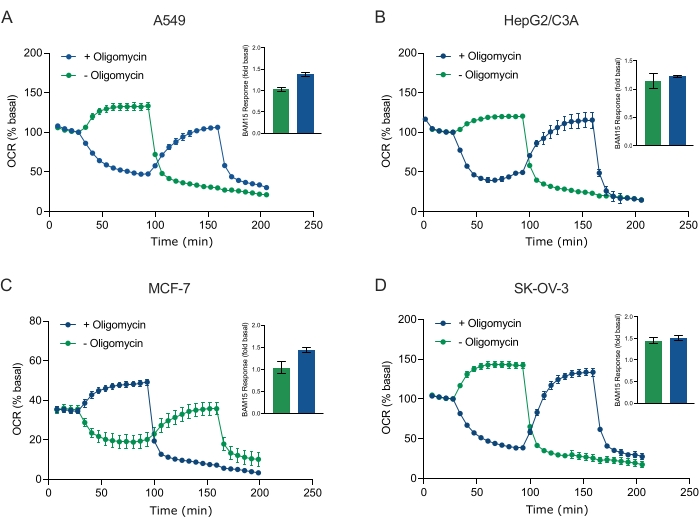
Figure 5: Single or sequential injection of mitochondrial respiratory compounds. Cancer-cell-derived spheroids of MCF-7, HEPG2/C3A, SK-OV-3, and A549 were placed into wells of an XFe96 spheroid microplate in XF RPMI and probed for OCR using the Agilent Seahorse XFe96 analyzer. OCR was measured 5x, after which 2 µg/mL oligomycin (injection Port A: green trace) or 5 µM BAM15 (injection Port A: blue trace or injection port B: green trace) to inhibit the mitochondrial ATP synthase and determine maximal respiratory capacity, respectively. Kinetic OCR data are expressed as % basal (A-D). Maximal respiratory capacity (OCRmax) was calculated as a factor of basal OCR by the equation: OCRmax = OCRBAM15 / OCRbasal. OCRmax was obtained from OCR averages across measurement cycles 8-10 post BAM15 injection with (green bars) and without (blue bars) oligomycin. Data are averages ± SEM from 3-8 individual well replicates across the spheroid assay microplate. Abbreviations: OCR = oxygen consumption rate. Please click here to view a larger version of this figure.
to:
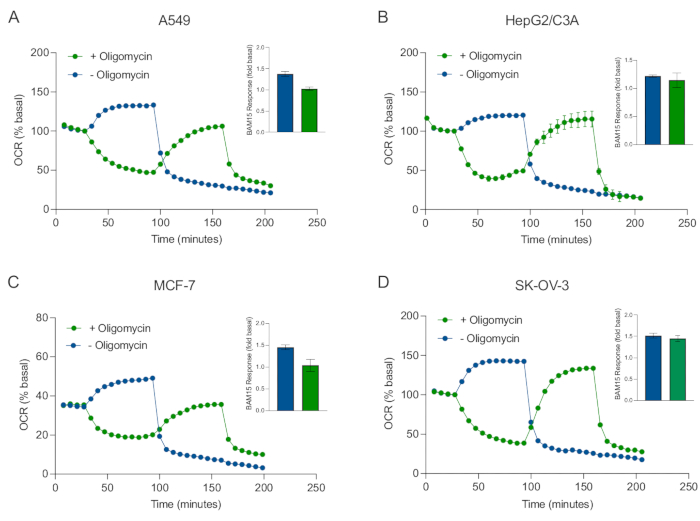
Figure 5: Single or sequential injection of mitochondrial respiratory compounds. Cancer-cell-derived spheroids of MCF-7, HEPG2/C3A, SK-OV-3, and A549 were placed into wells of an XFe96 spheroid microplate in XF RPMI and probed for OCR using the Agilent Seahorse XFe96 analyzer. OCR was measured 5x, after which 2 µg/mL oligomycin (injection Port A: green trace) or 5 µM BAM15 (injection Port A: blue trace or injection port B: green trace) to inhibit the mitochondrial ATP synthase and determine maximal respiratory capacity, respectively. Kinetic OCR data are expressed as % basal (A-D). Maximal respiratory capacity (OCRmax) was calculated as a factor of basal OCR by the equation: OCRmax = OCRBAM15 / OCRbasal. OCRmax was obtained from OCR averages across measurement cycles 8-10 post BAM15 injection with (green bars) and without (blue bars) oligomycin. Data are averages ± SEM from 3-8 individual well replicates across the spheroid assay microplate. Abbreviations: OCR = oxygen consumption rate. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved