A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
طريقة خطوة بخطوة للكشف عن الأجسام المضادة المحايدة ضد AAV باستخدام فحص قائم على الخلايا اللونية
In This Article
Summary
يتم وصف بروتوكول المختبر الشامل وسير عمل التحليل لإجراء فحص سريع وفعال من حيث التكلفة ومباشر قائم على الخلايا اللونية للكشف عن العناصر المحايدة ضد AAV6.
Abstract
أثبتت الفيروسات المرتبطة بالغدية المؤتلفة (rAAV) أنها ناقل آمن وناجح لنقل المواد الوراثية لعلاج مختلف الحالات الصحية في كل من المختبر والعيادة. ومع ذلك ، فإن الأجسام المضادة المحايدة الموجودة مسبقا (NAbs) ضد قفيصات AAV تشكل تحديا مستمرا للإدارة الناجحة للعلاجات الجينية في كل من النماذج التجريبية الحيوانية الكبيرة والمجموعات البشرية. يعد الفحص الأولي لمناعة المضيف ضد AAV ضروريا لضمان فعالية العلاجات الجينية القائمة على AAV كأداة بحثية وكعامل علاجي قابل للتطبيق سريريا. يصف هذا البروتوكول مقايسة قياس الألوان في المختبر للكشف عن العوامل المحايدة ضد النمط المصلي AAV 6 (AAV6). يستخدم الفحص التفاعل بين AAV الذي يشفر جين مراسل الفوسفاتيز القلوي (AP) وركيزته NBT / BCIP ، والتي تولد وصمة أرجوانية غير قابلة للذوبان كميا عند الجمع.
في هذا البروتوكول ، يتم دمج عينات المصل مع AAV الذي يعبر عن AP ويتم احتضانه للسماح بحدوث نشاط تحييد محتمل. يضاف خليط مصل الفيروسات لاحقا إلى الخلايا للسماح بالنقل الفيروسي لأي AAVs لم يتم تحييدها. تتم إضافة الركيزة NBT / BCIP وتخضع لتفاعل كروموجيني ، يتوافق مع النقل الفيروسي ونشاط التحييد. يتم تحديد نسبة المساحة الملونة باستخدام أداة برمجية حرة لإنشاء عيارات محايدة. يظهر هذا الفحص علاقة إيجابية قوية بين التلوين والتركيز الفيروسي. أدى تقييم عينات المصل من الأغنام قبل وبعد إعطاء AAV6 المؤتلف إلى زيادة كبيرة في نشاط التحييد (125 إلى > زيادة قدرها 10000 ضعف). أظهر الفحص حساسية كافية للكشف عن النشاط المحايد في >1:32,000 تخفيف المصل. يوفر هذا الفحص طريقة بسيطة وسريعة وفعالة من حيث التكلفة للكشف عن NAbs ضد AAVs.
Introduction
تستخدم الفيروسات المرتبطة بالأغينو (AAV) بشكل متزايد كناقلات لتوصيل العلاجات الجينية إلى العلاجات التجريبية لمختلف الحالات الصحية التي تؤثر على الجهاز القلبي الوعائي والرئوي والدورة الدموية والعينية والجهاز العصبي المركزي1،2،3،4،5. تنبع شعبية ناقلات AAV كمنصة رائدة للعلاج الجيني من ملف تعريف السلامة الإيجابي الخاص بها ، والتعبير الجيني المتحول على المدى الطويل ، والاستوائيات الخاصة بالأنسجة واسعة النطاق1,6. وقد مهدت النتائج الناجحة في الدراسات التي أجريت على الحيوانات الطريق لأكثر من خمسين تجربة سريرية للعلاج الجيني AAV وصلت بنجاح إلى نقاط نهاية فعاليتها7، فضلا عن إطلاق أول دواء متاح تجاريا للعلاج الجيني AAV معتمد من قبل إدارة الغذاء والدواء الأمريكية8. بعد النجاحات الأولية ، واصلت AAV اكتساب قوة دفع في قطاعات البحوث الأساسية والسريرية كناقل مفضل وهي حاليا العلاج الجيني الوحيد في الجسم الحي المعتمد للاستخدام السريري في الولايات المتحدة وأوروبا9. ومع ذلك، فإن وجود أجسام مضادة محايدة موجودة مسبقا (NAbs) ضد قفيصات ناقلات AAV لا يزال يشكل عائقا أمام كل من البحوث قبل السريرية وفعالية التجارب السريرية. وتوجد NAbs في كل من المجموعات البشرية والحيوانية الساذجة وتمنع نقل الجينات بعد إعطاء ناقل AAV في الجسم الحي1. الإيجابية المصلية AAV هي معيار استبعاد لمعظم تجارب العلاج الجيني ، وبالتالي فإن الفحص الأولي لمناعة المضيف أمر بالغ الأهمية في كل من المختبر والعيادة. يعد إنشاء فحص يمكنه اكتشاف وجود NAbs ضد AAV خطوة أساسية في خط أنابيب أي مشروع بحثي قائم على العلاج الجيني AAV. يركز هذا التقرير على AAV6 الذي كان موضع اهتمام الباحثين بسبب نقله الفعال والانتقائي في العضلات المخططة (القلب والعضلات الهيكلية)1،10،11،12. يعتبر العلاج الجيني استراتيجية واعدة لاستهداف القلب لأنه من الصعب استهداف القلب على وجه التحديد دون إجراءات القلب المفتوح الغازية.
عادة ما يتم تحديد نشاط التحييد باستخدام إما اختبار تثبيط النقل القائم على الخلايا في المختبر أو في الجسم الحي. في الجسم الحي عادة ما تتضمن اختبارات NAb إعطاء مصل من موضوع اختبار (على سبيل المثال ، إنسان أو كبير) إلى الفئران ، يليه AAV مع جين مراسل ، يليه اختبار للتعبير عن جين المراسل أو المستضد المقابل. تحدد الفحوص المخبرية عيارات NAb عن طريق احتضان المصل أو البلازما من إنسان أو كبير في تخفيفات تسلسلية باستخدام AAV المؤتلف (rAAV) الذي يعبر عن جين مراسل. الخلايا مصابة بخليط المصل / الفيروس ، ويتم تقييم مدى تثبيط التعبير الجيني للمراسل مقارنة بالضوابط. تستخدم الفحوصات في المختبر على نطاق واسع لفحص NAb بسبب تكلفتها المنخفضة نسبيا ، والسرعة في الاختبار ، والقدرة الأكبر على التوحيد القياسي والتحقق من الصحة 13,14 مقارنة بالفحوصات في الجسم الحي. غالبا ما يتم الإبلاغ عن أن الفحوصات في الجسم الحي لها حساسية أكبر15،16 ، ولكن تم تقديم نفس الادعاء فيما يتعلق بالمقايسات في المختبر14،17.
حتى الآن ، استخدمت اختبارات NAb في المختبر بشكل أساسي التلألؤ (luciferase) كجين مراسل للكشف عن التحييد. على الرغم من أن الطريقة القائمة على الضوء لها ميزة في العديد من السياقات ، إلا أن اختبار NAb اللوني / اللوني قد يكون مفيدا في بعض الظروف. تم استخدام المقايسات اللونية لتقييم التحييد بنجاح لفيروسات أخرى مثل الأنفلونزا والفيروسات الغدية18,19. وتنبع جاذبيتها من بساطتها وانخفاض تكلفتها والحاجة إلى أجهزة وأدوات مختبرية يومية فقط20. تتطلب مقايسات NAb التي تستخدم جين مراسل قائم على التلألؤ مجموعات ركيزة باهظة الثمن ومقياس لمعان وبرامج مقابلة للتحليل21. يتميز هذا الفحص اللوني بأنه يتطلب فقط مجهرا ضوئيا وركيزة رخيصة جدا. وقد أسفر الإبلاغ عن حساسية المقايسات اللونية مقابل المضيئة عن نتائج متضاربة. اقترحت إحدى الدراسات أن اختبارات ELISA القائمة على التلألؤ تعرض حساسية أكبر وقابلية تكرار مماثلة لمقايسات قياس الألوان22 ، في حين وجدت دراسة أخرى أن اختبارات ELISA القائمة على القياس اللوني تضفي حساسية أكبر23. هنا ، يتم توفير بروتوكول مفصل لفحص NAb في المختبر ضد AAV يستخدم التفاعل الكروموجيني بين AAV الذي يشفر جين مراسل الفوسفاتيز القلوي (AP) ورباعي التيتانوليوم الأزرق النيترو / 5-bromo-4-chloro-3-indolyl phosphate (NBT / BCIP). تم تطوير هذا البروتوكول خطوة بخطوة استنادا إلى تقرير سابق استخدم جين مراسل hPLAP (الفوسفاتيز القلوي للمشيمة البشرية) (AAV6-hPLAP) للكشف عن النشاط المحايد ضد AAV24. هذا الفحص فعال من حيث التكلفة ، وفعال من حيث الوقت ، وسهل الإعداد ، ويتطلب الحد الأدنى من المهارات التقنية والمعدات المختبرية والكواشف. علاوة على ذلك ، فإن بساطة هذا الفحص تمنحه إمكانية تحسينه للتطبيقات الواسعة عبر أنواع مختلفة من الخلايا أو الأنسجة أو الأنماط المصلية الفيروسية.
Protocol
أجريت جميع جوانب رعاية الحيوانات والتجارب وفقا لمعهد فلوري للعلوم العصبية والمبادئ التوجيهية للصحة العقلية والقانون الأسترالي لرعاية واستخدام الحيوانات للأغراض العلمية بعد المرجع 25. تم استخدام نعاج ميرينو البالغة من العمر 1.5-3 سنوات للدراسة. ويرد في الشكل 1 نظرة عامة تخطيطية على بروتوكول المقايسة.
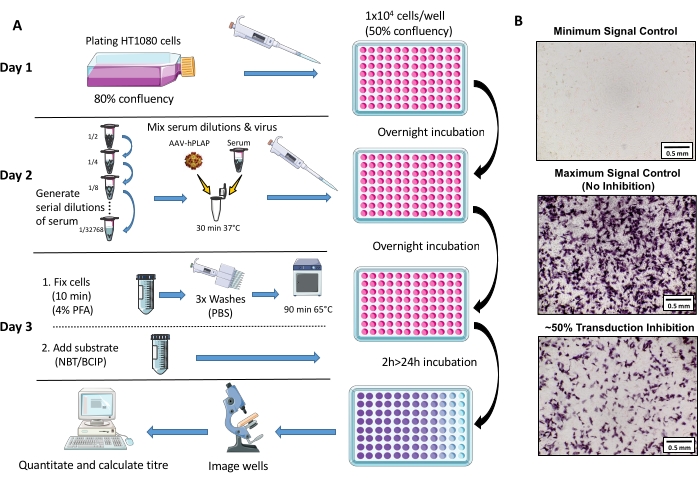
الشكل 1: رسم تخطيطي لبروتوكول فحص NAb. (A) تمثيل مرئي لفحص NAb يوضح الخطوات الأساسية التي ينطوي عليها بروتوكول الأيام الثلاثة. لفترة وجيزة ، تزرع الخلايا وتطلى بين عشية وضحاها. في اليوم التالي ، يتم إعداد التخفيفات التسلسلية للمصل ، واحتضانها باستخدام AAV ، ثم احتضانها مع الخلايا بين عشية وضحاها. في اليوم التالي ، يتم إصلاح الخلايا وغسلها واحتضانها ودمجها مع الركيزة واحتضانها مرة أخرى ، تليها التصوير والكمية. (ب) صور تمثيلية للحد الأدنى من التحكم في الإشارة (تثبيط AAV الكامل) ، والحد الأقصى للتحكم في الإشارة (بدون تثبيط) ، وعينة مصل البويضة مع تثبيط إشارة ~ 50٪. شريط المقياس = 0.5 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. التحضير الأولي
- للتقييم في الأغنام: اجمع الدم في أنابيب منشط جلطة فاصل مصل 8 مل (انظر جدول المواد) ، واترك عينة الدم في درجة حرارة الغرفة (RT) لمدة 20-30 دقيقة ، ثم قم بالدوران لأسفل عند 2100 × g لمدة 15 دقيقة. السوبرناتانت الواضح الذي يتشكل في الجزء العلوي من الأنابيب هو المصل. Aliquot المرحلة المائية واضحة في أنابيب الطرد المركزي الدقيقة وتخزينها في -80 درجة مئوية.
ملاحظة: يبقى المصل عند -80 درجة مئوية مستقرا لمدة 5 سنوات تقريبا. تم جمع الدم من الوريد السباتي باستخدام إبرة 16 G (قطع الطرف) وحقنة من الحيوانات الواعية. - قم بتسخين مصل البقر الجنيني المعطل (FBS) عن طريق وضعه في حمام مائي عند 56 درجة مئوية لمدة 30 دقيقة ويدور بشكل متقطع. للحصول على الدقة، ضع ميزان حرارة في زجاجة ثانية تحتوي على حجم مكافئ من الماء وأضفه إلى الحمام الحراري في نفس الوقت الذي تحتوي فيه زجاجة FBS. ابدأ التوقيت عندما يصل مقياس الحرارة إلى 56 درجة مئوية.
- استخدام تقنية التعقيم المناسبة وممارسة زراعة الخلايا لجميع الخطوات اللاحقة التي يتم تنفيذها في غطاء محرك السيارة لزراعة الخلايا26,27. رش 70٪ من الإيثانول على جميع الأشياء والغطاء قبل الاستخدام وتنظيفه بنسبة 1٪ هيبوكلوريت الصوديوم عند الانتهاء.
- اجعل متوسط النسر المعدل (DMEM) من دولبيكو كاملا من خلال الجمع بين الجلوكوز العالي (4.5 جم / لتر) DMEM (89٪) مع FBS المعطل حراريا (10٪) والبنسلين Streptomycin (1٪). الجمع والتصفية باستخدام نظام ترشيح فراغي معقم (حجم المسام 0.22 ميكرومتر ، غشاء البولي إيثرسلفون) (انظر جدول المواد). تخزين DMEM كاملة ملفوفة في احباط في 4 درجة مئوية.
- إنشاء خلايا HT1080 (انظر جدول المواد) والمرور في قارورة مربعة 75 سم 2 كما هو موضح في المرجع 28. إنشاء مخزون مجمد متعدد من الخلايا. لا تستخدم الخلايا بعد 20 مقطعا لأن المزيد من المرور قد يؤثر على نتائج الفحص.
2. اليوم الأول - طلاء الخلايا
- مرور خلايا HT1080 عندما تصل إلى ~ 80٪ التقاء.
- قبل التسخين الكامل DMEM (أعدت في الخطوة 1.4) ، 0.05 ٪ التربسين-EDTA ، و 1x المالحة العازلة بالفوسفات (PBS) إلى 37 درجة مئوية في حمام مائي. قم بإزالة وسط النمو من الخلايا التي تم تمريرها باستخدام نظام الشفط.
ملاحظة: يستخدم كل الطموح في هذا البروتوكول نظام فراغ مع أنبوب متصل بماصة مصلية معقمة سعة 5 مل. - اغسل الخلايا في 10 مل من 1x PBS المسخنة مسبقا (37 درجة مئوية) وخلايا التربسين لمدة 3-4 دقائق في 4 مل من التريبسين-EDTA المسخن مسبقا بنسبة 0.05٪ لفصل الخلايا عن القارورة.
- قم بتعطيل التربسين عن طريق إضافة 6 مل من DMEM الكامل الذي تم تسخينه مسبقا وماصة الخلايا في أنبوب 50 مل. احسب عدد الخلايا القابلة للحياة وتركيزها باستخدام مقياس الدم وطريقة استبعاد التربان الأزرق29.
- قم بتخفيف الخلايا إلى تركيز 1 × 105 خلية / مل في DMEM كامل تم تسخينه مسبقا. زرع 100 ميكرولتر من الخلايا / البئر في لوحات واضحة ذات قاع مسطح 96 بئرا (1 × 104 خلية لكل بئر). احتضان اللوحة عند 37 درجة مئوية ، 5 ٪ ثاني أكسيد الكربون (CO2) بين عشية وضحاها لمدة 16-22 ساعة.
3. اليوم الثاني - إصابة الخلايا
- قم بإزالة الصفيحة / الألواح من الحاضنة واستخدم المجهر الضوئي للتأكد من أن الخلايا مشتتة بالتساوي داخل الآبار وأن الالتقاء هو ~ 50٪. إذا لم تكن الخلايا ضمن نطاق التقاء 45٪ -55٪ ، كرر بروتوكول "اليوم 1" واضبط تركيز الخلية الأولي وفقا لذلك.
- توليد تخفيفات تسلسلية لعينات المصل ذات الأهمية في أنابيب الطرد المركزي الدقيقة سعة 1.5 مل باستخدام DMEM الكامل الذي تم تسخينه مسبقا كمخفف. ويبين الجدول 1 توليد شلال التخفيف للعينات الثلاثية.
- لإجراء الفحص في ثلاثة أضعاف ، قم بإعداد جينوم ناقل 7.5 × 106 (vg) / μL من حل العمل من AAV6-hPLAP (انظر جدول المواد) عن طريق تخفيف محلول مخزون الفيروسات في 1x PBS.
- أضف 66 ميكرولتر من محلول عمل الفيروسات 7.5 × 106 vg/μL إلى كل أنبوب يحتوي على 264 ميكرولتر من المصل/تخفيف الوسائط (330 ميكرولتر من الحجم الكلي/التخفيف، انظر الجدول 1).
ملاحظة: هذا فحص قوي لا يتطلب ظروفا ثقافية مثالية. ومع ذلك ، لتحديد كمية دقيقة وضمان موثوقية كل عملية فحص ، من الضروري تضمين ما يلي: (1) التحكم في الفيروسات والوسائط فقط ، (2) التحكم في الوسائط فقط ، و (3) عينة تحكم إيجابية NAb على جميع اللوحات في ظل نفس الظروف التجريبية. الحجم الموصوف (330 ميكرولتر) يمثل عينات ثلاثية +10٪ من خليط المصل والفيروسات. يوصى بشدة بإجراء النسخ المتماثلة لتحديد نشاط التحييد بدقة.
- امزج تخفيفات الفيروس / المصل عن طريق السحب وضع الأنابيب التي تحتوي على مخاليط الفيروس / المصل في حاضنة عند 37 درجة مئوية ، 5٪ CO2 لمدة 30 دقيقة للسماح بحدوث تحييد محتمل.
- ماصة 100 ميكرولتر من خليط الفيروس / المصل إلى كل بئر على لوحة 96 بئر تحتوي على 1 × 104 خلية / بئر لكل تخفيف.
ملاحظة: سيؤدي ذلك إلى توليد تركيز فيروسي نهائي من 15 ألف فيروس/تعدد خلايا العدوى (MOI) في كل بئر. ويقدم الجدول 2 مثالا على تخطيط لوحة العينة المكونة من 96 بئرا لتقييم العينات إلى تخفيف 1/512. - لف الصفيحة المكونة من 96 بئرا والتي تحتوي على الخلايا والمصل و AAV-hPLAP في رقائق معدنية وضعها في حاضنة عند 37 درجة مئوية ، 5٪ CO2 بين عشية وضحاها لمدة 16-24 ساعة للسماح بدخول AAV إلى الخلايا.
| تسمية سلسلة التخفيف | التخفيف | 3 × عينة (240 ميكرولتر) + 10٪ حجم المخزن المؤقت (24 ميكرولتر) | نسبة المصل: الوسائط |
| التخفيف 1 (D1) | 1/2 | 264 ميكرولتر مصل 264 ميكرولتر وسائط | 50:50 |
| التخفيف 2 (D2) | 1/4 | 264 ميكرولتر D1 + 264 ميكرولتر الوسائط | 25:75 |
| التخفيف 3 (D3) | 1/8 | 264 ميكرولتر D2 +264μL الوسائط | 12.5:87.5 |
| التخفيف 4 (D4) | 1/16 | 264 ميكرولتر D3 +264 ميكرولتر الوسائط | 6.25:93.75 |
| التخفيف 5 (D5) | 1/32 | 264 ميكرولتر D4 +264 ميكرولتر الوسائط | 3.13:96.87 |
| التخفيف 6 (D6) | 1/64 | 264 ميكرولتر D5 +264 ميكرولتر الوسائط | 1.56:98.44 |
| التخفيف 7 (D7) | 1/128 | 264 ميكرولتر D5 +264 ميكرولتر الوسائط | 0.78:99.22 |
| التخفيف 8 (D8) | 1/256 | 264 ميكرولتر D5 +264 ميكرولتر الوسائط | 0.39:99.61 |
| التخفيف 9 (D9) | 1/512 | 264 ميكرولتر D7 + 264 ميكرولتر الوسائط | 0.2:99.8 |
| التخفيف 10 (D10) | 1/2048 | 132 ميكرولتر D8 + 396 ميكرولتر الوسائط | 0.05:99.95 |
| التخفيف 11 (D11) | 1/8192 | 132 ميكرولتر D9 + 396 ميكرولتر الوسائط | 0.01:99.99 |
| التخفيف 12 (D12) | 1/32768 | 132 ميكرولتر D10 + 396 ميكرولتر الوسائط | 0.003:99.997 |
الجدول 1: كميات المصل والمخفف اللازمة لتوليد التخفيفات التسلسلية للمصل في ثلاثة أضعاف.
| عينة المصل # 1 | عينة المصل # 2 | عينة المصل # 3 | أحادي AB (mAB) ، عناصر تحكم وعينات إضافية | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| A | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 50 نانوغرام ماجستيريا | 50 نانوغرام ماجستيريا | 50 نانوغرام ماجستيريا |
| B | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 5 نانوغرام ماجستيريا | 5 نانوغرام ماجستيريا | 5 نانوغرام ماجستيريا |
| C | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 0.5 نانوغرام ميلي أمبير | 0.5 نانوغرام ميلي أمبير | 0.5 نانوغرام ميلي أمبير |
| D | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | MO (-C) | MO (-C) | MO (-C) |
| E | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | VO (+C) | VO (+C) | VO (+C) |
| F | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | نموذج #1 1/512 | نموذج #1 1/512 | نموذج #1 1/512 |
| G | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | نموذج #2 1/512 | نموذج #2 1/512 | نموذج #2 1/512 |
| H | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | نموذج #3 1/512 | نموذج #3 1/512 | نموذج #3 1/512 |
الجدول 2: مثال على تخطيط لوحة 96 بئرا لتقييم عينات المصل الساذجة في تخفيفات تتراوح من 1/2 إلى 1/512. يتم دمج تخفيفات أعلى في الفحص إذا تم تقييم عينة معروفة بأنها إيجابية ل AAV NAbs (عينات ما بعد الإدارة) أو إذا كانت هناك حاجة إلى عيار أعلى. MO (-C): التحكم في الوسائط فقط. VO (+C): التحكم في الفيروسات والوسائط فقط. mAb: جسم مضاد أحادي النسيلة ضد AAV (التحكم الإيجابي NAb).
4. اليوم 3 - تثبيت وإضافة الركيزة إلى الخلايا
- قم بتسخين أليكوت من 1x PBS إلى 37 درجة مئوية (~ 25 مل / 96 لوحة بئر). قم بتبريد الأليكوتات المنفصلة من PBS (~ 25 مل / 96 لوحة بئر) و H2O المقطر المزدوج (DDW ، ~ 25 مل / 96 لوحة بئر) إلى 4 درجات مئوية. قم بإذابة حبيبة من BCIP / NBT (انظر جدول المواد) في 10 مل من DDW في أنبوب طرد مركزي مخروطي 50 مل عن طريق الدوامة (10 مل يكفي ل 2 × 96 لوحة بئر).
- استنشاق الوسائط من آبار صفيحة البئر 96 باستخدام ماصة مصلية أو ما شابه ذلك متصلة بنظام الشفط القائم على الشفط أو فراغ غطاء الدخان. ضع طرف الماصة المصلية بلطف في البئر وأزل الوسائط مع توخي الحذر لعدم تعطيل الخلايا الملتصقة.
- أضف 50 ميكرولتر من RT 4٪ PFA إلى كل بئر باستخدام ماصة. لف اللوحة بورق القصدير واتركها في RT لمدة 10 دقائق لإصلاح الخلايا.
تحذير: بارافورمالدهيد (PFA) هو مادة مسرطنة محتملة وسامة من الجلد أو ملامسة العين أو الاستنشاق. تعامل مع غطاء الدخان مع معدات الحماية الشخصية المناسبة وكذلك قناع الوجه. اصنع PFA طازجا بنسبة 4٪ مخففا في PBS (~ 7 مل مطلوب لكل لوحة 96 بئرا).
- أضف 50 ميكرولتر من RT 4٪ PFA إلى كل بئر باستخدام ماصة. لف اللوحة بورق القصدير واتركها في RT لمدة 10 دقائق لإصلاح الخلايا.
- غسل وشفط الخلايا مع 200 ميكرولتر من RT 1x PBS. كرر هذه الخطوة مرتين.
ملاحظة: تعد الماصة متعددة القنوات خيارا فعالا لخطوات السحب. - ماصة 200 ميكرولتر من PBS المسخنة مسبقا في كل بئر ، لف اللوحة في رقائق معدنية واحتضنها عند 65 درجة مئوية لمدة 90 دقيقة لإزالة طبيعة نشاط الفوسفاتيز القلوي الداخلي30.
- استنشاق الآبار وغسل الخلايا مع 200 ميكرولتر من PBS الباردة (4 درجة مئوية). الشفط مرة أخرى ، وغسل في 200 ميكرولتر من DDW الباردة ، وشفط مرة أخرى.
- ماصة 50 ميكرولتر من BCIP / NBT المذاب (أعدت في الخطوة 4.1) في كل بئر.
- لف اللوحة في رقائق معدنية واحتضنها في RT لمدة 2-24 ساعة.
ملاحظة: كن متسقا مع وقت الحضانة بين الأشواط. تسمح مرونة الوقت للمستخدمين بتصوير الآبار إما في اليوم 3 أو في اليوم التالي. - باستخدام كاميرا المجهر الضوئي ، التقط صورا لكل بئر باستخدام عدسة موضوعية 4x ، مما يضمن استخدام نفس التعرض والتوازن الأبيض وإعدادات الضوء باستمرار لجميع الفحوصات التي يتم إجراؤها.
- ضع كل بئر بشكل متطابق وتأكد من أن حواف البئر غير مرئية في الصور. احفظ الصور بتنسيق TIF أو ما شابه ذلك.
ملاحظة: تختلف الإعدادات المحددة بين المجاهر، ولكن القياس الكمي سيكون أكثر فعالية إذا كانت إضاءة الخلفية عالية ومتسقة في جميع أنحاء الآبار (الشكل 1B).
- ضع كل بئر بشكل متطابق وتأكد من أن حواف البئر غير مرئية في الصور. احفظ الصور بتنسيق TIF أو ما شابه ذلك.
5. القياس الكمي لتحديد نشاط التحييد باستخدام ImageJ
- قم بتنزيل وتثبيت البرنامج المتاح مجانا "ImageJ" (انظر جدول المواد).
- افتح الصورة المراد تحليلها في ImageJ عن طريق تحديد ملف > فتح (الشكل 2).
- إذا كنت تستخدم صورا ملونة، فقم بالتحويل إلى تدرج رمادي عن طريق تحديد نوع الصورة > > 8 بت.
- انقر فوق الصورة > ضبط عتبة >. اضبط العتبة حتى يتم تلوين جميع المساحات الملونة باللون الأحمر، ولكن الخلفية ليست كذلك. عند إضافة NBT / BCIP ، سيترسب المنتج الملون في المنطقة المحيطة بالخلايا التي تعبر عن hPLAP.
ملاحظة: يوصى باستخدام نفس إعداد العتبة لجميع الصور الملتقطة على نفس اللوحة. - انقر فوق تحليل > تعيين القياسات ووضع علامة في مربعات الاختيار المنطقة والحد من العتبة وكسر المنطقة وعرض التسمية وانقر فوق موافق.
- لتحديد قراءة الإشارة (النسبة المئوية للتلوين) لبئر معين ، انقر فوق تحليل > قياس. يعرض عمود "النسبة المئوية للمساحة" في النافذة المنبثقة قراءة الإشارة.
- قم بإجراء قياس كمي لكافة نسخ العينات المتماثلة. استبعاد أي آبار ملوثة، أو آبار تظهر توزيعا غير متساو للخلايا، أو آبارا تختلف في كثافة الخلايا أو الإضاءة.
ملاحظة: انظر الشكل التكميلي 1 للاطلاع على أمثلة للآبار التي ينبغي النظر في استبعادها. عادة ، قد تتطلب 3-4 آبار الاستبعاد من لوحة 96 بئرا. يوفر الشكل 2 تمثيلا مرئيا لعملية القياس الكمي باستخدام ImageJ.
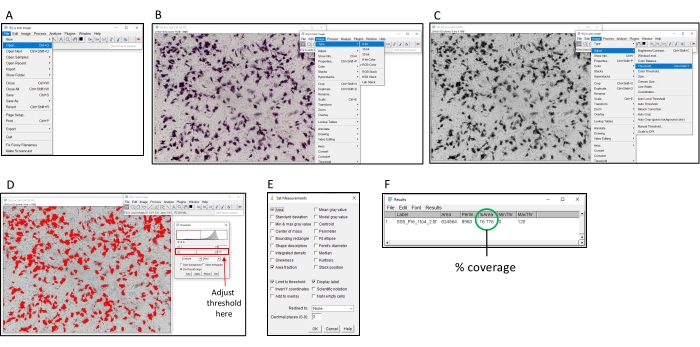
الشكل 2: خطوات تحديد النسبة المئوية للتلوين باستخدام برنامج ImageJ. (أ) افتح الصورة المراد تحليلها باستخدام برنامج ImageJ. (ب) تحويل الصورة إلى تدرج رمادي 8 بت. (ج) افتح نافذة العتبة. (د) اضبط الحد الأقصى بحيث يتم تغطية جميع المناطق الملونة ، ولكن منطقة الخلفية ليست كذلك (يجب أن تكون هذه العتبة متسقة عبر لوحة بأكملها). (ه) حدد مربع الإسقاط "تحليل" ، وانقر فوق "تعيين القياسات" وحدد "المنطقة" و "جزء المساحة" و "عتبة الحد" و "ملصق العرض" ، وانقر فوق "موافق". (و) انقر فوق "قياس" لقياس المنطقة المغطاة. تشير المساحة ٪ إلى نسبة الصورة التي تم تلوينها. يمكن بعد ذلك استخدام هذا مع عينات التحكم لتحديد عيار TI50 . يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. تحديد عيار تثبيط النقل (TI50)
- حدد متوسط القراءة من النسخ المتماثلة (باستخدام الخطوات الموضحة في الخطوة 5) لما يلي: (1) عنصر تحكم الوسائط فقط (قراءة إشارة الأساس). (2) التحكم في الفيروسات + الوسائط فقط (الحد الأقصى لقراءة الإشارة). (3) عينات الفيروسات + المصل ذات الاهتمام.
- احسب النسبة المئوية للتثبيط باستخدام الصيغة التالية:
100 - [(اختبار قراءة إشارة العينة (الفيروس + عينة المصل محل الاهتمام) - قراءة إشارة خط الأساس (التحكم في الوسائط فقط)) / (الحد الأقصى لقراءة الإشارة (الوسائط والفيروسات فقط) - قراءة إشارة خط الأساس) × 100] = ٪ تثبيط النقل 13. - احسب النسبة المئوية لتثبيط النقل من جميع النسخ المتماثلة لكل تخفيف لجميع العينات باستخدام الصيغة في 6.2. تحديد متوسط تثبيط النقل بين النسخ المتماثلة التقنية لكل تخفيف لجميع العينات والضوابط.
- احسب عيار تثبيط النقل بنسبة 50٪ (عيار TI50 ) لعينة ذات أهمية عن طريق تحديد أدنى تخفيف للعينة ينتج عنه تثبيط نقل بنسبة 50٪ أو أكبر لنشاط hPLAP. على سبيل المثال ، إذا كان التخفيف 1/8 للعينة يحتوي على تثبيط نقل أكبر من 50٪ بناء على الحساب الذي تم إجراؤه في 6.2 (ولا يؤدي التخفيف 1/4) ، فقم بالإبلاغ عن عيار TI50 على أنه 1/8.
7. تحديد جزيئات AAV المحايدة
- احسب عدد جسيمات AAV المحايدة لكل ميكرولتر من المصل لعينة معينة باستخدام الصيغة التالية:
((MOI x عدد الخلايا / بئر) / (حجم المصل / عامل تخفيف عيار TI50 )) / 2 = جزيئات AAV المحايدة / ميكرولتر من المصل 9.
ملاحظة: القسمة على 2 تمثل TI50 التي تقيس 50٪ من الجسيمات المحايدة. بالنسبة للعينة التي تعطي عيار TI50 من 1/4 (مصل 25٪ ، مخفف بنسبة 75٪) حيث استخدم الفحص 80 ميكرولتر من المصل غير المخفف و MOI من 15k مطلي على خلية 1 × 104 ، سيتم استخدام الحساب التالي: ((15000 × 10000) / (80/4)) / 2 = 3.75x106 جسيمات محايدة / ميكرولتر من المصل.
النتائج
فحص النقل لتحديد الجرعة الفيروسية المثلى لتغطية اللوحة
تم اختيار خلايا HT1080 ، وهي خط خلايا الساركوما الليفية الراسخ ، لهذا الفحص. تركيز 1 × 104 HT1080 خلية / بئر قدمت ~ 50٪ التقاء الخلايا في كل بئر من لوحة 96 بئر. لتحديد التركيز الفيروسي الأمثل للفحص، تمت إضافة rAAV ترميز جين مراسل hPLAP ...
Discussion
يصف هذا التقرير مقايسة لونية تقيم مدى تحييد AAV في عينة مصل معينة من خلال تقييم تفاعل كروموجيني يتوافق مع درجة النقل الفيروسي في المختبر. استند تطوير البروتوكول إلى التفاعل اللوني المعروف بين إنزيم الفوسفاتيز القلوي و NBT / BCIP ، والذي تم استخدامه على نطاق واسع كأداة تلطيخ للكشف عن أهداف ?...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذه الدراسة من خلال منحة مشروع المجلس الوطني للصحة والبحوث الطبية إلى JRM و CJT (ID 1163732) وجزئيا من قبل برنامج دعم البنية التحتية التشغيلية التابع لحكومة فيكتوريا. يتم دعم SB من خلال منحة دكتوراه مشتركة بين معهد بيكر للقلب والسكري وجامعة لا تروب. يتم دعم KLW من قبل مؤسسة Shine On Foundation وزمالة قادة المستقبل من مؤسسة القلب الوطنية الأسترالية (ID 102539). يتم دعم JRM من قبل زمالة أبحاث عليا من المجلس الوطني للصحة والبحوث الطبية (ID 1078985).
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Gibco | 25300-054 | |
| 50 mL conical centrifuge tube | Falcon | 14-432-22 | Or equivalent |
| 75 cm2 square flasks | Falcon | 353136 | Or equivalent |
| 96 well flat bottomed plate | Falcon | 353072 | |
| AAV6-CMV-hPLAP Vector | Muscle Research & Therapeutics Lab (University of Melbourne, Australia) AAV6-CMV-hPLAP can be provided upon request. | ||
| Aluminium foil | |||
| Anti-AAV6 (intact particle) mouse monoclonal antibody, (ADK6) | PROGEN | 610159 | Positive control monoclonal antibody |
| BCIP/NBT | SIGMAFAST | B5655 | |
| Cell and tissue culture safety cabinet | |||
| Electronic Pipette | 5 & 10 mL stripette inserts | ||
| Fetal Bovine Serum | Gibco | 10099-141 | |
| Haemocytometer | |||
| High glucose Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965118 | |
| HT1080 cells | ATCC | ||
| ImageJ Software | Freely available: https://imagej.nih.gov/ij/download.html | ||
| Incubator | 37 °C, 5% CO2 | ||
| Light microscope with camera | Capable of taking photos with a 4x objective lens | ||
| Oven | For a 65 °C incubation | ||
| Paraformaldehyde | MERCK | 30525-89-4 | |
| Penicillin Streptomycin | Gibco | 15140-122 | |
| Phosphate buffered saline | |||
| Pipettes and tips | 20 μL, 200 μL & 1 mL single pipettes and tips & 200 μL multichannel pipette | ||
| Stericup quick release filter | Millipore | S2GPU10RE | Used for combining media reagents |
| Trypan blue solution | Sigma-Aldrich | T8154 | |
| VACUETTE TUBE 8 ml CAT Serum Separator Clot Activator | Greiner BIO-ONE | 455071 | Used for serum collection & processing from sheep |
| Water bath |
References
- Bass-Stringer, S., et al. Adeno-associated virus gene therapy: Translational progress and future prospects in the treatment of heart failure. Heart, Lung and Circulation. 27 (11), 1285-1300 (2018).
- Casey, G. A., Papp, K. M., MacDonald, I. M. Ocular gene therapy with adeno-associated virus vectors: current outlook for patients and researchers. Journal of Ophthalmic and Vision Research. 15 (3), 396-399 (2020).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. Journal of Neurodevelopmental Disorders. 10 (1), 16 (2018).
- Guggino, W. B., Cebotaru, L. Adeno-Associated Virus (AAV) gene therapy for cystic fibrosis: Current barriers and recent developments. Expert Opinion on Biological Therapy. 17 (10), 1265-1273 (2017).
- Perrin, G. Q., Herzog, R. W., Markusic, D. M. Update on clinical gene therapy for hemophilia. Blood. 133 (5), 407-414 (2019).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Weber, T. Anti-AAV Antibodies in AAV gene therapy: Current challenges and possible solutions. Frontiers in Immunology. 12, 658399 (2021).
- Weeks, K. L., et al. Phosphoinositide 3-kinase p110alpha is a master regulator of exercise-induced cardioprotection and PI3K gene therapy rescues cardiac dysfunction. Circulation: Heart Failure. 5 (4), 523-534 (2012).
- Gregorevic, P., et al. Systemic delivery of genes to striated muscles using adeno-associated viral vectors. Nature Medicine. 10 (8), 828-834 (2004).
- Bernardo, B. C., et al. Gene delivery of medium chain acyl-coenzyme A dehydrogenase induces physiological cardiac hypertrophy and protects against pathological remodelling. Clinical Science (London). 132 (3), 381-397 (2018).
- Meliani, A., et al. Determination of anti-adeno-associated virus vector neutralizing antibody titer with an in vitro reporter system. Human Gene Therapy Methods. 26 (2), 45-53 (2015).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Wang, D., et al. Adeno-Associated virus neutralizing antibodies in large animals and their impact on brain intraparenchymal gene transfer. Molecular Therapy - Methods & Clinical Development. 11, 65-72 (2018).
- Wang, M., et al. Prediction of adeno-associated virus neutralizing antibody activity for clinical application. Gene Therapy. 22 (12), 984-992 (2015).
- Kruzik, A., et al. Detection of biologically relevant low-titer neutralizing antibodies against adeno-associated virus require sensitive in vitro assays. Human Gene Therapy Methods. 30 (2), 35-43 (2019).
- Lehtoranta, L., Villberg, A., Santanen, R., Ziegler, T. A novel, colorimetric neutralization assay for measuring antibodies to influenza viruses. Journal of Virological Methods. 159 (2), 271-276 (2009).
- Johnston, P. B., Grayston, J. T., Loosli, C. G. Adenovirus neutralizing antibody determination by colorimetric assay. Proceedings of the Society for Experimental Biology and Medicine. 94 (2), 338-343 (1957).
- Xiaoli Zhu, T. G. . Nano-Inspired Biosensors for Protein Assay with Clinical Applications. , 237-264 (2019).
- Jungmann, A., Muller, O., Rapti, K. Cell-based measurement of neutralizing antibodies against adeno-associated virus (AAV). Methods in Molecular Biology. 1521, 109-126 (2017).
- Samineni, S., et al. Optimization, comparison, and application of colorimetric vs. chemiluminescence based indirect sandwich ELISA for measurement of human IL-23. Journal of Immunoassay and Immunochemistry. 27 (2), 183-193 (2006).
- Siddiqui, J., Remick, D. G. Improved sensitivity of colorimetric compared to chemiluminescence ELISAs for cytokine assays. Journal of Immunoassay and Immunochemistry. 24 (3), 273-283 (2003).
- Arnett, A. L., Garikipati, D., Wang, Z., Tapscott, S., Chamberlain, J. S. Immune responses to rAAV6: The Influence of canine parvovirus vaccination and neonatal administration of viral vector. Frontiers in Microbiology. 2, 220 (2011).
- Australian code for the care and use of animals for scientific purposes. National Health and Medical Research Council Available from: https://www.nhmrc.gov.au/about-us/publications/australian-code-care-and-use-animals-scientific-purposes (2013)
- Coecke, S., et al. Guidance on good cell culture practice. A report of the second ECVAM task force on good cell culture practice. Alternatives to Laboratory Animals. 33 (3), 261-287 (2005).
- Journal of Visualized Experiments. General Laboratory Techniques. Journal of Visualized Experiments Database. , (2018).
- AAV-HT1080 Cells. Stratagene Available from: https://www.chem-agilent.com/pdf/strata/240109.pdf (2003)
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (3), 1-3 (2015).
- Bieber, S., et al. Extracorporeal delivery of rAAV with metabolic exchange and oxygenation. Scientific Reports. 3, 1538 (2013).
- Winbanks, C. E., Beyer, C., Qian, H., Gregorevic, P. Transduction of skeletal muscles with common reporter genes can promote muscle fiber degeneration and inflammation. PLoS One. 7 (12), 51627 (2012).
- Thomas, C. J., et al. Evidence that the MEK/ERK but not the PI3K/Akt pathway is required for protection from myocardial ischemia-reperfusion injury by 3',4'-dihydroxyflavonol. European Journal of Pharmacology. 758, 53-59 (2015).
- Barger, A., et al. Use of alkaline phosphatase staining to differentiate canine osteosarcoma from other vimentin-positive tumors. Veterinary Pathology. 42 (2), 161-165 (2005).
- Gregorevic, P., et al. Evaluation of vascular delivery methodologies to enhance rAAV6-mediated gene transfer to canine striated musculature. Molecular Therapy. 17 (8), 1427-1433 (2009).
- Sharma, A., Ghosh, A., Hansen, E. T., Newman, J. M., Mohan, R. R. Transduction efficiency of AAV 2/6, 2/8 and 2/9 vectors for delivering genes in human corneal fibroblasts. Brain Research Bulletin. 81 (2-3), 273-278 (2010).
- Smejkal, G. B., Kaul, C. A. Stability of nitroblue tetrazolium-based alkaline phosphatase substrates. Journal of Histochemistry & Cytochemistry. 49 (9), 1189-1190 (2001).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Orlowski, A., et al. Successful transduction with AAV Vectors after selective depletion of anti-aav antibodies by immunoadsorption. Molecular Therapy - Methods & Clinical Development. 16, 192-203 (2020).
- Goossens, K., et al. Differential microRNA expression analysis in blastocysts by whole mount in situ hybridization and reverse transcription quantitative polymerase chain reaction on laser capture microdissection samples. Analytical Biochemistry. 423 (1), 93-101 (2012).
- Entrican, G., Wattegedera, S. R., Griffiths, D. J. Exploiting ovine immunology to improve the relevance of biomedical models. Molecular Immunology. 66 (1), 68-77 (2015).
- Walters, E. M., Prather, R. S. Advancing swine models for human health and diseases. Molecular Medicine. 110 (3), 212-215 (2013).
- Rapti, K., et al. Neutralizing antibodies against AAV serotypes 1, 2, 6, and 9 in sera of commonly used animal models. Molecular Therapy. 20 (1), 73-83 (2012).
- Tellez, J., et al. Characterization of naturally-occurring humoral immunity to AAV in sheep. PLoS One. 8 (9), 75142 (2013).
- Gupta, S., et al. Recommendations for the validation of cell-based assays used for the detection of neutralizing antibody immune responses elicited against biological therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 55 (5), 878-888 (2011).
- Gupta, S., et al. Recommendations for the design, optimization, and qualification of cell-based assays used for the detection of neutralizing antibody responses elicited to biological therapeutics. Journal of Immunological Methods. 321 (1-2), 1-18 (2007).
- Shankar, G., et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. Journal of Pharmaceutical and Biomedical Analysis. 48 (5), 1267-1281 (2008).
- U.S. Department of Health and Human Services Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Immunogenicity Testing of Therapeutic Protein Products — Developing and Validating Assays for Anti-Drug Antibody Detection. U.S. Department of Health and Human Services Food and Drug Administration. , (2019).
- Baatartsogt, N., et al. A sensitive and reproducible cell-based assay via secNanoLuc to detect neutralizing antibody against adeno-associated virus vector capsid. Molecular Therapy - Methods & Clinical Development. 22, 162-171 (2021).
- Watano, R., Ohmori, T., Hishikawa, S., Sakata, A., Mizukami, H. Utility of micro mini pigs for evaluating liver-mediated gene expression in the presence of neutralizing antibody against vector capsid. Gene Therapy. 27 (9), 427-434 (2020).
- Majowicz, A., et al. Therapeutic hFIX activity achieved after single AAV5-hFIX treatment in Hemophilia B patients and NHPs with pre-existing anti-AAV5 NABs. Molecular Therapy - Methods & Clinical Development. 14, 27-36 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved