A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مصفوفة Optrode للتعديل البصري الوراثي المتزامن والتسجيل العصبي الكهربائي
* These authors contributed equally
In This Article
Summary
هنا ، نقدم طريقة تصنيع نظام optrode مع ألياف بصرية لتوصيل الضوء ومجموعة قطب كهربائي للتسجيل العصبي. في الجسم الحي ، تظهر التجارب مع الفئران المعدلة وراثيا التي تعبر عن قناة رودوبسين-2 جدوى النظام للتحفيز البصري الوراثي المتزامن والتسجيل الكهروفسيولوجي.
Abstract
خلال العقد الماضي ، أصبح علم البصريات الوراثي أداة أساسية للتحقيق في الإشارات العصبية بسبب قدرته الفريدة على التعديل العصبي الانتقائي أو الرصد. نظرا لأنه يمكن تعديل أنواع محددة من الخلايا العصبية وراثيا للتعبير عن بروتينات opsin ، فإن علم البصريات الوراثي يمكن من التحفيز البصري أو تثبيط الخلايا العصبية المختارة. كان هناك العديد من التطورات التكنولوجية في النظام البصري لعلم البصريات الوراثية. في الآونة الأخيرة ، اقترح الجمع بين الدليل الموجي البصري لتوصيل الضوء والتسجيل الكهروفسيولوجي لمراقبة الاستجابات العصبية للتحفيز البصري الجيني أو التثبيط في وقت واحد. في هذه الدراسة ، تم تطوير مصفوفة optrode قابلة للزرع (ألياف بصرية 2x2) مع أقطاب كهربائية متعددة القنوات مدمجة.
تم استخدام الصمام الثنائي الباعث للضوء (LED) كمصدر للضوء ، وتم دمج مجموعة من العدسات الدقيقة الدقيقة لتوفير طاقة ضوئية كافية عند طرف الألياف البصرية. يتكون نظام مصفوفة optrode من الجزء القابل للتصرف والجزء القابل لإعادة الاستخدام. يحتوي الجزء القابل للتصرف على ألياف بصرية وأقطاب كهربائية ، في حين أن الجزء القابل لإعادة الاستخدام يحتوي على LED والدوائر الإلكترونية للتحكم في الضوء ومعالجة الإشارات العصبية. يتم تقديم التصميم الجديد لنظام مصفوفة الأوبترود القابلة للزرع في الفيديو المصاحب بالإضافة إلى إجراء جراحة زرع الأوبترود ، وتحفيز الضوء البصري الوراثي ، والتسجيل العصبي الكهروفسيولوجي. أظهرت نتائج التجارب في الجسم الحي بنجاح طفرات عصبية مقفلة زمنيا أثارتها المحفزات الضوئية من الخلايا العصبية المثيرة للحصين من الفئران.
Introduction
يعد تسجيل النشاط العصبي والتحكم فيه أمرا ضروريا لفهم كيفية عمل الدماغ في الشبكة العصبية وعلى المستويات الخلوية. تشمل طرق التسجيل الكهروفسيولوجية التقليدية مشبك التصحيح1،2،3،4 باستخدام ماصة دقيقة وتسجيل خارج الخلية باستخدام أقطاب عصبية دقيقة5،6،7،8. كطريقة تعديل عصبي ، تم استخدام التحفيز الكهربائي بشكل متكرر لتحفيز منطقة الدماغ البؤرية مباشرة من خلال إزالة الاستقطاب المباشر أو غير المباشر للخلايا العصبية. ومع ذلك ، لا يمكن للطريقة الكهربائية التمييز بين أنواع الخلايا العصبية للتسجيل أو التحفيز لأن التيارات الكهربائية تنتشر في جميع الاتجاهات.
كتقنية ناشئة ، بشرت البصريات الوراثية بعصر جديد في فهم كيفية عمل الجهاز العصبي9،10،11،12،13،14،15،16. جوهر التقنيات البصرية الجينية هو استخدام الضوء للتحكم في نشاط بروتينات opsin الحساسة للضوء التي تعبر عنها الخلايا المعدلة وراثيا. وبالتالي ، فإن علم البصريات الوراثي يمكن من التعديل المتطور أو مراقبة الخلايا المختارة وراثيا في الدوائر العصبية المعقدة14,17. وقد استلزم الاستخدام الأوسع للنهج البصري الوراثي التسجيل العصبي المتزامن لتأكيد التعديل العصبي البصري مباشرة. لذلك ، فإن الجهاز المتكامل مع وظائف التحكم في الضوء والتسجيل سيكون ذا قيمة كبيرة16،18،19،20،21،22،23،24،25.
هناك قيود على التحفيز البصري الوراثي التقليدي القائم على الليزر ، والذي يتطلب نظاما ضخما ومكلفا لتوصيل الضوء 26،27،28،29،30. لذلك ، استخدمت بعض المجموعات البحثية مجسات السيليكون القائمة على μLED لتقليل حجم نظام توصيل الضوء31،32،33،34. ومع ذلك ، هناك خطر تلف الدماغ الحراري الناجم عن الاتصال المباشر مع μLEDs بسبب انخفاض كفاءة تحويل الطاقة من المصابيح. تم تطبيق أدلة موجية ضوئية ، مثل الألياف البصرية ، SU-8 ، وأوكسينتريد السيليكون (SiON) ، لتجنب التلف الحراري30،35،36،37،38،39. ومع ذلك ، فإن هذه الاستراتيجية لها أيضا عيب بسبب انخفاض كفاءة الاقتران بين مصادر الضوء والأدلة الموجية.
تم تقديم مجموعة العدسات الدقيقة سابقا لتعزيز كفاءة اقتران الضوء بين مصابيح LED والألياف البصرية40. تم تطوير نظام optrode على أساس تقنيات الأنظمة الكهروميكانيكية الدقيقة (MEMS) للتحفيز البصري والتسجيل الكهربائي على مقياس مجهري40. زادت مصفوفة العدسات الدقيقة بين LED والألياف البصرية من كفاءة الإضاءة بمقدار 3.13 ديسيبل. كما هو موضح في الشكل 1 ، يتم محاذاة صفيف الألياف البصرية 2x2 على صفيف microlens 4x4 ، ويتم وضع LED أسفل صفيف microlens. يتم تركيب الألياف البصرية 2x2 بدلا من 4x4 لتقليل تلف الدماغ. يتم وضع مصفوفة قطب التنغستن بجوار مصفوفة الأوبترود باستخدام السيليكون عبر ثقوب للتسجيل الكهروفسيولوجي (الشكل 1B).
يتكون النظام من جزء علوي يمكن التخلص منه وأجزاء سفلية قابلة للفصل. تم تصميم الجزء العلوي القابل للتصرف ، والذي يتضمن مصفوفة الألياف البصرية ، ومصفوفة العدسات الدقيقة ، ومجموعة قطب التنغستن ، ليتم زرعها بشكل دائم في الدماغ لإجراء تجارب في الجسم الحي . يتضمن الجزء السفلي مصدر ضوء LED وخط إمداد طاقة خارجي ، والذي يمكن إزالته بسهولة وإعادة استخدامه لتجربة حيوانية أخرى. يحمي الغطاء البلاستيكي القابل للتوصيل الجزء القابل للتصرف عند إزالة الجزء القابل للفصل.
يتم التحقق من جدوى النظام عن طريق الزرع في أدمغة الفئران المعدلة وراثيا التي تعبر عن قناة رودوبسين-2 (ChR2) في الخلايا العصبية الإيجابية للبروتين كيناز II المعتمد على Ca2 + / calmodulin (CaMKIIα::ChR2 mouse). تم استخدام أقطاب التسجيل لتسجيل الأنشطة العصبية من الخلايا العصبية الفردية أثناء التحفيز البصري للخلايا العصبية.
Protocol
تمت الموافقة على رعاية الحيوانات والإجراءات الجراحية من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانات (IACUC) في جامعة Ewha Womans University (رقم 20-029).
1. إعداد مصفوفة optrode (الشكل 1 والشكل 2)
- إرفاق الألياف البصرية مع صفيف microlens.
- قم بإزالة طلاء التخميل للألياف البصرية وقطعه إلى قطع بطول 5 مم باستخدام ساطور ألياف بصرية دقيق.
- اغمس الألياف البصرية في راتنج الأشعة فوق البنفسجية الشفاف وضع الألياف البصرية على صفيف العدسات الدقيقة.
- علاج الراتنج باستخدام مصباح الأشعة فوق البنفسجية.
- إرفاق صفيف microlens إلى السكن المطبوع 3D باستخدام الايبوكسي.
- محاذاة أسلاك التنغستن المطلية بالبيرفلوروألكوكسي (PFA).
- قم بلحام 4 قطع من أسلاك التنغستن PFA بطول 30 مم وسلك فضي واحد إلى الموصل الأنثوي ذو ال 5 دبابيس و 1.27 مم. استخدم سلك الفضة كقطب مرجعي.
- قم بتوصيل الموصل الأنثوي ذو الميل 1.27 مم بمكبر الصوت الأمامي.
- ضع أسلاك التنغستن بعناية عبر السيليكون عبر الثقوب (الشكل 1B) للمساعدة في المحاذاة الدقيقة لأقطاب التنغستن.
- قطع أسلاك التنغستن المحاذاة 1 مم أقصر من طول الألياف البصرية.
- قم بتوصيل الموصل بالسكن المطبوع 3D باستخدام الايبوكسي.
- وضع LED
- ضع الصمام في السكن المطبوع 3D.
- قم بتوصيل مؤشر LED بدائرة القيادة التي تولد تعديل عرض النبضة (PWM).
ملاحظة: يتم إنشاء نبضة PWM بواسطة المتحكم الدقيق. - نظرا للضوضاء الناجمة عن دائرة القيادة LED ، تأكد من أن أقطاب التسجيل تبعد 50 مم عن دائرة القيادة LED.
- قم بقياس شدة الضوء في نهاية طرف الألياف البصرية باستخدام صمام ثنائي ضوئي.
- اغمر أقطاب التنغستن والألياف البصرية في الكحول لمدة 15 دقيقة. ثم اغمر النظام في ماء D.I المعقم وتعقيمه بغاز أكسيد الإيثيلين.
2. جراحة الزرع (الشكل 3 والشكل 4)
ملاحظة: يجب اتباع تقنية معقمة أثناء الجراحة.
- تحضير الحيوانات المعدلة وراثيا ، والتي يتم تعديلها وراثيا للتعبير عن بروتينات opsin الحساسة للضوء في نوع معين من الخلايا العصبية.
ملاحظة: تم استخدام ذكر ، يبلغ من العمر شهرين ، فأر معدل وراثيا يعبر عن قناة رودوبسين-2 (ChR2) في الخلايا العصبية الإيجابية للبروتين المعتمد على Ca2 + / calmodulin kinase II (CaMKIIα::ChR2 mouse) في هذه الدراسة41. - تخدير الفأر مع كوكتيل الكيتامين-زيلازين - خليط من الكيتامين (100 ملغ / كغ) و xylazine (10 ملغ / كغ) - عن طريق الإدارة داخل الصفاق.
- تحقق من الحيوان المخدر كل 30 دقيقة عن طريق مراقبة حركة الشعيرات ورد الفعل على قرصة مخلب.
- حقن كوكتيل الكيتامين-زيلازين في نصف الجرعة الأولية إذا كانت هناك حاجة إلى تخدير إضافي.
- حلق جلد الرأس ووضع الماوس المخدر في الإطار التجسيمي.
ملاحظة: إجراء التحضير الجراحي للجلد ولف الحيوان. يتضمن تحضير الجلد إزالة الشعر يليه تنظيف الجلد بعوامل مضادة للميكروبات.- ضع الرأس داخل الإطار التجسيمي وأدخل قضبان الأذن في اللحم.
- قم بتوسيط رأس الماوس في الإطار التجسيمي عن طريق تخفيف وتشديد قضبان الأذن بشكل متكرر لتحديد المواقع بدقة.
- ضع قضيب القواطع بحيث يتم ربط القواطع العلوية فوق الحافة الداخلية الأمامية.
- اضبط شريط القاطعة لضبط ارتفاع شريط القاطعة ، وشد مشبك الأنف ضد الخطم.
- قم بتشغيل وسادة التدفئة الحرارية المضمنة في الإطار التجسيمي مقدما للحفاظ على درجة حرارة الجسم عند 37 درجة مئوية طوال العمليات الجراحية.
- ضع المسبار الحراري في مستقيم الماوس لتنظيم الحرارة المثلية.
ملاحظة: يجب التحقق من موضع قضيب الأذن عن طريق الإمساك بالخطم والتمايل برفق. يجب إعادة ضبط شريط الأذن إذا كان من الممكن تحريك الخطم أكثر من ~ 4 مم أفقيا.
- غطي العينين بالفازلين (انظر جدول المواد) لمنع الجفاف.
- حقن 1٪ يدوكائين في فروة الرأس. ارفع جلد الرأس بالملقط ، وقم بتأمين مساحة حقن ، وحقن يدوكائين تحت فروة الرأس.
- قم بإجراء شق سهمي باستخدام مشرط ومقص دقيق. امسك الجلد المحفور بمشبك صغير لتوسيع نطاق رؤية المنطقة الجراحية.
ملاحظة: يبلغ طول الشق <1 سم فوق البريجما والحافة الذيلية للعظم الجداري. - إزالة السمحاق باستخدام مسحات القطن. إذا كان هناك نزيف ، قم بكي الجمجمة باستخدام بوفي لإغلاق الأوعية الدموية.
- نظف الجمجمة بمحلول ملحي وحدد مواقع بضع القحف باستخدام ذراع ملاعب: الحصين الأمامي الخلفي (AP) −1.8 إلى -2.8 مم ، الإنسي الجانبي (ML) 0.5-2.5 مم ، والظهري البطني (DV) من -1 إلى -2 مم.
ملاحظة: بالنظر إلى سمك جمجمة الماوس، أدخل صفيف الأوبترود -1.2 إلى -2.2 مم من منطقة الدماغ المكشوفة. بالنظر إلى مسار الحصين ، ترسل الخلايا الهرمية ل CA3 محاورها إلى CA1. لذلك ، تكون الألياف البصرية أطول بمقدار 1 مم من أقطاب التسجيل ، بحيث يتم وضع الألياف البصرية في CA3 وأقطاب التسجيل في CA1. - حفر حفرة فوق المخيخ وإدخال المسمار للأرض. ضع المسمار الأرضي بعمق 0.5 مم باستخدام برغي دقيق حتى يصل إلى الجزء العلوي من المخيخ.
ملاحظة: تأكد من الإدخال المحكم للبرغي ، والذي سيتم استخدامه كقطب أرضي وهيكل داعم لتحقيق أقصى قدر من الاستقرار على المدى الطويل للزرع ، لأنه يزيد من السطح ثلاثي الأبعاد للالتصاق بأسمنت الأسنان. - حفر المنطقة المحددة وإزالة قطعة من الجمجمة مع ملقط.
- ثني طرف إبرة 26 جم إلى 120 درجة في اتجاه عقارب الساعة ، وكشف منطقة الدماغ عن طريق إدخال الجانب المشطوف من الإبرة المتجه لأعلى. احرص على عدم إتلاف الدماغ والأوعية الدموية.
- نظف الدماغ المكشوف بمحلول ملحي لغسل غبار العظام والمواد الدخيلة.
- قم بإصلاح صفيف optrode في ذراع المتلاعب واقترب من المنطقة المكشوفة.
ملاحظة: عند وضع الجهاز، يمكن أن تؤدي إعادة حساب المنطقة المستهدفة مرة أخرى من البريجما إلى زيادة دقة الموضع. - أدخل صفيف optrode ببطء وقم بتوصيل المسمار الأرضي بالسلك الفضي المتصل بالنظام42.
ملاحظة: في هذه العملية، يجب تثبيت الصفيف بإحكام على ذراع المتلاعب لتقليل التذبذب لمنع تلف الدماغ من الحركة الدقيقة أثناء الإدخال. يجب إجراء الإدخال ببطء ، مع الراحة لمدة 10 دقائق لحساب تورم الدماغ الذي ربما تم الضغط عليه بعد الإدخال. يوصى بسرعة إدخال أقل من 1 ميكرومتر / ثانية في أنسجة المخ للحصول على جودة عالية لنسبة الإشارة إلى الضوضاء وعدد الوحدات الفردية القابلة للفصل42. - إذا كان هناك نزيف ، فقم بالضغط المباشر على النزيف باستخدام قطعة قطن جافة أو استخدم الكي. لا تنتقل إلى الخطوات التالية حتى يتوقف النزيف تماما.
- أدخل رغوة هلام بين الدماغ المكشوف والجهاز لحماية المواد الكيميائية من الاتصال المباشر مع الدماغ.
ملاحظة: رغوة الجل تساعد أيضا على الإرقاء وتحافظ على رطوبة الدماغ. - امسح الجمجمة بمسحات قطنية لإزالة الرطوبة قدر الإمكان ، وانتقل إلى خطوة التثبيت التالية.
- ضع أسمنت الأسنان بعناية على الجمجمة لإصلاح الجهاز وتغطية رغوة الجل. قبل أن يتم تصلب أسمنت الأسنان بالكامل ، افصل فروة الرأس إذا كانت متصلة بأسمنت الأسنان. اسحب الجلد المحفور باستخدام ملقط لتغطية أسمنت الأسنان المتصلب وخياطة فروة الرأس. ثم حرر الجهاز من ذراع المتلاعب.
ملاحظة: تأكد من أن أسمنت الأسنان لا يلتصق بالجلد ويغطي منطقة الجمجمة فقط. عندما ينمو الجلد ، يمكنه دفع الأسمنت بعيدا ، وفي النهاية ، سيسقط الجهاز. هذا سوف يسبب مشكلة حرجة على المدى الطويل في التجارب في الجسم الحي .
3. التعافي ورعاية الزرع
- أخرج الماوس من الإطار التجسيمي.
- إدارة محلول كاربروفين باستخدام إبرة 26 G. حقن مرة واحدة قبل الجراحة و 12 ساعة (صباح اليوم التالي في حالة جراحة بعد الظهر) و 24 ساعة بعد الجراحة لتقليل الألم.
ملاحظة: تركيز الدواء في الزجاجة هو 50 ملغ / مل ، ويتم تخزينه في 4 درجات مئوية. كاربروفين لزج ويحتاج إلى تخفيفه في الماء المعقم 1:10. إذا تم الحفاظ على العقم ، يمكن تخزين المحلول لمدة تصل إلى 4 أسابيع. للحفاظ على المدة الفعالة للدواء ، حقن محلول كاربروفين على فترات 12 ساعة. - ضع الماوس على وسادة التدفئة وتحقق مما إذا كان يتعافى جيدا من التخدير.
ملاحظة: لا يترك الحيوان دون مراقبة حتى يستعيد وعيه الكافي. - إزالة خيوط خياطة 7-10 أيام بعد الجراحة.
- السماح للحيوان للتعافي لمدة 1 أسبوع. راقب تناول الطعام والماء خلال فترة التعافي. إدارة مسكن والتحقق من علامات عدم الراحة أو الألم.
ملاحظة: لا يمكن للحيوانات التي خضعت لعملية جراحية البقاء مع الحيوانات الأخرى حتى تتعافى تماما.- خلال فترة النقاهة، قم بوزن الماوس كل يوم للتحقق من تغيرات الوزن. التضحية بالفأر (انظر القسم 6) إذا كان هناك فقدان للوزن بنسبة 20٪ مقارنة بالعمر والجنس المطابق للحيوانات الضابطة.
4. التحفيز البصري الجيني والتسجيل الكهروفسيولوجي
- تخدير الماوس ووضع الماوس المخدر في الإطار التجسيمي.
- قم بإعداد معلمات التحفيز.
- اضبط وصفة نبض الضوء على دورة عمل 4٪ وتردد 10 هرتز43. قم بإعداد التحفيز الضوئي لمدة 2 ثانية (20 نبضة) أثناء التسجيل العصبي.
- استخدم تيارا بقوة 50 مللي أمبير لدفع 3 ميجاوات/مم2 شدة ضوء عند طرف الألياف البصرية. قم بقياس طاقة الضوء باستخدام الصمام الثنائي الضوئي ومقياس الطاقة وقسم طاقة الضوء على منطقة وجه الألياف البصرية.
- اخلع الغطاء البلاستيكي وقم بتوصيل الجزء العلوي الذي يحتوي على نظام توصيل الضوء بمصابيح LED والدوائر القابلة لإعادة الاستخدام.
- قم بتوصيل مضخم الصوت الأمامي بموصل 5 دبوس مزروع.
- افتح البرنامج لتسجيل الإشارات العصبية.
- قم بإعداد فلاتر البرامج. استخدم مرشح تمرير النطاق الترددي عند 0.1-20 كيلو هرتز ومرشح الشق عند 60 هرتز.
- قبل التسجيل ، تحقق مما إذا تم اكتشاف إشارات الارتفاع العصبي.
ملاحظة: إلغاء الضوضاء مهم لأن الإشارات العصبية صغيرة جدا. إذا كان مستوى الضوضاء مرتفعا جدا ، فقد يتم حجب الإشارات العصبية بواسطة الضوضاء وتصبح غير مرئية. استخدم التأريض المناسب والتدريع بالموجات الكهرومغناطيسية لتقليل الضوضاء. - بعد فحص الإشارة، قم بتسجيل الإشارات العصبية دون تحفيز الضوء لتسجيل خط الأساس.
- قم بتوصيل ضوء LED وتسجيل الاستجابات العصبية في وقت واحد (الشكل 5 والشكل 6).
ملاحظة: بمجرد التحفيز ، يجب إجراء تجربة التحفيز التالية بعد فاصل زمني لا يقل عن 5 دقائق حتى لا يؤثر النشاط العصبي الذي أثاره التحفيز السابق على التجربة التالية.
5. تحليل البيانات
- قم بتحميل البيانات التي تم الحصول عليها باستخدام برنامج MATLAB.
- احصل على أنشطة عصبية مفردة باستخدام خوارزمية فرز السنبلة "Wave-Clus"44,45. اكتشف المسامير في كل قناة بواسطة عتبة السعة كما في Eq (1)45.
العتبة = 5 × الوسيط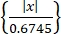 (1)
(1)
حيث x هي الإشارة التي تمت تصفيتها بواسطة ممر النطاق الترددي.- لتثبيت "Wave-Clus"، راجع رابط التنزيل في جدول المواد.
- لفتح واجهة المستخدم الرسومية (GUI)، اكتب wave_clus في موجه الأوامر الخاص ب MATLAB.
- اكتب الدالة Get_spikes('filename.ext') لامتداد الملف المعد للكشف عن الارتفاع. ثم قم بتشغيل Do_clustering ('filename_spikes.mat') لفرز الارتفاع.
- عد المسامير التي تم فرزها قبل وأثناء وبعد التحفيز الضوئي باستخدام صناديق زمنية محددة. استخدم صناديق زمنية 0.2 ثانية و 2 ثانية للتحليل.
- ارسم عدد المسامير من كل قناة تسجيل.
ملاحظة: تم حساب ورسم المتوسط مع الخطأ المعياري للوسائل (SEM) للبيانات من نتائج 8 تجارب متكررة.
6. القتل الرحيم
- بعد كل التجارب ، ضح بالفأر عن طريق استنشاق ثاني أكسيد الكربون (CO2).
- بدون شحن الغرفة مسبقا ، ضع الماوس في غرفة القتل الرحيم الشفافة ، دون توريد CO2 و / أو التسريبات.
- قم بتشغيل غاز CO2 ، وإزاحة الهواء بمعدل 30 - 50٪ من حجم هواء غرفة القتل الرحيم في الدقيقة.
ملاحظة: يجب توصيل مقياس التدفق بأسطوانة غاز CO2 لضمان أن معدل إزاحة الهواء هو 30-50٪ من حجم غرفة القتل الرحيم في الدقيقة. - راقب الفأر المضحى به لعدم وجود تنفس وتغير لون العين.
ملاحظة: عادة ما يكون الوقت المتوقع للقتل الرحيم في غضون 10 إلى 15 دقيقة. - بعد مراقبة علامات الموت ، قم بإزالة الماوس من غرفة القتل الرحيم.
- لإكمال إجراء القتل الرحيم ، تحقق من الوفاة عن طريق تأكيد السكتة التنفسية والقلبية.
النتائج
تم تصنيع نظام optrode بنجاح لتوفير طاقة ضوئية كافية لتنشيط الخلايا العصبية المستهدفة. يتم تحقيق المحاذاة الدقيقة لأقطاب التنغستن من خلال السيليكون المصنوع من الميكرو عبر الثقوب. تبلغ شدة الضوء المقاسة 3.6 ميجاوات/مم2 عند طرف الألياف البصرية عند تطبيق تيار 50 مللي أمبير. زادت العدسات الدق?...
Discussion
وتم التحقق من جدوى نظام التحفيز البصري الوراثي المتزامن والتسجيل الكهروفسيولوجي (الشكل 6). المسامير الكبيرة أثناء تحفيز الضوء هي القطع الأثرية الكهروضوئية التي تحدث في نفس الوقت الذي يتم فيه تحفيز الضوء (الشكل 6A). هذا واضح في العرض المكبر للشكل الموجي في ال?...
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذا البحث من قبل برنامج البحث والتطوير التكنولوجي المتقارب لتعزيز الإنسان من خلال المؤسسة الوطنية للبحوث في كوريا (NRF) ، بتمويل من وزارة العلوم وتكنولوجيا المعلومات والاتصالات (NRF-2019M3C1B8090805) ، وبدعم من منحة المؤسسة الوطنية للبحوث الكورية (NRF) الممولة من الحكومة الكورية (MSIT) (رقم 2019R1A2C1088909). نشكر مختبر Seung-Hee Lee في قسم العلوم البيولوجية ، KAIST ، دايجون ، كوريا ، على التكرم بتوفير الفئران المعدلة وراثيا.
Materials
| Name | Company | Catalog Number | Comments |
| 5-pin Connector | NW3 | HD127K | 1.27 mm (.050") pitch |
| Bovie | Fine Science Tools(F.S.T) | 18010-00 | High Temperature Cautery Kit |
| Data Acquisition Software | Intan Technologies, LLC | USB Interface Board software | Work with the RHD USB Interface Board |
| Dental Cement | Lang Dental Manufacturing Company, Inc. | 1223CLR | Use Jet Liquid and powder in jet denture repair package |
| Digital Manipulator Arm | Stoelting Co. | 51904/51906 | Left, Right each Digital Manipulator Arm, 3-Axes, Add-On |
| Gel Foam | Cutanplast | Standard (70*50*10 mm) | Sterile re-absorbable gelatin sponge with a haemostatic effect |
| Headstage Preamplifier | Intan Technologies, LLC | #C3314 | RHD 16-Channel Recording Headstages |
| Heating Pad | Stoelting Co. | 53800R | Stoelting Rodent Warmer X1 with Rat Heating Pad |
| LED | OSLON | GB CS8PM1.13 | λ typ. 470 nm, Viewing angle 80 °, Forward voltage 2.85 V |
| MATLAB | MathWorks, Inc. | R2019a | |
| Micro Clamp | SURGIWAY | 12-1002-04 | Straight type, Serre-fine DIEFFENBACH droite 3.5 cm |
| Optical Fiber | Thorlabs, Inc. | FT200UMT | 0.39 NA, Ø 200 µm Core Multimode Optical Fiber, High OH for 300 - 1200 nm |
| PFA-Coated Tungsten Wire | A-M System | Custom ordered | Rod type, Ø 101.6 μm (.004") |
| Photodiode | Thorlabs | S121C | |
| power meter | Thorlabs Inc. | PM100D | |
| Precision cleaver | FITEL | S326 | Fiber slicer tool |
| Prism | GraphPad | 5.01 version | |
| Scalpel | Feather™ | #20 | Scalpel blade with 100mm long Scalpel Handle |
| screw | Nasa Korea | stainless steel | diameter: 1.2 mm, length: 3 mm |
| Silver Wire | The Nilaco Corporation | AG-401265 | Ø 200 µm |
| Stereotaxic Fxrame | Stoelting Co. | 51500D | Digital new standard stereotaxic, rat and mouse |
| suture | ETHICON | W9106 | suture size: 4-0, length:75 cm, wire diameter: 4-0 |
| Vaseline | Unilever PLC | Original | 100% pure petroleum jelly |
| Wave_Clus | N/A | N/A | https://github.com/csn-le/wave_clus |
References
- Wang, Y., Liu, Y. Z., Wang, S. Y., Wang, Z. In vivo whole-cell recording with high success rate in anaesthetized and awake mammalian brains. Molecular Brain. 9 (1), 86 (2016).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments: JoVE. (112), e54024 (2016).
- Lee, D., Shtengel, G., Osborne, J. E., Lee, A. K. Anesthetized- and awake-patched whole-cell recordings in freely moving rats using UV-cured collar-based electrode stabilization. Nature Protocols. 9 (12), 2784-2795 (2014).
- Tao, C., Zhang, G., Xiong, Y., Zhou, Y. Functional dissection of synaptic circuits: in vivo patch-clamp recording in neuroscience. Frontiers in Neural Circuits. 9, 23 (2015).
- Henze, D. A., et al. Intracellular features predicted by extracellular recordings in the hippocampus in vivo. Journal of Neurophysiology. 84 (1), 390-400 (2000).
- Takahashi, S., Anzai, Y., Sakurai, Y. Automatic sorting for multi-neuronal activity recorded with tetrodes in the presence of overlapping spikes. Journal of Neurophysiology. 89 (4), 2245-2258 (2003).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature Neuroscience. 19 (4), 634-641 (2016).
- Balasubramaniam, S., et al. Wireless communications for optogenetics-based brain stimulation: present technology and future challenges. IEEE Communications Magazine. 56 (7), 218-224 (2018).
- Bedbrook, C. N., et al. Machine learning-guided channelrhodopsin engineering enables minimally invasive optogenetics. Nature Methods. 16 (11), 1176-1184 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deng, W., Goldys, E. M., Farnham, M. M., Pilowsky, P. M. Optogenetics, the intersection between physics and neuroscience: light stimulation of neurons in physiological conditions. American journal of physiology. Regulatory, Integrative and Comparative Physiology. 307 (11), 1292-1302 (2014).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annual Review Neuroscience. 34, 389-412 (2011).
- Mahmoudi, P., Veladi, H., Pakdel, F. G. Optogenetics, tools and applications in neurobiology. Journal of Medical Signals and Sensors. 7 (2), 71-79 (2017).
- Sasaki, Y., et al. Near-infrared optogenetic genome engineering based on photon-upconversion hydrogels. Angewandte Chemie International Edition in English. 58 (49), 17827-17833 (2019).
- Zhang, Y., et al. Battery-free, lightweight, injectable microsystem for in vivo wireless pharmacology and optogenetics. Proceedings of National Academy of Sciences of the United States of America. 116 (43), 21427-21437 (2019).
- Bernstein, J. G., Boyden, E. S. Optogenetic tools for analyzing the neural circuits of behavior. Trends in Cognitive Sciences. 15 (12), 592-600 (2011).
- Wang, J., et al. Integrated device for combined optical neuromodulation and electrical recording for chronic in vivo applications. Journal of Neural Engineering. 9 (1), 016001 (2012).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Zhang, J., et al. Integrated device for optical stimulation and spatiotemporal electrical recording of neural activity in light-sensitized brain tissue. Journal of Neural Engineering. 6 (5), 055007 (2009).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proceedings of National Academy of Sciences of the United States of America. 113 (50), 8169-8177 (2016).
- Kravitz, A. V., Owen, S. F., Kreitzer, A. C. Optogenetic identification of striatal projection neuron subtypes during in vivo recordings. Brain Research. 1511, 21-32 (2013).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4 (3), 143-156 (2007).
- Anikeeva, P., et al. Optetrode: a multichannel readout for optogenetic control in freely moving mice. Nature Neuroscience. 15 (1), 163-170 (2011).
- Obaid, S. N., et al. Multifunctional flexible biointerfaces for simultaneous colocalized optophysiology and electrophysiology. Advanced Functional Materials. 30 (24), 1910027 (2020).
- Wang, L., et al. An artefact-resist optrode with internal shielding structure for low-noise neural modulation. Journal of Neural Engineering. 17 (4), 046024 (2020).
- Shin, H., et al. Multifunctional multi-shank neural probe for investigating and modulating long-range neural circuits in vivo. Nature Communications. 10 (1), 3777 (2019).
- Kampasi, K., et al. Dual color optogenetic control of neural populations using low-noise, multishank optoelectrodes. Microsystem & Nanoengineering. 4, 10 (2018).
- Schwaerzle, M., Paul, O., Ruther, P. Compact silicon-based optrode with integrated laser diode chips, SU-8 waveguides and platinum electrodes for optogenetic applications. Journal of Micromechanics and Microengineering. 27 (6), 065004 (2017).
- Son, Y., et al. In vivo optical modulation of neural signals using monolithically integrated two-dimensional neural probe arrays. Scientific Reports. 5, 15466 (2015).
- Yasunaga, H., et al. Development of a neural probe integrated with high-efficiency MicroLEDs for in vivo application. Japanese Journal of Applied Physics. 60 (1), 016503 (2020).
- Kim, K., et al. Artifact-free and high-temporal-resolution in vivo opto-electrophysiology with microLED optoelectrodes. Nature Communications. 11 (1), 2063 (2020).
- Mendrela, A. E., et al. A high-resolution opto-electrophysiology system with a miniature integrated headstage. IEEE Transactions on Biomedical Circuits and Systems. 12 (5), 1065-1075 (2018).
- Scharf, R., et al. Depth-specific optogenetic control in vivo with a scalable, high-density muLED neural probe. Scientific Reports. 6, 28381 (2016).
- Oh, K., Sonsi, Y. -. A., Ha, S. Optogenetic stimulator with µLED-coupled optical fiber on flexile substrate via 3D printed mount. 2021 21st International Conference on Solid-State Sensors, Actuators and Microsystems (Transducers). , 1476-1479 (2021).
- McAlinden, N., et al. Multisite microLED optrode array for neural interfacing. Neurophotonics. 6 (3), 035010 (2019).
- Kwon, K. Y., Lee, H. M., Ghovanloo, M., Weber, A., Li, W. Design, fabrication, and packaging of an integrated, wirelessly-powered optrode array for optogenetics application. Frontiers in Systems Neuroscience. 9, 69 (2015).
- Bernstein, J. G., Allen, B. D., Guerra, A. A., Boyden, E. S. Processes for design, construction and utilisation of arrays of light-emitting diodes and light-emitting diode-coupled optical fibres for multi-site brain light delivery. Journal of Engineering. , (2015).
- Stark, E., Koos, T., Buzsaki, G. Diode probes for spatiotemporal optical control of multiple neurons in freely moving animals. Journal of Neurophysiology. 108 (1), 349-363 (2012).
- Jeon, S., et al. Implantable optrode array for optogenetic modulation and electrical neural recording. Micromachines. 12 (6), 725 (2021).
- Song, Y. H., et al. A neural circuit for auditory dominance over visual perception. Neuron. 93 (4), 940-954 (2017).
- Fiáth, R., et al. Slow insertion of silicon probes improves the quality of acute neuronal recordings. Scientific Reports. 9 (1), 111 (2019).
- Melchior, J. R., Ferris, M. J., Stuber, G. D., Riddle, D. R., Jones, S. R. Optogenetic versus electrical stimulation of dopamine terminals in the nucleus accumbens reveals local modulation of presynaptic release. Journal of Neurochemistry. 134 (5), 833-844 (2015).
- Quiroga, R. Q., Nadasdy, Z., Ben-Shaul, Y. Unsupervised spike detection and sorting with wavelets and superparamagnetic clustering. Neural Computation. 16 (8), 1661-1687 (2004).
- Chaure, F. J., Rey, H. G., Quian Quiroga, R. A novel and fully automatic spike-sorting implementation with variable number of features. Journal of Neurophysiology. 120 (4), 1859-1871 (2018).
- Casanova, F., Carney, P. R., Sarntinoranont, M. Effect of needle insertion speed on tissue injury, stress, and backflow distribution for convection-enhanced delivery in the rat brain. PLoS One. 9 (4), 94919 (2014).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Arias-Gil, G., Ohl, F. W., Takagaki, K., Lippert, M. T. Measurement, modeling, and prediction of temperature rise due to optogenetic brain stimulation. Neurophotonics. 3 (4), 045007 (2016).
- Jeon, S., et al. Multi-wavelength light emitting diode-based disposable optrode array for in vivo optogenetic modulation. Journal of Biophotonics. 12 (5), 201800343 (2019).
- Korposh, S., James, S. W., Lee, S. -. W., Tatam, R. P. Tapered optical fibre sensors: current trends and future perspectives. Sensors. 19 (10), 2294 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved