Method Article
زرع الخلايا الدبقية الصغيرة المشتقة من الخلايا الجذعية متعددة القدرات التي يسببها الإنسان في دماغ الفئران المناعية عبر طريق الأنف غير الغازي
In This Article
Summary
يسمح البروتوكول المعروض هنا بزرع الخلايا الدبقية البشرية المستحثة متعددة القدرات المشتقة من الخلايا الجذعية (iPSMG) في الدماغ عبر طريق عبر الأنف في الفئران المناعية. يتم عرض طريقة تحضير وزرع الخلايا عبر الأنف وإدارة خليط السيتوكين للحفاظ على iPSMG.
Abstract
الخلايا الدبقية الصغيرة هي مجموعة متخصصة من الخلايا الشبيهة بالبلاعم في الدماغ. أنها تلعب أدوارا أساسية في كل من وظائف الدماغ الفسيولوجية والمرضية. يعتمد معظم فهمنا الحالي للدبقية الصغيرة على التجارب التي أجريت على الماوس. تختلف الخلايا الدبقية الصغيرة البشرية عن الخلايا الدبقية الصغيرة للفئران ، وبالتالي فإن استجابة وخصائص الخلايا الدبقية الصغيرة للفأر قد لا تمثل دائما استجابة وخصائص الخلايا الدبقية الصغيرة البشرية. علاوة على ذلك ، بسبب الصعوبات الأخلاقية والتقنية ، يقتصر البحث في الخلايا الدبقية الصغيرة البشرية على نظام الاستزراع في المختبر ، والذي لا يستسلم في خصائص الجسم الحي للخلايا الدبقية الصغيرة. للتغلب على هذه المشكلات ، تم تطوير طريقة مبسطة لزرع الخلايا الدبقية البشرية المستحثة متعددة القدرات (iPSMG) المستحثة بشكل غير جراحي في دماغ الفئران المناعية عبر طريق عبر الأنف بالاقتران مع النضوب الدوائي للخلايا الدبقية الصغيرة الذاتية المنشأ باستخدام مضاد مستقبلات العامل 1 المحفز للمستعمرة (CSF1R). يوفر هذا البروتوكول طريقة لزرع الخلايا بشكل غير جراحي في دماغ الفأر ، وبالتالي قد يكون ذا قيمة لتقييم دور الخلايا الدبقية الصغيرة البشرية في وظائف الدماغ الفسيولوجية والمرضية.
Introduction
الخلايا الدبقية الصغيرة هي مجموعة متخصصة من الخلايا الشبيهة بالبلاعم في الجهاز العصبي المركزي (CNS) وتلعب أدوارا أساسية في التحكم في وظائف الدماغ المختلفة مثل تطور الدائرة العصبية ، وتعديل النقل العصبي ، والحفاظ على توازن الدماغ1،2،3. على الرغم من أن الخلايا الدبقية الصغيرة الفئران تشترك في العديد من الوظائف مع وظائف البشر ، إلا أنها تظهر اختلافات خاصة بالأنواع. وبالتالي ، فإن استجابة الخلايا الدبقية الصغيرة للفئران لمختلف المحفزات قد لا تمثل دائما استجابة الخلايا الدبقية الصغيرة البشرية 4,5,6. على الرغم من أن العديد من الدراسات قد حللت الخلايا الدبقية الصغيرة البشرية ، إلا أن هذه التجارب تقتصر على الدراسات المخبرية. تظهر الخلايا الدبقية الصغيرة البشرية المستزرعة في المختبر ميزات مورفولوجية وتعبيرا جينيا مختلفا تماما عن تلك الموجودة في الجسم الحي. وبالتالي ، قد لا تستسلم التجارب في المختبر دائما للخصائص الحية للخلايا الدبقية الصغيرة البشرية. لذلك ، هناك حاجة إلى نظام تجريبي لدراسة الخلايا الدبقية الصغيرة البشرية في الجسم الحي.
في الآونة الأخيرة ، لدراسة الخصائص في الجسم الحي للخلايا الدبقية الصغيرة البشرية ، في المختبر ولدت الخلايا الجذعية المستحثة متعددة القدرات (iPSCs) - أو الخلايا الجذعية الجنينية المشتقة من الخلايا الدبقية البشرية يتم زرعها جراحيا في دماغ الفئران7،8،9،10،11،12،13،14. باستخدام هذا النهج ، تم تمييز العديد من الميزات في الجسم الحي للخلايا الدبقية الصغيرة البشرية. ومع ذلك ، فإن الاستخدام الواسع النطاق لهذه الطريقة محدود لسببين. الأول هو شرط الفئران التي تعاني من نقص المناعة. وبالتالي ، لدراسة دور الخلايا الدبقية الصغيرة البشرية في مختلف الأمراض العصبية التنكسية ، يجب عبور الفئران الحاملة للطفرات المرضية إلى فئران تعاني من نقص المناعة ، الأمر الذي يتطلب وقتا وجهدا كبيرين. علاوة على ذلك ، في مختلف الاضطرابات العصبية ، يمكن للخلايا المناعية الطرفية ، مثل الخلايا التائية ، تعديل وظائف الخلايا الدبقية الدقيقة15،16،17. لذلك ، قد لا تمثل التجارب التي أجريت على الفئران التي تعاني من نقص المناعة خصائص حسنة النية للخلايا الدبقية الصغيرة البشرية في الجسم الحي. ثانيا، تتطلب العمليات الجراحية الغازية لزرع الخلايا الدبقية الصغيرة معدات وتدريبا إضافيين. علاوة على ذلك ، قد تؤدي إصابة الدماغ أثناء الزرع الغازي إلى تغيير الأنماط الظاهرية الدبقية الصغيرة.
في هذا البروتوكول ، يتم وصف الزرع عبر الأنف غير الغازي (Tsn) من iPSMG في الفئران البرية ذات الكفاءة المناعية18. من خلال الجمع بين ON/OFF الدوائي لمضاد CSF1R PLX5622 الذي يستنفد الخلايا الدبقية الصغيرة للفئران الذاتية المنشأ19 و TSN ، يمكن زرع iPSMG بشكل غير جراحي في دماغ الفأر. علاوة على ذلك ، مع تطبيق السيتوكين البشري الخارجي ، يظل iPSMG المزروع قابلا للحياة لمدة 60 يوما بطريقة خاصة بالمنطقة دون أي مثبطات للمناعة.
Protocol
تم الحصول على جميع الحيوانات المستخدمة في هذه الدراسة وإيوائها ورعايتها واستخدامها وفقا ل "المبادئ التوجيهية في رعاية واستخدام الحيوانات في مجال العلوم الفسيولوجية" التي نشرتها الجمعية الفسيولوجية اليابانية20 ، وبموافقة مسبقة من لجنة رعاية الحيوان بجامعة ياماناشي (Yamanashi ، اليابان).
1. تحضير وسط الخلية ووسط الزرع وخليط التخدير
- تحضير وسط الخلية عن طريق إضافة 10٪ مصل بقري جنيني و 0.1٪ بنسلين / ستربتومايسين في DMEM.
- قم بإعداد وسط الزرع عن طريق إضافة hCSF1 (250 نانوغرام / مل) و hTGF-β1 (100 نانوغرام / مل) إلى وسط الخلية.
- تحضير خليط التخدير للحقن داخل الصفاق عن طريق خلط 0.45 مل من هيدروكلوريد ميديتوميدين ، 1.2 مل من الميدازولام ، و 1.5 مل من طرطرات بوتيوفيفانول في 11.8 مل من المالحة العادية.
2. إعداد iPSMG
ملاحظة: تم الاحتفاظ ب iPSMG المجمدة (جدول المواد) عند -80 درجة مئوية حتى الاستخدام.
- قم بإذابة الخلايا المجمدة بسرعة في حمام مائي 37 درجة مئوية. قم بتدوير العينات حتى يذوب الجليد المرئي.
- أضف iPSMG المذاب إلى وسائط الثقافة الدافئة إلى 37 درجة مئوية. أضف 1 مل من الخلايا المذابة التي تحتوي على وسط (1 × 106 خلايا) إلى 10 مل من وسائط الزرع.
- الطرد المركزي للخلايا في 300 × غرام لمدة 5 دقائق للحصول على بيليه الخلية.
- بعد الطرد المركزي ، قم بإزالة جميع المواد الفائقة دون إزعاج حبيبات الخلية. الإزالة الكاملة لل supernatant أمر مرغوب فيه للحد من تخفيف تركيز السيتوكين في وسط الزرع.
- أضف وسط الزرع للحصول على تركيز خلية 1 × 105 خلايا / ميكرولتر.
- ضع iPSMG على الجليد وانتقل على الفور إلى الزرع.
ملاحظة: يتم إعداد iPSMG للزرع على مقعد نظيف لتجنب التلوث.
3. إعداد الفأر لزرع الأنف (Tsn)
- إطعام الفئران الذكور من النوع البري (C57BL / 6J ، 8 أسابيع من العمر) مع PLX5622 التي تحتوي على نظام غذائي لمدة 7 أيام.
- فينهاية اليوم 7 ، توقف عن اتباع نظام PLX الغذائي وأطعم الفئران بنظام غذائي طبيعي حتى نهاية الدراسة.
ملاحظة: يتم تحضير النظام الغذائي الذي يحتوي على PLX5622 عن طريق إضافة 1.2 غرام من PLX5622 في 1 كجم من AIN-93G (جدول المواد).
4. زرع الخلايا عبر الأنف
- بعد 24 ساعة من توقف تغذية PLX ، قم بوزن الفئران وتخديرها باستخدام حقن داخل الصفاق لخليط التخدير (0.2 مل / 20 جم).
- بعد تخدير الفئران بالكامل كما تم تقييمها من خلال عدم الاستجابة لمنعكس سحب الدواسة (قرصة إصبع القدم الثابتة) ، قم بإعطاء 2.5 ميكرولتر من الهيالورونيداز في PBS (100 U / mL) في 1 ساعة قبل Tsn من iPSMG لكل فتحة أنف مرتين باستخدام طرف ماصة 10 ميكرولتر لزيادة نفاذية الغشاء المخاطي للأنف.
- بعد تطبيق هيالورونيداز ، ضع الفئران في وضع ضعيف.
- كرر الخطوة 4.2 قبل 10 دقائق من زرع iPSMG عبر الأنف.
- ضع 2.5 ميكرولتر من تعليق الخلية في فتحة أنف واحدة من الماوس باستخدام طرف ماصة 10 ميكرولتر.
- ضع الماوس في وضع ضعيف لمدة 5 دقائق قبل إعطاء تعليق الخلية إلى فتحة الأنف الأخرى.
- كرر الخطوتين 4.5 و 4.6 أربع مرات ، مع تطبيق حجم إجمالي قدره 20 ميكرولتر لكل.
- ضع الماوس في وضع ضعيف على وسادة حرارية 37 درجة مئوية حتى يتعافى من التخدير.
- في 48 ساعة بعد توقف تغذية PLX ، كرر الخطوات 4.1-4.7 على نفس الفئران مرة أخرى.
ملاحظة: تجدر الإشارة إلى أن iPSMG يتم وضعها على الجليد أثناء عملية الزرع.
5. تطبيق السيتوكينات
- تخدير الفئران عن طريق الحقن داخل الصفاق من خليط التخدير (0.2 مل / 20 جم).
- ضع 2.5 ميكرولتر من وسط الزرع في فتحة أنف واحدة من الماوس باستخدام طرف ماصة 10 ميكرولتر.
- ضع الماوس في وضع ضعيف لمدة 5 دقائق قبل إعطاء وسط الزرع إلى فتحة الأنف الأخرى.
- كرر الخطوتين 5.2 و 5.3 أربع مرات ، مع تطبيق حجم إجمالي قدره 20 ميكرولتر لكل.
ملاحظة: تجدر الإشارة إلى أن الإدارة عبر الأنف لوسط الزرع (السيتوكينات البشرية) مطلوبة كل 12 ساعة من أجل جدوى iPSMG المزروعة حتى نهاية الدراسة.
النتائج
تسمح هذه التقنية للباحث بزرع iPSMG بشكل غير جراحي في الحصين والمخيخ ولكن ليس في قشرة دماغ الفأر. بعد الانتهاء من الدراسة ، تعرضت الفئران المخدرة لتروية عبر القلب من PBS الباردة المثلجة (−) ، تليها 4٪ (ث / v) بارافورمالديهايد في PBS. تم عزل الأدمغة ، وتثبيتها بين عشية وضحاها في 4٪ (ث / v) بارافورمالديهايد ، ومحمية بالتبريد في PBS تحتوي على 30٪ (ث / v) السكروز. علاوة على ذلك ، تم تجميد الأدمغة في مركب مضمن وتقسيمها (أقسام إكليلية سميكة 20 ميكرومتر) على جهاز تبريد. تم غسل الأقسام ثلاث مرات في PBS (−) (10 دقائق لكل منها) وتخلل ومنعت مع 0.5٪ (v / v) Triton X-100 في مصل الماعز العادي بنسبة 10٪ لمدة ساعة واحدة. ثم تم احتضان الأقسام بعلامة سيتوبلازم مضادة للإنسان ، STEM121 (1:100) ، ومضادة Iba1 (1:1000) لمدة 5 أيام. بعد ذلك ، تم غسل الأقسام ثلاث مرات باستخدام PBS (-) لمدة 10 دقائق لكل منها وتم احتضانها بأجسام مضادة ثانوية: Alexa Fluor 488-، أو الفأر المترافق 546 ، أو الأرنب IgGs (1: 1000) لمدة 2 ساعة في درجة حرارة الغرفة. بعد الغسيل باستخدام PBS (-) ثلاث مرات ، تم تركيب الأقسام على شرائح باستخدام وسيط تركيب مضاد للتلاشي. تم استخدام مجهر متحد البؤرة مجهز بعدسة موضوعية 40x للحصول على صور التألق. تظهر صلاحية iPSMG في شهرين بعد الزرع في الحصين والقشرة في الشكل 1. يمكن تحديد عدد الخلايا المزروعة عن طريق حساب الخلايا الموجبة لكل من الأجسام المضادة الخاصة بالإنسان وعلامات عموم الخلايا الدبقية الصغيرة / الوحيدة، في حين أن الخلايا الدبقية الصغيرة للفئران الذاتية المنشأ إيجابية لعلامة عموم الخلايا الدبقية الصغيرة / الوحيدة، فقط كما هو موضح سابقا18. تحل iPSMGs المزروعة محل الخلايا الدبقية الصغيرة للفئران ، وتظهر مورفولوجيات متشعبة في الحصين ، ولا يتم اكتشافها في القشرة18.
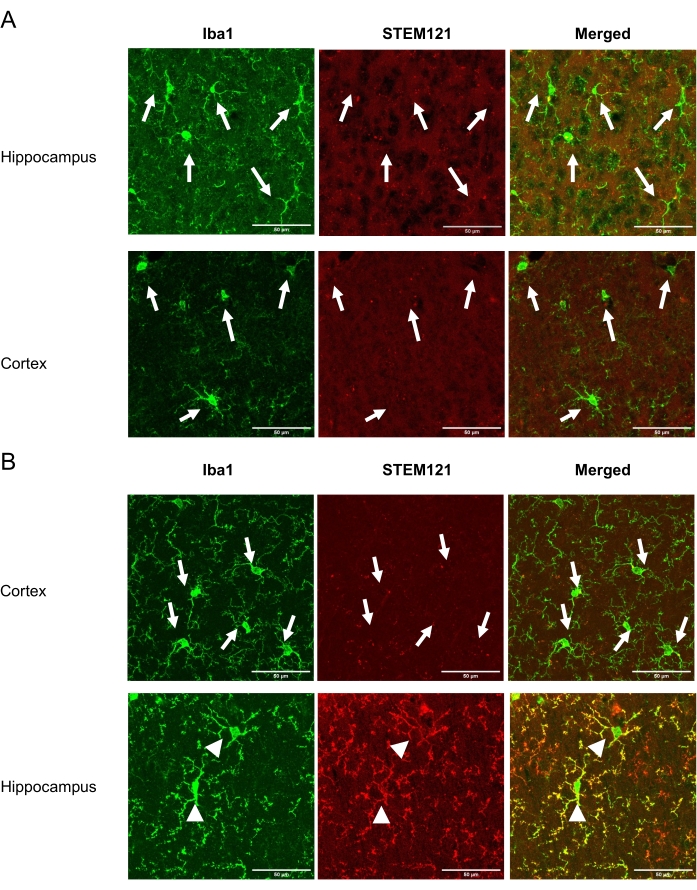
الشكل 1: جدوى iPSMG في القشرة والحصين في 2 أشهر بعد Tsn. تظهر اللوحة اليسرى تلطيخا مناعيا مع علامة عموم الخلايا الدبقية الصغيرة / أحادية الخلية ، Iba1 (أخضر). تظهر اللوحة الوسطى تلطيخا مناعيا باستخدام علامة السيتوبلازم الخاصة بالإنسان STEM121 (أحمر). تعرض اللوحة اليمنى صورة مدمجة للتلطيخ المناعي Iba1 و STEM121. (أ) في الفئران الضابطة ، تم اكتشاف الدبقية الصغيرة للفئران فقط (Iba1 + / STEM121-) في كل من القشرة والحصين. (ب) في الفئران المزروعة iPSMG ، في القشرة الدماغية ، تم اكتشاف الخلايا الدبقية الصغيرة للفئران فقط (Iba1 + / STEM121-) ، بينما في الحصين iPSMG (Iba1 + / STEM121 +). تظهر الأسهم في الصورة الخلايا الدبقية الصغيرة للماوس، بينما تظهر رؤوس الأسهم iPSMG. تم استخدام مجهر متحد البؤرة مجهز بعدسة موضوعية 40x للحصول على صورة فلورية. الحد الأقصى لحجم الصورة: 1024 × 1024 بكسل. عامل التكبير/التصغير: 2. أشرطة المقياس = 50 ميكرومتر يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف البروتوكول هنا عملية زرع iPSMG غير الغازية في دماغ الفأر. تفرد البروتوكول الحالي هو أنه من خلال الجمع بين طرق PLX ON / OFF الدوائية وزرع الأنف ، يمكن زرع iPSMG بشكل غير جراحي في دماغ الفأر المناعي. شكلت iPSMG المزروعة غالبية الخلايا الدبقية الصغيرة في الحصين والمخيخ من خلال احتلال المكان الشاغر لمدة تصل إلى 60 يوما ولكن ليس في القشرة.
النقاط الحرجة ل Tsn الفعال ل iPSMG هي (i) كفاءة استنفاد الخلايا الدبقية الصغيرة للفئران الداخلية (ii) إدارة السيتوكينات البشرية كل 12 ساعة. تحافظ الخلايا الدبقية الصغيرة على أراضيها الخاصة في الدماغ. مطلوب استنزاف فعال من الخلايا الدبقية الصغيرة للفئران لتوفير مكانة لتطعيم iPSMG المزروعة. عندما يكون استنزاف الخلايا الدبقية الصغيرة للفئران الداخلية غير كاف ، لا يلاحظ استعمار الحصين الفأر والمخيخ بواسطة iPSMG. تعتمد صلاحية الخلايا الدبقية الصغيرة على إشارات CSF1R و TGFBR 19,21,22. تم الإبلاغ عن أن hCSF1 يزيد بشكل انتقائي من صلاحية الخلايا الدبقية الصغيرة البشرية ، و hTGF-β1 مطلوب لبقاء الخلايا الدبقية الصغيرة وكذلك يخفف من الالتهاب عند إعطائه كل 12 ساعة21،23،24. في حالة عدم وجود السيتوكينات البشرية الخارجية ، لا يتم ملاحظة iPSMG في دماغ الفأر. علاوة على ذلك ، يجب الحرص على عدم تنشيط iPSMG ميكانيكيا عن طريق السحب المفرط أو بأي وسيلة أخرى قبل TSN ، لأنه يغير خصائص iPSMG بشكل لا رجعة فيه بالإضافة إلى كفاءة الزرع. إذا لم يتم رؤية Tsn المرضي ل iPSMG ، فيجب تحديد صلاحية iPSMG قبل الزرع وكذلك استنفاد الخلايا الدبقية الصغيرة الذاتية. إذا كان استنفاد الخلايا الدبقية الصغيرة للفأر الداخلي لا يزيد عن 90٪ ، فقد يتم تعديل وقت التغذية PLX5622 لزيادة النضوب.
بالمقارنة مع طريقة الزرع الجراحية التقليدية الغازية التي تتطلب معدات وتدريبا إضافيين ، تسمح Tsn بالزرع بطريقة غير غازية وبسيطة ومستقرة وسهلة. بالإضافة إلى ذلك ، تسمح هذه الطريقة بزرع iPSMG في أدمغة الفئران المناعية ؛ وبالتالي ، يمكن استخدام الفئران نموذج المرض المناعي لدراسة استجابة iPSMG.
أكبر عيب في الطريقة الحالية هو عدم التجانس الإقليمي في تطعيم iPSMG. إذا كانت عملية زرع iPSMG الخاصة بمنطقة الدماغ مطلوبة ، فإن البروتوكول الحالي غير مناسب لأن iPSMG المزروع يظل محصورا لمدة 60 يوما فقط في الحصين والمخيخ ولكن ليس في القشرة. علاوة على ذلك ، فإن الحاجة إلى إدارة السيتوكينات البشرية الخارجية داخل الأنف كل 12 ساعة هي أيضا قيود على البروتوكول الحالي لأنها تتطلب عمالة واسعة النطاق ومكلفة.
في الختام ، يتم توفير بروتوكول مفصل ل Tsn من iPSMG في أدمغة الفئران المناعية. عند دمجه مع ON/OFF الدوائي للدماوس الدبقية الصغيرة بواسطة PLX5622 ، يسمح هذا البروتوكول بالتطعيم الناجح ل iPSMG. وبما أنه يمكن ملاحظة الخلايا المزروعة في الحصين والمخيخ لفترة طويلة من الزمن عند تطبيق السيتوكينات الخارجية المنشأ، فقد تكون الطريقة الحالية ذات قيمة لتقييم دور الخلايا الدبقية الصغيرة البشرية في كل من الحالات الفسيولوجية والمرضية في تلك المناطق.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
رعاة المنحة: تم دعم هذه الدراسة من قبل JSPS KAKENHI 17K14961 (PB) و 20K15899 (PB) و JP18K06481 (YS) و JP20KK0366 (YS) و 20H05902 (SK) و 20H05060 (SK) و 19H04746 (SK) و 21H04786 (SK) و 21K19309 (SK) و AMED-Crest (SK) و CREST (SK) و Mitsubishi Science Foundation (SK) و Takeda Science Foundation (SK) و Frontier Brain Science Grant من جامعة Yamanashi (SK).
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher Scientific | 10566 | |
| AIN 93G | Oriental Yeast Co | ||
| Anti-Iba1 antibody | FUJIFILM | 019–19741 | |
| Anti-STEM121 antibody | Takara Bioscience | Y40410 | |
| Butorphanol tartrate | Kyoritsu Seiyaku | 8019 | |
| Confocal microscope | Olympus | FV1200 | |
| Fetal bovine serum | GE Healthcare Life Sciences | SH30070.03 | |
| Frozen iPSMG | Shionogi & Co., Ltd | Laboratory for Drug Discovery and Disease Research | |
| Human colony stimulating factor 1 (hCSF1) | PeproTech | 300-25 | |
| Hyaluronidase | Sigma-Aldrich | H-3506 | |
| Medetomidine hydrochloride | Meiji Seika | VETLI5 | |
| Midazolam | Astellas | 18005A2 | |
| Paraformaldehyde | Wako Pure Chemical Industries | 162-16065 | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Pipette | Eppendorf | 3120000011 | |
| Pipette tip | Eppendorf | 30076028 | |
| PLX5622 | Amadis Chemical | A930097 | |
| Transforming growth factor-β1 (Tgf-b1) | PeproTech | 100-21 | |
| Triton X-100 | Sigma-Aldrich | X-100 | |
| VECTA SHIELD Hard Set Mounting Medium | Vector Laboratories | H-1400-10 | antifade mounting medium |
References
- Hanisch, U. K., Kettenmann, H. Microglia: active sensor and versatile effector cells in the normal and pathologic brain. Nature Neuroscience. 10 (11), 1387-1394 (2007).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), 1456-1458 (2011).
- Smith, A. M., Dragunow, M. The human side of microglia. Trends in Neurosciences. 37 (3), 125-135 (2014).
- Galatro, T. F., et al. Transcriptomic analysis of purified human cortical microglia reveals age-associated changes. Nature Neuroscience. 20 (8), 1162-1171 (2017).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science. 356 (6344), (2017).
- Abud, E. M., et al. iPSC-derived human microglia-like cells to study neurological diseases. Neuron. 94 (2), 278-293 (2017).
- Brownjohn, P. W., et al. Functional studies of missense TREM2 mutations in human stem cell-derived microglia. Stem Cell Reports. 10 (4), 1294-1307 (2018).
- Douvaras, P., et al. Directed differentiation of human pluripotent stem cells to microglia. Stem Cell Reports. 8 (6), 1516-1524 (2017).
- Haenseler, W., et al. A highly efficient human pluripotent stem cell microglia model displays a neuronal-co-culture-specific expression profile and inflammatory response. Stem Cell Reports. 8 (6), 1727-1742 (2017).
- Hasselmann, J., et al. Development of a chimeric model to study and manipulate human microglia in vivo. Neuron. 103 (6), 1016-1033 (2019).
- Mancuso, R., et al. Stem-cell-derived human microglia transplanted in mouse brain to study human disease. Nature Neuroscience. 22 (12), 2111-2116 (2019).
- Muffat, J., et al. Efficient derivation of microglia-like cells from human pluripotent stem cells. Nature Medicine. 22 (11), 1358-1367 (2016).
- Pandya, H., et al. Differentiation of human and murine induced pluripotent stem cells to microglia-like cells. Nature Neuroscience. 20 (5), 753-759 (2017).
- Schetters, S. T. T., Gomez-Nicola, D., Garcia-Vallejo, J. J., Van Kooyk, Y. Neuroinflammation: Microglia and T cells get ready to tango. Frontiers in Immunology. 8, 1905 (2017).
- Sulzer, D., et al. T cells from patients with Parkinson's disease recognize alpha-synuclein peptides. Nature. 546 (7660), 656-661 (2017).
- Togo, T., et al. Occurrence of T cells in the brain of Alzheimer's disease and other neurological diseases. Journal of Neuroimmunology. 124 (1), 83-92 (2002).
- Parajuli, B., et al. Transnasal transplantation of human induced pluripotent stem cell-derived microglia to the brain of immunocompetent mice. Glia. 69 (10), 2332-2348 (2021).
- Elmore, M. R., et al. Colony-stimulating factor 1 receptor signaling is necessary for microglia viability, unmasking a microglia progenitor cell in the adult brain. Neuron. 82 (2), 380-397 (2014).
- Zasshi, N. S. Guiding principles for the care and use of animals in the field of physiological sciences. Journal of the Physiologic Society of Japan. 64 (7-8), 143-146 (2002).
- Bohlen, C. J., et al. Diverse requirements for microglial survival, specification, and function revealed by defined-medium cultures. Neuron. 94 (4), 759-773 (2017).
- Butovsky, O., et al. Identification of a unique TGF-beta-dependent molecular and functional signature in microglia. Nature Neuroscience. 17 (1), 131-143 (2014).
- Regateiro, F. S., Howie, D., Cobbold, S. P., Waldmann, H. TGF-beta in transplantation tolerance. Current Opinion in Immunology. 23 (5), 660-669 (2011).
- Yoshimura, A., Muto, G. TGF-beta function in immune suppression. Current Topics in Microbiology and Immunology. 350, 127-147 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved