A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تأثير حمض الهيالورونيك 35 كيلو دال أمبير على نموذج في المختبر للإصابات المعوية الصغيرة المبكرة والشفاء باستخدام الطبقات الأحادية المشتقة من الأمعاء
In This Article
Summary
يصف هذا البروتوكول طريقة لإنشاء وإجراء فحص جرح خدش على طبقات أحادية ثنائية الأبعاد (2D) مشتقة من الأمعاء ثلاثية الأبعاد (3D) المعزولة من الدقاق الرئيسي غير البشري.
Abstract
تستخدم فحوصات الجرح في المختبر بشكل شائع للتحقيق في آليات وخصائص الشفاء الظهاري في مجموعة متنوعة من أنواع الأنسجة. هنا ، نصف بروتوكولا لتوليد طبقة أحادية ثنائية الأبعاد (2D) من المعوية الرئيسية ثلاثية الأبعاد (3D) غير البشرية المشتقة من الخبايا المعوية للدقاق الطرفي. ثم تم استخدام هذه الطبقات الأحادية المشتقة من الأمعاء في فحص جرح خدش في المختبر لاختبار قدرة الهيالورونان 35 كيلو دال (HA35) ، وهو حليب بشري يحاكي HA ، لتعزيز هجرة الخلايا وانتشارها على طول حافة الجرح الظهارية. بعد زراعة الطبقات الأحادية إلى التقاء ، تم خدشها يدويا ومعالجتها باستخدام HA35 (50 ميكروغرام / مل ، 100 ميكروغرام / مل ، 200 ميكروغرام / مل) أو التحكم (PBS). تم تصوير هجرة الخلايا وانتشارها إلى الفجوة باستخدام مجهر ضوئي منقول مجهز لتصوير الخلايا الحية. تم تحديد إغلاق الجروح كميا كنسبة مئوية من التئام الجروح باستخدام المكون الإضافي لحجم التئام الجروح في ImageJ. تم قياس منطقة الخدش ومعدل هجرة الخلايا والنسبة المئوية لإغلاق الجرح على مدار 24 ساعة. HA35 في المختبر يسرع التئام الجروح في الطبقات الأحادية المعوية المعوية الصغيرة ، على الأرجح من خلال مزيج من تكاثر الخلايا عند حافة الجرح والهجرة إلى منطقة الجرح. يمكن استخدام هذه الطرق كنموذج لاستكشاف تجديد الأمعاء في الأمعاء الدقيقة البشرية المبكرة.
Introduction
التهاب الأمعاء والقولون الناخر (NEC) هو واحد من أكثر حالات الطوارئ المعدية المعوية شيوعا عند الأطفال الخدج1. يتميز المرض بالتهاب معوي حاد يمكن أن يتدهور بسرعة إلى نخر معوي وتعفن الدم وربما الموت. على الرغم من أن المسببات غير واضحة ، إلا أن الأدلة تشير إلى أن NEC متعدد العوامل ونتيجة لتفاعل معقد للتغذية ، واستعمار بكتيري غير طبيعي ، وظهارة معوية غير ناضجة 2,3. زاد الأطفال الخدج من نفاذية الأمعاء ، والاستعمار البكتيري غير الطبيعي ، وانخفاض القدرة التجديدية للخلايا المعوية 4,5 ، مما يزيد من خطر إصابتهم بخلل في الحاجز المعوي ، ونقل البكتيريا ، وتطوير NEC. لذلك ، فإن تحديد الاستراتيجيات أو التدخلات لتسريع النضج الظهاري المعوي وتعزيز تجديد أو شفاء الظهارة المعوية أمر بالغ الأهمية في الوقاية من هذا المرض الفتاك.
أظهرت الدراسات أن الحليب البشري (HM) يحمي من NEC في الأطفال الخدج6،7،8،9،10،11. أظهرت كل من الدراسات البشرية والحيوانية أن الصيغة القائمة على الأبقار تزيد من نفاذية الأمعاء وهي سامة مباشرة للخلايا الظهارية المعوية 2,12. على الرغم من عدم توضيحها بالكامل ، تشير الأدلة إلى أن الآثار الوقائية ل HM يتم بوساطة المكونات النشطة بيولوجيا مثل اللاكتوفيرين والغلوبولين المناعي A (IgA) و HM oligosaccharides13. HM غني أيضا بالهيالورونان (HA) ، وهو جليكوزامينوغليكان غير كبريتات فريد من نوعه مع تكرار حمض D-glucuronic و N-acetyl-D-glucosamine disaccharides14,15. الأهم من ذلك ، لقد أظهرنا أن الفم 35 kDa HA (HA35) ، وهو تقليد HM HA ، يخفف من شدة الإصابة المعوية ، ويمنع نقل البكتيريا ، ويقلل من الوفيات في نموذج إصابة معوية تشبه الفئران NEC16,17.
هنا ، يتم التحقيق بشكل أكبر في آثار HA35 على الشفاء المعوي والتجديد في المختبر. حاليا ، الفحص الأكثر استخداما في المختبر لجرح الأمعاء وإصلاحها هو فحص جرح الخدش الذي يتم إجراؤه في الطبقات الأحادية لخلايا سرطان القولون والمستقيم (CRC). إن الأهمية الفسيولوجية لمثل هذا النموذج لأمعاء الرضع الخدج محدودة ، حيث يعتمد إصلاح الجروح لخلايا CRC بشكل كبير على الطبيعة التكاثرية للغاية للخلايا السرطانية بدلا من عمليات الإصلاح التي تحركها الخلايا الجذعية18. للتغلب على هذا القيد ، يتم وصف إنشاء نموذج جرح خدش الأمعاء 2D ، بما في ذلك إجراء عزل والحفاظ على الأمعاء المعوية الصغيرة المشتقة من الخلايا الجذعية الأولية من الرئيسيات غير البشرية الخدج (NHP) ، هنا. بالنظر إلى أن NEC قبل الأوان غالبا ما يتم الإبلاغ عنه في الأمعاء الدقيقة البعيدة ، فإن استخدام الخلايا العضوية الظهارية الأولية في نموذج للتلف والإصلاح المعوي يوفر نموذجا أكثر قابلية للترجمة الفسيولوجية في المختبر مقارنة بالنماذج الحالية التي تستخدم الطبقات الأحادية التقليدية للقولون والمستقيم18,19.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية في هذه الدراسة من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانات التابعة لمركز العلوم الصحية بجامعة أوكلاهوما. بعد الموافقة المؤسسية، تم الحصول على عينات راحة الأمعاء الدقيقة الجنينية من الرئيسيات غير البشرية قبل الأوان (NHP، 90٪ من الحمل، بابون الزيتون، بابيو أنوبيس) بعد القتل الرحيم لدراسة منفصلة (البروتوكول #101523-16-039-I)20.
1. إنشاء الرئيسيات المعوية 3D الرئيسيات غير البشرية قبل الأوان
- الإعداد الإعلامي
ملاحظة: يمكن إعداد الوسائط قبل 1 أسبوع من عزل السرداب باتباع تقنية التعقيم القياسية. يمكن استخدام البنسلين / الستربتومايسين (التركيز النهائي 1٪) بدلا من المضادات الحيوية واسعة الطيف للخلايا الأولية إذا رغبت في ذلك.- تحضير وسائط النمو العضوي البشري + Y-27632 (HOGMY) عن طريق خلط 50 مل من وسط النمو العضوي وسط قاعدي بشري مع 50 مل من الملحق العضوي (جدول المواد). أضف 200 ميكرولتر من المضادات الحيوية واسعة الطيف (التركيز النهائي 100 ميكروغرام/مل) (جدول المواد) وY-27632 (إلى تركيز نهائي قدره 10 ميكرومتر). دافئ على سطح الطاولة إلى درجة حرارة الغرفة.
- تحضير وسائط النمو العضوي البشري (HOGM) عن طريق خلط 50 مل من وسط قاعدي عضوي متوسط النمو البشري مع 50 مل من الملحق العضوي. أضف 200 ميكرولتر من المضادات الحيوية واسعة الطيف (100 ميكروغرام / مل). دافئ على سطح الطاولة إلى درجة حرارة الغرفة.
ملاحظة: سيتم استخدام HOGM عند تغيير الوسائط بعد أول 2-3 أيام بعد المرور. - قم بتبريد 100 مل من 1x محلول ملحي مخزن بالفوسفات (PBS) بدون كالسيوم أو مغنيسيوم حتى يصبح الثلج باردا.
- قم بتحضير 50 مل من المخزن المؤقت للغسيل عن طريق الجمع بين 1x PBS بدون كالسيوم أو مغنيسيوم مع ألبومين مصل البقر بنسبة 0.1٪ (BSA). يبرد حتى يصبح الثلج باردا.
- قم بتحضير المخزن المؤقت لغسيل DMEM-F12 عن طريق إضافة 1 مل من المضادات الحيوية واسعة الطيف (100 ميكروغرام / مل) إلى 500 مل من DMEM / F12 (خليط Dulbecco المعدل من النسر المتوسط / المغذي F12 + 15 mM HEPES العازل). احفظه باردا.
- عزل السرداب والطلاء
ملاحظة: يجب أن يبقى الهيدروجيل القائم على المصفوفة خارج الخلية (ECM) على الجليد أثناء الإجراء بأكمله. يفترض هذا الإجراء وجود أنسجة كافية لملء ست قباب هيدروجيل قائمة على ECM. إذا تم حصاد كثافة مختلفة من الخبايا ، فيجب تغيير رقم القبة وفقا لذلك.- إذابة 150 ميكرولتر من عامل النمو المخفض (GFR) مستخلص الغشاء السفلي (BME) (خال من الفينول الأحمر) بين عشية وضحاها على الجليد عند 2-8 درجة مئوية.
- احتضن صفيحة بوليسترين معالجة بزراعة الأنسجة ذات 24 بئرا ومسطحة القاع في حاضنة عند 37 درجة مئوية و 5٪ CO2 لمدة لا تقل عن 30 دقيقة قبل الاستخدام.
- بعد القتل الرحيم NHP وجمع الأنسجة ، اغسل الجزء الدقاقي من الحطام بطرف ماصة 1000 ميكرولتر باستخدام 1x PBS البارد في طبق بتري يمكن التخلص منه.
ملاحظة: يجب حصاد الأنسجة الطازجة بسرعة والحفاظ على الجليد البارد لحصاد الأمعاء الصحية. - قطع الدقاق طوليا على طول الأمعاء بأكملها ، واغسل مع PBS 3x الباردة الجليدية. قم بلف الأنسجة إلى شظايا صغيرة (طولها حوالي 2 مم) باستخدام مقص معقم فوق أنبوب مخروطي سعة 50 مل يحتوي على 15 مل من PBS البارد ، بدءا من جزء الجزء اللفائفي الأقرب إلى الأنبوب.
- استخدم ماصة مصلية سعة 10 مل لتعطيل الخبايا عن طريق السحب لأعلى ولأسفل 5-10x. دع أجزاء الأنسجة تستقر في الجزء السفلي من الأنبوب ، ثم قم بإزالة supernatant واستبدله ب PBS طازج وبارد. كرر هذه العملية بحد أدنى 7x-10x حتى يصبح supernatant واضحا وخاليا من الحطام.
- بمجرد أن تصبح واضحة ، قم بإزالة supernatant وأعد تعليق الخبايا في 25 مل من كاشف تفكك الخلية. ضع الأنبوب على منصة هزازة عند 20 دورة في الدقيقة لمدة 15 دقيقة في درجة حرارة الغرفة.
- قم بإزالة الأنبوب من الروك ، واسمح للخلايا بالاستقرار لمدة 30 ثانية إلى 1 دقيقة تقريبا ، وقم بإزالة السوبرناتانت. أضف 10 مل من المخزن المؤقت للغسيل البارد المثلج. ماصة صعودا وهبوطا مع ماصة p1000 لمزيد من الانفصال في سراديب واحدة.
- قم بتصفية الأنسجة من خلال مصفاة خلية 70 ميكرومتر في أنبوب مخروطي جديد بسعة 50 مل. اشطف الأنبوب المخروطي الأصلي سعة 50 مل مع 10 مل من المخزن المؤقت للغسيل البارد المثلج وقم بالتصفية من خلال مصفاة 70 ميكرومتر لضمان إزالة جميع الخبايا من الأنبوب الأصلي. كرر هذا الغسيل للأنسجة لما مجموعه 4x شطف.
- الطرد المركزي للترشيح عند 300 × g لمدة 5 دقائق عند 4 درجات مئوية وإزالة supernatant. أضف 600 ميكرولتر من HOGMY وقم بتعطيل الكريات عن طريق السحب لأعلى ولأسفل باستخدام ماصة 200 ميكرولتر. ضع الأنبوب على الثلج حتى يصبح المحلول باردا.
ملاحظة: إذا لم يكن المحلول باردا ، فلن تحافظ القبة على الهيكل المناسب عند طلائها. تجنب إدخال الفقاعات عند سحب قباب الهيدروجيل القائمة على ECM ، لأن الفقاعات ستمنع الالتصاق السليم بقاع اللوحة. - أضف 600 ميكرولتر من الهيدروجيل القائم على ECM البارد المثلج لتعليق حبيبات الخلايا وتخلط جيدا مع ماصة 200 ميكرولتر.
- قم بإزالة اللوحة المكونة من 24 بئرا من الحاضنة وضعها على جهاز تدفئة صفيحة 37 درجة مئوية. ماصة 50 ميكرولتر من خليط هيدروجيل HOGMY / ECM البارد في وسط 24 بئرا من صفيحة استزراع 24 بئرا (50 ميكرولتر لكل قبة).
- بمجرد طلائها ، دع القباب تجلس على جهاز تدفئة صفيحة 37 درجة مئوية لمدة 1 دقيقة للسماح بالالتزام بالجزء السفلي من اللوحة. قم بعكس اللوحة بعناية ، وتأكد من عدم تراكم أي تكثيف في الجزء السفلي من اللوحة ، ووضع اللوحة المقلوبة في الحاضنة عند 37 درجة مئوية و 5٪ CO2.
- بعد 15 دقيقة ، اقلب اللوحة إلى الجانب الأيمن لأعلى وماصة 750 ميكرولتر من HOGMY في درجة حرارة الغرفة في كل بئر.
ملاحظة: وسائط ماصة ببطء على الجدار الجانبي للآبار ، مع الحرص على عدم تعطيل قبة هيدروجيل 3D ECM التي تم تشكيلها حديثا. - بمجرد ملء جميع الآبار بالوسائط ، ضع اللوحة في الحاضنة وقم بتغيير الوسائط كل 3 أيام باستخدام 750 ميكرولتر من HOGM. مرور المعوية كل 7-10 أيام.
- تمرير الأمعاء المعوية
ملاحظة: البروتوكول التالي هو للوحة واحدة من 24 بئرا تحتوي على معوية NHP بمعدل انقسام 1: 2.- قم بإزالة الوسائط المعوية من كل بئر ، مع الحرص على عدم تعطيل قبة ECM التي تحتوي على الأمعاء ، وإضافة 500 ميكرولتر من كاشف تفكك الخلايا الباردة إلى كل بئر باستخدام ماصة 1000 ميكرولتر ، واحتضان في درجة حرارة الغرفة لمدة 1 دقيقة.
- قم بتعطيل ECM يدويا عن طريق السحب لأعلى ولأسفل 8-12x. نقل محتويات 12 بئرا إلى أنبوب مخروطي واحد سعة 15 مل.
- بمجرد جمع كل المحلول من لوحة زراعة 24 بئرا ، أضف 250 ميكرولتر من كاشف اضطراب الخلايا إلى كل بئر لضمان إزالة جميع المعوية NHP من كل بئر ، مع إضافة هذا الشطف الأخير إلى الأنابيب المخروطية الحالية التي تبلغ سعتها 15 مل.
- يوضع على منصة هزازة بسرعة 40 دورة في الدقيقة لمدة 15 دقيقة في درجة حرارة الغرفة (20 درجة مئوية). بدلا من ذلك ، هز الأنابيب يدويا لمدة 15 دقيقة في درجة حرارة الغرفة.
- بعد 15 دقيقة ، جهاز طرد مركزي عند 300 × g لمدة 5 دقائق عند 4 درجات مئوية. قم بإزالة السوبرناتانت من أنابيب 15 مل حتى تبقى الكريات فقط.
- أضف 8 مل من DMEM البارد المثلج + المضادات الحيوية واسعة الطيف إلى أنبوب مخروطي واحد سعة 15 مل ، مع التأكد من تعطل الكريات بشكل كاف. جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية وتخلص من السوبرناتانت.
- أضف 600 ميكرولتر من HOGMY وقم بتعطيل الكريات عن طريق السحب لأعلى ولأسفل باستخدام ماصة 1000 ميكرولتر. ضع الأنبوب على الثلج حتى يصبح المحلول باردا. بمجرد أن يصبح المحلول باردا ، أضف 600 ميكرولتر من ECM البارد المثلج لتعليق حبيبات الخلية وتخلط جيدا مع ماصة 1000 ميكرولتر. كرر الخطوات 1.3.2.-1.3.7. للآبار ال 12 المتبقية.
- للحصول على الخطوات المتبقية، راجع الخطوات 1.2.11.-1.2.16.
2. إنشاء طبقة أحادية الأمعاء وفحص جرح الخدش
- إعداد الوسائط والعلاج
- يبرد 5 مل من PBS بدون كالسيوم أو مغنيسيوم حتى يبرد الجليد.
- قم بتحضير المخزن المؤقت لغسيل DMEM-F12 عن طريق إضافة 1 مل من المضادات الحيوية واسعة الطيف (100 ميكروغرام / مل) إلى 500 مل من DMEM / F12 (خليط Dulbecco المعدل من النسر المتوسط / المغذي F12 + 15 mM HEPES العازل). حافظ على برودة الجليد.
- قم بإعداد 100 مل من HOGMY ، كما هو موضح في الخطوة 1.1.1.1 ، وقم بتسخينه على سطح الطاولة إلى درجة حرارة الغرفة.
- دافئ 25 مل من 0.25٪ من حمض التربسين-الإيثيلين ديامين رباعي الأسيتيك (EDTA) في حمام مائي 37 درجة مئوية.
- تحضير 50 ميكروغرام / مل ، 100 ميكروغرام / مل ، و 200 ميكروغرام / مل تركيزات من HA35 لمعالجة الخلايا ، وذلك باستخدام PBS معقمة بدون الكالسيوم أو المغنيسيوم كمذيب. سيستخدم التخفيف النهائي ل HA35 HOMGY كمذيب.
ملاحظة: قد يتطلب تحضير HA35 عدة تخفيفات ، حيث أن HA35 غالبا ما يخرج من المحلول بتركيز أكبر من 5 ملغ / مل.
- تشكيل أحادي الطبقة المعوية
ملاحظة: يوفر الإجراء التالي كميات كافية لتوليد صفيحة واحدة من 24 بئرا من الطبقات الأحادية المعوية. اضبط وحدات التخزين للعدد المطلوب من الطبقات الأحادية.- إذابة 96 ميكرولتر من هيدروجيل BME القائم على ECM (خال من الفينول الأحمر) بين عشية وضحاها على الجليد عند 2-8 درجة مئوية. تمييع الهيدروجيل القائم على ECM في PBS المثلج البارد بدون كالسيوم أو المغنيسيوم بنسبة 1:50. قم بتغطية كل بئر من صفيحة زراعة الأنسجة المكونة من 24 بئرا ب 200 ميكرولتر من الهيدروجيل المخفف القائم على ECM المخفف بالجليد البارد.
- احتضان اللوحة المطلية بالهيدروجيل القائم على ECM لمدة لا تقل عن 1 ساعة عند 37 درجة مئوية و 5٪ CO2. استنشاق الوسائط من لوحة الثقافة 24-well التي تحتوي على المعوية 3D الموجهة إلى الطبقات الأحادية واستبدالها ب 500 ميكرولتر من كاشف تفكك الخلية / البئر.
- تعطيل قباب الهيدروجيل القائمة على ECM يدويا عن طريق السحب لأعلى ولأسفل 8x-12x ونقل محتويات 12 بئرا إلى أنبوب مخروطي 15 مل.
- اغسل الآبار الفارغة ال 12 ب 250 ميكرولتر من كاشف تفكك الخلايا لضمان إزالة جميع المعوية ونقل المحتويات إلى أنبوب مخروطي 15 مل. كرر الخطوة 2.2.5. والخطوة 2.2.6. للآبار ال 12 المتبقية باستخدام أنبوب مخروطي ثان سعة 15 مل.
- الطرد المركزي للأنابيب المخروطية في 300 × غرام لمدة 5 دقائق عند 4 درجات مئوية والتخلص من supernatant. أضف 10 مل من المخزن المؤقت لغسل DMEM-F12 البارد إلى 15 مل من الأنابيب المخروطية الكريات المعوية عن طريق عكس الأنابيب. جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- قم بإزالة السوبرناتانت وإعادة تعليق كريات الخلايا في 12 مل من 37 درجة مئوية Trypsin-EDTA. ضع الأنابيب في حمام مائي 37 درجة مئوية لمدة 10 دقائق أو حتى تبدو الخلايا قابلة للذوبان. أضف 3 مل من المخزن المؤقت للغسيل DMEM-F12 إلى كل أنبوب لتخفيف التربسين-EDTA ، واخلطه عن طريق عكس الأنابيب ، وضعه على الجليد.
- قم بتصفية الأمعاء المنفصلة من خلال مصفاة خلية شبكية 37 ميكرومتر ، وجمع المحتويات في أنابيب مخروطية نظيفة سعة 15 مل. جهاز الطرد المركزي للأنابيب عند 300 × g لمدة 5 دقائق عند 4 درجات مئوية.
- أثناء تكسير الخلايا في جهاز الطرد المركزي ، قم بإزالة اللوحة المطلية بالهيدروجيل القائم على ECM من الحاضنة وقم بشفط أي محلول هيدروجيل زائد قائم على ECM دون خدش السطح المطلي أو ترك اللوحة تجف تماما.
- قم بإزالة supernatant من الأنابيب المخروطية وأعد تعليق كريات الخلايا مع 6 مل من HOMGY. أضف 500 ميكرولتر من تعليق خلية HOMGY المدمج سعة 12 مل في كل بئر من الصفيحة المكونة من 24 بئرا المطلية بهيدروجيل قائم على ECM بكثافة بذر تبلغ حوالي 3 × 105 خلايا / بئر. قم بتدوير اللوحة بغطاء لضمان توزيع متساو للخلايا داخل الآبار.
- احتضن اللوحة عند 37 درجة مئوية و 5٪ CO2 ، وتبادل وسائط HOMGY كل يومين حتى تصل الطبقات الأحادية إلى التقاء >90٪.
- العلاج أحادي الطبقة وفحص الجرح الخدش
- بمجرد أن تصل الطبقات الأحادية إلى التقاء >90٪ ، قم بشفط الوسائط لإزالة أي خلايا تفشل في الالتصاق. عالج الخلايا التي تحتوي على 500 ميكرولتر من HA35 (50 ميكروغرام / مل ، 100 ميكروغرام / مل ، 200 ميكروغرام / مل) أو PBS ، الذائبة في HOMGY ، لمدة 24 ساعة.
- بعد 24 ساعة ، قم بإزالة الوسائط ، مع الحرص على عدم تعطيل سطح الطبقة الأحادية. باستخدام طرف ماصة 200 ميكرولتر ، قم بعمل خدش خطي عبر قطر السطح الكامل للطبقة الأحادية في كل بئر ، مع الحرص على عدم ترك الطبقات الأحادية تجف.
- اغسل الطبقات الأحادية المخدوشة 1x ب 500 ميكرولتر من 1x PBS. أضف 500 ميكرولتر من HA35 (50 ميكروغرام / مل ، 100 ميكروغرام / مل ، 200 ميكروغرام / مل) أو PBS المذاب في HOMGY ونقل اللوحة إلى أداة تحليل الخلايا الحية (جدول المواد) داخل حاضنة 37 درجة مئوية و 5٪ CO2 .
- ضمن أيقونة الجدول الزمني في برنامج تحليل الخلايا الحية (جدول المواد) ، انقر فوق أيقونة إطلاق إضافة معالج سفينة جديدة وقم بتعيين تردد المسح الضوئي للمسح الضوئي وفقا لجدول زمني. قم بإنشاء وعاء Whole Well جديد ضمن نوع المسح الضوئي ، وحدد إعدادات المسح الضوئي (أي المرحلة لقنوات الصور و 4x للهدف) ، وانقر فوق التالي.
- حدد الشركة المصنعة للوحة ورقم الكتالوج من القائمة المتوفرة. ضمن أيقونة جدولة ، اختر رمز الجمع حيث سيتم وضع اللوحة داخل أداة تحليل الخلايا الحية. حدد نمط المسح الضوئي المطلوب، ثم قم بإنشاء خريطة لوحة عن طريق تحديد "+" في صفحة تخطيط اللوحة. حدد تأجيل التحليل إلى وقت لاحق، ثم قم بتعيين جدول المسح الضوئي لكل 4 ساعات لمدة 24 ساعة وتحقق من إعدادات الاستحواذ ضمن صفحة ملخص معالج السفينة . وأخيرا، حدد إضافة إلى الجدول.
- بمجرد اكتمال الفحص 24 ، ضمن أيقونة عرض ، انقر نقرا مزدوجا فوق اسم السفينة ، وقم بتصدير الصور والأفلام. حدد الآبار وسلسلة من الصور لعرضها وتصديرها بتنسيق JPEG. قم بتحليل الصور للحصول على النسبة المئوية لالتئام الجروح باستخدام المكون الإضافي لحجم التئام الجروح ل ImageJ21 ، وفقا للخطوة 2.4. ادناه.
- تحليل الجرح الخدش
- افتح برنامج ImageJ. قم بتحميل صور فحص جرح الخدش (. TIFF أو .JPG).
- حدد صورة > اكتب > 8 بت لتغيير الصورة من RGB 24 بت إلى 8 بت. قم بتثبيت المكون الإضافي لحجم التئام الجروح عن طريق تحديد المكونات الإضافية > وحدات الماكرو > تثبيت المكون الإضافي > حجم التئام الجروح.
- قم بتدوير الصورة بحيث يكون الخدش رأسيا وقم بتهيئة المكون الإضافي أداة حجم التئام الجروح.
- حدد معلمات المكون الإضافي في مربع الحوار لتناسب جرح الخدش بشكل أفضل. قم بتعيين قيمة معلمات خيارات حجم التئام الجروح كما يلي: نصف قطر نافذة التباين عند 20، وقيمة العتبة عند 100، والنسبة المئوية للبيكسلات المشبعة عند 0.001، واختر نعم لتعيين مقياس عالمي. قم بإنهاء التحديد بالنقر فوق الزر موافق ( OK) . تحقق مما إذا كانت المنطقة المحددة هي منطقة الجرح. قد تتطلب المعلمات المذكورة أعلاه التوحيد القياسي من مختبر إلى آخر.
- كرر الخطوات 2.4.2.-2.4.4. للنقاط الزمنية المتبقية لكل خدش.
- احسب النسبة المئوية لالتئام جروح منطقة الخدش للخلايا المهاجرة أو المنتشرة على مدار 24 ساعة على النحو التالي:
٪ التئام الجروح =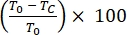
حيث T 0 = ٪ المساحة في الوقت 0 ساعة و Tc = ٪ المساحة عند 0 ساعة أو 4 ساعات أو 12 ساعة أو 24 ساعة.
النتائج
آثار HA على إصلاح الأنسجة والتئام الجروح في مختلف الأنسجة والأعضاء موثقة جيدا. ومع ذلك ، فإن الآثار المحددة ل HA مع وزن جزيئي يبلغ 35 kDa على الشفاء والتجديد المعوي الصغير للجنين أو حديثي الولادة غير معروفة حاليا. لاختبار قدرة HA35 على تعزيز التئام الجروح في نموذج للأمعاء الدقيقة الجنينية أو حدي?...
Discussion
يتعرض الجهاز الهضمي للرضيع الخدج لضغط تجديدي مستمر من التعرض المتكرر للإهانات البيئية المرتبطة ب dysbiosis ، والمستقلبات البكتيرية الالتهابية والسموم ، ونقص الأكسجة المتقطع23,24. لسوء الحظ ، فإن الظهارة المعوية للرضيع المبتس غير قادرة على إثبات السلامة الوظيفي...
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه ولا تضارب في المصالح.
Acknowledgements
هذا المحتوى هو مسؤولية المؤلفين فقط ولا يمثل بالضرورة وجهات النظر الرسمية للمعاهد الوطنية للصحة. يتم دعم HC من خلال منحة P20GM134973 من المعاهد الوطنية للصحة. يتم دعم KB من خلال منحة مؤسسة مستشفى الأطفال (CHF) ومؤسسة الصحة المشيخية (PHF). تم دعم خدمات تصوير الخلايا الحية التي يقدمها مركز علم الجينوم الوظيفي للسرطان جزئيا من قبل المعهد الوطني للعلوم الطبية العامة P20GM103639 والمعهد الوطني للسرطان منحة P30CA225520 من المعاهد الوطنية للصحة ، الممنوحة لمركز العلوم الصحية بجامعة أوكلاهوما مركز ستيفنسون للسرطان.
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipet | Fisher Scientific | 13-675-49 | |
| 100x21mm Dish, Nunclon Delta | ThermoFisher Scientific | 172931 | |
| 15 mL Conical tube | VWR | 89039-666 | |
| 24-Well, TC-Treated, Flat Bottom Plate | Corning | 3524 | |
| 37 µM Reversible Cell Strainer | STEMCELL Technologies | 27215 | |
| 50 mL Conical tube | VWR | 89039-658 | |
| 70 µm Sterile Cell Strainers | Fisher Scientific | FB22-363-548 | |
| Albumin, Bovine (BSA) | VWR | 0332-100G | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | |
| Dulbecco's Modified Eagle's Medium/Nutrient Ham's Mixture F-12 (DMEM-F12) with 15 mM HEPES buffer | STEMCELL Technologies | 36254 | |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 100-0485 | |
| ImageJ | NIH | imagej.nih.gov/ij/ | |
| Incucyte S3 Live-Cell Analysis Instrument | Sartorius | 4647 | |
| Incucyte Scratch Wound Analysis Software Module | Sartorius | 9600-0012 | |
| IntestiCult Organoid Growth Medium (Human) | STEMCELL Technologies | 06010 | This is HOGMY, but without the Y-27632 or antibiotics. Also used as base for HOGM, but then only missing the antibiotics. |
| Lipopolysaccharides from Escherichia coli O111:B4, purified by gel filtration chromatography | Millipore Sigma | L3012-10MG | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, Phenol Red-Free | Corning | 356231 | |
| Nunc MicroWell 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | ThermoFisher Scientific | 136101 | |
| PBS (Phosphate-Buffered Saline), 1X [-] Calcium, Magnesium, pH 7.4 | Corning | 21-040-CM | |
| Primocin | Invivogen | ant-pm-1 | This is broad-spectrum antibiotics |
| Sodium Hyaluronate, Research Grade, HA20K | Lifecore Biomedical | HA20K-1 | |
| TC20 Automated Cell Counter | Company: Bio-Rad | 1450102 | |
| Trypsin-EDTA 1X, 0.25% Trypsin | Fisher Scientific | MT25053CI | |
| Y-27632 | STEMCELL Technologies | 72302 |
References
- Lemons, J. A., et al. Very low birth weight outcomes of the National Institute of Child Health and Human Development Neonatal Research Network, January 1995 through December 1996. Pediatrics. 107 (1), 1 (2001).
- Burge, K., Vieira, F., Eckert, J., Chaaban, H. Lipid composition, digestion, and absorption differences among neonatal feeding strategies: Potential implications for intestinal inflammation in preterm infants. Nutrients. 13 (2), 550 (2021).
- Duffy, L. C. Interactions mediating bacterial translocation in the immature intestine. The Journal of Nutrition. 130, 432-436 (2000).
- Nanthakumar, N., et al. The mechanism of excessive intestinal inflammation in necrotizing enterocolitis: An immature innate immune response. PLoS One. 6 (3), 17776 (2011).
- Nanthakumar, N. N., Fusunyan, R. D., Sanderson, I., Walker, W. A. Inflammation in the developing human intestine: A possible pathophysiologic contribution to necrotizing enterocolitis. Proceedings of the National Academy of Sciences of the United States of America. 97 (11), 6043-6048 (2000).
- He, Y., Lawlor, N. T., Newburg, D. S. Human milk components modulate toll-like receptor-mediated inflammation. Advances in Nutrition. 7 (1), 102-111 (2016).
- Walker, W. A., Iyengar, R. S. Breast milk, microbiota, and intestinal immune homeostasis. Pediatric Research. 77 (1-2), 220-228 (2015).
- Westerbeek, E. A., vanden Berg, A., Lafeber, H. N., Fetter, W. P., van Elburg, R. M. The effect of enteral supplementation of a prebiotic mixture of non-human milk galacto-, fructo- and acidic oligosaccharides on intestinal permeability in preterm infants. British Journal of Nutrition. 105 (2), 268-274 (2011).
- vanden Berg, A., et al. The effect of glutamine-enriched enteral nutrition on intestinal permeability in very-low-birth-weight infants: A randomized controlled trial. Journal of Parenteral and Enteral Nutrition. 30 (5), 408-414 (2006).
- Foster, J. P., Seth, R., Cole, M. J. Oral immunoglobulin for preventing necrotizing enterocolitis in preterm and low birth weight neonates. The Cochrane Database of Systematic Reviews. 4 (4), (2016).
- Maffei, D., Schanler, R. J. Human milk is the feeding strategy to prevent necrotizing enterocolitis. Seminars in Perinatology. 41 (1), 36-40 (2017).
- Patel, A. L., Kim, J. H. Human milk and necrotizing enterocolitis. Seminars in Pediatric Surgery. 27 (1), 34-38 (2018).
- Nolan, L. S., Parks, O. B., Good, M. A review of the immunomodulating components of maternal breast milk and protection against necrotizing enterocolitis. Nutrients. 12 (1), 14 (2019).
- Hill, D. R., et al. Human milk hyaluronan enhances innate defense of the intestinal epithelium. Journal of Biological Chemistry. 288 (40), 29090-29104 (2013).
- Burge, K., Bergner, E., Gunasekaran, A., Eckert, J., Chaaban, H. The role of glycosaminoglycans in protection from neonatal necrotizing enterocolitis: A narrative review. Nutrients. 12 (2), 546 (2020).
- Chaaban, H., et al. Acceleration of small intestine development and remodeling of the microbiome following hyaluronan 35 kDa treatment in neonatal mice. Nutrients. 13 (6), 2030 (2021).
- Gunasekaran, A., et al. Hyaluronan 35 kDa enhances epithelial barrier function and protects against the development of murine necrotizing enterocolitis. Pediatric Research. 87 (7), 1177-1184 (2020).
- Montenegro-Miranda, P. S., et al. A novel organoid model of damage and repair identifies HNF4α as a critical regulator of intestinal epithelial regeneration. Cellular and Molecular Gastroenterology and Hepatology. 10 (2), 209-223 (2020).
- Lee, C., Hong, S. N., Kim, E. R., Chang, D. K., Kim, Y. H. Epithelial regeneration ability of Crohn's disease assessed using patient-derived intestinal organoids. International Journal of Molecular Sciences. 22 (11), 6013 (2021).
- Gurung, S., et al. Maternal Zika virus (ZIKV) infection following vaginal inoculation with ZIKV-infected semen in timed-pregnant olive baboons. Journal of Virology. 94 (11), 00058 (2020).
- Suarez-Arnedo, A., et al. An image J plugin for the high throughput image analysis of in vitro scratch wound healing assays. PLoS One. 15 (7), 0232565 (2020).
- Kobelt, D., Walther, W., Stein, U. S. Real-time cell migration monitoring to analyze drug synergism in the scratch assay using the IncuCyte system. Methods in Molecular Biology. 2294, 133-142 (2021).
- de Jong, J. C. W., Ijssennagger, N., van Mil, S. W. C. Breast milk nutrients driving intestinal epithelial layer maturation via Wnt and Notch signaling: Implications for necrotizing enterocolitis. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1867 (11), 166229 (2021).
- Yu, Y., et al. Erythropoietin protects epithelial cells from excessive autophagy and apoptosis in experimental neonatal necrotizing enterocolitis. PLoS One. 8 (7), 69620 (2013).
- Kessler, S. P., et al. Multifunctional role of 35 kilodalton hyaluronan in promoting defense of the intestinal epithelium. The Journal of Histochemistry and Cytochemistry. 66 (4), 273-287 (2018).
- Fraser, J. R. E., Laurent, T. C., Laurent, U. B. G. Hyaluronan: Its nature, distribution, functions and turnover. Journal of Internal Medicine. 242 (1), 27-33 (1997).
- Kim, Y., et al. Hyaluronan 35kDa treatment protects mice from Citrobacter rodentium infection and induces epithelial tight junction protein ZO-1 in vivo. Matrix Biology. 62, 28-39 (2017).
- Prehm, P., Schumacher, U. Inhibition of hyaluronan export from human fibroblasts by inhibitors of multidrug resistance transporters. Biochemical Pharmacology. 68 (7), 1401-1410 (2004).
- Stenson, W. F., Ciorba, M. A. Nonmicrobial activation of TLRs controls intestinal growth, wound repair, and radioprotection. Frontiers in Immunology. 11 (3591), 617510 (2021).
- Riehl, T. E., Ee, X., Stenson, W. F. Hyaluronic acid regulates normal intestinal and colonic growth in mice. American Journal of Physiology-Gastrointestinal and Liver Physiology. 303 (3), 377-388 (2012).
- Riehl, T. E., Santhanam, S., Foster, L., Ciorba, M., Stenson, W. F. CD44 and TLR4 mediate hyaluronic acid regulation of Lgr5+ stem cell proliferation, crypt fission, and intestinal growth in postnatal and adult mice. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309 (11), 874-887 (2015).
- Hill, D. R., Kessler, S. P., Rho, H. K., Cowman, M. K., de la Motte, C. A. Specific-sized hyaluronan fragments promote expression of human beta-defensin 2 in intestinal epithelium. Journal of Biological Chemistry. 287 (36), 30610-30624 (2012).
- Fernando, E. H., Gordon, M. H., Beck, P. L., MacNaughton, W. K. Inhibition of intestinal epithelial wound healing through protease-activated receptor-2 activation in Caco2 cells. Journal of Pharmacology and Experimental Therapeutics. 367 (2), 382-392 (2018).
- Nyegaard, S., Christensen, B., Rasmussen, J. T. An optimized method for accurate quantification of cell migration using human small intestine cells. Metabolic Engineering Communications. 3, 76-83 (2016).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272 (2020).
- Singh, A., Poling, H. M., Spence, J. R., Wells, J. M., Helmrath, M. A. Gastrointestinal organoids: a next-generation tool for modeling human development. American Journal of Physiology-Gastrointestinal and Liver Physiology. 319 (3), 375-381 (2020).
- Foulke-Abel, J., et al. Human enteroids as an ex-vivo model of host-pathogen interactions in the gastrointestinal tract. Experimental Biology and Medicine. 239 (9), 1124-1134 (2014).
- Foulke-Abel, J., et al. Human enteroids as a model of upper small intestinal ion transport physiology and pathophysiology. Gastroenterology. 150 (3), 638-649 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved