A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تمكن صفائف الهيدروجيل من زيادة الإنتاجية لفحص تأثيرات مكونات المصفوفة والعلاجات في نماذج الأورام 3D
In This Article
Summary
يصف هذا البروتوكول منصة تجريبية لتقييم آثار الإشارات الميكانيكية والكيميائية الحيوية على استجابات العلاج الكيميائي لخلايا الورم الأرومي الدبقي المشتقة من المريض في مزارع محاكاة مصفوفة 3D باستخدام جهاز إضاءة الأشعة فوق البنفسجية المصنوع خصيصا لتسهيل الربط الضوئي عالي الإنتاجية للهيدروجيل مع ميزات ميكانيكية قابلة للضبط.
Abstract
تتوسط تفاعلات مصفوفة الخلايا العمليات الفسيولوجية المعقدة من خلال الإشارات الكيميائية الحيوية والميكانيكية والهندسية ، مما يؤثر على التغيرات المرضية والاستجابات العلاجية. ومن المتوقع أن يؤدي حساب آثار المصفوفة في وقت مبكر من خط أنابيب تطوير الأدوية إلى زيادة احتمال النجاح السريري للعلاجات الجديدة. توجد استراتيجيات قائمة على المواد الحيوية تلخص بيئات دقيقة محددة للأنسجة في زراعة الخلايا 3D ولكن دمجها مع طرق زراعة 2D المستخدمة في المقام الأول لفحص الأدوية كان تحديا. وبالتالي ، فإن البروتوكول المقدم هنا يفصل تطوير طرق لزراعة 3D داخل مصفوفات المواد الحيوية المصغرة في شكل لوحة متعددة الآبار لتسهيل التكامل مع خطوط أنابيب فحص الأدوية الحالية والفحوصات التقليدية لصلاحية الخلية. وبما أنه من المتوقع أن تكون ميزات المصفوفة الحاسمة الأهمية للحفاظ على الأنماط الظاهرية ذات الصلة سريريا في الخلايا المستزرعة خاصة بالأنسجة والأمراض، فإن الفحص التوافقي لبارامترات المصفوفة سيكون ضروريا لتحديد الظروف المناسبة لتطبيقات محددة. تستخدم الطرق الموضحة هنا تنسيق ثقافة مصغر لتقييم استجابات الخلايا السرطانية للتباين المتعامد لميكانيكا المصفوفة وعرض الرباط. على وجه التحديد ، توضح هذه الدراسة استخدام هذه المنصة للتحقيق في آثار معلمات المصفوفة على استجابات خلايا الورم الأرومي الدبقي (GBM) المشتقة من المريض للعلاج الكيميائي.
Introduction
ارتفعت التكلفة المتوقعة لتطوير دواء جديد بشكل مطرد على مدى العقد الماضي ، مع أكثر من مليار دولار في التقديرات الحالية1. جزء من هذه النفقات هو ارتفاع معدل فشل الأدوية التي تدخل التجارب السريرية. ما يقرب من 12٪ من الأدوية المرشحة تحصل في نهاية المطاف على موافقة من إدارة الغذاء والدواء الأمريكية (FDA) في عام 2019. تفشل العديد من الأدوية في المرحلة الأولى بسبب السمية غير المتوقعة2 ، في حين أن الأدوية الأخرى التي تجتاز تجارب السلامة قد تفشل بسبب نقص الفعالية3. يمكن تفسير هذا الاستنزاف بسبب عدم الفعالية جزئيا بحقيقة أن نماذج السرطان المستخدمة أثناء تطوير الأدوية غير تنبؤية بالفعالية السريرية4.
يمكن أن تعزى التفاوتات الوظيفية بين النماذج المختبرية ونماذج الجسم الحي إلى إزالة الخلايا السرطانية من بيئتها الدقيقة الأصلية ، بما في ذلك الخلايا غير السرطانية و ECM 5,6 المادي. عادة ، تستخدم مجموعات البحث مصفوفات استزراعية متاحة تجاريا ، مثل Matrigel (مصفوفة غشاء قبو بروتينية مشتقة من ساركوما الفئران) لتزويد الخلايا السرطانية المستزرعة ببيئة دقيقة ثلاثية الأبعاد. بالمقارنة مع ثقافة 2D ، حسنت ثقافة 3D في مصفوفة الغشاء من الأهمية السريرية للنتائج في المختبر 7,8. ومع ذلك ، فإن المواد الحيوية المستزرعة من الأنسجة الخالية من الخلايا ، بما في ذلك مصفوفة الغشاء ، عادة ما تظهر تباينا من دفعة إلى أخرى قد يعرض للخطر قابلية التكاثر9. علاوة على ذلك ، قد لا توفر المصفوفات المشتقة من الأورام ذات الأصول النسيجية المختلفة عن تلك التي تمت دراستها الإشارات الفسيولوجية المناسبة10. وأخيرا، فإن السرطانات ذات الدرجات العالية من عدم التجانس داخل الفخذ لها سمات بيئية دقيقة تختلف على نطاق دون الميكرون ولا يمكن ضبط مصفوفة الغشاء لتلخيصها11.
الورم الأرومي الدبقي (GBM) ، وهو ورم دماغي قاتل بشكل موحد مع متوسط وقت البقاء على قيد الحياة لمدة 15 شهرا تقريبا ، هو سرطان كان تطوير العلاج له صعبا بشكل خاص12,13. يتكون المعيار الحالي لرعاية GBM من استئصال الورم الأولي ، يليه العلاج الإشعاعي ، ثم العلاج الكيميائي باستخدام temozolomide (TMZ)14. ومع ذلك ، فإن أكثر من نصف أورام GBM السريرية تظهر مقاومة للعلاج من خلال آليات مختلفة15،16،17. من الصعب للغاية التنبؤ بفعالية نظام العلاج لمريض فردي. تتكون النماذج القياسية قبل السريرية المستخدمة للتنبؤ بالنتائج الفردية من خلايا الورم المشتقة من المريض والتي يتم تطعيمها بشكل تقويمي في الفئران التي تعاني من نقص المناعة. في حين أن xenografts المشتقة من المريض يمكن أن تلخص العديد من جوانب أورام GBM السريرية وهي ذات قيمة للنماذج قبل السريرية18 ، إلا أنها مكلفة بطبيعتها ، وإنتاجية منخفضة ، وتستغرق وقتا طويلا ، وتنطوي على مخاوف أخلاقية19. مزارع الخلايا المشتقة من المريض ، على الأسطح البلاستيكية 2D أو كروية ، في الغالب تجنب هذه القضايا. في حين أن الخلايا المشتقة من المريض تحافظ على الانحرافات الجينية ، فإن ثقافاتها في 2D أو كرويات معلقة كانت إلى حد كبير تمثيلات ضعيفة للأزينوفاتات المشتقة من المريض في القوارض وأورام المرضى الأصلية20. في السابق ، أظهرنا ، ونحن ، وآخرون ، أن خلايا GBM المستزرعة في ECM 3D التي تحاكي الخصائص الميكانيكية والكيميائية الحيوية لأنسجة المخ يمكن أن تحافظ على الأنماط الظاهرية المقاومة للأدوية10،21،22،23.
التفاعلات بين حمض الهيالورونيك (HA) ، وهو عديد السكاريد الوفير في الدماغ ECM والمبالغة في التعبير عنه في أورام GBM ، ومستقبلات CD44 الخاصة به تعدل اكتساب مقاومة الأدوية في المختبر21،24،25،26،27. على سبيل المثال ، أدى إدراج HA ضمن ثقافات 3D الناعمة إلى زيادة قدرة خلايا GBM المشتقة من المريض على اكتساب مقاومة علاجية. كانت هذه المسؤولية الميكانيكية تعتمد على ارتباط HA بمستقبلات CD44 على خلايا GBM21. بالإضافة إلى ذلك ، فإن ربط integrin بالببتيدات الحاملة ل RGD ، المدمجة في مصفوفات الثقافة ثلاثية الأبعاد ، يضخم المقاومة الكيميائية بوساطة CD44 بطريقة تعتمد على الصلابة21. أبعد من HA ، يختلف التعبير عن العديد من بروتينات ECM ، التي يحتوي العديد منها على مناطق RGD ، بين أورام الدماغ الطبيعية و GBM28. على سبيل المثال ، ذكرت إحدى الدراسات أن 28 بروتينا متميزا من بروتينات ECM تم تنظيمها في أورام GBM29. ضمن هذه البيئة الدقيقة المعقدة لمصفوفة الورم ، تدمج الخلايا السرطانية الإشارات الميكانيكية والكيميائية الحيوية لإنتاج نمط ظاهري مقاوم معين ، والذي يعتمد على اختلافات صغيرة نسبيا (على سبيل المثال ، أقل من ترتيب الحجم) في معامل يونغ أو كثافة الببتيدات المرتبطة بالتكامل28،29،30.
يميز هذا البروتوكول كيف تفسر الخلايا السرطانية مجموعات فريدة من إشارات المصفوفة وتحدد البيئات الدقيقة المعقدة الخاصة بالمريض والتي تعزز مقاومة العلاج (الشكل 1A). توفر الطريقة الكيميائية الضوئية لتوليد مصفوفات مصغرة ومضبوطة بدقة لثقافة 3D مساحة متغيرة كبيرة ومتعامدة . تم دمج مجموعة مصممة خصيصا من مصابيح LED ، التي تديرها وحدة تحكم دقيقة ، في الهلاميات المائية الضوئية المتقاطعة ضمن تنسيق لوحة 384 بئر لزيادة الأتمتة وقابلية التكرار. وتباينت شدة التعرض عبر البئر لتغيير الخواص الميكانيكية الدقيقة للهيدروجيل الناتج، كما تم تقييمها باستخدام مجهر القوة الذرية (AFM). في حين أن هذه المخطوطة لا تركز على بناء مصفوفة الإضاءة نفسها، يتم توفير مخطط الدائرة (الشكل 1B) وقائمة الأجزاء (جدول المواد) كمساعدات لإعادة إنتاج الجهاز.
يوضح هذا التقرير التوليد السريع لمجموعة من خلايا GBM المستزرعة في بيئات دقيقة فريدة من نوعها ثلاثية الأبعاد حيث كان معامل يونغ (أربعة مستويات عبر ترتيب واحد من الحجم) ومحتوى الببتيد المرتبط بالتكامل (المشتق من أربعة بروتينات ECM مختلفة) متعامدا. ثم تم استخدام هذا النهج للتحقيق في المساهمات النسبية لميكانيكا الهيدروجيل ومشاركة الإنتينجين الخاصة ب ECM على جدوى وانتشار خلايا GBM المشتقة من المريض لأنها تكتسب مقاومة للعلاج الكيميائي temozolomide (TMZ).
Protocol
تم توفير خطوط خلايا GBM المشتقة من المريض (GS122 و GS304) من قبل البروفيسور ديفيد ناثانسون (المتعاون معنا) ، الذي طور هذه الخطوط بموجب بروتوكول معتمد من قبل مجلس المراجعة المؤسسية بجامعة كاليفورنيا في لوس أنجلوس (IRB # 10-000655). تم توفير خلايا غير محددة الهوية بحيث لا يمكن ربط خطوط الخلايا مرة أخرى بالمرضى الفرديين.
1. إعداد محلول هيدروجيل
- قم بتحضير محلول مخزن مؤقتا ب HEPES عن طريق إذابة مسحوق HEPES عند 20 mM في محلول الملح المتوازن من Hank (HBSS). اضبط الرقم الهيدروجيني إلى 7 بعد الذوبان الكامل.
- في المحلول المخزن ب HEPES ، قم بإذابة HA المعزولة (الوزن الجزيئي الاسمي 700 kDa ، انظر جدول المواد) ، الذي تم إعداده بعد التقرير السابق31 ، بحيث يتم تعديل 6٪ -8٪ من بقايا حمض الكربوكسيل على كل حمض جلوكورونيك باستخدام ثيول ، بتركيز 10 ملغ / مل في محلول عازل.
ملاحظة: يوصى باستخدام قارورة كهرمان لمنع أكسدة الثيول بواسطة الضوء المحيط.- يحرك المزيج باستخدام صفيحة تحريك مغناطيسية (<1000 دورة في الدقيقة) في درجة حرارة الغرفة حتى يذوب تماما، عادة حوالي 45 دقيقة.
- أثناء ذوبان حمض الهيالورونيك ، قم بإعداد محاليل منفصلة من (1) 100 ملغ / مل من 8-arm-PEG-Norbornene (20 kDa) ، (2) 100 mg / mL من 4-arm-PEG-Thiol (20 kDa) ، (3) 4 mM من الببتيد المحتوي على السيستين أو السيستين (على سبيل المثال ، GCGYGRGDSPG) ، و (4) 4 mg / mL من LAP في أنابيب الطرد المركزي الدقيقة (انظر جدول المواد).
- قم بإعداد كل من هذه الحلول الأربعة في الحل المخزن مؤقتا ب HEPES الذي تم إعداده في الخطوة 1.1. دوامة الحلول لضمان الحل الكامل لكل كاشف قبل تنفيذ الخطوة 4.
ملاحظة: في حالة اختبار العديد من الببتيدات المختلفة ، يجب أن يحتوي كل منها على سيستين أو مصدر آخر من ثيول مويتي لكيمياء الاقتران هذه. - قم بإعداد المحاليل (4 mM المتاحة ثيول) من جميع الببتيدات ليتم ربطها داخل هيدروجيل واحد في هذه المرحلة.
ملاحظة: تسلسل الببتيد وبروتينات ECM التي اشتقت منها واستخدمت في هذه الدراسة مدرجة في الجدول 1. يمكن استبدال N-acetyl cysteine (انظر جدول المواد) ، الذي لا ترتبط به الخلايا ، بالببتيد النشط بيولوجيا المحتوي على الثيول لمعايرة تركيز الببتيد اللاصق أو العمل كعنصر تحكم سلبي31.
- قم بإعداد كل من هذه الحلول الأربعة في الحل المخزن مؤقتا ب HEPES الذي تم إعداده في الخطوة 1.1. دوامة الحلول لضمان الحل الكامل لكل كاشف قبل تنفيذ الخطوة 4.
- امزج المحاليل الفردية من HA و PEG-Norbornene و PEG-thiol والببتيدات المحتوية على السيستين / الثيول (انظر جدول المواد) لتحقيق التركيزات النهائية لمصفوفات الهيدروجيل النهائية المدرجة في الجدول 2. حرك (<1000 دورة في الدقيقة) على لوحة تحريك مغناطيسية لمدة 30 دقيقة على الأقل حتى تمتزج تماما.
ملاحظة: تتميز حلول HA بأنها شديدة اللزوجة ومن الأفضل التعامل معها باستخدام ماصة إزاحة إيجابية (انظر جدول المواد). إذا لم تكن ماصة الإزاحة الإيجابية متوفرة ، فيمكن أيضا الاستغناء عن المحاليل اللزجة بماصة دقيقة قياسية عن طريق السحب ببطء باستخدام أطراف فتحة عريضة.
2. الإضاءة والربط الضوئي للهيدروجيل عبر صفيف LED
تنبيه: ارتد نظارات واقية من الأشعة فوق البنفسجية وقم بتغطية مجال الإضاءة بمواد ممتصة للأشعة فوق البنفسجية.
ملاحظة: يتكون صفيف LED الموصوف في هذا البروتوكول من ست مجموعات من ثمانية مصابيح LED موضوعة في سلسلة، كما هو موضح في مخطط الدائرة المقدم (الشكل 1A). يمكن تشغيل كل مجموعة من مصابيح LED بشكل مستقل ، مما يسمح بما يصل إلى ستة إشعاعات مختلفة لكل تشغيل. يحتوي الملف التكميلي 1 على لقطات شاشة تتوافق مع الإرشادات التالية لمزيد من الإرشادات.
- قم بتنزيل ملف جهاز الإضاءة.zip من ملفات الترميز التكميلية. يحتوي هذا الدليل على الملفات التالية: Arduino.zip (ملف الترميز التكميلي 1) ، برامج التشغيل .zip (ملف الترميز التكميلي 2) ، واجهة المستخدم الرسومية .zip (ملف الترميز التكميلي 3) ، و Holder.zip (ملف الترميز التكميلي 4).
ملاحظة: 3D طباعة الأجزاء العلوية والسفلية لتثبيت لوحة الدوائر في مكانها (انظر ملفات الترميز التكميلية للحصول على التفاصيل). - قم بتنزيل برنامج المتحكم الدقيق وتثبيته (انظر جدول المواد).
- قم بتنزيل برنامج واجهة المستخدم الرسومية وتثبيته (انظر جدول المواد). راجع الملف التكميلي 1 للحصول على إرشادات تشغيل البرنامج.
- افتح المعالجة وقم بتثبيت مكتبة controlIP5 عبر النقر فوق Sketch > استيراد المكتبة > إضافة مكتبة. ثم ابحث عن controlIP5 في المكتبات وانقر فوق تثبيت. قم بإجراء هذا لأول مرة.
- قم بتشغيل جهاز الإضاءة (انظر جدول المواد) باستخدام مصدر الطاقة 36 فولت وقم بتوصيله بجهاز كمبيوتر باستخدام كبل micro-USB.
ملاحظة: لن تقوم بعض الأجهزة بتثبيت برامج التشغيل تلقائيا للوحات Arduino nano المختلفة. يتم توفير مجموعة واحدة من برامج التشغيل في ملف zip للجهاز. - افتح الملف Arduino.ino، الموجود في المجلد Adruino.zip، باستخدام Arduino IDE.
- قم بترجمة ملف Arduino.ino بالنقر فوق الزر علامة اختيار . قم بتحميل الرمز المترجم بالنقر فوق الزر سهم .
- افتح الملف GUI.pde الموجود في المجلد GUI.zip باستخدام المعالجة.
- انقر فوق تشغيل في برنامج المعالجة لتشغيل واجهة المستخدم الرسومية للتحكم في جهاز الإضاءة.
- في نافذة واجهة المستخدم الرسومية ، انقر فوق الكثافة للعمود الذي يحتوي على محلول سلائف الهيدروجيل ليتم ربطه وإدخال الكثافة المطلوبة. انقر على مربع الوقت وأدخل الوقت المطلوب. بالنسبة للحل المقدم في الجدول 2 ، سيكون هذا 15 ثانية.
ملاحظة: يحتاج المستعملون النهائيون إلى معايرة قيم الكثافة الرقمية إلى الإشعاع باستخدام مقياس إشعاعي. وترد أمثلة على الشدة النموذجية في الشكل 2 ألف. - قم بمحاذاة العينات مع جهاز الإضاءة (الشكل 2B) مع كل مصباح LED آخر في عمود واحد من قوالب السيليكون (انظر جدول المواد) أو لوحة 384 بئرا. انقر فوق إنهاء لبدء الإضاءة. كرر هذه العملية حسب الضرورة لإضاءة شرائح متعددة أو آبار أخرى للوحة 384 بئرا.
ملاحظة: تم تصميم الحامل بحيث يجلس صفيحة البئر 384 مع زاوية واحدة من الغرفة الداخلية أثناء الإضاءة.- بعد الإضاءة ، عند وضعها في زاوية واحدة ، حرك لوحة البئر إلى الزاوية التالية وكررها. لإضاءة الآبار على النصف الآخر من اللوحة ، ارفع اللوحة خارج الحامل وقم بتدوير 180 درجة.
- توليد هيدروجيل مع ميكانيكا مختلفة للتوصيف الميكانيكي باتباع الخطوات أدناه.
- نظف الشرائح الزجاجية وقوالب السيليكون باستخدام شريط لإزالة الحطام. قم بلصق قوالب السيليكون بالشريحة الزجاجية ، واضغط لأسفل لضمان ختم جيد ، وإزاحة أي فقاعات هواء.
- ماصة 80 ميكرولتر من محلول سلائف الهيدروجيل ، كما هو معد في الخطوة 1.4 ، في كل قالب سيليكون على الشريحة الزجاجية.
- ضع الشريحة الزجاجية على جهاز الإضاءة المحاذي لكل مؤشر LED آخر في عمود واحد. تعريض سلائف الهيدروجيل للأشعة فوق البنفسجية لمدة 15 ثانية ، كما هو موضح في الخطوة 2 ، إلى photocrosslink.
- بمجرد توقف الإضاءة ، استرجع الشرائح ، وقم بفك المواد الهلامية من القوالب عن طريق تتبع المحيط الداخلي للقالب بطرف ناعم (طرف ماصة 10 ميكرولتر ، إبرة 30 جم ، إلخ). قم بإزالة قوالب السيليكون باستخدام ملاقط / ملقط.
- انقل الهلاميات المائية المتشابكة إلى آبار فردية من صفيحة مكونة من 12 بئرا عن طريق ترطيب ملعقة ودفعها بلطف من الشريحة الزجاجية. املأ كل بئر ب 2 مل من DPBS (انظر جدول المواد) قبل إضافة الهيدروجيل. قم بنفخ المواد الهلامية في محلول DPBS لمدة 12 ساعة على الأقل (عادة بين عشية وضحاها) في درجة حرارة الغرفة (للتوصيف الميكانيكي لليوم التالي).
3. قياسات مجهر القوة الذرية (AFM)
- قم بتشغيل مجهر القوة الذرية (AFM) وفقا لتعليمات الشركة المصنعة (انظر جدول المواد). يوفر هذا البروتوكول تعليمات موجزة لاستخدام الأداة والبرامج ذات الصلة.
- قم بتثبيت مسبار AFM (انظر جدول المواد).
ملاحظة: بالنسبة لهذه الدراسة، تم تعديل ناتئ نيتريد السيليكون المثلث مع ثابت نابض اسمي قدره 0.01 N/m بجسيم كروي من ثاني أكسيد السيليكون 2.5 ميكرومتر. - بعد التثبيت ، قم بمحاذاة الليزر إلى قمة المسبار الثلاثي ، ثم اضبط المرآة وانحراف الليزر لزيادة مجموع الإشارة إلى أقصى حد (عادة بين 1.5-2.2 فولت).
- اغمر المسبار في DPBS وانتظر لمدة تصل إلى 15 دقيقة للحصول على التوازن الحراري. انقر فوق الزر معايرة وحدد المعايرة المعتمدة على جهات الاتصال . انقر فوق الزر جمع الضبط الحراري ، وبعد جمع البيانات ، حدد الذروة حول 3 كيلو هرتز للمعايرة.
ملاحظة: قد يكون من الضروري إجراء تعديل طفيف للمرآة وانحرافات الليزر بعد الغمر في سائل بسبب تغيرات معامل الانكسار. - اقترب من سطح طبق بتري (بلاستيكي) عن طريق تعيين معلمات الاقتراب على سرعة ثابتة ، وارتفاع مستهدف يبلغ 7.5 ميكرومتر ، وسرعة اقتراب تبلغ 15 ميكرومتر / ثانية. تمكين قياس خط الأساس لكل تشغيل للنهج بحيث يعمل النهج بشكل مستمر ولا يتوقف مبكرا بسبب الانجراف في الانحراف.
- عند الاقتراب ، قم بتعيين معلمات الاستحواذ لرسم خرائط القوة إلى 4 nN ، ومسافة بادئة 2 ميكرومتر ، وسرعة 1 ميكرومتر / ثانية ، ووقت اتصال 0 ثانية. اضغط على الزر ابدأ لبدء جمع منحنى قوة على السطح البلاستيكي (على سبيل المثال، لوحة بئر).
- ارجع إلى نافذة المعايرة وحدد جزء منحنى القوة المقابل لملامسة البلاستيك والمسافة البادئة له. اقبل قيم الحساسية والصلابة المحسوبة للمسبار لإكمال المعايرة.
- بعد المعايرة ، ارفع مسبار AFM وضع عينة الهيدروجيل للاستجواب. اقترب من هيدروجيل باتباع الإعدادات الواردة في الخطوة 5.
ملاحظة: أثناء إجراء الاقتراب تجاه سطح الهيدروجيل ، قد تؤدي الوحدة عن طريق الخطأ إلى تشغيل الحالة المقتربة. للتحقق من النهج الفعلي، احصل على منحنى قوة كما في الخطوة 4.6. كرر إجراء النهج إذا كان المنحنى الناتج لا يظهر الاتصال والمسافة البادئة الناتجة. - عند نجاح نهج السطح، قم بالتبديل إلى وضع تعيين القوة واضبط معلمات الاكتساب على خريطة بحجم 8 × 8 بطول 40 ميكرومتر لكل محور. الحصول على خرائط القوة في مناطق مختلفة لتقييم توحيد قياسات الصلابة.
- تفسير منحنيات القوة باستخدام البرنامج JPK SPM Data Processing من خلال نموذج Hertz / Sneddon المناسب (المعادلات 1 و 2 ، انظر الجدول 3 لتعريف جميع المتغيرات) مع الهندسة الكروية المختارة32,33,3 4.
 المعادلة 132
المعادلة 132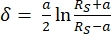 المعادلة 232
المعادلة 232
- تفسير منحنيات القوة باستخدام البرنامج JPK SPM Data Processing من خلال نموذج Hertz / Sneddon المناسب (المعادلات 1 و 2 ، انظر الجدول 3 لتعريف جميع المتغيرات) مع الهندسة الكروية المختارة32,33,3 4.
4. إعداد وعلاج المخدرات من الثقافات 3D ، مصفوفة جزءا لا يتجزأ من
- تحضير الخلايا المطلوبة كمحلول خلية واحدة.
ملاحظة: قد تتطلب أنواع الخلايا المختلفة طرق تمرير مختلفة. تم الإبلاغ عن بروتوكول نموذجي لتمرير ثقافة تعليق من الكرويات GBM من قارورة T-75 في المرجع31. - اجمع كرويات GBM (قطرها 150 ميكرومتر تقريبا) من مزرعة تعليق قارورة T-75 في أنبوب مخروطي 15 مل. شطف قارورة الثقافة مع 5 مل من DPBS لإزالة أي خلايا ووسائط متبقية وإضافة هذا الحجم إلى الأنبوب المخروطي.
- جهاز طرد مركزي للأنبوب المخروطي الذي يحتوي على خلايا عند 200 × g لمدة 5 دقائق في درجة حرارة الغرفة. بعد الطرد المركزي ، قم بإزالة المادة الفائقة باستخدام ماصة مصلية سعة 5 مل ، مع الحرص على عدم إزعاج حبيبات الخلية ، وإعادة التعليق في 5 مل من DPBS.
- جهاز طرد مركزي عند 200 × جم لمدة 5 دقائق في درجة حرارة الغرفة لغسل الخلايا. قم بشفط السوبرناتانت باستخدام ماصة مصلية سعة 5 مل ، مع الحرص على عدم إزعاج بيليه الخلية ، ثم أعد تعليق الخلايا في 2 مل من كاشف تفكك الخلية (انظر جدول المواد).
- حضانة في درجة حرارة الغرفة لمدة 10-15 دقيقة. أضف 3 مل من الوسط الكامل (انظر جدول المواد) وماصة بلطف 3-5 مرات لتحطيم الكرويات إلى تعليق خلية واحدة31.
- قم بطرد مركزي للتعليق أحادي الخلية عند 400 × g (قد يتم نسج المعلقات أحادية الخلية بشكل أسرع لتشكيل الكريات) لمدة 5 دقائق لخلايا الكريات في درجة حرارة الغرفة. استنشاق supernatant مع ماصة مصلية 5 مل ، مع الحرص على عدم إزعاج بيليه الخلية. أعد تعليق الخلايا في 1 مل من الوسط الكامل.
ملاحظة: إذا بقيت الخلايا في كتل ، بدلا من الخلايا المفردة في التعليق ، بعد المرور ، يمكن تمرير الخلايا عبر مصفاة خلية 40 ميكرومتر لتحقيق تعليق خلية واحدة. - قم بإزالة جزء من الخلايا للعد باستخدام مقياس الدم. قم بتخفيف هذا الجزء مرتين باستخدام أزرق التربان ، الذي يتخلل الخلايا ذات الجدوى المعرضة للخطر. عد فقط الخلايا الحية عديمة اللون. عادة ، ينتج T-75 البذر في 800000 خلية لكل قارورة 2-3 مليون خلية بعد أسبوع في الثقافة.
- تحديد عدد الخلايا اللازمة للتغليف. انقل كمية من الوسائط التي تحتوي على إجمالي عدد الخلايا اللازمة إلى أنبوب طرد مركزي دقيق معقم سعة 1.7 مل. تدور لأسفل عند 400 × g لمدة 5 دقائق في درجة حرارة الغرفة.
ملاحظة: على سبيل المثال ، هناك حاجة إلى ما لا يقل عن 2.5 مليون خلية أعيد تعليقها في 1 مل من حجم الجل لتغليف الخلايا عند 2.5 مليون خلية / مل. يسمح حجم الجل البالغ 1 مل للمستخدمين بتوزيع 100 قطرة هلام ، حيث تبلغ كل قطرة هلام 10 ميكرولتر. يوصى بإعداد حجم إضافي ~ 20٪ من الخلايا المعلقة في محلول الهيدروجيل لحساب الخسارة أثناء نقل الماصة. وبالتالي ، يمكن للمرء أن يعد 3 ملايين خلية و 1.2 مل من محلول سلائف الهيدروجيل في هذا المثال. يوصى بكثافة لا تقل عن 500 ألف خلية / مل. - استنشاق supernatant مع micromatete ، مع الحرص على عدم إزعاج بيليه الخلية. أعد تعليق حبيبات الخلايا في محلول سلائف الهيدروجيل ، كما هو معد في الخطوة 1.4 ، واخلطها جيدا عن طريق السحب لأعلى ولأسفل باستخدام ماصة دقيقة سعة 1000 ميكرولتر 4-5 مرات.
- قم بتحميل الخلايا في ماصة متكررة (انظر جدول المواد) تم ضبطها لتوزيع 10 ميكرولتر. لتجنب الفقاعات والاستغناء غير المتكافئ ، قم بتجهيز الماصة المتكررة عن طريق توزيع 1-2 مرات إضافية في حاوية نفايات.
- في كل بئر من صفيحة 384 بئرا ، قم بتوزيع 10 ميكرولتر من الخلايا المعلقة في محلول هيدروجيل من الماصة المتكررة. باستخدام صفيف LED ، قم بإضاءة كل بئر يحتوي على خلايا (الخطوة 2) لمدة 15 ثانية بكثافة (نتائج المثال في الشكل 2A استخدمت كثافة 1.14 و 1.55 و 2.15 و 2.74 mW / cm2) لتحقيق الخصائص الميكانيكية المطلوبة.
ملاحظة: يقترح البدء بخمسة نسخ متماثلة لكل حالة تجريبية والتوسع لأعلى أو لأسفل اعتمادا على الإنتاجية المطلوبة وتباين فحص نقطة النهاية. - أضف 40 ميكرولتر من الوسائط الكاملة إلى كل بئر يحتوي على الخلايا. أضف 50 ميكرولتر من DPBS إلى الآبار الجافة غير التجريبية المحيطة بالمواد الهلامية لتقليل الخسائر الناجمة عن التبخر.
- بالنسبة لخلايا GBM ، أضف 40 ميكرولتر من الدواء المحتوي على الوسائط (على سبيل المثال ، TMZ ، انظر جدول المواد) لتحقيق التركيز النهائي المطلوب (10 μM-100 μM في ثنائي ميثيل سلفوكسيد (DMSO) أو السيارة (DMSO) ، وفقا لذلك ، بدءا من 3 أيام بعد التغليف.
5. اختبار انتشار CCK8
- أضف 10 ميكرولتر من كاشف CCK8 (انظر جدول المواد) إلى كل بئر يحتوي على الخلايا.
ملاحظة: في حالة إجراء هذا الفحص لأول مرة، قم بتضمين آبار التحكم السلبية مثل الوسائط فقط أو الهيدروجيل الخالي من الخلايا في الوسائط. - احتضان لمدة 1-4 ساعات وفقا لتعليمات الشركة المصنعة.
ملاحظة: قد تختلف هذه المرة كدالة لنوع الخلية وكثافتها ، وبالتالي يجب اختبار أوقات الحضانة لكل تطبيق بحيث تقع قيم الامتصاص ضمن نطاق خطي ، وهو شرط لتطبيق قانون البيرة35. - اقرأ الامتصاص عند 450 نانومتر لجميع الآبار بعد الحضانة.
- احسب متوسط الامتصاص عند 450 نانومتر الذي تم الحصول عليه في الخطوة 3 لحالة السيارة لكل مجموعة. قسم كل دواء يعالج بشكل جيد على متوسط التحكم في السيارة لكل مجموعة.
- حساب فترات الثقة عن طريق إنشاء توزيعات bootstrap (N = 10,000) من خلال طريقة النسبة المئوية36.
ملاحظة: بشكل عام ، يمكن للمرء استخدام فترات ثقة بنسبة 95٪ وتفسير الظروف التي لا تتجاوز فترات الثقة فيها 1 لتكون مهمة وتستدعي مزيدا من التحقيق. إن تحديد فترات الثقة إلى 95٪ يتوافق مع تحديد حد أهمية p = 0.05. وبالنسبة للبيانات المبينة في النتائج، هناك فائدة في التمييز بين الظروف التي تعزز أو تمنع مقاومة الأدوية بوساطة المصفوفة، مما يتطلب تحليلا ذا جانبين.
النتائج
أكدت قياسات AFM التحكم الدقيق في ميكانيكا الهيدروجيل كدالة للإشعاع فوق البنفسجي (mW / cm2) أثناء الربط المتقاطع للصور باستخدام صفيف LED مصمم خصيصا يتم التحكم فيه بواسطة Arduino (الشكل 2A). يمكن العثور على تركيبة الهيدروجيل المستخدمة في هذا البروتوكول في الجدول 2. يتطاب?...
Discussion
يقدم العمل الحالي طرقا لتوليد 3D ، ثقافات مصغرة داخل HA القائمة على تغيير صلابة المصفوفة والببتيدات المتاحة للمشاركة في Integrin. تمكن هذه التقنية من الدراسة المنهجية لكيفية تأثير معلمات المصفوفة على الأنماط الظاهرية الخلوية (على سبيل المثال ، صلاحية الخلايا السرطانية المعرضة للعلاج الكيميائ...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يود المؤلفون أن يعربوا عن تقديرهم على وجه التحديد لكارولين كيم وأميليا لاو وريان ستوتامور وإيتاي سولومون لمساهماتهم في التكرارات السابقة لمخطط التبشير الضوئي. تم توفير خطوط الخلايا GS122 و GS304 بسخاء من قبل ديفيد ناثانسون. تم إنشاء جميع الأرقام مع BioRender.com. وكانت المرافق الأساسية لجامعة كاليفورنيا في لوس أنجلوس، والموارد المشتركة للفحص الجزيئي، ومختبر توصيف النانو وبيكو مفيدة في هذا العمل. تم دعم تشن شيا تشون من قبل جامعة كاليفورنيا في لوس أنجلوس إيلي ومركز إديث برود للطب التجديدي وبرنامج التدريب على أبحاث الخلايا الجذعية. تم دعم Grigor Varuzhanyan من قبل برنامج التدريب على بيولوجيا الخلايا السرطانية NIH Grant (T32 CA 009056).
Materials
| Name | Company | Catalog Number | Comments |
| 1.1 kOhm resistors, 6 W | Digikey | 35601k1ft | |
| 1.7 mL microcentrifuge tube | Genesse Scientific | 21-108 | |
| 15 mL conical tube | Fisher Scientific | 14-959-70C | |
| 365 nm LED | Digikey | ltpl-c034uvh365 | |
| 384 well plate | Bio Greiner One | 781090 | |
| 40 µm cell strainer | MTC bio | C4040 | |
| 4-Armed thiol terminated polyethlene glycol (20 kDa) | Laysan Bio | 4arm-PEG-SH-20K-1g | |
| 6 NPN BJTs | Digikey | 2n5550ta | |
| 80 Ohm resistors, 0.125 W | Digikey | erjj-6enf80r6v | |
| 8-Armed norbornene terminated polyethylene glycol (20 kDa) | Jenkem Technology | A7025-1 | |
| Accutase | Innovative Cell Technologies | AT104500 | cell dissociation reagent |
| AFM Probes | Novascan | 0.01 N/m Nominal spring constant, 2.5 µm SiO2 particle | |
| Arduino IDE | Arduino | 1.8.19 | |
| Arduino Nano | Makerfire | Mini Nano V3.0 ATmega328P Microcontroller Board | |
| bFGF | Peprotech | 100-18B | 20 ng/mL |
| CCK8 | Abcam | ab228554 | |
| Centrifuge | Thermoscientific | sorvall legend xtr | |
| CP100ST | Gilson | F148415 | Pipette tips for positive displacement pipette |
| Cubis Semi-Micro Balance | Sartorius | MSA225S100DI | |
| DMEM - F12 (50-50) | Life Technologies | 11330057 | 1x |
| DMSO | Fisher Scientific | BP231-100 | |
| DPBS Ca (-) Mg (-) | Genesse Scientific | 25-508 | |
| EGF | Peprotech | AF100-15 | 50 ng/mL |
| Ethanol, Anhydrous | Fisher Scientific | A405P | Add DI water to dilute to 70% |
| Fisherbrand Class B Amber Glass threaded vials | Fisher Scientific | 03-339-23C | |
| Fisherbrand Weighing Paper | Fisher Scientific | 09-898-12B | |
| G21 Supplement | Gemini Bio | 400-160 | 50x |
| Hanks Balanced Salt Solution | Thermo Fisher Scientific | 14175095 | |
| HCl, ACS, 12M | Sigma Aldrich | S25838A | Add DI water to dilute to 1 M |
| Heparin sodium salt from porcine intestinal mucosa | Sigma Aldrich | H3149-100Ku | 25 µg/mL |
| HEPES | Sigma Aldrich | H7006-100G | |
| Hot Air Gun | Wagner | HT1000 | |
| Integrin-binding sialoprotein (IBSP) peptide | Genscript | Custom Order | GCGYGGGGNGEPRGDTYRAY |
| Lithium phenyl-2,4,6 trimethylbenzoylphosphinate (LAP) , >95% | Sigma Aldrich | 900889-1G | |
| Magnetic stir plate | Thermo Scientific | SP194715 | |
| Microcentrifuge | Thermo Scientific | Sorvall legend micro 21R | |
| Microman E single Channel Pipettor | Gilson | FD10004 | Positive displacement pipette |
| Micropipette Tips | Various Manufacturs | Various sizes | |
| mLine micropipette | Sartorious | ||
| N-acetyl Cysteine | Sigma Aldrich | A7250-10G | |
| Nanowizard 4 | Bruker | AFM microscope | |
| NaOH | Fisher Scientific | ss255-1 | Add DI water to dilute to 1 M |
| Normoicin | Invivogen | ant-nr-1 | 500x |
| Osteopontin Peptide | Genscript | Custom Order | GCGYGTVDVPDGRGDSLAYG |
| Pipet Aid | Drummond | 4000102 | |
| Plain Microscope Slides | Globe Scientific | 1301 | |
| Press-To-Seal silicone Isolator, 12-4.5mm diam x 2mm deep | Grace Bio Labs | 664201-A | Cut so that 8 individual molds are made from a single sheet |
| Processing | Processing | 3.5.4 | |
| Repeater M4 | Eppendorf | 4982000322 | |
| Repeater Pipette Tips | Sartorious | 30089430 | 1 mL sizes |
| RGD Peptide | Genscript | GCGYGRGDSPG | |
| Scoth Tape | |||
| Serological Pipettes | Genesse Scientific | 12-102,12-104 | 5,10 mL Pipettes |
| Solder Paste | Digikey | 315-NC191LT15T5-ND | |
| Solder Wire | |||
| Straight dissecting forceps | VWR Scientific | 82027-408 | |
| Synergy H1 Plate Reader | Biotek | ||
| T-75 Cell Culture Treated Flask | Genesee Scientific | 25-209 | |
| Temozolomide | Sigma Aldrich | T2577 | Typically used from 10 µM to 100 µM |
| Tenascin-C Peptide | Genscript | GCGYGRSTDLPGLKAATHYTITIR GV | |
| Thiolated Hyaluronic Acid (700 kDa), 6-8% modified | Lifecore Biomedical | HA700K5 | |
| VWR Spinbar, Flea Micro | VWR | 58948-375 |
References
- Scannell, J. W., Blanckley, A., Boldon, H., Warrington, B. Diagnosing the decline in pharmaceutical R&D efficiency. Nature Reviews Drug Discovery. 11 (3), 191-200 (2012).
- Waring, M. J., et al. An analysis of the attrition of drug candidates from four major pharmaceutical companies. Nature Reviews Drug Discovery. 14 (7), 475-486 (2015).
- Khozin, S., Liu, K., Jarow, J. P., Pazdur, R. Why do oncology drugs fail to gain US regulatory approval. Nature Reviews Drug Discovery. 14 (7), 450-451 (2015).
- Booth, B., Ma, P., Glassman, R. Oncology's trials. Market indicators. Nature Reviews Drug Discovery. 2 (8), 609-610 (2003).
- Da Ros, M., et al. Glioblastoma chemoresistance: The double play by microenvironment and blood-brain barrier. International Journal of Molecular Sciences. 19 (10), 2879 (2018).
- Broekman, M. L., et al. Multidimensional communication in the microenvirons of glioblastoma. Nature Reviews Neurology. 14 (8), 482-495 (2018).
- Grundy, T. J., et al. Differential response of patient-derived primary glioblastoma cells to environmental stiffness. Scientific Reports. 6 (1), 1-10 (2016).
- Gomez-Roman, N., Stevenson, K., Gilmour, L., Hamilton, G., Chalmers, A. J. A novel 3D human glioblastoma cell culture system for modeling drug and radiation responses. Neuro-Oncology. 19 (2), 229-241 (2017).
- Simoni, R. D., et al. Basement membrane complexes with biological activity. Biochemistry. 25 (2), 312-318 (2002).
- Xiao, W., et al. Brain-mimetic 3D culture platforms allow investigation of cooperative effects of extracellular matrix features on therapeutic resistance in glioblastoma. Cancer Research. 78 (5), 1358-1370 (2018).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Spinelli, C., et al. Molecular subtypes and differentiation programmes of glioma stem cells as determinants of extracellular vesicle profiles and endothelial cell-stimulating activities. Journal of Extracellular Vesicles. 7 (1), 1490144 (2018).
- Ostrom, Q. T., Cioffi, G., Waite, K., Kruchko, C., Barnholtz-Sloan, J. S. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2014-2018. Neuro-Oncology. 23, (2021).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352 (10), 987-996 (2005).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Tomczak, K., Czerwińska, P., Wiznerowicz, M. The Cancer Genome Atlas (TCGA): An immeasurable source of knowledge. Contemporary oncology. 19, 68-77 (2015).
- Lee, S. Y. Temozolomide resistance in glioblastoma multiforme. Genes and Diseases. 3 (3), 198-210 (2016).
- Joo, K. M., et al. Patient-specific orthotopic glioblastoma xenograft models recapitulate the histopathology and biology of human glioblastomas in situ. Cell Reports. 3 (1), 260-273 (2013).
- Levy, N. The use of animal as models: Ethical considerations. International Journal of Stroke. 7 (5), 440-442 (2012).
- Phon, B. W. S., Kamarudin, M. N. A., Bhuvanendran, S., Radhakrishnan, A. K. Transitioning preclinical glioblastoma models to clinical settings with biomarkers identified in 3D cell-based models: A systematic scoping review. Biomedicine & Pharmacotherapy. 145, 112396 (2022).
- Xiao, W., et al. Bioengineered scaffolds for 3D culture demonstrate extracellular matrix-mediated mechanisms of chemotherapy resistance in glioblastoma. Matrix Biology. 85-86, 128-146 (2020).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Xu, X., Farach-Carson, M. C., Jia, X. Three-dimensional in vitro tumor models for cancer research and drug evaluation. Biotechnology Advances. 32 (7), 1256-1268 (2014).
- Xiao, W., Ehsanipour, A., Sohrabi, A., Seidlits, S. K. Hyaluronic-acid based hydrogels for 3-dimensional culture of patient-derived Glioblastoma Cells. Journal of Visualized Experiments: JoVE. (138), e58176 (2018).
- Preston, M. Digestion products of the PH20 hyaluronidase inhibit remyelination. Annals of Neurology. 73 (2), 266-280 (2013).
- Kim, Y., Kumar, S. CD44-mediated adhesion to hyaluronic acid contributes to mechanosensing and invasive motility. Molecular Cancer Research. 12 (10), 1416-1429 (2014).
- Pibuel, M. A., Poodts, D., Díaz, M., Hajos, S. E., Lompardía, S. L. The scrambled story between hyaluronan and glioblastoma. The Journal of Biological Chemistry. 296, 100549 (2021).
- Xiao, W., Sohrabi, A., Seidlits, S. K. Integrating the glioblastoma microenvironment into engineered experimental models. Future Science OA. 3 (3), (2017).
- Trombetta-Lima, M., et al. Extracellular matrix proteome remodeling in human glioblastoma and medulloblastoma. Journal of Proteome Research. 20 (10), 4693-4707 (2021).
- Schregel, K., et al. Characterization of glioblastoma in an orthotopic mouse model with magnetic resonance elastography. NMR in Biomedicine. 31 (10), 3840 (2018).
- Xiao, W., Ehsanipour, A., Sohrabi, A., Seidlits, S. K. Hyaluronic-acid based hydrogels for 3-dimensional culture of patient-derived glioblastoma cells. Journal of Visualized Experiments: JoVE. (138), e58176 (2018).
- Guz, N., Dokukin, M., Kalaparthi, V., Sokolov, I. If cell mechanics can be described by elastic modulus: Study of different models and probes used in indentation experiments. Biophysical Journal. 107 (3), 564-575 (2014).
- Sneddon, I. N. The relation between load and penetration in the axisymmetric boussinesq problem for a punch of arbitrary profile. International Journal of Engineering Science. 3 (1), 47-57 (1965).
- Soofi, S. S., Last, J. A., Liliensiek, S. J., Nealey, P. F., Murphy, C. J. The elastic modulus of MatrigelTM as determined by atomic force microscopy. Journal of Structural Biology. 167 (3), 216-219 (2009).
- Mayerhöfer, T. G., Popp, J. Beer's law - Why absorbance depends (almost) linearly on concentration. Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry. 20 (4), 511-515 (2019).
- Puth, M. T., Neuhäuser, M., Ruxton, G. D. On the variety of methods for calculating confidence intervals by bootstrapping. Journal of Animal Ecology. 84 (4), 892-897 (2015).
- Lavrentieva, A. Gradient hydrogels. Advances in Biochemical Engineering/Biotechnology. 178, 227-251 (2020).
- Zhu, D., Trinh, P., Li, J., Grant, G. A., Yang, F. Gradient hydrogels for screening stiffness effects on patient-derived glioblastoma xenograft cellfates in 3D. Journal of Biomedical Materials Research. Part A. 109 (6), 1027-1035 (2021).
- da Hora, C. C., Schweiger, M. W., Wurdinger, T., Tannous, B. A. Patient-derived glioma models: From patients to dish to animals. Cells. 8 (10), 1177 (2019).
- Li, W., et al. Characterization and transplantation of enteric neural crest cells from human induced pluripotent stem cells. Molecular Psychiatry. 23 (3), 499-508 (2018).
- Scaringi, C., Minniti, G., Caporello, P., Enrici, R. M. Integrin inhibitor cilengitide for the treatment of glioblastoma: A brief overview of current clinical results. Anticancer Research. 32 (10), 4213-4224 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved