Method Article
تقييم ومعالجة النشاط العصبي باستخدام المجهر المجسم ثنائي الفوتون
In This Article
Summary
قمنا بتطوير مجهر ثلاثي الأبعاد ثنائي الفوتون يمكنه تصور النشاط العصبي وتقييمه ومعالجته باستخدام دقة زمانية مكانية عالية ، بهدف توضيح التسبب في الاضطرابات العصبية والنفسية المرتبطة بالنشاط العصبي غير الطبيعي.
Abstract
مكنت التطورات الحديثة في التصوير الحيوي البصري وعلم البصريات الوراثي من تصور الظواهر البيولوجية والتلاعب بها ، بما في ذلك الأنشطة الخلوية ، في الحيوانات الحية. في مجال علم الأعصاب ، تم الآن الكشف عن النشاط العصبي التفصيلي المتعلق بوظائف الدماغ ، مثل التعلم والذاكرة ، وأصبح من الممكن التلاعب بهذا النشاط بشكل مصطنع للتعبير عن وظائف الدماغ. ومع ذلك ، فإن التقييم التقليدي للنشاط العصبي بواسطة التصوير ثنائي الفوتون Ca2+ لديه مشكلة الدقة الزمنية المنخفضة. بالإضافة إلى ذلك ، فإن التلاعب بالنشاط العصبي بواسطة علم البصريات الوراثي التقليدي من خلال الألياف البصرية لا يمكن إلا أن ينظم في وقت واحد نشاط الخلايا العصبية ذات الخلفية الوراثية نفسها ، مما يجعل من الصعب التحكم في نشاط الخلايا العصبية الفردية. لحل هذه المشكلة ، قمنا مؤخرا بتطوير مجهر ذو دقة زمانية مكانية عالية للتطبيقات البيولوجية من خلال الجمع بين علم البصريات الوراثي والتكنولوجيا الثلاثية الأبعاد الرقمية التي يمكنها تعديل أشعة الليزر بالأشعة تحت الحمراء فيمتو ثانية. هنا ، نصف بروتوكولات التصور والتقييم والتلاعب بالنشاط العصبي ، بما في ذلك إعداد العينات وتشغيل مجهر ثلاثي الأبعاد ثنائي الفوتون (الشكل 1). توفر هذه البروتوكولات معلومات زمانية مكانية دقيقة عن النشاط العصبي ، والتي قد تكون مفيدة لتوضيح التسبب في الاضطرابات العصبية والنفسية التي تؤدي إلى تشوهات في النشاط العصبي.
Introduction
يعد التصوير ثنائي الفوتون Ca2+ تقنية مفيدة لتقييم النشاط العصبي. يمكن استخدامه لتحديد ليس فقط النشاط العصبي المطلوب للسلوك والذاكرة في الحيوانات الطبيعية 1,2 ولكن أيضا نشاط عصبي غير طبيعي يحدث في نماذج الفئران من الاضطرابات العصبية والنفسية 3,4. تم استخدام هذه التقنية لتوضيح الأساس العصبي لوظائف الدماغ. ومع ذلك ، على الرغم من أنه يمكن أن يوفر صورا عالية الدقة وعالية الجودة ، إلا أن دقته الزمنية أقل من الطريقة الفيزيولوجية الكهربية 1,3.
ساعد علم البصريات الوراثي على ابتكار الطريقة التي يفهم بها علماء الأعصاب وظائف المخ5. نظرا للقيود التقنية ، استخدمت غالبية أبحاث علم البصريات الجينية مخططات تنشيط ذات دقة مكانية منخفضة ، مما يحد من أنواع التلاعب بالنشاط العصبي التي يمكن إجراؤها وفقا لذلك. ومع ذلك ، فإن التلاعب بالنشاط العصبي على المقاييس الزمانية المكانية الدقيقة يمكن أن يكون مفيدا لفهم أكثر اكتمالا للحساب العصبي والتسبب في الاضطرابات العصبية والنفسية. تعد تقنية التصوير المجسم الدقيقة مكانيا التي يمكنها تشكيل أشعة الليزر القريبة من الأشعة تحت الحمراء فيمتو ثانية بالتغلب على هذا التحدي وتفتح العديد من الفئات التجريبية الجديدة التي كانت مستحيلة في السابق 6,7. تمكن هذه التقنية علماء الأعصاب من الكشف عن الجوانب والأمراض الأساسية للرموز العصبية الحسية والمعرفية والسلوكية التي كانت بعيدة المنال.
يتضمن الإسقاط المجسم توليد أنماط الضوء المرغوبة للوصول إلى الخلايا الفردية والشبكات الوظيفية بشكل انتقائي. تتطلب التجارب في الجسم الحي انتقالا مثاليا للضوء لاستهداف الخلايا في الدماغ الحي. يخترق ضوء الأشعة تحت الحمراء الأنسجة الحية بشكل أعمق ويمكن استخدامه لإثارة الفوتون غير الخطي (2PE) 8،9،10. وبالتالي ، يمكن استخدام المجهر المجسم ثنائي الفوتون ، والذي يجمع بين الإسقاط المجسم و 2PE ، لتقييم ومعالجة الأنشطة العصبية لاستكشاف الشبكات الخلوية والوظيفية في الجسم الحي. أوضحت التطبيقات البيولوجية الحديثة للمجهر المجسم ثنائي الفوتون النشاط العصبي والدوائر اللازمة للتعلم في القشرة البصرية 11،12 ، والبصلة الشمية13 ، والحصين14.
أبلغت العديد من المختبرات في جميع أنحاء العالم عن نتائج وتحسينات مثيرة باستخدام أنظمة التحفيز الثلاثية الأبعاد15،16،17،18،19،20،21،22،23. في النظام الموصوف هنا ، يمكن بناء نظام التحفيز المجسم كجهاز إضافي للمجهر التقليدي. يعد معدل الضوء المكاني للطور فقط (SLM) هو الجهاز الرئيسي لتعديل واجهة موجة الطائرة إلى أي شكل ، ويتم استخدام تأثير التداخل للتحكم في شدة وموقع البؤر. يوضح الشكل 2 التحفيز المجسم وتصوير مسارات الضوء. مسار الضوء الأول مخصص لوضع تصوير مسح النقاط ويتكون من رأس مسح ضوئي وكاشفات صور. مسار الضوء الثاني مخصص للتحفيز المجسم بطول موجي 1040 نانومتر ويتكون من SLM1. مسار الضوء الثالث مخصص للإضاءة الثلاثية الأبعاد بطول موجي 920 نانومتر ويتكون من SLM2 ومستشعر صورة. يمكن لوضع التصوير المجسم تسجيل الشدة من مناطق متعددة ذات أهمية عن طريق إضاءة نقاط متعددة في العينة. بهذه الطريقة ، يمكن زيادة سرعة التسجيل إلى بضع مئات من الإطارات في الثانية. لتحقيق تصوير المسح الضوئي أو التصوير المجسم بالإضاءة ، تم تقسيم الليزر 920 نانومتر إلى مسارين بواسطة مقسم شعاع بنسبة ثابتة تبلغ 3: 7. تمت محاذاة جميع العناصر البصرية على لوح بصري بأبعاد 600 مم × 600 مم. دخل الضوء المعدل من خلال منفذ الضوء على جانب الجسم المجهري ، بينما دخل ضوء التصوير بالمسح النقطي من خلال رأس المسح في الجزء العلوي من الجسم المجهري. تم دمج هذه الأضواء فوق العدسة الشيئية مباشرة وخلقت بؤرا في مستوى العينة. بالإضافة إلى ذلك ، مكن البرنامج المصمم خصيصا سير العمل المنتظم من أن يكون بسيطا ومتسقا.
في هذه المقالة ، يتم تقديم بروتوكول كامل لاستخدام التحفيز المجسم أو الإضاءة لقياس النشاط العصبي وتقييم الاتصال الوظيفي بين الخلايا العصبية. لأغراض توضيحية ، نصف هنا جراحة دماغية تستهدف منطقة الطرف الخلفي من القشرة الحسية الجسدية الأولية (S1HL) لدماغ الفأر وطريقة لتقييم النشاط العصبي ومعالجته باستخدام المجهر المجسم ثنائي الفوتون. ينقسم الإجراء التجريبي إلى أربعة أجزاء. أولا ، تم تثبيت لوحة الرأس على جمجمة الفأر باستخدام الأسمنت السني. ثانيا ، تم حقن ناقل فيروسي يعبر عن jGCaMP8f أو GCaMP6m-P2A-ChRmine بشكل تجسيمي في S1HL. ثالثا ، تمت معايرة نظام التحفيز المجسم أو الإضاءة. رابعا ، بعد الشفاء بعد العملية الجراحية والتعبير عن هذين البروتينين ، تم إجراء تصوير في الجسم الحي Ca2+ لتقييم النشاط العصبي والاتصال الوظيفي بين الخلايا العصبية باستخدام المجهر المجسم ثنائي الفوتون.
Protocol
تمت الموافقة على جميع البروتوكولات التجريبية من قبل لجان رعاية واستخدام الحيوان في كلية الطب العليا بجامعة ناغويا (رقم الموافقة: M220295-003).
1. زرع لوحة الرأس (الشكل 1 أ)
- تطبيق المخدر (خليط من 74 ملغ/كغ كيتامين و10 ملغ/كغ زيلازين) داخل الصفاق لتخدير الفأر. تحقق من حالة التخدير للماوس بشكل متكرر عن طريق تقييم ردود فعل الدواسة.
- بعد التخدير ، ضع الماوس في أداة مجسمة. ضع مرهما للعين (انظر جدول المواد) لمنع القرنية من الجفاف عند زرع لوحة الرأس.
- حلق المنطقة الجراحية وعقم الجلد بثلاث جولات متناوبة من مقشرات البوفيدون واليود أو الكلورهيكسيدين متبوعة بمناديل كحولية بنسبة 70٪. فضح الجمجمة بعناية وتنظيفه بمسحات القطن.
ملاحظة: يجب تعقيم جميع الأدوات الجراحية ، ويجب تنفيذ جميع الإجراءات وفقا لذلك. أي حطام متبقي (مثل الشعر أو الدم المجفف) يسبب تفاعلات التهابية. لذلك ، يجب إزالة أي حطام تحت مجسمة باستخدام مسحات قطنية مبللة بالماء المعقم أو 70٪ كحول. - استخدم الإحداثيات التجسيمية - الأمامية والخلفية = 0.5 مم ، الإنسي والجانبي = 1.5 مم من bregma - للعثور على مركز حج القحف وتسميته بقلم تحديد.
- ضع لوحة رأس مصنوعة حسب الطلب في وسط الجمجمة. بعد ذلك ، ضع أسمنت الأسنان (انظر جدول المواد) لتثبيته بإحكام على الجمجمة. اضغط ضغطا خفيفا حتى تلامس لوحة الرأس بقوة الجزء الأمامي والخلفي من الجمجمة.
ملاحظة: تستغرق هذه الخطوة حوالي 20 دقيقة لإكمالها وهي ضرورية لتقليل آثار الحركة في الدماغ أثناء التصوير ثنائي الفوتون. أبعاد لوحة الرأس هي 20 مم × 40 مم × 1 مم مع فتحة على شكل لوحة منزلية بحافة واحدة بطول 15 مم ، وجانبان متجاوران بطول 3 مم ، والجانبان المتبقيان بطول 10 مم. - امزج أسمنت راتنج لاصق للأسنان قائم على الأكريليك معا على النحو التالي: نصف ملعقة من المسحوق ، وثلاث قطرات من السائل ، وقطرة واحدة من المحفز (انظر جدول المواد). لمنع الجفاف ، ضع هذا الأسمنت الراتنج اللاصق للأسنان المختلط على سطح الجمجمة السليم للماوسمع لوحة الرأس.
- ضع الماوس في قفص دافئ حتى يتعافى من التخدير. لا تترك الفأر دون مراقبة حتى يستعيد وعيه الكافي للحفاظ على الاستلقاء القصي.
2. الجراحة وحقن الفيروسات المرتبطة بالغدي (AAV) (الشكل 1 ب)
- إجراء حج القحف أو الحقن الفيروسي دون إزالة الأسمنت الراتنج لاصق الأسنان من الجمجمة 1 يوم بعد زرع لوحة الرأس.
ملاحظة: تطبيق التخدير (خليط من 74 ملغ/كغ من الكيتامين و10 ملغ/كغ من الزيلازين) داخل الصفاق لدى الفأر خلال هذا الإجراء. - لتجنب الوذمة الدماغية، يتم تطبيق ديكساميثازون فوسفات الصوديوم (1.32 ملغ/كغ) داخل الصفاق قبل ساعة واحدة من الجراحة.
- تخدير الماوس بلوحة الرأس بتخدير إيزوفلوران بنسبة 1٪ باستخدام المرذاذ (نظام توصيل التخدير) مع الحفاظ على درجة حرارة الجسم باستخدام وسادة التدفئة. ضع مرهما للعين لمنع جفاف القرنية.
- تحت مجسمة ، قم بإجراء حج القحف الدائري بقطر 2 مم تقريبا باستخدام مثقاب الأسنان. لتقليل تلف الدماغ ، قم بتشغيل مثقاب الأسنان بعناية مع حركة طفيفة ثابتة وضغط خفيف لأسفل.
- إزالة شظايا العظام عدة مرات باستخدام نظام الشفط. بعد إزالة شظايا العظام ، استخدم محلول السائل الشوكي الاصطناعي (ACSF) لإزالة وغسل أي حطام متبقي على سطح الدماغ. كرر إجراء التنظيف هذا عدة مرات لقمع ردود الفعل الالتهابية.
ملاحظة: تم تخزين محلول ACSF (140 mM NaCl و 2.5 mM KCl و 5 mM HEPES و 2.0 mM CaCl 2 و 1.0 mM MgCl2) عند 4 درجات مئوية لمدة شهر واحد بعد إذابة الكاشف وتصفيته (حجم المسام = 0.22 ميكرومتر). - باستخدام نظام حقن الضغط (انظر جدول المواد) ، اضبط الضغط المناسب (حوالي 10 رطل لكل بوصة مربعة في نبضات لمدة 4 مللي ثانية) لحقن 500 نانولتر من محلول AAV من خلال شعيرات زجاجية بقطر طرف 10-20 ميكرومتر (محضر باستخدام مجتذب ماصة دقيقة) لمدة 10 دقائق.
- حدد ما إذا كان يتم إعطاء محلول AAV للدماغ عن طريق التحقق مما إذا كان مستوى محلول AAV في الشعيرات الدموية الزجاجية ينخفض تدريجيا.
- اترك الشعيرات الدموية الزجاجية في مكانها لمدة 10 دقائق إضافية لمنع التدفق العكسي. كرر ثلاث مرات لإدارة ما مجموعه 1.5 ميكرولتر من محلول AAV في الدماغ.
- لتقييم ومعالجة النشاط العصبي في الخلايا الهرمية للطبقة 2/3 (L2/3) ، قم بحقن محلول AAV (لتصوير Ca 2+: AAV2 / 1-Syn-jGCaMP8f-WPRE عند 1.28 ×10 14 جينومات متجه / مل ، مخفف 1: 1 في محلول ملحي ؛ لتصوير الكالسيوم2+ باستخدام علم البصريات الوراثي: AAV2 / 8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1-WPRE عند 1.73 × 1014 جينوم متجه / مل ، مخفف 1: 1 في محلول ملحي) في منطقة المخلب الخلفي للقشرة الحسية الجسدية الأولية للفئران البرية (S1 ، تتمركز عند 0.5 مم خلفي و 1.5 مم جانبي من بريجما ، عمق 150 ميكرومتر من السطح).
ملاحظة: يجب حقن محلول AAV في 2-3 أسابيع و 1-2 أسابيع قبل التصوير لتعبير jGCaMP8f و GCaMP6m-P2A-ChRmine ، على التوالي. - بعد تطبيق 2٪ (w / v) agarose منخفض الذوبان على سطح الدماغ من S1 باستخدام micropipette ، ضع نافذة زجاجية فوق حج القحف مع اثنين من أكواب الغطاء. قم بتوصيل زجاجي الغطاء (قطر صغير 2.0 مم وقطر كبير 4.5 مم ؛ انظر جدول المواد) بمادة لاصقة قابلة للمعالجة بالأشعة فوق البنفسجية.
- اضغط على غطاء الزجاج ضد الأغاروز بينما لا يزال سائلا ؛ هذا يمنع تشكيل فقاعات الهواء في الأغاروز. أغلق حواف نافذة الجمجمة بأسمنت راتنج الأسنان واللاصق (الشكل 1 ج).
- أخرج الماوس من أداة التجسيم وأعده إلى قفصه. ضع الماوس في قفص دافئ ولا تعود إلى القفص مع الحيوانات الأخرى حتى يتعافى تماما من التخدير. حافظ بعناية على الظروف المعقمة أثناء جراحة البقاء على قيد الحياة.
- لأول 72 ساعة بعد الجراحة ، تحقق من الحالة الصحية للماوس من خلال مراقبة السلوك العام. إذا كان هناك أي تشوهات في السلوك العام ، حقن تحت الجلد العوامل المضادة للالتهابات والمسكنات.
3. التحضير لنظام التحفيز المجسم أو الإضاءة (الشكل 3)
- قم بمعايرة نظام التحفيز المجسم عن طريق وضع سطح شريحة مضان حمراء (ركيزة أكريليك مصبوب) في مستوى العينة. ضع المجهر في وضع التصوير المباشر مع ضوء إثارة ضعيف وقم بتشغيل ملف calibration_GUI.m. تحقق من جزء المعلمات وانقر على زر حفظ .
- انقر فوق الزر Z Scan في جزء الخطوة 1. سيولد تلقائيا ثلاث نقاط عشوائية في جميع المستويات المحورية ال 21 ، على بعد 2 ميكرومتر من كل مستوى.
- حرك شريط التمرير وتحقق من الصورة الحية. ابحث عن مستوى مثالي حيث تظهر البقع الأصغر والأكثر سطوعا ، ثم انقر فوق الزر حفظ . سيؤدي هذا تلقائيا إلى إنشاء واجهة موجية كروية إزاحة للهولوغرام الرقمي.
ملاحظة: إذا فشلت في العثور على ألمع البقع الفلورية، فقم بتغيير الحد الأدنى والحد الأقصى لقيم نطاق المسح الضوئي وحاول مرة أخرى. - انقر فوق الزر Go في جزء الخطوة 2 ثم انقر فوق ستة نقاط في المربع الأيمن. تحقق من الصورة الحية. إذا كانت هناك ست نقاط مضان مميزة ، فاكتب المحور x و y الخاص بها في مربعات التحرير وانقر فوق الزر حفظ . سيؤدي هذا تلقائيا إلى إنشاء معاملات تحويل أفين لتنسيق المعايرة بين نظام التحفيز المجسم والتصوير.
ملاحظة: يجب مطابقة رقم زوج المحور ورقم النقطة التي تم النقر عليها بالترتيب. إذا لم تكن متأكدا ، أو إذا لم تكن هناك نقاط في صورتك ، فيرجى المحاولة مرة أخرى وإنشاء نمط بقعة فريد أو اختيار نطاق أصغر حول مركز مجال الرؤية (FOV). - انقر فوق الزر فحص ضوئي في جزء الخطوة 3. سيولد 441 صورة ثلاثية الأبعاد رقمية لإجراء مسح بقعة واحدة عبر مجال الرؤية في 21 × 21 خطوة.
- أولا ، تحقق من الصور أثناء تغيير الأنماط في مربع القائمة. بعد ذلك ، اضبط طاقة الليزر للحصول على صور موضعية ضمن النطاق الديناميكي لجهاز التصوير (على سبيل المثال ، لتجنب الصور المشبعة بشكل مفرط).
- بعد ذلك ، اضبط الفاصل الزمني في مربع التحرير ؛ يجب أن يكون وقت الفاصل الزمني أكثر من ضعف وقت الفاصل الزمني للتسجيل. أخيرا ، ضع جهاز التصوير في وضع التسجيل وانقر فوق الزر "تشغيل ". إذا اكتملت المسرحية ، فستظهر سلاسل "عرض موافق" في نافذة الأوامر. توقف عن التسجيل وقم بتكديس الصور المتسلسلة المسجلة باستخدام طريقة الكثافة القصوى.
- انقر فوق إنشاء WM في جزء الخطوة 4 واختر صورة مكدسة من الأعلى. ثم أغلق نافذة calibration_GUI. سيقوم تلقائيا بإنشاء خريطة وزن للتعويض عن الكثافة غير المتوازنة في كل بقعة.
ملاحظة: للحصول على وصف أكثر تفصيلا ، يرجى الرجوع إلى 2 ؛ يمكن تنزيل كود Matlab من هنا (https://github.com/ZenKG/SLM_control).
4. تصوير Ca2+ باستخدام مستشعر صورة مع إضاءة ثلاثية الأبعاد (الشكل 4)
- ضع الماوس المحقون ب AAV بلوحة رأس تحت المجهر (الشكل 1 د).
ملاحظة: أثناء هذا الإجراء ، يتم تقييد الماوس في حالة اليقظة ، ولكنه قادر على الهروب من المنبهات غير المريحة. - قم بإجراء تصوير ثنائي الفوتون (وضع المسح النقطي) باستخدام مجهر ثلاثي الأبعاد وليزر Ti: sapphire مقفل بالوضع مضبوط على 920 نانومتر بهدف 25x (انظر جدول المواد).
- قم بتشغيل برنامج التصوير التجاري (انظر جدول المواد). في وضع التصوير المباشر ، اضبط جهد كاشف الصورة (انظر جدول المواد) وقوة ليزر التصوير لتحسين سطوع الخلايا العصبية التي تعبر عن jGCaMP8f. التقاط صور للخلايا العصبية التي تعبر عن هذا البروتين.
ملاحظة: شدة ليزر التصوير (920 نانومتر) هي 20-30 ميجاوات. كان مجال الرؤية 512 ميكرومتر × 512 ميكرومتر على عمق 100-150 ميكرومتر من السطح القشري. - لإلقاء الضوء على خلايا عصبية معينة تعبر عن jGCaMP8f بإضاءة ثلاثية الأبعاد ، قم بتشغيل ملف البرنامج النصي SLMcontrol.m. انقر فوق الصورة المرجعية واختر الصورة التي تم الحصول عليها أعلاه. ثم ، انقر فوق الزر "تركيز " لاختيار وحدات بكسل معينة على الخلايا العصبية في الصورة عن طريق النقر المستمر بالماوس (الشكل 4 أ). إذا اكتمل التحديد ، فاضغط على زر Enter على لوحة المفاتيح لإنهائه.
ملاحظة: يتم حساب الهولوغرام الرقمي تلقائيا وعرضه على SLM. يمكن أيضا إعادة النظر في هذا النمط بالنقر فوق مربع قائمة. وكانت الاستبانة المكانية لبقعة واحدة تولدها الإدارة المستدامة للأراضي حوالي 1.2 ميكرومتر على طول الاتجاه العرضي و~ 8.3 ميكرومتر على طول المحور الأصلي. استخدمنا عدسة موضوعية ذات فتحة عددية عالية (1.1) لتحقيق تحفيز ثلاثي الأبعاد أكثر موضعية. ويلخص الجدول 1 التقارير السابقة وهذا النظام فيما يتعلق بالاستبانة المكانية للتحفيز المجسم (هولوغرافي). - لاكتشاف النشاط العصبي بدقة زمنية عالية باستخدام مستشعر الصورة (انظر جدول المواد) ، اضبط وقت التعرض ومنطقة التصوير والتجميع (الشكل 4 ب) قبل إجراء التقاط الصور (الشكل 4C).
ملاحظة: شدة ليزر الإضاءة الثلاثية الأبعاد (920 نانومتر) الذي يحفز خلية عصبية واحدة باستمرار هي 2 ميغاواط ، وهو ما يكفي للكشف عن النشاط العصبي. على سبيل المثال ، لتحقيق معدل إطارات يبلغ 100 هرتز للتصوير ، يكون وقت التعرض 9 مللي ثانية ، ومنطقة التصوير 400 ميكرومتر × 400 ميكرومتر ، والتجميع 4. - بعد التجربة ، أعد الماوس إلى قفصه المنزلي.
5. التصوير ثنائي الفوتون (وضع المسح النقطي) مع علم البصريات الوراثي باستخدام مجهر ثلاثي الأبعاد (الشكل 2)
- كرر الخطوتين 4.1 و4.2.
- قم بتشغيل برنامج التصوير التجاري (انظر جدول المواد). في وضع التصوير المباشر ، اضبط جهد كاشف الصورة (انظر جدول المواد) وقوة ليزر التصوير لتحسين سطوع الخلايا العصبية التي تعبر عن GCaMP6m-P2A-ChRmine. التقط صورا للخلايا العصبية التي تعبر عن هذه البروتينات (الشكل 1E).
- كرر الخطوة 4.4.
- للتحقيق في الاتصال الوظيفي داخل الخلايا العصبية L2 / 3 ، استخدم SLM لتوليد أنماط ثلاثية الأبعاد للتحفيز البصري الوراثي (ChRmine ؛ 1040 نانومتر) ودمجها مع تصوير Ca 2+ ثنائي الفوتون (GCaMP6m ؛ 920 نانومتر ، 512 × 512 بكسل ، 2 هرتز أو 30 هرتز ، تقريب رقمي2x ، وضع مسح النقاط ؛ الشكل 4D-H).
- بالنسبة لهذا البروتوكول ، اضبط شدة ليزر التصوير على 920 نانومتر ، عند 10-20 ميجاوات ، و FOV على أنه 256 ميكرومتر × 256 ميكرومتر تم قياسه على عمق 100-150 ميكرومتر من السطح القشري. اضبط وقت بقاء البكسل على 1.5 ميكروثانية ل 2 هرتز أو 100 نانوثانية ل 30 هرتز.
- لمعرفة ما إذا كان محفز ثلاثي الأبعاد واحد قد تسبب في استجابة الكالسيوم في الخلايا العصبية ، استخدم كلا من 2 هرتز و 30 هرتز كمعدل إطارات التصوير. اضبط شدة ليزر التحفيز المجسم (1040 نانومتر) الذي يحفز خلية عصبية واحدة عند 10 ميجاوات ، وهو ما يكفي لتحفيز النشاط العصبي (الشكل 4 د).
ملاحظة: تبلغ الاستبانة المكانية لبقعة واحدة تولدها الإدارة المستدامة للأراضي حوالي 1.2 ميكرومتر على طول الاتجاه العرضي و ~ 8.3 ميكرومتر على طول المحور الأصلي. يبلغ نطاق الحجم الذي يمكن الوصول إليه في الاتجاه الجانبي حوالي 500 ميكرومتر × 500 ميكرومتر و 100 ميكرومتر في الاتجاه المحوري. لقد أكدنا كذلك مع تصوير Ca2+ بمعدل إطارات تصوير 2 هرتز أو 30 هرتز أنه لا يمكن تحفيز خلية عصبية واحدة فحسب ، بل خلايا عصبية متعددة بشكل ثلاثي الأبعاد في وقت واحد (الشكل 4E).
- قم بإجراء الحصول على الصور باستخدام البروتوكول التالي: قم بتصوير استجابة Ca2+ في وقت واحد عند 920 نانومتر مع 10 محفزات ثلاثية الأبعاد عند 1040 نانومتر بفواصل زمنية 8 ثوان (0.125 هرتز) لمدة 50 مللي ثانية بعد فترة خط الأساس البالغة 10 ثوان. بعد الانتهاء من جميع التجارب ، يتم القتل الرحيم للفئران.
ملاحظة: تم استحضار عابرات Ca2+ ، إن وجدت ، عن طريق التحفيز المجسم ، مع ظهور ذروتها في غضون 1 ثانية بعد التحفيز (الشكل 4F-H).
6. تحليل الصور وتقييم الاتصال الوظيفي (الشكل 4)
- افتح الصور الأولية المحفوظة في الخطوتين 4.5 أو 5.5 باستخدام ImageJ. للتعويض عن إزاحة المستوى البؤري، استخدم TurboReg المكون الإضافي ImageJ.
ملاحظة: إذا لم يكن التصحيح باستخدام TurboReg كافيا ، فمن المستحسن استخدام CaImAn (http://github.com / simonsfoundation) لتصحيح إزاحة المستوى البؤري. - لتقييم النشاط العصبي ، حدد مناطق الاهتمام (ROIs) في L2 / 3 باستخدام خوارزمية آلية (CaImAn). كشف وتحليل العابرين Ca2+ بعد تحديد شدة مضان خط الأساس (F0) وقيمة العتبة.
ملاحظة: F0 هيالقيمة المئوية 35 لشدة التألق المكتسبة خلال فترة التصوير الأساسية. يشار إلى العابرين Ca2+ بواسطة Δ F / F 0 (Δ F = F-F0) ، حيثF هي إشارة مضان لحظية. إذا كانت قيمة Δ F تزيد عن 2 S.D. من F0 ، فإننا نقيم عابرة Ca2+ مهمة. - لتحديد الاتصال الوظيفي في الخلايا العصبية L2 / 3 ، تحفيز الخلايا العصبية المستهدفة وقياس استجابات GCaMP6m في الخلايا العصبية المحفزة والمحيطة ، وفقا لذلك (الشكل 4F-H).
النتائج
يتم عرض التسجيلات التمثيلية التي تم الحصول عليها باستخدام الطريقة الموضحة هنا. في الجسم الحي يتطلب تصوير Ca2+ باستخدام الفحص المجهري المجسم 2-4 أسابيع لإكماله من زرع لوحة الرأس وحقن AAV إلى الحصول على البيانات. لذلك ، للحصول على نتائج مستقرة ، من المهم تقليل القطع الأثرية الحركية في الدماغ. يعد زرع لوحة الرأس (الخطوة 1.5) ووضع نافذة الجمجمة (الخطوة 2.9) خطوات مهمة جدا في هذه العملية. علاوة على ذلك ، من المهم أيضا اختيار AAV (AAV2 / 8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1) الذي يعبر في وقت واحد عن مؤشر الكالسيوم والأوبسين في خلية عصبية واحدة (الخطوة 2.8).
يوضح الشكل 4 أ بقعة للإضاءة الثلاثية الأبعاد لصورة خلية عصبية مكتسبة باستخدام برنامج MATLAB نصي مخصص. إذا نجحت الإضاءة الثلاثية الأبعاد في إضاءة الخلايا العصبية التي تعبر عن jGCaMP8f ، فيمكن الحصول على آثار Ca2+ باستخدام مستشعر الصورة (الشكل 4B) ، كما هو موضح في الشكل 4C.
تم تقييم الاتصال الوظيفي بين الخلايا العصبية باستخدام التحفيز المجسم (الشكل 4D) ، كما هو موضح في الشكل 4E. نظرا لأن الاتصال الوظيفي بين الخلايا العصبية هو أحد خصائص الدوائر العصبية التي يتم تغييرها في التسبب في فأر نموذج الألم24 ، فإننا نصف إجراء بسيطا لتقييمه. يوضح الشكل 4F صورة نموذجية للخلايا العصبية L2 / 3 في S1HL مرئية باستخدام GCaMP6m. عندما تم تحفيز خلية عصبية واحدة (دائرة برتقالية) ثلاثية الأبعاد ، كانت خلية عصبية أخرى (دائرة حمراء) نشطة في وقت واحد. وبالتالي ، كان عدد الروابط الوظيفية بين الخلايا العصبية واحدا (الشكل 4G).
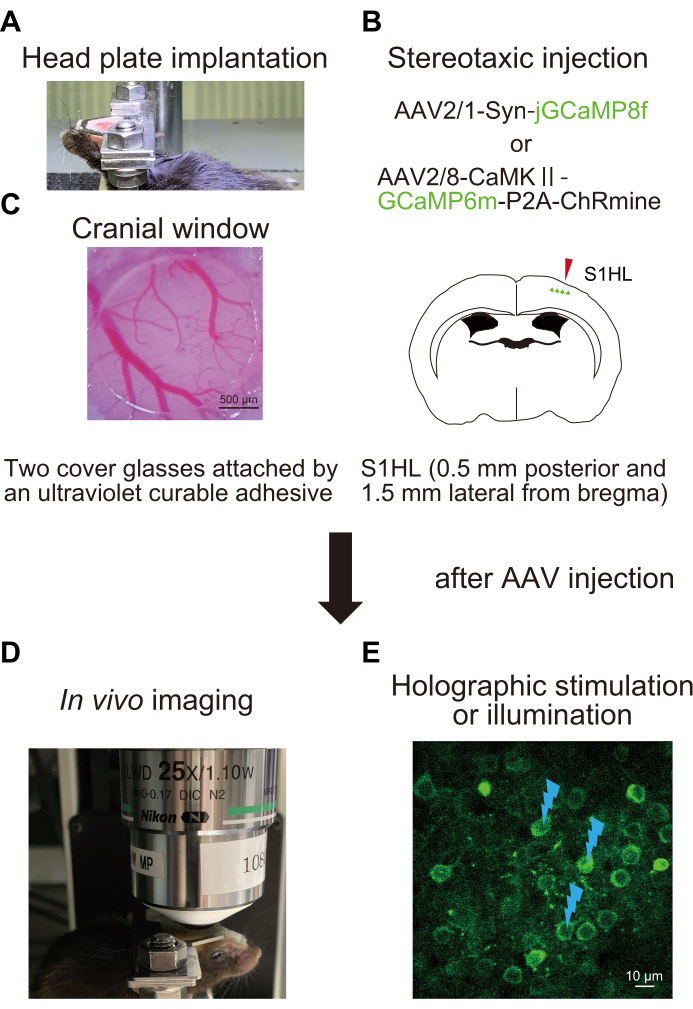
الشكل 1: مخطط تخطيطي للإجراء التجريبي. أ: تثبيت صفيحة الرأس على الجمجمة. (ب) الحقن التجسيمي ل AAV في منطقة المخلب الخلفي للقشرة الحسية الجسدية الأولية (S1HL). ج: غرس نافذة الجمجمة. لتقييم النشاط العصبي ومعالجته ، يتم إجراء التصوير في الجسم الحي Ca2+ في الفئران المستيقظة (D) مع التحفيز المجسم (E). تشير علامات الوميض إلى التحفيز المجسم أو الإضاءة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
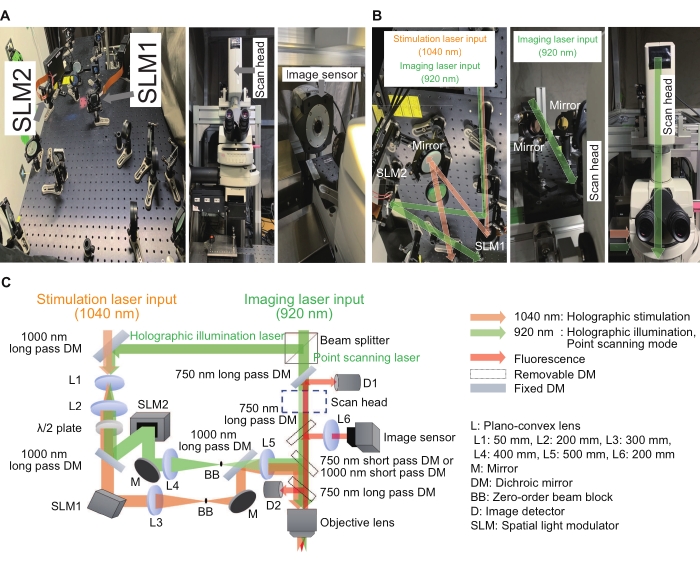
الشكل 2: النظام المستخدم للمجهر الهولوغرافي. (أ) صور لمسارات ضوء التحفيز والإضاءة الثلاثية الأبعاد (يسار) بالقرب من المجهر (في المنتصف) مع مستشعر الصورة (يمين). (ب) هذه صور مكبرة لمسارات ضوئية للتحفيز المجسم والإضاءة حول SLMs المعنية (يسار ويمين) ومسار ضوء مسح نقطي حول رأس مسح (وسط ويمين). ج: رسم تخطيطي لمسارات التحفيز والتصوير البصري. تستخدم SLMs ذات الطور فقط لعرض الصور المجسمة الرقمية ، ويتم وضع موسع شعاع (مزيج من L1 و L2) ونظام ترحيل 4f (مزيج من L3 و L4 للتحفيز المجسم و L4 و L5 للإضاءة الثلاثية الأبعاد) قبل وبعد SLMs المعنية للتأكد من تصوير كل صورة ثلاثية الأبعاد رقمية عند بؤبؤ الخروج لعدسة هدف الغمر في الماء ، مع حجم صورة أقل قليلا من المملوء. لقمع المكونات المتبقية ذات الترتيب الصفري ، يتم وضع كتلة شعاع في المستوى الوسيط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
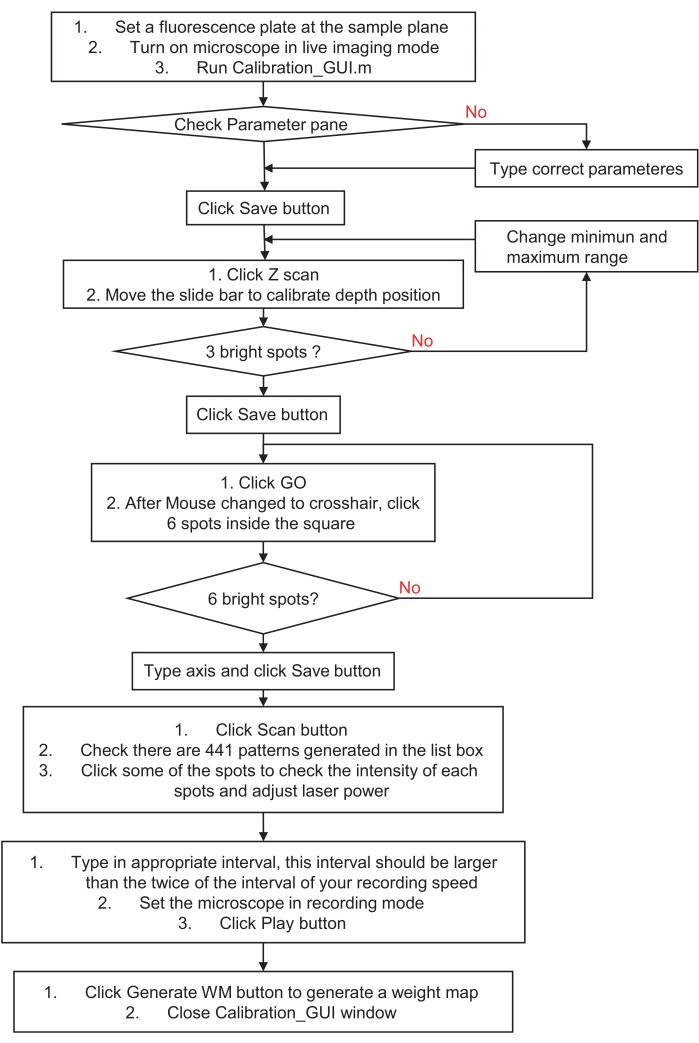
الشكل 3: مخطط انسيابي لكيفية معايرة نظام التحفيز المجسم أو الإضاءة. يصف هذا المخطط الانسيابي خطوات معايرة نظام التحفيز المجسم أو الإضاءة لمساحة العينة ونظام التصوير. يرجى زيارة الخطوة 3 ، التحضير لنظام التحفيز المجسم أو الإضاءة ، للحصول على إرشادات مفصلة وتنزيل نموذج برنامج. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
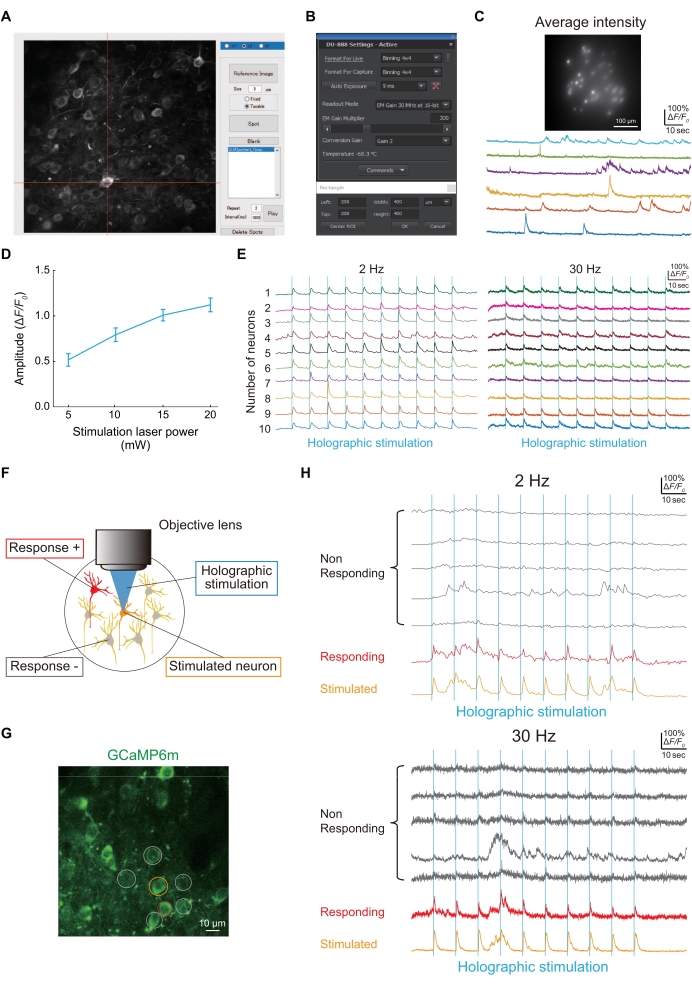
الشكل 4: النتائج التمثيلية للتصوير والاتصال الوظيفي باستخدام مجهر التصوير الثلاثي الأبعاد . (أ) لإلقاء الضوء على خلايا عصبية معينة تعبر عن jGCaMP8f أو GCaMP6m-P2A-ChRmine ، يتم التقاط صورة الخلايا العصبية ، ثم يتم تشكيل بقعة على الخلية العصبية باستخدام نص MATLAB مخصص له. ( ب) إعداد مستشعر الصورة (وقت التعرض ومنطقة التصوير و binning). (ج) صورة تمثيلية وآثار الخلايا العصبية التي تعبر عن jGCaMP8f في تصوير 100 هرتز مع إضاءة ثلاثية الأبعاد ومستشعر صورة. (د) يوضح هذا الرسم البياني الاستجابة العصبية للتحفيز المجسم (1040 نانومتر) عند كل قوة ليزر (بيانات من GCaMP6m-P2A-ChRmine تعبر عن الخلايا العصبية بمعدل إطار تصوير 2 هرتز [n = 16]). تشير أشرطة الخطأ إلى الخطأ القياسي للمتوسط. (E) آثار Ca2+ التمثيلية أثناء التحفيز المجسم (الخطوط الرأسية الزرقاء) ل 10 خلايا عصبية مختلفة عند معدلات إطارات تصوير 2 هرتز (يسار) و 30 هرتز (يمين). في آثار 2 هرتز و 30 هرتز Ca2+ ، يشير نفس اللون إلى نفس الخلايا العصبية. (و) رسم تخطيطي يقيم الروابط الوظيفية بين الخلايا العصبية. عندما يتم تحفيز الخلية العصبية البرتقالية ، تستجيب الخلايا العصبية الحمراء في نفس الوقت ، مما يشير إلى وجود اتصال وظيفي بين هذه الخلايا العصبية. (G) صورة نموذجية للخلايا العصبية S1HL التي تعبر عن GCaMP6m بالوزن. شريط المقياس = 10 ميكرومتر. (H) آثار Ca2+ النموذجية أثناء التحفيز المجسم (الخطوط الرأسية الزرقاء) عند معدلات إطارات تصوير 2 هرتز (علوية) و 30 هرتز (أقل). الخلية العصبية المستحثة محاطة بدائرة باللون البرتقالي، والخلايا العصبية المستجيبة محاطة بدائرة باللون الأحمر، والخلايا العصبية غير المستجيبة محاطة بدائرة باللون الرمادي. يمكن الكشف عن الاستجابة العصبية للتحفيز المجسم بسرعات تصوير 2 هرتز و 30 هرتز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مجموعتنا 6 | براكاش ، ر. وآخرون 25 | مارشيل ، جي إتش وآخرون 12 | روبنسون ، إن تي إم وآخرون 14 | |
| القرار الجانبي | 1.2 ميكرومتر | 1.27 ميكرومتر | ― | 2.22 ميكرومتر |
| القرار المحوري | 8.3 ميكرومتر | 56.86 ميكرومتر | 15.5 ميكرومتر | 10.26 ميكرومتر |
| عدسة موضوعية/فتحة عدسة رقمية | 25x/1.1 | 20x/0.5 | 16x/0.8 | 16x/0.8 |
الجدول 1: ملخص التقارير السابقة وهذا النظام للاستبانة المكانية للتحفيز المجسم يتم وصف الدقة الجانبية والدقة المحورية والعدسة الموضوعية المستخدمة أثناء القياس.
Discussion
لفهم وظائف المخ ، من الضروري إجراء تقييم دقيق للدوائر العصبية الكامنة وراء وظيفة الدماغ عن طريق استخراج ديناميكيات النشاط العصبي. علاوة على ذلك ، من الضروري تحديد كيفية تغيير هذه الدوائر العصبية لتوضيح التسبب في الاضطرابات العصبية والنفسية. في الواقع ، من المعروف أن النشاط العصبي مرتفع في نماذج الفئران لمرض الزهايمر4 ومتلازمة X الهشة26 والفئران التي تعاني من ضعف وظيفة المادة البيضاء3. علاوة على ذلك ، في نموذج الماوس من الألم الالتهابي ، ترتبط زيادة تزامن النشاط العصبي والاتصال الوظيفي بين الخلايا العصبية بالأعراض24. يسمح لنا الفحص المجهري المجسم ثنائي الفوتون بمراقبة نشاط الخلايا العصبية الفردية والروابط الوظيفية بين الخلايا العصبية في وقت واحد ، وهو أمر ضروري لفهم الدوائر العصبية. استخدمنا عدسة موضوعية 25x بفتحة عددية = 1.1 بأطوال موجية تبلغ 1040 نانومتر. دالة انتشار النقطة النظرية هي توزيع غاوسي بعرض كامل بنصف أقصى 0.5 ميكرومتر أفقيا و 1.7 ميكرومتر محوريا. ومع ذلك ، فإن الفتحة العددية الفعلية أقل من 1.1 ، وحجم البقعة المقاسة على حبة مضان هو 1.2 ميكرومتر أفقيا ، و 8.3 ميكرومتر محوريا. بالنظر إلى أن قطر الخلية العصبية يبلغ حوالي 15 ميكرومتر وأن خطأ المعايرة في حدود 3 ميكرومتر ، فإن الاستهداف جيد بشكل عام. ومع ذلك ، قد تتأثر الخلايا في الاتجاه المحوري بحجم البقعة الأطول6. هنا ، وصفنا الحقن الفيروسي ، والجراحة ، ومعايرة أنظمة التحفيز المجسم أو الإضاءة ، وبروتوكولات التصوير لتقييم ومعالجة النشاط العصبي في الفئران الحية باستخدام نظام الفحص المجهري الخاص بنا.
يستغرق الأمر من 2 إلى 4 أسابيع لإكمال جميع الإجراءات التجريبية ، من زرع لوحة الرأس وحقن الفيروسات إلى الحصول على البيانات للتصوير في الجسم الحي Ca2+ باستخدام الفحص المجهري المجسم. العملية معقدة وشاقة ، ويعتمد النجاح النهائي للتجربة على عوامل متعددة ، بما في ذلك حالة نافذة الجمجمة ، التي تتأثر بالتهاب ما بعد الجراحة ، والاختيار الصحيح لمؤشر Ca2+ و opsin ، وما إذا كان يمكن تصحيح القطع الأثرية المتحركة في الصور المكتسبة. على وجه الخصوص ، هناك خطوتان مهمتان لتحقيق نتيجة ناجحة. الأول يتعلق بتثبيت لوحة الرأس والجراحة. من الأهمية بمكان أن يتم تثبيت لوحة الرأس بإحكام على رأس الماوس باستخدام الأسمنت السني. علاوة على ذلك ، من المهم تنظيف شظايا العظام والدم المتخثر بشكل متكرر باستخدام ACSF البارد أثناء الجراحة. نظرا لأن الالتزام بهذا الإجراء يقلل الالتهاب ، فقد لاحظنا بنجاح ديناميكيات الخلايا الدبقية الصغيرة ، وهي الخلايا المسؤولة عن الجهاز المناعي للدماغ ، دون تنشيط عملياتها وأشواكها أو البنى المجهرية للخلايا العصبية27,28. القضية الثانية هي تقييم ومعالجة النشاط العصبي. اخترنا AAV2 / 8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1 للتعبير عن مؤشر Ca2+ و opsin في خلية عصبية واحدة في وقت واحد. هذا لأنه من الصعب إصابة خلية عصبية واحدة بكفاءة بأنواع مختلفة من AAV. سبب آخر لهذا الاختيار هو أن ChRmine يمكنه تنشيط النشاط العصبي بكفاءة عند 1040 نانومتر باستخدام ليزر ثنائي الفوتون12. في الآونة الأخيرة ، تم الإبلاغ عن أن ChRmine ، من خلال تحور هيكله بناء على المعلومات الهيكلية التي تم الحصول عليها عن طريق المجهر الإلكتروني البارد ، يحسن وظيفته29 ، والتي تعتبر مفيدة لتحليل وظيفة الهدف في مجال علم الأعصاب. في ضوء هذه المشكلات ، من الضروري مشاركة طرق فعالة لتقييم الخلايا العصبية ومعالجتها عند قراءة النشاط العصبي وكتابة المعلومات باستخدام الفحص المجهري المجسم.
كشفت التطورات الحديثة في التصوير وعلم البصريات الوراثي عن النشاط العصبي التفصيلي الذي تنطوي عليه وظائف الدماغ مثل التعلم والذاكرة ، ومن الممكن التلاعب بشكل مصطنع بهذا النشاط العصبي للتعبير عن وظائف الدماغ30. ومع ذلك ، فإن الطرق التقليدية للتلاعب بالنشاط العصبي شديدة التوغل بسبب إدخال الألياف الضوئية في الدماغ ولأن مجموعة من الخلايا المعبرة عن الأوبسين يتم تحفيزها في وقت واحد ، مما يجعل من المستحيل التلاعب بالنشاط العصبي بدقة زمنية ومكانية. يمكن لطريقتنا التلاعب بالنشاط العصبي عن طريق تحفيز خلايا عصبية محددة فقط في الدماغ ، وبالتالي تمكين التلاعب بالنشاط العصبي بأنماط تحفيز محددة ودقة زمانية مكانية عالية. علاوة على ذلك ، من المهم ملاحظة أنه لا يمكن تقييم الاتصال الوظيفي بين الخلايا العصبية إلا في عدد صغير من الخلايا العصبية باستخدام تجارب شريحة الدماغ31 ؛ ومع ذلك ، تسمح هذه التقنية بالتقييم المتزامن للخلايا العصبية المتعددة في الحيوانات الحية.
أحد القيود الرئيسية للمجاهر الثلاثية الأبعاد الحالية هو الحاجة إلى إصلاح رأس الماوس ، مما يحد من سلوك الماوس. في الآونة الأخيرة ، تم تطوير مجهر مصغر ثنائي الفوتون32 ، ومع مزيد من التصغير للجهاز ، قد يكون التصوير في الجسم الحي Ca2+ مع التحفيز المجسم ممكنا في الفئران التي تتحرك بحرية. بالإضافة إلى ذلك ، يمكن توسيع إمكانات هذا المجهر من خلال تحسين الدقة الزمنية للتصوير ودمجها مع البروتينات الفلورية الحساسة للجهد33.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم دعم هذا العمل من خلال المنح في المعونة للبحث العلمي في المجالات المبتكرة (19H04753 ، 19H05219 ، و 25110732 إلى H. W.) ، المنح في المعونة لمجالات البحث التحويلي (A) (20H05899 إلى H. W. ، 20H05886 إلى OM ، و 21H05587 إلى D. K.) ، تعزيز البحث الدولي المشترك (B) (20KK0170 إلى H. W.) ، منحة في المعونة للبحث العلمي (B) (18H02598 إلى H. W.) ، منحة في المعونة للبحث العلمي (A) (21H04663 إلى O. M.) ، منحة في المعونة للعلماء في بداية حياتهم المهنية (20K15193 إلى X. Q.) ، رقم منحة JST CREST JPMJCR1755 ، اليابان ، ورقم منحة JST A-STEP JPMJTR204C.
Materials
| Name | Company | Catalog Number | Comments |
| 25x Objective | Nikon | N25X-APO-MP | Objective |
| A1MP | Nikon | A1MP | Microscope |
| AnesII | Bio machinery | AnesII | Anesthesia delivery system |
| C2 plus | Nikon | C2 plus | Microscope |
| DECADRON Phosphate Injection | Aspen | 21N024 | Avoid cerebral edema |
| Dental Drill | Jota | C1.HP.005 | Dental drill |
| Electric Microinjector | NARISHIGE | IM-31 | Pressure injection system |
| FEATHERS | FEARGER | FA-10 | Shaving |
| G-CEM ONE ADHESIVE ENHANCING PRIMER | GC | 2110271 | Resin cement primer for dental adhesion |
| G-CEM ONE neo | GC | 43093 | Resin cement for dental adhesion |
| Glass Capillary with Filament | NARISHIGE | GDC-1 | Glass capillary |
| Image Detector | Hamamatsu | H10770PA-40 | GaAsP photocathode photomultiplier tube |
| Imaging Software | Nikon | NISelements | Imaging software |
| Isoflurane Inhalation Solution | Pfizer | 229KAR | Anesthetics |
| iXon EMCCD Camera | Andor | iXon Life 888 | Image sensor |
| Ketamine | daiitisannkyou | s9-018506 | Anesthetics |
| Leica-M60 | Leica | M60 | Stereoscope |
| Linicon | Linicon | LV-125 | Vacuum pump |
| Mode-locked Ti:sapphire Chameleon Ultra II laser | Coherent | Chameleon Discovery NX | Femtosecond laser |
| Mos-Cure | U-VIX | mini 365 | Portable LED UV Light Source |
| PEN Bright | SHOFU INC. | PEN Bright | Dental light curing unit |
| Puller | SUTTER instaument | P-97 | Puller |
| Stereotaxic Instrument (for Mice) | NARISHIGE | SR-6M-H | Stereotaxic instrument |
| Stereotaxic Micromanipulator | NARISHIGE | SM-15R | Stereotaxic micromanipulator |
| Super-Bond CATALYST V | SUN MEDICAL | 8070 | Dental adhesive resin cement |
| Super-Bond Dental Adhesive Monomer | SUN MEDICAL | 8071 | Dental adhesive monomer |
| Super-Bond Teeth Color Polymer Powder | SUN MEDICAL | 145052000 | Teeth color polymer powder |
| Tarivid Ophthalmic Ointment 0.3% | Santen Pharmaceutical | TRN3952 | Eye ointment |
| UlTIMATE XL | NSK | Y141446 | Dental laboratory micromotor control unit |
| UV Curing Optical Adhesives | THORLABS | NOA61 | UV Curing Optical Adhesives |
| Xylazine | Bayer | KP0F2BK | Anesthetics |
References
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nature Neuroscience. 17 (7), 987-994 (2014).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Kato, D., et al. Motor learning requires myelination to reduce asynchrony and spontaneity in neural activity. Glia. 68 (1), 193-210 (2020).
- Busche, M. A., et al. Tau impairs neural circuits, dominating amyloid-β effects, in Alzheimer models in vivo. Nature Neuroscience. 22 (1), 57-64 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Quan, X., Kato, D., Daria, V., Matoba, O., Wake, H. Holographic microscope and its biological application. Neuroscience Research. 179, 57-64 (2022).
- Adesnik, H., Abdeladim, L. Probing neural codes with two-photon holographic optogenetics. Nature Neuroscience. 24 (10), 1356-1366 (2021).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Svoboda, K., Denk, W., Kleinfeld, D., Tank, D. W. In vivo dendritic calcium dynamics in neocortical pyramidal neurons. Nature. 385 (6612), 161-165 (1997).
- Carrillo-Reid, L., Han, S., Yang, W., Akrouh, A., Yuste, R. Controlling visually guided behavior by holographic recalling of cortical ensembles. Cell. 178 (2), 447-457 (2019).
- Marshel, J. H., et al. Cortical layer-specific critical dynamics triggering perception. Science. 365 (6453), (2019).
- Gill, J. V., et al. Precise holographic manipulation of olfactory circuits reveals coding features determining perceptual detection. Neuron. 108 (2), 382-393 (2020).
- Robinson, N. T. M., et al. Targeted activation of hippocampal place cells drives memory-guided spatial behavior. Cell. 183 (6), 1586-1599 (2020).
- Packer, A. M., Russell, L. E., Dalgleish, H. W., Häusser, M. Simultaneous all-optical manipulation and recording of neural circuit activity with cellular resolution in vivo. Nature Methods. 12 (2), 140-146 (2015).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nature Neuroscience. 21 (6), 881-893 (2018).
- Yang, W., Carrillo-Reid, L., Bando, Y., Peterka, D. S., Yuste, R. Simultaneous two-photon imaging and two-photon optogenetics of cortical circuits in three dimensions. Elife. 7, 32671 (2018).
- Forli, A., et al. Two-photon bidirectional control and imaging of neuronal excitability with high spatial resolution in vivo. Cell Reports. 22 (11), 3087-3098 (2018).
- Pégard, N. C., et al. Three-dimensional scanless holographic optogenetics with temporal focusing (3D-SHOT). Nature Communications. 8 (1), 1228 (2017).
- Dal Maschio, M., Donovan, J. C., Helmbrecht, T. O., Baier, H. Linking neurons to network function and behavior by two-photon holographic optogenetics and volumetric imaging. Neuron. 94 (4), 774-789 (2017).
- Russell, L. E., et al. All-optical interrogation of neural circuits in behaving mice. Nature Protocols. 17 (7), 1579-1620 (2022).
- Oron, D., Papagiakoumou, E., Anselmi, F., Emiliani, V. Two-photon optogenetics. Progress in Brain Research. 196, 119-143 (2012).
- Hernandez, O., et al. Three-dimensional spatiotemporal focusing of holographic patterns. Nature Communications. 7, 11928 (2016).
- Okada, T., et al. Pain induces stable, active microcircuits in the somatosensory cortex that provide a therapeutic target. Science Advances. 7 (12), 8261 (2021).
- Prakash, R., et al. Two-photon optogenetic toolbox for fast inhibition, excitation and bistable modulation. Nature Methods. 9 (12), 1171-1179 (2012).
- Gonçalves, J. T., Anstey, J. E., Golshani, P., Portera-Cailliau, C. Circuit level defects in the developing neocortex of Fragile X mice. Nature Neuroscience. 16 (7), 903-909 (2013).
- Akiyoshi, R., et al. Microglia enhance synapse activity to promote local network synchronization. eNeuro. 5 (5), (2018).
- Haruwaka, K., et al. Dual microglia effects on blood brain barrier permeability induced by systemic inflammation. Nature Communications. 10 (1), 5816 (2019).
- Kishi, K. E., et al. Structural basis for channel conduction in the pump-like channelrhodopsin ChRmine. Cell. 185 (4), 672-689 (2022).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Ko, H., et al. The emergence of functional microcircuits in visual cortex. Nature. 496 (7443), 96-100 (2013).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Villette, V., et al. ultrafast two-photon imaging of a high-gain voltage indicator in awake behaving mice. Cell. 179 (7), 1590-1608 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved