Method Article
استخدام التصوير في الجسم الحي للكشف عن الأنماط الظاهرية للتشكل في سلالات المبيضات البيض الطافرة أثناء العدوى النشطة في مضيف الثدييات
In This Article
Summary
تصف هذه المخطوطة طريقة لفحص مكتبات المبيضات المبيضات المتحولة متوسطة الحجم بحثا عن الأنماط الظاهرية للتشكل أثناء العدوى النشطة في مضيف الثدييات باستخدام الفحص المجهري متحد البؤر غير الغازي.
Abstract
المبيضات البيض هو أحد مسببات الأمراض البشرية الهامة. قدرتها على التبديل بين الأشكال المورفولوجية أمر أساسي لمرضها. يتم تنظيم هذه التغييرات المورفولوجية من خلال شبكة إشارات معقدة يتم التحكم فيها استجابة للمحفزات البيئية. تمت دراسة هذه المكونات التنظيمية بشكل كبير ، ولكن جميع الدراسات تقريبا تستخدم مجموعة متنوعة من المحفزات في المختبر لتحفيز الخيوط. لتحديد كيفية تنظيم التشكل أثناء عملية التسبب في المرض ، قمنا بتطوير نظام الفحص المجهري في الجسم الحي للحصول على صور عالية الدقة المكانية للكائنات الحية التي تخضع لتكوين hyphal داخل مضيف الثدييات. يصف البروتوكول المقدم هنا استخدام هذا النظام لفحص مجموعات صغيرة من سلالات C. albicans الطافرة ، مما يسمح لنا بتحديد المنظمين الرئيسيين للتشكل عند حدوثه في موقع الإصابة. يتم تقديم نتائج تمثيلية ، مما يدل على أن بعض منظمات التشكل ، مثل منظم النسخ Efg1 ، لها أنماط ظاهرية متسقة في المختبر وفي الجسم الحي ، في حين أن المنظمين الآخرين ، مثل adenyl cyclase (Cyr1) ، لديهم أنماط ظاهرية مختلفة بشكل كبير في الجسم الحي مقارنة بالمختبر.
Introduction
المبيضات البيض هو أحد مسببات الأمراض الفطرية البشرية الشائعة ، مما يسبب أمراض الجلد المخاطي ، والأمراض المنتشرة ، والتهابات الأنسجة الموضعية1. السمة الرئيسية لفسيولوجيا C. albicans هي نموها المعقد متعدد الأشكال ، والذي يرتبط بدوره كعامل ممرضوممرض 2،3،4. في ظل ظروف المغذيات الغنية في المختبر عند 30 درجة مئوية ، تنمو عادة كخميرة بيضاوية الشكل. تؤدي مجموعة متنوعة من المحفزات البيئية ، بما في ذلك الحرمان من المغذيات ، وتغيرات الأس الهيدروجيني ، والنمو عند 37 درجة مئوية ، والتعرض للمصل ، والنمو عند تضمينه في أجار ، إلى الانتقال إلى نمط نمو مستقطب ، مما يؤدي إلى تكوين خيوط حقيقية و / أو خيوط كاذبة5. يشار إلى بدء النمو المستقطب والنمو الناتج للكائنات الخيطية باسم التشكل.
نظرا لأهمية التشكل في ضراوة الكائن الحي ، فقد تمت دراسة تنظيم تكوين hyphal على نطاق واسع 6,7. هناك شبكة معقدة من مسارات الإشارات وتنظيم النسخ الذي يؤدي إلى التشكل. على الرغم من علاقة تشكل C. albicans مع التسبب في المرض ، فقد استخدمت معظم الدراسات التي تبحث في التشكل المحفزات في المختبر لتحفيز تكوين hyphal. أصبح من الواضح بشكل متزايد أن النماذج المختلفة في المختبر للخيوط ليست متطابقة من حيث المسارات التنظيمية الفردية المحفزة. علاوة على ذلك ، لا تتوافق ظروف النمو في المختبر بإحكام مع البيئة المعقدة للمضيف. نظرا لأهمية C. albicans كممرض بشري ، فإن الهدف من هذا البروتوكول هو التحقيق في مورفها أثناء العدوى النشطة في مضيف الثدييات باستخدام نظام ذو إنتاجية معتدلة ، مما يسمح للمحقق بفحص مكتبات C. albicans الطافرة.
لتسهيل هذه التحقيقات ، تم تطوير نظام تصوير في الجسم الحي يسمح لنا بالحصول على صور عالية الدقة المكانية لخلايا C. albicans أثناء إصابة صيوان فأر مخدر باستخدام مجهر متحد البؤرمقلوب 8،9،10. نظرا لأن جلد الصيوان رقيق جدا ، يمكن الحصول على هذه الصور دون الحاجة إلى تشريح الأنسجة. وبالتالي ، يمكن قياس بيانات النمط الظاهري الكمي في موقع العدوى النشطة داخل الأنسجة المضيفة. يتضمن البروتوكول الموصوف هنا تحويل سلالة مرجعية وسلالة متحولة واحدة أو أكثر مع أشرطة تعبير بروتين فلوري مختلفة11,12. ثم يتم خلط السلالات المعبرة عن البروتين الفلوري وحقنها بشكل مشترك داخل الأدمة. بعد إنشاء العدوى ، يتم استخدام التصوير متحد البؤر لتحديد كل من تواتر الخيوط وطول الخيوط المشكلة. يتم تطبيع البيانات التي تم الحصول عليها من السلالات الطافرة إلى تلك التي تم الحصول عليها من السلالة المرجعية ، الموجودة في نفس منطقة الأنسجة ، وبالتالي توفير التحكم الداخلي. سمح لنا هذا النظام بفحص عدة سلاسل من سلالات C. albicans الطافرة بنجاح ، والعديد منها به عيوب في التشكل في المختبر 9,10. العديد من هذه السلالات خيوط بسهولة في الجسم الحي ، مما يسلط الضوء على أهمية النماذج في الجسم الحي للتحقيق في التشكل.
Protocol
تمت الموافقة على الدراسات في هذا البروتوكول من قبل لجنة رعاية واستخدام الحيوان المؤسسية بجامعة أيوا (IACUC). راجع إرشادات CDC للمعدات والإجراءات الخاصة بالعمل مع كائنات BSL213.
1. إعداد سلالات المبيضات البيض
- تحديد سلالة مرجعية مناسبة لاستخدامها كعنصر تحكم إيجابي. تأكد من أن هذه السلالة تتطابق بشكل وثيق مع السلالات التجريبية من حيث نسبها والتلاعب الجيني.
ملاحظة: بالنسبة للتجارب التمثيلية المقدمة هنا ، تم إنشاء الطفرات من السلالات الموصوفة في Homann، et al.14 ، والتي تم إنشاؤها من SN152. هذه المسوخ هي Arg-. لذلك ، كانت السلالة المرجعية المختارة هي SN250 ، والتي تم إنشاؤها أيضا من SN152 وهي أيضا Arg-. الضغوطات الغذائية حاسمة في تنظيم النمو المستقطب في الخميرة Saccharomyces cerevisiae15 ؛ كما تورطوا في خيوط في C. albicans والفطريات الأخرى16،17،18. لذلك ، يجب مطابقة السلالة المرجعية مع التغذية الخارجية مع السلالات التجريبية كلما أمكن ذلك لتجنب الآثار المربكة المحتملة من الإجهاد الغذائي. - اختر تركيبات تعبير البروتين الفلوري. عند فحص مجموعة متنوعة من السلالات التجريبية ، قم بإنشاء سلالة مرجعية تعبر عن بروتين فلوري واحد واستخدم بروتينات فلورية أخرى لتمييز السلالات الطافرة.
ملاحظة: تستخدم البيانات التمثيلية المقدمة هنا النيون للسلالة المرجعية و iRFP للسلالات الطافرة. يمكن استخدام أي بروتين فلوري إذا كان معبرا عنه بشكل كبير ، ومشرق نسبيا ، وقادر على الإثارة / الكشف عنه بواسطة المجهر المستخدم. لم تظهر تجارب التحكم التي تقارن السلالات المرجعية التي تعبر عن بروتينات فلورية مختلفة أي تأثير لتعبير البروتين الفلوري على التشكل. - تحويل السلالات مع تركيبات التعبير البروتين الفلوريسنت.
ملاحظة: تتطلب العديد من المؤسسات استخدام احتياطات السلامة البيولوجية من المستوى 2 للعمل مع C. albicans. يجب أن تتبع جميع الأعمال لوائح السلامة المحلية. بغض النظر عن اللوائح المحلية ، يجب تدريب المحققين الذين يعملون مع C. albicans على التعامل الآمن مع الكائن الحي.- تحويل السلالات المرجعية والتجريبية باستخدام بروتوكولات أسيتات الليثيوم القياسية19.
ملاحظة: تستخدم التجارب الموصوفة هنا بلازميدات pENO1-NEON-NAT R و pENO1-iRFP-NATR ، التي قدمها بسخاء الدكتور روبرت ويلر11,12. تم تشكيل البلازميدات باستخدام NotI9. - حدد المحولات بناء على النمو على نورسيوثريسين أو أي وسيط اختيار آخر ذي صلة.
- تحديد المحولات الناجحة. اختر القليل من الخلايا من كل مستعمرة باستخدام عود أسنان ثم امزجها في قطرة 2.5 ميكرولتر من الماء على شريحة مجهرية. ضع غطاء وافحصه بتكبير 10x-40x. افحص باستخدام نظام تصوير متحد البؤر (يستخدم لبقية البروتوكول) أو أي مجهر مضان قياسي واسع المجال. سيكون للمحولات المناسبة إشارة ساطعة ذات أطوال موجية مناسبة للإثارة والانبعاث.
ملاحظة: بالنسبة للنتائج التمثيلية ، تم تصور سلالات التعبير عن النيون باستخدام مجهر مضان عمودي مع مرشح تمرير طويل مع مرشح تمرير طويل مع مرشح إثارة تمرير النطاق 472/30 نانومتر ، ومرشح انبعاث تمرير النطاق 520/35 نانومتر ، ومقسم شعاع ثنائي اللون أحادي الحافة 495 نانومتر. نظرا لأن iRFP غير مرئي بالعين ، فقد تم تصور سلالات التعبير عن iRFP باستخدام نظام الفحص المجهري متحد البؤر المستخدم في التصوير في الجسم الحي ، باستخدام ليزر 638 نانومتر للإثارة والكشف عن ضوء الانبعاث من 655-755 نانومتر.- بدلا من ذلك ، قم بتقييم مضان المستعمرة العيانية باستخدام المجهر المجسم الفلوري ، أو أنظمة الإثارة الفلورية المحمولة باليد ، أو أنظمة الكشف عن التألق المستخدمة عادة في المواد الهلامية والبقع الغربية.
- إنشاء مخزون الفريزر من المحولات المختارة.
- تحويل السلالات المرجعية والتجريبية باستخدام بروتوكولات أسيتات الليثيوم القياسية19.
- تلقيح YPD (مستخلص الخميرة بيبتون سكر العنب) وسائط صلبة بمرجع معبرة عن البروتين الفلوري وسلالات تجريبية من مخزون المجمد قبل 3 أيام من الحقن ، باستخدام عود أسنان لنقل مجموعة من الكائنات الحية من مخزون الفريزر إلى الوسائط الصلبة YPD. احتضان في 30 درجة مئوية لمدة 2 أيام.
- لكل سلالة ، تلقيح قارورة تحتوي على 25 مل من YPD مع خلايا C. albicans المأخوذة من عدة مستعمرات 1 يوم قبل الحقن. افعل ذلك باستخدام عود أسنان لنقل مجموعة من الكائنات الحية من مستعمرة واحدة إلى YPD ؛ كرر عدة مرات للحصول على خلايا من عدة مستعمرات مختلفة. احتضان بين عشية وضحاها عند 30 درجة مئوية في حاضنة شاكر المدارية عند 175 دورة في الدقيقة.
ملاحظة: من المهم استخدام مستعمرات متعددة كمصدر للقاح، لأن بكتيريا C. albicans لديها تواتر عال من التغيرات الجينية التلقائية. إن استخدام مستعمرات متعددة عند بدء زراعة اللقاح يقلل من فرصة ظهور جميع الكائنات الحية في اللقاح من أحد الوالدين مع تغيرات عفوية كبيرة. - في يوم الحقن:
- أجهزة الطرد المركزي 1 مل من الثقافة لمدة 2 دقيقة في 500 × غرام.
- اغسل المزرعة ثلاث مرات باستخدام 1 مل من محلول ملحي معقم من دولبيكو (dPBS). بعد الغسيل النهائي ، أعد تعليق الحبيبات في 1 مل من dPBS المعقم.
- تمييع عينة من الثقافة المغسولة في 1: 100 والعد باستخدام مقياس الدم.
- اضبط كثافة المزرعة المغسولة على 1 × 108 كائنات حية لكل مل باستخدام dPBS.
- لكل مجموعة من السلالات المراد حقنها ، قم بإنشاء اللقاح عن طريق خلط كميات متساوية من السلالة المرجعية والسلالة (السلالات) التجريبية. هذا يحافظ على كثافة اللقاح عند 1 × 108 كائنات حية لكل مل.
ملاحظة: عدد السلالات التي يمكن تقييمها لكل أذن محدود بقدرة نظام الفحص المجهري المستخدم على تمييز الإشارة بوضوح من كل بروتين فلوري. - بمجرد تحضير اللقاح ، انتقل مباشرة إلى حقن الحيوانات. لا تقم بتخزين اللقاح قبل الاستخدام.
2. إعداد الحيوانات
- الحصول على موافقة من اللجنة المؤسسية المحلية لرعاية واستخدام الحيوانات أو الهيئة الإدارية المحلية ذات الصلة.
- احصل على فئران عمرها 6-12 أسبوعا من بائع أو برنامج تربية. الفئران المنزلية في المنشأة التي ستعيش فيها طوال التجربة لمدة 1 أسبوع على الأقل قبل التلقيح.
ملاحظة: بالنسبة للنتائج التمثيلية ، تم استخدام إناث الفئران DBA2 / N البالغة من العمر 6 أسابيع. - إطعام الحيوانات تشاو خالية من الكلوروفيل لمدة 7 أيام على الأقل قبل التلقيح.
3. إزالة الشعر والتلقيح
- حث طائرة جراحية للتخدير (الشكل 1).
تنبيه: عوامل التخدير المستنشقة هي مواد خطرة ويمكن أن تسبب تهيج العين أو الجلد وكذلك سمية الجهاز العصبي. يجب اتباع جميع السياسات والإجراءات المؤسسية وممارسات السلامة المختبرية العامة لاستخدام التخدير المستنشق. يمكن فقط للأفراد المدربين على استخدام التخدير المستنشق تنفيذ هذه الخطوات. تشمل الممارسات القياسية ارتداء القفازات ، ومعطف المختبر ، وحماية العين ، واستخدام نظام زبال التخدير ، وحفظ السجلات بعناية وفقا للإرشادات المؤسسية.- ضع الفأر في غرفة تحريض التخدير قبل التسخين. الحفاظ على الحيوان في بيئة دافئة طوال التخدير العام. أنجز ذلك باستخدام منصات التسخين المصممة لهذا الغرض ومرحلة المجهر الدافئة. لا تستخدم وسادة التدفئة التي لا تستلزم وصفة طبية لأنها يمكن أن ترتفع درجة حرارتها وتسبب حروقا.
- قم بتوفير 2٪ -3٪ إيزوفلوران لغرفة الحث حتى يفقد الفأر منعكسه الصحيح ويكون التنفس بطيئا وثابتا. تطهير غرفة الحث من التخدير ونقل الحيوان إلى مخروط الأنف غير إعادة التنفس توفير 1٪ -2٪ إيزوفلوران.
- تحقق من صحة مستوى التخدير باستخدام منعكس قرصة إصبع القدم أو آليات التحقق الأخرى. طوال التجربة ، راقب النمط التنفسي للحيوان ومستوى التخدير ، واضبط تركيز التخدير حسب الحاجة.
- ضع مزلق العين لمنع جفاف القرنية.
- إزالة الشعر (الشكل 1 ج ، د)
- ضعي كريم مزيل الشعر المتاح دون وصفة طبية على السطح الداخلي والخارجي لكلتا الأذنين باستخدام قطعة قطنية.
- بعد 2-3 دقائق (أو وفقا لتوجيهات الشركة المصنعة) ، امسح الأذن برفق باستخدام وسادة شاش جافة لإزالة كل الكريم والشعر. امسح مرتين أخريين باستخدام وسادات الشاش المشبعة بالماء المعقم لإزالة بقايا كريم مزيل الشعر بالكامل. سيؤدي عدم إزالة كل كريم مزيل الشعر إلى تهيج / التهاب الجلد.
- الحقن (الشكل 1E ، F)
- امسح سطح الأذن المراد حقنه بقطعة شاش مشبعة بنسبة 70٪ من الإيثانول واتركها تجف في الهواء.
- امزج اللقاح جيدا عن طريق الانقلاب عدة مرات أو الدوامة.
- ارسم 20-30 ميكرولتر من اللقاح في حقنة الأنسولين. أمسك الإبرة لأعلى ، اضغط على المحقنة برفق للتأكد من أن أي هواء في البرميل في الأعلى. أخرج الهواء واللقاح الزائد بعناية مرة أخرى إلى أنبوب اللقاح أو أنبوب النفايات بحيث يكون المكبس عند علامة 10 ميكرولتر.
- ارتداء كشتبان على إصبع أو إبهام اليد غير المهيمنة ، تثبيت الأذن عن طريق لفها عبر كشتبان. بدلا من ذلك ، ضع شريطا جلديا على الوجهين بدون وصفة طبية (شريط أزياء) على أنبوب بلاستيكي صغير مخروطي أو مستدير القاع وقم بثني الأذن عبر الشريط. احرص على عدم إزاحة مخروط أنف التخدير أثناء القيام بذلك. قد يكون من المفيد لصق المخروط على سطح العمل.
ملاحظة: يمكن حقن الجانب الداخلي أو الخارجي للأذن بناء على الراحة الجسدية للمحقق. بالنسبة للفحص المجهري ، تأكد من وضع الماوس بحيث يكون جانب الأذن المحقون متجها نحو العدسة الشيئية. - مع الحفاظ على إبرة المحقنة موازية تماما تقريبا للجلد وتجنب أي عروق كبيرة ، أدخل طرف الإبرة في الطبقة الخارجية من الجلد حتى يتم تغطية شطبة فقط.
- حقن اللقاح ببطء داخل الأدمة. الحقن الجيد داخل الأدمة سيرفع فقاعة صغيرة في الجلد. حافظ على الإبرة في مكانها لمدة 15-20 ثانية قبل إزالتها من الأذن لتقليل التسرب.
- إذا أصبح الجانب السفلي من أذن الحيوان رطبا ، كانت الإبرة عميقة جدا ومرت عبر الأذن بالكامل. في هذه الحالة ، كرر الحقن في منطقة مختلفة من الأذن.
- كرر العملية باستخدام أذن الحيوان الأخرى. يمكن القيام بذلك مع نفس سلالات C. albicans لتكرار أو مع مجموعة مختلفة من سلالات C. albicans.
- إذا لم يتم التصوير على الفور ، ضع الحيوان في غرفة إنعاش دافئة. راقب الحيوان حتى يتعافى من التخدير ثم أعده إلى قفصه السكني.
- باتباع البروتوكولات المؤسسية ، ضع علامة واضحة على القفص بملصقات بيولوجية وأشر إلى أن الحيوانات في القفص مصابة بالمبيضات البيض.
- أكمل جميع السجلات المطلوبة المتعلقة بتخدير الحيوانات وأي ممارسات مؤسسية أخرى مطلوبة.
- إيواء الحيوان في ظروف منشأة حيوانية باستخدام احتياطات السلامة البيولوجية الحيوانية المستوى 2.
4. تحديد التشكل في المختبر للمقارنة مع النتائج في الجسم الحي
- باستخدام نفس المزارع المغسولة التي تم استخدامها لإعداد اللقاح ، قم بإنشاء تخفيف 1:50 للكائنات الحية في RPMI1640 + 10٪ مصل بقري جنيني معطل بالحرارة واحتضانه عند 37 درجة مئوية مع التقليب لمدة 4 ساعات. بدلا من ذلك ، يمكن استخدام الوسائط الأخرى التي تحفز التشكل في المختبر .
- جهاز طرد مركزي للعينة لمدة 5 دقائق عند 500 × جم وإعادة تعليقها في 0.5 مل من dPBS.
- قم بتخفيف العينة بنسبة 1:10 ، ضع 2.5 ميكرولتر من العينة المخففة على شريحة مجهر ، وقم بتغطيتها بغطاء غطاء.
- افحص العينة باستخدام مجهر مضان. عد ما لا يقل عن 100 خلية ، وسجل عدد الخميرة والخلايا الخيطية لكل سلالة. في النتائج التمثيلية المعروضة هنا، تعرف الخلية الخيطية بأنها أي خلية يزيد طولها عن ضعف طول الخلية الأم.
ملاحظة: يمكن إجراء القياس الكمي للتشكل في المختبر في نفس يوم تلقيح الحيوانات. من الممكن بدء مقايسة التشكل في المختبر أثناء تحضير اللقاح للحقن وإجراء تلقيح الحيوانات خلال فترة الحضانة 4 ساعات. إذا تم الانتهاء من جميع الإجراءات الحيوانية قبل نهاية فترة الحضانة 4 ساعات ، انتقل مباشرة إلى فحص الخلايا المحفزة في المختبر . بدلا من ذلك ، يمكن إعادة تعليق الخلايا في 3.7٪ فورمالديهايد في dPBS (في الخطوة 4.2) وتخزينها في 4 درجات مئوية لعدة أيام. يمكن بعد ذلك قياس الكائنات الثابتة كلما سمح الوقت بذلك. يجب عدم تأخير تلقيح الحيوانات لإجراء فحص كمي في المختبر .
5. التحضير للتصوير في الجسم الحي
- تحضير المجهر (الشكل 2 أ).
- قم بتشغيل جميع معدات الفحص المجهري وابدأ تشغيل برنامج التصوير.
- قم بتحميل أي إعدادات تصوير محددة مسبقا إذا كان ذلك متاحا.
- قم بتنشيط الليزر وأجهزة الكشف اللازمة للكشف عن البروتينات الفلورية المستخدمة.
- قم بتشغيل مرحلة المجهر الساخن واتركه يسخن إلى 37 درجة مئوية.
ملاحظة: من الممكن استخدام مجهر مع غرفة بيئية مغلقة بالكامل بدلا من مرحلة ساخنة. - قم بتعيين نقطة مرجعية للمحور z بحيث يكون مستوى التركيز البؤري في السطح العلوي لقسيمة الغطاء. يمكن القيام بذلك عن طريق لصق غطاء في مكانه فوق فتحة المسرح ووضع قطرة ماء على قسيمة الغطاء. استخدم هدف "جاف" منخفض التكبير (10x) للتركيز على حافة قطرة الماء ثم قم بتعيين النقطة المرجعية للمحور z. استخدم قطعة من المنشفة لامتصاص الماء من الغطاء قبل إزالته من المسرح.
- قم بتدوير هدف مسافة العمل الطويلة جدا في مكانه وضع قطرة من سائل الغمر على العدسة. اخفض العدسة لتجنب التلف المحتمل عند وضع غطاء الغطاء.
- ضع غطاء # 1.5 فوق فتحة المسرح وقم بلصقه في مكانه. تأكد من أن الشريط يغطي بالكامل جميع حواف غطاء الغطاء لمنع أي سائل من الفتل أسفل غطاء الغطاء في المجهر. ارفع الهدف إلى النقطة المرجعية للمحور z بحيث يكون سائل الغمر ملامسا لكل من العدسة الشيئية والغطاء الانزلاقي.
- قم بإعداد قطع متعددة من الشريط الحساس للضغط بحيث تكون جاهزة للاستخدام عند وضع مخروط الأنف والماوس.
- قم بتشغيل جميع معدات الفحص المجهري وابدأ تشغيل برنامج التصوير.
- حث التخدير العام في الماوس ليتم تصويره على النحو الوارد أعلاه (الخطوة 3.1).
- ضع الماوس (الشكل 2B-D).
- قم بتأمين مخروط أنف التخدير على مرحلة المجهر مع وضع مخروط الأنف بحيث يغطي أنف الحيوان بالكامل عندما يكون الحيوان في وضع التصوير. يمكن تحقيق ذلك بسهولة أكبر مع اثنين من المحققين. اطلب من الباحث الأول وضع أنف الفأر المخدر في مخروط الأنف وتحريك الماوس إلى موضعه للتصوير مع الاستمرار في تثبيت مخروط الأنف فوق أنف الحيوان. اطلب من المحقق الآخر لصق مخروط الأنف والأنبوب في مكانه بحيث يستقر بثبات فوق أنف الماوس. بمجرد لصق مخروط الأنف في مكانه ، اتركه هناك لبقية جلسة التصوير.
- بعد تحديد أفضل مكان لوضع nosecuone ، لاحظ موقعه. بالنسبة لجلسات التصوير اللاحقة ، يمكن تأمين الأنف إلى المرحلة قبل إحضار إلى المجهر.
- ضع قطرة من الماء المعقم على الغطاء فوق العدسة الشيئية.
- ضع الماوس على مرحلة المجهر. تأكد من أن الأذن فوق قطرة الماء ومسطحة على غطاء الغطاء.
- استخدم غطاء ثان (علوي) لتسطيح الأذن.
- ضع حافة الغطاء موازية لجسم الماوس ، بحيث تلامس الحافة الماوس حيث تلتقي الأذن بالرأس.
- اخفض الحافة الحرة لغطاء الغطاء إلى مرحلة المجهر بحركة مفصلية. عندما يأتي الغطاء ضد مرحلة المجهر ، فإنه سوف يسطح الأذن. احرص على عدم إنشاء طيات أو حواف في الأذن.
- قم بلصق الغطاء العلوي في مكانه بإحكام بحيث يتحمل ضغطا كافيا للحفاظ على الأذن مسطحة. احرص على عدم التقاط شعر الماوس أو شعيراته في الشريط.
- ما لم يتم استخدام مجهر مع غرفة بيئية ، قم بتغطية جسم الفأر بشكل فضفاض بستارة معقمة للحفاظ على بيئة حرارية معيارية.
- تحديد مجال الاهتمام.
- تأكد من أن الهدف عند النقطة المرجعية للمحور z.
- باستخدام الضوء الأبيض / التصوير واسع المجال ، اضبط مستوى التركيز البؤري في أنسجة الأذن. تتمثل الإستراتيجية الجيدة في التركيز على الأوعية الدموية - إذا كان بإمكان المرء رؤية خلايا الدم الحمراء تتحرك في الأوعية الدموية ، فإن مستوى التركيز يكون داخل الأنسجة.
- إذا كان المجهر مجهزا بقدرة مضان واسعة المجال ، فاستخدمه لتحديد مجال الاهتمام. إذا لم يكن كذلك ، استخدم التصوير متحد البؤر. بشكل عام ، يكون استخدام الفحص المجهري واسع المجال لتحديد مجالات الاهتمام أسرع ويتطلب تشعيعا أقل لأنسجة الأذن.
- باستخدام مكعب مرشح للكشف عن البروتين الفلوري المعبر عنه في السلالة المرجعية ، حدد مجال رؤية يحتوي على إشارة فلورية من السلالة المرجعية. ضع في اعتبارك أن الضوء خارج نطاق التركيز من المحتمل أن يمنع القدرة على التركيز على الكائنات الحية الفردية. الهدف من هذه الخطوة هو تحديد مجال الاهتمام للتصوير البؤري.
- قم بالتغيير إلى مكعب مرشح يكتشف البروتين الفلوري الذي تعبر عنه السلالة (السلالات) التجريبية ويتحقق من وجودها في مجال الرؤية المحدد.
6. التصوير
- تحديد الإعدادات.
- أثناء وجود برنامج التصوير في وضع البؤر المباشر ، افحص مجال الاهتمام أثناء تحريك المستوى البؤري عبر المحور z. اختر مستوى المحور z مع إشارة قوية من جميع البروتينات الفلورية المستخدمة.
- اضبط قوة الليزر و / أو سرعة التصوير للحصول على إشارة قوية بما يكفي بحيث يمكن تحديد التشكل لجميع الخلايا في مجال الرؤية. لتجنب تلف الأنسجة ، استخدم أقل طاقة ليزر ممكنة.
ملاحظة: كما هو الحال مع جميع عمليات التصوير ، هناك توازن بين طاقة الليزر وسرعة الاكتساب والدقة. حدد الإعدادات التي تحدد بوضوح مورفولوجيا الكائن الحي مع موازنة السرعة وقوة الليزر لتقليل تشعيع أنسجة الأذن. نظرا لأن التصوير يحدث من خلال الأدمة الخارجية ، فإن طاقة الليزر أعلى للإثارة مما هو ضروري عادة للتصوير متحد البؤر للعينات التقليدية المثبتة على الشرائح. لحسن الحظ ، فإن مستوى الدقة المكانية المطلوبة لتحليل التشكل ليس متطرفا. وبالتالي ، فإن الحصول على صور بإشارة كافية لتحديد مورفولوجيا الكائن الحي دون التسبب في تلف الأنسجة يمكن تحقيقه بسهولة. - بمجرد إنشاء هذه المعلمات ، استخدمها طوال جلسة التصوير لتكون بمثابة نقطة انطلاق لجلسات التصوير اللاحقة. وبالتالي من المفيد حفظ إعدادات التصوير.
ملاحظة: قد تكون مناطق العدوى الفردية ضحلة أو أعمق داخل الأنسجة. قد تتطلب المناطق العميقة زيادة في طاقة الليزر. نظرا لأن هذا الفحص يعتمد على التوزيع المكاني للإشارة بدلا من شدتها ، فمن المقبول تغيير إعدادات الصورة بين الحقول حسب الحاجة.
- الحصول على الصور.
- اختر مجال رؤية يحتوي على تكوين خيوط واضح في السلالة المرجعية وحيث تنتشر معظم الكائنات الحية بدرجة كافية بحيث يمكن تحديد مورفولوجيتها.
- اضبط مستويي التركيز العلوي والسفلي لمكدس z. ليس من الضروري تغطية عمق المنطقة المصابة بالكامل ، ولكن ضع في اعتبارك أن الكائنات الحية في أعلى أو أسفل الحجم المصور عادة ما يتم استبعادها من التحليل.
- احصل على صور z-stack ، وقم بتلوين كل قناة زائفة لتمييز كل سلالة ، وتراكب القنوات. احفظ الصور.
- كرر لمجالات العرض الأخرى. يمكن أن يختلف التشكل من موقع إلى آخر. لذلك ، من المهم الحصول على وتحليل ثلاثة حقول على الأقل من كل أذن.
7. التحليل اليدوي ثنائي الأبعاد: تردد الفتيل
- استخدم برنامج التصوير لإجراء أقصى إسقاط لمكدس z في صورة ثنائية الأبعاد. التعليمات الواردة هنا هي لفيجي / صورة J.
- افتح صور الفحص المجهري باستخدام برنامج ImageJ.
- إذا لزم الأمر ، ضع لونا زائفا على كل قناة للسماح بالتعرف المباشر على كل سلالة من سلالات C. albicans. لهذا ، انقر فوق Image > Lookup Table > LUT Color وحدد اللون الزائف المختار.
- تحويل ملف المكدس إلى صورة ثنائية الأبعاد لإسقاط الكثافة القصوى:
- حدد ملف z-stack. انقر فوق مكدسات > الصور > Z Projection.
- حدد المستوى العلوي والسفلي وحدد نوع الإسقاط أقصى كثافة.
- عد كل كائن حي يظهر في صور الإسقاط القصوى حسب نوع السلالة (يتميز بلون القناة) والتشكل.
- سيكون من الصعب عد الكائنات الحية المتداخلة بشكل كبير أو المناطق ذات الكثافة العالية جدا للكائنات الحية بدقة. استبعد هذه من العد ، ولكن احرص على عدم إدخال التحيز ضد الأشكال الخيطية ، والتي من المرجح أن تتداخل.
- ستظهر الأشكال الخيطية التي يتم إسقاطها مباشرة داخل أو خارج مكدس z ككائنات مستديرة صغيرة في أقصى إسقاط. وبالمثل، قد تبدو الكائنات الحية المقطوعة بحدود الصورة وكأنها خميرة؛ لأن الفتيل خارج مجال الرؤية. وبالتالي ، فإن التحليل ثنائي الأبعاد سوف يبالغ دائما في تقدير النسبة المئوية لأشكال الخميرة. نظرا لأن هذا سيحدث بالتساوي مع السلالة (السلالات) المرجعية والتجريبية ، قارن دائما النتائج التجريبية بنتائج السلالة المرجعية.
- إجراء مقارنات إحصائية للنتائج وفقا لما يمليه التصميم التجريبي.
8. التحليل اليدوي ثنائي الأبعاد: طول الشعيرة
- بالنسبة لبكتيريا C. albicans ، يمكن أن يحدث تكوين خيوط شاذة بسبب: أ) عدد أقل من خلايا الخميرة "الأم" تخضع للتشكل ، ب) تنمو الخيوط بمعدل أبطأ ، أو ج) يبدأ النمو الخيطي ولكن لا يتم الحفاظ عليه. لتقييم هذه الاحتمالات ، حدد طول مسار المنحنى لكل خيط في صورة الإسقاط القصوى كبديل للطول الحقيقي ثلاثي الأبعاد (تمت مناقشته أدناه).
- عندما ينمو برعم على خلية أم ، لا يمكن معرفة ما إذا كان سيصبح خيطا أم خميرة. للتأكد من تضمين الخلايا الخيطية فقط في هذا التحليل ، قم بقياس الكائنات الحية فقط التي يبلغ طول الخلية البنوية فيها ضعف طول الخلية الأم على الأقل.
- افتح صورة العرض القصوى التي تم إنشاؤها في الخطوة 7.
- في مجموعة أدوات ImageJ ، انقر بزر الماوس الأيمن فوق أداة الخط المستقيم / المجزأ واختر الخيار خط مجزأ. يسمح خيار الخط المجزأ للمستخدم بقياس طول الفتيل على طول مسار منحني ، وهي ضرورة نظرا لمرونة خيوط C. albicans.
- قم بقياس طول الفتيل من عنق البرعم إلى الطرف المتنامي للخيوط. انقر بزر الماوس الأيسر على رقبة البراعم ؛ سيتغير المؤشر إلى مربع صغير. تتبع الفتيل على طوله ، وانقر فوق مركز الفتيل في كل مرة يكون هناك منحنى أو دوران أو تغيير في المحور الطويل للفتيل. انقر نقرا مزدوجا فوق الطرف المتنامي للخيوط.
- اضغط على Control + M. سيؤدي هذا إلى فتح نافذة منبثقة تقوم بجدولة قياسات المنطقة والمتوسط والحد الأدنى والحد الأقصى والطول. بعد قياس كل خيوط ، اضغط على Control + M مرة أخرى لإضافة القياس الحالي إلى جدول القياسات.
- عندما يتم قياس جميع الخيوط ، انسخ والصق قياسات الطول في ملف تحليل البيانات.
- إجراء تحليل إحصائي لتقييم توزيع أطوال الفتيل في السلالة المرجعية والسلالة الطافرة.
9. التحليل اليدوي ثلاثي الأبعاد
- للحصول على قياس أكثر دقة للتشكل يتجنب المبالغة في تقدير أشكال الخميرة وقد يسمح بالتمييز بين الخيوط الكاذبة والخيوط الفطرية ، قم بالتمرير يدويا لأعلى ولأسفل من خلال z-stack أثناء تقييم مورفولوجيا كل كائن حي في ثلاثة أبعاد.
- بدلا من ذلك ، قم بإنشاء صورة ثلاثية الأبعاد لكل مكدس z وتحليل شكل كل كائن حي أثناء تدوير الصورة.
10. التحليل الآلي
- باستخدام برنامج التصوير ، أتمتة تعداد الكائنات الحية ومورفولوجيتها في بعدين أو ثلاثة أبعاد.
ملاحظة: يمكن لبعض الخوارزميات الخاصة بتمييز أنواع التشكل أن تؤدي إلى التحيز. وبالتالي ، يجب التحقق من صحة استراتيجيات الأتمتة بعناية فيما يتعلق بالتصميم التجريبي. يمكن أن يؤدي تحليل الصور الآلي المصمم جيدا والتحقق من صحته إلى زيادة إنتاجية خطوة التحليل.
النتائج
تستند النتائج المقدمة هنا إلى التقارير المنشورة سابقا 9,10. الهدف من هذا التحليل هو إجراء تقييم كمي لقدرة سلالات C. albicans الطافرة على الخضوع للتشكل أثناء العدوى النشطة. قد يكون من الصعب تقييم المعلمات النموذجية التي تميز الخيوط الكاذبة عن الخيوط الفطرية في الكائنات الحية التي تنمو في ثلاثة أبعاد في بيئة معقدة في الجسم الحي. هذا صحيح بشكل خاص عند النظر إلى المقاطع العرضية ثنائية الأبعاد التي تم إنشاؤها بواسطة التصوير البؤري. ومن ثم، يركز تحليل الفحص هذا على تحديد الكائنات الحية التي تنمو في صورة خيطية مقابل خميرة. بالنسبة لدراسات المتابعة باستخدام تحليل أكثر تعمقا ، بما في ذلك إعادة البناء ثلاثية الأبعاد ، يمكن تكييف هذه الطريقة لتمييز الخميرة والخيوط والخيوط الزائفة.
يسمح التعبير عن بروتين فلوري في سلالة مرجعية أو متحولة من C. albicans بالكشف المباشر عن مورفولوجيا الإجهاد في الجسم الحي (الشكل 3 والشكل 4). بشكل عام ، من الأفضل إجراء تحليل المجهر الضوئي الكمي عندما يكون عدد قليل من وحدات البكسل في الصورة مشبعا. بالنسبة لهذا البروتوكول ، غالبا ما يؤدي تشبع الصورة إلى تبسيط التحليل. توطين البروتين الفلوري ليس موحدا في جميع أنحاء الخلية وغالبا ما يكون أعلى في الخميرة الأم منه في خيوط. لحسن الحظ ، بالنسبة للتحقيق في التشكل ، فإن التوزيع المكاني للإشارة ، وليس شدتها ، يحدد النتيجة. لذلك ، فإن الحصول على الصور التي يتم فيها تشبع العديد من وحدات البكسل يحسن القدرة على تحديد التشكل في هذا الفحص.
لتوضيح أهمية تقييم التشكل في الجسم الحي ، يتم تقديم نتائج تمثيلية للسلالة المرجعية (SN250) واثنين من الطفرات: أحدهما يفتقر إلى عامل النسخ Efg1 والآخر يفتقر إلى adenylyl cyclase Cyr1. في المختبر ، لا تنمو أي من هذه السلالات كخيوط20,21. عندما تزرع في المختبر في وسط RPMI المكمل بمصل 10٪ ، فإن السلالة المرجعية تشكل خيوط بسرعة ، في حين أن سلالات efg1ΔΔ و cyr1ΔΔ لا تفعل ذلك (الشكل 3 والشكل 4). في ظل هذه الظروف ، يظهر الطافر efg1ΔΔ نموا مستقطبا إلى حد ما ، حيث تكون الخلايا الابنة ممدودة قليلا مقارنة بالخلايا الأم. هذا يؤكد على أهمية استخدام تعريف واضح للخيوط. أي تعريف من هذا القبيل هو تعسفي بشكل افتراضي ، لكنه ضروري لإجراء تقييم متسق للنمط الظاهري. بالنسبة لهذه الدراسات ، يتم تعريف نمط النمو الخيطي على أنه كائن حي له أطول بعد لخلية ابنة أكثر من ضعف أبعاد الخلية الأم. باستخدام هذا التعريف ، فإن خلايا efg1ΔΔ الممدودة ليست خيطية.
تمشيا مع النمط الظاهري في المختبر ، يظهر efg1 ΔΔ عيبا كبيرا في خيوط الجسم الحي: ما يقرب من 9 ٪ من خلايا efg1ΔΔ نمت كخيوط في الجسم الحي (الشكل 3). في المقابل ، نمت 53٪ من الخلايا الطافرة cyr1ΔΔ كخيوط في الجسم الحي (الشكل 4). على الرغم من أن عدد الخلايا الطافرة cyr1 ΔΔ التي تخضع للخيوط في الجسم الحي كان أقل بكثير من السلالة المرجعية ، فإن قدرة متحولة cyr1ΔΔ على تكوين خيوط في الجسم الحي تمثل تغييرا كبيرا عن افتقارها التام إلى التشكل في المختبر. بصريا ، بدت الخيوط التي شكلتها طفرة cyr1ΔΔ أقصر من السلالة المرجعية. لتقييم هذا كميا ، تم قياس طول مسار المنحنى للخلايا الخيطية باستخدام إسقاط ثنائي الأبعاد للصور في الجسم الحي (الشكل 4E). كان متوسط طول خيوط cyr1ΔΔ أقصر بنسبة 29٪ من خيوط السلالة المرجعية.
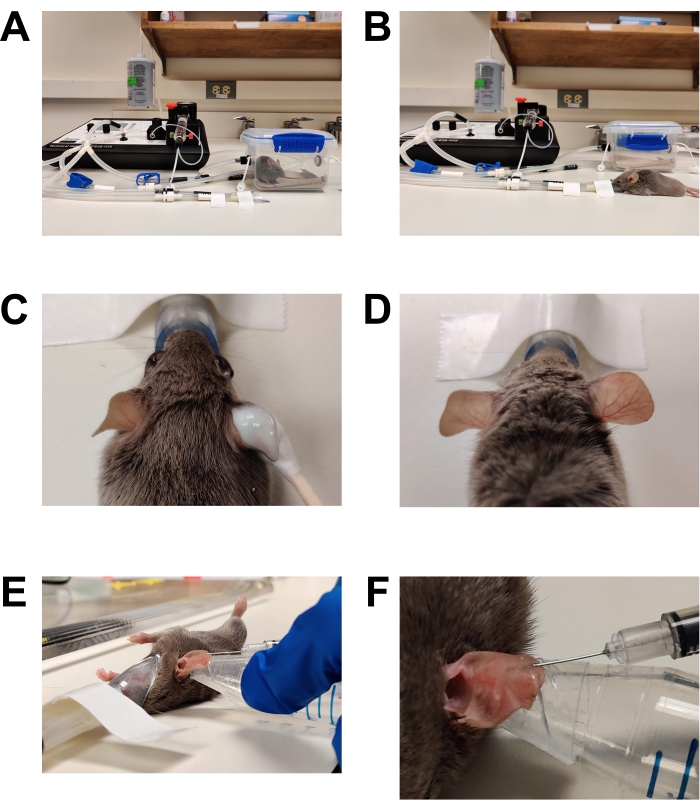
الشكل 1: التخدير والتلقيح. أ: تحريض التخدير باستخدام غرفة الحث. (ب) يتم الحفاظ على التخدير باستخدام مخروط الأنف ، مما يسمح بإعادة وضع الماوس حسب الحاجة. (ج) يوضع كريم إزالة الشعر باستخدام قضيب ذو رأس قطني. تم تطبيق جل تزييت العين لحماية العينين أثناء التخدير. (د) إزالة الشعر الفعال للأذن اليمنى. قارن مع الأذن اليسرى غير المعالجة. (ه) حقن المطثية البيض داخل الأدمة في أذن الفأر. يتم تثبيت الأذن في مكانها باستخدام طرف أنبوب مخروطي ملفوف بشريط جلدي على الوجهين (شريط أزياء). (و) لقطة مقربة للحقن داخل الأدمة. تتشكل فقاعة شاحبة في الجلد ، وهي علامة على نجاح التنسيب داخل الأدمة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: التحضير للتصوير. (أ) مرحلة المجهر المعدة للتصوير. يتم تأمين مخروط أنف التخدير في مكانه. يتم لصق غطاء على المسرح الذي يغطي فتحة العدسة. تتوفر قطع إضافية من الشريط. يتم تسخين المرحلة الساخنة مسبقا إلى 37 درجة مئوية (غير معروضة). ب: وضع الفأر المخدر في مخروط أنف التخدير. (ج) يتم تدوير الماوس قليلا بحيث يكون جانب الأذن الذي تم تلقيحه متجها نحو الغطاء السفلي / العدسة الموضوعية. ثم يتم تسطيح الأذن مقابل الغطاء السفلي وتثبيتها في مكانها عن طريق وضع غطاء ثان أعلى الأذن. (د) يتم لصق الغطاء العلوي على المسرح لتثبيت الأذن في مكانها بالنسبة لمرحلة المجهر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 3: مورفولوجيا في المختبر وفي الجسم الحي للسلالة الطافرة efg1ΔΔ. (أ) صورة واسعة المجال لسلالات WT و efg1ΔΔ الطافرة بعد تحريض الخيوط في المختبر عن طريق نمو الخلايا في RPMI + مصل 10٪ عند 37 درجة مئوية لمدة 4 ساعات. تمثل قضبان المقياس 10 ميكرومتر. تم ضبط تباين الصورة باستخدام برنامج تحرير الصور لتسهيل المشاهدة. (ب) النسبة المئوية للخيوط في المختبر التي لوحظت في سلالات WT و efg1ΔΔ الطافرة. Und = غير قابل للكشف (لم يتم اكتشاف أي خيوط). يمثل ارتفاع الشريط النسبة المئوية المتوسطة للخلايا الخيطية من ثلاث تجارب مستقلة حيث تم تحديد كمية 100 خلية على الأقل. تشير أشرطة الخطأ إلى الانحراف المعياري (مقارنة النتائج باختبار t للطالب ، p < 0.001). (C) صورة مجهرية متحدة البؤر ل WT (أخضر) ومتحولة EFG1ΔΔ (حمراء) تنمو في الجسم الحي بعد 24 ساعة من التلقيح. تشير الأسهم إلى أمثلة على الخلايا الطافرة efg1ΔΔ التي تلبي تعريفنا ل "الخيطية". يمثل شريط المقياس 50 ميكرومتر. (د) النسبة المئوية للخيوط في الجسم الحي التي لوحظت في سلالات WT و efg1ΔΔ الطافرة. يمثل ارتفاع الشريط النسبة المئوية المتوسطة للخلايا الخيطية من تجربتين مستقلتين. تشير أشرطة الخطأ إلى الانحراف المعياري (مقارنة النتائج باختبار t للطالب ، p < 0.001). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
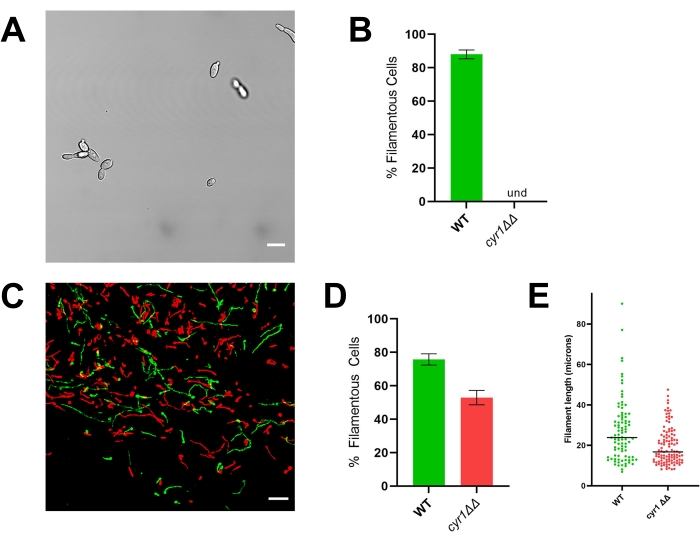
الشكل 4: مورفولوجيا في المختبر وفي الجسم الحي للسلالة الطافرة cyr1 ΔΔ. (أ) صورة واسعة المجال للسلالة الطافرة cyr1ΔΔ بعد تحريض الخيوط في المختبر عن طريق نمو الخلايا في RPMI + مصل 10٪ عند 37 درجة مئوية لمدة 4 ساعات. يمثل شريط المقياس 10 ميكرومتر. تم ضبط تباين الصورة باستخدام برنامج تحرير الصور لتسهيل المشاهدة. (ب) النسبة المئوية للخيوط في المختبر التي لوحظت في سلالات WT و cyr1ΔΔ الطافرة. Und = غير قابل للكشف (لم يتم اكتشاف أي خيوط). يمثل ارتفاع الشريط النسبة المئوية المتوسطة للخلايا الخيطية من ثلاث تجارب مستقلة حيث تم تحديد كمية 100 خلية على الأقل. تشير أشرطة الخطأ إلى الانحراف المعياري (مقارنة النتائج باختبار t للطالب ، p < 0.001). (C) صورة مجهرية متحدة البؤر ل WT (أخضر) ومتحولة cyr1ΔΔ (حمراء) تنمو في الجسم الحي بعد 24 ساعة من التلقيح. يمثل شريط المقياس 50 ميكرومتر. (د) النسبة المئوية للخيوط في الجسم الحي التي لوحظت في سلالات WT و cyr1ΔΔ الطافرة. يمثل ارتفاع الشريط النسبة المئوية المتوسطة للخلايا الخيطية من تجربتين مستقلتين. تشير أشرطة الخطأ إلى الانحراف المعياري (مقارنة النتائج باختبار t للطالب ، p < 0.001). (ه) توزيع طول الفتيل في الجسم الحي ، كما تم قياسه بطول مسار المنحنى في إسقاط ثنائي الأبعاد لمكدس z. تمثل كل نقطة طول خيط واحد. لم يتم تضمين الخلايا التي تنمو كخميرة في هذا التحليل. يشير الشريط إلى متوسط طول الفتيل. يختلف توزيع الأطوال اختلافا كبيرا عند تحليلها باستخدام اختبار Mann-Whitney U (p < 0.001). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
يستخدم هذا النموذج الفحص المجهري متحد البؤر للحصول على صور لكائنات C. albicans أثناء نموها داخل أنسجة مضيف الثدييات ، مما يسمح لنا بتقييم الأنماط الظاهرية للتشكل أثناء العدوى النشطة. تعتبر عملية التشكل أساسية لتسبب C. albicans وقد تمت دراستها على نطاق واسع باستخدام مجموعة متنوعة من المقايسات في المختبر 2،3،4. ومع ذلك ، لا يمكن لأي مقايسة في المختبر أن نمذجة البيئة البيوكيميائية والهيكلية المعقدة للمضيف بشكل كامل.
يركز البروتوكول الموصوف هنا على استخدام نظام التصوير في الجسم الحي لفحص سلسلة / مكتبة من طفرات C. albicans لتحديد الجينات المشاركة في التشكل أثناء العدوى. يسمح لنا استخدام سلالات C. albicans التي تعبر عن بروتينات فلورية مختلفة بتحديد التشكل في الجسم الحي لسلالات C. albicans الطافرة مقارنة بسلالات السلالة المرجعية. إن مقارنة التشكل في الطفرة بالسلالة المرجعية داخل نفس منطقة العدوى تضمن تعرض الكائنات الحية لبيئات متطابقة. وهذا يسمح بالقياس الكمي للنسبة المئوية للخلايا التي تخضع للخيوط ، وكذلك مدى الخيوط. يسمح لنا تطبيع قياسات سلالة (سلالات) الطفرة بقياسات السلالة المرجعية بمقارنة أداء طفرة بأخرى بشكل أفضل.
توضح النتائج التمثيلية المقدمة هنا إمكانية وجود تباين كبير بين الأنماط الظاهرية في المختبر وفي الجسم الحي . غالبا ما تستخدم سلالة C. albicans efg1ΔΔ الطافرة كعنصر تحكم سلبي في فحوصات التشكل لأنها تفشل في الخيوط في جميع الظروف المختبرية تقريبا20. على الرغم من أن النتائج في الجسم الحي كانت مشابهة جدا للنتائج في المختبر ، حتى هذه السلالة المعوقة بشدة شكلت أحيانا خيوطا في بيئة الأنسجة المضيفة (الشكل 3). هذا يؤكد على قوة البيئة المضيفة في تحفيز التشكل.
في المقابل ، تظهر سلالة cyr1ΔΔ الطافرة تنافرا كبيرا بين النمو في المختبر والنمو في الجسم الحي. على الرغم من عدم خضوع أي من الخلايا الطافرة للخيوط في المختبر ، إلا أن نصف الخلايا تقريبا تنمو كخيوط في الجسم الحي (الشكل 4) 10,21. ومن المثير للاهتمام أن هذه الخيوط كانت أقصر بكثير من تلك التي شكلتها السلالة المرجعية ، مما يشير إلى أن CYR1 يساهم إما في معدل نمو الفتيل أو القدرة على الحفاظ على النمط الظاهري الخيطي. لتسهيل تحليل طول الفتيل ، تم قياس طول مسار منحنى الخيوط باستخدام إسقاط ثنائي الأبعاد للصور. في الإسقاطات ثنائية الأبعاد للخيوط التي تنمو في ثلاثة أبعاد ، فإن أي خيط ينمو على محور غير مواز للمستوى xy سيبرز أقصر من طوله الحقيقي. نظرا لأن هذا التقصير المسبق يحدث أيضا للسلالة المرجعية ، فإن تقييم توزيع أطوال الخيوط في إسقاط ثنائي الأبعاد لا يزال يسمح بإجراء مقارنة كمية بين السلالات المرجعية والمتحولة. يتطلب تحليل طول الفتيل في بعدين بدلا من ثلاثة أبعاد تحليلا أقل كثافة للصورة ؛ وبالتالي ، يمكن إجراؤه بسرعة نسبيا على كمبيوتر سطح مكتب نموذجي. يسمح استخدام هذا التحليل الأبسط بإدراج توزيع طول الخيوط كجزء من بروتوكول الفحص ، مما يعطي فهما أكثر دقة لقدرة كل متحولة على الخضوع للتشكل دون التسبب في تأخيرات كبيرة في الإنتاجية.
تم إجراء الدراسات التمثيلية المقدمة هنا باستخدام الفئران DBA2 / N ، والتي لديها عيب في نظامها المكمل مما تسبب في فشل تجنيد العدلات إلى موقع عدوى C. albicans 22. كان الهدف من هذه الدراسات هو التحقيق في آليات تنظيم خيوط C. albicans داخل الأنسجة المضيفة. لذلك تم استخدام الفئران DBA2 / N لتجنب إرباك النتائج بسبب حساسية سلالة فردية أو مقاومة للعدلات. نظرا لأن استجابة العدلات المضادة ل C. albicans يمكن أن تؤثر على الخيوط23 ، فإن تجنيد العدلات إلى موقع العدوى يمكن أن يؤثر على نتائج فحص التشكل. إذا كانت السلالة قادرة على الخيوط في الجسم الحي ولكن يتم تثبيطها بشدة من الخيوط عند وجود العدلات ، اكتشاف الخيوط في الفئران DBA2 / N ولكن من غير المحتمل رؤيتها عند استخدام الفئران ذات الانجذاب الكيميائي العدلات السليم. وبالتالي ، فإن إجهاد الماوس المستخدم كمضيف هو عامل مهم عند استخدام هذا البروتوكول.
من غير المرجح أن تكون ملاحظة أن السلالة الطافرة efg1ΔΔ تفشل في الخيوط في الجسم الحي مرتبطة باستجابات العدلات المضيفة ، لأن هذه السلالة تفشل أيضا في الخيوط في المختبر. الفتيل الذي لوحظ في الجسم الحي مع سلالة cyr1ΔΔ يتعارض مع فشله في الخيوط في المختبر. تشير البيانات من نموذج الزرد لعدوى C. albicans إلى أن العدلات المستجيبة مهمة في الوقاية من التشكل24. لذلك ، من غير المرجح أن يفسر استخدام فئران DBA2 / N ، التي تفتقر إلى استجابات العدلات ، الزيادة في خيوط cyr1ΔΔ في الجسم الحي مقارنة بالمختبر. ومع ذلك ، فإن البيئة في الجسم الحي تؤثر بوضوح على تشكل سلالة cyr1ΔΔ. وبالتالي ، قد يوفر مزيد من التحقيق في هذه السلالة معلومات مهمة حول تنظيم تشكل C. albicans أثناء العدوى النشطة. تم تصميم البروتوكول الموصوف هنا كاختبار فحص لتحديد سلالات مثل سلالة cyr1ΔΔ لاستخدامها في الدراسات المستقبلية.
يعد استخدام نظام تخدير الغاز منخفض التدفق مفيدا جدا لهذا البروتوكول (الشكل 1 أ ، ب). خلال التطوير الأولي لهذا البروتوكول ، تم تخدير الفئران باستخدام كوكتيل مخدر عن طريق الحقن من الكيتامين الممزوج بالزيلازين. في حين أنه كان من الممكن إجراء تصوير محدود باستخدام طريقة التخدير هذه ، إلا أن مدة التخدير كانت غير متوقعة ، مما يتطلب إنهاء جلسات التصوير بسرعة لتجنب تعافي الفأر من التخدير أثناء التصوير. أنظمة التخدير التقليدية المستنشقة ضخمة وتتطلب معدلات عالية من تدفق غازات التخدير ، وغالبا ما تتطلب استخدامها داخل غطاء الدخان. وبالتالي ، سيكون من الصعب جدا استخدام أنظمة التخدير المستنشقة التقليدية مع قيود المساحة للمجهر متحد البؤر دون تعريض الباحثين عن غير قصد لعوامل التخدير. يسمح استخدام نظام التخدير المستنشق منخفض التدفق بتخدير ثابت للحيوان مع الحفاظ على بيئة آمنة للمحقق. يسمح المخروط ذو التدفق المنخفض بتحديد موقع الحيوان بسهولة لكل من التلقيح والفحص المجهري. يسمح أنبوب التوصيل ذو العيار الصغير والحجم المنخفض باستخدام أنابيب طويلة نسبيا ، مما يتيح وضع آلة التخدير على مسافة كافية حتى لا تتداخل مع الفحص المجهري.
يؤدي الكلوروفيل الموجود في تشاو الفأر النموذجي إلى تألق ذاتي كبير للأنسجة25. هذا يخلق ضوضاء كبيرة في الصور ، مما يجعل من الصعب الحصول على صور عالية الجودة وعالية الدقة المكانية. عندما تم تغذية الحيوانات بالكلوروفيل الخالي من الكلوروفيل لمدة 7 أيام قبل التصوير ، انخفضت الخلفية من التألق الذاتي بشكل كبير في الأنسجة ، لكن الكلوروفيل المترسب في الشعر ظل يمثل مشكلة. إزالة الشعر على الصيوان باستخدام كريم مزيل الشعر الكيميائي الذي لا يحتاج إلى وصفة طبية فعال في تقليل التألق الذاتي في الشعر (الشكل 1C ، D). وبالتالي ، فإن الجمع بين تشاو الخالي من الكلوروفيل وإزالة الشعر الكافية قلل بشكل كبير من التألق الذاتي وحسن جودة الصورة بشكل كبير. نظرا لإزالة الشعر من الأذن قبل التصوير ، فإن لون شعر الحيوان لا يؤثر على هذا النظام. تم استخدام هذا البروتوكول بنجاح لدراسة عدوى C. albicans في الفئران BALB / c (أبيض) و C57BL / 6 (أسود) و DBA2 / N (بني). يمكن أيضا استخدام البروتوكول مع فئران خروج المغلوب C57BL / 6 التي تعاني من نقص في جينات مضيفة مختلفة. سيسمح ذلك بإجراء تحقيقات مستقبلية حول كيفية تأثير الجهاز المناعي المضيف للثدييات على الخيوط. إحدى ميزات هذا النموذج التي لم تتم مناقشتها في هذا البروتوكول هي أنه نظرا لأن نظام التصوير هذا غير جراحي ، يمكن تصوير نفس الحيوان بشكل متكرر على مدار عدة أيام ، مما يسمح بمتابعة تقدم العدوى الفردية بمرور الوقت. من المحتمل أن تلعب هذه الميزة دورا رئيسيا في الدراسات المستقبلية حول التفاعل بين المضيف وممرض.
باختصار ، ينتج عن هذا البروتوكول صور عالية الدقة المكانية ل C. albicans تنمو في أنسجة مضيف ثديي حي ، مما يسمح بتقييم دقيق للتشكل في السلالات الطافرة8،9،10. توضح النتائج المقدمة هنا كيف يمكن استخدام هذا البروتوكول لفحص مكتبة من طفرات C. albicans. من بين طفرات C. albicans التي تم اختبارها حتى الآن ، يخضع جزء كبير من الطفرات ذات العيوب المعروفة في التشكل في المختبر بسهولة للخيوط في الجسم الحي 9,10. هذا يسلط الضوء على أهمية تضمين نظام في الجسم الحي مثل هذا النظام في التجارب المصممة لتوضيح آليات التسبب في C. albicans.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم هذا العمل من قبل منحة المعاهد الوطنية للصحة 1R01AI33409 وقسم طب الأطفال ، كلية كارفر للطب ، جامعة أيوا.
Materials
| Name | Company | Catalog Number | Comments |
| #1.5 coverslips | Thermo-Fisher | 20811 | large enough to cover the universal stage opening |
| 0.1 mL Insulin syringes | EXELint | 26018 | Can use syringes that are 5/16"–1/2" long and 29–32 G |
| 3.7% formaldehyde in dPBS | Sigma-Aldrich | SHBJ5734 | |
| 70% Ethanol/30% water | Decon Laboratories | A05061001A | |
| Alcohol prep pads | Covidien | 5110 | Alternative: gauze pads soaked in 70% isopropyl alcohol |
| C.albicans reference strain and experimental strains | SN250 | FGSC Online Catalog | The specific C. albicans strain varies with experiment and the investigators goals. We have used strains derived from SC5314 as well as other clinical isolates. |
| Chlorophyl free mouse chow | Envigo | 2920x | |
| Computer | Dell | Optiplex 7050 | Computer that can run imaging software for acquisition and for analysis of images. A variety of imaging software is available and varies with the specific microscope and user system. |
| Cotton tip applicator | Pro Advantage | 76200 | |
| DBA2/N (6-12 week old mice) | BALB/c and C57/BL6 mice can also be used. The latter allow for the use of widely available knockout mouse models as well as mouse models in which individual cell types, such as phagocytes, are identified by their expression of fluorescent proteins. | ||
| Double sided tape designed to hold fabric to skin (fashion tape) | local pharmacy or grocery store | Double sided adhesive tape designed for keeping clothing in place over human skin. This is typically available over the counter in pharmacies and variety stores. It is important to use this type of tape as it is designed for gentle adherence to skin. Examples: https://www.amazon.com/Womens-Fashion-Clothing-Transparent-Suitable/dp/B08S3TWR3H/ref=sr_1_40?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-40 https://www.amazon.com/Fearless-Tape-Sensitive-Clothing-Transparent/dp/B07QY8V5XT/ref=sr_1_26?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174320&sprefix= fashion+tape%2Caps%2C70&sr=8-26 https://www.amazon.com/Hollywood-Fashion-Secrets-Tape-Floral/dp/B009RX77MK/ref=sr_1_29?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-29 | |
| Dulbecco's phosphate buffered saline | Gibco / Thermo-Fisher | 14190-144 | Must be sterile; open a new container for every experiment |
| Fetal bovine serum | Gibco / Thermo-Fisher | 26140-079 | |
| Gauze pad | Pro Advantage | P157112 | |
| Gel eye lurbicant | local pharmacy or grocery store | ||
| ImageJ or FIJI analysis software | NIH | ImageJ (FIJI) | |
| Isoflurane | Akorn | J119005 | |
| Leica DMi8 (SP8 platform) with Leica 11506375 objective lens | Leica | DMi8 (SP8) | The objective lens (Leica 11506375) used here is a 25x water immersion lens to allow us to have a high NA (0.95) while approximating the refractive index of the ear tissue. The microscope (Leica DMi8 (SP8 platform) has 488 nm and 638 nm diode laser lines and is equipped with filter-free spectral detection with computer controlled adjustable bandwidth for detection of emission light. The stage must have enough clearance to allow the objective to reach the bottom coverslip without hitting the stage. |
| Low-flow anesthesia system or traditional anesthesia vaporizer | Kent Scientific International | SomnoSuite | |
| Nair hair remover lotion | local pharmacy or grocery store | Over the counter depilatory cream | |
| Nourseothricin | Jena Bioscience | AB-101L | |
| pENO1-NEON-NATR pENO1-iRFP-NATR plasmids | Fluorescent protein expression transformation constructs generously given to us by Dr. Robert Wheeler (Seman, et al., 2018, Infection and Immunity; Bergeron, et al., 2017, Infection and Immunity) | ||
| Pressure sensitive laboratory tape | Tape & Label Graphic Systems Inc | 1007910 | |
| RPMI1640 cell culture medium | Gibco / Thermo-Fisher | 11875-093 | |
| Thimble, plastic 15 mL conical tube, or Falcon 5 mL round bottom polystyrene tubes | Falcon | 352196 | To safely hold the animals ear during injectinos |
References
- Lopes, J. P., Lionakis, M. S. Pathogenesis and virulence of Candida albicans. Virulence. 13 (1), 89-121 (2022).
- Saville, S. P., Lazzell, A. L., Monteagudo, C., Lopez-Ribot, J. L. Engineered control of cell morphology in vivo reveals distinct roles for yeast and filamentous forms of Candida albicans during infection. Eukaryotic Cell. 2 (5), 1053-1060 (2003).
- Arita, G. S., et al. Cell wall associated proteins involved in filamentation with impact on the virulence of Candida albicans. Microbiological Research. 258, 126996(2022).
- Rai, L. S., Wijlick, L. V., Bougnoux, M. E., Bachellier-Bassi, S., d'Enfert, C. Regulators of commensal and pathogenic life-styles of an opportunistic fungus-Candida albicans. Yeast. 38 (4), 243-250 (2021).
- Sudbery, P. E. Growth of Candida albicans hyphae. Nature Reviews Microbiology. 9 (10), 737-748 (2011).
- Basso, V., d'Enfert, C., Znaidi, S., Bachellier-Bassi, S. From genes to networks: The regulatory circuitry controlling candida albicans morphogenesis. Current Topics in Microbiology and Immunology. 422, 61-99 (2019).
- Mancera, E., et al. Evolution of the complex transcription network controlling biofilm formation in Candida species. Elife. 10, 64682(2021).
- Mitra, S., Dolan, K., Foster, T. H., Wellington, M. Imaging morphogenesis of Candida albicans during infection in a live animal. Journal of Biomedical Optics. 15 (1), 010504(2010).
- Wakade, R. S., Huang, M., Mitchell, A. P., Wellington, M., Krysan, D. J. Intravital imaging of Candida albicans identifies differential in vitro and in vivo filamentation phenotypes for transcription factor deletion mutants. mSphere. 6 (3), 0043621(2021).
- Wakade, R. S., Kramara, J., Wellington, M., Krysan, D. J. Candida albicans filamentation does not require the cAMP-PKA pathway in vivo. mBio. 13 (3), 0085122(2022).
- Bergeron, A. C., et al. Candida albicans and Pseudomonas aeruginosa interact to enhance virulence of mucosal infection in transparent zebrafish. Infection and Immunity. 85 (11), 00475(2017).
- Seman, B. G., et al. Yeast and filaments have specialized, independent activities in a zebrafish model of Candida albicans infection. Infection and Immunity. 86 (10), 00415-00418 (2018).
- Centers for Disease Control and Prevention. Biosafety in Microbiological and Biomedical Laboratories (BMBL). 6th edition. , Available from: https://www.cdc.gov/labs/BMBL.html (2020).
- Homann, O. R., Dea, J., Noble, S. M., Johnson, A. D. A phenotypic profile of the Candida albicans regulatory network. Plos Genetics. 5 (12), 1000783(2009).
- Cullen, P. J., Sprague, G. F. The regulation of filamentous growth in yeast. Genetics. 190 (1), 23-49 (2012).
- Herrero, A. B., et al. Control of filament formation in Candida albicans by polyamine levels. Infection and Immunity. 67 (9), 4870-4878 (1999).
- Ahmad Hussin, N., et al. Biotin auxotrophy and biotin enhanced germ tube formation in Candida albicans. Microorganisms. 4 (3), 37(2016).
- Nantel, A., et al. Transcription profiling of Candida albicans cells undergoing the yeast-to-hyphal transition. Molecular Biology of the Cell. 13 (10), 3452-3465 (2002).
- Noble, S. M., Johnson, A. D. Strains and strategies for large-scale gene deletion studies of the diploid human fungal pathogen Candida albicans. Eukaryotic Cell. 4 (2), 298-309 (2005).
- Glazier, V. E. EFG1, Everyone's favorite gene in Candida albicans: A comprehensive literature review. Frontiers in Cellular Infection and Microbiology. 12, 855229(2022).
- Huang, G., Huang, Q., Wei, Y., Wang, Y., Du, H. Multiple roles and diverse regulation of the Ras/cAMP/protein kinase A pathway in Candida albicans. Molecular Microbiology. 111 (1), 6-16 (2019).
- Saville, S. P., Lazzell, A. L., Chaturvedi, A. K., Monteagudo, C., Lopez-Ribot, J. L. Use of a genetically engineered strain to evaluate the pathogenic potential of yeast cell and filamentous forms during Candida albicans systemic infection in immunodeficient mice. Infection and Immunity. 76 (1), 97-102 (2008).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryotic Cell. 10 (7), 932-944 (2011).
- Brothers, K. M., et al. NADPH oxidase-driven phagocyte recruitment controls Candida albicans filamentous growth and prevents mortality. PLoS Pathogens. 9 (10), 1003634(2013).
- Holmes, H., Kennedy, J. C., Pottier, R., Rossi, R., Weagle, G. A recipe for the preparation of a rodent food that eliminates chlorophyll-based tissue fluorescence. Journal of Photochemistry and Photobiology. B: Biology. 29 (2-3), 199(1995).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved