A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل وقياس فيروس إبشتاين بار من خط الخلية P3HR1
In This Article
Summary
يسمح هذا البروتوكول بعزل جزيئات فيروس إبشتاين بار من خط خلايا P3HR1 البشري عند تحفيز الدورة الفيروسية مع phorbol 12-myristate 13-acetate. يتم استخراج الحمض النووي لاحقا من المستحضر الفيروسي وإخضاعه لتفاعل البوليميراز المتسلسل في الوقت الفعلي لتحديد تركيز الجسيمات الفيروسية.
Abstract
فيروس إبشتاين بار (EBV) ، المعين رسميا باسم فيروس الهربس البشري 4 (HHV-4) ، هو أول فيروس ورم بشري معزول. ما يقرب من 90-95 ٪ من السكان البالغين في العالم مصابون بفيروس EBV. مع التطورات الحديثة في البيولوجيا الجزيئية وعلم المناعة ، قدم تطبيق كل من النماذج التجريبية في المختبر وفي الجسم الحي نظرة عميقة وذات مغزى حول التسبب في EBV في العديد من الأمراض وكذلك في تكوين الأورام المرتبطة ب EBV. الهدف من ورقة التجربة المرئية هذه هو تقديم نظرة عامة على عزل جزيئات EBV الفيروسية من خلايا خط الخلايا P3HR1 ، متبوعا بتقدير كمي للتحضير الفيروسي. يمكن لخلايا P3HR1 ، المعزولة في الأصل من سرطان الغدد الليمفاوية بيركيت البشري ، أن تنتج فيروس P3HR1 ، وهو سلالة EBV من النوع 2. يمكن تحفيز الدورة lytic EBV في خلايا P3HR1 هذه عن طريق العلاج باستخدام phorbol 12-myristate 13-acetate (PMA) ، مما ينتج عنه جزيئات فيروسية EBV.
باستخدام هذا البروتوكول لعزل جزيئات EBV ، يتم استزراع خلايا P3HR1 لمدة 5 أيام عند 37 درجة مئوية و 5٪ CO2 في وسط RPMI-1640 كامل يحتوي على 35 نانوغرام / مل PMA. بعد ذلك ، يتم طرد وسط الاستزراع بسرعة 120 × جم لمدة 8 دقائق لتكوير الخلايا. ثم يتم جمع المادة الطافية المحتوية على الفيروس وتدويرها بسرعة 16000 × جم لمدة 90 دقيقة لتكوير جزيئات EBV. ثم يتم إعادة تعليق الحبيبات الفيروسية في وسط RPMI-1640 كامل. ويتبع ذلك استخراج الحمض النووي وتفاعل البوليميراز المتسلسل الكمي في الوقت الفعلي لتقييم تركيز جزيئات EBV في التحضير.
Introduction
فيروس إبشتاين بار (EBV) هو أول فيروس ورم بشري يتم عزله1. EBV ، الذي يشار إليه رسميا باسم فيروس الهربس البشري 4 (HHV-4) 2 ، هو جزء من فصيلة فيروس الهربس غاما من عائلة فيروس الهربس وهو النموذج الأولي لجنس Lymphocryptovirus. ما يقرب من 90-95 ٪ من السكان البالغين في العالم مصابون بالفيروس3. في معظم الحالات ، تحدث العدوى الأولية خلال أول 3 سنوات من الحياة وتكون بدون أعراض ، ومع ذلك ، إذا حدثت العدوى في وقت لاحق خلال فترة المراهقة ، فقد تؤدي إلى مرض يشار إليه باسم كريات الدم البيضاء المعدية4. EBV قادر على إصابة الخلايا البائية المستريحة مما يحثها على أن تصبح أرومات لمفاوية B تكاثرية حيث يؤسس الفيروس ويحافظ على حالة إصابة كامنة5. يمكن إعادة تنشيط EBV في أي وقت وبالتالي يؤدي إلى التهابات متكررة6.
على مدى السنوات ال 50 الماضية ، أصبح الارتباط بين بعض الفيروسات وتطور الأورام الخبيثة البشرية واضحا بشكل متزايد ، واليوم تشير التقديرات إلى أن 15٪ إلى 20٪ من جميع أنواع السرطان البشرية مرتبطة بالعدوى الفيروسية7. فيروسات الهربس ، بما في ذلك EBV ، هي بعض من أفضل الأمثلة المدروسة لهذه الأنواع من فيروسات الورم8. في الواقع ، يمكن أن يسبب EBV العديد من أنواع الأورام الخبيثة البشرية ، مثل سرطان الغدد الليمفاوية Burkitt (BL) ، وسرطان الغدد الليمفاوية هودجكين (HL) ، وسرطان الغدد الليمفاوية للخلايا البائية الكبيرة المنتشرة ، وأمراض التكاثر اللمفاوي في المضيفين الذين يعانون من نقص المناعة 9,10. كما ثبت أن EBV مرتبط بتطور أمراض المناعة الذاتية الجهازية. بعض الأمثلة على اضطرابات المناعة الذاتية هذه هي التهاب المفاصل الروماتويدي (RA) ، التهاب العضلات - التهاب الجلد والعضلات (PM-DM) ، الذئبة الحمامية الجهازية (SLE) ، مرض النسيج الضام المختلط (MCTD) ، ومتلازمة سجوجرن (SS) 11. يرتبط EBV أيضا بتطور مرض التهاب الأمعاء (IBD)12.
يمكن دراسة العديد من هذه الأمراض أو نمذجتها باستخدام زراعة الخلايا أو الفئران أو الكائنات الحية الأخرى المصابة بفيروس EBV. هذا هو السبب في أن جزيئات EBV ضرورية لإصابة الخلايا أو الكائنات الحية ، سواء في المختبر أو في نماذج الجسم الحي 13،14،15،16 ، ومن هنا تأتي الحاجة إلى تطوير تقنية تسمح بعزل الجسيمات الفيروسية بتكلفة منخفضة. يوفر البروتوكول الموصوف هنا إرشادات لطريقة سهلة لعزل جزيئات EBV بشكل موثوق من خط خلية يمكن الوصول إليه نسبيا وتحديد كمية الجسيمات باستخدام تفاعل البوليميراز المتسلسل في الوقت الفعلي ، وهو فعال من حيث التكلفة ومتاح بسهولة لمعظم المختبرات. هذا بالمقارنة مع العديد من الطرق الأخرى التي تم وصفها لعزل EBV من خطوط الخلايا المختلفة17،18،19،20.
P3HR-1 هو خط خلية BL ينمو معلقا ويصاب بشكل كامن بسلالة EBV من النوع 2. هذا الخط الخلوي هو منتج EBV ويمكن تحريضه لإنتاج جزيئات فيروسية. الهدف من هذه المخطوطة هو عرض طريقة تسمح بعزل جزيئات EBV من خط الخلية P3HR-1 ، يليها تحديد كمية المخزون الفيروسي الذي يمكن استخدامه لاحقا لكل من النماذج التجريبية في المختبر وفي الجسم الحي .
Protocol
ملاحظة: ينبغي اعتبار EBV مادة يحتمل أن تكون خطرة بيولوجيا، وبالتالي ينبغي التعامل معها في إطار احتواء السلامة الأحيائية من المستوى 2 أو أعلى. يجب ارتداء معطف المختبر وكذلك القفازات. إذا كان هناك احتمال للتعرض للبقع ، فيجب أيضا مراعاة حماية العين. يجب إجراء الإجراء التالي في خزانة السلامة البيولوجية.
1. عد خلايا P3HR1
- الطرد المركزي وإعادة تعليق الخلايا
- انقل معلق الخلية من صفيحة ثقافة 100 مم (أو دورق T-25) لمزرعة خلية P3HR1 مستمرة عند التقاء 80٪ إلى أنبوب مخروطي سعة 15 مل. كثافة البذر لخلايا P3HR-1 هي 1 × 106 خلايا / مل. الحفاظ على وسط زراعة RPMI الكامل (79٪ وسط زراعة RPMI ، 20٪ مصل بقري جنيني ، 1٪ مضاد حيوي Pen-Strep) عند 37 درجة مئوية و 5٪ CO2 ، والمرور كل 3-4 أيام.
- جهاز طرد مركزي لمدة 8 دقائق عند 120 × جم. بعد الطرد المركزي ، تخلص من المادة الطافية ، وأعد تعليق حبيبات الخلية في 1 مل من وسط زراعة RPMI الكامل ، واخلطها جيدا (سيشار إلى هذا المحلول باسم التعليق A).
- تحضير تعليق الخلية للعد
- قم بإعداد معلق خلية مخفف B عن طريق خلط 2 ميكرولتر من معلق الخلية A مع 8 ميكرولتر من وسط الثقافة. أضف 10 ميكرولتر من 0.4٪ تريبان أزرق إلى المعلق B للحصول على التعليق C. امزج المستحضر جيدا عن طريق ماصة لطيفة.
- عد الخلايا باستخدام مقياس الدم
- ضع غطاء زجاجي على مقياس الدم وقم بتحميل 10 ميكرولتر من المعلق C. ضع مقياس الدم تحت مجهر ضوئي واحسب عدد الخلايا غير الملطخة باللون الأزرق في كل من الأرباع الأربعة لغرفة مقياس الدم باستخدام هدف المجهر 40x (الشكل 1).
- بقع تريبان الزرقاء الخلايا الميتة الزرقاء. لا تحسب هذه الخلايا ، ولا الخلايا التي تلامس أيا من الحدود العلوية أو السفلية أو اليمنى أو اليسرى لكل ربع من رباعي مقياس الدم.
- احسب تركيز الخلايا لكل مل باستخدام الصيغة التالية:
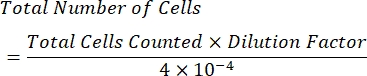
ملاحظة: عدد الأرباع المحسوبة هو أربعة ، و 10-4 مل هو حجم المربعات على مقياس الدم. الأرباع الأربعة التي يجب عدها ممثلة باللون الأخضر في الشكل 1. إجمالي الخلايا المحسوبة في الصيغة هي مجموع أعداد الخلايا في الأرباع 1 و 2 و 3 و 4. يجب حساب الخلايا الممثلة باللون الأزرق في الشكل 1 ، بينما لا ينبغي حساب الخلايا باللون الأحمر لأنها تلامس الحدود العلوية أو اليمنى أو السفلية أو اليسرى للربع.
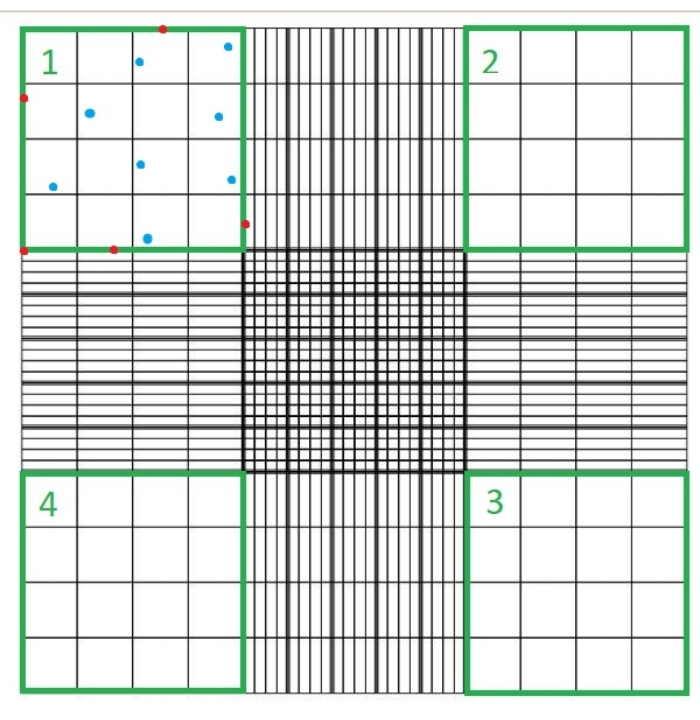
الشكل 1: عد الخلايا باستخدام حجرة مقياس الدم. يتم حساب أربعة أرباع باستخدام المجهر الضوئي. يتم تمثيل هذه الأرباع باللون الأخضر. إجمالي الخلايا المحسوبة في الصيغة المشار إليها في الخطوة 1.3.3 من البروتوكول الموصوف هنا هو مجموع عدد الخلايا في الأرباع 1 و 2 و 3 و 4. يجب حساب الخلايا المشار إليها باللون الأزرق ، بينما لا ينبغي حساب الخلايا باللون الأحمر لأنها تلامس الحدود العلوية أو اليمنى أو السفلية أو اليسرى للربع الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
2. تحضير الطبق للثقافة
- ضع حجم معلق الخلية A في أنبوب مخروطي سعة 15 مل. يعتمد الحجم المطلوب على عدد الخلايا. اضبط مستوى الصوت بحيث يكون عدد الخلايا 2.2 × 106 خلايا تقريبا للوحة ثقافة 100 مم.
- أضف 5 مل من وسط الاستزراع الكامل إلى الأنبوب ثم انقل محتويات الأنبوب إلى لوحة استزراع 100 مم. أضف 80 ميكرولتر من ثنائي ميثيل سلفوكسيد (DMSO) إلى لوحة الاستزراع.
ملاحظة: DMSO حساس للضوء ، وبالتالي يجب تخزينه في حاوية مقاومة للضوء أو تغطيته بمادة غير شفافة مثل رقائق الألومنيوم. - أضف 350 ميكرولتر من 1 مجم / مل من فوربول 12-ميريستات 13-أسيتات (PMA) إلى الأنبوب. يجب أن يكون التركيز النهائي ل PMA 35 نانوغرام / مل ، ويجب أن يكون تركيز DMSO 0.08٪.
تنبيه: PMA سامة ومسببة للتآكل ومسرطنة ، وبالتالي يجب التعامل معها بعناية فائقة. PMA حساس للضوء ، وبالتالي يجب تخزينه في حاوية مقاومة للضوء أو تغطيته بمادة غير شفافة مثل رقائق الألومنيوم. - أضف 4.27 مل من وسط الاستزراع بحيث يكون الحجم الكلي 10 مل. امزج محتويات الأنبوب عن طريق الإمالة ، ثم انقل المحتويات إلى لوحة ثقافة 100 مم. اترك الطبق في حاضنة زراعة الخلايا لمدة 5 أيام عند 37 درجة مئوية ، 5٪ CO2.
3. تحريض وعزل جزيئات فيروس إبشتاين بار
- بعد 5 أيام في الحاضنة ، قم بالطرد المركزي لمحتويات اللوحة عند 120 × جم لمدة 8 دقائق لتكوير الخلايا. اجمع المادة الطافية الخالية من الخلايا والتي تحتوي على الفيروسات وتخلص من حبيبات الخلية.
- جهاز طرد مركزي للطافي عند 16000 × جم لمدة 90 دقيقة عند 4 درجات مئوية لحبيبات جزيئات الفيروس. تخلص من المادة الطافية وأعد تعليق حبيبات الفيروس في 5 مل من وسط الثقافة.
ملاحظة: يمكن استخدام محلول ملحي مخزن بالفوسفات (PBS) لإعادة تعليق حبيبات الفيروس بدلا من وسط الاستزراع. - القسمة على التعليق الفيروسي الذي تم الحصول عليه في 20 أنبوبا ، يحتوي كل منها على 250 ميكرولتر من التعليق الفيروسي. قم بتخزين التعليق في درجة حرارة -80 درجة مئوية.
4. استخراج الحمض النووي من الجسيمات الفيروسية
تنبيه: يجب توخي الحذر الشديد عند التعامل مع الفينول ، لأنه سام وتآكل ولديه القدرة على التسبب في حروق شديدة. الفينول حساس للضوء ويتأكسد عند ملامسته للضوء أو الهواء. قم بتخزينه في وعاء مقاوم للضوء أو قم بدلا من ذلك بتغطية أنبوب الفينول بمادة غير شفافة مثل رقائق الألومنيوم.
- فصل البروتينات عن الحمض النووي
- أضف 500 ميكرولتر من الفينول المشبع ب TrisCl إلى أحد الأنابيب سعة 250 ميكرولتر. أضف 100 ميكرولتر من الماء (لزيادة حجم الطور المائي) وبئر دوامة للحصول على مستحلب وردي. جهاز طرد مركزي لمدة 15 دقيقة عند 9650 × جم.
- ترسيب الحمض النووي
- اجمع المادة الطافية (الطور المائي الشفاف) وانقلها إلى أنبوب طرد مركزي دقيق جديد سعة 1.5 مل.
- أضف ما يعادل 1/10 من حجم المادة الطافية من أسيتات الصوديوم الباردة (3 م ، درجة الحموضة 5.2) واخلطها عن طريق السحب لأعلى ولأسفل. أضف 1 ميكرولتر من 20 مجم / مل من الجليكوجين واخلطه عن طريق السحب.
ملاحظة: هذه الخطوة اختيارية ، لكن إضافة الجليكوجين يعزز ترسيب الحمض النووي ويسهل تصور حبيبات الحمض النووي. - أضف ثلاثة أضعاف حجم المادة الطافية من الإيثانول البارد بنسبة 100٪. يحفظ في درجة حرارة -80 درجة مئوية طوال الليل.
ملاحظة: يمكن إيقاف الإجراء هنا ليتم استئنافه في وقت لاحق. يمكن تخزين العينة في -80 درجة مئوية لمدة 1 ساعة ، أو بدلا من ذلك بين عشية وضحاها. التخزين بين عشية وضحاها يعزز ترسيب الحمض النووي وبالتالي يوصى به.
- عزل الحمض النووي الفيروسي
- في اليوم التالي ، جهاز طرد مركزي عند 9650 × جم لمدة 15 دقيقة عند 4 درجات مئوية وتخلص من المادة الطافية للحصول على حبيبات الحمض النووي.
- اغسل الحبيبات ثلاث مرات باستخدام 1 مل من الإيثانول البارد بنسبة 70٪ ، وأجهزة الطرد المركزي عند 9650 × جم لمدة 15 دقيقة ، وتخلص من المادة الطافية.
- جفف الحبيبات بالهواء لمدة 10 دقائق. أعد تعليق الحبيبات في 10-50 ميكرولتر من الماء المقطر الخالي من النيوكلياز (حسب حجم حبيبات الحمض النووي).
- قم بتخزين العينات في -20 درجة مئوية للمعالجة اللاحقة أو عند 4 درجات مئوية طوال الليل لضمان أقصى انحلال للحمض النووي متبوعا بالتخزين عند -20 درجة مئوية. بدلا من ذلك ، تابع مباشرة مع الخطوة 5.
5. التحقق من تركيز الحمض النووي ونقاوته
- بعد تنظيف قاعدة مقياس الطيف الضوئي الدقيق باستخدام ممسحة مهمة حساسة ، قم بتحميل 1 ميكرولتر من إعداد الحمض النووي.
- لاحظ تركيز الحمض النووي (DNA) في العينة. تحقق من نسب الامتصاص في كل
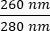 من و
من و 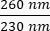 . سوف يمتص الحمض النووي عند 260 نانومتر ، والبروتينات عند 280 نانومتر ، والمواد العضوية مثل الفينول سوف تمتص عند 230 نانومتر. تعتبر نسبة 1.8-2 كافية لتفاعل البوليميراز المتسلسل في الوقت الفعلي.
. سوف يمتص الحمض النووي عند 260 نانومتر ، والبروتينات عند 280 نانومتر ، والمواد العضوية مثل الفينول سوف تمتص عند 230 نانومتر. تعتبر نسبة 1.8-2 كافية لتفاعل البوليميراز المتسلسل في الوقت الفعلي.
6. القياس الكمي عن طريق تفاعل البلمرة المتسلسل في الوقت الحقيقي
- تحضير خلطات تفاعل PCR
- ضع 5 ميكرولتر من مزيج تفاعل البوليميراز المتسلسل الأخضر في الوقت الفعلي SYBR في أنابيب PCR سعة 0.2 مل. أضف إلى كل أنبوب 1 ميكرولتر من 7.5 بمول / ميكرولتر التمهيدي الأمامي و 1 ميكرولتر من 7.5 بمول / ميكرولتر التمهيدي العكسي. تسلسل التمهيدي إلى الأمام: 5'-CCCTAGTGGTTTCGGACA-3'; تسلسل التمهيدي العكسي: 5'-ACTTGCAAATGCTCTAGGCG-3'. الجين المضخم لتحديد رقم نسخة جينوم EBV هو جين فيروس إبشتاين بار الصغير RNA 2 (EBER-2).
- إلى أحد الأنابيب ، أضف 2 ميكرولتر من الماء الخالي من النيوكلياز و 1 ميكرولتر من الحمض النووي الفيروسي من الخطوة 4. الحجم الكلي لخليط التفاعل هو 10 ميكرولتر.
ملاحظة: اعتمادا على تركيز الحمض النووي في العينة ، قد تكون هناك حاجة إلى خطوة تخفيف. يجب ملاحظة عامل التخفيف F وسيتم دمجه في الصيغة في الخطوة 6.3. - قم بإعداد أنابيب أخرى سيتم استخدامها كمعايير مع أرقام نسخ جينوم EBV المعروفة (1000 و 2000 و 5000 و 10000 و 54000 نسخة).
- قم بتشغيل مخاليط تفاعل البوليميراز المتسلسل بدءا من خطوة أولية للتنشيط عند 95 درجة مئوية لمدة 5 دقائق ، ثم 40 دورة عند 95 درجة مئوية و 58 درجة مئوية (التلدين) لمدة 15 ثانية و 30 ثانية على التوالي.
- قم بإنشاء منحنى قياسي qPCR عن طريق رسم قيم Ct للمعايير مقابل سجل عدد نسخ جينوم EBV لكل أنبوب قياسي. باستخدام معادلة مخطط المنحنى القياسية ، اشتق عدد نسخ جينوم EBV في أنبوب PCR الذي يحتوي على الحمض النووي الفيروسي المستحث. بعد ذلك ، استخدم الصيغة التالية لحساب تركيز المستحضر الفيروسي المستحث:

حيث X هو عدد نسخ جينوم EBV المشتقة من المنحنى القياسي و F هو عامل التخفيف المستخدم لإعداد الحمض النووي المستخدم لكل تفاعل PCR.
7. التحقق من النشاط البيولوجي / العدوى للجزيئات الفيروسية
- نقل خلايا BC-3 من صفيحة استزراع 100 مم عند التقاء 80٪ إلى أنبوب مخروطي سعة 15 مل. كثافة البذر لخلايا P3HR-1 هي 1 × 106 خلايا / مل. الحفاظ على وسط زراعة RPMI الكامل (79٪ وسط زراعة RPMI ، 20٪ مصل بقري جنيني ، 1٪ مضاد حيوي Pen-Strep) عند 37 درجة مئوية و 5٪ CO2 ، والمرور كل 3-4 أيام.
- عد خلايا BC-3 بنفس الطريقة التي تم بها حساب خلايا P3HR-1 باتباع الخطوة 1. إلى لوحة 96 بئر ، أضف 105 خلايا BC-3 إلى كل بئر. استخدم ثلاثة أو ستة أو تسعة أو 12 بئرا لضمان أهمية النتائج وتقليل الأخطاء.
- أضف كمية من المخزون الفيروسي إلى كل بئر ، اعتمادا على تركيز المستحضر الفيروسي المحدد في الخطوة 6.3. يمكن أن تختلف وزارة الداخلية ، وسيكشف تحسين هذا البروتوكول عن أفضل MOI للعدوى (يوصى بنطاق MOI من 2-50). تأكد من أن الحجم الكلي للخليط الموجود في كل بئر هو 250 ميكرولتر.
- لتحديد الحجم المطلوب ، يجب معرفة تركيز المخزون الفيروسي ، ويجب اختيار وزارة الداخلية. على سبيل المثال ، إذا كان MOI هو 2 ، فيجب أن يكون عدد الجسيمات الفيروسية المضافة ضعف عدد الخلايا. احسب الحجم V للمخزون الفيروسي المطلوب باستخدام الصيغة:
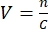 ، مع n هو عدد الجسيمات الفيروسية المطلوبة ، و C التركيز المعروف للمخزون الفيروسي
، مع n هو عدد الجسيمات الفيروسية المطلوبة ، و C التركيز المعروف للمخزون الفيروسي
- لتحديد الحجم المطلوب ، يجب معرفة تركيز المخزون الفيروسي ، ويجب اختيار وزارة الداخلية. على سبيل المثال ، إذا كان MOI هو 2 ، فيجب أن يكون عدد الجسيمات الفيروسية المضافة ضعف عدد الخلايا. احسب الحجم V للمخزون الفيروسي المطلوب باستخدام الصيغة:
- احتضان محتويات لوحة 96 بئر لمدة 5 أيام. بعد 5 أيام ، انقل محتويات كل بئر إلى أنبوب سعة 1.5 مل.
- قم بالطرد المركزي للأنابيب بسرعة 120 × جم لمدة 8 دقائق لفصل الخلايا عن وسط الاستزراع المحتوي على الفيروس. إخضاع كريات الخلايا وكذلك المواد الطافية لاستخراج الحمض النووي متبوعا بقياس كمية تفاعل البوليميراز المتسلسل في الوقت الفعلي للتحقق من وجود الجينومات الفيروسية في كل جزء ، وبالتالي تقييم عدوى الجسيمات الفيروسية.
النتائج
الهدف من هذا الإجراء هو عزل جزيئات EBV في معلق بعيار فيروسي معروف ، والذي يمكن استخدامه لاحقا لنمذجة عدوى EBV. وبالتالي ، من الأهمية بمكان استخدام التركيزات المثلى للكواشف المختلفة للحصول على أعلى عائد EBV من الإجراء.
تم إجراء تجربة تحسين لتحديد تركيزات PMA و DMSO التي من شأنها أن ت?...
Discussion
يعد إنتاج جزيئات EBV ضروريا لفهم بيولوجيا هذا الفيروس وكذلك الأمراض المرتبطة به. وصفنا هنا إنتاج هذه الجسيمات من خط الخلية P3HR-1. خط الخلية هذا ليس خط المنتج الوحيد ل EBV. في الواقع ، تم أيضا عزل جزيئات EBV من خلايا B95-821,22 وكذلك خط خلايا Raji18,19
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم تمويل هذا العمل من خلال منح لقسم الطوارئ من صندوق الأسمر للأبحاث والمجلس الوطني اللبناني للبحوث العلمية (L-CNRS) وخطة الممارسة الطبية (MPP) في الجامعة الأمريكية في بيروت.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL thin-walled PCR tubes | Thermo Scientific | AB0620 | Should be autoclaved before use |
| 0.2-10 µL Microvolume Filter Tips | Corning | 4807 | Should be autoclaved before use |
| 0.5-10 µL Pipette | BrandTech | 704770 | |
| 10 mL Disposable Serological Pipette | Corning | 4488 | |
| 1000 µL Filtered Pipette Tips | QSP | TF-112-1000-Q | |
| 100-1000 µL Pipette | Eppendorf | 3123000063 | |
| 100x20 mm Cuture Plates | Sarstedt | 83.1802 | |
| 10-100 µL Pipette | BrandTech | 704774 | |
| 15 mL Conical Tubes | Corning | 430791 | |
| 200 µL Filtered Pipette Tips | QSP | TF-108-200-Q | |
| 20-200 µL Pipette | Eppendorf | 3123000055 | |
| 50 mL Conical Tubes | Corning | 430828 | |
| CFX96 Real-Time C-1000 Thermal Cycler | Bio-Rad | 184-1000 | |
| DMSO | Amresco | 0231 | |
| DNase/RNase Free Water | Zymo Research | W1001-1 | |
| EBER Primers | Macrogen | N/A | Custom Made Primers |
| EBV DNA Control (Standards) | Vircell | MBC065 | |
| Ethanol (Laboratory Reagent Grade) | Fischer Chemical | E/0600DF/17 | |
| Fetal Bovine Serum | Sigma | F9665 | |
| Fresco 21 MicroCentrifuge | Thermo Scientific | 10651805 | |
| Glycogen Solution | Qiagen | 158930 | |
| Hemocytometer | BOECO | BOE 01 | |
| Inverted Light Microscope | Zeiss | Axiovert 25 | |
| iTaq Universal SYBR Green Supermix | Bio-Rad | 172-5121 | |
| Microcentrifuge Tube | Costar (Corning) | 3621 | Should be autoclaved before use |
| P3HR-1 Cell Line | ATCC | HTB-62 | |
| Penicillin-Streptomycin Solution | Biowest | L0022 | |
| Phenol | VWR | 20599.297 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma-Aldrich | P8139 | |
| Pipette Filler | Thermo Scientific | 9501 | |
| Precision Wipes | Kimtech | 7552 | |
| RPMI-1640 Culture Medium | Sigma | R7388 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | |
| Sodium Acetate | Riedel-de Haën (Honeywell) | 25022 | |
| Spectrophotomer | DeNovix | DS-11 | |
| Tris-HCl | Sigma | T-3253 | |
| Trypan Blue Solution | Sigma | T8154 | |
| Water Jacketed CO2 Incubator | Thermo Scientific | 4121 |
References
- Epstein, M. A., Achong, B. G., Barr, Y. M. Virus particles in cultured lymphoblasts from Burkitt's lymphoma. Lancet. 1 (7335), 702-703 (1964).
- Sample, J., et al. Epstein-Barr virus types 1 and 2 differ in their EBNA-3A, EBNA-3B, and EBNA-3C genes. Journal of Virology. 64 (9), 4084-4092 (1990).
- Chang, M. S., Kim, W. H. Epstein-Barr virus in human malignancy: a special reference to Epstein-Barr virus associated gastric carcinoma. Cancer Research and Treatment. 37 (5), 257-267 (2005).
- Manet, E., Schwab, M. . Encyclopedia of Cancer. , 1602-1607 (2017).
- Babcock, G. J., Decker, L. L., Volk, M., Thorley-Lawson, D. A. EBV persistence in memory B cells in vivo. Immunity. 9 (3), 395-404 (1998).
- Khan, G., Miyashita, E. M., Yang, B., Babcock, G. J., Thorley-Lawson, D. A. Is EBV persistence in vivo a model for B cell homeostasis. Immunity. 5 (2), 173-179 (1996).
- Jha, H. C., Banerjee, S., Robertson, E. S. The role of gammaherpesviruses in cancer pathogenesis. Pathogens. 5 (1), 18 (2016).
- El-Sharkawy, A., Al Zaidan, L., Malki, A. Epstein-Barr virus-associated malignancies: roles of viral oncoproteins in carcinogenesis. Frontiers in Oncology. 8, 265 (2018).
- Vereide, D., Sugden, B. Insights into the evolution of lymphomas induced by Epstein-Barr virus. Advances in Cancer Research. 108, 1-19 (2010).
- Vereide, D. T., Sugden, B. Lymphomas differ in their dependence on Epstein-Barr virus. Blood. 117 (6), 1977-1985 (2011).
- Houen, G., Trier, N. H. Epstein-Barr virus and systemic autoimmune diseases. Frontiers in Immunology. 11, 587380 (2020).
- Ortiz, A. N., et al. Impact of Epstein-Barr virus infection on inflammatory bowel disease (IBD) clinical outcomes. Revista Espanola de Enfermedades Digestivas. 114 (5), 259-265 (2021).
- Caplazi, P., et al. Mouse models of rheumatoid arthritis. Veterinary Pathology. 52 (5), 819-826 (2015).
- Kiesler, P., Fuss, I. J., Strober, W. Experimental models of inflammatory bowel diseases. Cellular and Molecular Gastroenterology and Hepatology. 1 (2), 154-170 (2015).
- Warde, N. Experimental arthritis: EBV induces arthritis in mice. Nature Reviews Rheumatology. 7 (12), 683 (2011).
- Jog, N. R., James, J. A. Epstein Barr virus and autoimmune responses in systemic lupus erythematosus. Frontiers in Immunology. 11, 623944 (2020).
- Shimizu, N., Yoshiyama, H., Takada, K. Clonal propagation of Epstein-Barr virus (EBV) recombinants in EBV-negative Akata cells. Journal of Virology. 70 (10), 7260-7263 (1996).
- Hsu, C. H., et al. Induction of Epstein-Barr virus (EBV) reactivation in Raji cells by doxorubicin and cisplatin. Anticancer Research. 22, 4065-4071 (2002).
- Nutter, L. M., Grill, S. P., Li, J. S., Tan, R. S., Cheng, Y. C. Induction of virus enzymes by phorbol esters and n-butyrate in Epstein-Barr virus genome-carrying Raji cells. Cancer Research. 47 (16), 4407-4412 (1987).
- Fresen, K. O., Cho, M. S., zur Hausen, H. Recovery of transforming EBV from non-producer cells after superinfection with non-transforming P3HR-1 EBV. International Journal of Cancer. 22 (4), 378-383 (1978).
- Glaser, R., Tarr, K. L., Dangel, A. W. The transforming prototype of Epstein-Barr virus (B95-8) is also a lytic virus. International Journal of Cancer. 44 (1), 95-100 (1989).
- Sairenji, T., et al. Inhibition of Epstein-Barr virus (EBV) release from P3HR-1 and B95-8 cell lines by monoclonal antibodies to EBV membrane antigen gp350/220. Journal of Virology. 62 (8), 2614-2621 (1988).
- Savage, A., et al. An assessment of the population of cotton-top tamarins (Saguinus oedipus) and their habitat in Colombia. PLoS one. 11 (12), 0168324 (2016).
- Kallin, B., Klein, G. Epstein-Barr virus carried by raji cells: a mutant in early functions. Intervirology. 19 (1), 47-51 (1983).
- Fresen, K. O., Cho, M. S., Hausen, H. Z. Recovery of transforming EBV from non-producer cells after superinfection with non-transforming P3HR-1 EBV. International Journal of Cancer. 22 (4), 378-383 (1978).
- Bounaadja, L., Piret, J., Goyette, N., Boivin, G. Evaluation of Epstein-Barr virus, human herpesvirus 6 (HHV-6), and HHV-8 antiviral drug susceptibilities by use of real-time-PCR-based assays. Journal of Clinical Microbiology. 51 (4), 1244-1246 (2013).
- Buelow, D., et al. Comparative evaluation of four real-time PCR methods for the quantitative detection of Epstein-Barr virus from whole blood specimens. Journal of Molecular Diagnostics. 18 (4), 527-534 (2016).
- Wu, D. Y., Kalpana, G. V., Goff, S. P., Schubach, W. H. Epstein-Barr virus nuclear protein 2 (EBNA2) binds to a component of the human SNF-SWI complex, hSNF5/Ini1. Journal of Virology. 70 (9), 6020-6028 (1996).
- Li, C., et al. EBNA2-deleted Epstein-Barr virus (EBV) isolate, P3HR1, causes Hodgkin-like lymphomas and diffuse large B cell lymphomas with type II and Wp-restricted latency types in humanized mice. PLoS Pathogens. 16 (6), 1008590 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved