A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحكم في جزء الجسيمات في سقالات الجسيمات الملدنة الصغيرة التي يسهل اختراقها لثقافة الخلية 3D
In This Article
Summary
إن تقليل التباين في جزء الجسيمات داخل السقالات الحبيبية يسهل التجريب القابل للتكرار. يصف هذا العمل طرق توليد سقالات حبيبية مع كسور الجسيمات الخاضعة للرقابة لتطبيقات هندسة الأنسجة في المختبر .
Abstract
الكبسولات الهلامية الدقيقة هي اللبنات الأساسية لسقالات الجسيمات الملدنة الصغيرة التي يسهل اختراقها (MAP) ، والتي تعمل كمنصة لكل من زراعة الخلايا في المختبر وإصلاح الأنسجة الحية . في هذه السقالات الحبيبية ، تتيح المسامية الفطرية الناتجة عن الفراغ الفراغي بين الكبسولات الهلامية الدقيقة تسلل الخلايا والهجرة. يعد التحكم في جزء الفراغ وجزء الجسيمات أمرا بالغ الأهمية لتصميم سقالة MAP ، حيث أن المسامية هي إشارة نشطة بيولوجيا للخلايا. يمكن إنشاء الهلاميات الدقيقة الكروية على جهاز الموائع الدقيقة للتحكم في الحجم والشكل ثم تجفيفها بالتجميد باستخدام طرق تمنع تكسير شبكة البوليمر. عند إعادة الإماهة ، تؤدي الهلاميات الدقيقة المجففة بالتجميد إلى كسور جسيمات خاضعة للرقابة في سقالات MAP. أدى تنفيذ هذه الطرق لتجفيف الميكروجيل إلى دراسات قابلة للتكرار تظهر تأثير جزء الجسيمات على انتشار الجزيئات الكبيرة وانتشار الخلايا. سيغطي البروتوكول التالي تصنيع الكبسولات الهلامية الدقيقة وتجفيفها وإعادة إماهتها للتحكم في جزء الجسيمات في سقالات MAP ، بالإضافة إلى تلدين الهلاميات الدقيقة من خلال الربط الحيوي المتعامد لزراعة الخلايا ثلاثية الأبعاد في المختبر.
Introduction
سقالات الجسيمات الملدنة الصغيرة التي يسهل اختراقها (MAP) هي فئة فرعية من المواد الحبيبية التي ترتبط فيها كتل البناء microgel (μgel) لتشكيل سقالة مسامية سائبة. مع البنية الدقيقة الفريدة لهذه السقالات الحبيبية ، فإن المسامية الفطرية الناتجة عن مساحة الفراغ بين الميكروجيل الكروي المترابط تدعم تسلل الخلايا المتسارعة والهجرة1. يمكن تصنيع اللبنات الأساسية للميكروجيل لسقالات MAP من كل من البوليمرات الاصطناعية والطبيعية مع تعديلات كيميائية2. تسلط الطرق الموضحة هنا الضوء على وجه التحديد على استخدام المواد الهلامية الدقيقة المكونة من العمود الفقري لحمض الهيالورونيك (HA) المعدل بمقابض نوربورنين الوظيفية (NB). يدعم المقبض الوظيفي NB على بوليمر HA تفاعلات كيمياء النقر لتشكيل الهلاميات الدقيقة وربطها معا لتوليد سقالات MAP 3,4. تم استخدام العديد من المخططات لربط الهلاميات الدقيقة معا (أي التلدين) ، مثل تفاعلات الأنزيمية1 ، 5,6 القائمة على الضوء ، وكيمياء النقر الخالية من المواد المضافة 3,7. تم وصف كيمياء النقر الخالية من المواد المضافة في هذا العمل ، باستخدام اقتران ديلز-ألدر للطلب العكسي للإلكترون رباعي-نوربورنين لربط الهلاميات الدقيقة HA-NB.
لتصنيع سقالات MAP ، يقوم المستخدمون أولا بإنشاء كتل بناء microgel باستخدام مستحلبات عكسية إما في أنظمة الدفعات أو داخل أجهزة الموائع الدقيقة ، وكذلك مع الرش الكهروهيدروديناميكي أو الطباعة الحجرية أو التجزئة الميكانيكية2. تم وصف إنتاج الهلاميات الدقيقة الكروية HA-NB بشكل جيد وتم الإبلاغ عنها سابقا باستخدام كل من مستحلب الدفعات2 وتقنيات توليد قطرات الموائع الدقيقة8،9،10،11. في هذا العمل ، تم إنشاء كبسولات هلامية كروية HA-NB على منصة موائع دقيقة تركز على التدفق للتحكم في الحجم والشكل ، كما هو موضح سابقا8،9،10. بعد التنقية ، توجد الهلاميات الدقيقة في تعليق مائي ويجب أن تتركز للحث على حالة انحشار. عند التشويش ، تظهر الهلاميات الدقيقة خصائص ترقق القص ، مما يسمح لها بالعمل كمواد قابلة للحقن وملء الفراغ1. تتمثل إحدى طرق إحداث حالة انحشار في تجفيف الكبسولات الهلامية الدقيقة عن طريق التجفيد ، أو التجفيف بالتجميد ، ثم إعادة ترطيب المنتج المجفف لاحقا في حجم متحكم فيه12. بدلا من ذلك ، يمكن إزالة المخزن المؤقت الزائد من ملاط microgel عن طريق الطرد المركزي فوق مصفاة أو مع الإزالة اليدوية للمخزن المؤقت من حبيبات microgel إما عن طريق الشفط أو باستخدام مادة ماصة. ومع ذلك ، فإن استخدام الطرد المركزي لتجفيف الهلاميات الدقيقة يمكن أن يولد نطاقا متغيرا للغاية من كسور الجسيمات والكسور الفارغة عند صنع السقالات الحبيبية12. تم وصف تقنيات تجفيف الكبسولات الهلامية الدقيقة باستخدام 70٪ IPA للكبسولات الهلامية الدقيقة13 من البولي إيثيلين جلايكول (PEG) ، والزيوت المفلورة للجيل الجيلاتيني ميثاكريلويل (GelMa)14 ، و 70٪ من الإيثانول للهلاميات الدقيقةHA 12. يسلط هذا البروتوكول الضوء على طرق تجفيف الهلاميات الدقيقة HA الكروية بالتجميد باستخدام 70٪ من الإيثانول ، وهو كاشف مختبري قياسي ، للاحتفاظ بخصائص microgel الأصلية أثناء عملية التجفيف. يمكن وزن المواد الهلامية الدقيقة HA المجففة بالتجميد وإعادة ترطيبها بنسب وزن يحددها المستخدم للتحكم في كسور الجسيمات النهائية في سقالات MAP12.
تعتمد الخطوة الأخيرة في تشكيل سقالة MAP على تلدين الكبسولات الهلامية الدقيقة لإنشاء سقالة كبيرة ومسامية1. من خلال استخدام مكونات المصفوفة خارج الخلية الأصلية واستخدام مخططات التلدين المتعامد الحيوي ، تعمل سقالات MAP كمنصة متوافقة حيويا لكل من زراعة الخلايا في المختبر وإصلاح الأنسجة الحية 3. من خلال هذه الأساليب ، يمكن تصنيع سقالات MAP من كتل بناء HA-NB مع كسور الجسيمات المحددة من قبل المستخدم لاستخدامها في تطبيقات هندسة الأنسجة12. يصف البروتوكول التالي إنتاج الموائع الدقيقة للكبسولات الهلامية الدقيقة HA-NB متبوعا بالتجفيف بالتجميد والإماهة للتحكم في جزء الجسيمات في سقالات MAP. أخيرا ، يتم وصف خطوات تلدين الهلاميات الدقيقة باستخدام الكيمياء الحيوية المتعامدة لتجارب زراعة الخلايا 3D في المختبر .
Protocol
1. تصنيع جهاز الموائع الدقيقة
- الطباعة الحجرية الناعمة
ملاحظة: يصف هذا البروتوكول تصنيع الجهاز لتصميم جهاز الموائع الدقيقة الذي يركز على التدفق من de Wilson et al.9. ومع ذلك ، يمكن استخدام هذا البروتوكول مع أي تصميم جهاز على رقاقة SU-8. يمكن لصق الرقاقة على طبق بتري ، ثم تحتاج إلى أن يتم silanized لمنع التصاق PDMS بميزات الرقاقة15.- امزج قاعدة المطاط الصناعي polydimethylsiloxane (PDMS) مع عامل المعالجة (انظر جدول المواد) بنسبة 10: 1. تحضير ما يقرب من 100 غرام لتغطية رقاقة مع ~ 5 مم PDMS. يسكب خليط PDMS على الرقاقة ويتخلص من الغازات في مجفف لمدة 30 دقيقة تقريبا. بمجرد اختفاء جميع الفقاعات ، ضعها في فرن على حرارة 60 درجة مئوية لمدة 2 ساعة على الأقل لعلاج PDMS.
- استخدم سكينا لتتبع معلمة الجهاز برفق دون تكسير الرقاقة ؛ ثم ، قشر PDMS بعناية من الرقاقة. استخدم لكمة خزعة 1 مم (انظر جدول المواد) لإنشاء قنوات المدخل والمخرج.
ملاحظة: كن لطيفا عند ثقب جهاز الموائع الدقيقة. يمكن أن تتسبب التمزقات أو التمزقات حول قنوات المدخل أو المخرج في حدوث تسربات أثناء إنتاج الميكروجيل. - استخدم شريطا لإزالة الغبار من الجهاز على جانب الميزة. ضع الأجهزة ونظف الشرائح الزجاجية على لوح تسخين عند 135 درجة مئوية لمدة 15 دقيقة على الأقل لإزالة الرطوبة.
- في غطاء الدخان ، استخدم مسدس بلازما الإكليل (انظر جدول المواد) على ارتفاع على كل من الشرائح الزجاجية والأجهزة (الجانب المميز مكشوف) لمدة 30 ثانية تقريبا ، ثم اربطها معا بسرعة. اضغط برفق لضمان إحكام جيد بين الجهاز والشريحة الزجاجية. ضع الأجهزة في فرن 60 درجة مئوية طوال الليل لتأمين السند.
2. إنتاج الموائع الدقيقة من المواد الهلامية الدقيقة لحمض الهيالورونيك (HA) مع مقابض وظيفية نوربورنين (NB)
- توليف HA-NB
ملاحظة: تم تكييف تخليق HA-norbornene (HA-NB) من Darling et al.3 باستخدام 79 كيلو دالتون من الصوديوم HA مع المكافئات المولية ل 1: 1.5: 2.5 من وحدات تكرار HA إلى 4- (4،6-ثنائي ميثوكسي-1،3 ،5-تريازين-2-يل) -4-ميثيل مورفولينيوم كلوريد (DMTMM) إلى 5-نوربورنين-2-ميثيل أمين (NMA).- وزن المتفاعلات. قم بإذابة HA عند 20 مجم / مل في محلول MES 200 mM (درجة الحموضة ~ 6) عن طريق التقليب في دورق أو دورق على طبق تقليب. بمجرد الذوبان ، أضف DMTMM إلى محلول HA واتركه يتفاعل لمدة 20 دقيقة تقريبا في درجة حرارة الغرفة. على سبيل المثال ، يمكن استخدام 1 جم HA + 1.09 جم DMTMM + 845 ميكرولتر NMA.
- أضف NMA قطرة إلى حل HA / DMTMM. أضف البارافيلم إلى فتحة وعاء التفاعل لتقليل التبخر وتغطية وعاء التفاعل بورق الألمنيوم. استمر في التقليب مع السماح للتفاعل بالاستمرار لمدة 24 ساعة تقريبا.
- بعد 24 ساعة ، قم بتبريد 200 إيثانول مقاوم (حوالي 10 أضعاف حجم التفاعل). على طبق التحريك ، انقل التفاعل بالتنقيط إلى الإيثانول المبرد لترسيب HA-NB واستمر في التقليب عند 200-300 دورة في الدقيقة لمدة 20 دقيقة.
- انقل المحلول إلى أنابيب مخروطية سعة 50 مل ، ثم قم بالطرد المركزي بسرعة 5000 × جم لمدة 10 دقائق. اسكب الإيثانول الزائد للتخلص منه كنفايات. في هذه المرحلة ، يجب أن يكون منتج HA-NB عبارة عن كريات بيضاء في الأنابيب المخروطية. اسحب المكنسة الكهربائية على HA-NB في مجففة لتجف طوال الليل.
- تنقية HA-NB باستخدام 12-14 كيلو دالتون قطع الوزن الجزيئي أنابيب غسيل الكلى السليلوز (انظر جدول المواد). قم بإذابة HA-NB في محلول كلوريد الصوديوم 2 M وانقله إلى أنبوب غسيل الكلى. اربط الأنبوب وثبته بالمشابك ، إذا لزم الأمر. انقل أنبوب غسيل الكلى المملوء إلى دلو به 5 لتر من الماء عالي النقاء وقم بغسيل HA-NB ضد الماء طوال الليل.
- في اليوم التالي ، قم بإزالة الماء واستبدله بمحلول 1 M NaCl لمدة 30 دقيقة. قم بإزالة محلول كلوريد الصوديوم ، ثم قم بغسيل الكلى ضد الماء عالي النقاء لمدة 3 أيام ، ليحل محل الماء يوميا.
- قم بتصفية المنتج الذي تم تحليله باستخدام مرشح مفرغ من الهواء 0.2 ميكرومتر ، ثم انقل المنتج المصفى إلى أنابيب مخروطية سعة 50 مل.
- أضف النيتروجين السائل إلى وعاء مبرد وقم بتجميد أنابيب HA-NB لمدة 10 دقائق. بعد ذلك ، قم بإزالة الأنابيب المخروطية بالملقط وقم بإزالة الغطاء والغطاء بسرعة بمنديل من الدرجة المعملية (انظر جدول المواد). قم بتأمين المنديل بشريط مطاطي وانقله إلى حاوية أو غرفة تجفيف بالتجميد (انظر جدول المواد) وقم بتجميد التجميد. قم بتخزين المنتج المجفف بالتجميد في درجة حرارة -20 درجة مئوية.
تنبيه: النيتروجين السائل مادة خطرة. ارتداء معدات الحماية الشخصية المناسبة عند العمل مع النيتروجين السائل. - حدد تعديل النوربورنين عن طريق إذابة HA-NB عند 10 مجم / مل في D2O والتحليل عبر البروتون NMR (الشكل 1A) 16.
- لتحديد مقدار الأداء الوظيفي ، قم أولا بمعايرة ذروة مذيب D2O إلى 4.8 جزء في المليون. دمج ذروة بروتونات ميثيل HA (δ2.05) ومعايرة التكامل إلى 3.0. بعد ذلك ، قم بدمج قمم مجموعات نوربورنين المعلقة عند δ6.33 و δ6.02 (بروتونات الفينيل ، إندو). تطبيع تكامل هذه القمم مع العدد المقابل من البروتونات لتحديد متوسط درجة التعديل3.
- إعداد السلائف ميكروجيل HA-NB
- قم بإعداد 50 mM HEPES buffer (درجة الحموضة 7.5) وتصفية المخزن المؤقت المعقم باستخدام مرشح يحركه الفراغ 0.2 ميكرومتر. باستخدام المخزن المؤقت HEPES ، قم بإعداد مخزون 50 مللي مول من فينيل الليثيوم (2،4،6 ، -ثلاثي ميثيل بنزويل) فوسفينات (LAP) وعامل اختزال تريس (2-كربوكسي إيثيل) فوسفين (TCEP). احتفظ بمحلول LAP بعيدا عن الضوء.
- قم بإعداد مكونات سلائف microgel الأخرى عن طريق تحضير مخزون 50 mM من رابط ثنائي ثيول وببتيد RGD في الماء المقطر المعقم. قم بوزن HA-NB وقم بإذابته في محلول HEPES لتحضير مرق 10 مجم / مل.
ملاحظة: يمكن استخدام روابط ثنائية ثيول مختلفة للتشابك الداخلي للكبسولات الهلامية الدقيقة بناء على تفضيل المستخدم. تم إدراج كل من الرابط القابل للتحلل (أي MMP-cleavable) وغير القابل للتحلل (dithiothreitol أو DTT) في جدول المواد. يتم تضمين ببتيد RGD في تركيبة microgel لتعزيز التصاق الخلايا في سقالات MAP ، ولكن يمكن إزالة هذا المكون واستبداله بحجم متساو من المخزن المؤقت HEPES. - اجمع مكونات السلائف مع التركيزات النهائية 9.9 mM LAP و 0.9375 mM TCEP (4 thiol / TCEP) و 2.8 mM di-thiol linker و 1 mM RGD peptide و 3.5 wt٪ (w / v) HA-NB عن طريق إضافة مخزن HEPES إضافي للوصول إلى الحجم النهائي المطلوب. امزج السلائف جيدا باستخدام ماصة إزاحة موجبة.
- باستخدام ماصة P1000 ، اسحب الخليط بالكامل ببطء. ضع الطرف على نهاية حقنة سعة 1 مل وأخرج الطرف من الماصة. اسحب مكبس المحقنة لتحميل الخليط في المحقنة ، ثم أضف مرشحا 0.2 ميكرومتر في نهاية المحقنة وقم بالتصفية في أنبوب طرد مركزي دقيق جديد سعة 1.5 مل. جهاز طرد مركزي لمحلول السلائف المصفى لإزالة الفقاعات الناتجة أثناء التصفية.
- مرة أخرى ، باستخدام ماصة P1000 ، اسحب السلائف المفلترة ببطء مع الحرص على عدم إنشاء فقاعات. إذا كانت هناك فقاعات ، فاضغط برفق على الطرف حتى تزيح وتطفو إلى الأعلى.
- ضع الطرف على نهاية حقنة سعة 1 مل وأخرج الطرف من الماصة. حافظ على المحقنة عمودية واسحب مكبس المحقنة ببطء حتى يصبح محلول السلائف بالكامل في المحقنة. أضف إبرة ذات طرف حاد إلى المحقنة وادفع السلائف عبر طرف الإبرة. لف المحقنة بورق القصدير لإبعادها عن الضوء.
- إعداد محلول معسر ميكروجيل
- تحضير 5٪ v / v Span-80 في زيت معدني أبيض ثقيل وتخلط جيدا. جفف لإزالة الفقاعات. احتفظ بخليط الفاعل بالسطح / الزيت في درجة حرارة الغرفة ملفوفا بورق الألمنيوم. تخلط جيدا وتجفف قبل كل استخدام.
- استخدم حقنة سعة 5 مل لسحب خليط الزيت / الفاعل بالسطح (تقليل الفقاعات) حتى تصبح المسافة بين المكبس وقبضة الإصبع مساوية تقريبا لمسافة حقنة السلائف. أضف إبرة حادة إلى المحقنة وادفع الزيت عبر طرف الإبرة.
- إعداد جهاز الموائع الدقيقة
- أضف إبرة حادة إلى حقنة سعة 1 مل واملأها بمحلول معالجة اصطناعي كاره للماء (انظر جدول المواد). قم بتدفق المحلول برفق عبر جهاز الموائع الدقيقة حتى يتجمع عند كل مدخل / مخرج. اترك المحلول يجف في الجهاز على الطاولة لمدة 30 دقيقة تقريبا ، ثم اسحب المكنسة الكهربائية على المخرج لإزالة المحلول الزائد. تأمين الجهاز مع المشابك على المجهر الطاولة.
- لف أنبوبا مخروطيا سعة 15 مل بورق القصدير وضعه في رف أنبوب ليكون بمثابة حاوية تجميع ميكروجيل. استخدم حاملا حلقيا بمشبك لوضع مسبار ضوء الأشعة فوق البنفسجية في فتحة أنبوب التجميع. استخدم كاشف الأشعة فوق البنفسجية (انظر جدول المواد) لقياس شدة الأشعة فوق البنفسجية ، وتحريك المسبار حتى يتم تحقيق 20 ميغاواط / سم2 . أطفئ ضوء الأشعة فوق البنفسجية حتى وقت لاحق.
- قطع الأنابيب بطول يصل من جهاز الموائع الدقيقة إلى حاوية التجميع. في أحد طرفي الأنبوب ، قم بقطع زاوية 45 درجة. أدخل الطرف المائل للأنبوب برفق في قناة المخرج.
ملاحظة: كن لطيفا عند إدخال الأنبوب في جهاز الموائع الدقيقة. يمكن أن تتسبب التمزقات أو التمزقات حول قنوات المدخل أو المخرج في حدوث تسربات أثناء إنتاج الميكروجيل. - قم بتأمين كل من محاقن السلائف ومحاقن الطور الزيتي على مضخة مزدوجة المحاقن (انظر جدول المواد). قطع قطعتين أخريين من الأنابيب بطول يصل من نصائح المحاقن إلى جهاز الموائع الدقيقة. في أحد طرفي كل أنبوب ، اقطع زاوية 45 درجة. ثبت بعناية الأنبوب (نهاية حادة) على كل من أطراف المحقنة.
- قم بتغيير الإعدادات الموجودة على المضخة للمحقنة سعة 1 مل وقم بتضمين حجم السلائف التقريبي. ادفع المضخة ببطء للأمام حتى يتم تطبيق ضغط كاف على غطاسات المحاقن لدفع كل من الزيت والسلائف إلى نهايات الأنبوب ، وإزالة أي هواء من النظام. دع الضغط يتعادل لمدة 5-10 دقائق قبل الانتقال إلى الخطوة 2.4.6.
- أدخل الطرف المائل للأنبوب برفق في قنوات مدخل جهاز الموائع الدقيقة باستخدام محلول سلائف microgel في المدخل الأمامي وزيت القرص في المدخل الخلفي. حرك المضخة للأمام بزيادات صغيرة حتى يبدأ التدفق في الجهاز وتبدأ الهلاميات الدقيقة الكروية في التكون في منطقة تركيز التدفق. ابدأ تشغيل المضخة بمعدل تدفق 0.4 ميكرولتر / دقيقة واترك الجهاز يعمل حتى يستقر. إذا لزم الأمر ، اضبط معدل التدفق ±0.1 ميكرولتر / دقيقة بزيادات صغيرة لتثبيت إنتاج ميكروجيل.
- بمجرد استقرار إنتاج الميكروجيل كما هو موضح في الشكل 1 ب ، استبدل أنبوب التجميع بأنبوب جديد ، وقم بتشغيل ضوء الأشعة فوق البنفسجية. تحقق من الجري بشكل دوري للتأكد من استقرار إنتاج الهلام الدقيق طوال مدة التشغيل.
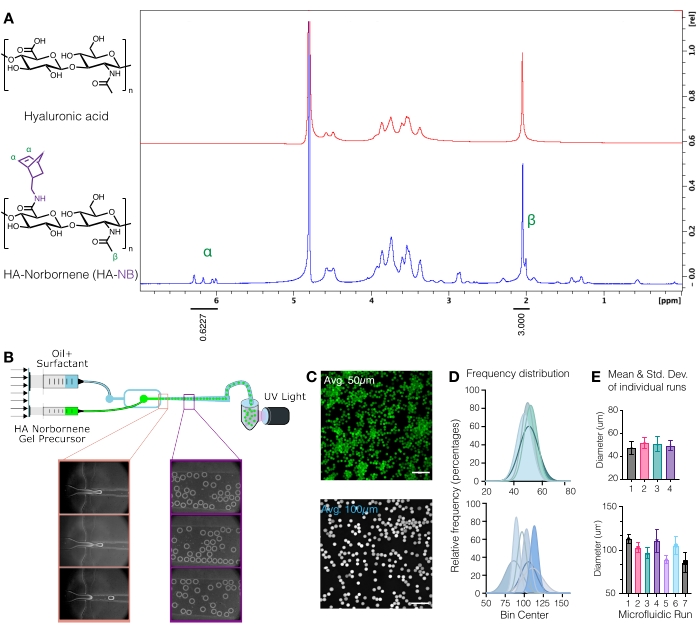
الشكل 1: إنتاج الموائع الدقيقة للكبسولات الهلامية الدقيقة لحمض الهيالورونيك (HA) مع مقابض وظيفية نوربورنين (NB). (أ) تم تعديل ما يقرب من 31٪ من وحدات تكرار HA بنجاح باستخدام NB ، كما هو محدد بواسطة تحليل البروتون NMR الذي تم إجراؤه في أكسيد الديوتيريوم. 1 تمت مقارنة تحولات H NMR للنوربورنين المعلقات عند δ6.33 و δ6.02 (بروتونات الفينيل ، إندو) ، و δ6.26 و δ6.23 جزء في المليون (بروتونات الفينيل ، exo) بمجموعة ميثيل HA δ2.05 جزء في المليون لتحديد الوظيفية. أعيد طبعها من Anderson et al.12 بإذن من Elsevier. (ب) رسم تخطيطي لجهاز الموائع الدقيقة الذي يركز على التدفق المستخدم لتوليد ميكروجيلات HA-NB. (ج) تم استخدام إسقاطات الكثافة القصوى من الفحص المجهري متحد البؤر لتصور μgels المسمى بالفلورسنت (شريط المقياس = 500 ميكرومتر). (د) تظهر توزيعات التردد لقطر الهلام الدقيق من عمليات التشغيل المستقلة على إعداد الموائع الدقيقة التحكم في حجم الهلام الدقيق ~ 50 ميكرومتر أو ~ 100 ميكرومتر اعتمادا على الجهاز المستخدم. (ه) يتم الإبلاغ عن قطر Microgel على أنه المتوسط والانحراف المعياري لكل تشغيل مستقل. أعيد طبعها من ويلسون وآخرون 9 بإذن من وايلي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
3. تنقية وتجفيف الهلاميات الدقيقة
- تنقية microgels
- قم بإعداد المخزن المؤقت للغسيل microgel (300 mM HEPES ، 50 mM NaCl ، 50 mM CaCl 2) بالإضافة إلى2٪ (w / v) محلول Pluronic F-127 الخافض للتوتر السطحي في محلول الغسيل. تعقيم المحاليل باستخدام مرشح يعمل بالفراغ 0.2 ميكرومتر.
- جهاز طرد مركزي لأنبوب جمع الميكروجيل (5000 × جم) لمدة 5 دقائق. في غطاء معقم ، استنشاق بعناية مرحلة الزيت الزائد. امزج الميكروجيل 1: 1 مع محلول الفاعل بالسطح Pluronic F-127 بنسبة 2٪ والدوامة للخلط جيدا. جهاز طرد مركزي (5000 × جم) لمدة 5 دقائق وشفط محلول الغسيل الطارد.
- أضف محلول الغسيل بحجم 4x microgel ودوامة لخلط جيدا. جهاز طرد مركزي (5000 × جم) الخليط لمدة 5 دقائق وشفط محلول الغسيل. أكمل 4-8 غسلات باستخدام مخزن الغسيل المؤقت حتى تتم إزالة الفاعل بالسطح من النظام (أي لا توجد فقاعات).
- وضع العلامات الفلورية على الكبسولات الهلامية الدقيقة HA-NB
ملاحظة: يعتمد التوليف الداخلي لرباعي الترازين المسمى بالفلورسنت على تفاعلين إضافة ثيول-مايكل محفزين بالقاعدة في سلسلة تم وصفها جيدا والإبلاغ عنها سابقا3. لهذا العمل ، تم اقتران Alexa Fluor-488 مع tetrazine لوضع العلامات على μgels المعدلة بالنوربورنين. تم إذابة المنتج المجفف بالتجميد (Alexa Flour 488-Tet) في ثنائي ميثيل الفورماميد عند 1 مجم / مل وتخزينه عند -20 درجة مئوية.- لتسمية الميكروجيل بالفلورسنت ، قم أولا بإعداد محلول عملي من Alexa Fluor 488-Tet عن طريق تخفيف مخزون 1 مجم / مل 1:14 في برنامج تلفزيوني معقم 1x. في غطاء معقم ، ادمج الميكروجيل مع محلول العمل (2: 1 من حيث الحجم).
- استخدم ماصة الإزاحة واخلطها جيدا. احتضان الخليط لمدة 1 ساعة في درجة حرارة الغرفة أو طوال الليل عند 4 درجات مئوية.
- جهاز طرد مركزي (5000 × جم) وشفط محلول التلطيخ. اغسل الميكروجيل مرتين باستخدام برنامج تلفزيوني واحد (1: 1 من حيث الحجم) لإزالة Alexa Fluor 488-Tet غير المتفاعل.
ملاحظة: في هذه المرحلة ، يمكن تصوير الميكروجيل المسمى بالفلورسنت على مجهر متحد البؤر لتحديد حجم الهلام الدقيق (الشكل 1C-E)9. تم وصف طرق قياس حجم الهلام الدقيق بدقة بواسطة Roosa et al.17.
- تجفيف الهلاميات الدقيقة HA-NB
- انقل الميكروجيل المنقى (الشكل 2 أ) إلى أنبوب غطاء لولبي آمن للتبريد باستخدام ماصة إزاحة موجبة. أضف 70٪ إيثانول إلى الميكروجيل المنقى 50٪ (v / v) واخلطه جيدا مع ماصة الإزاحة. جهاز طرد مركزي لمدة 5 دقائق عند 5000 × جم.
تنبيه: الإيثانول مادة شديدة الاشتعال.
ملاحظة: يمكن وزن أنبوب الغطاء اللولبي الآمن من التبريد قبل إضافة الميكروجيل ، ثم وزنه مرة أخرى بعد التجفيد لتحديد كتلة الميكروجيل. يوصى بذلك لتقليل الخطأ عند استخدام كميات أقل من 1 ملغ. تأكد من ضبط الميزان أو معايرته داخليا قبل الاستخدام. - استنشاق السائل الطافي واستبداله ب 70٪ إيثانول (50٪ v / v) (الشكل 2B). تخلط جيدا مع ماصة الإزاحة. احتضان بين عشية وضحاها عند 4 درجات مئوية.
ملاحظة: يمكن تخزين الكبسولات الهلامية الدقيقة في 70٪ من الإيثانول عند 4 درجات مئوية قبل التجفيد للتخزين طويل الأجل ، إذا لزم الأمر. تظهر الهلاميات الدقيقة المجففة بالتجميد في الشكل 2C. يمكن استخدام وسائط التجفيد الأخرى في هذه الخطوة إذا كان تكوين cryogel مطلوبا (الشكل 2D). - جهاز طرد مركزي لفترة وجيزة للتأكد من أن الميكروجيل في الجزء السفلي من أنبوب الغطاء اللولبي. أضف النيتروجين السائل إلى حاوية مبردة ، ثم أضف أنبوب μgels إلى التجميد السريع.
- بعد 5-10 دقائق ، قم بإزالة أنبوب μgels بالملقط. قم بإزالة الغطاء بسرعة وقم بتغطيته بمنديل من الدرجة المعملية. ثبت المنديل بشريط مطاطي وانقله إلى حاوية أو غرفة التجفيد.
- قم بتحميل العينة على جهاز التجفيد باتباع تعليمات الشركة المصنعة. التجفيد عند 0.066 تور و -63 درجة مئوية. قم بتخزين الميكروجيل المجفف بالتجميد (lyo-μgels) مغلقا بإحكام في درجة حرارة الغرفة.
ملاحظة: يكتمل التجفيد عند إزالة كل السائل من الأنبوب ويبقى منتج جاف. يمكن للمذيبات العضوية أن تقلل من طول عمر تركيبات المطاط في أنظمة التجفيد الشائعة.
- انقل الميكروجيل المنقى (الشكل 2 أ) إلى أنبوب غطاء لولبي آمن للتبريد باستخدام ماصة إزاحة موجبة. أضف 70٪ إيثانول إلى الميكروجيل المنقى 50٪ (v / v) واخلطه جيدا مع ماصة الإزاحة. جهاز طرد مركزي لمدة 5 دقائق عند 5000 × جم.
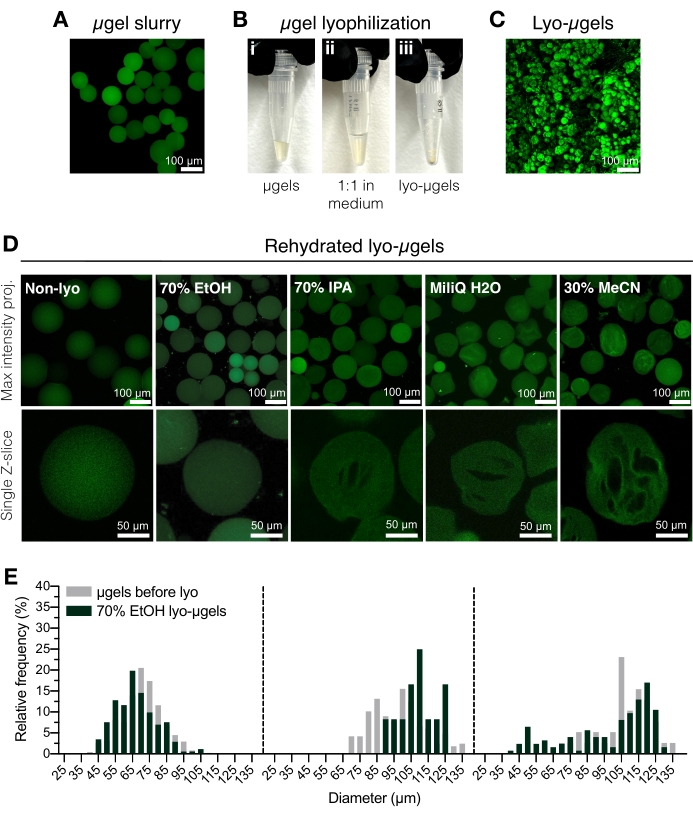
الشكل 2: تجفيف الهلاميات الدقيقة HA-NB. (أ) إسقاط الكثافة القصوى للميكروغرام في محلول مائي (شريط المقياس = 100 ميكرومتر). (ب) يمكن تحضين الميكروجيل المنقى بنسبة 1: 1 من حيث الحجم في وسط التجفيد المختار والمجفف بالتجميد. (ج) إسقاط الكثافة القصوى لليو-ميكروجل المجفف (شريط المقياس = 100 ميكرومتر). (د) يعاد تعليق الكبسولات الهلامية الدقيقة بعد التجفيد. يوصى باستخدام EtOH (70٪) للاحتفاظ بالخصائص الأصلية للميكروجل طوال عملية التجفيد ؛ ومع ذلك ، يمكن استخدام وسائط أخرى مثل كحول الأيزوبروبيل (IPA) والماء والأسيتونيتريل (MeCN) بالتبادل لتسهيل تكوين cryogel (شريط المقياس = 100 أو 50 ميكرومتر كما لوحظ). (ه) قياس قطر الهلام الميكروي HA-NB قبل (الرمادي) وبعد التجفيد (الأخضر) في 70٪ EtOH مبين كتوزيعات متكررة لثلاث مجموعات ميكروجيل. أعيد طبعها من Anderson et al.12 بإذن من Elsevier. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
4. تصنيع سقالة MAP
- توليف رابط رباعي
ملاحظة: يمكن استخدام وصلات Tetrazine لربط الميكروجيلات التي تحمل مجموعات نوربورنين الحرة (الشكل 3 أ). تم تكييف إجراء تخليق HA-tetrazine (HA-Tet) من Zhang et al.18 باستخدام 79 كيلو دالتون من الصوديوم HA مع المكافئات المولية من 1: 1: 0.25 من وحدات تكرار HA إلى DMTMM إلى tetrazine-amine (الشكل 3B) 12.- وزن المتفاعلات. قم بإذابة HA عند 20 مجم / مل في محلول MES 200 mM (درجة الحموضة ~ 6) عن طريق التقليب في دورق أو دورق على طبق تقليب. بمجرد الذوبان ، أضف DMTMM إلى محلول HA واتركه يتفاعل لمدة 20 دقيقة تقريبا في درجة حرارة الغرفة. على سبيل المثال ، يمكن استخدام 100 ملغ HA + 72.8 ملغ DMTMM + 14.14 ملغ tetrazine-amine.
- قم بإذابة رباعي الأمين عند 15 مجم / مل في محلول MES 200 mM وأضف قطرة قطرة إلى محلول HA / DMTMM. ارجع إلى الشكل 3C لإعداد تفاعل HA-Tet.
- أضف البارافيلم إلى فتحة وعاء التفاعل لتقليل التبخر وتغطية وعاء التفاعل بورق الألمنيوم. استمر في التقليب مع السماح للتفاعل بالاستمرار لمدة 24 ساعة تقريبا.
- بعد 24 ساعة ، قم بتبريد 200 إيثانول مقاوم (حوالي 10 أضعاف حجم التفاعل). على طبق التحريك ، انقل التفاعل بالتنقيط إلى الإيثانول المبرد لترسيب HA-Tet (الشكل 3D) واستمر في التقليب لمدة 20 دقيقة.
- انقل المحلول إلى أنابيب مخروطية سعة 50 مل ، ثم قم بالطرد المركزي بسرعة 5000 × جم لمدة 10 دقائق. اسكب الإيثانول الزائد للتخلص منه كنفايات. اسحب المكنسة الكهربائية على HA-Tet في مجفف لتجف طوال الليل. يمكن العثور على مثال للمنتج المجفف في هذه الخطوة في البروتوكول في الشكل 3E.
- تنقية HA-Tet باستخدام غسيل الكلى. قم بإذابة HA-Tet في محلول كلوريد الصوديوم 2 M وانقله إلى أنبوب غسيل الكلى السليلوز مع قطع الوزن الجزيئي 12-14 كيلو دالتون. انقل أنبوب غسيل الكلى المملوء إلى دلو به 5 لتر من الماء عالي النقاء ، وقم بغسيل HA-Tet ضد الماء طوال الليل.
- في اليوم التالي ، قم بإزالة الماء واستبدله بمحلول 1 M NaCl لمدة 30 دقيقة. قم بإزالة محلول كلوريد الصوديوم ، ثم قم بغسيل الكلى ضد الماء عالي النقاء لمدة 3 أيام ، ليحل محل الماء يوميا.
- قم بتصفية المنتج الذي تم تحليله باستخدام مرشح مفرغ 0.2 ميكرومتر ، ثم انقل منتج HA-Tet المصفى إلى أنابيب مخروطية سعة 50 مل.
- قم بتجميد الأنابيب المخروطية في النيتروجين السائل لمدة 10 دقائق ، ثم قم بإزالة الأنابيب المخروطية بالملقط. قم بإزالة الغطاء بسرعة وقم بتغطيته بمنديل من الدرجة المعملية. قم بتأمين المنديل بشريط مطاطي وانقله إلى حاوية أو غرفة تجفيف بالتجميد و lyophilize. قم بتخزين المنتج المجفف بالتجميد (الشكل 3F) في -20 درجة مئوية.
- تحديد تعديل التترازين عن طريق إذابة HA-Tet عند 10 مجم / مل في D2O والتحليل عبر البروتون NMR (الشكل 3G)16.
- لتحديد مقدار الأداء الوظيفي ، قم أولا بمعايرة ذروة مذيب D2O إلى 4.8 جزء في المليون. دمج ذروة بروتونات ميثيل HA (δ2.05) ومعايرة التكامل إلى 3.0. بعد ذلك ، قم بدمج قمم مجموعات tetrazine المعلقة عند δ8.5 (2H) و δ7.7 (2H) (البروتونات العطرية). تطبيع تكامل هذه القمم مع العدد المقابل من البروتونات لتحديد متوسط درجة التعديل12.
- ربط lyo-μgels لتشكيل سقالات MAP للتوصيف
- تحضير مكونات سقالة MAP (أي μgels ، HA-Tet ، حجم التهوية). قم بوزن lyo-μgels (الشكل 4 أ) وأعد تكوينه في 84٪ من حجم MAP النهائي البالغ 1x PBS. اترك الهلاميات الدقيقة تنتفخ لمدة 20 دقيقة تقريبا (الشكل 4 ب ، ج). يمكن اختيار WT٪ MAP المستخدم في الإماهة بناء على تفضيل المستخدم لجزء الجسيمات النهائي (راجع الشكل 4D ، E).
- قم بإذابة HA-Tet في 1x PBS بالتركيز المختار (انظر الملاحظة أدناه).
ملاحظة: سيؤدي تغيير كل من جزء التعبئة (عبر wt٪ MAP) وكذلك تركيز HA-Tet إلى تغيير الخواص الميكانيكية للسقالة السائبة. على سبيل المثال ، سقالة MAP بالوزن 3.4٪ متشابكة مع 0.02 مجم / مل HA-Tet (نسبة التلدين 2.6 مول Tet: mol HA-NB) تولد سقالات MAP مع ما يقرب من 700 باسكال معامل تخزينالقص 12. - استخدم ماصة الإزاحة للجمع بين HA-Tet و lyo-μgels واخلطها جيدا. في هذه المرحلة ، يمكن نقل الخليط عبر ماصة الإزاحة على شرائح زجاجية أو ألواح بئر أو حاوية من اختيار المستخدم. اترك الميكروجيل يلدن عند 37 درجة مئوية لمدة 25 دقيقة ، ثم استخدم ملعقة لنقل سقالات MAP إلى أطباق جيدة مملوءة ب 1x PBS. احتفظ بسقالات MAP في 1x PBS حتى تصبح جاهزة للتوصيف.
- حساب جزء جسيمات سقالة MAP
- لتحسين جودة الصورة، انقل سقالة MAP إلى غطاء زجاجي باستخدام ملعقة. صورة سقالات MAP على مجهر متحد البؤر باستخدام الليزر لإثارة وانبعاث FITC. سقالات Image MAP على هدف 20x والحصول على مكدس Z يجتاز 250-300 ميكرومتر في الاتجاه Z بحجم خطوة 2.5 ميكرومتر. قم بتدوين معايرة μm / pixel للصورة.
- قم باستيراد صورة Z-stack إلى برنامج التحليل (انظر جدول المواد). حدد الزر إضافة أسطح جديدة . حدد المربع لتقسيم منطقة اهتمام فقط، ثم حدد زر السهم الأزرق التالي: منطقة الاهتمام.
- حدد منطقة الاهتمام ، وتتبع أبعاد X و Y و Z للحجم الذي يتم تحليله. حدد زر السهم الأزرق التالي: القناة المصدر.
ملاحظة: الأبعاد X و Y بوحدات البكسل بينما البعد Z هو عدد الخطوات. يجب أن يتضمن ارتفاع Z الموصى به لمنطقة الاهتمام ما لا يقل عن اثنين من μgels. - استخدم القائمة المنسدلة القناة المصدر لتحديد قناة FITC. حدد المربع بجوار أملس وأدخل تفاصيل سطح 2.50 ميكرومتر. ضمن عتبة، حدد الكثافة المطلقة، ثم حدد زر السهم الأزرق التالي: العتبة.
- استخدم قيمة العتبة المقترحة لقناة FITC. قم بتدوير إسقاط 3D لتقييم جودة العرض وضبطه حسب الحاجة. حدد التالي: تصنيف الأسطح.
ملاحظة: يمكن استخدام الزر السابق لتحرير الخطوات السابقة في العملية، مثل البعد Z، حسب الحاجة. - تحقق مما إذا كان عدد Voxels هو 10.0 ، ثم حدد زر السهم المزدوج الأخضر إنهاء: قم بتنفيذ جميع خطوات الإنشاء وإنهاء المعالج.
ملاحظة: يمكن تخزين معلمات تجسيد الحجم لتحليل الدفعات بحيث يتم تطبيق نفس الإعدادات لتحليل جميع السقالات. - لتصدير البيانات، حدد علامة التبويب إحصائيات ، ثم علامة التبويب مفصل . استخدم المربع المنسدل الثاني لتحديد متغير Volume. حدد زر القرص المرن تصدير الإحصائيات في علامة التبويب عرض إلى ملف وحفظه كملف جدول بيانات (.xls) عندما يطلب منك ذلك.
- افتح الملف واستخدم الدالة SUM في العمود A Volume لتحديد الحجم الكلي (ميكرومتر3) للميكروغرام في منطقة الاهتمام.
- تحويل أبعاد المنطقة ذات الاهتمام التي تم تحليلها من بكسل إلى ميكرومتر. استخدم معايرة μm / pixel للصورة من الخطوة 4.3.1 لتحويل أبعاد X و Y. اضرب البعد Z (عدد الخطوات) في حجم الخطوة للصورة لتحويل البعد Z إلى μm. احسب حجم منطقة الاهتمام (ميكرومتر3) بضرب أبعاد X و Y و Z.
- لتحديد جزء الجسيمات من السقالة ، قسم الحجم الكلي للميكروجيل في منطقة الاهتمام (الموجودة في الخطوة 4.3.8) على حجم منطقة الاهتمام (الموجودة في الخطوة 4.3.9).
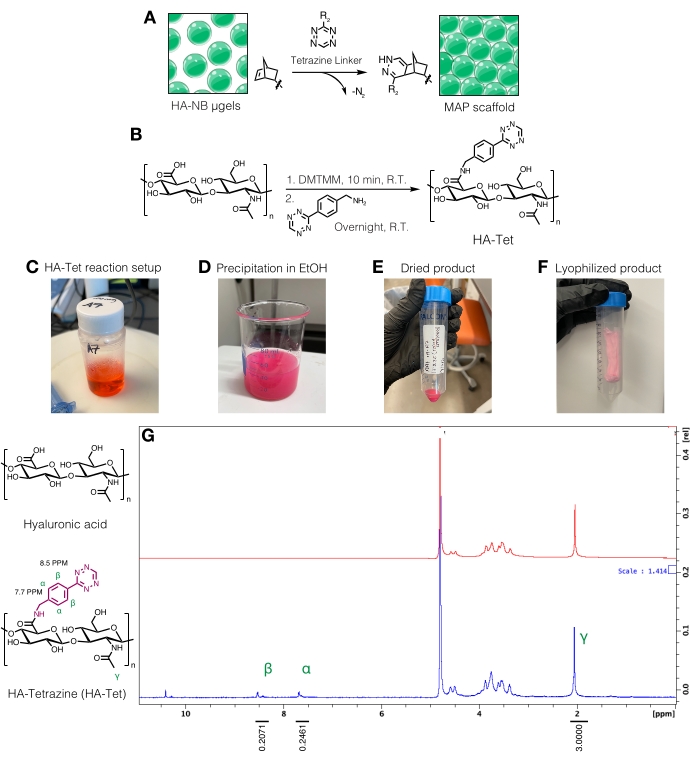
الشكل 3: تخليق رابط رباعي الزينة لتصنيع سقالات الجسيمات الملدنة الصغيرة التي يسهل اختراقها (MAP). (أ) رسم تخطيطي لميكروجيلات HA-NB التي يتم ربطها برابط رباعي الأضلاع لتشكيل سقالات MAP. (ب) مخطط التفاعل لتخليق HA-Tet. (ج) تم إعداد تفاعل HA-Tet وسمح له بالتفاعل طوال الليل متبوعا ب (د) ترسيب HA-Tet في الإيثانول. (ه) بمجرد تنقيته وتجفيفه ، تم إعادة ترطيب HA-Tet وتجفيفه بالتجميد لإنتاج (F) منتج وردي فاتح مجفف. (ز) يظهر تحليل الرنين المغناطيسي النووي بالبروتون تعديلا ناجحا ل 11٪ من وحدات تكرار HA. أعيد طبعها من Anderson et al.12 بإذن من Elsevier. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
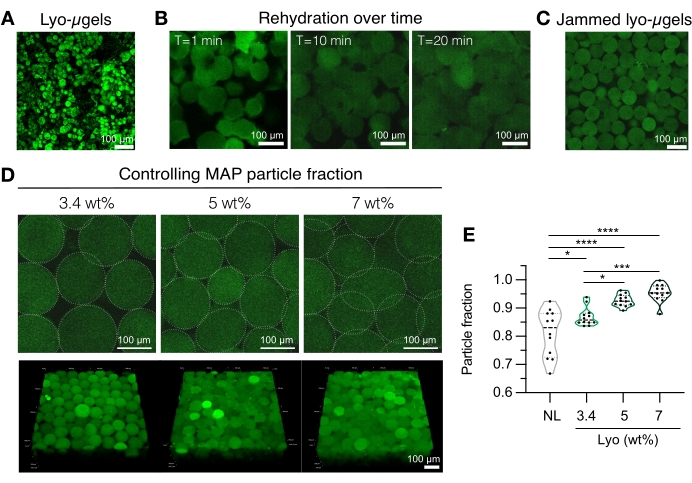
الشكل 4: إماهة الهلاميات الدقيقة المجففة بالتجميد لتصنيع سقالة MAP. (أ) إسقاط الكثافة القصوى لل lyo-μgels المجففة (شريط المقياس = 100 ميكرومتر). (ب) بعد التجفيف بالتجميد ، تبين أن معالجة الجفاف في lyo-μgels تستغرق حوالي 20 دقيقة (شريط المقياس = 100 ميكرومتر). (C) يمكن إعادة ترطيب Lyo-μgels بوزن متفاوت٪ MAP لإنتاج كبسولات ميكروجيلية محشورة (شريط المقياس = 100 ميكرومتر). (د) تؤدي زيادة الوزن ٪ MAP عند إعادة إماهة lyo-μgels إلى تغيير جزء الجسيمات في سقالات MAP ، كما هو موضح في شرائح Z المفردة من سقالات MAP وإسقاطات الحجم (شريط المقياس = 100 ميكرومتر). (ه) باستخدام سقالات MAP المحددة من قبل المستخدم ، يمكن تحقيق كسور جسيمات فريدة (NL = μgels غير مجفف بالتجميد). تم إجراء تحليل ANOVA أحادي الاتجاه باستخدام Tukey HSD على العينات (n = 3) ، مع الإبلاغ عن دلالة عند p < 0.05 (*) ، p < 0.01 (**) ، p < 0.005 (***) ، و p < 0.001 (****). أعيد طبعها من Anderson et al.12 بإذن من Elsevier. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
5.3D زراعة الخلايا في سقالات الخريطة
- تحضير أجهزة زراعة الخلايا
- لإنشاء جهاز زراعة خلايا مخصص لهذه التجارب (الشكل 5A-C) ، استخدم طابعة ثلاثية الأبعاد لطباعة قالب سلبي باستخدام ملف CAD الموجود في ملف الترميز التكميلي 1.
ملاحظة: أبعاد جهاز زراعة الخلايا هي كما يلي: 94.9 مم × 94.9 مم × 4.8 مم مع ارتفاع بئر إجمالي 2.6 مم. يبلغ قطر الآبار الداخلية والآبار الخارجية 4 مم و 6 مم على التوالي. - امزج قاعدة المطاط الصناعي polydimethylsiloxane (PDMS) مع عامل المعالجة بنسبة 10: 1 حسب الكتلة. يسكب خليط PDMS في طبق بتري بلاستيكي كبير ويتخلص من الغازات في مجفف لمدة 30 دقيقة تقريبا أو حتى تختفي جميع الفقاعات.
- بمجرد اختفاء جميع الفقاعات ، ضع القالب المطبوع 3D بعناية في PDMS لتقليل تكوين فقاعات جديدة. ضعيها في الفرن على حرارة 60 درجة مئوية لمدة 2 ساعة على الأقل لعلاج PDMS.
- استخدم سكينا أو شفرة حلاقة لتتبع معلمة جهاز الثقافة برفق ، ثم قم بإزالة القالب بعناية. استخدم لكمة خزعة 4 مم لإزالة أي PDMS من قاع الآبار. قم بقص الأجهزة لتناسب غطاء زجاجي.
ملاحظة: يمكن أيضا ربط أجهزة زراعة الخلايا بالشرائح الزجاجية ، لكن أغطية الزجاج تعمل على تحسين تصوير العينة. - استخدم الشريط لإزالة الغبار من الجانب السفلي لأجهزة الثقافة. ضع الأغطية الزجاجية النظيفة وأجهزة الاستزراع (الجانب السفلي لأعلى) على طبق ساخن عند 135 درجة مئوية لمدة 15 دقيقة على الأقل لإزالة الرطوبة.
- في غطاء الدخان ، استخدم مسدس بلازما الإكليل على ارتفاع على كل من الغطاء الزجاجي والجانب السفلي من الجهاز لمدة 30 ثانية ، ثم اربط الأسطح المعالجة معا بسرعة. اضغط برفق لضمان إحكام جيد بين جهاز الثقافة والغطاء الزجاجي.
- كرر الخطوة 5.1.6 لجميع الأجهزة ، ثم ضعه في فرن 60 درجة مئوية طوال الليل لتأمين السند. الأوتوكلاف الأجهزة لتعقيمها قبل استخدامها في المختبر.
- لإنشاء جهاز زراعة خلايا مخصص لهذه التجارب (الشكل 5A-C) ، استخدم طابعة ثلاثية الأبعاد لطباعة قالب سلبي باستخدام ملف CAD الموجود في ملف الترميز التكميلي 1.
- زراعة الخلايا في سقالات MAP
- قم بإعداد مكونات سقالة MAP (أي μgels ، HA-Tet ، حجم الوسائط) بناء على جزء الجسيمات المطلوب (راجع الشكل 4D-E). قم بوزن lyo-μgels في غطاء معقم وأعد تكوينه في 84٪ من حجم MAP النهائي لوسائط الخلية بناء على WT٪ MAP المختار. اترك الميكروجيل تنتفخ لمدة 20 دقيقة تقريبا.
ملاحظة: تتطلب هذه الطرق من المستخدم وزن منتج lyo-microgel لإعادة الجفاف. بالنسبة للكتل الصغيرة (1 ملغ أو أقل) ، يقترح أولا وزن أنبوب التبريد قبل إضافة وتجفيف الميكروجل ، ثم إعادة وزن الأنبوب بعد التجفيد لتحديد كتلة المنتج لتقليل الخطأ. - قم بإذابة HA-Tet في وسائط الخلية في 16٪ من حجم MAP النهائي.
ملاحظة: يمكن تغيير الخطوات التالية لإعداد الخلايا للبذر في سقالات MAP اعتمادا على نوع الخلية المستخدمة. في هذا البروتوكول ، نمت خلايا اللحمة المتوسطة للفأر D1 في وسط النسر المعدل من Dulbecco (DMEM) مع 1٪ بنسلين ستربتومايسين (pen-strep) و 10٪ مصل بقري جنيني (FBS) (انظر جدول المواد). يجب اتباع بروتوكولات زراعة الخلايا الملتصقة القياسية لهذه الخلايا ، مع الحفاظ على المزارع عند 37 درجة مئوية و 5٪ CO2 في أوعية الاستزراع المعالجة بزراعة الأنسجة. - بمجرد أن تصل خلايا اللحمة المتوسطة للفأر D1 إلى التقاء 70٪ -80٪ ، استنشق الوسائط واغسل الخلايا باستخدام 1x PBS. ارفع الخلايا بإضافة حجم كاف من 1٪ من التربسين-EDTA لتغطية سطح وعاء زراعة الأنسجة. احتضان عند 37 درجة مئوية لمدة 1-3 دقائق ، ثم إخماد التربسين عن طريق إضافة وسائط DMEM المكملة ب 1٪ من القلم العقدي و 10٪ FBS عند 2x من حجم التربسين-EDTA.
- جهاز طرد مركزي لتعليق الخلية عند 100 × جم لمدة 5 دقائق في درجة حرارة الغرفة لحبيبات الخلايا. قم بشفط الوسائط الطافية وأعد تعليق الخلايا في وسائط DMEM سعة 1 مل مكملة بنسبة 1٪ من التهاب القلم العقدي و 10٪ من FBS.
- تأكد من خلط تعليق الخلية جيدا ، ثم انقل 20 ميكرولتر إلى أنبوب طرد مركزي دقيق جديد. أضف 20 ميكرولتر من محلول تريبان الأزرق واخلطه جيدا. استخدم 20 ميكرولتر من هذا الخليط لعد الخلايا باستخدام إما مقياس الدم أو عداد الخلايا الآلي مع شرائح غرفة عد الخلايا.
- نقل عدد الخلايا اللازمة لبذر 10000 خلية / ميكرولتر MAP إلى أنبوب طرد مركزي دقيق جديد. جهاز طرد مركزي عند 100 × جم لمدة 5 دقائق في درجة حرارة الغرفة لتكوير الخلايا. استنشاق بعناية وسائط الطاف من بيليه الخلية دون استنشاق الخلايا.
- أضف μgels و crosslinker إلى بيليه الخلية مع ماصة الإزاحة. تخلط جيدا مع ماصة الإزاحة ، ثم البذور 10 ميكرولتر من الخليط لكل بئر. عند الطلاء ، ماصة في حركة دائرية لتوزيع الخليط بالتساوي في البئر.
- اترك الميكروجيل يلدن عند 37 درجة مئوية في حاضنة الخلية لمدة 25 دقيقة قبل إضافة وسائط الخلية لملء الآبار (~ 50 ميكرولتر من الوسائط لكل بئر). الحفاظ على الثقافات 3D عند 37 درجة مئوية وتغيير الوسائط حسب الحاجة. لتجنب استنشاق السقالة عند تغيير الوسائط ، قم بتثبيت طرف الماصة على طول حافة البئر العلوي.
ملاحظة: عند إضافة أو إزالة السائل من آبار الاستزراع ، ضع نهاية طرف الماصة على الحافة فوق سقالة MAP لتقليل فرصة تعطيل أو شفط السقالة من البئر. - في النقاط الزمنية المطلوبة ، قم بإصلاح العينات عن طريق إزالة الوسائط وإضافة 50 ميكرولتر من 4٪ بارافورمالدهيد لكل بئر لمدة 30 دقيقة في درجة حرارة الغرفة. اغسل العينات 3x مع 50 ميكرولتر من 1x PBS أو المخزن المؤقت المفضل. في هذه المرحلة من البروتوكول ، يمكن اتباع الطرق القياسية للتألق المناعي أو تلطيخ التألق ، باستخدام 50 ميكرولتر لكل بئر حجم العمل.
ملاحظة: تصف طرق التثبيت وتلطيخ الخلايا هذه على وجه التحديد استخدام بقع الفلورسنت. ومع ذلك ، يمكن إجراء تلطيخ مناعي مع اقتران الأجسام المضادة الأولية و / أو الثانوية في هذه السقالات أيضا باتباع تعليمات الشركة المصنعة باستخدام 50 ميكرولتر كحجم عمل لكل بئر. - خلايا الصورة في سقالات MAP على مجهر متحد البؤر باستخدام هدف 20x والحصول على مكدس Z يجتاز 200-250 ميكرومتر في الاتجاه Z بحجم خطوة 2.5 ميكرومتر. مثال على تلطيخ مضان مع DAPI (صبغة نووية مخففة 1: 1000 في 0.15٪ Triton-X في 1x PBS) و phalloidin-647 (صبغة F-actin مخففة 1:40 في 0.15٪ Triton-X في 1x PBS) موضحة في الشكل 5E ، F مع خلايا D1 ثابتة مستزرعة في سقالات MAP لمدة 3 أيام.
ملاحظة: تؤدي معالجة الأسطح الزجاجية بالبلازما إلى زيادة المحبة للماء ، والتي ثبت أنها تعزز التصاق الخلايا. من المحتمل أن تلاحظ الخلايا تنتشر على طول قاع آبار زراعة الخلايا ولكن لا ينبغي تضمينها في عدد الخلايا أو القياس الكمي لحجم الخلية لتقييم استجابة الخلية في سقالات MAP.
- قم بإعداد مكونات سقالة MAP (أي μgels ، HA-Tet ، حجم الوسائط) بناء على جزء الجسيمات المطلوب (راجع الشكل 4D-E). قم بوزن lyo-μgels في غطاء معقم وأعد تكوينه في 84٪ من حجم MAP النهائي لوسائط الخلية بناء على WT٪ MAP المختار. اترك الميكروجيل تنتفخ لمدة 20 دقيقة تقريبا.
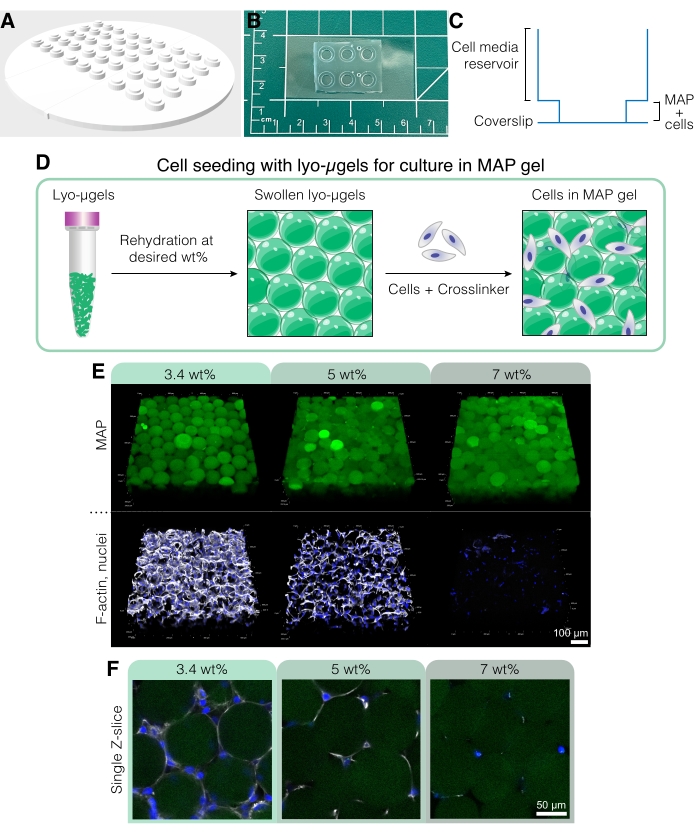
الشكل 5: زراعة الخلايا في سقالات MAP. (أ) يمكن طباعة قالب إنشاء آبار زراعة الخلايا 3D وصبها باستخدام PDMS. يبلغ قطر القالب بأكمله 95 مم ، وقطر الآبار الكبيرة 6 مم ، وقطر الآبار الداخلية الصغيرة 4 مم. (ب) بمجرد صبها باستخدام PDMS ، يتم ربط أجهزة زراعة الخلايا بالبلازما بأغطية لتحسين قدرات الفحص المجهري. (ج) يصور المقطع العرضي لبئر زراعة الخلايا خزان وسائط الخلية (~ 50 ميكرولتر) وخزان أصغر لبذر سقالة MAP بالخلايا (~ 10 ميكرولتر). (د) تعتمد عملية بذر الخلايا في سقالات MAP أولا على إعادة إماهة lyo-μgels بالوزن المطلوب للمستخدم٪ ، يليها الاختلاط مع الخلايا والرابط المتشابك لربط الميكروجيل. (ه) يمكن تغليف الخلايا في سقالات MAP (خضراء) مع WT٪ MAP متنوعة. الصور التمثيلية هي من اليوم 5 من زراعة الخلايا D1 في سقالات MAP (شريط المقياس = 100 ميكرومتر). (F) تظهر شرائح Z المفردة اختلافات في نمو الخلايا في السقالات التي تضم MAP مختلفة بالوزن (شريط المقياس = 50 ميكرومتر). أعيد طبعها من Anderson et al.12 بإذن من Elsevier. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
النتائج
الهدف من هذا البروتوكول هو إظهار تحضير سقالات الجسيمات الملدنة الصغيرة التي يسهل اختراقها (MAP) مع مخطط تشابك متعامد حيوي بالإضافة إلى كسور الجسيمات الخاضعة للرقابة لثقافة الخلايا ثلاثية الأبعاد. أولا ، تم تعديل HA مع مجموعات قلادة نوربورنين لاستخدامها في كل من تكوين microgel والربط لتشكيل سقا?...
Discussion
ثبت أن إنتاج الموائع الدقيقة للكبسولات الهلامية الدقيقة HA-NB يولد هلاميات دقيقة ذات نطاق أضيق لتوزيع الحجم من إنتاج دفعة المستحلب 3,9. تمت صياغة الكبسولات الهلامية الدقيقة الموصوفة في هذا البروتوكول باستخدام رابط متقاطع قابل للانقسام MMP (Ac-GCRDGPQGIWGQDRCG-NH2) ?...
Disclosures
قدمت ARA و TS براءة اختراع مؤقتة لهذه التكنولوجيا.
Acknowledgements
يود المؤلفون أن يشكروا المعاهد الوطنية للصحة ، والمعاهد الوطنية للاضطرابات العصبية والسكتة الدماغية (1R01NS112940 ، 1R01NS079691 ، R01NS094599) ، والمعهد الوطني للحساسية والأمراض المعدية (1R01AI152568). تم تنفيذ هذا العمل جزئيا في مرفق أجهزة المواد المشتركة بجامعة ديوك (SMIF) ، وهو عضو في شبكة تكنولوجيا النانو مثلث أبحاث نورث كارولينا (RTNN) ، والتي تدعمها المؤسسة الوطنية للعلوم (رقم الجائزة ECCS-2025064) كجزء من البنية التحتية الوطنية المنسقة لتكنولوجيا النانو (NNCI). يود المؤلفون أن يشكروا الدكتور لوكاس شيرمر ، ما بعد الدكتوراه السابق في المختبر ، وكذلك إيثان نيكلو على مساعدتهم في توليد الجهاز المطبوع 3D لتجارب زراعة الخلايا.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309628 | |
| 5 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309646 | |
| Alexa Fluor 488 C5 maleimide | Invitrogen | A10254 | For synthesis of fluorescently-labeled tetrazine |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | For staining cell culture samples |
| Aluminum foil | VWR | 89107-726 | |
| Biopsy punch with plunger, 1.0 mm | Integra Miltex | 69031-01 | |
| Biopsy punch, 4 mm | Integra Miltex | 33-34 | |
| Blunt needle, 23 G 0.5", Non-Sterile, Capped | SAI Infusion Technologies | B23-50 | |
| Bottle-top vacuum filter, 0.22 μm | Corning | CLS430521 | |
| Calcium chloride | VWR | 1B1110 | For microgel washing buffer |
| Capillary-piston assemblies for positive-displacement pipettes, 1000 μL max. volume | Rainin | 17008609 | |
| Capillary-piston assemblies for positive-displacement pipettes, 25 μL max. volume | Rainin | 17008605 | |
| Capillary-piston assemblies for positive-displacement pipettes, 250 μL max. volume | Rainin | 17008608 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10228 | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Centrifuge tube, 15 mL | CELLTREAT | 667015B | |
| Centrifuge tube, 50 mL | CELLTREAT | 229421 | |
| Chloroform, ACS grade, Glass Bottle | Stellar Scientific | CP-C7304 | For synthesis of fluorescently-labeled tetrazine |
| Corona plasma gun, BD-10A High Frequency Generator | ETP | 11011 | |
| CryoTube Vials, Polypropylene, Internal Thread with Screw Cap | Nunc | 368632 | |
| D1 mouse mesenchymal cells | ATCC | CRL-12424 | Example cell line for culture in MAP gels |
| DAPI | Sigma-Aldrich | D9542 | For staining cell culture samples |
| Deuterium oxide, 99.9 atom% D | Sigma-Aldrich | 151882 | For NMR spectroscopy |
| Dialysis tubing, regenerated cellulose membrane, 12-14 kDa molecular weight cut-off | Spectra/Por | 132703 | For purifying HA-NB and HA-Tet |
| Diethyl ether | VWR | BDH1121-4LPC | For synthesis of fluorescently-labeled tetrazine |
| Dimethylformamide | Sigma-Aldrich | 277056 | For synthesis of fluorescently-labeled tetrazine |
| 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride (DMTMM) | TCI-Chemicals | D2919 | For modifying HA |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | Non-degradable dithiol linker (substitute for MMP-cleavable peptide) |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | D6429-500ML | For D1 cell culture |
| EMS Paraformaldehyde, Granular | VWR | 100504-162 | For making 4% PFA |
| Ethanol absolute (200 proof) | KOPTEC | 89234-850 | |
| Fetal bovine serum (FBS) | ATCC | 30-2020 | For D1 cell culture |
| Heating Plate | Kopf Instruments | HP-4M | |
| Hemacytometer with coverglass | Daigger Scientific | EF16034F | |
| 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375 | |
| Sodium hyaluronate, 79 kDa average molecular weight, produced in bacteria Streptococcus zooepidemicus, pharmaceutical grade, microbial contamination <100 CFU/g, bacterial endotoxins <0.050 IU/mg | Contipro | N/A | 79 kDa average molecular weight was used for HA-Tet synthesis, but these methods could be adapted for other molecular weights. |
| IMARIS Essentials software package | Oxford Instruments | N/A | Microscopy image analysis software |
| Infusion pump, dual syringe | Chemyx | N/A | |
| Kimwipe | Kimberly-Clark | 34120 | |
| Laboratory stand with support lab clamp | Geyer | 212100 | |
| Liquid nitrogen | Airgas | NI 180LT22 | |
| Lithium Phenyl(2,4,6-trimethylbenzoyl)phosphinate | TCI-Chemicals | L0290 | |
| Lyophilizer | Labconco | N/A | Labconco FreeZone 6 plus has been discontinued, but other lab grade console freeze dryers could be used for this protocol. |
| Methyltetrazine-PEG4-maleimide | Kerafast | FCC210 | For synthesis of fluorescently-labeled tetrazine |
| 2-(4-Morpholino)ethane Sulfonic Acid (MES) | Fisher Scientific | BP300-100 | For modifying HA |
| Micro cover glass, 24 x 60 mm No. 1 | VWR | 48393-106 | |
| Microfluidic device SU8 master wafer | FlowJem | Custom design made either in-house in clean room or outsourced | |
| Mineral oil, heavy | Sigma-Aldrich | 330760 | |
| MMP-cleavable dithiol crosslinker peptide (Ac-GCRDGPQGIWGQDRCG-NH2) | GenScript | N/A | |
| 5-Norbornene-2-methylamine | TCI-Chemicals | 95-10-3 | For HA-NB synthesis |
| Packing tape | Scotch | 3M 1426 | |
| Parafilm | Bemis | PM996 | |
| PEG(thiol)2 | JenKem Technology USA | A4001-1 | For synthesis of fluorescently-labeled tetrazine |
| Penicillin-Streptomycin, 10,000 units/mL | Thermo Fisher Scientific | 15140122 | For D1 cell culture |
| Petri dish, polystyrene, disposable, Dia. x H=150 x 15 mm | Corning | 351058 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | For washing HMPs |
| Phosphate buffered saline (PBS) 1x | Gibco | 10010023 | |
| RainX water repellent glass treatment | Grainger | 465D20 | Synthetic hydrophobic treatment solution for microfluidic device treatment |
| RGD peptide (Ac-RGDSPGERCG-NH2) | GenScript | N/A | |
| Rubber bands | Staples | 112417 | |
| Sodium chloride | Chem-Impex | 30070 | For dialysis |
| Span 80 for synthesis | Sigma-Aldrich | 1338-43-8 | |
| Sylgard 184 Silicone Elastomer | Electron Microscopy Science | 4019862 | polydimethylsiloxane (PDMS) elastomer for making microfluidic devices and tissue culture devices |
| Syringe filter, Whatman Uniflo, 0.2 μm PES, 13 mm diameter | Cytvia | 09-928-066 | |
| Tetraview LCD digital microscope | Celestron | 44347 | |
| Tetrazine-amine HCl salt | Chem-Impex | 35098 | For HA-Tet synthesis |
| Triethylamine | Sigma-Aldrich | 471283 | For synthesis of fluorescently-labeled tetrazine |
| Tris(2-carboxyethyl)phosphine (TCEP) | Millipore Sigma | 51805-45-9 | |
| Triton X-100 | VWR | 97063-864 | |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| Trypsin EDTA (0.25%), Phenol red | Fisher Scientific | 25-200-056 | For lifting adherent cells to seed in MAP gels |
| Tygon ND-100-80 Non-DEHP Medical Tubing, Needle Gauge=23, Wall Thickness=0.020 in, Internal diameter = 0.020, Outer diameter = 0.060 in | Thomas Scientific | 1204G82 | |
| UV curing system controller, LX500 LED | OmniCure | 010-00369R | |
| UV curing head, LED spot UV | OmniCure | N/A | |
| UV light meter, Traceable | VWR | 61161-386 | |
| Vacuum dessicator | Bel-Art | 08-594-15C | |
| X-Acto Z Series Precision Utility Knife | Elmer's | XZ3601W |
References
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Darling, N. J., et al. Click by click Microporous Annealed Particle (MAP) scaffolds. Advanced Healthcare Materials. 9 (10), 1901391 (2020).
- Truong, N. F., et al. Microporous annealed particle hydrogel stiffness, void space size, and adhesion properties impact cell proliferation, cell spreading, and gene transfer. Acta Biomaterialia. 94, 160-172 (2020).
- Pfaff, B. N., et al. Selective and improved photoannealing of Microporous Annealed Particle (MAP) scaffolds. ACS Biomaterials Science & Engineering. 7 (2), 422-427 (2021).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science & Engineering. 2 (11), 2034-2041 (2016).
- Caldwell, A. S., Campbell, G. T., Shekiro, K. M. T., Anseth, K. S. Clickable microgel scaffolds as platforms for 3D cell encapsulation. Advanced Healthcare Materials. 6 (15), 1700254 (2017).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194 (2022).
- Wilson, K. L., et al. Stoichiometric post modification of hydrogel microparticles dictates neural stem cell fate in microporous annealed particle scaffolds. Advanced Materials. 34 (33), 2201921 (2022).
- Muir, V. G., Qazi, T. H., Shan, J., Groll, J., Burdick, J. A. Influence of microgel fabrication technique on granular hydrogel properties. ACS Biomaterials Science & Engineering. 7 (9), 4269-4281 (2021).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3D printing applications. Advanced Science. 6 (1), 1801076 (2018).
- Anderson, A. R., Nicklow, E., Segura, T. Particle fraction as a bioactive cue in granular scaffolds. Acta Biomaterialia. 150, 111-127 (2022).
- Pruett, L., Ellis, R., McDermott, M., Roosa, C., Griffin, D. R. Spatially heterogeneous epidermal growth factor release from microporous annealed particle (MAP) hydrogel for improved wound closure. Journal of Materials Chemistry B. 9 (35), 7132-7139 (2021).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step variable height photolithography for valved multilayer microfluidic devices. Journal of Visualized Experiments. (119), e55276 (2017).
- JoVE. Nuclear Magnetic Resonance (NMR) Spectroscopy. JoVE Science Education Database. Organic Chemistry. JoVE. , (2022).
- Roosa, C., et al. Microfluidic synthesis of microgel building blocks for microporous annealed particle scaffold. Journal of Visualized Experiments. (184), e64119 (2022).
- Zhang, H., Dicker, K. T., Xu, X., Jia, X., Fox, J. M. Interfacial bioorthogonal crosslinking. ACS Macro Letters. 3 (8), 727-731 (2014).
- Welzel, P. B., et al. Cryogel micromechanics unraveled by atomic force microscopy-based nanoindentation. Advanced Healthcare Materials. 3 (11), 1849-1853 (2014).
- Plieva, F., Huiting, X., Galaev, I. Y., Bergenståhl, B., Mattiasson, B. Macroporous elastic polyacrylamide gels prepared at subzero temperatures: control of porous structure. Journal of Materials Chemistry. 16 (41), 4065-4073 (2006).
- Rommel, D., et al. Functionalized microgel rods interlinked into soft macroporous structures for 3D cell culture. Advanced Science. 9 (10), 2103554 (2022).
- Kurt, E., Segura, T. Nucleic acid delivery from granular hydrogels. Advanced Healthcare Materials. 11 (3), 2101867 (2021).
- Isaac, A., et al. Microporous bio-orthogonally annealed particle hydrogels for tissue engineering and regenerative medicine. ACS Biomaterials Science & Engineering. 5 (12), 6395-6404 (2019).
- Truong, N. F., Lesher-Pérez, S. C., Kurt, E., Segura, T. Pathways governing polyethylenimine polyplex transfection in Microporous Annealed Particle scaffolds. Bioconjugate Chemistry. 30 (2), 476-486 (2019).
- Koh, J., et al. Enhanced in vivo delivery of stem cells using microporous annealed particle scaffolds. Small. 15 (39), 1903147 (2019).
- Li, F., et al. Cartilage tissue formation through assembly of microgels containing mesenchymal stem cells. Acta Biomaterialia. 77, 48-62 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved