A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الطرق المحسنة لتثبيت سطح الكولاجين وفحوصات ربط الكولاجين
* These authors contributed equally
In This Article
Summary
يقدم هذا العمل بروتوكولا محسنا لتثبيت الكولاجين من النوع الأول والثالث بشكل متكرر وتحديده على الصفائح الدقيقة ، متبوعا ببروتوكول مقايسة ربط محسن في المختبر لدراسة تفاعلات مركبات الكولاجين باستخدام طريقة مضان تم حلها بمرور الوقت. يتم توفير تحليل البيانات اللاحق خطوة بخطوة وتفسير البيانات.
Abstract
يحدث التليف في أنسجة مختلفة كرد فعل تعويضي للإصابة أو التلف. ومع ذلك ، إذا كان التليف مفرطا ، يمكن أن يؤدي إلى تندب الأنسجة وفشل الأعضاء ، والذي يرتبط بارتفاع معدلات المراضة والوفيات. الكولاجين هو المحرك الرئيسي للتليف ، حيث يعتبر النوع الأول والنوع الثالث من الكولاجين من الأنواع الأساسية المشاركة في العديد من الأمراض الليفية. على عكس البروتوكولات التقليدية المستخدمة لشل حركة البروتينات الأخرى (على سبيل المثال ، الإيلاستين ، والألبومين ، والفيبرونكتين ، وما إلى ذلك) ، فإن البروتوكولات الشاملة لتثبيت أنواع مختلفة من الكولاجين بشكل متكرر من أجل إنتاج طلاءات مستقرة ليست متاحة بسهولة. يعد تثبيت الكولاجين أمرا صعبا بشكل مدهش لأن الظروف التجريبية المتعددة قد تؤثر على كفاءة الشلل ، بما في ذلك نوع الكولاجين ودرجة الحموضة ودرجة الحرارة ونوع الصفيحة الدقيقة المستخدمة. هنا ، يتم توفير بروتوكول مفصل لشل حركة الكولاجين من النوع الأول والثالث وتحديده بشكل متكرر مما يؤدي إلى مواد هلامية / أغشية مستقرة وقابلة للتكرار. علاوة على ذلك ، يوضح هذا العمل كيفية إجراء وتحليل وتفسير دراسات ربط التألق التي تم حلها بمرور الوقت في المختبر للتحقيق في التفاعلات بين الكولاجين والمركبات المرشحة المرتبطة بالكولاجين (على سبيل المثال ، الببتيد المترافق مع مخلب معدني يحمل ، على سبيل المثال ، اليوروبيوم [الاتحاد الأوروبي (III)]). يمكن تطبيق مثل هذا النهج عالميا على العديد من التطبيقات الطبية الحيوية ، بما في ذلك مجال التصوير الجزيئي لتطوير مجسات التصوير المستهدفة ، وتطوير الأدوية ، ودراسات سمية الخلايا ، ودراسات تكاثر الخلايا ، والمقايسات المناعية.
Introduction
يعرف تراكم النسيج الضام الليفي كجزء من عملية التئام الجروح الطبيعية بعد إصابة الأنسجة بالتليف. ومع ذلك ، إذا فشل ترسب الأنسجة الليفية في الانتهاء واستمر إلى ما هو أبعد مما هو مطلوب لإصلاح الأنسجة ، فإن التليف يصبح مفرطا1،2. يضعف التليف المفرط فسيولوجيا الأعضاء ووظيفتها ويمكن أن يؤدي إلى تلف الأعضاء وربما فشل الأعضاء3،4،5. هناك محركان رئيسيان للتليف هما بروتينات المصفوفة خارج الخلية (ECM) الكولاجين من النوع الأول والنوع الثالث6. الكولاجين هو بروتين هيكلي موجود في أعضاء مختلفة يشكل ما يقرب من ثلث إجمالي محتوى البروتين في جسم الإنسان1. هناك 28 نوعا مختلفا من الكولاجين التي تم تحديدها عن طريق تسلسل الجينوم البشري ، وأكثرها وفرة هي الكولاجين الليفي7. الكولاجين الليفي الأساسي هو الكولاجين من النوع الأول ، والذي يزود ECM بقوة شد ومقاومة للتشوه8. الكولاجين من النوع الثالث هو مكون هيكلي يوفر مرونة ويتناقل مع الكولاجين من النوع الأول. يتم التعبير عنه أثناء التطور الجنيني ويوجد بشكل طبيعي بكميات صغيرة في الجلد والعضلات والأوعية الدمويةالبالغة 9.
يبدأ تخليق الكولاجين في الجسم الحي بعملية داخل الخلايا يتم فيها نسخ mRNA في النواة ثم ينتقل إلى السيتوبلازم ، حيث يتم ترجمته. بعد الترجمة ، تخضع السلسلة المتكونة لتعديل ما بعد الترجمة في الشبكة الإندوبلازمية ، حيث يتم تشكيل برو الكولاجين (مقدمة الكولاجين). ثم ينتقل Pro-collagen إلى جهاز Golgi للتعديل النهائي قبل إفرازه إلى الفضاء خارج الخلية10. من خلال الانقسام المحلل للبروتين ، يتحول برو الكولاجين إلى تروبوكولاجين. ثم يتم ربط هذا إما عبر مسار ربط متقاطع بوساطة إنزيمية محفز بواسطة إنزيم ليزيل أوكسيديز (LOX) أو عبر مسار ربط متقاطع غير إنزيمي يتضمن تفاعلميلارد 11. تعتمد بروتوكولات المختبر لتثبيت الكولاجين بشكل أساسي على قدرة الكولاجين على التجميع الذاتي. يتم استخراج الكولاجين من الأنسجة بناء على قابليته للذوبان ، والتي تعتمد إلى حد كبير على مدى الارتباط المتبادل لألياف الكولاجين الفردية7. يذوب الكولاجين الليفي في حمض الخليك ، ويمكن أن تصلح الألياف عند ضبط الرقم الهيدروجيني ودرجة الحرارة12. في المختبر ، يمكن اعتبار تكوين الليف للكولاجين عملية من مرحلتين7. المرحلة الأولى هي مرحلة التنوي ، حيث تشكل ألياف الكولاجين ثنائيات وألياف تشذيب قبل إعادة ترتيبها لتشكيل بنية حلزونية ثلاثية. المرحلة الثانية هي مرحلة النمو ، حيث تبدأ الألياف في النمو بشكل جانبي وتؤدي إلى تكوين النطاق D المميز ، والذي يتم ملاحظته بشكل عام من خلال التغيرات في التعكر7. كشفت دراسات الفحص المجهري للقوة الذرية (AFM) أيضا أن الكولاجين من النوع الأول والنوع الثالث لهما خصائص مختلفة (الجدول 1) 13.
لدراسة تفاعلات الربط بين الكولاجين والمركبات الأخرى ، يجب تثبيت الكولاجين بشكل متكرر في آبار الصفائح الدقيقة. هناك بروتوكولات مختلفة لتثبيت الكولاجين القابل للذوبان14،15،16. عادة ما تستخدم الصفائح الدقيقة المتوفرة تجاريا والمغلفة مسبقا بالكولاجين لزراعة الخلايا. ومع ذلك ، تحتوي الألواح الدقيقة المطلية مسبقا على طبقة رقيقة جدا من كمية غير معروفة من الكولاجين المطلي على الآبار ، مما يجعلها غير مناسبة لمقايسات الربط في المختبر . هناك العديد من التحديات عند تثبيت الكولاجين على آبار اللوحة. يتمثل أحد التحديات الرئيسية في اختيار نوع مناسب من الصفيحة الدقيقة ، لأن أنواعا مختلفة من الكولاجين (على سبيل المثال ، النوع الأول والثالث) لها خصائص كيميائية مختلفة ، وبالتالي ، تشل الحركة بشكل أكثر ثباتا وفعالية اعتمادا على مادة الصفيحة الدقيقة. التحدي الآخر هو الظروف التجريبية لبروتوكول الشلل ، حيث تعتمد عملية تكوين الليف على عوامل متعددة ، بما في ذلك درجة الحرارة ، ودرجة الحموضة ، وتركيز مخزون الكولاجين ، والتركيز الأيوني للمخزن المؤقت7.
لدراسة التفاعلات بين الكولاجين (الهدف) والمركبات الأخرى (أي الببتيد المستهدف) ، من الضروري أيضا تطوير فحص قوي للتحقيق في خصوصية وانتقائية المركب نحو الهدف عن طريق قياس ثابت التفكك ،KD. يتم التعبير عن موضع توازن تكوين مركب ثنائي الجزيئات بين البروتين (الكولاجين) والترابط من حيث ثابت الارتباط Ka ، الذي يتناسب حجمه مع تقارب الارتباط. ومع ذلك ، الأكثر شيوعا ، يعبر علماء الكيمياء الحيوية عن علاقات التقارب من حيث ثابت تفكك التوازن ،KD ، للمركب ثنائي الجزيئات ، والذي يتم تعريفه على أنه Kd = 1 / Ka (Kd وهو معكوس Ka). كلما انخفضت قيمة Kd ، زادت قوة الارتباط بين البروتين والترابط. ترتبط ميزة استخدام Kd لمقارنة تقارب الارتباط بين الروابط المختلفة لنفس البروتين (والعكس صحيح) بحقيقة أن وحدات Kd لمركب ثنائي الجزيئات هي مول / لتر (أي وحدة التركيز). في معظم الظروف التجريبية ، تتوافق قيمة Kd مع تركيز الترابط الذي يؤدي إلى تشبع 50٪ لمواقع الربط المتاحة على الهدف عند التوازن17،18. عادة ما يتم استخراج ثابت التفكك عن طريق تحليل الإشغال الجزئي للمستقبل (FO) ، والذي يتم تعريفه على أنه النسبة بين مواقع الربط المشغولة وإجمالي مواقع الربط المتاحة ، كدالة لتركيز الترابط. يمكن القيام بذلك بشرط توفر اختبار تحليلي قادر على تمييز وقياس كمية الترابط المقيد.
يمكن إجراء فحوصات ربط الترابط في المختبر باستخدام طرق التحليل الحيوي المختلفة ، بما في ذلك القياس الضوئي البصري ، وطرق الربط الإشعاعي ، وقياس الطيف الكتلي للبلازما المقترن بالحث (ICP-MS) ، ورنين البلازمون السطحي (SPR). من بين طرق القياس الضوئي ، تتطلب تلك التي تعتمد على انبعاث التألق عادة وضع العلامات على الروابط أو البروتينات بالفلوروفورات لزيادة الحساسية وتحسين حد الكشف عن المقايس. تعتبر مخلبات بعض أيونات اللانثانيد (III) ، مثل Eu (III) ، جذابة للغاية مثل الفلوروفورات لأنها تحتوي على تحولات ستوكس كبيرة ، ونطاقات انبعاث ضيقة (توفر نسبة إشارة إلى ضوضاء جيدة) ، وتبييض ضوئي محدود ، وعمر انبعاث طويل. الأهم من ذلك ، أن الخاصية الأخيرة تتيح استخدام التألق الذي تم حله بمرور الوقت (TRF) من الفلوروفورات Eu (III) لإلغاء التألق الذاتي في الخلفية19. في إصدار المقايسة المناعية الفلورية لللانثانيد المعزز بالتفكك (DELFIA) لمقايسة TRF المستندة إلى الاتحاد الأوروبي (III) ، يتم تحضين الروابط المصنفة بمخلب Eu (III) غير مضيء مع تثبيت المستقبل على الصفائح الدقيقة. يتم فصل مركب الترابط / المستقبلات المسمى عن الترابط غير المرتبط ، ويتم تنشيط مضان الاتحاد الأوروبي (III) عن طريق تفكك مركب الاتحاد الأوروبي (الثالث) عند درجة حموضة حمضية ، متبوعا بإعادة التعقيد باستخدام مخلب معزز للمضان لتشكيل مركب Eu (III) عالي الفلورسنت20.
يمكن تحقيق خطوة إزالة المعقدة بشكل معقول باستخدام المخلبات ، مثل ثنائي إيثيلين تريامين خماسي أسيتات (DTPA) ، التي تظهر حركية إزالة التعقيد السريعة. ومع ذلك ، فإن مجمعات الاتحاد الأوروبي (III) مع بعض المخلبات الحلقية الكبيرة ، مثل DOTA (1،4،7،10-tetraazacyclododecane1،4،7،10-tetraacetic acid) ومشتقاته أحادية أميد (DO3AAm) ، تظهر ثباتا ديناميكيا حراريا عاليا وخمول حركي عالي جدا. في هذه الحالة ، يجب تحسين خطوات إزالة المعقد بدقة لتحقيق تنشيط كاف وقابل للتكرار ل TRF21 القائم على الاتحاد الأوروبي (III). تجدر الإشارة إلى أن مجمعات اللانثانيد (Ln (III)) -DOTA و Ln (III) -DO3AAm هي تلك الأكثر استخداما كعوامل تباين للتصوير الجزيئي في الجسم الحي عن طريق تقنيات التصوير بالرنين المغناطيسي (MRI)22. وبالتالي ، فإن اختبار TRF المستند إلى Ln (III) هو الأداة المفضلة لدراسة تقارب ربط المجسات الجزيئية بالرنين المغناطيسي مع أهدافها البيولوجية المقصودة في المختبر . حاليا ، لا توجد بروتوكولات شاملة وقابلة للتكرار لتثبيت الكولاجين من النوع الأول والنوع الثالث وخط أنابيب قابل للتكرار لإجراء تجارب TRF للربط في المختبر Eu (III). للتغلب على هذه القيود ، تم تطوير طرق قابلة للتكرار للتجميع الذاتي وشل حركة الكولاجين من النوع الأول والنوع الثالث وتوليد المواد الهلامية والأفلام المستقرة ، على التوالي ، مع التركيز الكافي من الكولاجين المطلوب لفحوصات الربط في المختبر . يتم تقديم بروتوكول محسن ل EU (III) TRF للمجمعات الخاملة للغاية القائمة على Eu (III) -DO3Aam. أخيرا ، تم عرض مقايسة TRF المحسنة في المختبر Eu (III) لقياسKD للروابط المسماة بالاتحاد الأوروبي (III) تجاه الكولاجين من النوع الأول والنوع الثالث (الشكل 1).
Protocol
ملاحظة: يتم عرض جميع معلومات المنتج المستخدمة في هذا العمل في جدول المواد.
1. تجميد الكولاجين
ملاحظة: تأكد من أن كل بئر في الصفيحة الدقيقة المستخدمة أثناء اختبار الربط بها آبار مجاورة خالية لتجنب التألق المتقاطع. قم بتنفيذ هذا الجزء من البروتوكول على الجليد لأن الكولاجين يتجمع ذاتيا عند ارتفاع درجات الحرارة ومستويات الأس الهيدروجيني. قم بتنفيذ هذا الإجراء في غطاء مزرعة الأنسجة وفي ظل ظروف معقمة لأن الصفائح الدقيقة يتم تحضينها لاحقا في حاضنة زراعة الأنسجة (TC).
- تجميد الكولاجين من النوع الأول على الصفائح الدقيقة المكونة من 96 بئرا (الشكل 2)
اليوم 1- تحضير صينية سيليكون بالثلج. ضع القارورة التي تحتوي على الكولاجين من النوع الأول ، والمحلول الملحي البارد 10x المخزن بالفوسفات (PBS) ، والصفائح الدقيقة على الثلج ، ورش كل شيء بنسبة 70٪ من الإيثانول. ضع المادة تحت غطاء محرك TC.
- قم بتحييد الكولاجين باستخدام كميات متساوية من الكولاجين من النوع الأول و 10x PBS (درجة الحموضة 7.4).
- اقلب المحلول عدة مرات ، مع التأكد من عدم تكوين فقاعات.
- أضف 100 ميكرولتر من الكولاجين المحايد إلى كل بئر آخر وكل صف آخر من الصفيحة الدقيقة ، واحتضن عند 37 درجة مئوية لمدة 18-20 ساعة لتبخر الكولاجين حتى يجف.
اليوم 2 - اغسل الصفائح الدقيقة ب 100 ميكرولتر من 1x PBS ، درجة الحموضة 7.4 ، مرتين لإزالة أي كولاجين غير مرتبط.
- انقل الألواح الدقيقة إلى الحاضنة عند 37 درجة مئوية لمدة ساعتين أخريين حتى تجف قبل استخدامها لمزيد من تجارب الربط.
- تجميد الكولاجين من النوع الثالث على الصفائح الدقيقة المكونة من 96 بئرا (الشكل 3)
اليوم 1- تحضير صينية سيليكون بالثلج. ضع القارورة التي تحتوي على الكولاجين من النوع الثالث ، والبارد 10x PBS ، والصفائح الدقيقة على الثلج ، ورش كل شيء بنسبة 70٪ من الإيثانول. ضع المادة تحت غطاء محرك TC.
- قم بتحييد الكولاجين باستخدام كميات متساوية من الكولاجين من النوع الثالث و 10x PBS (درجة الحموضة 7.4).
- أضف 70 ميكرولتر من الكولاجين المحايد إلى كل بئر آخر وكل صف آخر من الصفيحة الدقيقة ، واحتضن عند 37 درجة مئوية لمدة ساعتين عن طريق وضع الصفيحة الدقيقة تحت غطاء مزرعة الأنسجة لتبخير الكولاجين حتى يجف.
اليوم 2 - اغسل الصفائح الدقيقة ب 70 ميكرولتر من 1x PBS ، درجة الحموضة 7.4 ، مرتين لإزالة أي كولاجين غير مرتبط.
- انقل الصفائح الدقيقة إلى الحاضنة لمدة ساعة واحدة عند 37 درجة مئوية ، ثم انقل الصفائح الدقيقة إلى المقعد ، واترك 1 ساعة حتى تجف قبل استخدامها في تجارب ربط أخرى.
2. تقييم استقرار المواد الهلامية / الأفلام الكولاجينية المجمدة
- حضانة مع PBS لمدة 1 ساعة
ملاحظة: أثناء تجربة الربط ، احتضان الكولاجين الثابت بمركب الاهتمام. من المهم التحقيق في استقرار هلام أو فيلم الكولاجين الناتج. للقيام بذلك ، قم بقياس استقرار ثلاثة شروط: لا غسيل = يقيس الكولاجين الثابت مباشرة بعد الحضانة ؛ الغسيل = يقيس الكولاجين الثابت بعد غسل الطبق مرتين ب 100 ميكرولتر من PBS ؛ و 1 ساعة PBS تقليد & غسل = يقيس الكولاجين الثابت بعد الحضانة لمدة ساعة واحدة مع PBS متبوعا بغسلتين مع PBS. أدناه ، يتم شرح طريقة حضانة PBS.- أضف 70 ميكرولتر من PBS (1x) إلى كل بئر من الآبار المطلية بالكولاجين ، واحتضن الصفيحة الدقيقة في درجة حرارة الغرفة لمدة 1 ساعة.
- استنشق السائل الزائد من كل بئر باستخدام ماصة ، واغسله باستخدام PBS (1x) مرتين قبل إجراء مقايسة قياس البروتين الموضح أدناه.
- القياس الكمي لكمية الكولاجين الثابت باستخدام مقايسة حمض البيسنكونينيك (BCA)
ملاحظة: استخدم مجموعة فحص البروتين Pierce BCA (جدول المواد) باتباع تعليمات الشركة المصنعة. ضع معايير الكولاجين الخاصة بهذا الفحص. يتراوح نطاق تركيز الكولاجين I من 0-3,000 ميكروغرام / مل وللكولاجين III من 0-750 ميكروغرام / مل. في المجموع ، قم بعمل 11 معيارا لكل كولاجين.- قم بإعداد الحجم الإجمالي لكاشف العمل (WR) المطلوب باتباع تعليمات الشركة المصنعة.
- أضف 25 ميكرولتر من كل معيار من الكولاجين في آبار الصفيحة الدقيقة (مكررة). تستخدم هذه الحلول لرسم المنحنى القياسي.
- أضف 200 ميكرولتر من محلول الكاشف العامل إلى كل بئر من الآبار التي تحتوي على المعايير والآبار المطلية بتركيزات غير معروفة من الكولاجين.
- ضع الصفيحة الدقيقة على شاكر الطبق لمدة 30 ثانية. قم بتغطية الصفائح الدقيقة واحتضانها عند 37 درجة مئوية لمدة 30 دقيقة.
- قم بإزالة الألواح الدقيقة واتركها لتبرد في درجة حرارة الغرفة. قم بقياس الامتصاص عند 560 نانومتر باستخدام قارئ لوحة.
- ارسم منحنى معايرة عن طريق رسم A560 (AU) مقابل التركيز (ميكروغرام / مل) للمحلالين القياسيين ال 11 ، واستخدم منحنى المعايرة لحساب كمية الكولاجين.
3. مقايسة ربط ترابط Europium (III) TRF (الشكل 1)
ملاحظة: المركب المستخدم هو ببتيد مرشح مرتبط بالكولاجين (CBP) مسمى بمركب واحد من الاتحاد الأوروبي (III) -DO3AAm ، يشار إليه باسم EU (III) -DO3AAm-CBP (الشكل 4).
- حضانة الألواح المطلية بالكولاجين بمركب EU (III) -DO3AAm-CBP
- تحضير محاليل مركب الاتحاد الأوروبي (III) -DO3AAm-CBP بتركيزات تتراوح بين 0.1-15 ميكرومتر (0.1 ميكرومتر ، 0.5 ميكرومتر ، 1 ميكرومتر ، 3 ميكرومتر ، 5 ميكرومتر ، 7 ميكرومتر ، 10 ميكرومتر ، 15 ميكرومتر) في 1x PBS.
- أضف 75 ميكرولتر من كل تركيز من المركب في الآبار المطلية بالكولاجين (اللوحة A). قم بإجراء التجربة بثلاث نسخ لحساب كمية المركب الذي يرتبط بالكولاجين.
- استخدم صفيحة ثانية غير مطلية (اللوحة B) ، وأضف 75 ميكرولتر من كل مركب إلى الآبار الفارغة لحساب الارتباط غير المحدد للمركب باللوحة. استخدم ثلاث نسخ لكل تركيز.
- احتضان الصفائح الدقيقة لمدة 1 ساعة في درجة حرارة الغرفة.
- باستخدام ماصة ، قم بشفط المحلول الزائد والتخلص منه من كل بئر ، واغسل الآبار باستخدام 1x PBS مرتين لإزالة المركب الزائد غير المرتبط. قم بتنفيذ هذه الخطوة باستخدام كل من الألواح الدقيقة المطلية بالكولاجين وغير المطلية.
- إلى صفيحة ثالثة غير مطلية (اللوحة C) ، أضف 10 ميكرولتر من نفس النطاق من تركيزات الاتحاد الأوروبي (III) -DO3AAm-CBP (مكررة). استخدم قراءة التألق من الاتحاد الأوروبي (III) -DO3AAm-CBP في المحلول لعمل منحنى معايرة.
ملاحظة: لا تغسل أو تستنشق المحلول من هذه اللوحة.
- الاستخراج الحمضي لقراءات Europium (III) والفلورة المحولة بمرور الوقت (TRF)
ملاحظة: يرجى الرجوع إلى المعلومات التكميلية حول تحضير ومعايرة أحجام المحلول الحمضي (AS) ومحلول التخزين المؤقت (BS). كانت أحجام AS و BS المطلوبة لتحقيق درجة حموضة مثالية بشكل متكرر 54 ميكرولتر و 46 ميكرولتر ، على التوالي ، في هذا العمل. قم بتنفيذ العملية التالية على اللوحة A واللوحة B واللوحة C.- أضف 54 ميكرولتر من المحلول الحمضي (AS) إلى كل بئر ، وضع اللوحة في الحاضنة عند 37 درجة مئوية لمدة 90 دقيقة ، مع تغطية الصفائح الدقيقة بورق الألمنيوم لتجنب التبخر. يجب التحكم بعناية في درجة الحرارة ووقت الحضانة لتحقيق إزالة المعقدة القابلة للتكرار.
- أضف 46 ميكرولتر من محلول التخزين المؤقت (BS) إلى كل بئر ، وقم بهز اللوحة برفق لمدة 30 ثانية.
- أضف 100 ميكرولتر من محلول التحسين (ES) ، ورج اللوحة لمدة 30 ثانية.
- انتظر لمدة 30 دقيقة قبل قراءة اللوحة باستخدام قارئ لوحة TRF. استخدم المعلمات المدرجة في الجدول 2.
4. تحليل البيانات
- القياس الكمي لتركيز الكولاجين الثابت على الآبار
- احصل على معادلة منحنى المعايرة ل A560 (AU) مقابل التركيز (ميكروغرام / مل) للمحلالين القياسيين ال 11.
- استخدم قراءات الامتصاص المكتسبة من الآبار التي تحتوي على معايير الكولاجين.
- قم بجدولة متوسط القيم من الآبار المكررة ، وارسم متوسط الامتصاص مقابل تركيزات البروتين (الكولاجين) المعروفة (ميكروغرام / مل) للحصول على معادلة المنحنى القياسي.
- استخدم قيم الامتصاص لحساب الكتلة (ميكروغرام) وتركيز (M) للكولاجين الثابت.
- احسب متوسط قيم الامتصاص عبر الآبار الثلاثة التي تحتوي على الكولاجين الثابت ، وسجل الانحراف المعياري.
- استخدم معادلة المنحنى القياسية التي تم الحصول عليها من منحنى الكولاجين القياسي (الخطوة 2.2.6) لتحويل الامتصاص المقاس من الآبار المطلية بالكولاجين إلى تنسيق. من هذا ، احسب تركيز الكولاجين الذي تم تجميده داخل الآبار التجريبية بالميكروغرام / مل.
- حول التركيز المحسوب في الخطوة 4.1.2.2 (ميكروغرام / مل) أولا إلى جرام / لتر ثم ، بناء على الوزن الجزيئي للكولاجين ، إلى مولار (M).
- أخيرا ، احسب كتلة الكولاجين الثابت في كل بئر بقسمة التركيز على حجم الكولاجين المضاف إلى البئر (100 ميكرولتر للكولاجين من النوع الأول و 70 ميكرولتر للكولاجين من النوع الثالث).
- احصل على معادلة منحنى المعايرة ل A560 (AU) مقابل التركيز (ميكروغرام / مل) للمحلالين القياسيين ال 11.
- حساب ثابت التفكك (Kd) (الشكل 4)
- استخرج قراءات التألق.
- تصدير قراءات التألق من قارئ اللوحة إلى جدول بيانات.
ملاحظة: في فحوصات الربط ، من المهم مراعاة الارتباط المحتمل غير المحدد لمركب بالسطح البلاستيكي للألواح. - احسب القيم المتوسطة للقياسات الثلاثية من كل تركيز مركب للألواح الثلاثة المختلفة: قراءات الربط المحددة من الآبار المطلية (اللوحة A) ، والربط غير المحدد من الآبار غير المطلية (اللوحة B) وإجمالي Eu (III) -DO3AAm-CBP في المحلول في الآبار غير المطلية (اللوحة C).
- حدد قيم التألق للمركب المرتبط عن طريق طرح قراءات التألق للآبار غير المطلية (اللوحة B) من قراءات الآبار المطلية (اللوحة A).
المعادلة 1: تحديد التألق المرتبط17:
الفلورسينيك المرتبط = محدد (الآبار المطلية) - غير محدد (آبار غير مطلية) - قم بإنشاء منحنى معايرة باستخدام القراءات من المركب المسمى بالاتحاد الأوروبي (III) في المحلول (اللوحة C). ارسم قراءات التألق التي تم الحصول عليها مقابل تركيز المركب المسمى الاتحاد الأوروبي (III). قم بإجراء ملاءمة انحدار خطي.
- تصدير قراءات التألق من قارئ اللوحة إلى جدول بيانات.
- تحويل قراءات التألق إلى تركيزات.
- قم بتحويل قراءات التألق المرتبط (الخطوة 4.2.3) إلى تركيز باستخدام منحنى التألق القياسي من البيانات التي تم إنشاؤها باستخدام التركيزات المركبة في المحلول (الخطوة 4.2.1.4).
ملاحظة: عند مقارنة خصائص الارتباط لمركب واحد بالبروتينات المستهدفة المختلفة التي تجميد بتركيزات مختلفة ، يجب مراعاة هذا الأخير عند حساب كمية المركب المرتبط بالهدف (أي المركب / البروتين المرتبط). - اقسم تركيز المركب المرتبط على تركيز البروتين الثابت في البئر.
ملاحظة: في هذا الحساب ، استخدم تركيز الكولاجين الثابت الذي تم حسابه بعد احتضان الآبار باستخدام PBS لمدة ساعة واحدة (ما يسمى بتجربة تقليد PBS ؛ القسم 2.1 أعلاه). هذا لحساب الخسائر المحتملة للكولاجين أثناء خطوة الحضانة وخطوة الغسيل التي لن تساهم في إشارة التألق النهائية. - ارسم البيانات باستخدام مخطط مبعثر يحتوي على تركيزات المركب على المحور x (μM) والمركب / البروتين المرتبط على المحور y.
- قم بتحويل قراءات التألق المرتبط (الخطوة 4.2.3) إلى تركيز باستخدام منحنى التألق القياسي من البيانات التي تم إنشاؤها باستخدام التركيزات المركبة في المحلول (الخطوة 4.2.1.4).
- احصل على قيمKd .
- تناسب البيانات التي تم الحصول عليها في الخطوة 4.2.2.3 باستخدام نموذجين حركيين محتملين للربط: ربط موقع واحد وربط موقع واحد بمنحدر تل. يتم عرض المعادلات لكل نموذج في الشكل 6.
- اختر النموذج الذي يوفر ملاءمة غير غامضة بأعلى قيمة R مربعة عند ملاءمة البيانات.
- استبعاد القيم المتطرفة (القيم المتطرفة) لكل مجموعة من قراءات التألق لكل تركيز لكل لوحة.
- احسب قيمة Kd النهائية ، واعرض البيانات كمتوسط ± الانحراف المعياري للتجارب المستقلة.
ملاحظة: للحصول على نتائج قوية ، قم بإجراء قياسات ثلاثية داخل كل لوحة وثلاث تجارب مستقلة على الأقل مع ألواح دقيقة مختلفة.
- احسب الإشغال الجزئي (FO).
ملاحظة: من المعادلة 2 ، يكون تركيز الهدف غير معروف ، وبالتالي ، باستخدام الجبر وKD ، من المعادلة 3 ، تنشأ معادلة قابلة للتطبيق لحساب الإشغال الكسري في شكل معادلة 4.
المعادلة 2: تعريف الشغل الكسري17:
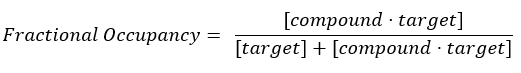
المعادلة 3: ثابت التفكك ، Kd ، وهو التركيز الذي يحتل عنده المركب 50٪ من الهدف عند التوازن17:
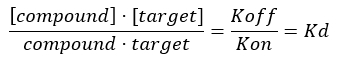
المعادلة 4: معادلة معاد ترتيبها لحساب معادلة FO17:
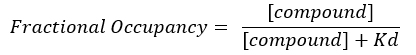
- احسب FO باستخدام قيمKD المستقلة التي تم الحصول عليها لكل لوحة على حدة. ارسم النتائج والمتوسط والانحرافات المعيارية ل FO مقابل تركيز المركب.
- أبلغ عن FO بقيم تتراوح من 0 إلى 1 أو كنسبة مئوية بقيم تتراوح من 0٪ إلى 100٪.
- استخرج قراءات التألق.
النتائج
تقييم استقرار وتركيز الكولاجين من النوع الأول والنوع الثالث الثابت في المواد الهلامية / الأغشية
تم إجراء القياس الكمي لتركيز الكولاجين الثابت لكل بئر باستخدام ثلاثة شروط مختلفة: أ) في الآبار دون غسل باستخدام PBS بعد تثبيت البروتينات (بدون غسيل) ؛ ب) في الآبار بخ?...
Discussion
يقدم هذا العمل طريقة قابلة للتكرار لتثبيت الكولاجين من النوع الأول والنوع الثالث. كما يوضح بروتوكولا للحصول على بيانات ربط TRF Eu (III) في المختبر وتحليلها وتفسيرها لتوصيف خصائص الربط للرابط المرشح تجاه الكولاجين من النوع الأول والثالث. تم تطوير بروتوكولات تثبيت الكول?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نحن ممتنون للممولين التاليين لدعم هذا العمل: (1) مجلس البحوث الطبية في المملكة المتحدة (MR / N013700 / 1) وعضو كينغز كوليدج لندن في شراكة تدريب الدكتوراه MRC في العلوم الطبية الحيوية. (2) منحة برنامج BHF RG/20/1/34802؛ (3) منحة مشروع BHF PG/2019/34897 ؛ (4) منحة مركز كينغز BHF للتميز البحثي RE / 18/2/34213 ؛ (5) برنامج مبادرة علوم الألفية - ICN2021_004 التابع للمعهد الوطني للتنمية الدولية. و (6) منحة ANID Basal FB210024.
Materials
| Name | Company | Catalog Number | Comments |
| 10x PBS | Gibco | 14200075 | Use this to make 1x PBS by diluting in water (1:10) |
| 10x PBS | Gibco | 14200075 | Use this to make 1x PBS by diluting in water (1:10) |
| 2M HCL | Made in house and details are in the supporting document | ||
| 2M HCL | Made in house and details are in the supporting document | ||
| 2M Sodium hydroxide +2M Glycine | Made in house and details are in the supporting document | ||
| 2M Sodium hydroxide +2M Glycine | Made in house and details are in the supporting document | ||
| Cell-star 96 well microplate | Greiner Bio-One | 655 160 | |
| Cell-star 96 well microplate | Greiner Bio-One | 655 160 | |
| DELFIA enhacement solution | Perkin Elmer | 1244-104 | |
| DELFIA enhacement solution | Perkin Elmer | 1244-104 | |
| Ice | |||
| Ice | |||
| Infinite 200 PRO NanoQuant microplate reader | TECAN | ||
| Infinite 200 PRO NanoQuant microplate reader | TECAN | ||
| Non-binding (NBS) 96 well microplates | Corning | 3641 | |
| Non-binding (NBS) 96 well microplates | Corning | 3641 | |
| pH electrode Inlab Routine | Mettler Toledo | 51343050 | |
| pH electrode Inlab Routine | Mettler Toledo | 51343050 | |
| pH meter (sevenCompact) | Mettler Toledo | ||
| pH meter (sevenCompact) | Mettler Toledo | ||
| Pierce BCA protein assay kit | Thermofisher | 23227 | |
| Pierce BCA protein assay kit | Thermofisher | 23227 | |
| Tissue culture incubator (37 °C, 5% CO2) | |||
| Type I bovine collagen, 3 mg/mL | Corning | 354231 | |
| Type III human placenta collagen, 0.99 mg/mL | Advanced Biomatrix | 5021 |
References
- Distler, J. H. W., et al. Review: Frontiers of antifibrotic therapy in systemic sclerosis. Arthritis and Rheumatology. 69 (2), 257-267 (2017).
- Wynn, T. A. Fibrotic disease and the TH1/TH2 paradigm. Nature Reviews Immunology. 4 (8), 583-594 (2004).
- Saha, P., et al. Magnetic resonance T1 relaxation time of venous thrombus is determined by iron processing and predicts susceptibility to lysis. Circulation. 128 (7), 729-736 (2013).
- Mirshahi, M., et al. Defective thrombolysis due to collagen incorporation in fibrin clots. Thrombosis Research. 8, 73-80 (1988).
- Comerota, A. J. The ATTRACT trial: Rationale for early intervention for iliofemoral DVT. Perspectives in Vascular Surgery and Endovascular Therapy. 21 (4), 221-225 (2009).
- Bateman, E. D., Turner-Warwick, M., Adelmann-Grill, B. C. Immunohistochemical study of collagen types in human foetal lung and fibrotic lung disease. Thorax. 36 (9), 645-653 (1981).
- Pawelec, K. M., Best, S. M., Cameron, R. E. Collagen: A network for regenerative medicine. Journal of Materials Chemistry B. 4 (40), 6484-6496 (2016).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Copes, F., Pien, N., Van Vlierberghe, S., Boccafoschi, F., Mantovani, D. Collagen-based tissue engineering strategies for vascular medicine. Frontiers in Bioengineering and Biotechnology. 7, 166 (2019).
- Veis, A. The biochemistry of collagen. Annals of Clinical and Laboratory Science. 5 (2), 123-131 (1975).
- Bielajew, B. K., Hu, J. C., Athanasiou, K. A. Collagen: Quantification, biomechanics, and role of minor subtypes in cartilage. Nature Reviews Materials. 5, 730-747 (2020).
- Zhao, Z., et al. Structural and functional plasticity of collagen fibrils. DNA and Cell Biology. 38 (4), 367-373 (2019).
- Eryilmaz, E., Teizer, W., Hwang, W. In vitro analysis of the co-assembly of type-I and type-III collagen. Cellular and Molecular Bioengineering. 10 (1), 41-53 (2017).
- Jagnow, J., Clegg, S. Klebsiella pneumoniae MrkD-mediated biofilm formation on extracellular matrix- and collagen-coated surfaces. Microbiology. 149 (9), 2397-2405 (2003).
- O'Sullivan, D., O'Neill, L., Bourke, P. Direct plasma deposition of collagen on 96-well polystyrene plates for cell culture. ACS Omega. 5 (39), 25069-25076 (2020).
- Caravan, P., et al. Collagen-targeted MRI contrast agent for molecular imaging of fibrosis. Angewandte Chemie - International Edition. 46 (43), 8171-8173 (2007).
- Copeland, R. A. . Enzymes: A Practical Introduction to Structure, Mechanism, and Data Analysis. , (2000).
- Salahudeen, M. S., Nishtala, P. S. An overview of pharmacodynamic modelling, ligand-binding approach and its application in clinical practice. Saudi Pharmaceutical Journal. 25 (2), 165-175 (2017).
- Bünzli, J. C. G., Piguet, C. Taking advantage of luminescent lanthanide ions. Chemical Society Reviews. 34 (12), 1048-1077 (2005).
- Hemmilii, I. Luminescent lanthanide chelates - A way to more sensitive diagnostic methods. Journal of Alloys and Compounds. 225 (1-2), 480-485 (1995).
- De Silva, C. R., Vagner, J., Lynch, R., Gillies, R. J., Hruby, V. J. Optimization of time-resolved fluorescence assay for detection of europium-tetraazacyclododecyltetraacetic acid-labeled ligand-receptor interactions. Analytical Biochemistry. 398 (1), 15-23 (2010).
- Digilio, G., Lacerda, S., Lavin Plaza, B., Phinikaridou, A. Extracellular matrix targeted MRI probes. Analysis & Sensing. 3 (1), (2022).
- Phinikaridou, A., et al. Tropoelastin: A novel marker for plaque progression and instability. Circulation. Cardiovascular imaging. 11 (8), 007303 (2018).
- Guzaeva, T. V., et al. Protein A used in DELFIA for the determination of specific antibodies. Immunology Letters. 35 (3), 285-289 (1993).
- Nasiri, A. H., Nasiri, H. R. Polymerase assays for lead discovery: An overall review of methodologies and approaches. Analytical Biochemistry. 563, 40-50 (2018).
- Capuana, F., et al. Imaging of dysfunctional elastogenesis in atherosclerosis using an improved gadolinium-based tetrameric MRI probe targeted to tropoelastin. Journal of Medicinal Chemistry. 64 (20), 15250-15261 (2021).
- Drescher, D. G., Drescher, M. J., Ramakrishnan, N. A. Surface plasmon resonance (SPR) analysis of binding interactions of proteins in inner-ear sensory epithelia. Methods in Molecular Biology. 493, 323-343 (2009).
- Murali, S., Rustandi, R. R., Zheng, X., Payne, A., Shang, L. Applications of surface plasmon resonance and biolayer interferometry for virus-ligand binding. Viruses. 14 (4), 717 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved