A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مراقبة التوهج الحيوي لبقاء الكسب غير المشروع في نموذج نقل بالتبني لمرض السكري المناعي الذاتي في الفئران
In This Article
Summary
يصف هذا البروتوكول طريقة مباشرة وطفيفة التوغل لزرع وتصوير خلايا NIT-1 في الفئران المصابة بالسكري غير البدينة (NOD) التي تعاني من نقص المناعة الشديد والتي تم تحديها مع خلايا الطحال المنقاة من فئران NOD المصابة بالسكري تلقائيا.
Abstract
يتميز مرض السكري من النوع 1 بتدمير المناعة الذاتية لخلايا بيتا المنتجة للأنسولين في البنكرياس. العلاج الواعد لهذا المرض هو زرع خلايا بيتا المشتقة من الخلايا الجذعية. ومع ذلك ، قد تكون التعديلات الجينية ضرورية لحماية الخلايا المزروعة من المناعة الذاتية المستمرة. تعد نماذج الفئران المصابة بالسكري أداة مفيدة للتقييم الأولي لاستراتيجيات حماية الخلايا المزروعة من هجوم المناعة الذاتية. الموصوفة هنا هي طريقة طفيفة التوغل لزرع وتصوير الطعوم الخلوية في نموذج نقل بالتبني لمرض السكري في الفئران. في هذا البروتوكول ، يتم زرع خلايا من خط خلايا بيتا البنكرياس NIT-1 الذي يعبر عن اليراع luciferase transgene luc2 تحت الجلد في الفئران المصابة بنقص المناعة غير البدينة (NOD) - شديدة النقص المناعي المشترك (scid). يتم حقن هذه الفئران في وقت واحد عن طريق الوريد مع خلايا الطحال من الفئران NOD السكري تلقائيا لنقل المناعة الذاتية. يتم تصوير الطعوم على فترات منتظمة عبر التصوير الحيوي غير الجراحي لمراقبة بقاء الخلية. تتم مقارنة بقاء الخلايا الطافرة مع بقاء الخلايا الضابطة المزروعة في نفس الفأر.
Introduction
يحدث مرض السكري من النوع الأول (T1D) بسبب تدمير المناعة الذاتية لخلايا بيتا المنتجة للأنسولين في البنكرياس. يؤدي فقدان كتلة خلايا بيتا إلى نقص الأنسولين وارتفاع السكر في الدم. يعتمد مرضى T1D على الحقن اليومية المتعددة للأنسولين الخارجي ويعانون من نوبات من ارتفاع السكر في الدم الشديد ونقص السكر في الدم طوال حياتهم. تشمل المضاعفات المرتبطة بهذه الحلقات اعتلال الشبكية السكري ، وانخفاض وظائف الكلى ، والاعتلال العصبي1.
حقن الأنسولين هي علاج ولكن ليس علاجا ل T1D. ومع ذلك ، فإن استبدال كتلة خلايا بيتا المفقودة لديه القدرة على عكس المرض من خلال تمكين المرضى من إنتاج الأنسولين الخاص بهم. ومع ذلك ، فإن المعروض من الجزر المانحة للجثث محدود2. قد توفر الجزر المشتقة من الخلايا الجذعية (SC-islets) إمدادات غير محدودة تقريبا من خلايا بيتا للزراعة. أثبتت عدة مجموعات أنه يمكن تمييز الخلايا الجذعية الجنينية البشرية (ESCs) والخلايا الجذعية المستحثة متعددة القدرات (iPSCs) لتوليد خلايا وظيفية شبيهة ببيتا3،4،5. تشير بيانات التجارب السريرية المبكرة الواعدة إلى أن هذه الخلايا تحافظ على وظيفتها بعد الزرع وقد تمكن المرضى من أن يصبحوا مستقلين عن الأنسولين6. ومع ذلك ، فإن كبت المناعة المزمن مطلوب ، مما يزيد من تعرضهم للإصابة بالسرطان والعدوى. بالإضافة إلى ذلك ، قد تكون العوامل المثبطة للمناعة سامة للخلايا للطعوم على المدىالطويل 7. للقضاء على الحاجة إلى كبت المناعة ، يمكن تعديل الجزر SC وراثيا لحمايتها من المناعة الذاتية المتكررة وكذلك المناعة الخيفية بعد الزرع.
أبحاث الخلايا الجذعية تتطلب الكثير من حيث التكاليف والعمالة. تعد خطوط خلايا الفأر والنماذج الحيوانية أدوات مفيدة للتحديد الأولي والتحقق التجريبي من استراتيجيات حماية الخلايا المزروعة من المناعة الذاتية. يصاب فأر NOD بمرض السكري المناعي الذاتي العفوي مع العديد من أوجه التشابه مع T1D8 البشري ، ويشترك خط خلايا الورم الأنسوليني NIT-1 في خلفية وراثية مع سلالة الفأر9. يمكن نقل مرض السكري بالتبني إلى سلالة الفئران NOD-scid ذات الصلة التي تعاني من نقص المناعة عن طريق حقن خلايا الطحال السكرية من فئران NOD من أجل مزامنة ظهور مرض السكري مؤقتا في الفئران التجريبيةالمكررة 10. يمكن استخدام هذا النموذج لتحديد الأهداف الجينية بسرعة نسبية وبتكلفة زهيدة لمزيد من التحقق في الجزر SC. في الآونة الأخيرة ، تم تطبيق الطريقة لتحديد والتحقق من صحة RNLS ، وهو هدف تم العثور عليه لحماية الجزر البشرية الأولية من المناعة الذاتية في الجسم الحي والجزر المشتقة من iPSC من إجهاد خلايا بيتا في المختبر11. الموصوف هنا هو بروتوكول مباشر لزرع خلايا NIT-1 المعدلة وراثيا ومراقبة بقائها على قيد الحياة بشكل غير جراحي في نموذج نقل بالتبني لمرض السكري المناعي الذاتي في الفئران.
Protocol
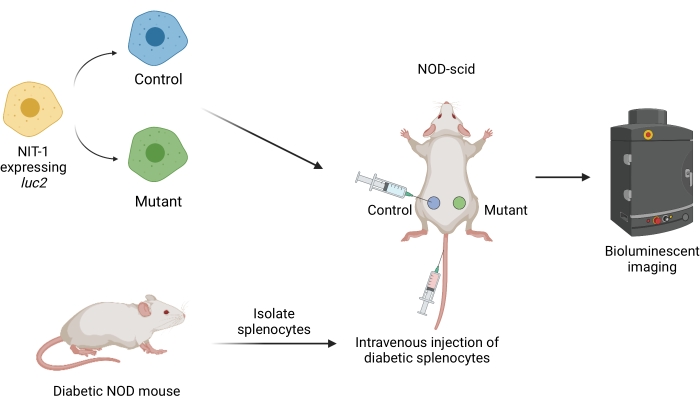
الشكل 1: سير العمل لزراعة الطعوم وتصويرها في نموذج النقل بالتبني لمرض السكري في الفئران. يتم زرع خلايا NIT-1 التي تعبر عن اليراع الناقل الجيني لوسيفيراز (luc2) تحت الجلد في الفئران NOD-scid. يتم حقن الفئران في وقت واحد مع خلايا الطحال ذاتية التفاعل المعزولة من فأر NOD السكري تلقائيا. يتم تصوير الطعوم على فترات منتظمة عن طريق التصوير الحيوي غير الغازي. الشكل الذي أنشأه BioRender.com. الاختصارات: NOD = مرض السكري غير البدين. SCID = نقص المناعة المشترك الشديد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تمت الموافقة على جميع بروتوكولات رعاية الحيوانات ودراستها وتنفيذها وفقا للجنة المؤسسية لرعاية واستخدام الحيوان (IACUC) في مركز جوسلين للسكري. يمكن الحصول على الفئران NOD و NOD-scid بسهولة من مصادر تجارية. يتم الاحتفاظ بجميع الفئران في هذه الدراسة في منشأة مراقبة الحراسة. راجع جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والحيوانات والأدوات والبرامج المستخدمة في هذا البروتوكول.
1. هندسة وصيانة خطوط الخلايا NIT-1
- الحفاظ على خطوط خلايا NIT-1 ، التي تشترك في الخلفية الوراثية مع الفئران NOD ، وخلايا 293FT في الأطباق المعالجة بزراعة الأنسجة في DMEM التي تحتوي على 4.5 جم / لتر من الجلوكوز المكمل بمصل بقري جنيني بنسبة 10٪ و 1٪ بنسلين / ستربتومايسين في حاضنة 37 درجة مئوية مع 5٪ CO2.
- تنمو خلايا 293FT إلى التقاء 70٪ -80٪ للنقل.
- لكل طبق 10 سم من خلايا 293FT ، اجمع بين 10 ميكروغرام من pLenti-luciferase-blast (انظر الملف التكميلي 1) ، والذي يعبر عن جين اليراع لوسيفيراز التحوير (luc2) تحت سيطرة مروج EF1α النشط بشكل أساسي ، 2 ميكروغرام لكل من بلازميدات التعبئة والتغليف pMD2.G و pMDLg / pRRE و pRSV-Rev و 4 ميكروغرام من بروتين المغلف بلازميد pCMV-VSV-G ، و 60 ميكروغرام من البولي إيثيلين الخطي (PEI) في 1 مل من DMEM الخالي من المصل. اضبط الكميات بناء على عدد الخلايا المراد نقلها.
- اترك الحمض النووي وجزيرة الأمير إدوارد و DMEM في درجة حرارة الغرفة (RT) لمدة 20 دقيقة ، ثم أضفها إلى خلايا 293FT.
- جمع الوسط الذي يحتوي على جزيئات lentiviral بعد 48 ساعة من النقل.
- قم بتحويل خلايا NIT-1 عند التقاء ~ 80٪ مع 1 مل من الوسط الذي يحتوي على جزيئات عدسية لكل 106 خلايا لمدة 48-72 ساعة.
- حدد الخلايا المعبرة عن لوسيفيراز مع 5 ميكروغرام / مل بلاستيسيدين لمدة 48 ساعة.
- مزيد من التعديل الوراثي للخلايا المعبرة عن لوسيفيراز لتناسب السؤال التجريبي. قم بتضمين خط خلية تحكم من النوع البري أو غير المستهدف للتعبير عن luciferase للمقارنة.
ملاحظة: تتضمن أمثلة التعديلات الجينية المستهدفة خروج المغلوب كريسبر ، و CRISPRa / i ، وضربة قاضية shRNA ، والإفراط في التعبير.
2. تحضير خلايا NIT-1 للزراعة
- تنمو الخلايا المعبرة عن لوسيفيراز حتى تتلاقى بنسبة 80٪ -90٪.
- قم بإزالة وسط النمو وغسل الخلايا بمحلول ملحي مخزن بالفوسفات (PBS ، 5 مل لطبق 10 سم).
- أضف 1 مل من 0.05٪ تربسين-EDTA إلى كل طبق لمدة 2 دقيقة.
- تحييد التربسين مع 5 مل من وسط النمو.
- استخدم ماصة لغسل الخلايا من الطبق ونقلها إلى أنبوب مخروطي.
ملاحظة: يمكن دمج خلايا من أطباق متعددة من نفس خط الخلية. - عد الخلايا باستخدام بقعة مثل التريبان الأزرق يدويا باستخدام مقياس الدم أو تلقائيا باستخدام عداد الخلايا التلقائي.
- أجهزة الطرد المركزي في 250 × غرام لمدة 5 دقائق في RT وإزالة طاف مع ماصة شفط.
- أعد تعليق حبيبات الخلية في برنامج تلفزيوني بتركيز 5 × 10 7 خلايا / مل (سيتم زرع 107 خلايا لكل خط خلية لكل فأر بحجم 200 ميكرولتر).
- الحفاظ على الخلايا على الجليد (لمدة تصل إلى 3 ساعات) حتى الزرع.
3. زرع خلايا NIT-1 في الفئران NOD-scid
- تخدير الفئران المتلقية (الفئران NOD-scid البالغة من العمر 8-10 أسابيع من نفس جنس الفئران المستخدمة لعزل الخلايا الطحالية) عن طريق استنشاق الأيزوفلوران في غرفة ضربة قاضية. قم بتوصيل 2.5٪ إيزوفلوران إلى الغرفة بمعدل تدفق 1.5 لتر / دقيقة ومعدل إخلاء 9 لتر / دقيقة.
- تليين عيون الحيوان مع مرهم العيون لمنع الجفاف.
- باستخدام ماكينة حلاقة كهربائية مع واقي ، قم بإزالة الشعر من الجزء الخلفي (الجانب الظهري) من الفئران لكشف الجلد. ستكون منطقة الزرع المحلوق حوالي 1 بوصة × 2 بوصة. أعد الفئران المحلوقة إلى غرفة الضربة القاضية حتى عملية الزرع.
- نقل الفئران واحدة تلو الأخرى إلى سطح نظيف مع مخروط الأنف isoflurane. وجه رأس الماوس برفق إلى مخروط الأنف. استخدم معدل تدفق إيزوفلوران يبلغ 0.25 لتر / دقيقة للحفاظ على التخدير أثناء عملية الزرع.
- امسح منطقة الزرع بوسادة تحضير كحول الأيزوبروبيل لإزالة الشعر المتساقط وتطهير الجلد.
- تأكد من إعادة تعليق الخلايا بالكامل قبل تحميل المحقنة. ارسم حجما زائدا (>300 ميكرولتر) من الخلايا في حقنة معقمة سعة 1 مل بإبرة 26 جرام. إزالة أي فقاعات. ثم أعد الخلايا الزائدة إلى الأنبوب بحيث يبقى 300 ميكرولتر من معلق الخلية في المحقنة.
- باستخدام زوج من الملقط المنحني المثبت في اليد غير المهيمنة ، ارفع الجلد برفق على جانب واحد (يسار أو يمين) من ظهر الماوس للسماح بوصول أسهل إلى المساحة تحت الجلد.
- باستخدام اليد المهيمنة ، ضع المحقنة بالتوازي مع الطائرات الإكليلية والسهمية لجسم الماوس. مع توجيه الإبرة نحو رأس الماوس ، أدخل الإبرة في الجلد بالقرب من المؤخرة ، وقم بتوجيهها برفق إلى الفضاء تحت الجلد. تأكد من بقاء الإبرة بأكملها تحت الجلد وعدم اختراقها.
- اضبط الملقط لتثبيت الجلد برفق حول قاعدة الإبرة. قم بتوزيع كمية صغيرة من تعليق الخلية ببطء (<50 ميكرولتر) وتأكد من وجود انتفاخ صغير تحت الجلد في موقع الحقن. استمر في حقن معلق الخلية حتى يتم توصيل 200 ميكرولتر إلى الفضاء تحت الجلد.
- تثبيت الملقط في مكانه والحفاظ على الإبرة موازية لجسم الماوس ، اسحب الإبرة ببطء. بعد إزالة الإبرة، أغلق الجلد بالملقط لبضع ثوان لمنع الخلايا من التسرب من جرح البزل.
- إذا تم تقييم التعديل الجيني ، كرر عملية الزرع على الجانب الآخر من الفأر باستخدام حقنة مختلفة بحيث يتم حقن كل من الخلايا الطافرة والخلايا الضابطة في كل فأر ، مع وجود خط خلية واحد على اليسار والآخر على اليمين. إذا تم زرع خط خلية واحد فقط ، فقم بحقن الخلايا على جانب واحد فقط.
- بعد عملية الزرع ، انقل كل فأر إلى قفص جديد. اسمح لكل فأر بالتعافي تماما من التخدير قبل إضافة فئران إضافية إلى القفص.
ملاحظة: يتم استرداد الفئران عندما تستأنف أنشطتها العادية ولا تظهر عليها علامات الخمول أو ضعف الحركة. - تقييم الحالة الصحية للفئران يوميا طوال مدة التجربة بعد عملية الزرع. إذا شكلت الطعوم انتفاخا كبيرا أو أصبحت الفئران ضعيفة وخاملة ، فقم بقياس نسبة الجلوكوز في الدم وتوفير 10٪ (وزن / وزن) من ماء السكروز لجميع الفئران المصابة بسكر الدم. اتبع جميع التوصيات البيطرية والقتل الرحيم لأي فئران مع استمرار حالة الجسم السيئة وفقا للإرشادات المؤسسية. في هذه الدراسة ، تم القتل الرحيم للفئران عن طريق استنشاق CO2 متبوعا بخلع عنق الرحم.
4. عزل وتنقية خلايا الطحال ذاتية التفاعل
- حدد ذكور أو إناث الفئران NOD البالغة من العمر 10-16 أسبوعا المصابة بداء السكري حديث الظهور (أقل من 10 أيام) باستخدام شرائط اختبار الجلوكوز في البول (أو الدم). تعتبر الفئران NOD مصابة بمرض السكري عندما يكون لديهم البول / جلوكوز الدم ≥250 ملغ / ديسيلتر على الأقل 2 أيام متتالية.
ملاحظة: لكل فأر NOD-scid ، هناك حاجة إلى 10 ملايين خلية طحالية. ينتج الطحال الواحد عادة 50 مليون إلى 150 مليون خلية طحالية. تم عزل الخلايا الطحالية من الفئران الخالية من مسببات الأمراض الموجودة في منشأة خاضعة للمراقبة الحساسة. - القتل الرحيم للعدد المناسب من الفئران NOD السكري.
ملاحظة: في هذه الدراسة ، تم القتل الرحيم للفئران عن طريق استنشاق CO2 متبوعا بخلع عنق الرحم لضمان الوفاة. - مع وجود الماوس على ظهره ، قم بعمل شق عمودي بطول 2 بوصة تقريبا في الجلد باستخدام مقص جراحي. افتح الجانب الأيمن من الماوس من وجهة نظر الباحث وحدد موقع الطحال الأحمر الفاتح. قطع الطحال بلطف بعيدا عن البنكرياس الوردي ونقله إلى طبق بتري معقم 10 سم يحتوي على 5 مل من برنامج تلفزيوني معقم. كرر التشريح مع أكبر عدد ممكن من الفئران حسب الحاجة.
ملاحظة: يمكن دمج الطحال من فئران متعددة في طبق واحد. قم بإجراء الخطوات التالية باستخدام الكواشف والمعدات المعقمة في غطاء معقم. - اهرسي الطحال (الطحال) بالجزء العلوي المسطح من مكبس حقنة معقمة.
- ضع مصفاة 40 ميكرومتر أو 70 ميكرومتر في أنبوب مخروطي سعة 50 مل واغسل المصفاة ب 5 مل من PBS لتجهيزها. انقل تعليق الطحال (الطحال) إلى المصفاة واستمر في الهرس اللطيف عبر المصفاة. اغسل الطبق ب 10 مل من PBS وانقل الغسيل إلى المصفاة. استمر في الهرس حتى يختفي اللون الأحمر من المصفاة.
- تخلص من المصفاة وقم بتدوير الأنبوب عند 500 × جم لمدة 5 دقائق في RT. قم بإزالة المادة الطافية باستخدام ماصة شفط.
- أعد تعليق حبيبات الخلية في 5 مل (لما يصل إلى ثلاثة طحال) من محلول تحلل ACK المسخن مسبقا إلى RT وتحلل خلايا الدم الحمراء لمدة 4 دقائق. قم بزيادة الحجم بمقدار 1-2 مل لكل طحال إذا كانت هناك حاجة إلى طحال إضافي.
- أوقف التفاعل باستخدام 5 مل من وسائط خلية NIT-1 (الموصوفة أعلاه) لكل 5 مل من محلول التحلل. مرر تعليق الخلية من خلال مصفاة جديدة لإزالة الكتل. تخلص من المصفاة ، وقم بتدويرها بمعدل 500 × جم لمدة 5 دقائق في RT.
- أعد تعليق حبيبات الخلية في 20 مل من PBS ، وعد الخلايا. تدور عند 500 × جم لمدة 5 دقائق في RT. أعد تعليق الخلايا في برنامج تلفزيوني معقم بتركيز 1 × 108 خلايا / مل (حجم الحقن 0.1 مل / فأر) في أنبوب تفاعل قفل آمن سعة 1.5 مل.
- قم بتخزين الخلايا على الجليد (لمدة لا تزيد عن 1 ساعة) أو احتفظ بالخلايا في RT ، وانتقل إلى حقن الوريد الذيل على الفور.
5. الحقن الوريدي لخلايا الطحال السكرية عبر الوريد الجانبي
- قم بتسخين جسم الفئران المتلقية البالغة NOD-scid (على سبيل المثال ، باستخدام مصباح حراري لمدة ~ 5-10 دقائق) لتوسيع الأوردة (وهذا يساعد على التصور والحقن في الوريد).
ملاحظة: لتجنب ارتفاع درجة حرارة الفئران ، لا تتجاوز هذا الوقت. راقب دائما الحالة الصحية. إذا بدت الفئران منهكة أو غير متحركة ، فقم بإغلاق مصباح الحرارة على الفور. - الاحماء تعليق الخلية. تحضير حقنة معقمة (0.3-1.0 مل) بإبرة معقمة (27-30 جم ، 0.3 مم / 0.5 بوصة أو أصغر) ، أو استخدم حقنة أنسولين معقمة 0.5 مل بإبرة 0.3 مم (0.5 بوصة). احتفظ دائما بالإبرة معقمة واستخدم صينية معقمة إذا كان يجب وضع المحقنة بين الحقن.
- أعد تعليق محلول الخلايا الطحالية قبل كل حقنة. لكل ماوس ، اسحب 100 ميكرولتر من تعليق الطحال المسخن والمختلط في المحقنة. تأكد من عدم وجود فقاعات هواء في المحقنة أو في التعليق.
ملاحظة: تأكد من تجهيز جميع المعدات والإمدادات (مناديل الكحول للتطهير ، وحقنة محملة بالخلايا الطحالية المراد حقنها ، وقفص جديد لفصل الفئران المحقونة) قبل وضع الماوس في جهاز التقييد. - ضع الماوس في جهاز التقييد. التقط الذيل باليد غير المهيمنة وحدد موقع أحد عروق الذيل الجانبية. قم بتدوير الذيل برفق إذا لزم الأمر. امسح الذيل بمسح التطهير (70٪ كحول الأيزوبروبيل) لتنظيف البشرة وزيادة وضوح الوريد.
- أدخل الإبرة بزاوية حادة في المنطقة الوسطى من الذيل باليد المهيمنة. مع توجيه شطبة الإبرة لأعلى ، حرك الإبرة بضعة ملليمترات عبر الجلد.
ملاحظة: تأكد من أن الإبرة موازية للوريد وتوضع قليلا تحت الجلد. كن مستعدا للحركات المفاجئة للفأر / الذيل مباشرة بعد اختراق الجلد / جدار الوعاء الدموي. يجب أن يبدو الإدخال الناجح للإبرة وكأنه "شريحة ناعمة" في الوريد. إذا كانت هناك حاجة إلى محاولة أخرى ، فتحرك لأعلى الذيل نحو الجسم. - اضغط برفق على المحقنة لحقن معلق الخلايا الطحالية. لا تسمح للإبرة بالتحرك أكثر للداخل أو للخارج عند الحقن. تكون الحقن الناجحة سلسة دون الشعور بأي ضغط خلفي أثناء الحقن ويشار إليها بتدفق دم شفاف / أبيض بعد الحقن مباشرة.
- حرر الإبرة برفق من الوريد ، واضغط ضغطا خفيفا على الذيل بمسح التطهير حتى يتوقف النزيف. حرر الماوس من جهاز ضبط النفس ، وانقله برفق إلى قفص طازج.
ملاحظة: حقن اثنين إلى ثلاثة من الفئران الضابطة التي لا تتلقى زرع خلية NIT-1 مع الخلايا الطحالية لتأكيد إمكانات الخلايا الطحال ذاتية التفاعل للحث على مرض السكري ، والذي يستغرق حوالي 2-4 أسابيع بعد الحقن.
6. التصوير الحيوي في الجسم الحي لترقيع NIT-1
ملاحظة: صور الطعوم مرة إلى مرتين في الأسبوع. في يوم الزرع ، انتظر 2 ساعة على الأقل بعد عملية الزرع للسماح للطعوم بالاستقرار وضمان تعبير لوسيفيراز مستقر. إذا كان الوقت عاملا مقيدا ، فيمكن إجراء القياس الأولي في اليوم 1 بدلا من ذلك. جدول التصوير الأولي الموصى به هو اليوم 0 أو اليوم 1 بعد الحقن واليوم 5 واليوم 10 واليوم 14 واليوم 18 واليوم 25. ومع ذلك ، اضبط الجدول الزمني بناء على تقدم المناعة الذاتية كما يتم الحكم عليه من خلال فقدان إشارة التوهج الحيوي.
- تحضير محلول د-لوسيفيرين 15 ملغ/مل في برنامج دولبيكو PBS. حرك في RT ليذوب ، ومرشح معقم (0.22 ميكرومتر). قم بتخزين 1 مل من القسمة عند -20 درجة مئوية ، وقم بإذابة الجليد حسب الحاجة.
ملاحظة: يمكن إعادة تجميد القسامة. - قبل 5 دقائق على الأقل من التصوير، يتم حقن الفئران داخل الصفاق باستخدام حقنة سعة 1 مل وإبرة 26 جم بمحلول د-لوسيفيرين بجرعة 150 ملغ/كغ.
ملاحظة: استخدم حقنة وإبرة جديدة لكل ماوس. - تخدير الفئران عن طريق استنشاق الأيزوفلوران وفقا للمبادئ التوجيهية المؤسسية. الشروط الموصى بها هي 2.5٪ إيزوفلوران بمعدل تدفق 1.5 لتر / دقيقة في غرفة الضربة القاضية ومعدل إخلاء 9 لتر / دقيقة.
- تليين عيون الحيوان مع مرهم العيون لمنع الجفاف.
- افتح البرنامج المرتبط بجهاز التصوير. إنشاء مستخدم جديد و / أو تسجيل الدخول. في لوحة التحكم في أسفل اليمين ، حدد تهيئة (الشكل 2 أ). لحفظ بيانات التصوير تلقائيا ، قم بإنشاء المجلدات المناسبة على الكمبيوتر، ثم حدد اكتساب | حفظ تلقائي إلى... (الشكل 2 أ). بمجرد انتهاء تهيئة الأداة ، اضبط وقت التعرض على 1 دقيقة.
ملاحظة: يتم عرض معلمات التصوير الكاملة في الشكل 2B. - نقل الفئران واحدة تلو الأخرى من غرفة ضربة قاضية إلى أداة التصوير. ضع الفأر على بطنه مع وضع أطرافه ، ووجه رأسه برفق إلى مخروط الأنف. معدل تدفق الأيزوفلوران البالغ 0.25 لتر / دقيقة يتم توصيله عبر مخروط الأنف مناسب للحفاظ على التخدير أثناء التصوير. قم بتسطيح الماوس برفق عن طريق الضغط على منتصف ظهره بكلتا يديه ثم نشر اليدين للخارج وبعيدا عن بعضهما البعض.
- حدد اكتساب (الشكل 2 ب). سجل أي تفاصيل ذات صلة بالتجربة في النافذة المنبثقة (الشكل 2C).
ملاحظة: انظر الشكل 3 أ للحصول على صور تمثيلية لثلاث إناث من الفئران NOD-scid البالغة من العمر 8 أسابيع والتي تم زرعها بطعمين في نقاط زمنية مختلفة.
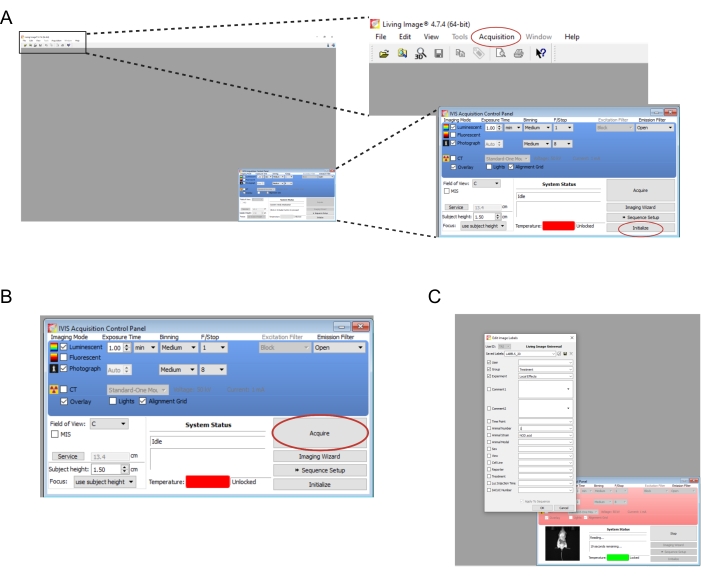
الشكل 2: لقطات شاشة لأوامر البرنامج لتصوير الطعوم ذات الإضاءة الحيوية . (أ) قبل التصوير، حدد تهيئة لتحضير الجهاز. قد يتم حفظ الصور تلقائيا في مجلد من اختيارك عن طريق تحديد اكتساب | حفظ تلقائي إلى... (ب) نظرة عامة على معلمات التصوير. بمجرد وضع الماوس في الجهاز، حدد اكتساب. ( C) لقطة شاشة لمربع الحوار الذي ينبثق أثناء التصوير. يمكن إدخال تفاصيل مثل النقطة الزمنية وإجهاد الماوس هنا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
7. تحليل البيانات
- تحديد إشارة التوهج الحيوي في أي وقت بعد التصوير. افتح البرنامج المرتبط بجهاز التصوير. حدد ملف | افتح ، وحدد ملف ClickInfo.txt المرتبط بالماوس المراد تحليله.
- في لوحة الأدوات ، حدد أدوات عائد الاستثمار (الشكل 3 ب ، الخطوة 1). من القائمة المنسدلة البيضاوية (الشكل 3B ، الخطوة 1 ، السهم الأحمر) ، حدد عدد الطعوم التي تم زرعها في الماوس.
- حرك الأشكال البيضاوية بحيث تحتوي على إشارة التوهج الحيوي من كل طعم ، وحدد قياس عائد الاستثمار (الشكل 3 ب ، الخطوة 2).
- سجل العدد الإجمالي لكل طعم (الشكل 3 ب ، الخطوة 3).
- لكل طعم ، قسم إشارة التوهج الحيوي المقاسة في كل نقطة زمنية على الإشارة المقاسة في النقطة الزمنية الأولى. أبلغ عن بقاء الكسب غير المشروع كنسبة أو نسبة مئوية من إشارة التوهج الحيوي المتبقية بالنسبة لإشارة التوهج الحيوي الأولية.
ملاحظة: إذا توسعت الطعوم بعد الزرع ، فستكون نسبة أو نسبة بقاء الكسب غير المشروع أكبر من 1 أو 100٪ على التوالي. يجب مراقبة جميع الفئران التي تتلقى عمليات زرع بحثا عن الآثار الصحية الضارة.
النتائج
ويرد في الشكل 1 نظرة عامة على البروتوكول. يمكن مقارنة بقاء خطين خلويين ، مثل عنصر تحكم متحور وغير مستهدف ، أو يمكن قياس بقاء خط خلية واحد في مجموعات متعددة من الفئران ، مثل الفئران المعالجة بالعقاقير مقابل الضوابط المعالجة بالمركبات. يوضح الشكل 3 أ ثلاث إناث ...
Discussion
T1D هو مرض مدمر لا يوجد علاج له حاليا. يقدم العلاج ببدائل خلايا بيتا علاجا واعدا للمرضى الذين يعانون من هذا المرض ، ولكن العائق الحاسم أمام هذه الاستراتيجية هو احتمال حدوث هجوم مناعي ذاتي متكرر ضد خلايا بيتا المزروعة. الهندسة الوراثية لخلايا SC-beta لتقليل ظهورها المناعي أو قابليتها للتأثر هي ?...
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم تضارب في المصالح.
Acknowledgements
نشكر الدكتورة إيريكا ب. كاي والدكتورة يوكي إيشيكاوا على تطوير الطريقة الموضحة في هذا البروتوكول (انظر المرجع 11). يتم دعم الأبحاث في مختبرات S.K. و PE بمنح من المعاهد الوطنية للصحة (NIH) (R01DK120445 ، P30DK036836) ، JDRF ، معهد هارفارد للخلايا الجذعية ، ومؤسسة بيتسون. تم دعم T.S. من خلال زمالة ما بعد الدكتوراه من المعهد الوطني للسكري وأمراض الجهاز الهضمي والكلى (NIDDK) (T32 DK007260-45) ، وتم دعم K.B. جزئيا من خلال زمالة من مؤسسة Mary K. Iacocca.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin, 0.53 mM EDTA | Corning | 25-052-CI | |
| 293FT | Invitrogen | R70007 | Fast-growing, highly transfectable clonal isolate derived from human embryonal kidney cells transformed with the SV40 large T antigen |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| Alcohol prep pads, 70% Isopropyl alcohol | Amazon/Ever Ready First Aid | B08NWF31DX | |
| BD 5ml Syringe Luer-Lok Tip | BD | 309646 | |
| BD PrecisionGlide Needle 26G x 5/8 (0.45 mm x 16 mm) Sub-Q | BD | 305115 | |
| BD 1 mL TB Syringe Slip Tip | BD | 309659 | |
| Blasticidin S HCl | Corning | 30-100-RB | |
| Cell strainer premium SureStrain, 70 µm, sterile | Southern Labware | C4070 | Or use similar sterile strainer with 40-70um pore size |
| CellDrop automated cell counter | Denovix | CellDrop BF-PAYG | Or use similar cell counter device |
| Corning 100 mL Penicillin-Streptomycin Solution, 100x | Corning | 30-002-CI | |
| Disposable Aspirating Pipets, Polystyrene, Sterile, Capacity=2 mL | VWR | 414004-265 | Or use similar aspirating pipette |
| D-Luciferin, Potassium Salt , Molecular Biology Grade, Powder, >99% | Goldbio | LUCK-100 | |
| DMEM, high glucose, pyruvate, no glutamine | Gibco | 10313039 | |
| Falcon BD tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Fetal Bovine Serum | Gibco | 10437-028 | |
| Forceps premium for tissues, 1 x 2 teeth 5 in, German Steel | Fisher Scientific | 13-820-074 | |
| Glucose urine test strip | California Pet Pharmacy | u-tsg100 | Or use similar test strip for glucose measurments in urine/blood |
| GlutaMAX–1 (100x) | Gibco | 35050-061 | |
| Infrared heating lamp | Cole Parmer | 03057-00 | Or use similar infrared lamp |
| Insulin syringe 0.5 mL, U-100 29 G 0.5 in | Becton Dickinson | 309306 | |
| Isoflurane, USP | Piramal Critical Care | 6679401725 | |
| IVIS Spectrum in vivo imaging system | Perkin Elmer | 124262 | Instrument for non-invasively collecting bioluminescent images of transplanted cells |
| Living Image Analysis Software | Perkin Elmer | 128113 | Software for collecting and quantifying bioluminescent signal |
| Microcentrifuge tubes seal-rite, 1.5 mL | USA Scientific | 1615-5510 | Or use similar sterile microcentrifuge tubes |
| NIT-1 | ATCC | CRL-2055 | Pancreatic beta-celll line derived from NOD/Lt mice |
| NOD.Cg-Prkdcscid/J | The Jackson Laboratory | 001303 | Mice homozygous for the severe combined immune deficiency spontaneous mutation Prkdcscid, commonly referred to as scid, are characterized by an absence of functional T cells and B cells, lymphopenia, hypogammaglobulinemia, and a normal hematopoietic microenvironment. |
| NOD/ShiLtJ | The Jackson Laboratory | 001976 | The NOD/ShiLtJ strain of mice (commonly called NOD) is a polygenic model for autoimmune type 1 diabetes |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010031 | No calcium, no magnesium, no phenol red |
| pCMV-VSV-G | Addgene | 8454 | |
| pLenti-luciferase-blast | Made in-house | Plasmid available upon request | See Supplemental File 1 |
| pMD2.G | Addgene | 12259 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polyethylenimine, Linear, MW 25,000, Transfection Grade (PEI 25K) | Fisher Scientific | NC1014320 | |
| pRSV-Rev | Addgene | 12253 | |
| Restrainer for rodents, broome-style round 1 in | Fisher Scientific | 01-288-32A | |
| Scissors, sharp-pointed | Fisher Scientific | 08-940 | Or use other scissors made of surgical-grade stainless steel |
| Tissue-culture treated culture dishes | Millipore Sigma | CLS430167-20EA | Or use other sterile cell culture-treated Petri dishes |
| Tweezers/Forceps, fine precision medium tipped | Fisher Scientific | 12-000-157 |
References
- Katsarou, A., et al. Type 1 diabetes mellitus. Nature Reviews Disease Primers. 3, 17016 (2017).
- Shapiro, A. M., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews Endocrinology. 13 (5), 268-277 (2017).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO Journal. 34 (13), 1759-1772 (2015).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nature Biotechnology. 32 (11), 1121-1133 (2014).
- Vertex Announces Positive Day 90 Data for the First Patient in the Phase 1_2 Clinical Trial Dosed With VX-880, a Novel Investigational Stem Cell-Derived Therapy for the Treatment of Type 1 Diabetes. Businesswire Available from: https://www.businesswire.com/news/home/20211018005226/en/Vertex-Announces-Positive-Day-90-Data-for-the-First-Patient-in-the-Phase-12-Clinical-Trial-Dosed-With-VX-880-a-Novel-Investigational-Stem-Cell-Derived-Therapy-for-the-Treatment-of-Type-1-Diabetes (2021)
- Gamble, A., Pepper, A. R., Bruni, A., Shapiro, A. M. J. The journey of islet cell transplantation and future development. Islets. 10 (2), 80-94 (2018).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the Non Obese Diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Hamaguchi, K., Gaskins, R. H., Leiter, E. H. NIT-1, a pancreatic β-cell line established from a transgenic NOD/Lt mouse. Diabetes. 40 (7), 842-849 (1991).
- Christianson, S. W., Shultz, L. D., Leiter, E. D. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice: Relative contribution of CD4+ and CD8+ T-cells from diabetogenic versus prediabetic NOD.NON-Thy1a donors. Diabetes. 42 (1), 44-55 (1993).
- Cai, E. P., et al. Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes. Nature Metabolism. 2 (9), 934-945 (2020).
- Parent, A. V., et al. Selective deletion of human leukocyte antigens protects stem cell-derived islets from immune rejection. Cell Reports. 36 (7), 109538 (2021).
- Brehm, M. A., et al. Lack of acute xenogeneic graft-versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB Journal. 33 (3), 3137-3151 (2019).
- Abdulreda, M. H., et al. In vivo imaging of type 1 diabetes immunopathology using eye-transplanted islets in NOD mice. Diabetologia. 62 (7), 1237-1250 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved