Method Article
الرحلان الكهربائي المستحث بالضوء لتوصيف السلوك الكهربائي للخلايا الجذعية الوسيطة البشرية
In This Article
Summary
هنا ، نقدم الرحلان الكهربائي الناجم عن الضوء كنهج خال من التسمية لتوصيف خطوط الخلايا غير المتجانسة ، وتحديدا الخلايا الجذعية الوسيطة البشرية (hMSCs). تصف هذه الورقة بروتوكولا لاستخدام وتحسين جهاز الموائع الدقيقة بطبقة موصلة ضوئية لتوصيف السلوك الكهربائي ل hMSCs دون تغيير حالتها الأصلية.
Abstract
توفر الخلايا الجذعية الوسيطة البشرية (hMSCs) مصدرا للخلايا المشتقة من المريض لإجراء دراسات ميكانيكية للأمراض أو للعديد من التطبيقات العلاجية. أصبح فهم خصائص hMSC ، مثل سلوكها الكهربائي في مراحل النضج المختلفة ، أكثر أهمية في السنوات الأخيرة. الرحلان الكهربائي (DEP) هو طريقة يمكنها معالجة الخلايا في مجال كهربائي غير منتظم ، يمكن من خلالها الحصول على معلومات حول الخواص الكهربائية للخلايا ، مثل سعة غشاء الخلية والسماحية. تستخدم الأنماط التقليدية ل DEP أقطاب معدنية ، مثل الأقطاب الكهربائية ثلاثية الأبعاد ، لتوصيف استجابة الخلايا ل DEP. في هذه الورقة ، نقدم جهاز الموائع الدقيقة المبني بطبقة موصلة ضوئية قادرة على معالجة الخلايا من خلال إسقاطات الضوء التي تعمل كأقطاب كهربائية افتراضية في الموقع مع هندسة قابلة للتوافق بسهولة. يتم تقديم بروتوكول هنا يوضح هذه الظاهرة ، تسمى DEP المستحث بالضوء (LiDEP) ، لتوصيف hMSCs. لقد أظهرنا أن استجابات الخلايا التي يسببها LiDEP ، والتي تقاس بسرعات الخلية ، يمكن تحسينها من خلال معلمات مختلفة مثل جهد الدخل ، ونطاقات الطول الموجي لإسقاطات الضوء ، وشدة مصدر الضوء. في المستقبل ، نتصور أن هذه المنصة يمكن أن تمهد الطريق لتقنيات خالية من الملصقات وتقوم بتوصيف في الوقت الفعلي للمجموعات غير المتجانسة من hMSCs أو خطوط الخلايا الجذعية الأخرى.
Introduction
يتم التعرف على الخلايا الجذعية الوسيطة البشرية (hMSCs) لخصائصها المثبطة للمناعة1 ، والتي أدت إلى استخدامها في العلاجات لعلاج مجموعة متنوعة من الأمراض ، مثل مرض السكري من النوع الثاني2 ، ومرض الكسب غير المشروع مقابل المضيف3 ، وأمراض الكبد4. HMSCs غير متجانسة ، وتحتوي على مجموعات فرعية من الخلايا التي تتمايز إلى الخلايا الشحمية ، والخلايا الغضروفية ، وبانيات العظم. تستمد HMSCs من الأنسجة الدهنية وأنسجة الحبل السري ونخاع العظام ، وتعتمد إمكانية تمايزها على نسيج المنشأ وعملية زراعة الخلايا المستخدمة5. على سبيل المثال ، وفقا لدراسة أجراها Sakaguchi et al. ، من المرجح أن تتمايز hMSCs المشتقة من الأنسجة الدهنية إلى خلايا دهنية ، في حين أن hMSCs المشتقة من نخاع العظم من المرجح أن تتمايز إلى الخلايا العظمية6. ومع ذلك ، فإن تأثير أصل الأنسجة من hMSCs على قدرتها على التمايز هو ظاهرة لا تزال بحاجة إلى مزيد من الفهم. بالإضافة إلى ذلك ، تساهم إمكانات التمايز المتنوعة ل hMSCs في عدم تجانسها المتأصل وتخلق تحديات في تطبيق hMSCs للعلاجات. على هذا النحو ، فإن توصيف ، وكذلك فرز ، خطوط الخلايا الجذعية غير المتجانسة أمر بالغ الأهمية لتطوير التطبيق المختبري والسريري لهذه الخلايا. يستخدم قياس التدفق الخلوي ، وهو الأسلوب القياسي الذهبي لفحص الاختلافات في الأنماط الظاهرية الخلوية ، مستضدات سطح الخلية والأصباغ الفلورية لتسمية الخلايا المستهدفة وتوصيفها بناء على تشتت الضوء أو خصائص التألق الخاصة بالخلية6،7،8. تشمل عيوب هذه الطريقة التوافر المحدود للمؤشرات الحيوية لمستضد سطح الخلية ، والتكلفة العالية للمعدات والتشغيل ، وحقيقة أن تلطيخ سطح الخلية يمكن أن يتلف غشاء الخلية ويؤثر على التطبيقات العلاجية9،10،11. لذلك ، فإن استكشاف تقنيات جديدة لتوصيف الخلايا دون المساس بالحالة الأصلية للغشاء الخلوي يمكن أن يفيد الأداء السريري لعلاجات الخلايا الجذعية.
الرحلان الكهربائي (DEP) ، وهي طريقة لتوصيف الخلايا لا تستخدم الملصقات السطحية ، هي محور هذا العمل الحالي. DEP هي طريقة خالية من الملصقات أو غير ملوثة يتم تنفيذها على منصات الموائع الدقيقة لتوصيف مجموعات الخلايا غير المتجانسة بناء على خصائصها الكهربائية. يستخدم DEP مجالا كهربائيا للتيار المتردد (AC) ليحل محل تلطيخ التألق (أي طريقة قائمة على الملصقات)7. تشمل المزايا الأخرى لاستخدام أجهزة الموائع الدقيقة القائمة على DEP لتوصيف الخلايا استخدام كميات صغيرة (ميكرولتر) ، ووقت التحليل السريع ، والحد الأدنى من متطلبات تحضير عينة الخلية ، والحد الأدنى من مخاطر تلوث العينات ، والحد الأدنى من إنتاج النفايات ، والتكلفة المنخفضة12,13. فائدة أخرى من DEP هي المراقبة في الوقت الحقيقي للخلايا14،15،16. بالنسبة إلى DEP ، تتعرض الخلايا المعلقة لمجال كهربائي تيار متردد غير منتظم تم إنشاؤه باستخدام أقطاب كهربائية ، وتصبح مستقطبة6. يتسبب هذا الاستقطاب في حركة الخلية ويسمح بمعالجة الخلايا بناء على تردد وجهد المجال الكهربائي للتيار المتردد المطبق. من خلال ضبط التردد ، عادة بين 5 كيلو هرتز إلى 20 ميجاهرتز ، يمكن جذب الخلايا أو صدها بعيدا عن الأقطاب الكهربائية ، المقابلة لسلوك DEP الإيجابي والسلبي ، على التوالي6.
هناك طرق متعددة لتوصيف DEP ، وهي التقليدية ، تجزئة تدفق المجال ، والضوء المستحث ، كما هو مصنف حسب تكوين القطب و / أو الاستراتيجية التشغيلية17. يشتمل محلل 3DEP ، وهو وضع تقليدي ل DEP ، على أقطاب معدنية مادية ويراقب الاستجابة الخلوية لمجال كهربائي للتيار المتردد. يستخدم هذا النظام شريحة تتكون من آبار دقيقة ذات أقطاب دائرية ثلاثية الأبعاد متعددة ويكتشف التغيرات في شدة الضوء لتوصيف سلوك DEP للخلية18،19،20،21. لوحظ DEP الإيجابي عندما تتحرك الخلايا نحو حواف الأقطاب الكهربائية الدائرية على طول جدران البئر الصغير ، مما يؤدي إلى زيادة شدة الضوء في وسط البئر الصغير. لوحظ DEP السلبي كخلايا تتجمع في وسط البئر الصغير بعيدا عن الأقطاب الكهربائية الدائرية ، مما يؤدي إلى انخفاض شدة الضوء في وسط البئر الصغير. هاتان الظاهرتان ممثلتان في الشكل 1. تتمتع طرق DEP التقليدية بالقدرة على توصيف الخواص الكهربائية لمجموعات الخلايا غير المتجانسة18،20،21. على سبيل المثال ، أظهر Mulhall et al. إمكانية التمييز بين الخلايا الكيراتينية الفموية الطبيعية (HOK) وخطوط خلايا الخلايا الكيراتينية الفموية الخبيثة (H357) بناء على الاختلافات في سعة الغشاء21 باستخدام محلل 3DEP. ومع ذلك ، فإن أحد قيود الأنماط التقليدية ل DEP هو هندسة القطب الثابت. نظرا لأن hMSCs غير متجانسة ، فمن المفيد أن يكون لديك القدرة على تعديل هندسة القطب بسهولة أثناء تقييمات DEP. على سبيل المثال ، تسمح القدرة على تعديل الأقطاب الكهربائية أو صفائف الأقطاب الكهربائية في الوقت الفعلي لمحاصرة الخلية الواحدة بتوصيف الخلايا بناء على السرعة وسلوك DEP. يسمح تطبيق تعديل القطب في الوقت الفعلي في تقييمات DEP ل hMSCs بتحليل الخلية الواحدة ل hMSCs مباشرة بعد الحصول عليها من أنسجة العينة لتوصيف عدم تجانس مجتمع العينة.
للتغلب على قيود الأنماط التقليدية ل DEP (أي الأقطاب الكهربائية الفيزيائية الثابتة) واستكشاف فرص جديدة لتعديلات تكوين القطب في الوقت الفعلي باستخدام ظاهرة DEP ، تم استكشاف DEP المستحث بالضوء (LiDEP). LiDEP هو وضع غير تقليدي من DEP يتعامل مع الخلايا باستخدام جهاز الموائع الدقيقة الموصل للضوء22,23 عبر الإسقاطات الضوئية ، تخلق الأقطاب الكهربائية الموضعية مجالا كهربائيا غير منتظم ، على غرار طريقة DEP التقليدية. يسمح هذا النهج أيضا بالمرونة في هندسة القطب الكهربائي وتحريك الأقطاب الكهربائية داخل جهاز الموائع الدقيقة. هذا يخفف من القيود التي تظهر مع الأقطاب الكهربائية الثابتة ويوفر الفرصة للحصول على مزيد من المعلومات حول عدم التجانس الخلوي. تم استخدام LiDEP لاكتشاف وتحليل أنواع الخلايا المختلفة في مجموعات متجانسة وغير متجانسة من الخلايا22،23،24. على سبيل المثال ، استخدم Liao et al. LiDEP لفصل الخلايا السرطانية المنتشرة (CTCs) التي تعبر عن وحدة التصاق الخلايا الظهارية (EpCAMneg) عن خلايا الدم الحمراء لاستكشاف أهميتها في ورم خبيثالسرطان 22. تم استخدام تحليل الخلية الواحدة باستخدام LiDEP بنجاح لتوصيف الخلايا السرطانية ومعالجتها من خلال التقسيم الطبقي لأورام البنكرياس23 وتحليل CTCs في عينات ما قبل وبعد ورم خبيث24.
هنا ، نصف كيف يمكن استخدام LiDEP لمعالجة hMSCs مع مجموعة متنوعة من الأشكال الهندسية للأقطاب الكهربائية (الدائرة ، والماس ، والنجمة ، والخطوط المتوازية) وإعدادات النظام (الجهد المطبق ، وشدة الضوء ، ومواد جهاز الموائع الدقيقة) ، وبالتالي تقديم نهج لتوصيف سلوك الخلايا الجذعية المشتقة من الإنسان مع الأقطاب الافتراضية.
Protocol
1. تصنيع جهاز الموائع الدقيقة LiDEP
ملاحظة: تتكون عملية التصنيع من الجمع بين ثلاثة مكونات ذات طبقات: (أ) طبقة موصلة للضوء مع سيليكون غير متبلور (A: Si) والموليبدينوم المترسب على ركيزة زجاجية من أكسيد القصدير الإنديوم (ITO)؛ (ب) طبقة موصلة للضوء مع سيليكون غير متبلور (A: Si) والموليبدينوم المترسب على ركيزة زجاجية من أكسيد القصدير الإنديوم (ITO)؛ (ب) طبقة موصلة للضوء مع سيليكون غير متبلور (A: Si) والموليبدينوم المترسب على ركيزة زجاجية من أكسيد القصدير الإنديوم (ITO)؛ (ب) طبقة موصلة للضوء مع سيليكون غير متبلور (A: Si) وموليبدينوم مترسب على (ii) طبقة قناة دقيقة مقطوعة من شريط على الوجهين ؛ و (iii) ركيزة زجاجية علوية ITO مع ثقوب محفورة لمدخل ومخرج تعليق الخلية.
- طلاء زجاجي لأكسيد القصدير الإنديوم الموصل للضوء (ITO)
- قم بتنظيف الركيزة الزجاجية المطلية ب ITO (مقاومة 15-20 Ω) عن طريق تدفق غاز النيتروجين (N2) على السطح بمعدل تدفق يكفي لتحريك جزيئات الغبار المرئية. بعد هذه الخطوة ، شطف الركيزة مع الأسيتون.
- انقل الشريحة الزجاجية المطلية ب ITO إلى حمام كحول الأيزوبروبيل لغسل بقايا الأسيتون ، وشطفها بماء DI ، وتدفق غاز N2 مرة أخرى حتى تجف الركيزة تماما.
- ضع الشريحة الزجاجية مع الجانب المطلي ب ITO لأعلى في نظام الاخرق بالتفريغ.
- رش طبقة بسمك 10 نانومتر من الموليبدينوم على الركيزة الزجاجية المطلية ب ITO (هدف الموليبدينوم) بمعدل ترسيب 0.7 Å / s ووقت ترسيب 140 ثانية.
- أضف قناع ظل إلى جانب واحد من الركيزة الزجاجية لترك 2 مم من حافة الركيزة الزجاجية مكشوفة للتوصيلات الكهربائية. إيداع 1 ميكرومتر من A: Si باستخدام ترسيب البخار الكيميائي المعزز بالبلازما والبلازما المقترنة بالحث (ICP-PECVD) ، كما هو موضح في Medjdoub et al.25.
- نظف الشريحة بغاز N2 لإزالة الغبار والشوائب الأخرى. لأي A: Si مترسب تحت قناع الظل ، اغمر الحافة حتى علامة 2 مم في محلول هيدروكسيد البوتاسيوم 25٪ w / v لحفر A: Si.
- تصنيع جهاز رقاقة LiDEP
- لتشكيل القناة الدقيقة ، احصل على شريط على الوجهين (52 مم × 25 مم) ، وثقوب مثقوبة (القطر = 4 مم) 5-6 مم بعيدا عن حافة البعد الأقصر وتوسيطها بين الجوانب الأطول للشريط. استخدم مشرطا لقطع خطين مستقيمين (3 مم) عبر الثقوب. تأكد من تشغيل الألواح الواقية على كلا وجهي الشريط على الوجهين أثناء خطوة قطع القنوات الدقيقة بأكملها.
- احفر فتحتين بقطر 3 مم في الشريحة الزجاجية العلوية ITO. يمكن محاذاة الشريط أعلى الزجاج المطلي ب ITO ، مع محاذاة الحافة الطويلة للشريط مع الحافة الطويلة للزجاج. حدد موقع الفتحة بعلامة قابلة للغسل. تأكد من محاذاة الثقوب المحفورة مع الثقوب المثقوبة في الشريط على الوجهين. سيعمل هذان الفتحان كفتحات مدخل ومخرج لجهاز الموائع الدقيقة.
- قم بإزالة جانب واحد من الفيلم الواقي على الشريط على الوجهين ، وقم بمحاذاة الثقوب الموجودة في الشريط والشريحة الزجاجية العلوية ITO ، واضغط عليهما معا. اضغط برفق لإزالة الجيوب الهوائية ، خاصة بالقرب من القناة الدقيقة. قد تسمح الجيوب الهوائية للوسيط أو المحاليل الأخرى بالتسرب تحت الشريط ، مما قد يؤدي إلى تلف أو التسبب في العفن في جهاز الموائع الدقيقة.
- قم بإزالة الفيلم الواقي الآخر من الشريط على الوجهين ، واضغط على الموليبدينوم والجانب الزجاجي ITO المطلي ب A: Si. قم بمطابقة حافة الشريحة الموصلة للضوء المقابلة لجانب الخلوص 2 مم مع حافة الشريط على الوجهين باتجاه مركز الشريحة الزجاجية العلوية ITO. سيكون هناك مخلفات من أعلى شريحة زجاجية ITO وشريحة زجاجية ITO مطلية بمواد موصلة للضوء.
- اضغط على سطح مستو لضمان التصاق جيد. يوضح الشكل 1 أ مخططا للركيزة الزجاجية وطبقات الشريط على الوجهين. قطع الشريط الزائد على الجانب.
- ضع شريطا نحاسيا على حواف الطبقة A والطبقة C لتوصيل مولد الوظائف. قم بذلك عن طريق لف الشريط على جانب ITO أو مادة موصلة للضوء ، اعتمادا على ما إذا كانت الطبقة A أو الطبقة C ، من حافة الشريط على الوجهين إلى حوالي 3 سم على الجانب غير المطلي من الركيزة الزجاجية.
- لضمان نجاح تصنيع الجهاز ، استخدم مقياسا متعددا لاختبار قراءة المقاومة بين الشرائح المطلية لكل من الركائز الزجاجية والشريط النحاسي الذي تم توصيله بالزجاج.
- إعداد المخزن المؤقت DEP
- قم بقياس 4.25 g من السكروز ، وضعه في أنبوب مخروطي 50m. بعد ذلك، قم بقياس 0.15 g من الجلوكوز، وضعه في نفس الأنبوب المخروطي سعة 50 mL.
- املأ الأنبوب المخروطي ب 25 مل من الماء عالي النقاء ، وأغلق الغطاء ، واخلطه. بمجرد إذابة نصف السكروز والجلوكوز تقريبا ، املأ الأنبوب المخروطي بالماء عالي النقاء حتى خط 50 mL. تخلط بقوة حتى يذوب كل السكروز والجلوكوز. يحتوي محلول DEP العازل على 8.5٪ (وزن / حجم) سكروز و 0.3٪ (وزن / حجم) جلوكوز.
- احصل على 20 مل من محلول السكروز والجلوكوز المحضر ، وضعه في أنبوب مخروطي سعة 50 مل. بعد ذلك ، قم بقياس 0.1 جرام من ألبومين مصل الأبقار (BSA) ، وضعه في أنبوب مخروطي سعة 50 مل يحتوي على محلول السكروز والجلوكوز. دوامة حتى يتم حل BSA. يحتوي حل المخزن المؤقت DEP النهائي على 0.5٪ (w / v) BSA.
- إعداد الخلية
- احصل على ما لا يقل عن 1 × 106 خلايا (hMSCs أو HEK 293) معلقة في 1 مل من وسط النمو باستخدام بروتوكول زراعة الخلايا الموصوف في الدراسات السابقة26,27. ضع تعليق الخلية في أنبوب طرد مركزي سعة 10 مل.
- أجهزة الطرد المركزي خلايا HEK 293 عند 201 × جم لمدة 5 دقائق و hMSCs عند 290 × جم لمدة 10 دقائق. بعد الطرد المركزي ، قم بشفط المادة الطافية ، وأعد تعليق الخلايا في 1 مل من محلول المخزن المؤقت DEP بنسبة 0.5٪ BSA. تأكد من عدم إضافة محلول المخزن المؤقت بسرعة كبيرة لأن الفقاعات قد تتشكل.
- كرر عملية الطرد المركزي مرتين أخريين ، ثم أعد تعليق الخلايا في المخزن المؤقت DEP باستخدام 0.5٪ BSA لتوصيف LiDEP. بروتوكول إعداد الخلية المدرج يكفي لمدة 10 أشواط. على سبيل المثال ، يتطلب اختبار تردد واحد 15 تشغيلا على الأقل ، وبالتالي ، يجب إجراء 2 مل من الخلايا بتركيز 1 × 106 خلايا / مل.
2. توصيف LiDEP
- الإعداد التجريبي
- قم بتجميع المعدات التالية للإعداد التجريبي لتحديد الاستجابات الخلوية ل LiDEP: كمبيوتر محمول ، وجهاز عرض ، وعدسة موضوعية ، ومجهر رقمي ، ومولد وظائف. استخدم الكمبيوتر المحمول لتصميم الإسقاطات الضوئية (نجمة وماسة وثلاثة خطوط وبيضاوية) ، وقم بتوصيله بجهاز العرض.
- استخدم جهاز العرض كمصدر للضوء لعرض إسقاطات الضوء على السطح الموصل للضوء (الطبقة C) لشريحة LiDEP. قم بإعداده بحيث ينتقل الضوء من مصدر الضوء (جهاز العرض) عبر عدسة موضوعية 10x إلى منطقة القنوات الدقيقة لشريحة LiDEP. توجد العدسة الموضوعية بمعدل 10 أضعاف أعلى عدسة جهاز العرض. يوضح الشكل التكميلي 1 دمج جهاز العرض في نظام LiDEP.
- قم بتوصيل شريحة LiDEP بمولد الوظائف لتطبيق المجال الكهربائي للتيار المتردد. راقب الخلايا التي تعاني من قوة LiDEP باستخدام المجهر الرقمي للتصوير وتسجيل الفيديو. يوضح الشكل 1 ب مخططا للجهاز التجريبي. اتبع بروتوكولات زراعة الخلايا القياسية26,27 لجميع الخلايا التي تم اختبارها.
- الإجراءات التجريبية
- اغسل القناة الدقيقة بنسبة 70٪ من الإيثانول ، متبوعا بمحلول BSA بنسبة 0.5٪. اغسل القناة الدقيقة مرة أخرى بمحلول 0.5٪ BSA مرتين أخريين لضمان غسل الإيثانول والخلايا السابقة تماما. ستستجيب الخلايا التي تعرضت بالفعل لحقل DEP بشكل مختلف عن الخلايا الجديدة وقد تعطل جمع البيانات.
- قم بإزالة محلول BSA بنسبة 0.5٪ باستخدام ماصة ، وقم بتركيب جهاز الموائع الدقيقة في حامل الجهاز.
- قم بتوصيل مشابك التمساح بكل من وصلات الشريط النحاسي على الجهاز. اضبط مولد الوظائف على الجهد المطلوب (الجهد من الذروة إلى الذروة ، Vpp) والتردد (هرتز). كان نطاق التردد الذي تم اختباره هنا من 30 كيلو هرتز إلى 20 ميجاهرتز.
- أضف 70 ميكرولتر من تعليق الخلية (الخلايا + محلول المخزن المؤقت DEP مع 0.5٪ BSA) إلى القناة الدقيقة للجهاز. نظرا لنحافة القناة الدقيقة (~ 0.05 مم) ، قد يحدث انسكاب من فتحات المدخل والمخرج. للمساعدة في تقليل كمية الانسكاب ، استخدم طرف ماصة أصغر ، وقم بإمالة الطرف قليلا في الفتحة باتجاه القناة الدقيقة. يمكن مسح أي محلول وصول (0.5٪ BSA أو خلايا في المحلول) باستخدام مناديل ورقية تستخدم مرة واحدة والتخلص منها في نفايات بيولوجية.
- قم بعرض هندسة القطب الافتراضي المطلوبة (هنا ، الدوائر ، الماس ، النجوم ، و / أو الخطوط المتوازية) على شريحة LiDEP.
- في برنامج المجهر الرقمي ، اضبط طول الفيديو على 3 دقائق. اضبط مؤقت المختبر على 2 دقيقة و 30 ثانية. بمجرد أن تصبح الخلايا ثابتة في القناة الدقيقة لشريحة LiDEP ، اضغط على Start في برنامج المجهر الرقمي لبدء عملية تسجيل الفيديو.
- انتظر 10 ثوان ، ثم اضغط على زر التشغيل ( ON ) لخرج قناة مولد الوظيفة لتطبيق المجال الكهربائي للتيار المتردد ، واضغط على Start (ابدأ ) للمؤقت. راقب سلوك DEP للخلية من خلال المجهر الرقمي ، ومنع الاهتزاز أو الحركة حول الإعداد.
- بمجرد أن يرن المؤقت ، اضغط على زر التشغيل ( ON ) لخرج قناة مولد الوظيفة. يؤدي هذا إلى إيقاف تشغيل خرج قناة مولد الوظيفة ، ولم يعد يتم توفير المجال الكهربائي للتيار المتردد من خلال الأقطاب الكهربائية. أوقف تسجيل الفيديو في 3 دقائق ، واحفظه في المجهر الرقمي لتحليله في المستقبل.
- ماصة الخلايا من نهاية مخرج شريحة LiDEP عن طريق دفع 60 ميكرولتر ببطء من المخزن المؤقت DEP مع 0.5٪ BSA في القناة الدقيقة وجمعها في نفس الوقت عند المخرج. استمر حتى يكون هناك القليل من الخلايا أو لا توجد خلايا في القناة الدقيقة.
- كرر الخطوات 2.2.3-2.2.9 حتى يتم اختبار جميع الترددات.
النتائج
تم الانتهاء من اختبارات الجهد ولون القطب باستخدام الإجراء أعلاه مع اختلاف طفيف في الخطوة 2.2.3 والخطوة 2.2.10. بالنسبة لاختبار الجهد ، ظل لون القطب وتردده ثابتين ، وتم تطبيق 5 فولت pp و 10 Vpp و 20 Vpp. بالنسبة لاختبار لون القطب ، تم تثبيت الجهد والتردد المطبقين عند 30 كيلو هرتز و 20 فولتpp ، وتم فحص الأقطاب الكهربائية المسقطة باللون الأزرق والأحمر والأبيض والأصفر (المشار إليها برموز ألوان HEX #4472C4 و #FF0000 و #FFFFFF و #FFFF00 على التوالي). تم فحص صلاحية الخلية عن طريق تلطيخ الخلايا باللون الأزرق المثقب وحساب عدد الخلايا الحية والميتة باستخدام مقياس الدم.
باستخدام إعداد LiDEP ، تمكنا من معالجة hMSCs وإنشاء منحنيات استجابة DEP استجابة لتردد الإدخال ، وهي إحدى الطرق لتوصيف السلوك الكهربائي للخلايا. أجريت سلسلة من التجارب للعثور على ظروف التشغيل المثلى من خلال معالجة المعلمات مثل الجهد المطبق ولون القطب المتوقع (أي الأشكال ذات الألوان المميزة التي تم إنشاؤها باستخدام برنامج محرر الرسومات) لمراقبة سلوك الخلية المتسق للمجال الكهربائي غير المنتظم للتيار المتردد الناتج عن الأقطاب الكهربائية الافتراضية. تمت مقارنة البيانات التي تم جمعها لاستجابات الخلايا باستخدام LiDEP ، DEP غير التقليدي ، بنتائج محلل 3DEP ، DEP التقليدي.
ركز اختبار التحسين الأول على استجابة DEP الإيجابية ل hMSCs (أي الخلايا التي تتحرك نحو القطب الافتراضي) في شريحة LiDEP. أظهرت الخلايا التي لا تظهر استجابة DEP إيجابية استجابة DEP سلبية عن طريق الابتعاد عن القطب الافتراضي ، أو كانت ثابتة ودوارة ، أو لم تكن تستجيب للمجال الكهربائي. تم قياس استجابة الخلايا من خلال تتبع سرعاتها (ميكرومتر / ثانية) في ImageJ خلال فترة 2 دقيقة و 30 ثانية. تم استخدام إسقاط بيضاوي أصفر للقطب الافتراضي ، وتم فحص الفولتية المطبقة من 5 V pp و 10 V pp و 20 Vpp بتردد محدد يبلغ 30 كيلو هرتز. ركزنا على الخلايا التي كانت في نطاق 50 ميكرومتر من القطب الافتراضي بينما كان المجال الكهربائي للتيار المتردد قيد التشغيل من أجل الاتساق وتقليل القيم المتطرفة. نتج عن 20 V pp أسرع حركة خلية لخلايا HEK 293 ، بمتوسط سرعة 0.035 ميكرومتر / ثانية ، وتبع ذلك 0.032 ميكرومتر / ثانية عند 10 V pp و 0.020 μm / s عند 5 Vpp ، مما يعني أن هذه الخلايا تمثل عنصر تحكم متجانس نسبيا. ولوحظ اتجاه مماثل بالنسبة ل hMSCs ، التي كان متوسط سرعتها 0.051 ميكرومتر / ثانية عند 20 فولت pp ، و 0.036 μm / s عند 10 Vpp ، و 0.025 μm / s عند 5 Vpp ، كما في الشكل 2A (هنا ، * يشير إلى p < 0.05). عند 20 فولتpp ، لوحظ أن hMSCs شهدت DEP إيجابية وسلبية في وقت واحد. لم يلاحظ هذا عند 10 فولت pp و 5V pp. أظهرت نتائج الجدوى ل hMSCs بعد تجربة قوة DEP أن الفولتية العالية أدت عموما إلى انخفاض صلاحية الخلية ، مع 66٪ من الخلايا قابلة للحياة عند 5 V pp ، و 58٪ من الخلايا قابلة للحياة عند 10 V pp ، و 57٪ من الخلايا قابلة للحياة عند 20 V pp ، كما في الشكل 2B (هنا ، ** يشير إلى p < 0.01).
نظرا لكون LiDEP نظاما بصريا ، فإن شدة الضوء ولون القطب هي معلمات يمكن ضبطها بسهولة للتحكم في أداء شريحة LiDEP. هنا ، تم تقييم ألوان القطب المختلفة (الأبيض والأصفر والأحمر والأزرق) المتولدة بناء على الشكل الذي يتم إسقاطه لتحديد التأثير على استجابات DEP للخلايا. تم تقييم خلايا HEK 293 و hMSCs عند 20 فولتpp و 30 كيلو هرتز. تم اختيار أقطاب كهربائية ذات ألوان بيضاء وصفراء وحمراء وزرقاء ، لكن الإضاءة من خلال شريحة LiDEP تأثرت بالطبقة الموصلة للضوء ، والتي كان لونها أحمر برتقالي. وهكذا ، ظهر القطب الأبيض المتوقع باللون الأصفر مع تصميم داخلي أبيض ، وظهر القطب الأحمر باللون البرتقالي مع مخطط أحمر ، وظهر القطب الأزرق باللون الأخضر الفاتح (الشكل 3A-D). كانت مخرجات الطاقة لهذه الألوان الأربعة على النحو التالي: 77.7 μW ± 0.7 μW ، 92.7 μW ± 1.3 μW ، 21.9 μW ± 0.2 μW ، و 56.7 μW ± 0.9 μW للأبيض والأصفر والأحمر والأزرق ، على التوالي. يشير هذا بقوة إلى أن الأصفر والأبيض كان لهما أقوى مجال DEP ، بينما كان الأزرق والأحمر أضعف ، كما في الشكل 3E (هنا ، *** يشير إلى p < 0.001 لخلايا HEK 293 و ** يشير إلى p < 0.01 ل hMSCs). كما لوحظ دوران ثابت للخلايا على حواف الأقطاب الكهربائية الافتراضية الصفراء والبيضاء أثناء تطبيق قوة DEP. بالنسبة لجميع اختلافات لون القطب ، حدثت استجابات DEP سلبية وإيجابية متزامنة ، مرتبطة بما تم عرضه عند 20 فولتpp لاختبار الجهد. بالإضافة إلى ذلك ، بينما اختلفت سرعة الخلايا بناء على لون القطب ، استجابت جميع الخلايا تقريبا داخل حدود 50 ميكرومتر ل LiDEP. تم قياس حجم hMSCs على أنه 19.2 ميكرومتر ± 5.8 ميكرومتر.
لتقييم قدرة LiDEP مقارنة ب DEP مع الأقطاب الكهربائية التقليدية ، قمنا بتقييم الاختلافات بين سلوك DEP للخلايا التي تستخدم LiDEP إلى سلوك الخلايا التي تم تحليلها بواسطة محلل 3DEP. تم قياس استجابة DEP ل hMSCs في محلول عازلة DEP منخفض التوصيل مع 0.5٪ BSA (~ 100 μS / cm). لتقليد محلل 3DEP ، تم إسقاط قطب افتراضي أصفر بيضاوي واحد عند 10فولت ص. تم تمييز سلوك DEP ل hMSCs من 30 كيلو هرتز إلى 20 ميجاهرتز. عند ترددات أقل من 25 كيلو هرتز ، لاحظنا التحليل الكهربائي ، مما أدى إلى توليد الفقاعات على سطح الطبقة المعدنية داخل جهاز الموائع الدقيقة. بالنسبة إلى LiDEP ، عند الترددات المنخفضة ، شهدت hMSCs قوة DEP إيجابية ، كما في الشكل 4A ، ممثلة كنسبة مئوية من الخلايا التي تنجذب إلى القطب الافتراضي. بدأت الخلايا بقوة DEP إيجابية قوية ، والتي ضعفت مع زيادة التردد. شهدت الخلايا أقوى قوة DEP إيجابية من 30 كيلو هرتز إلى 97 كيلو هرتز. بعد تطبيق المجال الكهربائي للتيار المتردد على هذه الترددات ، أصبحت بعض الخلايا غير مستجيبة ، بينما أظهرت خلايا أخرى سلوك DEP سلبيا. ينحرف هذا الاتجاه عن الاستجابة المرصودة المحددة كميا باستخدام محلل 3DEP ؛ زادت الخلايا في DEP الموجب من 37 كيلو هرتز إلى 255 كيلو هرتز وانخفضت في DEP الموجب من 1,772 كيلو هرتز إلى 20 ميجاهرتز ، كما في الشكل 4B.
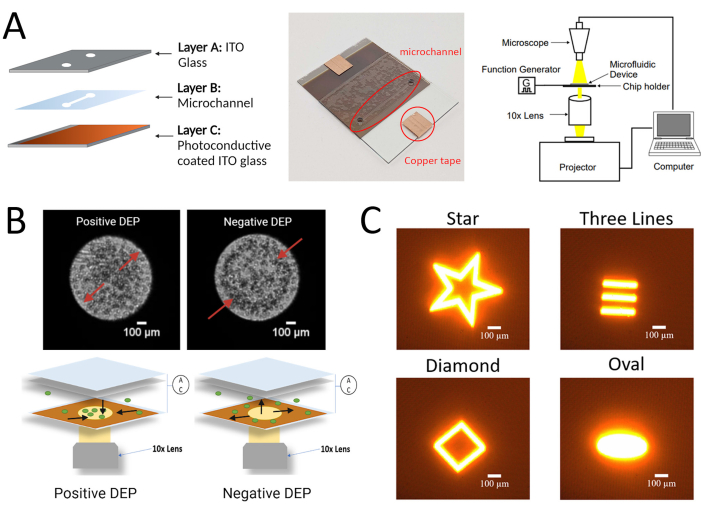
الشكل 1: الإعداد التجريبي لبروتوكول LiDEP الموصوف هنا ل hMSCs. (أ) صورة تخطيطية وحقيقية لشريحة LiDEP مع الطبقة الموصلة للضوء والإعداد التجريبي. (ب) صور تمثيلية لاستجابات DEP الإيجابية والسلبية للخلايا في محلل 3DEP (باستخدام أقطاب DEP التقليدية ، أعلى) وتمثيل تخطيطي لاستجابات DEP الإيجابية والسلبية للخلايا باستخدام LiDEP (باستخدام إسقاطات الضوء كأقطاب كهربائية افتراضية ، أسفل). ج: أمثلة على أشكال مختلفة يمكن إسقاطها على الجهاز في صورة أقطاب كهربائية افتراضية. تم إنشاء الشكل باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
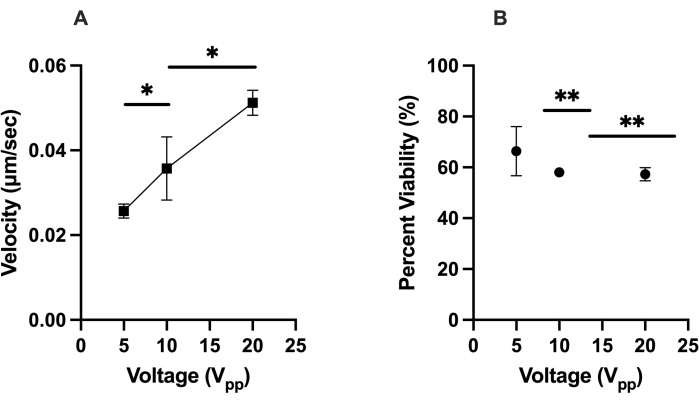
الشكل 2: توصيف استجابات DEP (سرعة) hMSCs وصلاحيتها في ظل ظروف معينة. (أ) السرعات المقاسة لاستجابات DEP الإيجابية ل hMSCs إلى 5 V pp و 10 V pp و 20 V pp. تحركت hMSCs عند 0.051 ميكرومتر / ثانية عند 20 فولت pp ، و 0.036 μm / s عند 10 Vpp ، و 0.025 μm / s عند 5V pp. (ب) صلاحية hMSCs بعد تجربة قوة DEP الإيجابية المتولدة باستخدام الأقطاب الافتراضية. كانت الجدوى 57٪ و 58٪ و 66٪ ل 20 فولت pp و 10 V pp و 5V pp على التوالي. تمثل أشرطة الخطأ الانحراف المعياري (SD). اكتمل التحليل الإحصائي على مجموعات البيانات المجمعة باستخدام اختبارات t (* p < 0.05 و ** p < 0.01). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
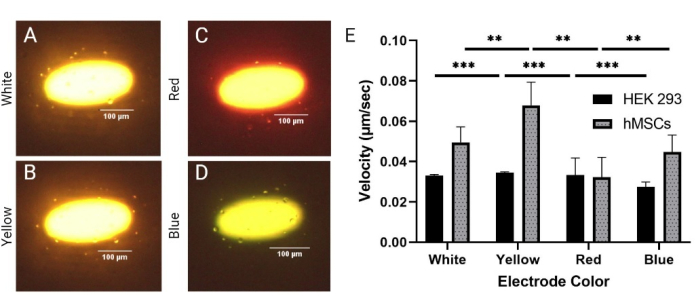
الشكل 3: مقارنة استجابات DEP بين خطوط الخلايا المتجانسة (HEK 293) وغير المتجانسة (hMSCs). استجابة DEP الإيجابية لخلايا hMSCs إلى (A) الأبيض و (B) الأصفر و (C) الأحمر و (D) الأزرق عند 20 Vpp و 30 kHz. ه: استجابات السرعة لخلايا HEK 293 و hMSCs للأقطاب الكهربائية الملونة المختلفة. أظهرت خلايا HEK 293 أعلى سرعات مع الأقطاب الكهربائية الصفراء والحمراء عند 0.035 ميكرومتر / ثانية و 0.033 ميكرومتر / ثانية على التوالي. أظهرت خلايا HEK 293 أدنى سرعة مع الأقطاب الزرقاء عند 0.027 ميكرومتر / ثانية. أظهرت hMSCs أعلى السرعات مع الأقطاب الكهربائية الصفراء والبيضاء عند 0.068 ميكرومتر / ثانية و 0.049 ميكرومتر / ثانية ، على التوالي. شهدت hMSCs أدنى سرعة مع الأقطاب الكهربائية الحمراء عند 0.039 ميكرومتر / ثانية. تمثل أشرطة الخطأ SD. اكتمل التحليل الإحصائي على مجموعات البيانات المجمعة باستخدام اختبارات t (* p < 0.05 و ** p < 0.01 و *** p < 0.001). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
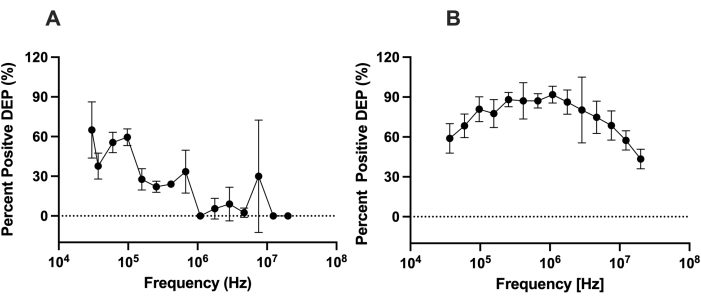
الشكل 4: مقارنة استجابات DEP ل hMSCs باستخدام LiDEP و 3DEP. تم قياس استجابات DEP ل hMSCs باستخدام (A) LiDEP و (B) محلل 3DEP عند 10V pp. مع LiDEP ، كان هناك اضمحلال في استجابة DEP الإيجابية ل hMSCs من 30 كيلو هرتز إلى 20 ميجاهرتز. من محلل 3DEP ، زادت الخلايا في DEP الموجب من 37 كيلو هرتز إلى 255 كيلو هرتز وانخفضت في DEP الموجب من 1,772 كيلو هرتز إلى 20 ميجاهرتز. تمثل أشرطة الخطأ SD. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: صور تمثيلية لإعداد LiDEP المستخدم في التجارب في هذا البروتوكول. صورة مكبرة لنظام LiDEP توضح تكامل جهاز العرض. ينتقل الضوء من المصدر (جهاز العرض) عبر عدسة موضوعية 10x إلى القناة الدقيقة لشريحة LiDEP. يقع الهدف بمعدل 10 أضعاف أعلى عدسة جهاز العرض. يتم ترقيم كل مكون في الصور ومدرج على الجانب. الرجاء الضغط هنا لتنزيل هذا الملف.
الفيديو التكميلي 1: فيديو تمثيلي ل hMSCs تستجيب للأقطاب الكهربائية الافتراضية البيضاء والصفراء والحمراء والزرقاء. يتم تصور الخلايا على أنها تعاني من DEP إيجابي (تتحرك نحو القطب الافتراضي) ، أو تعاني من DEP سلبي (الابتعاد عن القطب الافتراضي) ، أو ثابتة ودوارة ، أو لا تستجيب للمجال الكهربائي. تم اختبار hMSCs عند 37 كيلو هرتز و 20 فولتلكل نقطة ، وتم تسريع الفيديو 20x. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يعد فحص عدم تجانس hMSCs أمرا مهما لتقدمها في العلاجات. يوفر هذا العمل خطوة أولى لاستخدام LiDEP كأداة تحليلية لتقييم hMSCs. درسنا اعتماد الجهد لاستجابة DEP الإيجابية للخلايا في LiDEP عن طريق تحديد السرعة. من المتوقع أن تنتج الفولتية العالية قوة DEP موجبة أقوى ، وقد لاحظنا هذا النمط مع السرعات المقاسة. كانت الفولتية 10 فولت pp و 20 Vpp كافية لمعالجة hMSCs باستخدام LiDEP. أدت الفولتية المنخفضة (أي 5 فولتPP) إلى استجابات أبطأ للخلايا. على الرغم من أنه ليس مثاليا ل hMSCs ، فقد يكون هذا مفيدا لأنواع الخلايا الأخرى. كان هناك انخفاض يعتمد على الجهد في صلاحية hMSCs بنسبة 9٪ تقريبا. هذا يختلف قليلا عن الأدبيات السابقة6،12،28،29 ، حيث لم يقلل استخدام DEP و LiDEP التقليديين في فحص الخلايا البيولوجية من صلاحية الخلية. ومع ذلك ، اختلف الهدف التجريبي في كل دراسة. راقب جلاسر وفوهر نمو الخلايا الليفية للفأر L929 الملتصقة على الأقطاب المعدنية في وسط زراعةالخلايا 28. على العكس من ذلك ، قام Lu et al. بفحص صلاحية الخلايا الجذعية العصبية المعرضة للمجالات الكهربائية AC لفترات زمنية مختلفة12. وصف آدامز وآخرون الخصائص العازلة ل hMSCs بأقطاب معدنية12 ، وتلاعب Li et al. بخلايا سرطان الدم باستخدام LiDEP29. كان الاختلاف بين هذه الدراسات ودراساتنا هو استخدام BSA ، والذي قد يكون سبب انخفاض الجدوى الذي لاحظناه. ومع ذلك ، قد يكون انخفاض الجدوى الإجمالية أيضا بسبب وقت التعرض (2 دقيقة و 30 ثانية) المستخدم في البروتوكول المحدد هنا. تم اختيار هذه المرة لتوفير الوقت الكافي لتصور التلاعب بالخلايا أثناء التعرض للمجال الكهربائي AC غير المنتظم.
تم اختبار طرق توصيف الخلايا عبر لون القطب لتحديد قدرات وقيود نظام LiDEP الخاص بنا المبني كما هو موضح في البروتوكول. في هذا البروتوكول المحدد ، يمكن التحكم في لون القطب بناء على لون الشكل الذي يتم عرضه من خلال ملف محرر رسومات. استخدمنا أربعة ألوان: الأبيض والأصفر والأحمر والأزرق. من قراءات خرج الطاقة لكل لون ، تم قياس الأقطاب الكهربائية الصفراء (#FFFF00) والأبيض (#FFFFFF) المتوقعة للحصول على كثافة أعلى ، وهو الأساس الذي جعل هذه الألوان أكثر ملاءمة للاستخدام في التجارب اللاحقة. بالإضافة إلى ذلك ، بسبب الاعتماد الثابت على شدة الضوء للمواد الموصلة للضوء30,31 ، تشير النتائج إلى أن أداء أجهزة LiDEP يعتمد على A: Si الموصل للضوء ويمكن ضبطه عن طريق اختيار لون القطب المتوقع. كما لوحظ مزيج من استجابات DEP الإيجابية والسلبية ل hMSCs باستخدام LiDEP ، وهو ما يشبه الظاهرة التي شوهدت في طرق DEP التقليدية. مع كل لون قطب كهربائي ، تعرضت hMSCs لقوة DEP سلبية ، وقوة DEP إيجابية ، ودوران الخلية ، مما يشير إلى أن عينة الخلية كانت غير متجانسة بتردد واحد (الفيديو التكميلي 1). يتفق هذا مع نتائج Adams et al.6 التي تظهر hMSCs سلوكا سلبيا وإيجابيا ل DEP بتردد واحد. قد توفر هذه الظروف (لون القطب وشكل القطب والمواد الموصلة للضوء) معلمات إضافية للكشف عن مستوى عدم التجانس في عينات hMSC.
أخيرا ، تمت مقارنة نتائج تقييم LiDEP بنتائج محلل 3DEP كمعيار لسلوك hMSC DEP. لوحظ اختلاف في نطاق التردد لاستجابة DEP الإيجابية ل hMSCs ، لكن الاتجاهات في البيانات التي تم جمعها عبر LiDEP ومحلل 3DEP كانت متشابهة بشكل عام (أي أن استجابة DEP الإيجابية انخفضت مع زيادة التردد). عندما تم تزويد المجال الكهربائي للتيار المتردد إلى شريحة LiDEP وتم إسقاط الضوء عليها ، انخفض التوصيل في المنطقة داخل إسقاط الضوء ، مما أدى إلى إنشاء مجال كهربائي غير منتظم. لذلك ، تؤثر خصائص مصدر الضوء (أي الشدة والطول الموجي) على الاستجابة المتوقعة للخلايا داخل شريحة LiDEP ، كما يتضح من نتائج اختبارات تباين لون الجهد والقطب. المعلمات الأخرى التي يمكن تعديلها هي مادة الطبقة الموصلة للضوء وموصلية محلول المخزن المؤقت DEP. على هذا النحو ، يجب تقييم الشروط المستخدمة لتقييم سلوك DEP للخلايا بناء على إعداد نظام LiDEP. على العكس من ذلك ، بالنسبة لمحلل 3DEP ، أو الطرق الأخرى التي تستخدم الأقطاب المعدنية لتطبيق قوة DEP ، تكون خصائص القطب ثابتة ولا يمكن تغييرها على الفور للتكيف مع ما هو مطلوب للخلايا قيد التحقيق. يمكن أن يكون هذا الاختلاف في سلوك DEP الإيجابي مفيدا للبحث المستقبلي في توصيف أنواع الخلايا المختلفة داخل عينات hMSC أو تحليل الخلية الواحدة أو فرز الخلايا. بالإضافة إلى ذلك ، مع تحرك الخلايا بعيدا عن الأقطاب الكهربائية الافتراضية ، يصبح المجال الكهربائي للتيار المتردد أضعف. ومع ذلك ، باستخدام محلل 3DEP ، أو أوضاع DEP التقليدية الأخرى التي تستخدم أقطاب معدنية ، يمكن تطبيق منطقة مجال كهربائي أكبر ، مما يسمح بمعالجة المزيد من الخلايا. لذلك ، شهد عدد أقل من الخلايا لكل تجربة LiDEP تأثيرات المجال الكهربائي للتيار المتردد داخل القناة الدقيقة لشريحة LiDEP. قد تحدث المزيد من التناقضات بسبب التغييرات في أداء الجهاز بمرور الوقت (أي 2 ساعة أو 3 ساعات) ، والتي لا تزال قيد التحقيق. يمكن أن يؤدي التدفق المستمر للماء والإيثانول ومحلول العازلة DEP إلى تكسير سطح طبقة القنوات الدقيقة (أي المادة الموصلة للضوء) ويجب أخذها في الاعتبار. يجب أيضا مراعاة أداء الجهاز بمرور الوقت لتوصيف الخلايا للاستخدام الموسع لشريحة LiDEP واحدة. استغرقت التعديلات على المعلمات التجريبية في الوقت الفعلي بضع ثوان إلى دقائق فقط. تم ضبط لون القطب والأشكال الهندسية على الفور باستخدام الإعدادات داخل برنامج محرر الرسومات.
باختصار ، توضح هذه الورقة قدرات LiDEP على معالجة وتوصيف خط الخلية مع مجموعات الخلايا غير المتجانسة مثل hMSCs. باستخدام هذا الإعداد والبروتوكول الموصوف ، تمكنا من تحقيق التوصيف الناجح ل hMSCs في ظل ظروف 20 فولتpp والأقطاب الكهربائية الصفراء الافتراضية المتوقعة. يجب أن تركز الدراسات المستقبلية على ضبط وقت تعرض hMSCs للمجال الكهربائي AC الذي تم إنشاؤه عبر LiDEP ، وزيادة شدة الضوء للأقطاب الكهربائية الافتراضية ، وتقييم المصادر المختلفة ل hMSCs (أو مجموعات الخلايا الجذعية الأخرى) لتطوير كتالوج LiDEP للتوقيعات الكهربائية لمجموعات الخلايا الجذعية غير المتجانسة.
Disclosures
لم يبلغ المؤلفون عن أي تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من خلال جائزة CAREER لمؤسسة العلوم الوطنية (2048221) عبر CBET. نود أن نعرب عن تقديرنا ل Mo Kebaili من مرفق أبحاث أنظمة النانو المتكاملة (INRF) التابع لشركة UCI. بالإضافة إلى ذلك ، نود أن نشكر الدكتور ديفين كيك للمساعدة في تطوير نظام LiDEP.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300054 | |
| 10x objective | AmScope | --- | |
| Amorphous silicon (A:Si) | Millipore Sigma | S5130 | |
| Antibiotic-Antimycotic (100X) | Gibco | 15240-062 | |
| Bovine Serum Albumin (BSA) | Fisher | BP9706-100 | |
| Copper Tape | Zehhe | BF4964 | |
| Dextrose (glucose) | Fisher | D16-1 | |
| Digital microscope | Keyence | VHX-7000 | |
| Double Sided Tape | Insulectro | FLX000484 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS) | Gibco | 14190-144 | |
| Fetel Bovine Serum (FBS) | Corning | 35-011-CV | |
| Function Generator | Tektronix | AFG 31102 | |
| Graphic editor software | Microsoft Office Powerpoint | --- | |
| Indium tin oxidec coated glass slides | MSE Supplied | GL0333 | |
| L-Alanyl-L-Glutamine | ATCC | PCS-999-034 | |
| Laptop | Dell | Inspiron 14, 2-in-1 | |
| Mesenchymal Stem Cell Basal Medium | ATCC | PCS-500-030 | |
| Mesenchymal Stem Cell Growth Kit for Umbilical and Adipose Cord-Derived MSCs | ATCC | PCS-500-040 | |
| Minimum Essential Mediaum Alpha (MEM a, 1X) | Giblo | A10490-01 | |
| Molybdenum, 99.95% | Kurt J. Lesker | EJTMOXX352A4 | Sputtering target |
| Phenol Red | Sigma | P5530 | |
| Power Meter | Thor Labs | S130VC/PM400 | |
| Projector | Vecupoi | --- | |
| Roswell Park Memorial Institute (RPMI) 1640 Media | Gibco | 11875-093 | This media has L-Glutamine and Phenol Red. |
| Sucrose | Fisher | BP220-1 | |
| Trypan Blue Stain | Gibco | 15250-061 | 0.40% |
| Trypsin Neutralizer | Gibco | R002100 | |
| Vacuum Sputtering System | Denton | DV-502M |
References
- Mahla, S. R. Stem cells applications in regenerative medicine and disease therapeutics. International Journal of Cell Biology. 2016, (2016).
- Bhansali, A. Efficacy of autologous bone marrow-derived stem cell transplantation in patients with type 2 diabetes mellitus. Stem Cells and Development. 18 (10), 1407-1416 (2009).
- Bouchlaka, M. N. Human mesenchymal stem cell-educated macrophages are a distinct high IL-6-producing subset that confer protection in graft-versus-host-disease and radiation injury models. Biology of Blood and Marrow Transplantation. 23 (6), 897-905 (2017).
- Alfaifi, M., Eom, Y. W., Newsome, P. N., Baik, S. K. Mesenchymal stromal cell therapy for liver diseases. Journal of Hepatology. 68 (6), 1272-1285 (2018).
- Oswald, J. Mesenchymal stem cells can be differentiated into endothelial cells in vitro. Stem Cells. 22 (3), 377-384 (2004).
- Sakaguchi, Y., Sekiya, I., Yagishita, K., Muneta, T. Comparison of human stem cells derived from various mesenchymal tissues: superiority of synovium as a cell source. Arthritis and rheumatism. 52 (8), 2521-2529 (2005).
- Poirier, J. T., Uthamanthil, R., Tinkey, P. Chapter 5 - Genetic profiling of tumors in PDX models. In Patient Derived Tumor Xenograft Models: Promise, Potential and Practice. , 149-159 (2017).
- . Sino Biological. Fluorescence-activated cell sorting (FACS) Available from: https://www.sinobiological.com/category/fcm-facs-facs (2023)
- González-González, M., Vázquez-Villegas, P., García-Salinas, C., Rito-Palomares, M. Current strategies and challenges for the purification of Stem Cells. Journal of Chemical Technology and Biotechnology. 87 (1), 2-10 (2011).
- Flanagan, A. L. Unique dielectric properties distinguish stem cells and their differentiated progeny. Stem Cells. 23 (3), 656-665 (2007).
- Vykoukal, J., Vykoukal, D. M., Freyberg, S., Alt, E. U., Gascoyne, P. R. C. Enrichment of putative stem cells from adipose tissue using dielectrophoretic field-flow fractionation. Lab on a Chip. 8 (8), 1386-1393 (2008).
- Adams, T. N. G., Turner, P. A., Janorkar, A. V., Zhao, F., Minerick, A. R. Characterizing the dielectric properties of human mesenchymal stem cells and the effects of charged elastin-like polypeptide copolymer treatment. Biomicrofluidics. 8 (5), (2014).
- Wu, H. W., Lin, C. C., Lee, G. B. Stem cells in microfluidics. Biomicrofluidics. 5 (1), (2011).
- Adams, T. N. G. Label-free enrichment of fate-biased human neural stem and progenitor cells. Biosensors and Bioelectronics. 152, 111982 (2020).
- Zhao, K., Larasati, ., Duncker, B. P., Li, D. Continuous cell characterization and separation by microfluidic alternating current dielectrophoresis. Analytical Chemistry. 91 (9), 6304-6314 (2019).
- Song, H. Continuous-flow sorting o stem cells and differentiation products based on dielectrophoresis. Lab on a Chip. 15, 1320-1328 (2015).
- Khoshmanesh, K., Nahavandi, S., Baratchi, S., Mitchell, A., Kalantar-Zadeh, K. Dielectrophoretic platforms for bio-microfluidic systems. Biosensors and Bioelectronics. 26 (5), 1800-1814 (2010).
- Hoettges, K. F. Ten-second electrophysiology: Evaluation of the 3DEP platform for high-speed, high-accuracy cell analysis. Scientific Reports. 9, 19153 (2019).
- Hubner, Y., Hoettges, K. F., Kass, G. E. N., Ogin, S. L., Hughes, M. P. Parallel measurements of drug actions on Erythrocytes by dielectrophoresis, using a three-dimensional electrode design. IEE Proceedings - Nanobiotechnology. 152 (4), 150-154 (2005).
- Hoettges, K. F. Dielectrophoresis-activated multiwell plate for label-free high-throughput drug assessment. Analytical Chemistry. 80 (9), 2063-2068 (2008).
- Mulhall, H. J. Cancer, pre-cancer and normal oral cells distinguished by dielectrophoresis. Analytical and Bioanalytical Chemistry. 401 (8), 2455-2463 (2011).
- Liao, C. -. J. An optically induced dielectrophoresis (ODEP)-based microfluidic system for the isolation of high-purity CD45neg/EPCAMNEG cells from the blood samples of cancer patients-Demonstration and initial exploration of the clinical significance of these cells. Micromachines. 9 (11), 563 (2018).
- McGrath, J. S. Electrophysiology-based stratification of pancreatic tumorigenicity by label-free single-cell impedance cytometry. Analytica Chimica Acta. 1101, 90-98 (2019).
- Chiu, T. K. Optically-induced-dielectrophoresis (ODEP)-based cell manipulation in a microfluidic system for high-purity isolation of integral circulating tumor cell (CTC) clusters based on their size characteristics. Sensors and Actuators, B: Chemical. 258, 1161-1173 (2018).
- Medjdoub, M., Courant, J. L., Maher, H., Post, G. Inductively coupled plasma - plasma enhanced chemical vapor deposition silicon nitride for passivation of InP based high electron mobility transistors (HEMTs). Material Science and Engineering: B. 80 (1-3), 252-256 (2001).
- . Umbilical cord-derived mesenchymal stem cells; Normal, human Available from: https://www.atcc.org/products/pcs-500-010 (2023)
- . 293 [HEK-293] Available from: https://www.atcc.org/products/crl-1573 (2023)
- Glasser, H., Fuhr, G. Cultivation of cells under strong ac-electric field-differentiation between heating and trans-membrane potential effects. Bioelectrochemistry and Bioenergetics. 47 (2), 301-310 (1998).
- Li, B. Implementation of flexible virtual microchannels based on optically induced dielectrophoresis. Nanotechnology. 33, 295102 (2022).
- Schellenberg, J. J., Kao, K. C. On the relationship between photoconductivity and light intensity in solids. Journal of Physics D: Applied Physics. 21, 1764-1768 (1988).
- Aoyagi, Y., Masuda, K., Namba, S. Explaination of light-intensity dependence of photoconductivity in zinc phthalocyanine. Journal of Applied Physics. 43, 249-251 (1972).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved