Method Article
استخدام الكواشف المرجعية لتأكيد متانة فحوصات إطلاق السيتوكين للتنبؤ بسلامة الأجسام المضادة وحيدة النسيلة
In This Article
Summary
يسمح استخدام الكواشف المرجعية لمقايسة إطلاق السيتوكين بملامح أمان أكثر قابلية للتكرار والموحدة في المختبر للأجسام المضادة أحادية النسيلة للعلاج المناعي. نصف هنا كيف يمكن استخدام فحوصات إطلاق السيتوكين جنبا إلى جنب مع لوحة الكاشف المرجعي للتنبؤ بسلامة بعض الأجسام المضادة وحيدة النسيلة العلاجية.
Abstract
أدوية الأجسام المضادة الجديدة المحفزة للمناعة المصممة إما لتحفيز خلايا مناعية معينة بشكل مباشر أو تعزيز الاستجابة المناعية بشكل غير مباشر عن طريق منع أو تنشيط منظم داخلي للجهاز المناعي لديها القدرة على التسبب في أحداث ضارة خطيرة مرتبطة بالمناعة مثل متلازمة إطلاق السيتوكين (CRS). لذلك ، من الأهمية بمكان تقييم ملف سلامة هذه الأدوية بمزيج من التجارب في الجسم الحي وفي المختبر قبل إعطاء الجرعة الأولى في الإنسان. فحوصات إطلاق السيتوكين (CRAs) ، حيث يتم زراعة علاج الأجسام المضادة المقترحة مع الخلايا المناعية البشرية (مثل خلايا الدم المحيطية أحادية النواة (PBMCs) أو الدم الكامل أو غير ذلك) ويتم قياس كمية السيتوكين الالتهابي المنتج ، ضرورية لتحديد المخاطر. ومع ذلك ، يمكن أن تهدد المختبرات المختلفة التي تستخدم أجساما مضادة تحكم مختلفة مواءمة CRA ، وقد يكون من الصعب الحصول على الضوابط ذات الصلة سريريا (مثل TGN1412) ، مما قد يؤدي إلى نتائج أو بيانات أقل دقة أو موثوقية يصعب مقارنتها بين المختبرات. يمكن أن يضمن تضمين الضوابط الإيجابية والسلبية في CRA دقة وموثوقية النتائج. أنتج المعهد الوطني للمعايير البيولوجية والرقابة (NIBSC) لوحة من ضوابط الأجسام المضادة المجففة بالتجميد المخصصة للاستخدام في منصات CRA المختلفة لتنسيق النتائج عبر مختلف المختبرات وطرق الفحص. تشمل مجموعة من ثلاثة أجسام مضادة مختلفة للتحكم الإيجابي مضاد CD52 ، ومضاد CD3 ، ومضاد CD28 الفائق (SA) ، والتي من المعروف أنها تحفز CRS المعتمد على الجرعة في المرضى. يتم تزويد كل جسم مضاد بجسم مضاد للتحكم السلبي متطابق مع النمط المتماثل. لقد ثبت سابقا أن هذه اللوحة من الكواشف المرجعية تتمتع بقابلية جيدة للتكرار بين المختبرات وهي عناصر تحكم مناسبة لزيادة ثقة ومتانة بيانات السلامة من مجموعة متنوعة من منصات CRA.
Introduction
يمكن أن يكون إطلاق السيتوكين المستحث تأثيرا متوقعا ومرغوبا لبعض الأجسام المضادة وحيدة النسيلة المعدلة للمناعة (mAbs). ومع ذلك ، فإن الإطلاق غير المتوقع للسيتوكينات المؤيدة للالتهابات يمكن أن يؤدي إلى متلازمة إطلاق السيتوكين (CRS) في المرضى الذين يتميزون بالحمى والتعب وحتى فشل الأعضاءالمتعددة 1. لذلك من الأهمية بمكان أن يتم اختبار mAbs المنبهة المناعية الجديدة في المختبر لقدرتها على التسبب في CRS عن طريق قياس إطلاق السيتوكينات في مقايسة إطلاق السيتوكين (CRA).
TGN1412 هو جسم مضاد أحادي النسيلة تم تطويره كعلاج محتمل لابيضاض الدم الليمفاوي المزمن للخلايا البائية من خلال العمل كناهض فائق CD28 (CD28SA) ، قادر على تنشيط الخلايا الليمفاوية التائية عن طريق ربط المستقبل التحفيزي المشترك CD282. في عام 2006 ، عانى ستة متطوعين أصحاء تم إعطاؤهم TGN1412 في تجربة سريرية من آثار جانبية شديدة ، بما في ذلك CRS ، في غضون ساعات من تلقي الدواء1. أدى ذلك إلى إيقاف المحاكمة TGN1412 سحب من مزيد من التطوير. تشمل الأجسام المضادة الأخرى المعروفة بأنها تسبب متلازمة نقص الكبد كأثر جانبي مضاد CD52 mAb و Campath-1H3 ومضاد CD3 mAb و Muromonab (OKT3) 4. نظرا لقدرتها على إحداث CRS المعتمد على الجرعة في المرضى ، فإن TGN1412 و OKT3 و Campath-1H هي أجسام مضادة للتحكم الإيجابي المناسب لتوليد نتائج قوية وموثوقة من CRA. ومع ذلك ، لم يكن من السهل الحصول على هذه الأجسام المضادة للتحكم في السابق بسبب التكاليف المرتفعة أو التوافر المحدود.
ومع ذلك ، تم مؤخرا توفير لوحة مرجعية مجففة بالتجميد من هذه الأجسام المضادة الثلاثة5،6،7 جنبا إلى جنب مع الضوابط السلبية المتطابقة مع النمط المتماثل من قبل المعهد الوطني للمعايير البيولوجية والرقابة (NIBSC). وقد ثبت سابقا أن هذه اللوحة من الكواشف المرجعية تتمتع بقابلية جيدة للاستنساخ بينالمختبرات 8 ، وبالتالي فهي تحكم مناسب لزيادة ثقة ومتانة بيانات السلامة من مجموعة متنوعة من منصات CRA. وبالتالي ، فإن الأساس المنطقي وراء استخدام هذا البروتوكول جنبا إلى جنب مع هذه الكواشف هو تحسين تنسيق CRA ، مع ميزة التحقق من صحة هذه الكواشف في دراسة تعاونية دولية8.
نصف هنا أفضل طريقة لاستخدام هذه اللوحة من الكواشف المرجعية في المرحلة الصلبة (SP) PBMC CRA والدم الكامل (WB) CRA للطور المائي (AQ) للتنبؤ ب CRS الناجم عن الأجسام المضادة. كلا تنسيقي CRA هذين يكملان بسبب طريقة عرض الأجسام المضادة (غير مباشر للمرحلة الصلبة مقابل الطور المائي) ونظرا لحقيقة أنهما يستهدفان مجموعات مختلفة من الخلايا المستجيبة. يمكن تكييف نفس البروتوكول للاستخدام مع الدم الكامل المخفف (dWB) أو مع المزارع البطانية: PBMC المشتركة.
Protocol
يتبع البروتوكول التالي إرشادات لجنة أخلاقيات البحث في NIBSC. وفقا للوائح والمبادئ التوجيهية المعمول بها، احصل على موافقة خطية مستنيرة من المتبرع أو المرضى الأصحاء. استخدم تقنيات معقمة لتنفيذ جميع خطوات تحضير البروتوكول في غطاء ثقافة خلايا التدفق الصفيحي. انظر جدول المواد للحصول على تفاصيل حول جميع الكواشف والمعدات.
1. تحضير الألواح المطلية بالمللي أمبير لمقايسة الطور الصلب (SP)
- أعد تكوين محتويات أمبولات الكاشف المرجعي ب 1 مل من الماء المقطر المعقم. اترك 5-10 دقائق للترطيب قبل خلط محلول الجسم المضاد ونقله إلى أنبوب معقم مغطى.
- بعد إعادة التكوين في 1 مل من الماء ، سيكون تركيز مخزون الأجسام المضادة المؤتلفة التالية 200 ميكروغرام / مل: مضاد CD3 (15/162) ، مضاد CD52 (15/178) ، تحكم في النمط المتماثل IgG1K (15/198) لمضاد CD52 ، التحكم في النمط المتشاوي IgG2a (15/218) لمضاد CD3 ، التحكم في النمط المتشاوي IgG4 (15/232) لمضاد CD28SA.
- بعد إعادة التكوين في 1 مل من الماء ، سيكون تركيز مخزون anti-CD28SA (15/144) 100 ميكروغرام / مل. للتخزين قصير الأجل لمدة تصل إلى 7 أيام ، انقل المواد المعاد تكوينها في أنبوب مغطى معقم إلى 4 درجات مئوية.
- قم بتخفيف الأجسام المضادة المعاد تكوينها واختبار الأجسام المضادة إلى 10 ميكروغرام / مل في PBS المعقم وقم بتغطية آبار صفيحة ميكروتيتر معقمة غير TC معالجة من مادة البولي بروبيلين 96 بئر من البولي بروبيلين على شكل حرف U مع 100 ميكرولتر من محلول الأجسام المضادة المخفف (1 ميكروغرام / بئر) واحتضانها طوال الليل عند 4 درجات مئوية.
ملاحظة: من المهم استخدام ألواح البولي بروبلين لامتصاص البروتين ، حيث تم استخدامها في التحقق من صحة الكواشف القياسية9.
2. إعداد PBMCs
- اجمع ما لا يقل عن 30 مل من الدم الكامل المحيطي (WB) في أنابيب تحتوي على الهيبارين / الهيبارين واقلبها عدة مرات لضمان الخليط المناسب مع هيبارين الصوديوم.
- نقل 15 مل من WB في أنبوب منفصل لاستخدامه لاحقا في تحضير مقايسة الدم الكامل للطور المائي (الخطوة 3.1)
- قم بتخفيف ال 15 مل المتبقية من الدم بنسبة حجم 1: 1 باستخدام PBS أو وسائط RPMI-1640 الخالية من المصل وقم بوضع طبقة من الدم المخفف برفق فوق 15 مل من وسط تدرج الكثافة (على سبيل المثال ، lymphoprep ، Ficoll-Hypaque) في أنبوب 50 مل.
- قم بالطرد المركزي للأنبوب عند 500 × جم لمدة 20 دقيقة في درجة حرارة الغرفة في دوار متأرجح للخارج بدون فرامل ومع تسارع منخفض لفصل الدم إلى مكوناته المختلفة.
- بعد الطرد المركزي ، سينفصل تدرج الكثافة كطبقة علوية من البلازما متبوعة بطبقة رقيقة من طبقة مصفاة تحتوي على PBMCs وطبقة سفلية تحتوي على خلايا الدم الحمراء (RBCs) والخلايا المحببة متعددة الأشكال بما في ذلك العدلات والحمضات. قم بحصاد PBMCs بعناية عن طريق إدخال ماصة مباشرة عبر طبقة البلازما العليا إلى PBMCs. بدلا من ذلك ، قم بإزالة الطبقة العليا قبل جمع الخلايا.
- قم بتعليق طبقة المغلي برفق في 10 مل من وسائط PBS أو وسائط RPMI-1640 الخالية من المصل. الطرد المركزي الأنبوب مرة أخرى عند 500 × جم لمدة 10 دقائق لتكسير الخلايا. قم بإزالة المادة الطافية وتخلص منها.
- كرر خطوة الغسيل 2.6. وإعادة تعليق الحبيبات في 2 مل من RPMI مع 10٪ FCS (RPMI-1640 كامل ، cRPMI)
- عد الخلايا باستخدام مقياس الدم10.
- اضبط PBMCs على تركيز 1 × 106 خلايا / مل في cRPMI.
3. تحضير مقايسة إطلاق السيتوكين في الدم الكامل (WB) للمرحلة المائية (AQ)
- أضف 190 ميكرولتر من WB إلى آبار صفيحة البوليسترين ذات القاع U المكونة من 96 بئرا. إذا لم يكن بالفعل عند 100 ميكروغرام / مل ، فقم بتخفيف جميع الأجسام المضادة للعلاج والكواشف المرجعية مسبقا إلى 100 ميكروغرام / مل في PBS.
- أضف 10 ميكرولتر من الأجسام المضادة المخففة إلى 190 ميكرولتر من WB لإعطاء تركيز نهائي للجسم المضاد يبلغ 5 ميكروغرام / مل في 95٪ WB.
- احتضان الصفيحة لمدة 48 ساعة في حاضنة رطبة عند 37 درجة مئوية.
4. تحضير مقايسة إطلاق السيتوكين PBMC للمرحلة الصلبة (SP)
- باستخدام ماصة متعددة القنوات ، قم بإزالة محلول الجسم المضاد والتخلص منه من الألواح المطلية (الموضحة في الخطوة 1) ، واملأ خزان الكاشف ب PBS واغسل اللوحة 3x ب 200 ميكرولتر من PBS لإزالة mAbs غير المرتبطة.
- أضف 200 ميكرولتر من معلق الخلية من الخطوة 2.8 إلى كل بئر. احتضان اللوحة لمدة 48 ساعة في حاضنة مرطبة عند 37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2.
5. جمع المواد المطفية أو البلازما
- بعد الحضانة لمدة 48 ساعة مع التحكم والاختبار mAbs ، ألواح الطرد المركزي عند 400 × جم لمدة 5 دقائق وتجمع الوسط أو البلازما المكيفة للخلية ، مع الحرص على عدم إزعاج حبيبات الخلية. قم بتجميد المادة الطافية أو البلازما المجمعة عند -20 درجة مئوية.
ملاحظة: تأكد من عدم إزعاج حبيبات خلايا الدم الحمراء عند جمع البلازما.
6. إجراء القياس الكمي للسيتوكينات في المادة الطافية أو البلازما
- باستخدام المادة الطافية أو البلازما التي تم جمعها ، قم بإجراء تحليل السيتوكين لتركيزات IFN-γ و IL-2 و TNF-α و IL-6 باستخدام خيار تعدد الإرسال المفضل. تم نشر طريقة مثال لتحليل السيتوكين المتعدد باستخدام مقايسة حبة القياس الخلويسابقا 11.
ملاحظة: يرجى الرجوع إلى جدول المواد الخاص بمجموعة تعدد الإرسال التي تم استخدامها في إنشاء النتائج التمثيلية.
النتائج
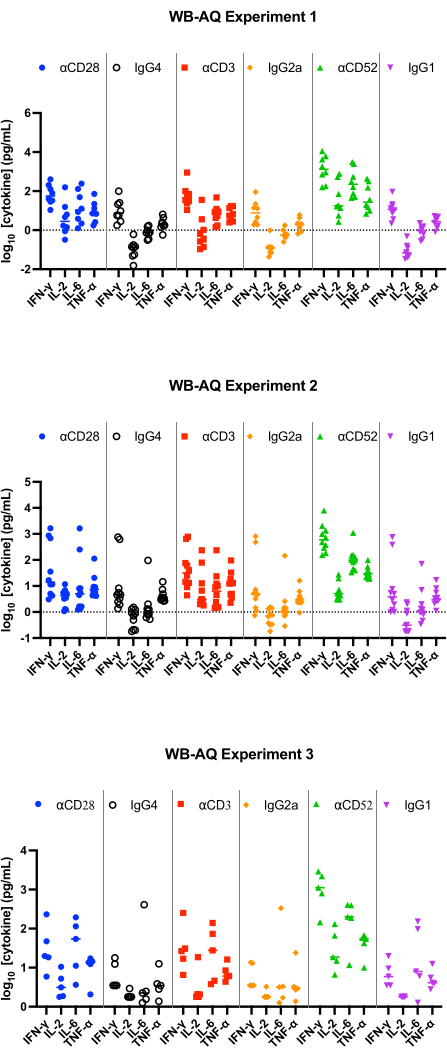
يجب أن تظهر نتائج مقايسة SP إطلاق IL-2 و IFN-γ و IL-6 وTNF-α 12 في نطاق pg / mL من جميع الأجسام المضادة الإيجابية للتحكم في 48 ساعة ويجب أن تكون أكبر بشكل ملحوظ إحصائيا من ضوابط النمط المتطابق. توضح نتائجنا التمثيلية أن الأجسام المضادة للتحكم الإيجابي ، αCD28 و αCD3 و αCD28SA تحفز مستويات عالية بشكل ملحوظ من IFN-γ و IL-6 و TNF-α مقارنة بضوابط النمط المتطابق ، عند تشغيلها في مقايسة PBMC SP (الشكل 1). يتميز هذا الاختبار أيضا بتغيير كبير في إطلاق IL-2 من التحفيز باستخدام αCD28SA مقارنة بنمطه المتطابق (859.0). في حين أن αCD3 و αCD52 ، بينما لا يزالان يحفزان تعبير IL-2 ، يؤديان إلى تغييرات في الطيات أقل من αCD28SA (6.2 و 3.3 ل αCD3 و αCD52 ، على التوالي ، الشكل 2).
في اختبار WB AQ (الشكل 3) ، يكون مستوى السيتوكينات القابلة للاكتشاف أقل بشكل ملحوظ مما كان عليه في اختبار PBMC SP ولكنه يتميز بحساسية أكبر للتحفيز بواسطة الجسم المضاد αCD52 (الشكل 2 والشكل 3) مع متوسط تغييرات الطيات ل IL-2 و IFN-γ و IL-6 فوق 100.
جسم مضاد للاختبار يمكن توقع ألا تتسبب الجرعات الأولى في الإنسان في المستقبل في حدوث أي زيادات كبيرة غير متوقعة في إطلاق السيتوكين مقارنة بضوابط النمط المتماثل ذات الصلة. على الرغم من أنه بدلا من إيقاف تطوير mAb علاجي جديد ، يجب اعتبار النتيجة الإيجابية في CRA جزءا من إدارة المخاطر / الفوائد13. عند تطوير منصة CRA جديدة ، يجب تكرار الفحص باستخدام مجموعة مختلفة من المانحين لضمان قابلية تكرار المنصة. وينبغي أيضا إيلاء أهمية لمراعاة تباين الاستجابة بين المتبرعين14، ولذلك يوصى بإجراء تجربة جيدةالقوة 15. من أجل فهم اتساع نطاق الاستجابات والحصول على تمثيل كامل للتباين الذي يمكن ملاحظته في استجابات المتبرعين ، يجب إجراء الاختبار بشكل مثالي مع العديد من المتبرعين الأفراد بالإضافة إلى فحص العلاج في التجارب المتكررة.

الشكل 1: إطلاق السيتوكين من تجربة PBMC-SP. النتائج التمثيلية لإطلاق IFN-γ و IL-2 و IL-6 و TNF-α التي تم الحصول عليها من فحوصات إطلاق السيتوكين PBMC-SP (3 تجارب مستقلة تحتوي كل منها على 5-8 متبرعين لكل تجربة ؛ ن = 8 ، ن = 10 ، ن = 5 [من أعلى إلى أسفل]) بعد 48 ساعة عند استخدام الأجسام المضادة للكاشف المرجعي. الاختصارات: PBMC = خلايا الدم المحيطية أحادية النواة. SP = الطور الصلب ؛ IFN-γ = إنترفيرون جاما. IL-2 = إنترلوكين 2 ؛ IL-6 = إنترلوكين 6 ؛ عامل نخر الورم α = عامل نخر الورم ألفا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
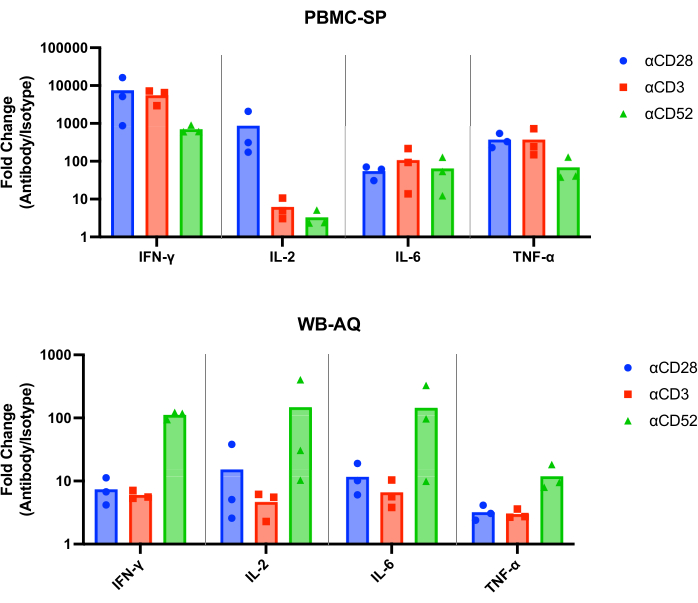
الشكل 2: زيادة تغيير طية السيتوكين من تجارب PBMC-SP و WB-AQ. تغيير الطية في إطلاق IFN-γ و IL-2 و IL-6 و TNF-α من الكواشف المرجعية للأجسام المضادة المحفزة ل CRS بالنسبة لضوابط النمط المتطابق ، والتي تم الحصول عليها من فحوصات إطلاق السيتوكين PBMC-SP و WB-AQ بعد 48 ساعة. الاختصارات: PBMC = خلايا الدم المحيطية أحادية النواة. SP = الطور الصلب ؛ WB = الدم الكامل ؛ AQ = مائي (مرحلة) ؛ IFN-γ = إنترفيرون جاما. IL-2 = إنترلوكين 2 ؛ IL-6 = إنترلوكين 6 ؛ TNF-α = عامل نخر الورم ألفا ؛ CRS = متلازمة إطلاق السيتوكين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 3: إطلاق السيتوكين من تجربة WB-AQ. النتائج التمثيلية لإطلاق IFN-γ و IL-2 و IL-6 و TNF-α التي تم الحصول عليها من فحوصات إطلاق السيتوكين WB-AQ (3 تجارب مستقلة تحتوي كل منها على 5-8 متبرعين لكل تجربة ؛ ن = 8 ، ن = 10 ، ن = 5 [من أعلى إلى أسفل]) بعد 48 ساعة عند استخدام الأجسام المضادة للكاشف المرجعي. الاختصارات: WB = الدم الكامل. AQ = مائي (مرحلة) ؛ IFN-γ = إنترفيرون جاما. IL-2 = إنترلوكين 2 ؛ IL-6 = إنترلوكين 6 ؛ عامل نخر الورم α = عامل نخر الورم ألفا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
موصوفة هنا هي طرق قياس إطلاق السيتوكين من PBMCs و WB بعد التحفيز بوساطة الأجسام المضادة من صفيحة مغلفة بالأجسام المضادة أو مع وجود جسم مضاد في المحلول ، باستخدام لوحة من الكواشف المرجعية للضوابط الإيجابية والسلبية. كل من هذه المقايسات لها نقاط القوة والضعف المرتبطة بها. فحوصات PBMC و WB مكملة لأن نسبة الخلايا المناعية المختلفة مثل الخلايا الليمفاوية والخلايا الوحيدة والخلايا المحببة تختلف في المصفوفات التجريبيتين المستخدمة في CRAs. من المثير للاهتمام ملاحظة أنه على الرغم من أن اختبار WB قد يمثل بشكل أفضل حالة في الجسم الحي بدلا من الزراعة الأحادية PBMC ، فإن المنصة السابقة أقل تنبؤا بمخاطر CRS بوساطة الخلايا التائية من TGN1412 و OKT315. نتيجة للجليكوفورين أ على كرات الدم الحمراء التي تثبط تمدد الخلايا التائية بوساطة IL-216. ومع ذلك ، فإن التنبؤ بمخاطر CRS من anti-CD52 لا يزال سليما في WB CRA ، ويرجع ذلك إلى وجود العدلات (المفقودة أثناء طرق تدرج الكثافة التقليدية الموصوفة في الخطوة 2 ، المستخدمة لعزل PBMC).
يعد تنسيق CRA (عرض SP أو AQ) أمرا بالغ الأهمية للكشف عن آلية محددة لمعيار الإبلاغ المشترك. على سبيل المثال ، فشل عرض المرحلة المائية ل mAb للخلايا الليمفاوية البشرية17،18 ، المستخدمة أثناء اختبارات السلامة في المختبر قبل السريرية ل TGN1412 في تحديد مخاطر CRS على الأرجح بسبب عدم وجود تجمع مستقبلات الخلايا الموضعية والمشاركة19 وما يترتب على ذلك من تنشيط الخلايا التائية بوساطة الجسم المضاد في المرحلة المائية. في الواقع ، لا يمكن اكتشاف CRS بوساطة TGN1412 بدقة إلا بتنسيق SP الذي يكرر بشكل مصطنع الارتباط المتقاطع لمستقبلات Fc-gamma (FcγR) ، كما هو موضح هنا ، أو عن طريق التحضير المعتمد على التلامس في زراعة PBMC بكثافة عالية وتفاعل Fc مع الخلايا المناعية CD32 + (مثل الخلايا البائية20 والخلايا الوحيدة21).
بالإضافة إلى هذه المنصات ، هناك طرق أخرى لأداء CRA مع أنظمة ثقافة مشتركة أكثر تعقيدا. مثال على CRA بديل لتلك الموصوفة في هذه الطرق هو الزراعة المشتركة PBMCs مع الخلايا البطانية لنمو الدم الذاتي (BOECs) 22. تم وصف هذا الاختبار في عام 2015 بأنه تحسن في اختبار HUVEC: PBMC التقليدي للمتبرعين المختلطين آنذاك عن طريق إزالة عدم تطابق الأنسجة المربك. إنه يظهر حساسية أفضل لمضاد CD28SA CRS من مقايسة WB ، كما يتغلب على قيود مقايسة الزراعة الأحادية PBMC من خلال محاكاة مزيج الخلايا البطانية والخلايا البيضاء الموجودة في الجسم الحي ، ولكن على حساب خطوات إجرائية أطول تتطلب تقنيات زراعة خلايامتخصصة 22.
علاوة على ذلك ، بينما يركز هذا البروتوكول بشكل خاص على إصدار IFN-γ و IL-2 و IL-6 و TNF-α ، فقد نظر الزملاء في MHRA سابقا إلى IL-12 وآخرين في هذا الإعداد23. يزداد إنتاج IL-12 من خلال هذه الأجسام المضادة ل CRS الإيجابية ، على الرغم من أنها ليست حساسة بشكل خاص ، وبالتالي ربما لا تكون مؤشرا رائعا على CRS في هذه الطريقة. لم يتم اختبار بعض السيتوكينات ، مثل IL-15 من بين أمور أخرى ، على الرغم من أن السيتوكينات الأربعة التي تم تقييمها في بروتوكولنا توفر مؤشرا جيدا على المخاطر المحتملة لمتلازمة الإبلاغ المزمن. بالطبع ، اعتمادا على الطريقة والأجسام المضادة التي تم اختبارها ، يمكن تقييم السيتوكينات الأخرى.
تسلط هذه الملاحظات مجتمعة الضوء على أهمية ملاحظة أنه على الرغم من أن استخدام الكواشف المرجعية يمكن أن يساعد في تحديد مخاطر CRS للأجسام المضادة الجديدة ، إلا أنه يجب توخي الحذر لتجنب منصة CRA دون المستوى الأمثل التي قد تفشل في تحديد إمكانات CRS. بشكل حاسم ، يجب أن تتطابق آلية عمل العلاج المتوقعة ، سواء من خلال منطقة Fc أو عملها المفترض على الخلايا التي تعبر عن المستضد ، مع بيولوجيا المقايس. لذلك ، في حين أن الاختلافات في آلية عمل الكواشف العلاجية والمرجعية للاختبار التي تمت مناقشتها في هذه المقالة قد تشكل قيدا محتملا بحيث يكون CRA ذي الصلة بالجسم المضاد للاختبار غير متوافق مع بيولوجيا الكواشف المرجعية ، فإن الاختبار يوفر منصة قوية وموثوقة لتحديد المخاطر. ومع ذلك ، قد تكون النتائج من العديد من تنسيقات CRA التي تغطي آليات مختلفة من الإجراءات والمجموعات الفرعية للخلايا المناعية ضرورية للثقة المثلى في بيانات تقييم السلامة.
Disclosures
كانت EM تعمل سابقا في وكالة تنظيم الأدوية ومنتجات الرعاية الصحية (MHRA). المؤلفون المتبقون ليس لديهم تضارب في المصالح.
Acknowledgements
تم تمويل هذا العمل من قبل المعهد الوطني للمعايير البيولوجية والرقابة. نشكر ساندرا ديبولد على مراجعة المخطوطة وعلى التعليقات والاقتراحات المفيدة. نحن ممتنون أيضا ل Ka Seng Ieong لتصوير الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 ml Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | |
| Fetal Bovine Serum, qualified, heat inactivated | ThermoFisher | 10500064 | |
| Heparinized tubes | ThermoFisher | 12967676 | |
| Heracell 150i CO2 Incubator | ThermoFisher | 16406639 | |
| MESO QuickPlex SQ 120 Human Proinflammatory Panel 1 V-PLEX kit | Meso Scale Discovery | K15049 | |
| MESO QuickPlex SQ 120MM | Meso Scale Discovery | AI1AA-0 | |
| Neubauer Improved Haemocytometer Counting Chamber | Hawksley | AS1000 | |
| Panel of lyophilized recombinant antibody controls for Cytokine Release Assays | NISBC | 19/156 | |
| PBS | ThermoFisher | 10010023 | |
| Polypropylene 96-well microtiter plate | Corning | 3879 | |
| Polystyrene 96-well microtiter plate | Corning | 3799 | |
| RPMI 1640 | ThermoFisher | 11875093 | |
| Sorvall ST 40 Centrifuge | ThermoFisher | 75004525 | |
| Sterile water | ThermoFisher | 15230162 |
References
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. The New England Journal of Medicine. 355 (10), 1018-1028 (2006).
- Hünig, T. The storm has cleared: lessons from the CD28 superagonist TGN1412 trial. Nature Reviews Immunology. 12 (5), 317-318 (2012).
- Wing, M. G., et al. Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. Journal of Clinical Investigation. 98 (12), 2819-2826 (1996).
- Gaston, R. S., et al. OKT3 first-dose reaction: Association with T cell subsets and cytokine release. Kidney International. 39 (1), 141-148 (1991).
- Riechmann, L., Clark, M., Waldmann, H., Winter, G. Reshaping human antibodies for therapy. Nature. 332 (6162), 323-327 (1988).
- Kung, P., Goldstein, G., Reinherz, E. L., Schlossman, S. F. Monoclonal antibodies defining distinctive human T cell surface antigens. Science. 206 (4416), 347-349 (1979).
- Ball, C., et al. Antibody C region influences TGN1412-like functional activity in vitro. Journal of Immunology. 189 (12), 5831-5840 (2012).
- Vessillier, S., et al. Development of the first reference antibody panel for qualification and validation of cytokine release assay platforms - Report of an international collaborative study. Cytokine: X. 2 (4), 100042(2020).
- Findlay, L., et al. Improved in vitro methods to predict the in vivo toxicity in man of therapeutic monoclonal antibodies including TGN1412. Journal of Immunological Methods. 352 (1-2), 1-12 (2010).
- oVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. Journal of Visualized Experiments. , (2023).
- Lehmann, J. S., Zhao, A., Sun, B., Jiang, W., Ji, S. Multiplex Cytokine Profiling of Stimulated Mouse Splenocytes Using a Cytometric Bead-based Immunoassay Platform. Journal of Visualized Experiments. (129), e56440(2017).
- Murthy, H., Iqbal, M., Chavez, J. C., Kharfan-Dabaja, M. A. Cytokine Release Syndrome: Current Perspectives. Immunotargets Therapy. 8, 43-52 (2019).
- Vidal, J. M., et al. In vitro cytokine release assays for predicting cytokine release syndrome: the current state-of-the-science. Report of a European Medicines Agency Workshop. Cytokine. 51 (2), 213-215 (2010).
- Grimaldi, C., et al. Cytokine release: A workshop proceedings on the state-of-the-science, current challenges and future directions. Cytokine. 85, 101-108 (2016).
- Vessillier, S., et al. Cytokine release assays for the prediction of therapeutic mAb safety in first-in man trials - Whole blood cytokine release assays are poorly predictive for TGN1412 cytokine storm. Journal of Immunological Methods. 424, 43-52 (2015).
- Chu, J. W. K., Sharom, F. J. Glycophorin A interacts with interleukin-2 and inhibits interleukin-2-dependent T-lymphocyte proliferation. Cellular Immunology. 145 (2), 223-239 (1992).
- Stebbings, R., Eastwood, D., Poole, S., Thorpe, R. After TGN1412: recent developments in cytokine release assays. Journal of Immunotoxicology. 10 (1), 75-82 (2013).
- Hanke, T. Lessons from TGN1412. Lancet. 368 (9547), author reply 1570 1569-1570 (2006).
- Stebbings, R., et al. #34;Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. Journal of Immunology. 179 (5), 3325-3331 (2007).
- Bartholomaeus, P., et al. Cell contact-dependent priming and Fc interaction with CD32+ immune cells contribute to the TGN1412-triggered cytokine response. Journal of Immunology. 192 (5), 2091-2098 (2014).
- Hussain, K., et al. Upregulation of FcγRIIb on monocytes is necessary to promote the superagonist activity of TGN1412. Blood. 125 (1), 102-110 (2015).
- Reed, D. M., et al. An autologous endothelial cell:peripheral blood mononuclear cell assay that detects cytokine storm responses to biologics. The FASEB Journal. 29 (6), 2595-2602 (2015).
- Eastwood, D., et al. Severity of the TGN1412 trial disaster cytokine storm correlated with IL-2 release. British Journal of Clinical Pharmacology. 76 (2), 299-315 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved