A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحليل قلب الشجرة مع التصوير المقطعي المحوسب بالأشعة السينية
In This Article
Summary
نوضح هنا كيفية معالجة نوى الأشجار باستخدام سلسلة أدوات التصوير المقطعي المحوسب بالأشعة السينية. باستثناء الاستخراج الكيميائي لبعض الأغراض ، لا حاجة إلى مزيد من المعالجة المعملية الفيزيائية. يمكن استخدام سلسلة الأدوات لتقديرات الكتلة الحيوية ، للحصول على بيانات عرض MXD / حلقة الشجرة وكذلك للحصول على بيانات تشريح الخشب الكمية.
Abstract
يتم تقديم سلسلة أدوات التصوير المقطعي المحوسب بالأشعة السينية (CT) للحصول على عرض حلقة الشجرة (TRW) ، والحد الأقصى لكثافة الخشب المتأخر (MXD) ، ومعلمات الكثافة الأخرى ، وبيانات تشريح الخشب الكمي (QWA) دون الحاجة إلى معالجة سطحية كثيفة العمالة أو أي تحضير مادي للعينات. ينصب التركيز هنا على نوى الزيادة وإجراءات المسح بدقة تتراوح من 60 ميكرومتر إلى 4 ميكرومتر. يتم تحديد ثلاثة مقاييس يجب النظر إليها في الخشب: (i) مقياس بين الحلقات ، (ii) مقياس الحلقة ، أي تحليل حلقة الشجرة ومقياس قياس الكثافة ، وكذلك (iii) مقياس تشريحي ، وهذا الأخير يقترب من جودة المقطع الرقيق التقليدية. تتيح حوامل العينات المصممة خصيصا لكل من هذه المقاييس إجراء مسح ضوئي عالي الإنتاجية لنوى الزيادة المتعددة. تم تطوير سلسلة من إجراءات البرامج خصيصا لمعالجة صور الأشعة السينية المقطعية ثلاثية الأبعاد بكفاءة لنوى الأشجار من أجل TRW وقياس الكثافة. يشرح هذا العمل بإيجاز المبادئ الأساسية للتصوير المقطعي المحوسب ، وهي ضرورية لفهم البروتوكول بشكل صحيح. يتم تقديم البروتوكول لبعض الأنواع المعروفة التي يشيع استخدامها في علم التسلسل الزمني للشجيرات. يتيح لنا الجمع بين تقديرات الكثافة التقريبية وبيانات TRW و MXD ، بالإضافة إلى بيانات التشريح الكمي ، توسيع وتعميق التحليلات الحالية لإعادة بناء المناخ أو استجابة الأشجار ، بالإضافة إلى مواصلة تطوير مجال علم البيئة الشجرية / علم المناخ وعلم الآثار.
Introduction
كثافة الخشبهي متغير 1 سهل القياس يعكس كل من الخصائص التشريحية والكيميائية للخشب2. في تقديرات الكتلة الحيوية للكتلة الحيوية فوق الأرض ، تعد كثافة الخشب متغيرا مهما للوزن 3،4،5 ، مضروبا في أبعاد الشجرة وعاملا يمثل محتوى الكربون في الخشب. ترتبط كثافة الخشب ارتباطا وثيقا بالخواص الميكانيكية للأخشاب6 وتعكس تاريخ حياة الشجرة7.
تقاس كثافة جدار الخلية على أنها حوالي 1500 كجم / متر مكعب وتعتبر ثابتة إلى حد ما8 ، ولكن يجب مراعاة اختلافات كثافة جدار الخلية داخل الحلقة أيضا 8,9. يتم توجيه / تشكيل الخلايا الخشبية (بشكل عام القصيبات في الصنوبريات والأوعية والحمة والألياف في الأخشاب الصلبة) بطرق مختلفة ويختلف سمك جدار الخلية وحجم تجويف هذه الخلايا10. لذلك ، تختلف كثافة الخشب بين الأشجار ، داخل الشجرة (المحورية والمستعرضة) وخلال فترات قصيرة داخل حلقة الشجرة11,12. في كثير من الحالات ، يحدد تباين كثافة الخشب على مقياس الحلقة أيضا حدود حلقة الشجرة13. يتم إنشاء كثافة الخشب وفي النهاية كسور الأنسجة وفي هذه الورقة يتم وضعها على نطاق واسع في ثلاث فئات (أي ثلاثة مقاييس دقة مختلفة) ، اعتمادا على هدف الدراسة (الشكل 1) كما هو موضح أدناه.
مقياس بين الحلقات: عن طريق قياس قطع الخشب ، يتم الحصول على قيمة واحدة لتلك العينة. يمكن القيام بذلك من خلال الغمر في الماء أوهندسيا 14. بهذه الطريقة ، يمكن الحصول على متغيرات الكتلة الحيوية العامة أو المتغيرات التكنولوجية للأخشاب. لتضمين الاختلاف من اللب إلى اللحاء ، يمكن تقسيم قطع الخشب هذه إلى كتل يتم قياسها يدويا للحصول على معلومات حول استراتيجية تاريخ الحياة15. عند التبديل إلى التصوير المقطعي المحوسب بالأشعة السينية منخفض الدقة كما هو الحال في الماسحات الضوئية الطبية17,18 ، يمكن إجراء بيانات TRW على الحلقات المتوسطة إلى العريضة بطريقة فعالة على العديد من العينات 18,19,20. هذا هو أيضا المقياس الذي يمكن استخدامه لتقييم الكتلة الحيوية من اللب إلى اللحاء من كل من الأشجار المعتدلة والاستوائية 4,22 ، والتي تتراوح عادة في الدقة من 50 ميكرومتر إلى 200 ميكرومتر.
مقياس الحلقة: الخشب هو مسجل للظروف البيئية الماضية. أفضل معلمة معروفة هي عرض حلقة الشجرة (TRW) ، ولكن بالنسبة لإعادة بناء درجات الحرارة العالمية ، ثبت أن سجلات كثافة الخشب المتأخر القصوى (MXD) هي وكيل أفضل لدرجة الحرارة22. MXD هو متغير23 سهل القياس ، ووكيل لسمك جدار الخلية وحجم الخلية على الخلايا الأخيرة من حلقة الشجرة ، وهي في خط الشجرة والمواقع الشمالية مرتبطة بشكل إيجابي بدرجة حرارة الهواء الموسمية24: كلما كان الصيف أكثر دفئا وأطول ، يحدث المزيد من تقشير جدار الخلية مما يزيد من كثافة هذه الخلايا الأخيرة. القياسات التقليدية مثل الغمر والهندسة أقل دقة لتحديد كثافة مستوى الحلقة هذه. طور عمل سابق سلسلة أدوات لاستخدام فيلم الأشعة السينية على عينات رقيقة25. أثار هذا ثورة في كل من الغابات وعلم المناخ القديم في وقت لاحق15,18 ، وتحديد الحد الأقصى لكثافة الخشب المتأخر (MXD) ، أي قيمة الكثافة القصوى غالبا في نهاية الحلقة ، كبديل لدرجة حرارة الصيف. المبدأ الأساسي هو أن العينات منشورة (حوالي 1.2 مم إلى 7 مم13) لتكون موازية تماما للاتجاه المحوري ، ويتم وضع العينة على فيلم حساس يتعرض لمصدر الأشعة السينية. ثم تتم قراءة أفلام التصوير الشعاعي هذه من خلال مصدر ضوء يكتشف الشدة ويحفظ الملامح ومعلمات حلقة الشجرة السنوية. ومع ذلك ، تتطلب هذه الأدوات قدرا كبيرا من إعداد العينات والعمل اليدوي. تم تطوير هذا مؤخرا للأشعة السينية CT بطريقة أكثر توحيدا أو بناء على النوى المركبة26. تتراوح الدقة هنا بين 10 ميكرومتر و 20 ميكرومتر. يتم قياس TRW على هذا المقياس أيضا ، خاصة عند التعامل مع الحلقات الأصغر.
المقياس التشريحي: عند هذا المقياس (الدقة < 4 ميكرومتر) ، يصبح متوسط مستويات الكثافة أقل أهمية حيث يتم تصور السمات التشريحية الرئيسية ويمكن قياس عرضها ونسبها. عادة ، يتم ذلك من خلال إجراء المقاطع المجهرية أو المسح البصري عالي الدقة أو فحوصات μ-CT. عندما تحتاج البنية التحتية لجدران الخلايا إلى تصور ، فإن الفحص المجهري الإلكتروني الماسح هو الطريقة الأكثر استخداما27. على المستوى التشريحي ، تصبح كسور الأنسجة الفردية مرئية بحيث يمكن اشتقاق المعلمات الفسيولوجية من الصور. استنادا إلى المعلمات التشريحية الفردية وكثافة جدار الخلية للخشب ، يمكن اشتقاق الكثافة التشريحية للمقارنة مع المقدرات التقليدية لكثافة الخشب24.
نظرا لتقنيات التقسيم المحسنة وبرامج الصور 29,30 ، تم تطوير dendro-anatomy30 للحصول على سجل أكثر دقة للخشب ، للحصول على تقدير أقرب ل MXD في الصنوبريات وقياس العديد من المتغيرات التشريحية من الأشجار عريضة الأوراق. على هذا المقياس ، يتم قياس المعلمات التشريحية الفعلية وتتعلق بالمعلمات البيئية31 . مع μCT يمكن الحصول على هذا المستوى أيضا32,33.
نظرا لأن الخشب استرطابي بطبيعته ومتباين الخواص ، يجب تحديد كثافة الخشب بعناية ويجب تحديد ظروف القياس ، إما على أنها جافة في الفرن أو مكيفة (عادة عند 12٪ من محتوى الرطوبة) أو خضراء (كما تم قطعها في الغابة)34. بالنسبة للعينات الكبيرة والأغراض الفنية ، يتم تعريف كثافة الخشب على أنها الوزن مقسوما على حجمه في ظروف معينة. ومع ذلك ، فإن قيمة كثافة الخشب تعتمد بشدة على المقياس الذي يتم قياسه به ، على سبيل المثال من كثافة الخشب من اللب إلى اللحاء يمكن أن تتضاعف ، وعلى مقياس الحلقة (في الصنوبريات) يؤدي انتقال الخشب المبكر إلى الخشب المتأخر إلى ارتفاع كبير في كثافة الخشب أيضا ، مع ذروة عند حدود الحلقة.
هنا ، يتم تقديم بروتوكول المسح بالأشعة السينية بالأشعة المقطعية لنوى الزيادة من أجل قياس الميزات في مقاييس 3 المذكورة أعلاه (الشكل 1). يمكن أن تغطي التطورات الأخيرة في التصوير المقطعي المحوسب بالأشعة السينية معظم هذه المقاييس ، بسبب الإعداد المرن. ستحدد أهداف البحث البروتوكول النهائي للمسح.
العامل المحدد الحاسم (المرتبط بطبيعته بالطبيعة المتدرجة لكثافة الخشب والخشب بشكل عام) هو الدقة والوقت اللازمين للمسح. توضح الأمثلة كيفية: (i) الحصول على ملامح كثافة الخشب على نطاق الأشجار بين الحلقات لتقديرات الكتلة الحيوية في Terminalia superba من حوض الكونغو ، (ii) الحصول على سجلات الكثافة من أرز Clanwilliam (Widdringtonia cedarbergensis) بناء على المسح الحلزوني على نظام HECTOR35 ، و (iii) قياس معلمات الأوعية على البلوط اللاطئ ، على نظام Nanowood. كلا الماسحين الضوئيين هما جزء من مجموعة الماسحات الضوئية في مركز UGent للتصوير المقطعي بالأشعة السينية (UGCT ،

الشكل 1: شجرة القرارات المنهجية العامة للتصوير المقطعي المحوسب بالأشعة السينية. تشير الصفوف إلى الخطوات التي يجب اتخاذها ، بدءا من هدف البحث وصولا إلى تنسيق البيانات النهائي. المربعات البيضاء هي الخطوات ذات الصلة بسلسلة الأدوات هذه. المربعات الرمادية هي خطوات يمكن تنفيذها باستخدام برامج أخرى أو حزم R ، مثل dplr47 و Treeclim48 لتحليل حلقة الشجرة ، و ROXAS44 بالإضافة إلى ImageJ42 أو تطبيقات أخرى (تجارية) لاشتقاق المعلمات التشريحية الخشبية بناء على صور التصوير المقطعي المحوسب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
أبحاث X-CT على الخشب
إعداد الماسح الضوئي: يتكون ماسح الأشعة السينية المقطعي المحوسب القياسي من أنبوب الأشعة السينية ، وكاشف الأشعة السينية ، ومرحلة الدوران ، ومجموعة من المحركات لتحريك مرحلة الدوران ، وفي معظم الحالات أيضا الكاشف ، ذهابا وإيابا (الشكل 2).

الشكل 2. نظام المسح الضوئي HIKTOR. النظام35 ، يوضح مسافة كاشف المصدر (SDD) ومسافة الكائن المصدر (SOD). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تحتوي معظم الأنظمة القائمة على المختبر على هندسة الحزمة المخروطية ، مما يعني أن الأشعة السينية المنتجة يتم توزيعها من نافذة خروج الأنبوب في شكل شعاع مخروطي ، مما يعني أنه من خلال تغيير المسافة بين الجسم والأنبوب (SOD = Source-Object-Distance) والكاشف والأنبوب (SDD = Source-Detector-Distance) ، يتم التحكم في التكبير (انظر المناقشة حول الدقة). نظرا لقوة اختراق الأشعة السينية ، فإنها تمر عبر الجسم ، وشدة حزمة التوهين هي دالة على طاقة شعاع الأشعة السينية ، والتركيب الكيميائي للجسم (العدد الذري للعناصر الموجودة) وكثافة المادة. بالنظر إلى طيف الطاقة الثابت والتركيب المادي الثابت للخشب ، فإن توهين شعاع الأشعة السينية يعتمد بشكل كبير على كثافة المادة ، وهو ما يفسر استخدامها لقياس الكثافة. يمكن التعبير عن التوهين (أو الإرسال) بواسطة قانون بير لامبرت:
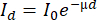
مع I0 شعاع الأشعة السينية الوارد أضعافا مضاعفة والذي يضمحل إلى شعاع الأشعة السينية المرسل Id عند الانتشار عبر المادة على مسافة d. يعتمد معامل التوهين الخطي μ على سلسلة من التفاعلات مع مادة الكائن. وبالتالي فإن الإسقاطات هي تسجيلات للحزمة المرسلة.
عمليا ، يتم تثبيت الكائن على مرحلة الدوران ، ويتم اختيار SOD و SDD المناسبين ، ويتم تحديد قوة معينة أيضا (تتعلق بحجم الكائن وكثافته وتكوينه) ويتم تدوير الكائن 360 درجة وخلال هذا الدوران يتم أخذ إسقاطات متعددة. ثم تستخدم هذه الإسقاطات لإعادة بناء البنية الداخلية للجسم. هناك العديد من خوارزميات إعادة البناء المتاحة ، والتي لا تزال أكثرها استخداما تستند إلى الإطار التحليلي الذي تم تطويره منذ عقود ، بالاعتماد على تحويل الرادون ونظرية شريحة فورييه. لمزيد من التفاصيل ، تتم إحالة القارئ إلى الأدبيات المتخصصة36.
لغز الدقة وحجم البيانات وحجم العينة: الدقة هي المفتاح في التصوير المقطعي المحوسب بالأشعة السينية. في الأنظمة ذات الهندسة العكسية ، أو هندسة الحزمة المتوازية مثل خطوط شعاع السنكروترون ، تلعب الاعتبارات الأخرى دورا. يناقش هذا البروتوكول فقط التصوير المقطعي المحوسب القياسي القائم على المختبر مع هندسة الحزمة المخروطية. هنا ، يعد مفهوم التكبير وحجم بكسل الكاشف وحجم البقعة أمرا ضروريا. يعرف التكبير بأنه نسبة SDD / SOD. بعد ذلك ، من الواضح أن حجم البكسل للكاشف يؤثر أيضا على الدقة: فكلما كان حجم البكسل أصغر ، زادت الدقة ، ولكن في معظم الحالات يرتبط مجال الرؤية (FoV) أيضا ارتباطا مباشرا بحجم البكسل وحجم الكاشف (حجم بكسل أصغر ، FoV أصغر لنفس العدد من وحدات البكسل). علاوة على ذلك ، فإن حجم بقعة شعاع الأشعة السينية مهم أيضا: فكلما زاد حجم البقعة ، انخفضت الدقة ، مما يعني أنه يمكن رؤية تفاصيل أقل.
من المهم معالجة أنه يمكن للمرء الحصول على دقة أعلى مما هو ممكن وفقا للحدود المذكورة أعلاه ، لذلك من الأفضل استخدام مصطلح حجم voxel (voxel هو بكسل حجم) بدلا من الدقة. علاوة على ذلك ، هناك عوامل أخرى تلعب دورا ، مثل حدة الكاشف ، والتي تحد بشكل أكبر من الدقة الحقيقية التي يتم بها مسح الكائن. فقط المعايرة الحقيقية للنظام ، باستخدام الأهداف المحددة ، توفر الإجابة الصادقة.
ومع ذلك ، في معظم الحالات ، يكون حجم voxel الذي يمكن مسح كائن به محدودا في الغالب بحجم الكائن. هذا يعني أنه كلما زاد حجم الكائن ، انخفض حجم الفوكسل. إذا كان الكائن لا يتناسب مع FoV للكاشف لحجم voxel معين ، فيمكن تقليل حجم voxel ، على سبيل المثال ، عن طريق الحد من التكبير.
من المهم مراعاة وقت المسح وحجم البيانات عند تحديد حجم voxel المطلوب. بشكل عام ، كلما كان حجم voxel أصغر يعني أنه كلما زادت التفاصيل التي يريد المرء رؤيتها ، أو كلما كانت العينة أصغر أو عددا أقل من العينات التي يمكن مسحها ضوئيا في وقت واحد ، يلزم المزيد من الوقت وسيتم جمع أحجام بيانات أكبر. تخيل المثال النظري التالي: يمكن للمرء مسح عينة بقياس 10 سم × 10 سم × 10 سم عند 50 ميكرومتر دفعة واحدة باستخدام نظام معين للأشعة السينية CT ويرغب في مسح نفس الحجم عند 10 ميكرومتر ، سيكون الحجم الذي يتناسب مع FoV 2 سم × 2 سم فقط ، على افتراض أن هذا ممكن جسديا. هذا يعني أن هناك حاجة إلى 125 عملية مسح ضوئي (5³ = دقة أعلى 5 مرات ، ومقاييس إلى قوة 3 بسبب الطبيعة الحجمية لتقنية التصوير) لتغطية الحجم بالكامل ، وأن حجم البيانات سيزداد بالمثل. بالطبع ، هذه مجرد تجربة فكرية ، ويحتاج المرء إلى التفكير في أكثر بكثير من مجرد القرار. لمزيد من المعلومات ، تتم إحالة القارئ إلى نظرة عامة على إمكانيات المسحالضوئي 37.
مرونة أدوات مسح الأشياء الخشبية: في العقد الماضي ، قدمت العديد من الشركات أنظمة الأشعة السينية المقطعية مع مجموعة مماثلة مثل HECTOR35. يتم إعطاء نظرة عامة على العديد من أنظمة التصوير المقطعي المحوسب ، والتي تم تقييمها بشكل خاص لدقتها الزمنية ، في38.
بشكل عام ، تحسنت مرونة وسهولة استخدام أنظمة الأشعة السينية المقطعية بشكل كبير. تسمح العديد من الأنظمة بمسح مجموعة متنوعة من الكائنات ، وهو ما يحدث أيضا مع الأنظمة في UGCT. يتم عرض البروتوكول أدناه لنظام HECTOR ، وهو مناسب لتحليل حلقة الأشجار. ومع ذلك ، فإن البروتوكول صالح لأي نظام آخر متاح إذا كان تنسيق الدقة والبيانات يسمح بذلك.
تسمح هذه الأنظمة بمسح مجموعة متنوعة من الكائنات. وترد في الشكل 3 بعض الصور لأشياء خشبية مختلفة تم مسحها ضوئيا باستخدام نظام HECTOR. هذه المرونة هي التي تتكون من المقاييس الثلاثة التي نقدمها في الشكل 1 ، والتي تتراوح من دقة خشنة إلى دقة دقيقة للغاية.

الشكل 3. مسح أمثلة الإعداد. (أ) سجل ، (ب) تشيلو49 ، (ج) حاملات عينات (النوع 1) مع نوى شجرة لمسح الدفعات و (د) حامل عينة من النوع 2 مع نوى زيادة للمسح الحلزوني مثبتة على مرحلة دوران HECTOR. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. أخذ العينات الأساسية
- تذوق الشجرة مع حفار بريسلر. استشر المراجع حول كيفية قلب الشجرة يدويا39. يتم تقديم سلسلة الأدوات هذه لنوى 5.15 مم.
- ضع نوى الشجرة غير الملصقة في قش ورقي 6 مم أو في أي مستقبل آخر لا يتطلب الغراء. لا تلصق نوى الشجرة على دعامة خشبية. إذا كانت النوى مثبتة بالفعل ، فقم بفكها بمشرط / منشار أو مذيب حسب نوع الغراء.
- تجنب لفها في أنابيب بلاستيكية ، حاول تجفيفها أولا لتجنب نمو العفن والعفن الفطري.
- استخدم قلم رصاص للكتابة على القش الورقي ، لأن الاستخراج قد يتلاشى كتابات العلامة.
ملاحظة: سلسلة الأدوات هذه مناسبة أيضا للنوى مقاس 4 مم. يمكن استخدام النوى المثبتة والرملية بالفعل ، ولكن يجب فكها أولا. بالنسبة للخشب الأثري أو المتبقي ، يجب عمل عينة بحجم النواة (عن طريق النشر / تقليل الحجم) للمسح الضوئي.
2. التحضير الأساسي قبل المسح
- قم بإجراء استخراج الإيثانول / التولوين أو الإيثانول أو الأسيتون40 Soxhlet لمدة 24 ساعة على الأقل (الشكل 4 أ ، ب). يعد ذلك ضروريا لضمان حجم خشب خال من الراتنج للحصول على حساب دقيق للكثافة (يخفف الراتنج الإشارة ، الشكل 4C13,41).
- اصنع محلولا من 1000 مل من الإيثانول مع 427 مل من التولوين (وفقا على سبيل المثال ، ASTM D 1107 - 96) أو الإيثانول النقي أو الأسيتون. يوجد في العديد من الجامعات ورشة عمل لزجاج المختبر يمكنها صنع نسخة معدلة من جهاز Soxhlet لنوى الأشجار (الشكل 4 ب).
- املأ القارورة ذات القاع المستدير بالمذيب ، وضع العينات داخل القش في دعامة من الفولاذ المقاوم للصدأ في جهاز Soxhlet مع مبرد على سخان المختبر. اسمح بما لا يقل عن 6 عمليات شفط لكل ساعة.
ملاحظة: يفضل استخدام دائرة المياه المغلقة للتبريد (أو أي نظام تبريد حديث آخر). في هذه الحالة ، تقوم مضخة المياه بتدوير الماء ، المخزن في حوض سعة 100 لتر مع أقراص الكلور (لتجنب تطور الطحالب) ، عند 120 لتر / ساعة (ولكن هذا سيعتمد على حجم جهاز Soxhlet وكذلك الحرارة المطبقة بواسطة عنصر الحرارة). يتم استخدام مبرد الهواء لتبريد الماء في حوض 100 لتر. لتوفير المذيبات ، يمكن استخدام الخرز الزجاجي لملء حجم الفراغ لجهاز Soxhlet. - تحقق من درجة الحرارة وعدد عمليات السحب بانتظام. جفف النوى تحت غطاء كيميائي (تحقق من سياسة المختبر الخاصة بذلك) لإزالة بقايا المذيبات أو ضع فرن تجفيف تحت الغطاء الكيميائي.
- جفف النوى لمدة 24 ساعة في فرن تجفيف (103.5 درجة مئوية) تحت تهوية العادم وقم بإجراء حمام ماء ساخن (90 درجة مئوية) أو استخراج الماء الساخن Soxhlet لمدة 24 ساعة كما هو موضح أعلاه.
- احتفظ بالعينات في القش الورقي في حاملات العينات الفولاذية. جفف مرة أخرى في فرن جاف لمدة 24 ساعة عند 103.5 درجة مئوية ، ثم رطب إلى 60٪ رطوبة نسبية (RH) قبل المسح.
ملاحظة: يتم اختيار قيمة 60٪ في هذه الحالة لأن هذه هي تقريبا متوسط ظروف الرطوبة النسبية المحيطة في غرفة التصوير المقطعي المحوسب بالأشعة السينية. يمكن أيضا استخدام عينات الفرن الجافة. العامل الأكثر أهمية هو أن جميع العينات يتم مسحها ضوئيا في ظل نفس الظروف. - في حالة تدهور استخراج المياه من القش الورقي ، أعد نوى الشجرة إلى قش ورقي جديد مقاس 6 مم21. يمكن وضع كل من النوى مقاس 5.15 مم و 4 مم في قش ورقي 6 مم.
- تأكد من أن القش الورقي بالكامل مملوء بالخشب. لف كل من القش ينتهي ويقطع الأطراف. يتيح ذلك سهولة إدخال المصاصات في الحامل الأسطواني.
- تأكد من الإشارة بوضوح إلى جانب الكامبيوم (اللحاء) على القلب لأن CoreProcessor و RingIndicator يفترضان أن جانب اللحاء لأسفل. قم بإزالة القطع والقطع وكذلك النوى ذات الشقوق حيث يصعب التعامل معها.
- احتفظ بالعينات في القش الورقي في حاملات العينات الفولاذية. جفف مرة أخرى في فرن جاف لمدة 24 ساعة عند 103.5 درجة مئوية ، ثم رطب إلى 60٪ رطوبة نسبية (RH) قبل المسح.
الشكل 4. سير عمل لاستخراج وتجفيف النوى قبل المسح. (أ) توضع نوى الزيادة في القش الورقي أولا في حمام ماء ساخن ثم في خليط ساخن من الإيثانول والتولوين بجهاز Soxhlet لمدة 24 ساعة ثم تجفف ، وتوضع في حمام ماء ساخن لمدة 24 ساعة ، ثم تجفف مرة أخرى عند 103.5 درجة مئوية ، ثم تكيف قبل المسح. (ب) صور لتركيب Soxhlet المعدل في جامعة غنت. يتم إرفاق العديد من أجهزة Soxhlet المعدلة بشكل متسلسل. لاحظ رقائق الألومنيوم وأنابيب العزل للحفاظ على خليط المذيب أو المذيب دافئا بدرجة كافية للاستخراج. (ج) مثال على سطح نواة زيادة من Pinus longaeva قبل الاستخراج وبعده. تخفي الراتنجات والمواد الاستخراجية الأخرى إشارة الكثافة الحقيقية ، بسبب توهين الأشعة السينية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. المسح الأساسي
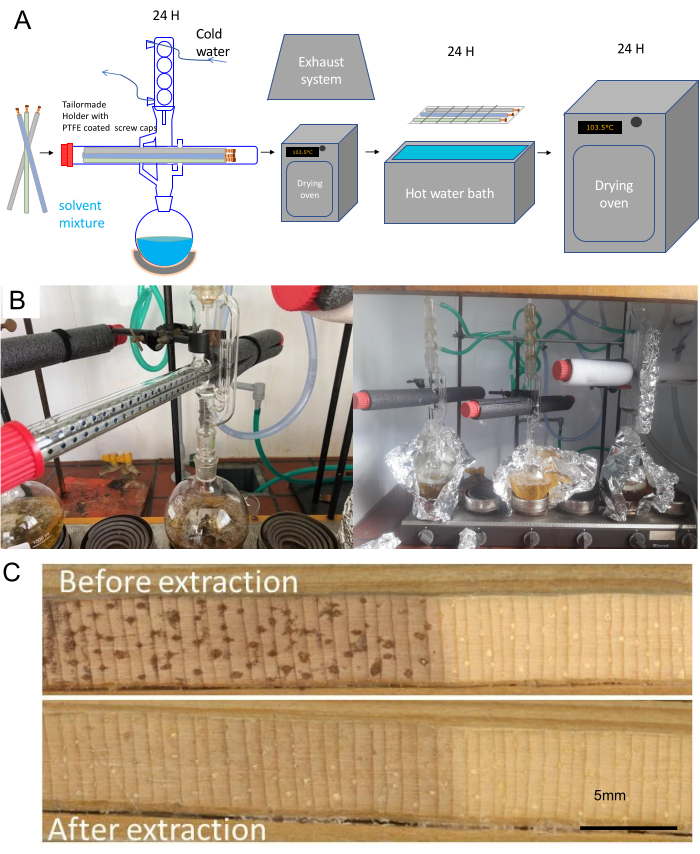
- حدد نوع حامل العينة المناسب (الشكل 5) كما هو موضح أدناه ، اعتمادا على الغرض من البحث كما هو موضح في الشكل 1.
- لأغراض المقياس بين الحلقات ، استخدم نوع الحامل 1 - الورق المقوى ورغوة الأزهار المثقبة.
- بالنسبة لحامل بيانات MXD ، استخدم النوع 2 - حامل عينة بلاستيكي يحتوي على 6 نوى بطول 1-15 سم وقطره 3 سم.
- استخدم نوع الحامل 3 - لأغراض التشريح الشجري الذي يتكون ببساطة من ربط القش الورقي معا.
- قم بتحميل نوى الشجرة في شفاطات ورقية في حامل العينة واملأ قالب جدول البيانات الذي يمكن تنزيله على https://dendrochronomics.ugent.be/#software. يتوافق كل رقم مع موضع معين في حامل العينة.
- المسح الضوئي في منشأة الأشعة السينية μCT: استشر خبير الأشعة السينية CT لمعرفة الإعدادات المناسبة وبروتوكول المسح. للاطلاع على الماسح الضوئي المستخدم في هذا البروتوكول، انظر37.
- إعادة بناء الصور الممسوحة ضوئيا: استشر خبير الأشعة السينية في التصوير المقطعي المحوسب لمعرفة الإعدادات المناسبة لإعادة البناء ، أو الإعدادات التي تأتي مع ماسح التصوير المقطعي المحوسب (حزمة برامج ماسح الأشعة السينية المقطعي المحوسب). للاطلاع على معلمات إعادة الإعمار لهذا البروتوكول، انظر37.
الشكل 5. أنواع حامل العينة والقرار. تصميم أنواع الحوامل الرئيسية الثلاثة ، والتي تتوافق مع (أ) مقياس بين الحلقات ، (ب) مقياس حلقة الشجرة ، و (ج) مقياس تشريحي. نظرا للحجم الناتج ، يتناقص عدد العينات مع زيادة متطلبات الدقة. العروض ثلاثية الأبعاد المقابلة للمقياس بين الحلقات (D) (الحامل 1) وعرض الحلقة (E) و MXD (نوع الحامل 2) و (F) المعلمات التشريحية (نوع الحامل 3). شريط المقياس = 5 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
4. الحصول على بيانات TRW وبيانات الكثافة والبيانات التشريحية
- الشروع في العمل مع البرنامج.
- للحصول على قيم الكثافة (نوع الحامل 1 و 2) ، قم بتثبيت حزم البرامج الثلاثة التالية: (i) CoreProcessor و (ii) RingIndicator و (iii) CoreCompare toolboxes من
- نظرا لأن صناديق الأدوات هذه تم إنشاؤها في MATLAB ، قم بتثبيت وقت تشغيل مترجم MATLAB الصحيح (MCR) ، المتاح على: http://nl.mathworks.com/products/compiler/mcr/. الإصدار المطلوب حاليا هو MATLAB2022B. MCR مجاني ، تماما مثل حزم برامج 3.
- بجوار مجلد وحدات التخزين المعاد إنشاؤها ، قم بإنشاء مجلد فارغ جديد لملفات MAT (تنسيق ملف من MATLAB يخزن المتغيرات ، وما إلى ذلك) ، على سبيل المثال ، matfiles_useful_name_sample_holder ، فهذا ضروري لتخزين المعلمات المؤقتة.
- تأكد من وجود جدول البيانات في مجلد وحدات التخزين المعاد بناؤها، لملء العينات في خطوة لاحقة.
- المعالجة المسبقة لوحدات التخزين الأساسية باستخدام CoreProcessor.
ملاحظة: بالنسبة لبيانات التشريح عالية الدقة، لا يلزم اتباع خطوات المعالجة (الشكل 1)، بمجرد توفر وحدات التخزين المعاد بناؤها، راجع إرشادات ImageJ لصور 3D42. يمكن إجراء التجزئة من خلال المكون الإضافي Weka43 للإشارة إلى الأوعية على شرائح فردية على سبيل المثال12، أو في المكونات الإضافية للبرامج مثل ROXAS44.- تحضير الاستخراج الأساسي: قم بإعداد الاستخراج الآلي لنوى الزيادة (اعتمادا على المقياس بين الحلقات الشكل 6 أ أو الشكل 6 ب) كما هو موضح أدناه.
- حدد المجلد الذي يحتوي على ملفات معاد إنشاؤها (شرائح TIFF مقطعية 16 بت) وملف جدول البيانات (XrayForm.xlsx).
- حدد المجلد الفارغ من 4.1.3. هذا هو المجلد حيث سيقوم CoreProcessor بإنشاء ملف MAT الذي سيتم استخدامه في 4.2.2. لاستخراج الكتلة الأساسية.
- حدد مجلد ملف MAT الفارغ الذي تم إنشاؤه حديثا أو ، إذا لم يتم إنشاؤه ، فحدد أي مجلد آخر. يتم تحميل وحدة التخزين ، ويظهر مقطع عرضي طولي للأسطوانة ، تحقق من بعض الشرائح الأفقية للتأكد مما إذا كانت جميع النوى والمراجع مثبتة بشكل صحيح في الأسطوانة.
- انقر من أسفل إلى أعلى لتحديد الشرائح لتقييم ذلك. سيتم استخدام هذه المقاطع العرضية للخطوة التالية ، لذا انقر عبر الطول بالكامل. أشر إلى المراجع المظلمة (الهواء) والأبيض (الشكل 6) ، عدة مرات كما هو موضح في ملف جدول البيانات. انقر نقرا مزدوجا بعد كل تحديد.
- بالنسبة لحامل العينة 1 ، افحص الشاشة المتعددة ذات 9 مقاطع عرضية ، تم إنشاؤها من خلال المادة المرجعية للتحقق مما إذا كان حساب الكثافة قد تم إجراؤه على الخشب (وليس على القش الورقي أو أي مادة أخرى غير خشبية). هذا ضروري للتحويل الصحيح إلى قيم كثافة الخشب الفعلية.
- في نافذة منبثقة جديدة ، حدد كل نواة على حدة عن طريق رسم دائرة / قطع ناقص حولها. قم بإجراء التسمية بناء على المعلومات الواردة في ملف جدول البيانات ، وتحقق مما إذا كان الاسم صحيحا أم لا. احترم الترتيب الذي يتم به ملء القالب. يتم تخزين جميع المعلومات في ملف MAT ، والذي سيتم استخدامه خلال الخطوة التالية لاستخراج جميع النوى مرة واحدة.
- انقر فوق Mass Core Extraction لإجراء استخراج النواة لجميع النوى في أسطوانة معينة (المشار إليها في 4.2.1.2) ، نظرا لأن ملفات البيانات الوصفية وجداول البيانات موجودة في نفس المجلد.
ملاحظة: عند استخدام استخراج النواة الجماعية ، سيتم استخراج جميع النوى وفقا لوضع العلامات الخاصة بالمستخدم (المخزنة في مجلد ملف mat). نتيجة لهذه العملية ، سيتم إنشاء مجلد جديد باسم Extracted يحتوي على جميع النوى المنفصلة. عند إعداد العديد من حاملي العينات في الخطوة الأولى ، ويتم تخزين جميع ملفات MAT في نفس المجلد ، ستتم معالجة جميع ملفات MAT في هذا المجلد. - في مربع أدوات CoreProcessor ، انقر فوق تصحيح Tg اليدوي ، ثم حدد المجلد المستخرج لضمان الاتجاه الصحيح للمستوى المستعرض والشعاعي لكل حجم أساسي ، على غرار تركيب العينات المادية في حامل العينة قبل الصنفرة مع إبقاء المستوى المستعرض في العرض (الشكل 7 ب).
- يتم عرض بعض المقاطع العرضية بحيث يمكن للمستخدم رؤية اتجاه الحبوب. في الرسم الأخير (أسفل اليمين) ، افحص الشريحة المعروضة وارسم خطا للإشارة إلى اتجاه الحبوب. انقر نقرا مزدوجا لتدوير النواة تلقائيا.
- ثم تظهر شاشة ، هنا قم بقص حجم النواة (الشكل 7C) ، مع التأكد من أن المستطيل يشمل قطر القلب بالكامل. يعد ذلك ضروريا لأن النقطة المركزية للمستطيل يجب أن تكون قريبة قدر الإمكان من المحور الأساسي (للمحاذاة الصحيحة في وحدة RingIndicator).
ملاحظة: في حالة المسح الضوئي بدقة عالية، حدد المواد الموجودة داخل القلب فقط في هذه المرحلة واستخدم المحول للتبديل إلى حامل العينة من النوع 2. هذا مفيد بالتأكيد للأنواع المسامية الحلقية على سبيل المثال.
- قم بتنفيذ الخطوات الاختيارية التالية في حالة وجود نوى غير محاذية أو معكوسة أو مكسورة أو تنسيقات صور غير متوافقة.
- تصحيح الإمالة الأساسية (لحامل العينة 1 فقط): للتصحيح التلقائي للإمالة الأساسية (على سبيل المثال، عندما يميل القلب قليلا في الأسطوانة؛ الشكل 7 أ). هذا مهم للخطوات اللاحقة. حدد المجلد المستخرج الذي تم إنشاؤه في الخطوة السابقة.
ملاحظة: عادة لا تكون هناك حاجة إلى هذا إذا كان لديك حامل عينة من النوع 2 أو النوع 3 (الشكل 5) أو عندما يتم وضع جميع العينات وحاملات العينات في وضع مستقيم تماما. - أحجام الوجه: في حالة عدم وضع العينة مع وضع جانب اللحاء لأسفل (لا يكون اتجاه لحاء اللب من اليسار إلى اليمين) ، قم بتغيير الاتجاه عن طريق قلب النوى. تطلب الوظيفة مجلدا وستنشئ مجلدا جديدا.
- نوى الغراء: قم بخياطة أجزاء كبيرة من النوى الفردية معا تقريبا. الفكرة ليست في الخياطة بشكل مثالي ، ولكن للتأكد من أن النوى الفردية ، إذا لزم الأمر ، موجودة في نفس حجم TIFF متعدد الصفحات. استخدم مؤشر النواة المكسورة (انظر الخطوة 4.3.4.9) للتغلب على المسافات بين القطع الأساسية.
- المحول: إذا تم التلاعب بوحدات التخزين في حزمة برامج أخرى وتم حفظها خارج صندوق الأدوات (على سبيل المثال ، ImageJ) ، فقم بتنفيذ هذه الخطوة للحصول على معلومات الرأس الصحيحة. استخدم هذه الخطوة لوحدات تخزين TIFF متعددة الصفحات 16 بت القادمة من ماسح ضوئي آخر للتصوير المقطعي المحوسب أيضا ولاستخدام مربع أدوات RingIndicator.
ملاحظة: جميع الخطوات من هنا مخصصة لتصحيحات اتجاه الهيكل وأخيرا قياس الكثافة وتحليل حلقة الشجرة.
- تصحيح الإمالة الأساسية (لحامل العينة 1 فقط): للتصحيح التلقائي للإمالة الأساسية (على سبيل المثال، عندما يميل القلب قليلا في الأسطوانة؛ الشكل 7 أ). هذا مهم للخطوات اللاحقة. حدد المجلد المستخرج الذي تم إنشاؤه في الخطوة السابقة.
- تحضير الاستخراج الأساسي: قم بإعداد الاستخراج الآلي لنوى الزيادة (اعتمادا على المقياس بين الحلقات الشكل 6 أ أو الشكل 6 ب) كما هو موضح أدناه.
- تصحيح الزوايا والإشارة إلى الحلقات في RingIndicator.
ملاحظة: يجب اتخاذ الخطوات التالية ترتيبا زمنيا في وحدة RingIndicator: (i) تصور المستوى المستعرض والشعاعي ، (ii) تصحيح الهيكل ، (iii) إنشاء ملف تعريف الكثافة ، و (iv) الإشارة إلى الحلقات يدويا أو شبه تلقائي.- قم بإجراء تصور للمستوى المستعرض والشعاعي كما هو موضح أدناه.
- للتعرف على واجهة المستخدم الرسومية ، افتح صندوق الأدوات وحدد ملف TIFF متعدد الصفحات (ملف تم إنشاؤه بعد الاستخراج وبعد تصحيح tg ، لذلك من اسم المجلد Tg تصحيح).
- حدد صورة نصف سمك الشريحة لعرض صورة متوسطة لشرائح X المركزية، مع نطاق X من 1-10 مع كون 1 بدون متوسط (أي عرض الشريحة المركزية فقط)، و10 هي صورة متوسطة للشرائح المركزية العشرة.
ملاحظة: يمكن أن يكون المتوسط مفيدا لتسليط الضوء على حدود الحلقة بشكل أفضل ، وقمع الضوضاء ، من ناحية أخرى ، يمكن أن يجعل حدود الحلقة تبدو أقل وضوحا ، خاصة عندما تكون زاوية الألياف كبيرة. يرجى ضبط هذه القيمة وفقا للاحتياجات. من المهم الإشارة إلى أن هذا هو فقط للعرض ، ولا يؤثر على الحجم الأساسي ، ولا يؤثر على الحسابات / النتائج النهائية. - افحص واجهة المستخدم الرسومية (GUI). تحتوي واجهة المستخدم الرسومية على شكل علوي مع المستوى المستعرض للنواة وشكل سفلي مع المستوى الشعاعي للنواة ، وقائمة (الشكل 8).
- لتحميل وحدة تخزين أساسية جديدة، ابحث عن الدالة Volume > Load Volume لتحديد ملف TIFF جديد متعدد الصفحات في الدليل. الآن المستخدم جاهز للإشارة إلى اتجاه الهيكل للإشارة لاحقا إلى حلقات الشجرة الفعلية.
- تصحيح الهيكل لتسهيل مؤشرات حلقة الشجرة التلقائية.
- انقر يدويا على الصورة لإدراج أشرطة خضراء لتصحيح الهيكل. ابدأ باللب (أو أقدم حلقة متاحة) وانتهي بأحدث حلقة. على طول اللب الصحيح للانحرافات الهيكلية على كل من المستوى المستعرض والشعاعي.
- تأكد من الإشارة إلى زاوية الحلقة والألياف بشكل صحيح ، لأن جميع المؤشرات اللاحقة ستأخذ زاوية محرف بين المؤشرات المعنية.
- أدخل شريطا أخضر على مستوى واحد ، وسيقوم تلقائيا بإنشاء شريط على المستوى الآخر. بعد إدخال الشريط ، حرك العقد (المربعات البيضاء) في نهاية الشريط لتغيير الزاوية. استخدم العقدة الوسطى لتغيير موضع الشريط. اضبط حجم العقد لسهولة الاستخدام.
- بعد كل خطوة ، تأكد من الضغط على Data > Export و Rings > Export Rings ، للتأكد من كتابة مؤشرات الحلقة والألياف إلى ملفات .txt المناسبة. خلال جميع التصحيحات ، تأكد دائما من تنفيذ هذين الإجراءين.
- حساب ملف تعريف الكثافة.
- استخدم مخطط قياس الكثافة > قياس الكثافة لحساب ملف تعريف الكثافة. قم بإنشاء ملف تخصيص كثافة ورسمه عن طريق تحديد رسم التراكب > ملف تعريف كثافة الرسم، والذي يمكن أن يكون بمثابة تراكب على المستويات الأساسية.
- لحساب MXD ، حدد نسبة مئوية (يوصى بها هي 20٪ ، على سبيل المثال ، 20٪ تعني أنه يتم تضمين 20٪ فقط من قيم الكثافة الأعلى) ، لاستبعاد القيم الأقل من قنوات الراتنج ، الأخشاب المبكرة وما إلى ذلك. بالنسبة لقيم الكثافة المتوسطة ، استخدم 100٪. للحد الأدنى من الكثافة أيضا استخدام 100 ٪.
- قم بإجراء إشارة يدوية و / أو تلقائية لحدود الحلقة باستخدام نقرة واحدة بالماوس الأيسر لكل حلقة كما هو موضح أدناه.
ملاحظة: أدخل نفس الأشرطة الخضراء كما في الخطوة 4.3.2.1 ، هذه المرة يجب على المستخدم القيام بذلك الآن رنين لكل حلقة (الشكل 9).- استخدم رسم التراكب > ملف تخصيص كثافة الرسم، لتصور ملف تخصيص الكثافة على الصورة. من الأفضل الإشارة إلى حدود الحلقة أيضا بالتزامن مع هذا الملف الشخصي.
ملاحظة: افتح العديد من المثيلات من مربعات الأدوات حسب الحاجة، بالاقتران مع مربع أدوات CoreCompare (انظر المزيد). - للحصول على مؤشرات تلقائية (موصى به للصنوبريات على سبيل المثال) ، استخدم اكتشاف Auto > Max / Min / Inflection . ستشير هذه الوظيفة تلقائيا إلى حدود حلقة الشجرة بناء على ملف تعريف قياس الكثافة الذي تم إنشاؤه في الخطوة السابقة. للمؤشرات التلقائية (يعمل بشكل أفضل مع الصنوبريات الشمالية أو الأنواع ذات حدود الحلقة الواضحة المحددة بواسطة ملف تعريف الكثافة)، استخدم اكتشاف > تلقائي للحد/الحد الأقصى/الحد الأدنى/الانعطاف . ستشير هذه الوظيفة تلقائيا إلى حدود حلقة الشجرة بناء على ملف تعريف قياس الكثافة الذي تم إنشاؤه في الخطوة السابقة.
- اعتمادا على الأنواع (منتشرة - مسامية / حلقة مسامية أو صنوبرية) ، استخدم الحد الأقصى / الحد الأدنى ، أو انعطاف المنحنى (مباشرة بعد ذروة الكثافة) كمعيار حدود حلقة الشجرة. المعلمة الأولى هي عتبة لوظيفة الذروة ، والثانية هي وظيفة أكثر سلاسة.
- بعد إجراء مؤشرات الحلقة الآلية ، قم بإجراء التبديل التلقائي (بحجم نافذة 1 بكسل والتكرارات المحددة من قبل المستخدم) ، مع التأكد من عدم رسم أي مؤشرات حلقة على بعضها البعض بسبب هذا التحول وإعادة تشغيل مخطط قياس الكثافة.
- قم بتغيير تاريخ القطع إلى السنة التي تم فيها أخذ نوى الزيادة على الأشجار الحية أو أي تاريخ آخر مناسب. يتم تعيين الإعداد الافتراضي على 1900.
- في رسم التراكب، حدد حلقات الرسم وسيتم عرض السنوات. حدد أيضا المستوى الذي تريد رسم الحلقات عليه و/أو ملف تعريف الكثافة.
- بمجرد وجود نواتين محددتين بالكامل (على سبيل المثال من نفس الشجرة) ، قم بإجراء مقارنات زوجية لمنحنيات عرض الحلقة الأساسية عن طريق فتح صندوق أدوات CoreComparison. افتح مثيل RingIndicator واحد لكل نواة وقم بتحرير المؤشرات إذا لزم الأمر. قم بتصديرها مرة أخرى واستخرج هذا النهج التكراري والتفاعلي للحصول على بيانات عالية الجودة. في الخطوة التالية (الخطوة 4.4.1.) ، قم بذلك لجميع النوى لتصدير كل من بيانات TRW وقيم الكثافة المقابلة.
- تحقق من مواضع الحلقة المزدوجة في الحلقات > تحقق من الحلقات الخيار. سيتحقق هذا مما إذا كانت أي مؤشرات لها موضع خارج الصور بالإضافة إلى حلقات متداخلة ، على سبيل المثال ، في حالة حدوث نقرة مزدوجة مرتين على نفس الموضع.
- بالنسبة للنوى المكسورة التي تحتوي على أجزاء وقطع ، ابدأ من اللب ، وحدد الحالات الشاذة (الهواء بسبب النوى المكسورة ، والبقع المضيئة بسبب جيوب الراتنج ، والتلوث ، والأجزاء المتحللة) كما لو كانت حلقات لحذفها بعد ذلك. قم بإنهاء حدود حلقة الشجرة لآخر حلقة مشكلة وقم بتصدير البيانات. حاول تجنب كسر النوى أثناء أخذ العينات (انظر الخطوة 1.1. و39).
ملاحظة: يمكن الإشارة إلى كل من الحلقات المفقودة والمكسورة ، انظر الشكل 10. يتم تعريف حالتين ، واحدة حيث ينكسر القلب في منتصف الحلقة ، والأخرى حيث ينكسر القلب على حدود الحلقة. بالنسبة للأول (الشكل 10 أ) ، أشر إلى الفجوة ، ولاحظ رقم تلك الفجوة متبوعا بالرقم 1 وأغلق الأقواس. ثم سيقوم البرنامج بجمع جزأين من الحلقة للحصول على قيمة TRW الصحيحة. في الحالة الثانية ، يشار إلى رقم الفجوة متبوعا بالرقم 2 ، وسيقوم البرنامج بحذف هذا القسم (الشكل 10B). - من خلال الإشارة إلى الحلقات وتوليد ملفات تعريف الكثافة ، يتم إنشاء العديد من ملفات .txt وتخزينها في نفس المجلد مثل ملفات TIFF متعددة الصفحات ، ويتم سرد أهمها في الجدول 1. احتفظ بملفات .txt هذه في نفس المجلد مثل صور TIFF ، من أجل معالجتها بشكل أكبر في وحدة CoreCompare (الخطوة 5.4).
ملاحظة: لحساب قيم الكثافة بطريقة مختلفة استنادا إلى ملف تعريف الكثافة الخام (على سبيل المثال عرض الخشب المتأخر مقابل عرض الخشب المبكر45 أو مقاييس أخرى غير مدعومة بواسطة مربعات أدوات CoreCompare و CoreProcessor) ، استخدم zpos_corr والملفات النصية density_corr واستخدمها لمثل هذه الحسابات.
- استخدم رسم التراكب > ملف تخصيص كثافة الرسم، لتصور ملف تخصيص الكثافة على الصورة. من الأفضل الإشارة إلى حدود الحلقة أيضا بالتزامن مع هذا الملف الشخصي.
- قم بإجراء تصور للمستوى المستعرض والشعاعي كما هو موضح أدناه.
- لمقارنة سلسلة TRW وتصدير البيانات عبر CoreCompare ، اتبع الخطوات أدناه.
ملاحظة: عند استخدام مربع الأدوات هذا، يتم فتح نافذتين في وقت واحد، CoreCompare والوحدة النمطية PatternMatching. تتعامل CoreCompare مع التأريخ المتقاطع وتصدير بيانات TRW ، في حين يمكن استخدام وحدة PatternMatching لتصدير ملفات تعريف الكثافة وقيم الكثافة (MXD ، والحد الأدنى للكثافة (MND) ، ومتوسط الكثافة ، و 4 قيم ربعية). الهدف الرئيسي من CoreComparison هو إنشاء قيم TRW وقيم الكثافة ، والحصول على تقدير تقريبي لجودة التأريخ المتقاطع ، مع اقتران RindIndicator في حالة وجود حلقات مفقودة أو مؤشرات خاطئة.- قم بتنفيذ الخطوات التالية للتأريخ المتقاطع أو مطابقة نمط عرض الحلقة مع سلسلة أخرى.
- بمجرد اكتمال قسم RingIndicator ، حدد الملفات النصية للمقارنة ، وستفتح شاشة بعرض الحلقة ، جنبا إلى جنب مع التأريخ المتقاطع أو المعلمات الإحصائية مثل Gleichlaüfigkeit (GLK) 46 و / أو ارتباط سبيرمان بين السلسلة الفردية (الشكل 11).
- لإجراء تغييرات في مؤشرات الحلقة (على سبيل المثال أثناء المواعدة المتقاطعة) ، أعد فتح RingIndicator ، واستورد البيانات ، وقم بتصدير البيانات والحلقات المعدلة ، واستخدم زر التحديث في وحدة CoreComparison (انظر أعلى الجانب الأيسر) لرؤية التغييرات.
- افتح مثيلات RingIndicator متعددة لإجراء تغييرات على سلسلة حلقات شجرة مختلفة واستخدم شاشات عرض متعددة للقيام بذلك.
- في قائمة GLK و CORR (الشكل 11) ، قم بتنفيذ سلسلة من الإجراءات المتعلقة ب GLK ، مثل تحديد عتبة الأرقام وتصدير قيم GLK إلى جدول بيانات وترتيبها.
- احصل على قيم TRW من CoreCompare كما هو موضح أدناه.
- استخدم دالة التخطيط والتصدير في CoreCompare لتغيير الإزاحة بين المنحنيات (تؤدي القيمة الأكبر إلى إزاحة أصغر). تصور بيانات TRW في مخطط عن طريق تحديد رسم وتصدير عرض الحلقة >.
- قم بتصدير بيانات TRW بالنقر فوق التخطيط والتصدير > تصدير بيانات RW. تصدير عرض الحلقة بتنسيق جدول بيانات أو بتنسيق Tucson.
- احصل على ملفات تعريف الكثافة من الوحدة النمطية PatternMatching كما هو موضح أدناه.
- للحصول على ملفات تعريف الكثافة في جدول البيانات ، انتقل إلى وحدة PatternMatching ، وبعد التحميل في ملفات التعريف ، في القائمة أخرى حدد التخطيط > تصدير ملفات تعريف الكثافة المصححة.
- لتجميع ملفات تعريف العمليات أو لتقييم البيانات باستخدام طرق مختلفة، استخدم ملفات .txt مباشرة من الجدول 1 (انظر الخطوة 4.3.4.11).
- احصل على MXD وMND وقيم الكثافة الأخرى من الوحدة النمطية PatternMatching كما هو موضح أدناه.
- للحصول على متوسط الكثافة وبيانات MXD وMND والبيانات الربعية لكل حلقة شجرة، استخدم مخططات أخرى > تصدير البيانات المجمعة. سيتم إنشاء جدول بيانات ويمكن العثور عليه في نفس المجلد مثل ملفات TIFF.
- علامات التبويب في جدول البيانات مفصلة في الجدول 2. قم بتصدير متغيرات حلقة الشجرة هذه إلى Rstudio أو برامج أخرى لمزيد من التحليل.
- قم بتنفيذ الخطوات التالية للتأريخ المتقاطع أو مطابقة نمط عرض الحلقة مع سلسلة أخرى.

الشكل 6. الحصول على قيم كثافة الخشب من القيم الرمادية. تحويل القيم الرمادية للصورة إلى تقديرات كثافة الخشب الفعلية ، من خلال المعايرة باستخدام مادة مرجعية. (أ) حامل العينة 1 ، بدقة 60 ميكرومتر ، يوضح مرجع الهواء والمرجع الأبيض واللب. (ب) حامل العينة، عند 20 ميكرومتر، يظهر الهواء والمرجع واللب أيضا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7. خطوات المعالجة المسبقة لوحدة التخزين الأساسية 3D. خطوات المعالجة المسبقة لحجم 3D الأساسي قبل التصور والإشارة إلى حلقات الشجرة. (أ) تصحيح الإمالة (المحوري)، (ب) التصحيح العرضي، مع الأشرطة الرمادية التي تشير إلى اتجاه الألياف، (ج) اقتصاص حجم القلب للحصول على حجم يحتوي على فوكسل خشبي فقط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8. لقطة شاشة لنواة. لقطة شاشة لنواة (عرض عرضي حوالي 3 مم ، دقة ميكرومتر) مفتوحة في صندوق أدوات RingIndicator. الجزء العلوي هو العرض المستعرض ، والجزء السفلي هو العرض الشعاعي. تظهر الأشرطة الخضراء مؤشر الهيكل (في هذه الحالة على حدود الحلقة) ، والخط الأحمر هو ملف تعريف الكثافة. تشير الأرقام الصفراء إلى السنة التقويمية ، والأرقام الزرقاء إلى رقم الحلقة العام (العد من المؤشر الأول). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
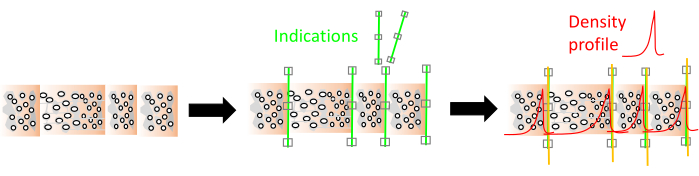
الشكل 9. مؤشر الحلقة وتصور ملف تعريف الكثافة في وحدة RingIndicator. الخطوط الخضراء هي مؤشرات ، والخط الأحمر هو ملف تعريف كثافة الخشب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
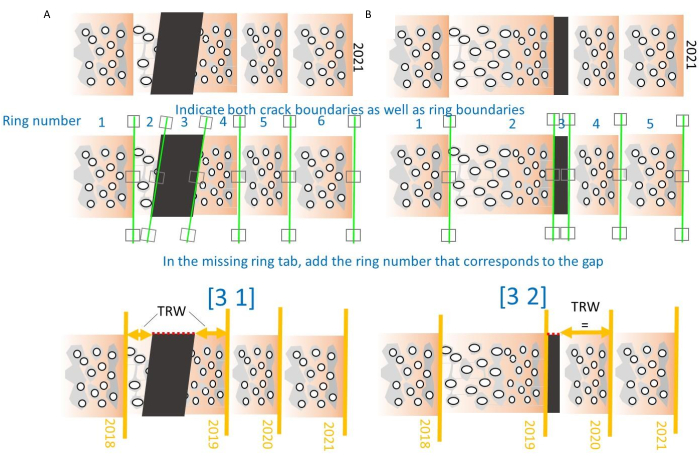
الشكل 10. كيفية التعامل مع الشقوق في النوى. (أ) عند حدوث صدع في منتصف الحلقة ، سيتم تسمية رقم الحلقة العام (بدءا من اللب) على أنه فجوة ، وسيتم حساب TRW عن طريق جمع عرض جزأين من الحلقة. المعلمات هي 3 (عدد الحلقة) و 1 (الحالة 1: الكراك في منتصف الحلقة)31. (ب) عند حدوث صدع عند حدود الحلقة ، سيتم حذف الفجوة من حساب TRW. المعلمات هي 3 (عدد الحلقة) و 2 (الحالة 2: الكراك عند حدود الحلقة)31. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
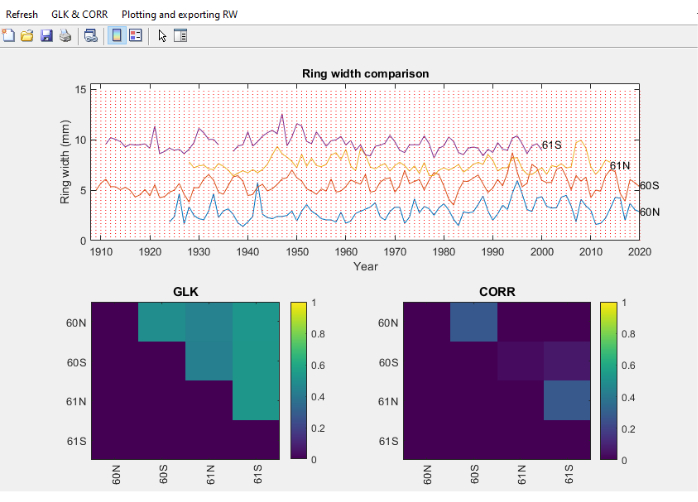
الشكل 11. لقطة شاشة لوحدة المقارنة الأساسية. لقطة شاشة لوحدة المقارنة الأساسية ، حيث يتم توزيع سلسلة عرض الحلقة عموديا لسهولة المقارنة البصرية. يظهر الجزء العلوي عرض الحلقة ل 4 نوى من Fagus sylvatica ، ويظهر الجزء السفلي الأيسر Gleichlaüfigkeit (GLK) والجزء الأيمن السفلي معامل ارتباط سبيرمان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم الملف | تفسير | ||
| SAMPLENAME_density.txt | قيم الكثافة غير المصححة لطول الصورة بالكامل، وبالتالي لا يتم تصحيحها لزاوية الحلقة والألياف | ||
| اسم العينة _density_corr.txt | راجع txt السابق ولكن بعد ذلك مع قيم الكثافة المصححة | ||
| اسم العينة _ring-and-fibre.txt | مواضع وزوايا مؤشر الحلقة والألياف | ||
| اسم العينة _zpos.txt | موضع حدود حلقة الشجرة على قلبك ، دون تصحيح الحلقة والألياف | ||
| اسم العينة _zpos.corr.txt | IDEM ك ZPOS ، ولكن بعد ذلك تم تصحيحه لزاوية الحلقة والألياف | ||
| اسم العينة _ringwidth.txt | عرض الحلقة المحسوب ، مع مراعاة زاوية الحلقة والألياف | ||
الجدول 1. الملفات النصية التي تم إنشاؤها بواسطة RingIndicator. قائمة الملفات النصية التي يتم إنشاؤها بعد الإشارة إلى الحلقات وتصدير ملف تعريف الكثافة في RingIndicator. يجب أن تظل هذه في نفس المجلد مثل ملف .tiff حتى يتم فتحها في وحدة CoreCompare النمطية.
| متغير حلقة الشجرة | تفسير | ||
| متوسط الكثافة | متوسط الكثافة لكل حلقة شجرة | ||
| أقصى كثافة نصف قائمة | MXD ولكن فقط بناء على النصف الثاني من حلقة الشجرة لتجنب عدم تضمين قيم الكثافة العالية للعام السابق | ||
| الحد الأدنى للكثافة | الحد الأدنى للكثافة لكل حلقة شجرة | ||
| Q1-Q4 | القيم المتوسطة والقصوى لكل ربع من ملف تعريف الحلقة خلال السنة | ||
الجدول 2. تفاصيل جدول البيانات. متغيرات حلقة الشجرة التي يتم تصديرها إلى جدول بيانات باسم تصدير البيانات متفاوتة المسافات.
Access restricted. Please log in or start a trial to view this content.
النتائج
إذا كان الهدف هو تقدير الكتلة الحيوية أو زيادة نمو الأشجار للعديد من العينات ، أي مقياس بين الحلقات (الشكل 1) ، استخدام حامل العينة 1 (الشكل 5) لمسح العينات للحصول على ملفات تعريف الكثافة (انظر الخطوة 5.4.3) وتقديرات نمو الأشجار ، على سبيل المثال ، للأشجار سريعة ا...
Access restricted. Please log in or start a trial to view this content.
Discussion
الخطوات الحاسمة داخل البروتوكول
تتضمن الخطوات الحاسمة داخل البروتوكول المعالجة المناسبة لحفار الزيادة للحصول على نوى زيادة عالية الجودة (الخطوة 1.1. وانظر39) لتجنب القطع والقطع. بعد ذلك ، من الضروري ترك النوى غير مثبتة (ولكن انظر26) ، سواء لإدخالها في حامل العينة (<...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
نشكر المراجعين الثلاثة المجهولين على ملاحظاتهم واقتراحاتهم. تم تمويل هذا البحث من قبل صندوق البحوث الخاص BOF ل JVdB (BOF Start Grant BOF. STG.2018.0007.01)، للتكنولوجيا التي ينتجها المستخدمون كمركز للخبرة (BOF. EXP.2017.0007) وكمرفق أساسي (BOF. COR.2022.008) ، يعترف المؤلفون أيضا بمؤسسة الأبحاث فلاندرز (G019521N و G009720N) ، وصندوق UGent للبحوث الصناعية (IOF) للدعم المالي للبنية التحتية من خلال منحة IOF. APP.2021.0005 (مشروع FaCT F2021/IOF-Equip/021).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 6 mm paper straws | http://artstraws.com/education/product/artstraws-thick-asst-cols/ | Coring | |
| Aluminium core holders | |||
| ASTM standard ASTM D 1107 – 96 | |||
| Cardboard postal tubes | https://www.rajapack.co.uk/envelopes-mailing-bags/postal-tubes/1-5-2mm-brown-cardboard-postal-tubes_PDT05623.html | ||
| Column drill | |||
| Computer hardware for reconstruction and analysis | X-ray CT scanning | ||
| Cooling | |||
| Drying oven | |||
| Ethanol | |||
| Flask for under soxhlet (2000 ml) | |||
| Floral foam | https://www.oasisfloral.eu/ | Sample holder type 1 | |
| Glass beads to fill void volume of Soxhlet to save solvent | |||
| Glue | |||
| Hot water bath | https://www.memmert.com/products/water-baths/water-bath/#!filters=%7B%7D | Soxhlet extraction | |
| Increment borer | https://haglofsweden.com/project/increment-borers/ | ||
| Plastic cylinder | Moonen et al. 2022 | Sample holder type 2 | |
| Plastic cylinders | |||
| Reservoir | |||
| Tailored soxhlet apparatus | |||
| Toluene | |||
| Water pump | |||
| X-ray CT scanner |
References
- Björklund, J., et al. The utility of bulk wood density for tree-ring research. Dendrochronologia. 69 (September), 125880(2021).
- Lachenbruch, B., Mcculloh, K. A. Traits, properties, and performance: How woody plants combine hydraulic and mechanical functions in a cell, tissue, or whole plant. New Phytologist. 204 (4), 747-764 (2014).
- Baker, T. R., et al. Variation in wood density determines spatial patterns in Amazonian forest biomass. Global Change Biology. 10 (5), 545-562 (2004).
- Bastin, J. F., et al. Wood specific gravity variations and biomass of central African tree species: The simple choice of the outer wood. PLoS ONE. 10 (11), 1-16 (2015).
- Chave, J., et al. Improved allometric models to estimate the aboveground biomass of tropical trees. Global Change Biology. 20 (10), 3177-3190 (2014).
- Chave, J., et al. Towards a worldwide wood economics spectrum. Ecology letters. 12, 351-366 (2009).
- Plourde, B. T., Boukili, V. K., Chazdon, R. L. Radial changes in wood specific gravity of tropical trees: inter- and intraspecific variation during secondary succession. Functional Ecology. 29 (1), 111-120 (2015).
- Decoux, V., Varcin, É, Leban, J. -M. Relationships between the intra-ring wood density assessed by X-ray densitometry and optical anatomical measurements in conifers. Consequences for the cell wall apparent density determination. Annals of Forest Science. 61, 251-262 (2004).
- Rathgeber, C. B. K., Decoux, V., Leban, J. M. Linking intra-tree-ring wood density variations and tracheid anatomical characteristics in Douglas fir (Pseudotsuga menziesii (Mirb.) Franco). Annals of Forest Science. 63 (7), 699-706 (2006).
- Ziemińska, K., Butler, D. W., Gleason, S. M., Wright, I. J., Westoby, M. Fibre wall and lumen fractions drive wood density variation across 24 Australian angiosperms. AoB PLANTS. 5, plt046(2013).
- Ziemińska, K., Westoby, M., Wright, I. J. Broad anatomical variation within a narrow wood density range - A study of twig wood across 69 Australian angiosperms. PLoS ONE. 10 (4), 1-25 (2015).
- De Mil, T., et al. Wood density profiles and their corresponding tissue fractions in tropical angiosperm trees. Forests. 9 (12), 763(2018).
- Björklund, J., et al. Scientific Merits and Analytical Challenges of Tree-Ring Densitometry. Reviews of Geophysics. 57 (4), 1224-1264 (2019).
- Maniatis, D., Saint André, L., Temmerman, M., Malhi, Y., Beeckman, H. The potential of using xylarium wood samples for wood density calculations: A comparison of approaches for volume measurement. IForest. 4 (1), 150-159 (2011).
- Lehnebach, R., et al. Wood density variations of legume trees in French Guiana along the shade tolerance continuum: Heartwood effects on radial patterns and gradients. Forests. 10 (2), 1-22 (2019).
- Longuetaud, F., et al. Within-stem maps of wood density and water content for characterization of species: a case study on three hardwood and two softwood species. Annals of Forest Science. 73 (3), 601-614 (2016).
- Steffenrem, A., Kvaalen, H., Dalen, K. S., Høibø, O. A. A high-throughput X-ray-based method for measurements of relative wood density from unprepared increment cores from Picea abies. Scandinavian Journal of Forest Research. 29 (5), 506-514 (2014).
- Vannoppen, A., et al. Dendrochronologia Using X-ray CT based tree-ring width data for tree growth trend analysis. Dendrochronologia. 44, 66-75 (2017).
- Maes, S. L., et al. Evaluating the robustness of three ring-width measurement methods for growth release reconstruction. Dendrochronologia. 46 (May), 67-76 (2017).
- Van Den Berge, S., et al. Biomass increment and carbon sequestration in hedgerow-grown trees. Dendrochronologia. 70 (September), 125894(2021).
- De Mil, T., Vannoppen, A., Beeckman, H., Van Acker, J., Van den Bulcke, J. A field-to-desktop toolchain for X-ray CT densitometry enables tree ring analysis. Annals of Botany. 117 (7), 1187-1196 (2016).
- St. George, S., Esper, J. Concord and discord among Northern Hemisphere paleotemperature reconstructions from tree rings. Quaternary Science Reviews. 203, 278-281 (2018).
- Schweingruber, F., Fritts, H., Braker, O., Drew, L., Schar, E. The X-ray technique as applied to dendroclimatology. Tree-Ring Bulletin. 38, 61-91 (1978).
- Björklund, J., et al. Cell size and wall dimensions drive distinct variability of earlywood and latewood density in Northern Hemisphere conifers. New Phytologist. 216 (3), 728-740 (2017).
- Polge, H. Applications dans les domaines Technologique et Physiologique. Annales des sciences forestières. 23 (1), 215(1966).
- De Mil, T., et al. A lonely dot on the map: Exploring the climate signal in tree-ring density and stable isotopes of clanwilliam cedar, South Africa. Dendrochronologia. 69 (November 2020), 125879(2021).
- Jansen, S., et al. Preparation of wood specimens for transmitted light microscopy and scanning electron microscopy. Belgian Journal of Botany. 131 (1), 41-49 (1998).
- Gärtner, H., Nievergelt, D. The core-microtome: A new tool for surface preparation on cores and time series analysis of varying cell parameters. Dendrochronologia. 28 (2), 85-92 (2010).
- von Arx, G., Crivellaro, A., Prendin, A. L., Čufar, K., Carrer, M. Quantitative Wood Anatomy-Practical Guidelines. Frontiers in Plant Science. 7 (June), 781(2016).
- Seftigen, K., et al. Prospects for dendroanatomy in paleoclimatology -- a case study on Picea engelmannii from the Canadian Rockies. Climate of the Past. 18 (5), 1151-1168 (2022).
- Castagneri, D., Regev, L., Boaretto, E., Carrer, M. Xylem anatomical traits reveal different strategies of two Mediterranean oaks to cope with drought and warming. Environmental and Experimental Botany. 133 (October), 128-138 (2017).
- Brodersen, C. R., et al. Automated analysis of three-dimensional xylem networks using high-resolution computed tomography. The New phytologist. 191 (4), 1168-1179 (2011).
- Van den Bulcke, J., et al. X-ray tomography as a tool for detailed anatomical analysis. Annals of Forest Science. 66 (5), 508(2009).
- Williamson, G. B., Wiemann, M. C. Measuring wood specific gravity...Correctly. American journal of botany. 97 (3), 519-524 (2010).
- Masschaele, B., et al. HECTOR: A 240kV micro-CT setup optimized for research. Journal of Physics: Conference Series. 463 (1), 012012(2013).
- Kak, A. C., Slaney, M. Principles of Computerized Tomographic Imaging. , Society for Industrial and Applied Mathematics. (2001).
- Van Den Bulcke, J., et al. Advanced X-ray CT scanning can boost tree ring research for earth system sciences. Annals of Botany. 124 (5), 837-847 (2019).
- Zwanenburg, E. A., Williams, M. A., Warnett, J. M. Review of high-speed imaging with lab-based x-ray computed tomography. Measurement Science and Technology. 33 (1), 012003(2022).
- Gärtner, H., Cherubini, P., Schneider, L., Lucchinetti, S. Advanced Workflow for Taking High-Quality Increment Cores - New Techniques and Devices. JoVE. (193), e64747(2023).
- Schweingruber, F. H., Fritts, H. C., Bräker, O. U. The X-ray technique as applied to dendroclimatology. Tree-Ring Bulletin. 38, (1978).
- Grabner, M., Wimmer, R., Gierlinger, N., Evans, R., Downes, G. M. Heartwood extractives in larch and effects on X-ray densitometry. Canadian Journal of Forest Research. 35 (12), 2781-2786 (2005).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Arganda-Carreras, I., et al. Trainable Weka Segmentation: A machine learning tool for microscopy pixel classification. Bioinformatics. 33 (15), 2424-2426 (2017).
- von Arx, G., Carrer, M. ROXAS - A new tool to build centuries-long tracheid-lumen chronologies in conifers. Dendrochronologia. 32 (3), 290-293 (2014).
- Koubaa, A., Zhang, S. Y. T., Makni, S. Defining the transition from earlywood to latewood in black spruce based on intra-ring wood density profiles from X-ray densitometry. Annals of Forest Science. 59 (5-6), 511-518 (2002).
- Buras, A., Wilmking, M. Correcting the calculation of Gleichläufigkeit. Dendrochronologia. 34, 29-30 (2015).
- Bunn, A. G. Statistical and visual crossdating in R using the dplR library. Dendrochronologia. 28 (4), 251-258 (2010).
- Zang, C., Biondi, F. Treeclim: an R package for the numerical calibration of proxy-climate relationships. Ecography. (November 2014), 1-6 (2014).
- Van den Bulcke, J., et al. Nondestructive research on wooden musical instruments: From macro- to microscale imaging with lab-based X-ray CT systems. Journal of Cultural Heritage. 27, S78-S87 (2017).
- Helama, S., Vartiainen, M., Kolström, T., Meriläinen, J. Dendrochronological investigation of wood extractives. Wood Science and Technology. 44 (2), 335-351 (2010).
- Black, B. A., et al. The value of crossdating to retain high-frequency variability, climate signals, and extreme events in environmental proxies. Global Change Biology. 22 (7), 2582-2595 (2016).
- Hubau, W., et al. The persistence of carbon in the African forest understory. Nature plants. 5 (2), 133-140 (2019).
- Stoffel, M., Klinkmüller, M. 3D analysis of anatomical reactions in conifers after mechanical wounding: First qualitative insights from X-ray computed tomography. Trees - Structure and Function. 27 (6), 1805-1811 (2013).
- Van den Bulcke, J., et al. Advanced X-ray CT scanning can boost tree-ring research for earth-system sciences. Annals of Botany. , 1-11 (2019).
- Ziaco, E., Biondi, F., Heinrich, I. Wood Cellular Dendroclimatology: Testing New Proxies in Great Basin Bristlecone Pine. Frontiers in Plant Science. 7 (October), 1-13 (2016).
- De Ridder, M., et al. High-resolution proxies for wood density variations in Terminalia superba. Annals of botany. 107 (2), 293-302 (2011).
- Resente, G., et al. Repeat! Artificial Intelligence for Quantitative Wood Anatomy. Frontiers in Plant Science. 12 (November), 1-14 (2021).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved