زراعة 3D من المواد العضوية من خبايا الفئران المعوية وخلية جذعية واحدة للبحوث العضوية
In This Article
Summary
وصفنا بروتوكولا لعزل خبايا الفئران المعوية الصغيرة والثقافة العضوية المعوية 3D من الخبايا. بالإضافة إلى ذلك ، وصفنا طريقة لتوليد المواد العضوية من خلية جذعية معوية واحدة في حالة عدم وجود مكانة خلوية شبه ظهارية.
Abstract
في الوقت الحاضر ، تمثل الثقافة العضوية أداة مهمة للدراسات في المختبر لمختلف الجوانب البيولوجية والأمراض في الأعضاء المختلفة. خبايا الفئران المعوية الصغيرة يمكن أن تشكل المواد العضوية التي تحاكي ظهارة الأمعاء عند استزراعها في مصفوفة 3D خارج الخلية. تتكون الكائنات العضوية من جميع أنواع الخلايا التي تؤدي وظائف استتباب الأمعاء المختلفة. وتشمل هذه الخلايا بانيث ، وخلايا الغدد الصماء المعوية ، والخلايا المعوية ، والخلايا الكأسية ، وخلايا الخصل. تضاف جزيئات جيدة التوصيف إلى وسط الاستزراع لإثراء الخلايا الجذعية المعوية (ISCs) الموسومة بتكرارات غنية بالليوسين تحتوي على مستقبلات مقترنة بالبروتين G 5 وتستخدم لدفع التمايز إلى أسفل سلالات محددة. تشمل هذه الجزيئات عامل نمو البشرة ، Noggin (بروتين مورفوجيني عظمي) ، و R-spondin 1. بالإضافة إلى ذلك ، تم أيضا تفصيل بروتوكول لتوليد المواد العضوية من مستقبلات الخلايا الكبدية B2 (EphB2) الإيجابية للإريثروبويتين. في مقالة الطرق هذه ، يتم وصف تقنيات عزل الخبايا المعوية الدقيقة و ISC واحد من الأنسجة وضمان الإنشاء الفعال للعضويات.
Introduction
ظهرت الكائنات العضوية المعوية ، التي تم تأسيسها لأول مرة في عام 2009 ، كأداة قوية في المختبر لدراسة بيولوجيا الأمعاء نظرا لتشابهها المورفولوجي والوظيفي مع الأنسجة الناضجة. في الآونة الأخيرة ، سمحت التطورات التكنولوجية في الكائنات العضوية المستزرعة المشتقة من الخلايا الجذعية للأنسجة البالغة بزراعة الخلايا الجذعية المعوية (ISCs) على المدى الطويل مع إمكانية التجديد الذاتي والتمايز. تم استخدام هذه الكائنات العضوية على نطاق واسع في الدراسات البحثية الأساسية والانتقالية حول فسيولوجيا الجهاز الهضمي والفيزيولوجيا المرضية1،2،3،4،5،6. توفر المواد العضوية ثلاثية الأبعاد التي طورتها مجموعة Clevers أداة قوية لدراسة ظهارة الأمعاء مع تحسين الأهمية الفسيولوجية7. نظرا لأن الكائنات العضوية المعوية مشتقة من الخلايا الجذعية النسيجية وتتكون من أنواع متعددة من الخلايا ، فإنها تلخص وظائف ظهارة الأمعاء. وتجدر الإشارة إلى أن الخلايا الجذعية ذات التكرارات الغنية بالليوسين المحتوية على بروتين G ذات الفرز الواحد 5 إيجابية (Lgr5 +) يمكن أن تولد أيضا عضويات ثلاثية الأبعاد بدون أي خلايا بانيث أو مكانة ISC مثل المكانة الظهارية أو مكانةاللحمية 7. ومع ذلك ، فإن قدرة تكوين الأعضاء لخلايا Lgr5 + أحادية الفرز منخفضة مقارنة بتلك الموجودة في خلايا crypt و ISC-Paneth8.
أظهر عدد متزايد من الدراسات أن طرق حضانة حمض الإيثيلين ديامينيترايتيك (EDTA) أو تفكك الكولاجين تسبب ارتخاء في الظهارة وإطلاق الخبايا. نظرا لأن التفكك الأنزيمي قد يكون له تأثير على حالة الخلية للخبايا ، فعادة ما تستخدم طريقة العزل الميكانيكي لفصل الأنسجة. على الرغم من أن الهضم الميكانيكي هو تقنية سريعة ، إلا أن هذه الطريقة يمكن أن تترافق مع غلة سرداب غير متسقة أو ضعف صلاحية الخلية9. لذلك ، يمكن الجمع بين معالجة EDTA والتفكك الميكانيكي لتوليد عوائد سرداب أفضل. من سمات المنهجية الموضحة في هذه المقالة استخدام الاهتزاز القوي لشظايا الأنسجة بعد استخلاب EDTA10. يسمح الاهتزاز القوي بالعزل الفعال للخبايا من مجمعات الزغابات في الأمعاء الدقيقة. تحدد درجة الاهتزاز اليدوي الفصل. وبالتالي ، فإن الحصول على الخبايا من المجمعات أمر مهم للمجربين في هذا المجال. بالإضافة إلى ذلك ، يمكن للمهارة المناسبة تقليل تلوث الزغابات إلى الحد الأدنى وزيادة عدد الخبايا.
ومن ثم ، فإن هذا البروتوكول التجريبي ، الذي يستخدم عضويات معوية دقيقة مشتقة من مورين ، يمكن أن يعزل الخبايا بشكل أفضل بالقوة البدنية بعد العلاج ب EDTA للتفكك. من المعروف أن نمط التعبير عن مستقبلات الخلايا الكبدية المنتجة للإريثروبويتين B2 (EphB2) يعكس جزئيا بيئة السرداب. على سبيل المثال ، يتم تنظيم الخلايا الإيجابية EphB2 من أسفل إلى أعلى11. تم إجراء فرز الخلايا المنشط بالفلورة (FACS) بناء على تعبير EphB2 ، وتم تقسيم الخلايا التي تم الحصول عليها إلى أربع مجموعات: EphB2high ، EphB2med ، EphB2low ، و EphB2neg. بعد ذلك ، تم إثبات النمو العضوي من خلاياEphB2 العالية أحادية الفرز في الفئران من النوع البري (WT).
Protocol
تمت الموافقة على جميع تجارب الفئران من قبل لجنة أخلاقيات الحيوان Suntory (APRV000561) ، وتم الحفاظ على جميع الحيوانات وفقا لإرشادات اللجنة لرعاية واستخدام المختبر. تم استخدام سلالة WT القياسية من Mus musculus (C57BL6 / J). تم استخدام كل من الفئران الذكور والإناث من 10 أسابيع إلى 20 أسبوعا من العمر. تم القتل الرحيم للفئران مع اختناق CO2 .
1. عزل الأمعاء الدقيقة
- استئصال الأمعاء الدقيقة ، بما في ذلك الاثني عشر والنصف القريب من الصائم ، بمقص المختبر.
- نقل الأنسجة إلى طبق بتري ، وغسل الأمعاء الدقيقة مع 5 مل من PBS-ABx الباردة (PBS + البنسلين - الستربتومايسين [1 ٪] + جنتاميسين [0.5 ٪]) في حقنة 5 مل لإزالة محتوى اللمعة.
- اقطع المنديل مفتوحا بالطول بمقص المختبر ، واغسله يدويا باستخدام PBS-ABx البارد أثناء الرج.
ملاحظة: عن طريق كشط الزغابات بشريحة ، يمكن تقليل تلوث الزغابات12. - جمع ما يقرب من 5 مم × 5 مم قطع من الجزء المعوي باستخدام مقص المختبر. انقل الشظايا إلى أنبوب سعة 50 مل مع ملاقط ، وأضف 25 مل من PBS-ABx البارد.
- اغسل الشظايا عن طريق التقليب ذهابا وإيابا 10x مع 25 مل من PBS-ABx البارد لإزالة محتويات الأمعاء في أنبوب 50 مل.
2. عزل القبو
- احتضن القطع في PBS-ABx التي تحتوي على 2 مللي متر EDTA لمدة 30 دقيقة على الجليد دون اهتزاز.
- لسهولة تصلب المصفوفة خارج الخلية (ECM) ، احتضن صفيحة 24 بئرا في حاضنة زراعة الأنسجة 37 درجة مئوية مسبقا.
- قم بنضح محلول EDTA من نظام زراعة الخلايا باستخدام مضخة تفريغ ، وأضف 25 مل من PBS-ABx الطازج والبارد ، ثم هز القطع لأعلى ولأسفل بقوة باليد 30x-40x لتحرير مجمعات crypt-villus.
ملاحظة: يمكن فحص الخبايا والزغابات المنفصلة من خلال المراقبة المجهرية لقطرة 25 ميكرولتر من التعليق عند تكبير 4x. - بعد ذلك ، قم بتصفية التعليق من خلال مصفاة 70 ميكرومتر مرة واحدة.
- جهاز طرد مركزي التعليق عند 390 × جم لمدة 3 دقائق عند 4 درجات مئوية.
- أعد تعليق حبيبات القبو في 20 مل من السوربيتول DMEM (DMEM / F12 المتقدم + البنسلين - الستربتومايسين [1٪] + الجنتاميسين [0.5٪] + مصل الأبقار الجنيني [1٪] + السوربيتول [2٪]) مع السحب ، ونقل تعليق القبو إلى أنبوبين جديدين سعة 15 مل للتقسيم إلى محلولين سعة 10 مل لأجهزة الطرد المركزي بسرعة منخفضة.
ملاحظة: يمكن فصل كتلة الخلية الكبيرة والخلايا / الحطام باستخدام الطرد المركزي منخفض السرعة. كتلة الخلية الكبيرة في الحبيبة ، والخلايا / الحطام في المادة الطافية. - قم بطرد مركزي معلقي القبو عند 80 × جم لمدة 3 دقائق عند 4 درجات مئوية ، ثم قم بشفط المادة الطافية برفق.
ملاحظة: نظرا لأن تكوين الحبيبات ضعيف ، فلا تستنشق كثيرا. اترك 2 مل من المادة الطافية في كل أنبوب. - أضف 10 مل من السوربيتول DMEM إلى كل أنبوب مرة أخرى. أجهزة الطرد المركزي التعليق عند 80 × جم لمدة 3 دقائق عند 4 درجات مئوية.
- بعد استنشاق المادة الطافية ، وترك 2 مل من المادة الطافية في كل أنبوب ، أضف 10 مل من السوربيتول DMEM للتعليق ، وطرد مركزي تعليق القبو عند 80 × جم لمدة 3 دقائق أخيرة عند 4 درجات مئوية.
- بعد استنشاق المادة الطافية ، وترك 2 مل من المادة الطافية في كل أنبوب ، أضف 10 مل من DMEM الكامل (DMEM / F12 + البنسلين - الستربتومايسين [1٪] + الجنتاميسين [0.5٪] + مصل الجنين البقري [1٪]) لإعادة تعليق الحبيبات عن طريق السحب لأعلى ولأسفل ، واتركها لمدة دقيقة واحدة.
ملاحظة: انتظر لمدة 1 دقيقة للحصول على الخبايا العائمة بكفاءة. - بعد 1 دقيقة ، اجمع كل تعليق 10 مل ليصبح المجموع 20 مل ، وقم بالتصفية مرة واحدة باستخدام مصفاة خلية 70 ميكرومتر لتنقية الخبايا.
- قبل زرع الخبايا النقية بشكل أساسي ، احسب عدد الخبايا في DMEM الكامل المصفى ، ثم أجهزة الطرد المركزي عند 290 × جم لمدة 3 دقائق عند 4 درجات مئوية.
- قم بتقطير قطرات 25 ميكرولتر في طبق 6 سم في ثلاث نقاط. احسب عدد الخبايا تحت المجهر عند تكبير 4x ، واحسب تركيز الخبايا لكل قطرة 25 ميكرولتر.
- تعليق 100 سرداب مع 40 ميكرولتر من ECM لكل بئر. ماصة صعودا وهبوطا 5x-10x للحصول على تعليق متجانس من الخبايا في ECM ، ثم البذور في لوحة 37 درجة مئوية مسخنة مسبقا 24 بئرا.
ملاحظة: احتفظ دائما بوحدة التحكم الإلكترونية على الجليد لتجنب البلمرة. ماصة بعناية لتجنب صنع فقاعات الهواء في ECM. - احتضان لوحة 24 بئرا لمدة 15 دقيقة في حاضنة 37 درجة مئوية ، 5٪ CO2 لبلمرة ECM.
- أخيرا ، قم بتغطية ECM ب 500 ميكرولتر من وسط الاستزراع الذي يحتوي على عامل نمو بشرة الفأر (EGF) ، والفأر المؤتلف R-spondin 1 ، والفأر المؤتلف Noggin في درجة حرارة الغرفة. التركيز النهائي للمواد لكل بئر هو كما يلي: البنسلين - الستربتومايسين (1٪) ، 50 وحدة / مل لكل منهما ؛ جنتاميسين (0.5٪) ، 25 ميكروغرام / مل ؛ EGF ، 20 نانوغرام / مل ؛ Noggin ، 100 نانوغرام / مل ؛ R-spondin 1،500 نانوغرام/مل؛ L- الجلوتامين ، 2 ملليمول.
- ابدأ زراعة القبو عند 37 درجة مئوية في حاضنة CO2 بنسبة 5٪.
ملاحظة: بالنسبة لوسط الاستزراع للعضويات في صفيحة 24 بئرا، انظر الجدول 1. - قم بإجراء تصوير مباشر طويل المدى لمراقبة التشكل العضوي باستخدام مجهر تسجيل صور الفاصل الزمني المجهز بهدف 20x كل 3 ساعات لمدة تصل إلى 7 أيام. احصل على صور متسلسلة على شكل حرف z بخطوات z تبلغ 1 ميكرومتر (1 ميكرومتر × خمس خطوات).
- تغيير الوسيط كل يوم.
3. فرز الخلايا المنشطة بالتألق (FACS)
- عزل الخبايا من الفئران (انظر القسم 2).
- عالج الخبايا المعزولة ب 2 مل من التربسين لمدة 30 دقيقة عند 37 درجة مئوية.
- أوقف التفاعل باستخدام 10 مل من PBS ، ثم تمر عبر مصفاة خلية 20 ميكرومتر.
- قم بطرد المحلول عند 390 × جم لمدة 3 دقائق عند 4 درجات مئوية ، وأعد تعليقه ب 100 ميكرولتر من DMEM الكامل.
- أضف الجسم المضاد المترافق ل EphB2 APC (1/50) ، واحتضانه لمدة 30 دقيقة على الجليد.
- اغسل الخلايا 3x باستخدام PBS ، وأخيرا أضف 7-amino-actinomycin D (7-AAD) (1/100).
- فرز الخلايا الملطخة عبر FACS.
- اضبط عامل قياس المنطقة ، وقم بالفرز وفقا لحجم الخلية (التشتت الأمامي ، FSC-A) مقابل الدقة (التشتت الجانبي ، SSC-A).
- قم بفرز الخلايا السالبة والموجبة 7-AAD للتأكد من صلاحيتها باستخدام الليزر الذي تم ضبطه بطول موجي يبلغ 488 نانومتر وطاقة 50 مللي فولت.
- قم بترسيم البوابات لفرز خلايا EphB2-high (EphB2 high) و EphB2-medium (EphB2med) و EphB2-low (EphB2 low) و EphB2-negative (EphB2neg) مع ضبط الليزر على طول موجي يبلغ 640 نانومتر وطاقة 100 مللي فولت.
- ابدأ زراعة الخلاياالعالية EphB2 عند 37 درجة مئويةفي حاضنة CO 2 بنسبة 5٪.
4. عضويات مستزرعة أحادية الخلية
- نفذ طريقة عزل الخلايا وفقا لمستويات سطح EphB2 المتدرجة11 ، ثم احصل على أربع مجموعات متميزة (عالية ومتوسطة ومنخفضة وسالبة).
- جمع ، حبيبات مع الطرد المركزي عند 390 × جم لمدة 3 دقائق عند 4 درجات مئوية ، وتضمين الخلاياالعالية EphB2 أحادية الفرز في ECM عن طريق السحب ، متبوعا بالبذر على لوحة 24 بئرا (100 مفردة / 40 ميكرولتر من ECM / بئر).
- كما في الخطوة 2.14 ، اسمح ل ECM بالبلمرة ، وقم بتغطية ECM بوسط استزراع يحتوي على مثبط كيناز مرتبط ب Rho (ROCK) (10 μM) لأول يومين للحفاظ على الخلاياالعالية EphB2.
ملاحظة: مثبط ROCK فعال ضد anoikis. - افحص الخلايا يدويا باستخدام مجهر مقلوب بتكبير 40x ، ولاحظ الكائنات العضوية القابلة للحياة مع تكوين كروي وبروز سرداب.
النتائج
لتوليد عضويات معوية صغيرة للفأر ، يمكن استخدام مزيج من علاج EDTA وطريقة العزل الميكانيكية لعزل الخبايا10,13 بكفاءة. أظهرت نتائج هذه الدراسة أن جميع الخبايا المعزولة تقريبا كانت مغلقة على الفور وظهرت على شكل مخروطي بعد أن تم ضغطها من المنافذ الظهارية (الشكل 1 أ). لتقليل تلوث الزغابات ، تم تمرير التعليق الناتج من خلال مصفاة خلية 70 ميكرومتر ، ثم تم طرد المرشح بالطرد المركزي. نظرا لتعطل بعض الخبايا أثناء الترشيح والتعليق ، يجب تنفيذ هذه الخطوات بعناية. أظهرت النتائج أن جميع الخبايا تقريبا في الكسر الأخير كانت متكاملة ومناسبة للاستخدام في الاستزراع (الشكل 1 ب). لتصور جميع الخبايا المطلية بشكل فردي ، تم طلاء 100 سرداب لكل بئر (الشكل 1C). بعد إضافة وسيط ثقافة سرداب محدد (الشكل 1D) ، تمت مراقبة تطور المواد العضوية باستخدام المجهر يوميا. علاوة على ذلك ، لوحظ نمو عضوي من الخبايا بواسطة صور الفاصل الزمني لمراقبة تطورها (الشكل 1E والفيديو التكميلي S1). تصرفت الخبايا المستزرعة بطريقة نمطية. تم ملء التجويف الداخلي للعضو بكتلة من الخلايا المبرمجة. حدث انتشار وتمايز نشطان ل ISCs في منطقة القبو مع التبرعم (الشكل 1E والفيديو التكميلي S1). اقترن التبرعم بهجرة مركز الدراسات الدولي وانتشاره وتمايز خلايا بانيث. كانت خلايا بانيث المتمايزة موجودة دائما في موقع التبرعم (الشكل التكميلي S1). نظرا لأنه تم التأكد من استقرار الكائنات العضوية في الثقافة باستخدام مجهر مقلوب عند تكبير 10x ، يمكن استخدام التقنية لفحص تكوين القبو في الأمعاء الدقيقة النامية وتحديد القدرة على تجديد الأنسجة والبقاء على قيد الحياة على المدى الطويل لإنتاج خلايا ظهارية معوية جديدة14،15،16.
يتم تعريف Lgr5 على أنه علامة ISC ، وتشكل خلايا الفئران Lgr5 + عضويات ثلاثية الأبعاد7. ومع ذلك ، نظرا لأن وفرة سطح الخلية لبروتين LGR5 منخفضة وهناك نقص في الأجسام المضادة عالية التقارب المضادة ل LGR5 ، فمن الصعب عزل ISCs الفئران بكفاءة بواسطة FACS. تم تحديد EphB2 سابقا كعلامة سطحية لتنقية الفئران و ISCs البشرية من الأنسجة المعوية17,18. يزيد نمط تعبير EphB2 من التعقيد الذي تنطوي عليه علامات ISC. يتم تنظيم الخلايا الإيجابية EphB2 في جميع أنحاء المقصورة التكاثرية ، وتبلغ ذروتها في الجزء السفلي من الخبايا ، بينما تنخفض في التدرج نحو الجزء العلوي من الخبايا11. يتم أيضا ترجمة خلايا بانيث والخلايا السلفية في القبو. تعبر خلايا بانيث بشكل أساسي عن EphB3 ، وهو أمر مطلوب لتحديد موقعها ، وتعبر الخلايا السلفية فوقها في القبو بشكل أساسي عن EphB2. وبالتالي ، يمكن أن يحدث تلوث لكلا النوعين من الخلايا أثناء تنقية ISC باستخدام الجسم المضاد ل EphB2. وبناء على ذلك، ينبغي تقييم التعبير الجيني للعلامات وقدرة الخلايا المعزولة باستخدام EphB2 بواسطة FACS.
بناء على هذه الحقائق ، باستخدام تحليل FACS ، يمكن عزل الخلايا ذات العلامات السطحية EphB2 من خبايا WT19. تم التحقيق فيما إذا كان تعبير EphB2 يمكن أن يميز بين أربع مجموعات مع التعبير عن علامات محددة ، مثل جينات العلامات الخاصة ب ISC (Lgr5 و Ascl2 و Olfm4) وجينات العلامات الخاصة بالخلية السلفية (Ki67 و Myc و FoxM1). أظهرت هذه التجربة أن الخلاياالعالية EphB2 كانت في الغالب ISCs ، على عكس خلايا EphB2med 20,21. أخيرا ، بناء على طريقة عزل الخلايا ، تم تقسيم الخلايا التي تم الحصول عليها إلى أربع مجموعات (EphB2عالية ، EphB2med ، EphB2 منخفضة ، وخلاياEphB2 neg) (الشكل 2). بعد ذلك ، تم استزراع الخلايا المفردة التي تعبر عن مستويات عالية من EphB2 مرتبة بواسطة FACS لنمو العضوي. يمكن تطبيق خليةعالية EphB2 واحدة بشكل مستقل للعلاج الموضعي وإعادة إنشاء هياكل سرداب ذاتية التنظيم تذكرنا بالأمعاء الدقيقة الطبيعية (الشكل 3). ومع ذلك ، فإن الخلايا المشتقة من مجموعات أخرى (EphB2med و EphB2low و EphB2neg) لا تولد عضويات20.
في دراسة سابقة ، ~ 6٪من خلايا Lgr5-GFP hi أحادية الفرز كانت قادرة على بدء عضويات سراديويةزغبية 7. ومع ذلك ، لم تتمكن الخلايا المتبقية من توليد المواد العضوية وماتت خلال أول 12 ساعة7. افترض أصحاب البلاغ أن هذا كان نتيجة الإجهاد البدني و / أو البيولوجي المتأصل في إجراءالعزل 7. كما تم الحصول على أقل من 6٪ من نمو عضوي من خلاياEphB2 عالية الفرز في الفئران WT. بحلول اليوم 5 من الثقافة ، تشكلت هياكل تشبه كروية (الشكل 3). من اليوم 7 إلى اليوم 9 ، حدث هبوب البقع لتشكيل خبايا (الشكل 3). الأهم من ذلك ، أن تطبيق مثبط ROCK المختار على الخلاياالعالية EphB2 أحادية الفرز قلل من موت الخلايا المبرمج الناجم عن التفكك وزاد من كفاءة نمو المواد العضوية.
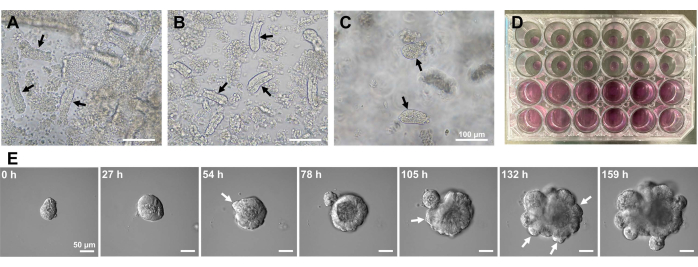
الشكل 1: توليد عضويات معوية صغيرة للفأر. (أ) خبايا محضرة بمزيج من استخلاب EDTA والتفكك الميكانيكي. (ب) الخبايا المنقاة الناتجة. ج: الخبايا المضمنة في المصفوفة خارج الخلية. (أ-ج) تشير الأسهم السوداء إلى الخبايا. د: الاستزراع ثلاثي الأبعاد للخبايا والكائنات العضوية. ه: صور تمثيلية لعضوي نام مشتق من سرداب. تشير الأسهم البيضاء إلى مهد القبو. أشرطة المقياس = (A-C) 100 ميكرومتر و (E) 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
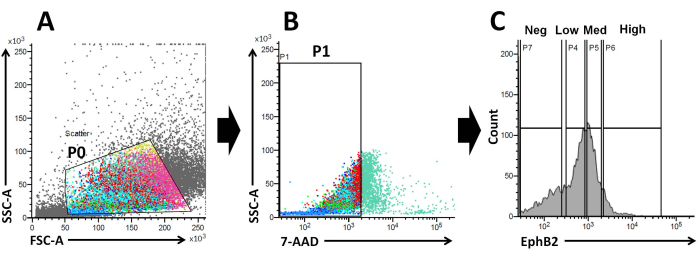
الشكل 2: استراتيجية بوابة قياس التدفق الخلوي للحصول على مجموعة من الخلايا الإيجابية EphB2 (EphB2 +) في الفئران البرية. (أ) تستخدم مخططات التشتت الأمامية والجانبية لفصل الخلايا وفقا لحجمها ودقتها، على الترتيب. (ب) يستخدم التشتت الفلوري لفصل الخلايا القابلة للحياة وفقا لشدة مضان الخلايا 7-AAD (PerCP). تم اختيار بوابة الخلايا السلبية 7-AAD. (ج) تم اختيار بوابات مجموعات خلايا EphB2-high (EphB2 high) و EphB2-medium (EphB2med) و EphB2-low (EphB2 low) و EphB2-negative (EphB2neg). الاختصارات: FSC-A = منطقة ذروة التشتت الأمامية ؛ SSC-A = منطقة ذروة التشتت الجانبية ؛ 7-AAD = 7-أمينو-أكتينومايسين د. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
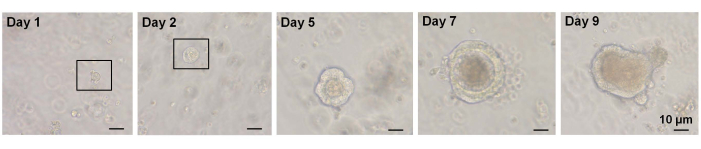
الشكل 3: المسار الزمني لنمو الخلاياالعضوية عالية الخلية EphB2 أحادية الفرز في الفئران البرية. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
الجدول 1: وسط استزراع للوحة 24 بئرا. الرجاء الضغط هنا لتنزيل هذا الجدول.
الفيديو التكميلي S1: صور الفاصل الزمني لعضو متنام. شريط المقياس = 50 ميكرومتر. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S1: صورة تمثيلية لتلطيخ الأجسام المضادة للليزوزيم في عضوي. تشير الأسهم البيضاء إلى خلايا بانيث. اختصار: DIC = مجهر تباين التداخل التفاضلي. شريط المقياس = 10 ميكرومتر. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يصف هذا البروتوكول طريقة لعزل الخبايا المعوية الدقيقة باستمرار والثقافة اللاحقة للعضويات 3D. لتحسين معدل تحرير القبو ، تم إنشاء طريقة عزل ميكانيكية تتضمن اهتزازا قويا بعد العلاج باستخدام EDTA. يختلف التركيب المتوسط عن البروتوكول الأصلي ل Sato et al.7. الوسيلة الأصلية مكلفة نسبيا. وهكذا ، يتم عرض وسط استزراع ووسط مخصص للعضويات المعوية الدقيقة للفئران التي تحتوي على مثبطات دوائية و / أو عوامل نمو مؤتلفة و / أو وسائط مكيفة في الجدول 1. لم يتم تضمين Wnt3A و N-acetylcysteine في وسط الاستزراع في هذا البروتوكول. نظرا لأن خلايا Paneth تعبر عن Wnt3 ، تنتج الخلايا Wnt3 وتدعم صيانة مركز الدراسات الدولي. بالإضافة إلى ذلك ، أثناء عزل القبو ، لا يتم استخدام الوسيط المشروط. النموذج العضوي ديناميكي وله عدم تجانس خلوي وهيفي (خلايا بانيث ، الخلايا المعوية ، الخلايا الكأسية ، خلايا الغدد الصماء المعوية ، خلايا الخصل ، و ISCs). وبالتالي ، يمكن استخدام هذه الكائنات العضوية على نطاق واسع لدراسة القضايا الأساسية لبيولوجيا العضوي.
يحافظ تدرج EphB2 على جذع ISC وانتشاره على طول محور الزغابات المشفرة في الأمعاء الدقيقة البالغة18. تتعلق ميزة صنع المواد العضوية من خلية واحدة من خلايا EphB2 مقارنة بالخبايا المعزولة بفهم بيولوجيا ISCs الفئران ، حيث تلعب ISCs أدوارا رئيسية في مختلف الاضطرابات المعوية البشرية. يمكن استزراع ISCs أحادية EphB2عالية التعبير لتشكيل عضويات بطريقة مماثلة لتطوير الكائنات العضوية من ISCs أحادية التعبير عن Lgr5. الخطوة الأكثر أهمية هي تقسيم الخلايا بدقة إلى أربع مجموعات (EphB2high و EphB2med و EphB2low و EphB2neg) وفقا لتعبير EphB2 في الخبايا باستخدام FACS. تستخدم مخططات التشتت الأمامي مقابل الجانبي (FSC مقابل SSC) بشكل شائع لتحديد الخلايا ذات الأهمية بناء على حجمها ودقتها. يشير FSC إلى حجم الخلية ، ويتعلق SSC بتعقيد أو دقة الخلية في بوابة P0 (الشكل 2A). في هذا العمل ، تم تحليل الخلايا التي تقع داخل البوابة المحددة (P0) لاحقا للتأكد من صلاحيتها. بعد ذلك ، تم تحديد صلاحيتها وفقا للسكان السلبية والإيجابية لإشارات مضان 7-AAD. تم تحديد الحدود بين الخلايا السلبية والإيجابية 7-AAD بدقة للحصول على الخلايا السلبية مع الحد الأدنى من تلوث الخلايا الإيجابية. تم تعيين بوابات EphB2 تقريبا بناء على التعبير المتدرج EphB2.
للتأكد من أن المجموعات الأربع مقسمة بدقة ، تم تحليل تعبير mRNA للجينات المختارة. مستويات mRNA لعلامات ISC مرتفعة في خلايا EphB2العالية 20. بالإضافة إلى ذلك ، فإن مستويات mRNA للعلامات الخاصة بالخلايا السلفية مرتفعة نسبيا في خلايا EphB2med 20. ومع ذلك ، فإن ضغط EphB2 في خلايا EphB2المنخفضة وخلاياEphB2 neg منخفض أو سلبي مقارنة بخلايا EphB2العالية و EphB2med 20. يجب اتخاذ التدابير السابقة لضمان إثراء الخلاياالعالية EphB2 قبل الطلاء. ومع ذلك ، قد يكون النمو العضوي لأقل من 6٪ من الخلاياالعالية EphB2 بسبب موت الخلايا الجذعية أثناء عملية الاستزراع ، وليس الاهتزاز القوي أثناء عزل القبو. لقد ثبت أن تطبيق مثبط كيناز انتقائي مرتبط ب Rho (ROCK) على الخلايا الجذعية الجنينية البشرية يقلل بشكل ملحوظ من موت الخلايا المبرمج الناجم عنالتفكك 22. وبالتالي ، كتغيير تقني ، يجدر محاولة إضافة مثبط ROCK بتركيز أعلى ومع حضانة أطول لتحسين الجدوى.
توفر خلايا Paneth المفرزة Wnt3A بجوار ISCs الدعم الأساسي لISCs 8. في الواقع ، تظهر مضاعفة خلايا ISC-Paneth قدرة تشكيل عضوية متزايدة بشدة مقارنة بISCs 8 المفردة. علاوة على ذلك ، فقد تبين أن إضافة Wnt3A بتركيز 100 نانوغرام / مل لأول 3 أيام من الاستزراع تزيد من قدرة تكوين المواد العضوية8. وبالتالي ، كتغيير تقني آخر ، يمكن أن تؤدي إضافة Wnt3A الخارجية إلى تحسين قدرة تكوين الأعضاء ل ISCs أحادية EphB2عالية التعبير.
بالمقارنة مع النهج في الجسم الحي ، يمكن استخدام المواد العضوية بسهولة للتلاعب الجيني ، وتحليل الأنماط الظاهرية للأورام الخبيثة ، وفحص الأدوية20,23. مزيج من استخلاب EDTA وطريقة العزل الميكانيكي فعال وقابل للتكرار وفعال من حيث الوقت لإنشاء عضويات معوية صغيرة من الخبايا ويمكن متابعتها بسهولة من قبل موظفي المختبر دون أي خبرة متقدمة. وبالتالي ، فإن إضافة العزل الميكانيكي مع اهتزاز قوي بعد العلاج باستخدام EDTA يمكن أن ينشئ بكفاءة عضويات معوية صغيرة خارج الجسم الحي ويوفر أداة محتملة للزراعة العضوية ونمذجة الأمراض للأنسجة الظهارية البالغة الأخرى.
الخلايا الطلائية المعوية مستقطبة وموجهة مع توجيه الجانب القمي نحو التجويف. ومع ذلك ، فإن الجانب القمي الذي يواجه تجويف المواد العضوية 3D موجود في داخلها. وبالتالي ، تمنع هذه المنظمة الوصول إلى الجانب القمي ، وهي مشكلة عند دراسة تأثيرات المكونات اللمعية ، مثل العناصر الغذائية والميكروبات والمستقلبات على الخلايا الظهارية. للتحايل على هذا العيب ، تم تطوير ثقافة الخلايا العضوية كطبقة أحادية2D 24. فيما يتعلق بالتطبيقات المستقبلية ، سيتم استخدام ثقافة الخلايا العضوية أحادية الطبقات ، لأن هذا يمثل النظام الأكثر كفاءة وقابلية للسحب.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم دعم هذا العمل من قبل المنح في المعونة للبحث العلمي (C) إلى T.T. (أرقام المنح JP17K07495 و JP20K06751). نشكر البروفيسور مينيكو كينغاكو على استخدام المعدات اللازمة للتصوير بفاصل زمني طويل المدى (LCV100; أوليمبوس).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Eppendorf | 0030 125.215 | |
| 5 mL syringe | TERUMO | SS-05SZ | |
| 15 mL Falcon tube | Iwaki | 2325-015 | |
| 20 μm cell strainer | Sysmex | 04-004-2325 | |
| 24-well plate | Iwaki | 3820-024 | |
| 50 mL Falcon tube | Iwaki | 2345-050 | |
| 60 mm tissue culture dish | FALCON | 353002 | |
| 70 μm cell strainer | Falcon | 352350 | |
| 100 mm Petri dish | Iwaki | 3020-100 | |
| 7-AAD | BD Biosciences | 559925 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| Alexa Fluor 568 Goat Anti-Mouse IgG (H+L) | Invitrogen | A-11004 | |
| Anti-EphB2 APC-conjugated antibody | BD Biosciences | 564699 | |
| C57BL6/J mice | Japan SLC, Inc. | ||
| Clean bench | HITACHI | CCV-1306E | |
| Confocal laser scanning microscope | Olympus | FV3000 | |
| EDTA (0.5 mol/L) | Nacalai Tesque | 06894-14 | 2 mM |
| FACSMelody | BD Life Sciences-Biosciences | 661762 | |
| Fetal bovine serum | Sigma | 173012 | 1% (v/v) |
| Fiji (software) | https://fiji.sc/ | ||
| Gentamicin (10 mg/mL) | Nacalai Tesque | 16672-04 | 25 μg/mL |
| Hammacher laboratory scissor | SANSYO | 91-1538 | |
| Incubator | Panasonic | MCO-170-PJ | |
| Laboratory tweezer | AS-ONE | 7-164-04 | |
| L-Glutamine 200 mM | Gibco | 25030081 | 2 mM |
| Matrigel | BD Biosciences | 354230 | ECM for 3D organoids |
| Mouse Anti-Human Lysozyme | LSBio | LS-B8704-100 | |
| Murine EGF (20 μg/mL stock solution) | PeproTech | 315-09 | 20 ng/mL |
| PBS 1x | Gibco | 10010-023 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | 50 U/mL |
| Pipetman (10 μL, 20 μL, 200 μL, and 1,000 μL) | GILSON | 1-6855-12, -13, -15, and -16 | |
| Recombinant murine Noggin (20 μg/mL stock solution | R&D Systems | 1967-NG-025 | 100 ng/mL |
| Recombinant murine R-Spondin 1 (250 μg/mL stock solution) | R&D Systems | 3474-RS-050 | 500 ng/mL |
| Sorbitol | Nacalai Tesque | 32021-95 | 2% (w/v) |
| TE2000-S (inverted microscope) | Nikon | 24131 | |
| Time-lapse image microscope | Olympus | LCV100 | |
| TrypLE Express 1x | Gibco | 12605-010 | |
| ULVAC | ULVAC KIKO Inc. | 100073 | |
| Y-27632 | Fujifilm | 331752-47-7 | 10 μM |
References
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Nikolaev, M., et al. Homeostatic mini-intestines through scaffold-guided organoid morphogenesis. Nature. 585 (7826), 574-578 (2020).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27, R99-R107 (2018).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Dedhia, P. H., Bertaux-Skeirik, N., Zavros, Y., Spence, J. R. Organoid models of human gastrointestinal development and disease. Gastroenterology. 150 (5), 1098-1112 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 469 (7330), 415-418 (2011).
- Aronowitz, J. A., Lockhart, R. A., Hakakian, C. S. Mechanical versus enzymatic isolation of stromal vascular fraction cells from adipose tissue. Springerplus. 4 (1), 713 (2015).
- Takahashi, T. New trends and perspectives in the function of non-neuronal acetylcholine in crypt-villus organoids in mice. Methods in Molecular Biology. 1576, 145-155 (2019).
- Batlle, E., et al. β-catenin and TCF mediate cell positioning in the intestinal epithelium by controlling the expression of EphB/ephrinB. Cell. 111 (2), 251-263 (2002).
- Baghdadi, M. B., Kim, T. -. H. Analysis of mouse intestinal organoid culture with conditioned media isolated from mucosal enteric glial cells. STAR Protocols. 3 (2), 101351 (2022).
- Takahashi, T., et al. Non-neuronal acetylcholine as an endogenous regulator of proliferation and differentiation of Lgr5-positive stem cells in mice. FEBS Journal. 281 (20), 4672-4690 (2014).
- Barker, N. Adult intestinal stem cells: Critical drivers of epithelial homeostasis and regeneration. Nature Reviews Molecular Cell Biology. 15 (1), 19-33 (2014).
- Fordham, R. P., et al. Transplantation of expanded fetal intestinal progenitors contributes to colon regeneration after injury. Cell Stem Cell. 13 (6), 734-744 (2013).
- Miyoshi, H., et al. Wnt5a potentiates TGF-β signaling to promote colonic crypt regeneration after tissue injury. Science. 338 (6103), 108-113 (2012).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. NatureMedicine. 17 (10), 1225-1227 (2011).
- Merlos-Suárez, A., et al. The intestinal stem cell signature identifies colorectal cancer stem cells and predicts disease relapse. Cell Stem Cell. 8 (5), 511-524 (2011).
- Mao, W., et al. EphB2 as a therapeutic antibody drug target for the treatment of colorectal cancer. Cancer Research. 64 (3), 781-788 (2004).
- Takahashi, T., et al. Muscarinic receptor M3 contributes to intestinal stem cell maintenance via EphB/ephrin-B signaling. Life Science Alliance. 4 (9), e202000962 (2021).
- Jung, P., et al. Isolation of human colon stem cells using surface expression of PTK7. Stem Cell Reports. 5 (6), 979-987 (2015).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Schulte, L., Hohwieler, M., Müller, M., Klaus, J. Intestinal organoids as a novel complementary model to dissect inflammatory bowel disease. Stem Cells International. 2019, 8010645 (2019).
- Puzan, M., Hosic, S., Ghio, C., Koppes, A. Enteric nervous system regulation of intestinal stem cell differentiation and epithelial monolayer function. Scientific Reports. 8 (1), 6313 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved