التألق المناعي المتعدد جنبا إلى جنب مع تحليل الصور المكانية للتقييم السريري والبيولوجي للبيئة المكروية للورم
In This Article
Summary
في هذه المقالة ، تم وصف بروتوكول لتضخيم إشارة التيراميد اليدوي (TSA) متعدد الإرسال المناعي (mIF) جنبا إلى جنب مع تحليل الصور والتحليل المكاني. يمكن استخدام هذا البروتوكول مع أقسام البارافين المضمنة في الفورمالين (FFPE) لتلطيخ اثنين إلى ستة مستضدات لكل شريحة اعتمادا على ماسح الشرائح المتاح في المختبر.
Abstract
تتكون البيئة المكروية للورم (TME) من عدد كبير من أنواع الخلايا المختلفة ، مثل الخلايا المناعية السامة للخلايا والخلايا المناعية. اعتمادا على تكوينه والتفاعلات بين الخلايا السرطانية والخلايا المحيطة بالورم ، قد يؤثر TME على تطور السرطان. يمكن أن يؤدي توصيف الأورام وبيئتها المكروية المعقدة إلى تحسين فهم أمراض السرطان وقد يساعد العلماء والأطباء على اكتشاف مؤشرات حيوية جديدة.
لقد طورنا مؤخرا العديد من لوحات التألق المناعي المتعدد (mIF) بناء على تضخيم إشارة التيراميد (TSA) لتوصيف TME في سرطان القولون والمستقيم وسرطان الخلايا الحرشفية في الرأس والرقبة وسرطان الجلد وسرطان الرئة. بمجرد الانتهاء من تلطيخ ومسح اللوحات المقابلة ، يتم تحليل العينات على برنامج تحليل الصور. ثم يتم تصدير الموقع المكاني وتلطيخ كل خلية من برنامج القياس الكمي هذا إلى R. لقد طورنا نصوص R التي تسمح لنا ليس فقط بتحليل كثافة كل نوع من الخلايا في العديد من مقصورات الورم (مثل مركز الورم وهامش الورم والسدى) ولكن أيضا لإجراء تحليلات قائمة على المسافة بين أنواع الخلايا المختلفة.
يضيف سير العمل هذا بعدا مكانيا إلى تحليل الكثافة الكلاسيكي الذي يتم إجراؤه بشكل روتيني بالفعل للعديد من العلامات. يمكن أن يسمح تحليل mIF للعلماء بالحصول على فهم أفضل للتفاعل المعقد بين الخلايا السرطانية و TME واكتشاف مؤشرات حيوية تنبؤية جديدة للاستجابة للعلاجات ، مثل مثبطات نقاط التفتيش المناعية والعلاجات المستهدفة.
Introduction
مع تطور العلاجات المستهدفة ومثبطات نقاط التفتيش المناعية ، أصبح من الأهمية بمكان توصيف التفاعلات بين الخلايا السرطانية والبيئة المكروية للورم بشكل أفضل ، وهذا مجال مهم حاليا للبحث الانتقالي. يتكون TME من عدد كبير من أنواع الخلايا المختلفة ، مع توازن الخلايا السامة للخلايا المناعية التي تستهدف الخلايا السرطانية والخلايا المناعية التي يمكن أن تفضل نمو الورم وغزوه1،2،3،4. يمكن أن يؤدي توصيف هذه البيئة المعقدة إلى تحسين فهم أمراض السرطان وقد يساعد العلماء والأطباء على اكتشاف مؤشرات حيوية تنبؤية ونذير جديدة من أجل اختيار المرضى بشكل أفضل للعلاج في المستقبل 5,6. على سبيل المثال ، طور جالون وفريقه Immunoscore ، وهي طريقة تسجيل قابلة للتكرار يمكن استخدامها كعلامة حيوية تنبؤية. يتم حساب Immunoscore باستخدام كثافة خلايا CD3 + و CD8 + T في الهامش الغازي وفي مركز الورم 7,8.
على مدى العقود الماضية ، تم تطوير حلول تجارية ل mIF ، ولكنها غالبا ما تكون باهظة الثمن ومصممة لألواح محددة من المستضدات. للتغلب على الحاجة إلى لوحات محددة من المستضدات في البحث الأكاديمي والانتقالي ، قمنا بتطوير طريقة فعالة من حيث التكلفة لإجراء mIF على أقسام ورم FFPE ، مما يسمح بتلطيخ اثنين إلى ستة مستضدات مضافة إلى تلطيخ نوى الخلية على عينات الإنسان والفئران.
بمجرد تلطيخ أقسام الأنسجة بأكملها ومسحها ضوئيا باستخدام ماسح ضوئي للشرائح الفلورية ، يمكن تحليل العينات بواسطة العديد من برامج تحليل الصور التي تدعم مجموعات البيانات الهرمية الكبيرة. أخيرا ، يمكن استخدام البيانات الأولية في بيئة للحوسبة الإحصائية والرسومات مثل برنامج R (v.4.0.2) من أجل إجراء تحليلات الكثافة والتحليل المكاني.
يتم تقديم بروتوكول محسن للتلطيخ بخمس علامات ، بالإضافة إلى الحيل والنصائح لتحسين اللوحات الجديدة ، في هذه المخطوطة. علاوة على ذلك ، يتم شرح الخطوات التفصيلية لتحليل الصور ووظائف R المستخدمة للتحليل الإحصائي والمكاني.
Protocol
وجميع العينات المستخدمة في هذا البروتوكول مأخوذة من دراسة وافقت عليها لجان الأخلاقيات المحلية وأذنت بها السلطة المختصة. قدم جميع المشاركين في الدراسة موافقة خطية مستنيرة. تم تسجيل التجربة مع ClinicalTrials.gov (NCT03608046).
1. التألق المناعي المتعدد
- تقسيم FFPE
- ثبت الأنسجة في 4٪ بارافورمالدهيد ، وقم بتضمين الأنسجة الثابتة في البارافين.
- قطع أقسام 5 ميكرومتر ، ووضعها على شرائح المجهر اللاصق.
- جفف الشرائح طوال الليل في درجة حرارة الغرفة (RT).
- إزالة البارافين وتثبيط البيروكسيديز الداخلي
- قم بإزالة الشمع من الأنسجة عن طريق غمر الشرائح في التولوين (3x لمدة 5 دقائق لكل منهما) والميثانول (3x لمدة 5 دقائق لكل منهما) تحت غطاء الدخان.
- تثبيط البيروكسيديز الداخلي عن طريق غمر الشرائح في 3٪ بيروكسيد الهيدروجين المخفف في الميثانول لمدة 20 دقيقة تحت غطاء الدخان.
- شطف الشرائح في المقطر (د) H2O (1x لمدة 3 دقائق).
- تلطيخ متعدد التألق المناعي
- اغمر الشرائح في وعاء تلطيخ سعة 300 مل يحتوي على سترات 10 مللي متر (درجة الحموضة 6) أو EDTA (درجة الحموضة 9) مع 0.1٪ TritonX-100.
ملاحظة: يعتمد المخزن المؤقت المستخدم (الرقم الهيدروجيني 6 أو الرقم الهيدروجيني 9) على المستضد الملون (انظر الجدول 1). - ضع برطمان التلوين مع إغلاق الغطاء في الميكروويف لمدة 3-5 دقائق بأقصى طاقة (على سبيل المثال ، 900 واط) حتى يبدأ المخزن المؤقت في الغليان.
ملاحظة: يعتمد الوقت الأمثل للغليان على الميكروويف وحجم المخزن المؤقت. قد تكون التعديلات ضرورية للعثور على التوقيت المثالي. بالنسبة لبعض المستضدات الهشة أو العينات الهشة والأقل التصاقا (مثل المواد العضوية والكروية) ، يمكن أن يكون غليان الميكروويف قاسيا جدا. في هذه الحالة ، يمكن استخدام قدر الضغط بدلا من ذلك. - احتفظ بالمخزن المؤقت في درجة حرارة قريبة من الغليان عن طريق وضع برطمان التلوين المغلق في الميكروويف على طاقة منخفضة (على سبيل المثال ، 90 واط) لمدة 15 دقيقة.
- قم بإجراء الخطوة الأخيرة من التسخين عن طريق وضع الميكروويف بأقصى طاقة لمدة 90 ثانية.
- أخرج البرطمان من الميكروويف ، واترك المخزن المؤقت يبرد لمدة 15 دقيقة في RT.
- اشطف الشرائح 3x لمدة 5 دقائق لكل منها في dH2O و 1x لمدة 5 دقائق في محلول ملحي مخزن بنسبة 0.1٪ Tween 20 (TBS-T).
- قم بإزالة TBS-T عن طريق تنشيف الشرائح على منشفة ورقية
- ضع الشرائح (مسطحة) على صينية غرفة تلطيخ أو صندوق شرائح مجهري (انظر جدول المواد).
- تطويق الأنسجة بقلم كاره للماء.
- سد مواقع الربط غير المحددة عن طريق تغطية الأنسجة بنسبة 5٪ من ألبومين مصل الأبقار (BSA) المذاب في TBS-T لمدة 30 دقيقة.
- قم بإزالة المخزن المؤقت للحظر عن طريق تنشيف الشرائح على منشفة ورقية.
ملاحظة: لا تشطف الشرائح بعد خطوة الحظر. - احتضان الأنسجة لمدة 60 دقيقة مع الجسم المضاد الأساسي (انظر الجدول 1) المخفف في 1٪ BSA TBS-T عن طريق تغطية الأنسجة بحوالي 300 ميكرولتر من المحلول.
- شطف الشرائح 3x لمدة 3 دقائق لكل منها مع TBS-T.
- احتضان الأنسجة لمدة 40 دقيقة بالأجسام المضادة الثانوية poly-HRP (انظر الجدول 1) عن طريق تغطية الأنسجة بحوالي 300 ميكرولتر من المحلول.
- شطف الشرائح 3x لمدة 3 دقائق مع TBS-T.
- احتضان الأنسجة لمدة 10 دقائق باستخدام كاشف الفلوروكروم تيراميد (انظر الجدول 1) المخفف 200 ضعف في محلول البورات (0.1 م بورات ، درجة الحموضة 7.8 ، 3 م كلوريد الصوديوم) مكمل بشكل ارتجالي ب 0.003٪ H 2 O2عن طريق تغطية الأنسجة بحوالي 300 ميكرولتر من المحلول.
- شطف الشرائح 3x لمدة 3 دقائق مع TBS-T.
- كرر الخطوات 1.3.1-1.3.16 حتى يتم إجراء جميع تلطيخ TSA.
- احتضان الأنسجة طوال الليل عند 4 درجات مئوية مع آخر جسم مضاد أولي (انظر الجدول 1) مخفف في 1٪ BSA TBS-T.
ملاحظة: نظرا لأن الحضانة تكون بين عشية وضحاها ، فمن المهم تغطية صينية غرفة التلوين أو صندوق شرائح المجهر وإضافة dH2O على منشفة ورقية في أسفل الصندوق (أسفل الشرائح) للتأكد من أن الأنسجة لا تجف أثناء الحضانة. - شطف المنديل 3x لمدة 5 دقائق لكل منهما مع TBS-T.
- احتضان الأنسجة لمدة 120 دقيقة مع الجسم المضاد الثانوي (يقترن مباشرة مع الفلوروكروم) المخفف 200 أضعاف في 1 ٪ BSA TBS-T.
- شطف المنديل 3x لمدة 5 دقائق لكل منهما مع TBS-T.
- قم بتلطيخ النوى عن طريق احتضان الأنسجة لمدة 5 دقائق في بيسبنزيميد (20 مللي مول) مخفف 1000 ضعف في 10٪ BSA TBS-T.
ملاحظة: يمكن استبدال Bisbenzimide ب DAPI ، لكن الأخير أكثر سمية ويجب التعامل معه بعناية تحت غطاء الدخان. - شطف المنديل 3x لمدة 3 دقائق لكل منهما في dH2O.
- قم بتركيب الشرائح باستخدام وسيط تركيب مضان ونظارات غطاء البورسليكات.
- اغمر الشرائح في وعاء تلطيخ سعة 300 مل يحتوي على سترات 10 مللي متر (درجة الحموضة 6) أو EDTA (درجة الحموضة 9) مع 0.1٪ TritonX-100.
2. مسح الشرائح
- قم برقمنة الشرائح عن طريق مسحها ضوئيا على ماسح ضوئي للشرائح الفلورية بتكبير 20x (يتم توفير تفاصيل الماسح الضوئي للشرائح في جدول المواد).
ملاحظة: يظهر مسح تمثيلي لمضاعف إرسال مثالي في الشكل 1.
3. تحليل الصور
- قم باستيراد عمليات المسح الضوئي إلى برنامج تحليل الصور (ملف > Open Image).
- انتقل إلى علامة التبويب المصنفات ، وحدد المكون الإضافي DenseNet الذكاء الاصطناعي V2 .
- قم بتدريب المكون الإضافي DenseNet الذكاء الاصطناعي V2 للتعرف على النوى من خلال إحاطة حوالي 500 نواة في صورة واحدة.
- قم بتدريب الذكاء الاصطناعي على عدة شرائح أخرى من نفس الدفعة ودفعات مختلفة من تلطيخ mIF عن طريق إحاطة عدة نوى (50) على عدة شرائح (حوالي 10).
ملاحظة: يمكن العثور على إرشادات مفصلة حول كيفية استخدام المكون الإضافي الذكاء الاصطناعي في دليل البرنامج. يعد استخدام الذكاء الاصطناعي للكشف عن النوى أمرا اختياريا. تتوفر طرق أخرى للكشف عن النوى اعتمادا على برنامج تحليل الصور المستخدم. - احفظ الذكاء الاصطناعي المدرب (إجراءات المصنف > حفظ).
- انتقل إلى علامة التبويب التعليقات التوضيحية ، وقم بإنشاء تعليق توضيحي لكل منطقة اهتمام (ROI)، مثل مركز الورم وهامش الورم، باستخدام أداة التعليق التوضيحي للقلم.
- إذا لزم الأمر، قم بإزالة المناطق ذات الطيات والمناطق التي تظهر ضبابية باستخدام أداة التعليقات التوضيحية للاستبعاد.
ملاحظة: يمكن إجراء تلطيخ الهيماتوكسيلين-يوزين لقسم مجاور للقسم المستخدم في mIF قبل تلطيخ mIF لضمان وجود الخلايا السرطانية في العينة ولمساعدة علماء التشريح على تحديد عائد الاستثمار. - انتقل إلى علامة التبويب تحليل، وحدد خوارزمية HighPlex FL (إجراءات الإعدادات > تحميل > HighPlex FL).
- حدد علامة التبويب تحديد الصبغة ، وحدد الصبغة محل الاهتمام.
- في علامة التبويب الكشف النووي ، انتقل إلى نوع التجزئة النووية ، وحدد الذكاء الاصطناعي مخصص.
- في مصنف التجزئة النووية، حدد الذكاء الاصطناعي المحفوظة في الخطوة 3.5.
- في علامة التبويب الكشف عن الغشاء والسيتوبلازم ، اختر الحد الأقصى لنصف قطر السيتوبلازم (في هذه الدراسة ، تم استخدام 1.5) وعدد أصباغ الغشاء.
- لكل صبغة ، حدد العتبة الموجبة للنواة ، والعتبة الإيجابية للسيتوبلازم ، والعتبة الموجبة للغشاء.
ملاحظة: تختلف العتبة لكل تلطيخ ويجب تعديلها لكل دفعة من الشرائح وكل مستضد ملطخ. يمكن أن يساعد استخدام أداة إعدادات العرض (عرض > عرض الإعدادات) في تحديد حد مناسب باستخدام قيمة الكثافة في نهاية ذروة الكثافة (على اليمين). - لكل صبغة ، حدد نسبة النواة والغشاء والسيتوبلازم من قيم الاكتمال.
ملاحظة: هذه المعلمة مهمة لتجنب الكشف الإيجابي الخاطئ عندما تكون خليتان بتلطيخ مختلف قريبتين من بعضهما البعض (الشكل 2). - احفظ الخوارزمية (إجراءات الإعدادات > حفظ).
- تحليل عائد الاستثمار (تحليل طبقة التعليقات التوضيحية >).
- انتقل إلى علامة التبويب النتائج ، وحدد جميع البيانات في بيانات الكائن (ctrl + A).
- تصدير البيانات بتنسيق .csv (انقر بزر الماوس الأيمن > تصدير بيانات الكائن > . CSV).
ملاحظة: يحتوي هذا الجدول على الموضع (Xmin, Xmax; Ymin ، Ymax) وإيجابية كل علامة لكل خلية تم تحليلها.
4. المعلوماتية الحيوية باستخدام R
ملاحظة: يتوفر برنامج نصي R يوفر مزيدا من التفاصيل حول الخطوات التالية على GitHub (benidovskaya / Ring: خط أنابيب لتحليل تلطيخ التألق المناعي المتعدد. [github.com])
- باستخدام الجدول المصدر ، حدد أولا أنواع الخلايا المختلفة بناء على تلطيخات colocalization. على سبيل المثال ، حدد الخلايا التائية السامة للخلايا بواسطة خلايا CD3 + / CD8 + مزدوجة الموجبة.
- بعد ذلك ، أعد إنشاء صورة مبسطة للشريحة على مخطط نقطي باستخدام الإحداثيات المصدرة من برنامج تحليل الصور و ggplot2 (الشكل 3). باستخدام هذه البيانات ، يمكن إجراء عدة أنواع من التحليل:
- تحليل الكثافة
ملاحظة: أبسط تحليل هو تحليل الكثافة.- قم بإجراء تحليل الكثافة لجميع أنواع الخلايا باستخدام الشريحة بأكملها للخزعات أو بعض المناطق المحددة من الأنسجة. على سبيل المثال ، احسب كثافة خلايا CD3 + و CD8 + T في مركز الورم وهامش الورم (الشكل 4A-C).
- لحساب هذه الكثافات ، استخدم برنامج تحليل الصور لإنتاج إطار بيانات محدد لكل عينة مع النمط الظاهري وإحداثيات كل خلية. من خلال وظيفة التجميع (k-أقرب جار) على R ، قم بإنشاء كائن مضلع باستخدام حدود الخزعة المدروسة ، وحساب كثافة أنواع الخلايا ذات الأهمية بداخلها.
ملاحظة: يسمح هذا بمقارنة كثافات أنواع الخلايا المختلفة بين الحالات المختلفة (مثل النقاط الزمنية المختلفة وأنواع العلاج وأنواع الأنسجة والاستجابة للعلاج) والتوطين (مركز الورم ، هامش الورم ، تليف السدى ، ومنطقة النخر) اعتمادا على الفرضية البيولوجية. نظرا للقرب الكبير بين الخلايا السرطانية والخلايا شبه السرطانية والخلايا المتسللة إلى الورم ، قد يكتشف برنامج تحليل الصور الخلايا الإيجابية المزدوجة كخلايا مناعية وخلايا سرطانية في نفس الوقت. في هذه الحالة ، يحتاج المرء إلى تصحيح هذه المشكلة من الناحية المعلوماتية الحيوية من خلال ذكر ماهية هذه الخلايا الإيجابية المزدوجة. في هذه الحالة ، تم تمييز خلايا CD3 + CD8 + cytokeratin+ على أنها خلايا سامة للخلايا لأن إيجابية السيتوكيراتين كانت بسبب الخلايا السرطانية المحيطة بالخلايا الليمفاوية المتسللة.
- خرائط الحرارة
- باستخدام كثافة كل نوع خلية من لوحات مختلفة ومن خلال تطبيق التطبيع (على سبيل المثال ، توسيط التحجيم) ، ارسم خرائط حرارية (الشكل 5) تمثل وفرة الخلية في مجموعة العينات.
- باستخدام التجميع الهرمي غير الخاضع للإشراف بناء على كثافة الخلايا ، والمرضى العنقوديين الذين لديهم تركيبات TME مماثلة ، وربط هذه المجموعات بالمعلمات السريرية مثل الاستجابة للعلاج والبقاء على قيد الحياة.
ملاحظة: يمكن إجراء خرائط الحرارة والتجميع بسهولة باستخدام حزمة R ComplexHeatmap9.
- توزيع الخلايا المكانية
- حساب المعلوماتية الحيوية المسافات بين الخلايا (على سبيل المثال ، الخلايا المناعية والأورام ؛ الشكل 6 أ ، ب) بناء على إحداثيات الخلية التي يوفرها تحليل الصورة. استخدم المسافات المتوسطة والمتوسطة بين أنواع الخلايا محل الاهتمام لمقارنة قرب الخلية عبر جميع عينات المجموعة.
- الدوال الوصفية المكانية
- استخدم أقرب دالة G-cross من النوع المتقاطع ، المتوفرة من خلال حزمة R spatstat10 ، لتحديد احتمال وجود خلية ذات أهمية ، X (على سبيل المثال ، خلية ورمية) ، تلتقي بأقرب خلية ، Y (على سبيل المثال ، خلية T) ، داخل دائرة نصف قطرها معينة حول الخلية X.
- احسب المساحة الواقعة أسفل المنحنى التجريبي للحصول على قيمة عددية تمثل تسلل الورم لخلايا CD3 + T حول الخلايا السرطانية11 (الشكل 6C). استخدم دوال وصفية مكانية أخرى مثل الدالة F أو الدالةJ 12.
- تحليل المناعة
- احسب النتيجة المناعية (I) ، التي طورها فريق Galon 7,8 ، باستخدام كثافة خلايا CD3 + و CD8 + T في مركز الورم والهامش الغازي للورم.
ملاحظة: تتراوح النتيجة من I0 إلى I4. ترتبط الكثافة المنخفضة لكل من خلايا CD3 + و CD8 + T في المركز وهامش الورم بدرجة I0 ، بينما ترتبط الكثافة العالية لخلايا CD3 + و CD8 + T في كلتا المنطقتين بدرجة I4. في الآونة الأخيرة ، تم التحقق من صحة التأثير النذير ل Immunocore في دراسة مع عينات من 2,681 مريضا بسرطان القولون من المرحلة الأولى إلى الثالثة من 14 مركزا في 13 دولة7. ومع ذلك ، ليتم حسابها ، تتطلب Immunoscore عينة تم استئصالها جراحيا تحتوي على كل من مركز الورم وهامشه. بالنسبة للخزعات ، التي تفتقر عادة إلى الهامش ، تم تطوير Immunoscore المكيف مع الخزعة مؤخرا13. - لحساب درجة المناعة المتكيفة مع الخزعة ، قم بتحويل قيمة كثافة الخلايا التائية CD3 + و CD8 + إلى نسبة مئوية ، ثم استخدم النسبة المئوية المتوسطة لخلايا CD3 + و CD8 + T للتسجيل في واحدة من ثلاث فئات (أي منخفضة ومتوسطة وعالية) 13.
- احسب النتيجة المناعية (I) ، التي طورها فريق Galon 7,8 ، باستخدام كثافة خلايا CD3 + و CD8 + T في مركز الورم والهامش الغازي للورم.
- تحليل النقاط الساخنة
- استخدم تحليل النقاط الساخنة ، باستخدام دالة العد الرباعي (spatstat) 10 ، لمقارنة كثافات أنواع الخلايا المختلفة في المنطقة الأكثر تسللا من الأنسجة. على سبيل المثال ، من الممكن حساب درجة "تشبه المناعة" باستخدام قيمة كثافة الخلايا التائية CD3 و CD8 للمربعات الأكثر تسللا من الأنسجة (الشكل 7). قم بتطبيق هذه الطريقة لتحليل أي نوع من الخلايا بتوزيع غير متجانس عبر الأنسجة.
- تحليل الكثافة
النتائج
باتباع هذا البروتوكول ، يجب التحقيق في العديد من المعلمات للتأكد من أن الأنسجة ملطخة بشكل صحيح. أولا ، يجب أن يعرض تلطيخ TSA نطاقا ديناميكيا جيدا عند استخدام أوقات التعرض المنخفضة (عادة 2-100 مللي ثانية) أثناء عملية المسح. يعني وقت التعرض المنخفض أن التضخيم قد تم بشكل صحيح أثناء التفاعل مع HRP. بالنسبة للمستضدات الملطخة بالجسم المضاد الثانوي المقترن مباشرة بالفلوروكروم ، يمكن أن يكون وقت التعرض أطول بكثير ، مما قد يؤدي إلى التبييض الضوئي (انخفاض في شدة الإشارة بسبب وقت التعرض الطويل). ثانيا ، من المهم التحقق من أن كل تلطيخ يعرض نسبة إشارة إلى الضوضاء عالية. يمكن أن تكون إشارة الخلفية العالية مع إشارة مستضد منخفضة مؤشرا على أن الجسم المضاد الأساسي ليس محددا بدرجة كافية ، أو أن البيروكسيديز الداخلي لم يتم تعطيله بشكل صحيح ، أو أن خطوة واحدة من البروتوكول لم تتم بشكل كاف. ثالثا ، اعتمادا على الماسح الضوئي للشرائح ومجموعات المرشحات المستخدمة للمسح الضوئي ، من الممكن رؤية التداخلات بين لونين (على سبيل المثال ، AF555 و AF594 و AF647). يعد اختيار مجموعات المرشحات المناسبة على الماسح الضوئي وتخفيف الأجسام المضادة الأساسي المناسب أمرا بالغ الأهمية لتجنب الاكتشافات المتقاطعة المحتملة. تتكون مراقبة الجودة من الكشف عن خلايا ملطخة مفردة لكل علامة على الملف الممسوح ضوئيا. أخيرا ، من المهم أيضا إضافة عنصر تحكم إيجابي وسلبي لكل دفعة من التلطيخ. بالنسبة للخلايا المناعية ، تعتبر اللوزتين تحكما إيجابيا جيدا. تظهر نتيجة تمثيلية للتلطيخ الأمثل في الشكل 1.
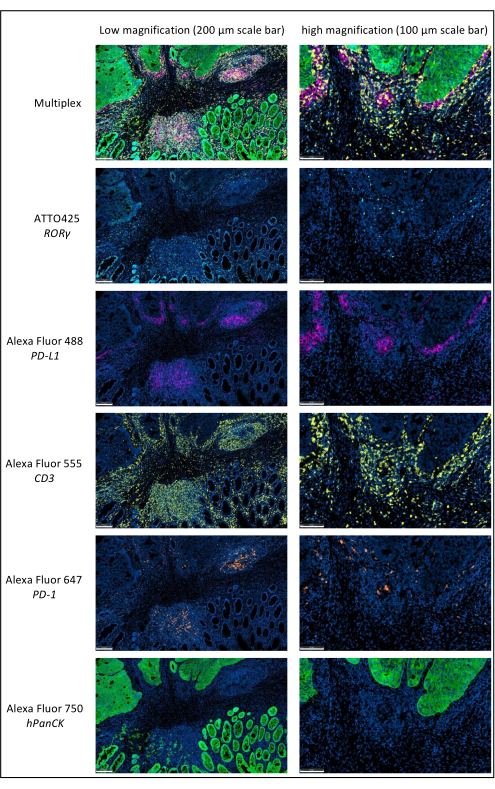
الشكل 1: سرطان المستقيم المتقدم محليا ملطخ بالتألق المناعي المتعدد. الاختصارات: PD-1 = بروتين موت الخلية المبرمج 1 ؛ PD-L1 = ليجند الموت المبرمج 1 ؛ ROR-γ = غاما مستقبلات يتيمة مرتبطة ب RAR ؛ CD3 = مجموعة التمايز 3 ؛ hPanCK = عموم السيتوكيراتين البشري. يتم مسح كل تلطيخ مستضد بتدرج الرمادي ، والألوان المعروضة في الشكل هي ألوان زائفة. تكبير شريط المقياس المنخفض: 200 ميكرومتر ؛ مقياس شريط التكبير عالية: 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
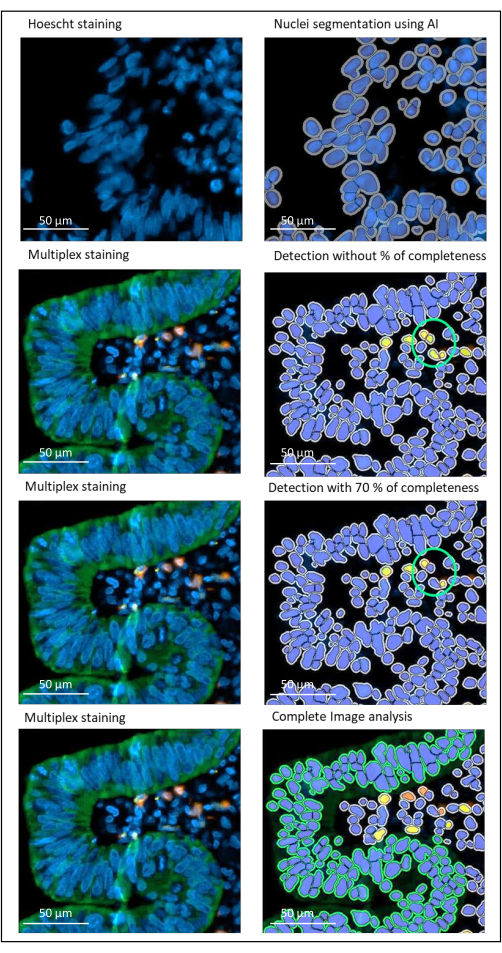
الشكل 2: الكشف عن النوى والبقع لسرطان المستقيم المتقدم محليا باستخدام برنامج تحليل الصور. بدون تعيين النسبة المئوية لمعلمة الاكتمال بشكل صحيح ، يكتشف البرنامج خليتين CD8 + (دائرة خضراء) لأنهما قريبتان من بعضهما البعض ، ولكن خلية واحدة فقط ملطخة. يساعد استخدام اكتمال 70٪ على تجنب هذا الاكتشاف الإيجابي الخاطئ. أخضر = hPanCK ؛ الأصفر = CD3 ؛ البرتقالي = CD8. شريط المقياس: 100 ميكرومتر الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
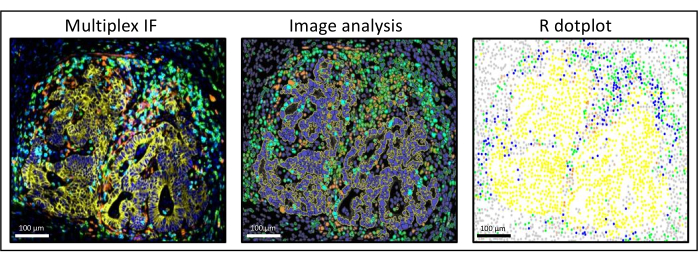
الشكل 3: تحليل الصورة وإعادة تكوين مخطط R النقطي لورم خبيث في سرطان القولون والمستقيم في الكبد. على تلطيخ تعدد الإرسال (يسار) ، يكون عموم السيتوكيراتين البشري باللون الأصفر ، و CD3 باللون الأخضر ، و CD8 باللون الأزرق الفاتح ، و IDO باللون البرتقالي. على الرسم البياني النقطي (على اليمين) ، تكون خلايا عموم السيتوكيراتين + البشرية باللون الأصفر ، وخلايا CD3 + CD8 − باللون الأخضر ، وخلايا CD3 + CD8 + باللون الأزرق ، وخلايا IDO + باللون البرتقالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
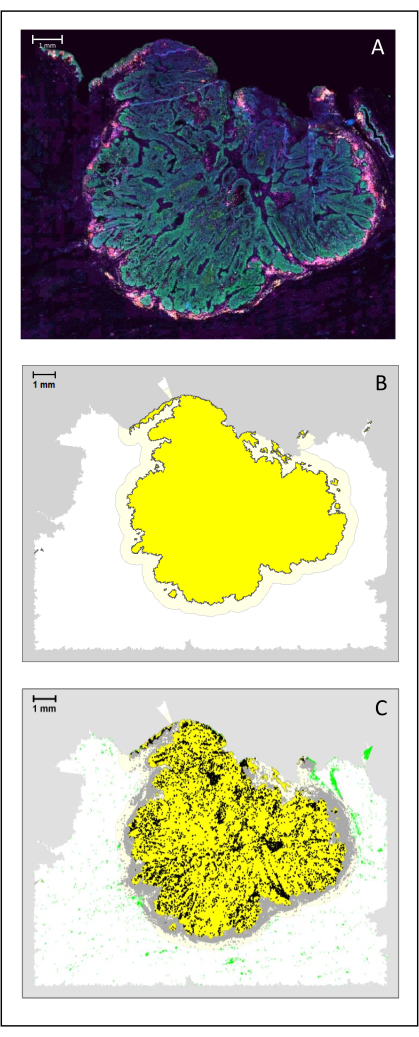
الشكل 4: تحليل القسم الجراحي من HNSCC. (أ) قسم جراحي من HNSCC. الخلايا السرطانية مرئية باللون الأخضر. يتم تصور الخلايا المحيطة بالورم حول جزر الورم (CD3 باللون الأصفر و CD8 باللون الأرجواني). (ب) يتم حساب مركز الورم (باللون الأصفر مع حد أسود) معلوماتيا حيويا بواسطة خوارزمية k-nearest-neighbor بناء على المسافة بين جزر الورم من منطقة واحدة. حول هذه المنطقة ، يتم حساب هامش غازي (أصفر فاتح مع حدود رمادية) على أساس تعسفي 500 ميكرومتر. (ج) يتم تمييز الخلايا التائية الغازية بنقاط سوداء في وسط الورم ونقاط رمادية في الهامش الغازي. يتم تمييز الخلايا التائية الأخرى بنقاط خضراء فاتحة. شريط المقياس: 1 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
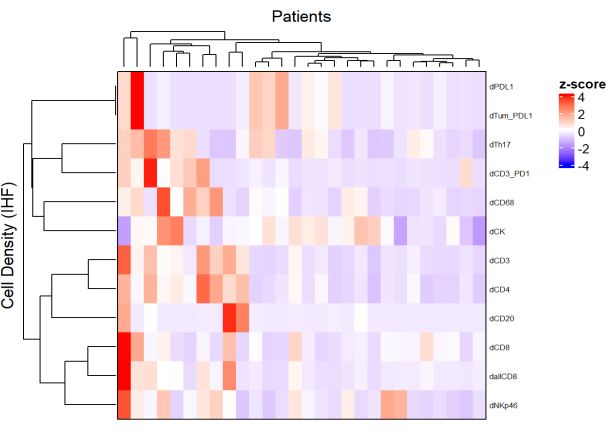
الشكل 5: خريطة حرارية لكثافة أنواع الخلايا المختلفة من خزعات سرطان المستقيم المتقدمة محليا. تم رسم خريطة التمثيل اللوني باستخدام تجميع غير خاضع للإشراف لكثافات أنواع الخلايا المختلفة من لوحات متعددة الإرسال مختلفة مع حزمة ComplexHeatmap. تم استخدام التحجيم والتمركز للتطبيع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
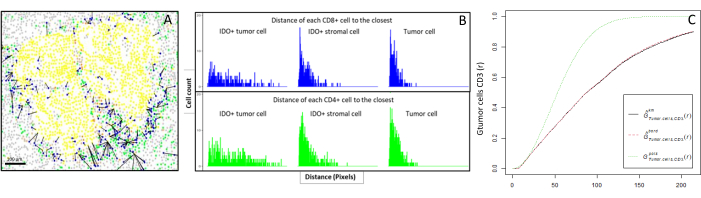
الشكل 6: مسافات خلايا CD4+ وCD8+ إلى كل خلية أورمية+ أو خلية ورمية. خلايا عموم السيتوكيراتين + البشرية باللون الأصفر، وخلايا CD3+CD8− باللون الأخضر، وخلايا CD3+CD8+ باللون الأزرق، وخلايا IDO+ باللون البرتقالي. أ: أقرب مسافة بين الخلايا السرطانية وكل خلية تائية CD8+ . (B) قطع شريطية للمسافات بين خلايا IDO+ وكل خلية CD8+ T (زرقاء) أو خلية CD4+ T (خضراء). (ج) مثال لعينة حللت بواسطة الدالة G-cross. يوضح المحور ص احتمال مواجهة خلية سرطانية لخلية ليمفاوية CD3 + في دائرة نصف قطرها تتراوح من 0-200 ميكرومتر حول الخلية السرطانية. يتم عرض ثلاثة منحنيات ؛ المنحنى النظري باللون الأخضر المنقط (توزيع بواسون) ، والمنحنى التجريبي المصحح مع تصحيح km باللون الأسود ، والمنحنى التجريبي المصحح مع تصحيح الحدود باللون الأحمر المنقط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
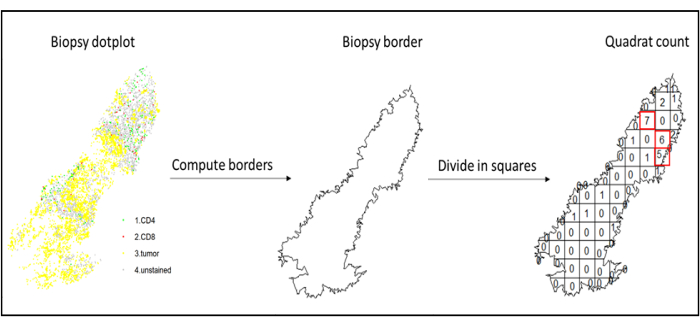
الشكل 7: رسم توضيحي للعد التربيعي. تم إجراء حساب الحدود و quadratcount باستخدام حزمة spatstats. يمكن استخدام المربعات الأكثر اختراقا (النقاط الساخنة) لإحصاءات المصب. CD4 باللون الأخضر ، CD8 باللون الأحمر ، والخلايا السرطانية باللون الأصفر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
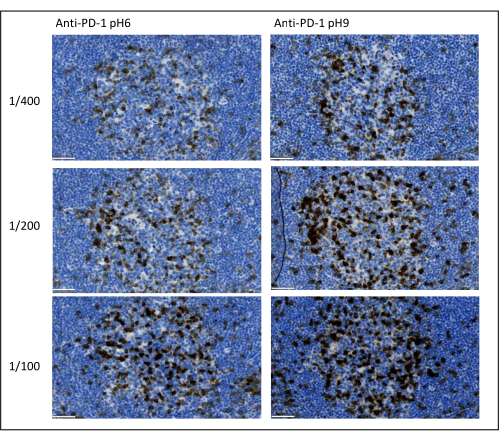
الشكل 8: تخفيف الأجسام المضادة وتحسين استرجاع مولد الضد. الكشف الكروموجيني عن PD-1 باستخدام ثلاثة تخفيفات مختلفة واثنين من حلول استرجاع المستضد المختلفة للجسم المضاد الأساسي (Citrate pH 6 و EDTA pH 9). شريط المقياس: 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
| الأجسام المضادة الأولية | التخفيف | استرجاع المستضد | الأجسام المضادة الثانوية | فلوروكروم | موضع |
| PD-1 | 1/100 | EDTA (درجة الحموضة 9) | مكافحة الأرنب | AF647 | 1 |
| PD-L1 | 1/1000 | EDTA (درجة الحموضة 9) | مكافحة الأرنب | AF488 | 2 |
| ROR-γ | 1/200 | EDTA (درجة الحموضة 9) | مضاد للماوس | ATT0-425 | 3 |
| سي دي 3 | 1/100 | سيترات (درجة الحموضة 6) | مكافحة الأرنب | AF555 | 4 |
| hPanCK | 1/50 | سيترات (درجة الحموضة 6) | مكافحة الماوس إلى جانب AF750 | 5 | |
الجدول 1: مثال على لوحة متعددة الإرسال محسنة. الاختصارات: PD-1 = بروتين موت الخلية المبرمج 1 ؛ PD-L1 = ليجند الموت المبرمج 1 ؛ ROR-γ = غاما مستقبلات يتيمة مرتبطة ب RAR ؛ CD3 = مجموعة التمايز 3 ؛ hPanCK = عموم السيتوكيراتين البشري ؛ AF = أليكسا فلور ؛ EDTA = حمض الإيثيلين ديامينيترايتيك. يستخدم CD3 للكشف عن الخلايا الليمفاوية التائية. يستخدم PD-1 للكشف عن الخلايا الليمفاوية المنهكة. يستخدم ROR- γ للكشف عن Th-17 ؛ ويستخدم hPanCK للكشف عن الخلايا السرطانية. يشير عمود الموضع إلى الترتيب الذي يجب أن يتم به تعدد الإرسال المتسلسل.
Discussion
أهم المعلمات التي يجب مراعاتها لتحسين تلطيخ تعدد الإرسال هي التخفيف والنوعية واسترجاع المستضد المستخدم لكل جسم مضاد أولي. قبل البدء في بروتوكول تعدد الإرسال ، يجب اختبار التخفيف الأمثل لكل جسم مضاد أولي واسترجاع الحواشي الأمثل (الرقم الهيدروجيني 6 أو الرقم الهيدروجيني 9) باستخدام التلوين الكروموجيني (DAB). ننصح باختبار ثلاثة تخفيفات لكل مخزن مؤقت لاسترجاع المستضد: التخفيف الذي يتم تحديده عادة من قبل العلامة التجارية التي تسوق الجسم المضاد ، ونفس التخفيف مقسم إلى شقين ، ونفس التخفيف مضاعف مرتين (الشكل 8). يعد اختيار التخفيف المناسب خطوة مهمة للغاية للتحقق من خصوصية الجسم المضاد وتحسين نسبة الإشارة إلى الضوضاء (SNR) للتلطيخ. بعد اختيار التخفيف المناسب في DAB ، يجب اختبار نفس التخفيف لكل جسم مضاد أساسي باستخدام uniplex TSA. بمجرد اختيار المخزن المؤقت للتخفيف واسترجاع الخاتمة لكل تلطيخ للمستضد ، من المهم أيضا إعداد تسلسل المضاعف بشكل صحيح ؛ على وجه التحديد ، يتم تلطيخ بعض المستضدات بشكل أفضل في الموضع الأول والبعض الآخر في الموضع الأخير. ننصح باختبار وضع العلامات المتعددة باستخدام جميع التباديل الممكنة لاختيار تلطيخ المستضد الذي يجب أن يأتي أولا وثانيا وما إلى ذلك. هذه أيضا خطوة مهمة جدا لأن بعض المستضدات الهشة يمكن أن تتحلل بعد عدة جولات من استرجاع الحاتم ، وبعض المستضدات تكون ملطخة بشكل أفضل بعد عدة جولات من استرجاع الحاتمة. على سبيل المثال ، يكون SNR دائما أعلى في الموضع الأخير ل CD3 وفي الموضع الأول لتلطيخ PD-1. علاوة على ذلك ، يمكن إعاقة تلطيخ العديد من المستضدات الموضعية المشتركة من خلال تأثير مظلة (تشبع المواقع التفاعلية للتيراميد). يمكن تخفيف ذلك عن طريق تقليل تركيز التيراميد. عندما يكون تعبير أحد المستضدات مشروطا بتعبير مستضد آخر (CD8 موجود فقط على الخلايا التائية المعبرة عن CD3) ، فإننا ننصح بتلطيخ المستضد بأوسع تعبير (CD3 في هذه الحالة) بعد الآخر. أخيرا ، يعد اختيار الفلوروكروم المناسب لكل تلطيخ للمستضد وفقا لخصائص الماسح الضوئي خطوة مهمة أيضا لتجنب الكشف المتبادل.
المزايا الرئيسية لهذه التقنية هي التضخيم ونسبة الإشارة إلى الضوضاء التي تم الحصول عليها. ومع ذلك ، تأتي هذه التقنية مع قيود ، وهي أن التلوين متسلسل ، وأن الفلوروكرومات مرتبطة تساهميا بالأنسجة. ومع ذلك ، بعد إجراء جميع جولات تضخيم إشارة التيراميد ، من الممكن أيضا إضافة تلطيخ أخير بجسم مضاد ثانوي مقترن مباشرة بالفلوروكروم (بدون TSA). في بعض اللوحات ، استخدمنا هذه الطريقة لإضافة تلطيخ في قناة 750. كان هذا ضروريا لأنه لم يكن هناك تيراميد-AF750 متاحا تجاريا في ذلك الوقت. من الجدير بالذكر أن وقت التعرض (أثناء الفحص) للمستضد الملطخ ب AF750 سيكون أطول بكثير من المستضدات الأخرى الملطخة ب TSA. في هذه الحالة ، ننصح بتلطيخ بروتين عالي التعبير مثل السيتوكيراتين أو زيادة تركيز الجسم المضاد الأساسي. من خلال القيام بذلك ، من الممكن تلطيخ ما يصل إلى خمسة إلى ستة مستضدات كحد أقصى لكل شريحة في دفعة واحدة اعتمادا على الماسح الضوئي الفلوري.
في المقابل ، تستخدم العديد من التقنيات المتاحة تجاريا تلطيخا تسلسليا بعدة جولات من التلوين والمسح والتجريد أو التبييض الضوئي لتحسين عدد المستضدات التي يمكن تلطيخها في قسم واحد من الأنسجة. ومع ذلك ، غالبا ما تستغرق هذه التقنيات وقتا طويلا ، ومكلفة ، ولا تحتوي على تضخيم للإشارة ، وتتطلب خطوات حسابية متقدمة لدمج عمليات المسح التسلسلي بشكل صحيح ، وفي تجربتنا ، يمكن أن تؤدي إلى تلف الأنسجة الذي لا رجعة فيه بسبب خطوات الإجراء العديدة. ومع ذلك ، فقد تم الإبلاغ عن أنه يمكن تلطيخ ما يصل إلى 30 مستضدا على نسيج واحد باستخدام هذه الطريقة14.
في الختام ، طريقتنا هي تقنية قوية وقابلة للتكرار وسهلة الاستخدام وفعالة من حيث التكلفة يمكن استخدامها في أي مختبر يمتلك ماسح ضوئي للشرائح الفلورية. يمكن استخدام أي جسم مضاد أولي تجاري مناسب للمدينة العالمية للخدمات الإنسانية ، والألواح ليست خاصة بأي مجموعات تجارية. يمكن إجراء تحليل الصور على عدة برامج مختلفة ، بما في ذلك البرامج مفتوحة المصدر مثل QuPath و R. ومع ذلك ، نعتقد أنه يمكن تحسين هذه الطريقة في المستقبل لألواح المستضد الكبيرة ، مما يسمح بإجراء تلطيخ / مسح تسلسلي لنفس الشريحة بألواح مختلفة من المستضدات ومع ميزة تضخيم الإشارة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
يود المؤلفون أن يشكروا الدكتورة دروان ف. على مساعدتها ودعمها. نيكولاس هويغي هو زميل باحث مدعوم بمنحة من الصندوق الوطني البلجيكي للبحث العلمي (Télévie / FNRS 7460918F).
Materials
| Name | Company | Catalog Number | Comments |
| anti-CD3 primary antibody | Abcam | ab16669 | rabbit monocolonal |
| anti-CD8 primary antibody | DAKO | M710301 | mouse monoclonal |
| anti-hPanCK primary antibody | DAKO | M3515 | mouse monoclonal |
| anti-PD-1 primary antibody | Cell Signalling | D4W2J | rabbit monocolonal |
| anti-PD-L1 primary antibody | Cell Signalling | 13684 | rabbit monocolonal |
| anti-RORC primary antibody | Sigma | MABF81 | mouse monoclonal |
| ATTO-425 | ATTOtec | ||
| Axioscan Z1 | Zeiss | Light source: Colibri 7 (385, 430, 475, 555, 590, 630, 735 nm) Filtersets: Excitation 379/34 – beam splitter 409 – emission 440/40; Excitation 438/24 – beam splitter 458 – emission 483/32; Excitation 490/20 – beam splitter 505 – emission 525/20; Excitation 546/10 – beam splitter 556 – emission 572/23; Excitation 592/21 – beam splitter 610 – emission 630/30; Excitation 635/18 – beam splitter 652 – emission 680/42; Excitation 735/40 – beam splitter QBS 405 + 493 + 611 + 762 - emission QBP 425/30 + 524/51 + 634/38 + 785/38; Objective: Plan-Apochromat 20x/0.8; Camera : Orca Flash 4.0 V3 | |
| Borosilicate Cover Glass | VWR | 631-0146 | |
| Envision+ anti-mouse | DAKO | K4001 | |
| Envision+ anti-rabbit | DAKO | K4003 | |
| Fluorescence mounting medium | DAKO | S3023 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 750 | ThermoFischer | A-21037 | |
| HALO software | Indicalabs | ||
| Hoescht | Sigma | 14533 | |
| Superfrost plus microscope slides | Fisherscientific/Epredia | 10149870 | |
| Tyramide-AF488 | ThermoFischer | B40953 | |
| Tyramide-AF555 | ThermoFischer | B04955 | |
| Tyramide-AF647 | ThermoFischer | B04958 |
References
- Ge, P., et al. Profiles of immune cell infiltration and immune-related genes in the tumor microenvironment of colorectal cancer. Biomedicine & Pharmacotherapy. 118, 109228 (2019).
- Fridman, W. H. The immune microenvironment as a guide for cancer therapies. Oncoimmunology. 1 (3), 261-262 (2012).
- Fridman, W. H., Pages, F., Sautes-Fridman, C., Galon, J. The immune contexture in human tumours: Impact on clinical outcome. in Nature Reviews. Cancer. 12 (4), 298-306 (2012).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Calu, V., et al. Key biomarkers within the colorectal cancer related inflammatory microenvironment. Scientific Reports. 11 (1), 7940 (2021).
- Havel, J. J., Chowell, D., Chan, T. A. The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy. Nature Reviews. Cancer. 19 (3), 133-150 (2019).
- Pages, F., et al. International validation of the consensus Immunoscore for the classification of colon cancer: a prognostic and accuracy study. Lancet. 391 (10135), 2128-2139 (2018).
- Mlecnik, B., et al. Integrative analyses of colorectal cancer show immunoscore is a stronger predictor of patient survival than microsatellite instability. Immunity. 44 (3), 698-711 (2016).
- Gu, Z., Eils, R., Schlesner, M. Complex heatmaps reveal patterns and correlations in multidimensional genomic data. Bioinformatics. 32 (18), 2847-2849 (2016).
- Baddeley, A., Rubak, E., Turner, R. . Spatial Point Patterns: Methodology and Applications with R. , (2022).
- Barua, S., et al. Spatial interaction of tumor cells and regulatory T cells correlates with survival in non-small cell lung cancer. Lung Cancer. 117, 73-79 (2018).
- Parra, E. R. Methods to determine and analyze the cellular spatial distribution extracted from multiplex immunofluorescence data to understand the tumor microenvironment. Frontiers in Molecular Biosciences. 8, 668340 (2021).
- El Sissy, C., et al. A diagnostic biopsy-adapted immunoscore predicts response to neoadjuvant treatment and selects patients with rectal cancer eligible for a watch-and-wait strategy. Clinical Cancer Research. 26 (19), 5198-5207 (2020).
- Bolognesi, M. M., et al. Multiplex staining by sequential immunostaining and antibody removal on routine tissue sections. The Journal of Histochemistry and Cytochemistry. 65 (8), 431-444 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved