A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ثقافة مجمعة غير مجزأة لعضلات الهيكل العظمي للفأر لتلخيص هدوء الخلايا الجذعية المتخصصة
* These authors contributed equally
In This Article
Summary
تتكون العضلات الهيكلية من أنواع متعددة من الخلايا، بما في ذلك الخلايا الجذعية المقيمة، ولكل منها مساهمة خاصة في الاتزان الداخلي للعضلات وتجديدها. هنا ، يتم وصف ثقافة 2D للخلايا الجذعية العضلية ومكانة الخلايا العضلية في بيئة خارج الجسم الحي تحافظ على العديد من الخصائص الفسيولوجية والحيوية والبيئية.
Abstract
العضلات الهيكلية هي أكبر نسيج في الجسم وتؤدي وظائف متعددة ، من الحركة إلى التحكم في درجة حرارة الجسم. تعتمد وظائفها والتعافي من الإصابات على العديد من أنواع الخلايا وعلى الإشارات الجزيئية بين خلايا العضلات الأساسية (الألياف العضلية والخلايا الجذعية العضلية) ومكانتها. لا تحافظ معظم الإعدادات التجريبية على هذه البيئة المكروية الفسيولوجية المعقدة ، كما أنها لا تسمح بالدراسة خارج الجسم الحي للخلايا الجذعية العضلية في هدوء ، وهي حالة خلوية ضرورية بالنسبة لهم. هنا ، يتم تحديد بروتوكول للثقافة خارج الجسم الحي للخلايا الجذعية العضلية مع المكونات الخلوية لمكانتها. من خلال الانهيار الميكانيكي والأنزيمي للعضلات ، يتم الحصول على مزيج من أنواع الخلايا ، والتي يتم وضعها في ثقافة 2D. يظهر التلوين المناعي أنه في غضون أسبوع 1 ، توجد خلايا متخصصة متعددة في الثقافة جنبا إلى جنب مع الألياف العضلية ، والأهم من ذلك ، الخلايا الإيجابية Pax7 التي تعرض خصائص الخلايا الجذعية العضلية الهادئة. هذه الخصائص الفريدة تجعل هذا البروتوكول أداة قوية لتضخيم الخلايا وتوليد خلايا جذعية شبيهة بالهدوء يمكن استخدامها لمعالجة الأسئلة الأساسية والانتقالية.
Introduction
تعتمد الحركة والتنفس والتمثيل الغذائي ووضعية الجسم والحفاظ على درجة حرارة الجسم على العضلات الهيكلية ، وبالتالي يمكن أن تسبب الأعطال في العضلات الهيكلية أمراضا منهكة (مثل اعتلالات العضلات وضمور العضلات وما إلى ذلك) 1. نظرا لوظائفها الأساسية ووفرتها ، جذبت العضلات الهيكلية انتباه مختبرات الأبحاث في جميع أنحاء العالم التي تسعى جاهدة لفهم الجوانب الرئيسية التي تدعم وظيفة العضلات الطبيعية ويمكن أن تكون بمثابة أهداف علاجية. بالإضافة إلى ذلك ، تعد العضلات الهيكلية نموذجا يستخدم على نطاق واسع لدراسة التجدد ووظيفة الخلايا الجذعية ، حيث يمكن للعضلات السليمة إصلاح ذاتي بالكامل بعد الإصابة الكاملة والانحطاط ، ويرجع ذلك في الغالب إلى الخلايا الجذعية المقيمة2 ؛ وتسمى هذه أيضا خلايا الأقمار الصناعية ويتم توطينها تحت الصفيحة القاعدية في محيط ألياف العضلات3.
الخلايا الأساسية للعضلات الهيكلية البالغة هي الألياف العضلية (الخلايا متعددة النوى المخلوية الطويلة) والخلايا الساتلية (الخلايا الجذعية ذات الإمكانات العضلية التي تكون هادئة حتى تنشطها الإصابة). الخلايا الأخيرة هي الخلايا المركزية لتجديد العضلات ، ولا يمكن أن تحدث هذه العملية في غيابها4،5،6،7. في بيئتها المكروية المباشرة ، هناك أنواع متعددة من الخلايا والعوامل الجزيئية التي تشير إليها. يتم تأسيس هذا المكان تدريجيا طوال فترة التطوير وحتى سنالبلوغ 8. تحتوي العضلات البالغة على أنواع متعددة من الخلايا (الخلايا البطانية ، الخلايا المحيطة ، الضامة ، السلف الليفي الدهني - FAPs ، الخلايا التائية التنظيمية ، إلخ.) 9،10 ومكونات مصفوفة خارج الخلية (اللامينين ، الكولاجين ، الفبرونيكتين ، الفيبريلين ، السمحاق ، إلخ.) 11 التي تتفاعل مع بعضها البعض ومع الخلايا الساتلية في سياق الصحة والمرض والتجديد.
يعد الحفاظ على هذا المكان المعقد في البيئات التجريبية أمرا أساسيا ولكنه يمثل تحديا. بنفس القدر من الصعوبة هو الحفاظ على الهدوء أو العودة إليه ، وهي حالة خلوية ضرورية لخلايا الأقمار الصناعية9. تم إدخال عدة طرق لمعالجة هذه التحديات جزئيا ، ولكل منها مزاياها وعيوبها (مفصلة في قسم المناقشة). هنا ، يتم تقديم طريقة يمكنها التغلب جزئيا على هذين الحاجزين. يتم حصاد العضلات في البداية ثم تكسيرها ميكانيكيا وإنزيميا قبل وضع خليط الخلايا غير المتجانسة في الثقافة. على مدار المزرعة ، يتم الكشف عن العديد من أنواع الخلايا المتخصصة ، ويتم ملاحظة خلايا الأقمار الصناعية التي عادت إلى الهدوء. كخطوة أخيرة من البروتوكول ، يتم تقديم خطوات التألق المناعي التي تسمح باكتشاف كل نوع من الخلايا من خلال استخدام علامات مقبولة عالميا.
Access restricted. Please log in or start a trial to view this content.
Protocol
امتثلت جميع التجارب للوائح الحيوانية الفرنسية والاتحاد الأوروبي في معهد موندور للبحوث الطبية الحيوية (INSERM U955) ، ولا سيما التوجيه 2010/63 / UE. تم الاحتفاظ بالحيوانات في بيئة خاضعة للرقابة وغنية في مرافق الحيوانات بأرقام الشهادات A94 028 379 و D94-028-028 ؛ تم التعامل معها فقط من قبل الباحثين المعتمدين والقائمين على رعاية الحيوانات ، وتم فحصها بصريا من قبل موظفي إسكان الحيوانات بحثا عن علامات عدم الراحة خلال حياتهم. تم القتل الرحيم عن طريق خلع عنق الرحم قبل التشريح. لم يتم تنفيذ أي إجراءات تدخلية خلال حياة الحيوانات. وبالتالي، لم يكن من الضروري الحصول على الموافقة على الإجراء من لجنة الأخلاقيات ووزارة التعليم العالي والبحث والابتكار الفرنسية. في الواقع ، لا يلزم الحصول على تصريح أخلاقي للقتل الرحيم والتشريح بعد الوفاة وفقا للتوجيه 2010/63 / UE. النتائج المقدمة في هذه المخطوطة مأخوذة من خط C57BL / 6NRj من النوع البري (انظر جدول المواد) والخط المعدل وراثيا Tg: Pax7-nGFP 12 (الذي تم تربيته بواسطة فريقنا). تم تطبيق البروتوكول على الفئران الذكور والإناث الذين تتراوح أعمارهم بين 8-12 أسبوعا.
1. الكاشف وإعداد المعدات قبل الهضم
- رش أدوات التشريح (مقص مستقيم ومنحني ، ملقط ، انظر جدول المواد) بنسبة 70٪ إيثانول ، وجففها بالورق. قم بتغطية طبق الفلين بورق الألمنيوم ، واحتفظ بأطباق بتري 10 سم (واحدة لكل) في مكان قريب. احصل على ورق و 70٪ إيثانول في متناول اليد.
ملاحظة: في نهاية التشريح ، اشطف أدوات التشريح بالماء ، ثم رشها بنسبة 70٪ من الإيثانول ، وجففها بالورق. - اضبط حمام مائي دوار على 37 درجة مئوية ، وقم بإعداد مزيج الهضم (20 مل /) عن طريق الجمع بين DMEM مع 1٪ بنسلين - ستربتومايسين ، 0.5 وحدة / مل كولاجيناز ، 3 وحدة / مل ديسباز (انظر جدول المواد) ، و 0.2٪ BSA في أنبوب (أنابيب) سعة 50 مل.
- مرر مزيج الهضم من خلال مرشح 0.22 ميكرومتر في غطاء زراعة الخلايا.
ملاحظة: يوصى بإعداد مزيج الهضم طازجا في كل مرة.
2. إعداد الكاشف والمعدات بعد الهضم
- بعد الهضم ، يمكن تجميد المزيج أو استزراعه. للتجميد ، تحضير 10٪ DMSO: 90٪ مصل بقري جنيني (FBS) ، بالإضافة إلى مجموعة من أنابيب التبريد (1 مل من معلق الخلية لكل 2 مل من أنبوب التبريد). للاستزراع ، قم بإعداد وسط الاستزراع (DMEM المكمل ب 1٪ بنسلين - ستربتومايسين ، 4 نانوغرام / مل bFGF ، و 20٪ FBS) ومجموعة من 8 ألواح جيدة. يجب طلاء الألواح قبل طلاء الخلايا (يتم توفير التفاصيل في الخطوة 7.1).
- للتلطيخ ، قم بإعداد 4٪ بارافورمالدهايد (PFA) في محلول ملحي مخزن بالفوسفات (PBS) (0.15 مل / بئر من الصفيحة المكونة من 8 آبار) ومحلول مانع (5٪ ألبومين مصل بقري خال من IgG [BSA] في PBS ؛ 0.15 مل / بئر من لوحة 8 آبار).
تنبيه: لا تتنفس مسحوق PFA. إعداده والتعامل معه تحت غطاء كيميائي.
3. تشريح
- رش الحيوان القتل الرحيم مع 70 ٪ من الإيثانول. قم بعمل شق أفقي (الجانب الأيسر من الجسم إلى الجانب الأيمن) بمقص كبير على مستوى البطن ، وقطعه حول الخصر. اسحب الجلد من الأطراف الخلفية للكشف عن العضلات (الشكل 1 أ).
- ضع الحيوان على صفيحة الفلين المغطاة بورق الألمنيوم ، وقم بتثبيت الطرف الأمامي والخلفي المقابلين. قم بإزالة جميع عضلات الأطراف الخلفية بسرعة (من الأمام والخلف) إلى طبق بتري 10 سم يوضع على الجليد (الشكل 1B ، C). توخ الحذر بشكل خاص لإزالة الأنسجة الدهنية من المناطق المحيطة بعضلات الفخذ والعضلات الخلفية. يمكن أيضا إزالة اللفافة والأعصاب والأوتار في هذه المرحلة إذا كان هذا لا يضر بالوقت الإجمالي الذي يقضيه في التشريح.
ملاحظة: يجب أن يكون وقت التشريح الأمثل لكل من الأطراف الخلفية حوالي 15-20 دقيقة. ينصح بأن وقت التشريح لا يتجاوز 30 دقيقة. - أضف قطرات من DMEM إلى العضلات من حين لآخر للحفاظ على رطوبتها ، ولكن ليس كثيرا ، لأن هذا سيجعل التقطيع صعبا. كرر للطرف الخلفي الآخر. بمجرد أن تكون جميع عضلات واحد في طبق بتري (الشكل 1 د) ، اقطعها جيدا بالمقص لمدة 7-10 دقائق للحصول على تجانس سلس (الشكل 1 ه).
ملاحظة: في هذا البروتوكول ، يتم استخدام DMEM المكمل ب L-glutamine و pyruvate و 4.5 جم / لتر D-glucose.
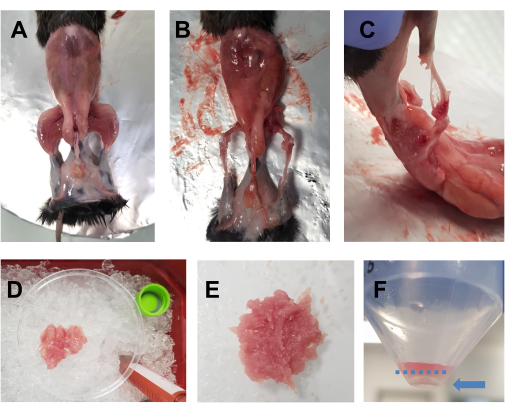
الشكل 1: تحضير العضلات قبل الاستزراع. (أ) تتم إزالة الجلد للكشف عن عضلات الأطراف الخلفية، كما هو موضح في الخطوة 3.1. (ب، ج) يتم حصاد جميع عضلات الأطراف الخلفية (B) حولها و (C) بين العظام ، كما هو موضح في الخطوة 3.2. (د) توضع العضلات المحصودة في طبق بتري طوله ١٠ سم على الثلج مع قطرات DMEM للحفاظ على رطوبتها، كما هو موضح في الخطوة 3.3. (ه) تقطع العضلات جيدا بالمقص حتى يتم الحصول على عجينة ناعمة بالقوام الموضح في هذه الصورة. (و) صورة للحبيبات بعد الطرد المركزي النهائي؛ يبرز السهم الأزرق الحبيبات ، التي تقع مقابل الأنبوب ، أسفل الخط الأزرق المتقطع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. الهضم
ملاحظة: في نهاية عملية الهضم ، هناك حاجة إلى جهاز طرد مركزي عند 4 درجات مئوية ، ودلو من الثلج ، وثلاث مصافي خلايا (100 ميكرومتر ، 70 ميكرومتر ، 40 ميكرومتر) ، وثلاثة أنابيب سعة 50 مل (لكل) للقسم 5.
- قم بإعداد وتصفية مزيج الهضم كما هو موضح في الخطوة 1.2. الحفاظ على المزيج على الجليد.
- بمجرد تقطيع جميع العضلات ، ضع التجانس في أنبوب سعة 50 مل مع 20 مل من مزيج الهضم. لف حواف الغطاء بغشاء مرن لمنع التسرب ، وضع الأنبوب في حمام مائي يهتز 37 درجة مئوية بسرعة منخفضة إلى متوسطة (50 دورة في الدقيقة).
- بعد 1 ساعة عند 37 درجة مئوية ، افتح الغطاء واخلطه عن طريق سحب الإصبع برفق سبع مرات لأعلى ولأسفل باستخدام ماصة سعة 10 مل للحصول على مزيج متجانس. ضع فيلما جديدا حول الغطاء ، وضعه مرة أخرى في حمام مائي يهتز. بعد 1 ساعة ، قم بإزالة الأنبوب وإيقاف تشغيل الحمام.
ملاحظة: بالنسبة للاستزراع ، استخدم وقت الحضانة هذا لتغطية الأطباق كما هو موضح في الخطوة 7.1 قبل الانتقال إلى القسم 5.
5. الترشيح
- املأ أنبوب الهضم ب DMEM البارد (مكمل ب 1٪ بنسلين - ستربتومايسين) حتى 50 مل. تخلط عن طريق قلب الأنبوب ثلاث مرات. احتفظ ب DMEM في دلو ثلج للخطوات التالية.
- ضع مصفاة خلية 100 ميكرومتر على أنبوب جديد سعة 50 مل. مرر المزيج المهضوم عبر مصفاة الخلية إلى الأنبوب الجديد. جهاز طرد مركزي عند 600 × جم لمدة 5 دقائق عند 4 درجات مئوية. اسكب المادة الطافية في حاوية نفايات سائلة.
- إعادة تعليق بيليه في 1 مل من DMEM الباردة (تستكمل مع 1 ٪ البنسلين الستربتومايسين). املأ الأنبوب حتى 50 مل بنفس DMEM. ملاحظة: إذا تم تخطي جهاز الطرد المركزي ، فسيكون من الصعب تحديد الحبيبات التالية وصيانتها.
- ضع مصفاة خلية 70 ميكرومتر على أنبوب جديد سعة 50 مل. مرر المزيج بالطرد المركزي / المعاد تعليقه عبر مصفاة الخلية إلى الأنبوب الجديد. أجهزة الطرد المركزي عند 80 × جم لمدة 5 دقائق عند 4 درجات مئوية.
ملاحظة: هذه الخطوة ليست إلزامية ولكن يوصى بها للتخلص من حطام الخلايا. - ضع مصفاة خلية 40 ميكرومتر على أنبوب جديد سعة 50 مل. مرر المادة الطافية عبر مصفاة الخلية إلى الأنبوب الجديد. أجهزة الطرد المركزي عند 600 × جم لمدة 5 دقائق عند 4 درجات مئوية ، صب المادة الطافية في حاوية نفايات سائلة ، وأعد تعليق الحبيبات في FBS تحت غطاء الاستزراع. الحبيبات صغيرة جدا في هذه الخطوة (الشكل 1F).
ملاحظة: التصفية من خلال مصفاة 40 ميكرومتر تزيل الحطام ، مما يعطي إشارة غير محددة في تلطيخ الثقافات في وقت لاحق.
6. (اختياري) تجميد
ملاحظة: القسم 6 اختياري. يمكن إيقاف البروتوكول مؤقتا بعد التصفية ، ولكن هذا يمكن أن يقلل من بقاء الخلية ونجاح الثقافة.
- أضف DMSO للحصول على 10٪ DMSO: 90٪ نسبة FBS ، وانقلها إلى أنابيب التبريد (1 مل من الحبيبات المعلقة لكل 2 مل من أنبوب التبريد).
- ضع أنبوب التبريد عند -80 درجة مئوية في صندوق بوليسترين طوال الليل. انتقل إلى -150 درجة مئوية في اليوم التالي للتخزين طويل الأجل.
ملاحظة: التخزين قصير الأجل عند -80 درجة مئوية ممكن أيضا. - عند بدء المزرعة ، قم بإذابة أنبوب التبريد بسرعة في حمام مائي بدرجة حرارة 37 درجة مئوية حتى يذوب تعليق الخلية. امزجه مع 4 مل من DMEM تحت غطاء الثقافة. تدور عند 600 × جم لمدة 5 دقائق عند 4 درجات مئوية. ماصة من المادة الطافية، وتابع كما هو موضح في الخطوة 7.2.
7. الثقافة
ملاحظة: من المتوقع أن تملأ معلقات الخلايا المجمدة أو الطازجة 24-32 بئرا من ثلاثة إلى أربعة ألواح من 8 آبار.
- قم بتغطية ألواح 8 آبار بمحلول الطلاء ، والذي يجب إذابته عند 4 درجات مئوية أو على الجليد (عادة ما يتم الاحتفاظ بمحلول طلاء المخزون عند -20 درجة مئوية). أضف 0.4 مل من محلول الطلاء إلى بئر واحد ، وقم بسحبه من بئر إلى بئر. بعد نقل محلول الطلاء عبر جميع الآبار ، يمكن تجميعه وإعادة تجميده للثقافات المستقبلية. احتفظ بالألواح المطلية عند 37 درجة مئوية لمدة 30 دقيقة قبل طلاء الخلايا.
- أضف DMEM (مكمل ب 1٪ بنسلين - ستربتومايسين) مكمل ب 4 نانوغرام / مل bFGF (انظر جدول المواد) إلى معلق خلية FBS للحصول على نسبة FBS 20٪: 80٪ DMEM.
ملاحظة: على الرغم من أن إضافة bFGF يمكن أن تكون مفيدة في ثقافات الخلايا العضلية الأولية وفي إنتاج الخلايا الشبيهة بالأقمار الصناعية في الثقافات السائبة ، إلا أن إضافتها اختيارية ، حيث أن حذفها في الثقافات السائبة ~ 7 أيام لا يضر بشدة بإنتاجية الخلية. - لوحة 0.4 مل من التعليق لكل بئر (من الخطوة 7.2) في الألواح المطلية ذات 8 آبار.
ملاحظة: احسب 30 سم2 من الاستزراع لكل للمستحضرات المجمدة والطازجة. - احتضان الثقافات عند 37 درجة مئوية مع 5٪ CO2 لمدة تصل إلى 10 أيام ، وتغيير الوسط كل يوم بعد أن تبدأ الثقافة في التغيير إلى لون مصفر (عادة 5-7 أيام).
ملاحظة: لتحديد كمية الخلايا في المرحلة S من دورة الخلية13 ، أضف 10 μM EdU 2 h قبل التثبيت. لالتقاط المرحلة S الأولى ، أضف 10 ميكرومتر EdU من الطلاء ، وقم بالتثبيت عند 40 ساعة من الثقافة.
8. التثبيت
ملاحظة: يجب إجراء الأقسام 8-10 في درجة حرارة الغرفة ما لم ينص على خلاف ذلك.
- ماصة خارج وسط الاستزراع ، وإصلاح الخلايا مع 4 ٪ PFA (0.15 مل / بئر).
تنبيه: أضف PFA تحت غطاء كيميائي.
ملاحظة: إذا تم إصلاح جميع الآبار في نفس الوقت ، فقم باحتضانها مع PFA في درجة حرارة الغرفة لمدة 10 دقائق. إذا تم إصلاح الآبار في نقاط زمنية مختلفة ، أضف PFA إلى الآبار المراد إصلاحها ، واحتفظ باللوحة في الحاضنة عند 37 درجة مئوية لمدة 5 دقائق. - ماصة خارج PFA ، وإضافة PBS لمدة 10 ثوان (0.15 مل / بئر). ماصة خارج PBS ، وإضافة PBS جديدة لمدة 5 دقائق (0.15 مل / بئر).
ملاحظة: إذا تم إصلاح جميع الآبار في نفس الوقت ، فقم باحتضانها باستخدام برنامج تلفزيوني في درجة حرارة الغرفة. إذا تم إصلاح الآبار في نقاط زمنية مختلفة ، أضف PBS إلى الآبار الثابتة ، واحتفظ باللوحة في الحاضنة عند 37 درجة مئوية لمدة 5 دقائق. ثم ، أضف 0.4 مل من PBS ، واحتفظ باللوحة في الحاضنة لمدة تصل إلى 1 أسبوع.
9. النفاذية والحجب
- عندما تكون جاهزا للبقع ، قم بإخراج PBS ، وتخلل بنسبة 0.5٪ TritonX 100 في PBS (0.15 مل / بئر) لمدة 8 دقائق. ماصة من TritonX 100 ، شطف مع PBS لمدة 10 ثوان (0.15 مل / بئر) ، ماصة خارج PBS ، واغسل مع PBS لمدة 5 دقائق (0.15 مل / بئر).
- كتلة مع 5٪ خالية من IgG BSA في PBS لمدة 30-60 دقيقة (0.15 مل / بئر).
10. تلطيخ
- قم بسحب BSA ، وأضف مزيج الأجسام المضادة الأساسي المخفف في PBS (0.15 مل / بئر) (انظر جدول المواد ؛ التخفيفات: مضاد CD31 1: 100 ، مضاد FOSB 1: 200 ، مضاد GFP 1: 1000 ، مضاد KI67 1: 1000 ، مضاد MyHC 1: 400 ، مضاد MYOD 1: 200 ، مضاد MYOG 1: 150 ، مضاد PAX7 1: 100 ، مضاد PDGFRa 1:50) للحضانة الليلية عند 4 درجات مئوية.
ملاحظة: بعد حضانة الأجسام المضادة ، اجمع مزيج الأجسام المضادة ، وأضف أزيد الصوديوم ، واحفظه عند 4 درجات مئوية أو -20 درجة مئوية (وفقا لتعليمات الشركة المصنعة للأجسام المضادة) لإعادة استخدامها في المستقبل. - ماصة من مزيج الجسم المضاد ، وشطف مع PBS لمدة 10 ثوان (0.15 مل / جيدا) ، ماصة خارج PBS ، واغسل مع PBS لمدة 5 دقائق (0.15 مل / بئر).
- ماصة خارج الغسيل PBS ، إضافة مزيج الأجسام المضادة الثانوية (الماعز المضادة للفأر Alexa Fluor 488 ، الماعز المضادة للأرانب Alexa Fluor 555 ، الماعز المضادة للفئران Alexa Fluor 647 ، الماعز المضادة للفأر Alexa Fluor 555 ، الماعز المضادة للدجاج Alexa Fluor 488 ، وكلها تستخدم في التخفيفات من 1: 500-1000) وعلامة النواة (على سبيل المثال ، DAPI) المخففة في PBS (0.15 مل / بئر) (انظر جدول المواد) ، واحتضان لمدة 1 ساعة في درجة حرارة الغرفة ، محمية من الضوء.
- ماصة من مزيج الأجسام المضادة الثانوية ، شطف مع PBS لمدة 10 ثوان (0.15 مل / بئر) ، ماصة خارج PBS ، اغسل مع PBS لمدة 5 دقائق (0.15 مل / بئر) ، ماصة خارج PBS ، وتركيب.
ملاحظة: إذا تم استخدام 8 ألواح جيدة مع فواصل قابلة للإزالة ، فقم بإزالة الفواصل قبل التركيب.
Access restricted. Please log in or start a trial to view this content.
النتائج
يسمح هذا البروتوكول بزراعة الخلايا العضلية مع الحفاظ على الخلايا الساتلية ومعظم الخلايا من مكانتها الداخلية. يلخص الشكل 2 الخطوات الرئيسية للبروتوكول ، بينما يتم عرض الأجزاء الأساسية من التشريح والهضم في الشكل 1. يوصى بتشريح عضلات الأطراف الخلفية (
Access restricted. Please log in or start a trial to view this content.
Discussion
ترتكز وظيفة العضلات الهيكلية للبالغين على مجموعة منسقة بدقة من التفاعلات الخلوية والإشارات الجزيئية. هنا ، يتم تقديم طريقة تسمح بدراسة هذه المعلمات في بيئة خارج الجسم الحي تشبه إلى حد كبير البيئة المكروية الفسيولوجية.
أبلغت عدة مجموعات في المختبر عن طرق لزراعة ا?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
بالنسبة للشكل 2 ، تم استخدام قوالب من Servier Medical Art (https://smart.servier.com/). يتم دعم مختبر FR من قبل الجمعية الفرنسية لمكافحة الاعتلال العضلي - AFM عبر TRANSLAMUSCLE (المنح 19507 و 22946) ، ومؤسسة البحوث الطبية - FRM (EQU202003010217 ، ENV202004011730 ، ECO201806006793) ، الوكالة الوطنية للبحوث - ANR (ANR-21-CE13-0006-02 ، ANR-19-CE13-0010 ، ANR-10-LABX-73) ، والرابطة الوطنية لمكافحة السرطان (IP / SC-17130). لم يكن للممولين المذكورين أعلاه أي دور في تصميم أو جمع أو تحليل أو تفسير أو الإبلاغ عن هذه الدراسة أو كتابة هذه المخطوطة.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| anti-CD31 | BD | 550274 | dilution 1:100 |
| anti-FOSB | Santa Cruz | sc-7203 | dilution 1:200 |
| anti-GFP | Abcam | ab13970 | dilution 1:1000 |
| anti-Ki67 | Abcam | ab16667 | dilution 1:1000 |
| anti-MyHC | DSHB | MF20-c | dilution 1:400 |
| anti-MYOD | Active Motif | 39991 | dilution 1:200 |
| anti-MYOG | Santa Cruz | sc-576 | dilution 1:150 |
| anti-Pax7 | Santa Cruz | sc-81648 | dilution 1:100 |
| anti-PDGFRα | Invitrogen | PA5-16571 | dilution 1:50 |
| b-FGF | Peprotech | 450-33 | concentration 4 ng/mL |
| Bovine serum albumin (BSA) – used for digestion | Sigma Aldrich | A7906-1006 | concentration 0.2% |
| BSA IgG-free, protease-free – used for staining | Jackson ImmunoResearch | 001-000-162 | concentration 5% |
| Cell strainer 40 um | Dominique Dutscher | 352340 | |
| Cell strainer 70 um | Dominique Dutscher | 352350 | |
| Cell strainer 100 um | Dominique Dutscher | 352360 | |
| Collagenase | Roche | 10103586001 | concentration 0.5 U/mL |
| Culture plate | Sarstedt | 94.6140.802 | |
| Dimethyl sulfoxide (DMSO) | Euromedex | UD8050-05-A | |
| Dispase | Roche | 4942078001 | concentration 3 U/mL |
| Dissection forceps size 5 | Fine Science Tools | 91150-20 | |
| Dissection forceps size 55 | Fine Science Tools | 11295-51 | |
| Dissection scissors (big, straight) | Fine Science Tools | 9146-11 | ideal for chopping |
| Dissection scissors (small, curved) | Fine Science Tools | 15017-10 | |
| Dissection scissors (small, straight) | Fine Science Tools | 14084-08 | |
| Dulbecco's Modified Eagle's Medium (DMEM) | ThermoFisher | 41966-029 | |
| EdU Click-iT kit | ThermoFisher | C10340 | |
| Fetal bovine serum – option 1 | Eurobio | CVF00-01 | |
| Fetal bovine serum – option 2 | Gibco | 10270-106 | |
| Matrigel | Corning Life Sciences | 354234 | coating solution |
| Parafilm | Dominique Dutscher | 090261 | flexible film |
| Paraformaldehyde – option 1 | PanReac AppliChem ITW Reagents | 211511.1209 | concentration 4% |
| Paraformaldeyde – option 2 | ThermoFisher | 28908 | concentration 4% |
| Penicillin streptomycin | Gibco | 15140-122 | |
| Shaking water bath | ThermoFisher | TSSWB27 | |
| TritonX100 | Sigma Aldrich | T8532-500 ML | concentration 0.5% |
| Wild-type mice | Janvier | C57BL/6NRj |
References
- Frontera, W. R., Ochala, J. Skeletal muscle: A brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Forcina, L., Cosentino, M., Musarò, A. Mechanisms regulating muscle regeneration: Insights into the interrelated and time-dependent phases of tissue healing. Cells. 9 (5), 1297(2020).
- Mauro, A. Satellite cell of skeletal muscle fibers. Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Lepper, C., Partridge, T. A., Fan, C. -M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- McCarthy, J. J., et al. Effective fiber hypertrophy in satellite cell-depleted skeletal muscle. Development. 138 (17), 3657-3666 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Hicks, M. R., Pyle, A. D. The emergence of the stem cell niche. Trends in Cell Biology. 33 (22), 112-123 (2022).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692(2021).
- Gama, J. F. G., et al. Role of regulatory T cells in skeletal muscle regeneration: A systematic review. Biomolecules. 12 (6), 817(2022).
- Loreti, M., Sacco, A. The jam session between muscle stem cells and the extracellular matrix in the tissue microenvironment. NPJ Regenerative Medicine. 7 (1), 16(2022).
- Sambasivan, R., et al. Distinct regulatory cascades govern extraocular and pharyngeal arch muscle progenitor cell fates. Developmental Cell. 16 (6), 810-821 (2009).
- Pereira, P. D., et al. Quantification of cell cycle kinetics by EdU (5-ethynyl-2'-deoxyuridine)-coupled-fluorescence-intensity analysis. Oncotarget. 8 (25), 40514-40532 (2017).
- Bismuth, K., Relaix, F. Genetic regulation of skeletal muscle development. Experimental Cell Research. 316 (18), 3081-3086 (2010).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Lertkiatmongkol, P., Liao, D., Mei, H., Hu, Y., Newman, P. J. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31). Current Opinion in Hematology. 23 (3), 253-259 (2016).
- Scholzen, T., Gerdes, J. The Ki-67 protein: From the known and the unknown. Journal of Cellular Physiology. 182 (3), 311-322 (2000).
- Abou-Khalil, R., Le Grand, F., Chazaud, B. Human and murine skeletal muscle reserve cells. Stem Cell Niche. 1035, 165-177 (2013).
- Pasut, A., Oleynik, P., Rudnicki, M. A. Isolation of muscle stem cells by fluorescence activated cell sorting cytometry. Methods in Molecular Biology. 798, 53-64 (2011).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Qu, Y., Edwards, K., Barrow, J. Isolation, culture, and use of primary murine myoblasts in small-molecule screens. STAR Protocols. 4 (2), 102149(2023).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: Background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2011).
- Saclier, M., Theret, M., Mounier, R., Chazaud, B. Effects of macrophage conditioned-medium on murine and human muscle cells: analysis of proliferation, differentiation, and fusion. Methods in Molecular Biology. 1556, 317-327 (2017).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Molecular Cell. 74 (3), 609-621 (2019).
- Tabula Muris Consortium et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Brunetti, J., Koenig, S., Monnier, A., Frieden, M. Nanopattern surface improves cultured human myotube maturation. Skeletal Muscle. 11 (1), 12(2021).
- Denes, L. T., et al. Culturing C2C12 myotubes on micromolded gelatin hydrogels accelerates myotube maturation. Skeletal Muscle. 9 (1), 17(2019).
- LaFramboise, W. A., et al. Effect of muscle origin and phenotype on satellite cell muscle-specific gene expression. Journal of Molecular and Cellular Cardiology. 35 (10), 1307-1318 (2003).
- Azhar, M., Wardhani, B. W. K., Renesteen, E. The regenerative potential of Pax3/Pax7 on skeletal muscle injury. Journal of Generic Engineering and Biotechnology. 20 (1), 143(2022).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198(2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved