القياس الكمي القائم على إزالة الخلايا للتسلل الدهني للعضلات الهيكلية
In This Article
Summary
تصف الدراسة الحالية المنهجيات القائمة على إزالة الخلايا لتصور وقياس ترسب الأنسجة الدهنية العضلية (IMAT) من خلال حجم العضلات السليم ، بالإضافة إلى قياس مقاييس الخلايا الشحمية الفردية التي تتكون منها IMAT.
Abstract
التسلل الدهني هو تراكم الخلايا الشحمية بين الألياف العضلية في العضلات الهيكلية وهو سمة بارزة للعديد من اعتلالات العضلات واضطرابات التمثيل الغذائي والضمور. سريريا في السكان البشريين ، يتم تقييم التسلل الدهني باستخدام طرق غير جراحية ، بما في ذلك التصوير المقطعي المحوسب (CT) والتصوير بالرنين المغناطيسي (MRI) والموجات فوق الصوتية (الولايات المتحدة). على الرغم من أن بعض الدراسات قد استخدمت التصوير المقطعي المحوسب أو التصوير بالرنين المغناطيسي لتحديد التسلل الدهني في عضلات الفئران ، إلا أن التكاليف والدقة المكانية غير الكافية لا تزال تمثل تحديا. تستخدم طرق الحيوانات الصغيرة الأخرى علم الأنسجة لتصور الخلايا الشحمية الفردية. ومع ذلك ، فإن هذه المنهجية تعاني من تحيز أخذ العينات في علم الأمراض غير المتجانسة. يصف هذا البروتوكول منهجية العرض النوعي والقياس الكمي للتسلل الدهني بشكل شامل في جميع أنحاء عضلة الفأر السليمة وعلى مستوى الخلايا الشحمية الفردية باستخدام إزالة الخلايا. لا يقتصر البروتوكول على عضلات معينة أو أنواع معينة ويمكن توسيعه ليشمل الخزعة البشرية. بالإضافة إلى ذلك ، يمكن إجراء تقييمات نوعية وكمية إجمالية باستخدام معدات المختبرات القياسية بتكلفة قليلة ، مما يجعل هذا الإجراء أكثر سهولة عبر مختبرات البحوث.
Introduction
يعد تراكم الخلايا الشحمية بين الألياف العضلية داخل العضلات الهيكلية سمة بارزة للحالات المتباينة ، من مرض السكري من النوع 2 إلى ساركوبينيا إلى إصابة العضلات والعظام1،2،3،4،5،6،7. يعد التقييم الشامل لهذا النسيج الدهني العضلي (IMAT) أمرا بالغ الأهمية لفهم التسبب في هذه الحالات ، حيث يرتبط ترسب IMAT ارتباطا وثيقا بمقاومة الأنسولين3،8،9،10 وضعف وظيفة العضلات الهيكلية11،12،13،14،15. وعلى الرغم من أن هذه الارتباطات قد لوحظت منذ عقود، فإن الآليات المرتبطة بالفريق ومنشأه لا تزال مجالا للتحقيق المكثف. ويرجع ذلك جزئيا إلى أن معظم الدراسات التي تقيم تسلل الدهون في العضلات الهيكلية قد أجريت على البشر ، حيث تكون التحقيقات الميكانيكية محدودة16,17. ومع ذلك ، في الآونة الأخيرة ، تم استخدام نماذج الحيوانات الصغيرة ، بما في ذلك الفئران ، للمساعدة في تحديد التنظيم الخلوي لتطوير IMAT والإشارةإلى 18،19،20. يهدف هذا العمل إلى توفير أداة جديدة للاستخدام مع النماذج الحيوانية الصغيرة لتصور نوعي وقياس تسلل الدهون في العضلات الهيكلية.
سريريا في السكان البشريين ، يتم تقييم التسلل الدهني باستخدام طرق غير جراحية ، بما في ذلك التصوير المقطعي المحوسب (CT) 6،21 ، والتصوير بالرنين المغناطيسي (MRI) 16،17،22،23 ، والموجات فوق الصوتية (الولايات المتحدة) 17،24. تحدد تقنيات التصوير هذه عادة منطقة اهتمام محددة (ROI) في العضلة وتكتسب شرائح صورة داخل تلك المنطقة ، على الرغم من استخدام مناهج شاملة أيضا25،26،27. تخضع شرائح الصور هذه للتصنيف النوعي6 ويتم قياسها كميا عبر عتبةالبكسل 28. تم استخدام أساليب مماثلة في الحيوانات سابقا29،30 ؛ ومع ذلك ، فهي مكلفة وتتطلب الوصول إلى أنظمة تصوير الحيوانات الصغيرة. يمثل الدقة المكانية عبر استخدام التصوير المقطعي المحوسب والتصوير بالرنين المغناطيسي أيضا مشكلة كبيرة ، حيث لا يمكنهم تحديد الخلايا الشحمية IMAT من ألياف العضلات الهيكلية داخل الفوكسل ويعتمدون بدلا من ذلك على الفصل الذاتي لمناطق العضلات في المقام الأول ومناطق IMAT في المقام الأول31,32. على هذا النحو ، فإن عدم القدرة على تحديد الأنسجة الدهنية أو العضلية بدقة يقدم أيضا تقديرا غير دقيق للكميات التمثيلية لهذه الأنسجة.
بسبب هذه القيود ، تعتمد التقنيات الحالية لتقييم تسلل الدهون في العضلات الهيكلية في النماذج الحيوانية الصغيرة بشكل شائع على علم الأنسجة كبديل غير مكلف ويمكن الوصول إليه33,34. تسمح إجراءات التلوين القياسية ، بما في ذلك الهيماتوكسيلين ويوزين (H&E) ، والزيت الأحمر O (ORO) ، والتلوين المناعي لعلامات الخلايا الشحمية مثل perilipin ، بالكشف والتصور البسيط للخلايا الشحمية التي تحتوي على تسلل دهني داخل العضلات. ومع ذلك، نادرا ما تكون نهج علم الأنسجة شاملة، وعادة ما يقتصر التقييم النوعي أو الكمي للمعهد الدولي للتنسيق الإداري على قسم واحد34. كما تم استخدام استخراج الدهون لتحديد إجمالي الدهون في العضلات35 ؛ ومع ذلك ، فشلت هذه التقنية في التمييز بين الدهون داخل الخلايا العضلية (IMCL) والأنسجة الدهنية العضلية (IMAT)36. باختصار ، لا تزال المنهجيات الحالية لتصور وقياس الدهون في العضلات محدودة إما بسبب التكاليف المالية أو الكشف المحدد عن IMAT.
هنا ، نصف طريقة مفصلة لتقييم تسلل الدهون في العضلات الهيكلية عن طريق التصور النوعي والقياس الكمي متعدد المقاييس. تستخدم هذه المنهجية تقنية بسيطة لإزالة الخلايا الخلوية تزيل الهياكل الخلوية العضلية ، بما في ذلك IMCL ، ولكنها تحافظ على قطرات الدهون المشتقة من الخلايا الدهنية IMAT الأكبر سليمة. تم نشر التحقق من خصوصية هذه التقنية37 ، بما في ذلك استخدام استخراج الدهون لإظهار استنفاد IMCL مع إزالة الخلايا ، μCT لإظهار الاحتفاظ بنمط IMAT مع إزالة الخلايا ، والأنسجة لإظهار توزيع الحجم المماثل لقطرات الدهون IMAT مقارنة بتلك المحددة مع إزالة الخلايا. بمجرد إزالة الخلايا ، يمكن تلطيخ العضلات بأصباغ قابلة للذوبان في الدهون من أجل التصور النوعي للنمط ومدى تسلل الدهون و / أو التصوير الكمي لقطرات الدهون IMAT الفردية. يمكن بعد ذلك استخراج الأصباغ باستخدام الأيزوبروبانول ، ويمكن استخدام الكثافة البصرية (OD) للمحلول الناتج لتقدير حجم الدهون في IMAT. تم نشر التحقق الصارم من هذه التقنية في مكان آخر37. توفر هذه المقالة بروتوكولا مفصلا لاستخدام هذه المنهجية مع عضلات الماوس وتوفر نصائح لاستكشاف الأخطاء وإصلاحها لدعم اعتماد هذه الطريقة في تطبيقات أخرى ، مثل العضلات من الأنواع الأخرى أو الأنسجة الأخرى.
Protocol
تم تنفيذ رعاية الفئران والتضحية بها وفقا لدليل المعاهد الوطنية للصحة لاستخدام ورعاية المختبر. تمت الموافقة على جميع الأعمال من قبل لجنة الدراسات الحيوانية في جامعة واشنطن في كلية سانت لويس للطب. تم استخدام ذكور الفئران C57BL / 6J الذين تتراوح أعمارهم بين 2-3 أشهر (انظر جدول المواد) لإنشاء أمثلة الصور المضمنة في هذا البروتوكول. يتم تنفيذ جميع الخطوات الموضحة أدناه في درجة حرارة الغرفة.
1. إزالة الخلايا العضلية
- تحضير محلول كبريتات دوديسيل الصوديوم بنسبة 1٪ وزن / فولت (SDS ؛ انظر جدول المواد) في محلول ملحي مخزن بالفوسفات (PBS). حرك المحلول حتى يخلط تماما.
ملاحظة: يمكن تحضير 1٪ SDS بكميات كبيرة وتخزينها في درجة حرارة الغرفة لمدة شهر واحد. - تشريح العضلات (العضلات) ذات الأهمية كما هو موضح سابقا38,39.
- كشف العضلات المثيرة للاهتمام عن طريق ترطيب الشعر والجلد بمحلول الإيثانول بنسبة 70٪ ، ثم إجراء شق عبر الجلد يبلغ حوالي 2 سم متبوعا بإزالة الجلد المغطى بالملقط والمقص الربيعي.
ملاحظة: تشمل العضلات (العضلات) ذات الأهمية هنا الظنبوب الأمامي (TA) ، والباسطة الرقمية الطويلة (EDL) ، والحجاب الحاجز. قد تقع بعض العضلات في عمق العضلات الأخرى ، مما يتطلب تشريح عضلات أخرى (على سبيل المثال ، يتطلب تشريح EDL إزالة TA). - قم بتشريح العضلات (العضلات) ذات الأهمية باستخدام مقص أو شفرات حادة (انظر جدول المواد) لضمان الحصول على كامل مدى العضلات وأن الحواف ناعمة.
ملاحظة: يتم ذلك بشكل مثالي تحت مجهر تشريح لتحسين التصور. - افحص العضلات للتأكد من عدم تضمين رقائق العظام أو الحواف الخشنة ، ثم قم بقصها بمقص حاد حسب الحاجة.
- وزن العضلات باستخدام ميزان تحليلي وتسجيل الوزن.
- كشف العضلات المثيرة للاهتمام عن طريق ترطيب الشعر والجلد بمحلول الإيثانول بنسبة 70٪ ، ثم إجراء شق عبر الجلد يبلغ حوالي 2 سم متبوعا بإزالة الجلد المغطى بالملقط والمقص الربيعي.
- ضع العضلات المشرحة في 0.1 مل على الأقل من 1٪ SDS لكل مليغرام من الوزن ؛ تعمل الألواح ذات 6 أو 12 أو 24 بئرا بشكل جيد لعضلات الفأر الحجاب الحاجز و TA و EDL ، على التوالي. الأحجام النموذجية هي 6 مل و 3 مل و 1.5 مل لألواح 6 و 12 و 24 بئرا على التوالي.
ملاحظة: يتسبب محلول SDS أحيانا في تشوه العضلات ، لذا تأكد من أن العضلات مسطحة / ممتدة عند الغمر الأولي. - ضع لوحة البئر (أو الأوعية الأخرى) على شاكر هزاز مضبوط على 50-80 هرتز.
- افحص حل SDS بصريا بشكل دوري. عندما يصبح المحلول غائما ، قم بإزالة المحلول باستخدام ماصة (مع الحرص على عدم استنشاق العضلات) واستبدله بحجم متساو من SDS الطازج بنسبة 1٪. عندما يظل المحلول واضحا لمدة 24 ساعة ، تكتمل عملية إزالة الخلايا.
ملاحظة: يختلف التردد المطلوب لتغيير المحلول حسب حجم العضلات وحجم المحلول الأولي. تحتاج العضلات الأكبر مثل TA إلى SDS جديد في غضون ساعات قليلة ، ويمكن للعضلات الأصغر مثل EDL أن تذهب بين عشية وضحاها في الحل الأصلي. - قم بإزالة محلول SDS النهائي من العضلات المنزوعة الخلايا باستخدام ماصة (مع الحرص على عدم استنشاق العضلات) واستبدله بحجم متساو من PBS.
- افحص بصريا العضلات المنزوعة الخلايا تحت مجهر تشريح واستخدم ملقط ومقص لإزالة أي شعر أو حطام عالق في العضلات.
ملاحظة: لاحظ أيضا وضوح العضلة المنزوعة الخلايا في هذه الخطوة. إذا لم تكن العضلة المنزوعة الخلايا شفافة تماما ولم يزداد حل SDS في الغيوم على مدار 24 ساعة ، فإن إزالة الخلايا لم تكن فعالة. هذا يخلق قطعة أثرية في التقييمات النوعية والكمية ، وبالتالي يجب دائما تحسين إزالة الخلايا على عينات الممارسة قبل الشروع في العضلات التجريبية. - قم بإزالة PBS بعناية ، واستبدله بحجم متساو من 3.7٪ فورمالديهايد أو 4٪ محلول بارافورمالدهايد ، وأعد اللوحة إلى شاكر هزاز لمدة 24 ساعة.
ملاحظة: تأكد من أن محلول الفورمالديهايد يغطي العضلات المنزوعة الخلايا بالكامل ، وإلا فإن التلوين سيكون غير متساو.
2. تصور IMAT مع النفط الأحمر O
- تحضير حل ORO.
- قم بإذابة 0.5 جم من مسحوق ORO (انظر جدول المواد) في 100 مل من الأيزوبروبانول لتوليد محلول مخزون.
ملاحظة: أضف حرارة لطيفة إلى المحلول ليذوب تماما. يمكن تخزين هذا المخزون في درجة حرارة الغرفة لمدة 1 شهر. - اجمع بين محلول مخزون ORO والماء منزوع الأيونات بنسبة 60:40 للحصول على محلول العمل اللازم لجميع العضلات باستخدام حجم لا يقل عن 0.1 مل / مجم من وزن العضلات. الأحجام النموذجية هي 6 مل و 3 مل و 1.5 مل لألواح 6 و 12 و 24 بئرا على التوالي.
ملاحظة: افحص محلول المخزون قبل الخلط. إذا كان محلول المخزون يحتوي على جسيمات كبيرة ، فقم بعمل مخزون طازج. - قم بتغطية محلول العمل لمدة 10 دقائق للسماح للجسيمات بالاستقرار.
- قم بتصفية محلول العمل من خلال شبكة 40 ميكرومتر ، متبوعا بمرشح حقنة 0.22 ميكرومتر.
ملاحظة: مرشح الحقنة 0.22 ميكرومتر يسد بسرعة ويجب استبداله إذا لم يتم دفع محلول العمل بسهولة.
- قم بإذابة 0.5 جم من مسحوق ORO (انظر جدول المواد) في 100 مل من الأيزوبروبانول لتوليد محلول مخزون.
- قم بإزالة محلول الفورمالديهايد أو بارافورمالدهايد واغسل العضلات المنزوعة الخلايا بثلاثة تغييرات في المحلول بحجم متساو من PBS.
- استبدل برنامج تلفزيوني بحجم متساو من محلول الأيزوبروبانول بنسبة 60٪ واحتضانه على شاكر هزاز لمدة 5 دقائق.
- استبدل محلول الأيزوبروبانول بنسبة 60٪ بمحلول عمل ORO واحتضانه على شاكر هزاز لمدة 10 دقائق.
ملاحظة: تأكد من أن محلول عمل ORO يغطي بالكامل العضلات المنزوعة الخلايا ، وإلا فإن التلوين سيكون غير متساو. - استبدل حل عمل ORO بحجم متساو قدره 1٪ SDS. افحص حل SDS بصريا بشكل دوري. عندما يصبح المحلول ورديا بشكل ملحوظ ، قم بإزالة المحلول باستخدام ماصة (مع الحرص على عدم استنشاق العضلات) واستبدله ب 1٪ SDS جديد.
- عندما يظل المحلول واضحا لمدة 24 ساعة ، استبدل 1٪ SDS ب PBS وافحص العضلات الملطخة تحت مجهر تشريح / ستيريو بتكبير 4x. قم بإزالة أي حطام أو جسيمات واضحة عالقة في الجزء الخارجي من العضلات. إذا كان هذا واسع النطاق ، يمكن لف العضلة منزوعة الخلايا برفق على منديل تنظيف لإزالة الحطام / الجسيمات.
- إذا كان التلوين مرضيا (كرات حمراء زاهية تطفو في مصفوفة شفافة) ، فاحصل على صور للتلوين حسب الرغبة باستخدام كاميرا متصلة بمجهر الاستريو (انظر جدول المواد).
ملاحظة: إذا لم يكن مجهر التشريح يحتوي على كاميرا مرفقة ، فيمكن استخدام كاميرا الهاتف لالتقاط الصور من خلال العدسة.
3. تصور قطرات الدهون IMAT مع BODIPY
ملاحظة: التصوير البؤري هو الأكثر فعالية مع العضلات رقيقة مثل EDL أو الحجاب الحاجز (~ 2 مم سمك). بدلا من ذلك ، يمكن استخدام شرائط سمك مماثلة للعضلات مثل TA.
- قم بإعداد محلول 1: 200 من BODIPY الفلوري 493/503 (انظر جدول المواد) في PBS للحصول على حجم محلول عمل لا يقل عن 0.1 مل / مجم من وزن العضلات. الأحجام النموذجية هي 6 مل و 3 مل و 1.5 مل لألواح 6 و 12 و 24 بئرا على التوالي.
- قم بإزالة الفورمالديهايد أو بارافورمالدهايد أو 1٪ SDS واغسل العضلات المنزوعة الخلايا بثلاثة تغييرات في المحلول بحجم متساو من PBS.
- استبدل PBS بمحلول العمل BODIPY واحتضنه على شاكر هزاز لمدة 20 دقيقة.
- اغسل العضلات المنزوعة الخلايا بثلاثة تغييرات في المحلول بحجم متساو من برنامج تلفزيوني.
- ضع العضلة في وعاء شفاف القاع متوافق مع المجهر متحد البؤر المتاح. من الناحية المثالية ، سيكون للطبق قاع غائر لوضع غطاء على العضلات دون تشويهها (انظر جدول المواد).
- احصل على مكدسات الصور باستخدام مجهر متحد البؤر قياسي (انظر جدول المواد) باستخدام ليزر 488. أحجام المكدس النموذجية ل EDL هي 0.5-1 مم بسمك شريحة 10 ميكرومتر ، مما ينتج عنه 50-100 صورة لكل مكدس.
ملاحظة: لتحديد الحجم الكلي للدهون ، والعدد الإجمالي لقطرات الدهون IMAT ، وأقرب مؤشر جار للتجميع ، قم بالصورة من خلال حجم العضلات بالكامل ، مع الحرص على ترك بعض التداخل لتسجيل الصورة. لتحديد متوسط حجم قطرات الدهون ، قد تكون كومة واحدة كافية. - إذا رغبت في ذلك ، قم بتلطيخ العضلات باستخدام ORO ، وفقا للقسم 2 ، للحصول على صورة مجانية للعضلات الكاملة لتوزيع IMAT.
ملاحظة: نظرا لأن BODIPY هو فلورسنت ، فلن يكون مرئيا تحت المجهر الضوئي عند الحصول على صور ORO.
4. تقدير إجمالي حجم الدهون عن طريق استخراج الدهون
- بعد الحصول على الصورة ، انقل العضلات إلى 200 ميكرولتر من الأيزوبروبانول في الآبار الفردية للوحة 96 بئرا ، أو قم بتكييف البئر / الحجم إذا كانت العضلات كبيرة جدا بحيث لا يمكن ملاءمتها.
- قم بتحريك المحلول عن طريق النقر على اللوحة ، وسحب المحلول لأعلى ولأسفل ، و / أو سحق العضلات ميكانيكيا بطرف ماصة حتى لا يمكن رؤية أي كرات حمراء / فلورية في العضلات منزوعة الخلايا تحت المجهر.
ملاحظة: عالج جميع العضلات بنفس المزيج من التنصت والماصة والسحق للحصول على أفضل موثوقية. احرص أيضا على الحد من الوقت الذي تقضيه في التنصت ، والسحب ، والسحق ، حيث سيتبخر الأيزوبروبانول بسرعة. - امزج المحلول في كل بئر عن طريق السحب لأعلى ولأسفل ، ثم انقل 75 ميكرولتر إلى بئرين نظيفين من اللوحة.
- قم بتغطية اللوحة وقراءة امتصاص الآبار المكررة سعة 75 ميكرولتر باستخدام مقياس الطيف الضوئي أو قارئ اللوحة. إذا كان البناء ملطخا ب ORO ، فاقرأ المحلول عند 500 نانومتر ؛ إذا كانت ملطخة ب BODIPY 493/503 ، اقرأ اللوحة عند 493 نانومتر.
ملاحظة: إذا كان البناء ملطخا بكل من BODIPY و ORO ، فمن المستحسن قراءة اللوحة عند 500 نانومتر ، حيث أن قراءات 500 نانومتر تعطي نتائج مماثلة بين التركيبات الملطخة ب ORO فقط و ORO بالإضافة إلى BODIPY. - اقسم قراءة الامتصاص على الوزن المسجل للعضلة إذا رغبت في تصحيح اختلافات الحجم بين العينات.
5. القياس الكمي لمقاييس قطرات الدهون IMAT من الصور متحدة البؤر
ملاحظة: يتطلب هذا القسم الوصول إلى ImageJ الإصدار 1.47 (انظر جدول المواد) أو أحدث ومهارات ImageJ الأساسية40.
- افتح مكدسات متحدة البؤر في ImageJ.
ملاحظة: قد تقوم المجاهر متحدة البؤر المختلفة بحفظ الصور متحدة البؤر بتنسيقات مختلفة. قد تتطلب ImageJ مكونا إضافيا أو متغيرا ، مثل فيجي ، لفتح المكدسات41. الخوارزميات المستخدمة هي جزء من حزمة برامج ImageJ. - قم بتشغيل خوارزمية عتبة في ImageJ لتحديد وحدات البكسل الموجبة BODIPY. يؤدي هذا إلى تحويل الصورة الحالية إلى صورة ثنائية.
- افتح واجهة مستخدم العتبة عن طريق تحديد Image > ضبط > Threshold. في واجهة المستخدم ، حدد Intermodes كنوع الحد الأدنى وتأكد من تحديد الخلفية الداكنة . لا يلزم تحديد خيارات أخرى. ثم انقر فوق تطبيق.
- يتم فتح مربع حوار لتحويل المكدس إلى ثنائي. تأكد من تحديد الخيارات التالية: الطريقة: بين الأوضاع ؛ الخلفية: داكنة. احسب الحد الأدنى لكل صورة وخلفية سوداء (للأقنعة الثنائية). يؤدي هذا إلى إنشاء مكدس ثنائي ، حيث يشير اللون الأبيض إلى وحدات البكسل الموجبة BODIPY ويشير اللون الأسود إلى وحدات البكسل السالبة BODIPY.
ملاحظة: قد لا تكون خوارزمية عتبة Intermodes هي الخيار الأفضل لجميع المستخدمين. يساعد الفحص الذاتي لخيارات العتبة المضمنة في ImageJ على تحديد الخوارزمية المثلى لفصل وحدات البكسل الإيجابية والسالبة BODIPY.
- قم بتشغيل خوارزمية مستجمعات المياه في ImageJ لفصل قطرات الدهون اللامسة. حدد عملية > مستجمعات المياه الثنائية >. يفتح مربع حوار يسأل عما إذا كان يجب معالجة كل الصور الموجودة في المكدس أم لا. حدد نعم. هذا يضيف خطوطا سوداء رفيعة تقسم مساحات أكبر من الأبيض الصلب.
- حدد عائد الاستثمار باستخدام خوارزمية تحليل الجسيمات في ImageJ.
- حدد تحليل > تحليل الجسيمات. يفتح مربع حوار لضبط إعدادات التحديد.
ملاحظة: يعد تحديد نطاق الحجم أمرا بالغ الأهمية لتحقيق أفضل تقدير لعائد الاستثمار لقطرات الدهون. يزيل الحد الأدنى المناطق التي من المحتمل أن تكون صغيرة جدا بحيث لا يمكن أن تكون قطرات دهنية مشتقة من IMAT (قطعة أثرية في الخلفية) ، ويزيل الحد العلوي المناطق التي من المحتمل أن تكون كبيرة جدا بحيث لا يمكن أن تكون قطرات دهنية مشتقة من IMAT (لمس قطرات الدهون التي لم يتم فصلها بواسطة خوارزمية مستجمعات المياه). - لضبط تلك القيم، افتح الصورة الأصلية وحدد أصغر وأكبر قطرة دهنية في العرض باستخدام الأداة البيضاوية. بعد ذلك ، أضف هذه الأشكال إلى مدير عائد الاستثمار عن طريق كتابة "t". حدد تحليل، ثم تعيين القياسات. يتم فتح مربع حوار لتحديد الإعدادات.
- تحقق من المنطقة فقط وانقر فوق موافق. ثم حدد قياس من مدير عائد الاستثمار. استخدم قياسي المساحة من نافذة النتائج هذه كنطاق حجم في تحليل الجسيمات.
- تأكد من تحديد إضافة إلى المدير . ليست هناك حاجة إلى خيارات أخرى.
- حدد تحليل > تحليل الجسيمات. يفتح مربع حوار لضبط إعدادات التحديد.
- تراكب عائد الاستثمار على المكدس البؤري عن طريق تحديد إظهار الكل في مدير عائد الاستثمار. استخدم شريط المنزلق لفحص كل شريحة مكدسة على حدة وإضافة المناطق المفقودة يدويا باستخدام الأداة البيضاوية (الموجودة في شريط أدوات ImageJ).
- إخراج قياسات عائد الاستثمار. حدد تحليل > تعيين القياسات وحدد المساحة والسنترويد واحتواء القطع الناقص وموضع المكدس. انقر فوق موافق. ثم حدد قياس من مدير عائد الاستثمار. يمكن تحديد البيانات الموجودة في جدول النتائج ونسخها إلى Matlab أو Excel لمزيد من التحليل.
- قم بتحسين عائد الاستثمار في كل مكدس إلى عائد استثمار واحد باستخدام رمز Refine.m Matlab37 أو خوارزمية مماثلة.
ملاحظة: هذه الخطوة مطلوبة لأن الخطوات 5.2-5.4 تحدد نفس قطرة الدهون في الشرائح المجاورة كعائد استثمار مميز. ومع ذلك ، يمكن بدلا من ذلك تحديد عائد الاستثمار يدويا فقط ، أو يمكن التخلص من عائد الاستثمار المكرر يدويا في ImageJ لتجنب الحاجة إلى Matlab. - احصل على إحصائيات موجزة في عائد الاستثمار باستخدام Matlab أو Excel.
- قدر العدد الإجمالي لقطرات الدهون على أنه إجمالي عدد عائد الاستثمار.
- تقدير حجم قطرات الدهون كحجم القطع الناقص المناسب لكل عائد استثمار 2D ، بافتراض أن عمق الشكل هو متوسط المحاور الرئيسية والثانوية للقطع الناقص.
- تقدير الحجم الكلي للدهون ، وهو مجموع أحجام قطرات الدهون المقدرة الفردية.
النتائج
التصور النوعي للتسلل الدهني للعضلات الهيكلية
العضلات المنزوعة الخلايا بشكل صحيح بيضاء وشبه شفافة (القسم 1 ؛ الشكل 1). عندما تكون العضلات غير الخلوية ملطخة ب ORO لتصور IMAT (القسم 2) ، تظهر قطرات الدهون IMAT داخل هياكل العضلات الواضحة ككرات حمراء (الشكل 1). تحتوي عضلات الأطراف الخلفية السليمة للفأر على القليل من IMAT الطبيعي ، ويتضح ذلك من القليل من الدهون الحمراء الإيجابية ORO (الشكل 1 أ). وبالمقارنة ، فإن عضلات الأطراف الخلفية المحقونة بسم القلب (CTX; الشكل 1 ب) أو الجلسرين (GLY; الشكل 1 ج) قبل 14 يوما من إزالة الخلايا ، زاد تراكم IMAT ، مع تركيز أكبر من IMAT بعد CTX مقارنة ب GLY كما لوحظ سابقا37.
يمكن تحديد إزالة الخلايا غير المكتملة مباشرة بعد معالجة SDS الأولية أو بعد غسل تلطيخ ORO كألياف وردية فاتحة شبه معتمة (الشكل 2B مقارنة بالشكل 2A). يمكن تحديد الخلوص غير الكامل ل ORO بعد غسل ORO كخلفية موحدة وردية أو حمراء ، بدلا من خطوط الألياف المميزة (الشكل 2C). يحتوي الشكل 2 أ ، ب أيضا على الدهون فوق العضلية (العلامات النجمية) ، وهي مجموعة من قطرات الدهون خارج العضلة المنزوعة الخلايا. يوضح الشكل 2 ج أيضا الطي العضلي الذي يمكن أن يحدث إذا لم تنتشر العضلات أثناء عملية إزالة الخلايا. إزالة الخلايا غير المكتملة ، وإزالة ORO غير المكتملة ، والدهون العضلية المتبقية كلها تزيد من (OD) من الدهون المستخرجة ، ولكنها لا تعيق بالضرورة التقييم النوعي للتسلل الدهني إذا تم التعرف عليها كقطعة أثرية.
التصوير الكمي للارتشاح الدهني للعضلات الهيكلية
يمكن تصوير قطرات الدهون الموسومة بالفلورسنت BODIPY عبر الفحص المجهري متحد البؤر لإجراء تقييم أكثر تفصيلا لمقاييس قطرات الدهون الفردية وتوزيعها (الشكل 3). هذه العملية شبه آلية ، كما هو موضح سابقا ، بما في ذلك رمز Matlab37. ينتج عن تلطيخ BODIPY الجيد أشكال بيضاوية ساطعة محددة من الأشكال المجاورة عند تصويرها في المستوى (الشكل 3 أ). يوفر تقسيم العتبة والشكل تمريرة أولى جيدة لتوليد عائد استثمار لكل قطرة دهون (الشكل 3 ب) ، ولكن هناك حاجة إلى تعديلات يدوية لتصحيح الأخطاء. الخطأ الأكثر انتشارا هو قطرات الدهون العميقة في الأنسجة وبالتالي فهي ليست ساطعة على أي شرائح (الشكل 3 ب ؛ الأسهم المزدوجة الوردية). يمكن معالجة ذلك عن طريق إضافة عائد استثمار يدويا باستخدام الأداة البيضاوية في ImageJ (الشكل 3C). والثاني هو تحديد مجموعة من قطرات الدهون كعائد استثمار واحد (الشكل 3 ب ؛ علامة النجمة الحمراء). يمكن تصحيح ذلك عن طريق حذف عائد الاستثمار الأصلي واستبداله بعدة عائد استثمار جديد (الشكل 3D). أخيرا ، يتم تحديد قطرة دهنية واحدة على أنها عائد استثمار فريد في شرائح متعددة ، لذلك يجب دمج عائد الاستثمار المكرر في عائد استثمار واحد (الشكل 3E ؛ السهم الأزرق). يتم ذلك بسهولة أكبر باستخدام أداة معالجة البيانات مثل Matlab ، ولكن يمكن أيضا القيام به يدويا عن طريق تحديد أكبر عائد استثمار وحذف الباقي. يمكن العثور على متوسط القيم لكل مقياس في الماوس C57BL6 / J و 129Sv في Biltz et al.37.
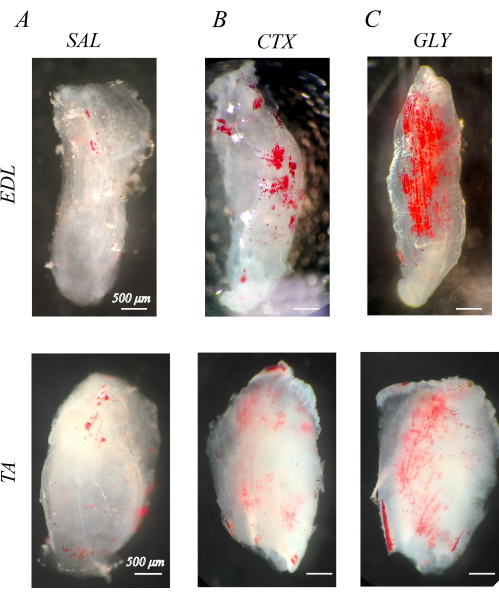
الشكل 1: مثال على تلطيخ الزيت الأحمر O (ORO) للعضلات غير الخلوية. العضلات الملطخة ب ORO بعد 14 يوما من الحقن بالمحلول الملحي (SAL) أو سم القلب (CTX) أو الجلسرين (GLY). تحتوي عضلات الباسطة الرقمية الطويلة (EDL) وعضلات الظنبوب الأمامية (TA) على القليل من IMAT (الكرات الحمراء) مع علاج SAL (A) ، ولكنها تتراكم IMAT استجابة لعلاج CTX (B) و GLY (C). هناك إزالة كاملة للخلايا وغسل ORO ، يتضح من قطرات الدهون الإيجابية ORO المميزة في خلفية العضلات البيضاء الشفافة. قضبان المقياس = 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
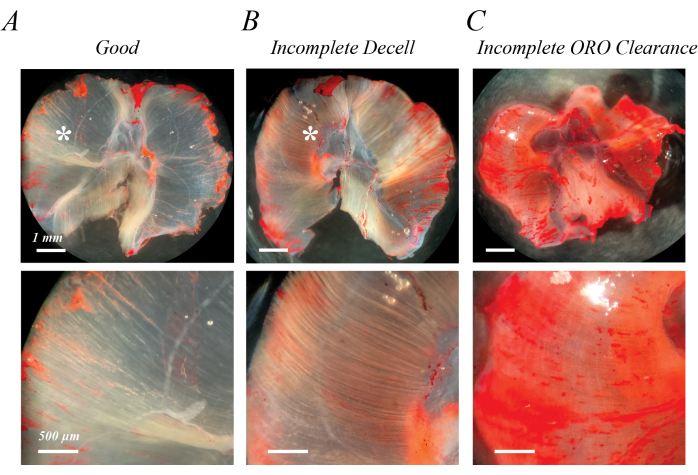
الشكل 2: أمثلة على نتائج تلطيخ ORO السيئة. يؤدي إزالة الخلايا غير المكتملة أو إزالة ORO غير المكتملة إلى خلفية وردية / حمراء شبه معتمة. بالمقارنة مع الخلفية البيضاء الشفافة لعضلة الحجاب الحاجز للفأر المنزوعة الخلايا بالكامل (A) ، تتميز عملية إزالة الخلايا غير المكتملة بمسارات ألياف وردية / حمراء فاتحة (B) ، وتتميز إزالة ORO غير المكتملة بخلفية وردية / حمراء منتشرة (C). قضبان المقياس: الألواح العلوية = 1 مم ؛ الألواح السفلية = 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
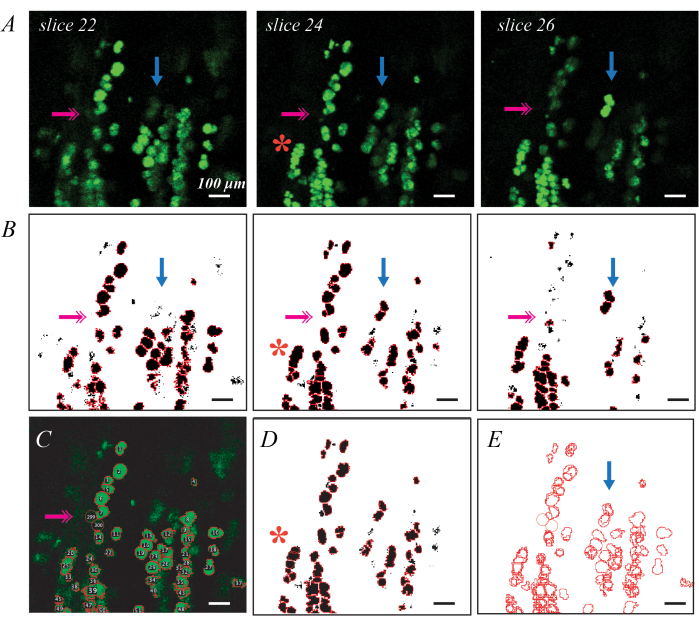
الشكل 3: أمثلة على تحديد قطرات الدهون الفردية مع تلطيخ BODIPY الفلوري والفحص المجهري متحد البؤر يمكن تحديد قطرات الدهون الملطخة BODIPY الفردية وقياسها في العضلات منزوعة الخلايا باستخدام الفحص المجهري متحد البؤر. تظهر الشرائح الفردية من خلال مكدس متحد البؤر قطرات الدهون في المستوى كقطع ناقص أخضر فاتح ، وقطرات الدهون خارج المستوى كأشكال أكثر خفوتا (A ؛ الأسهم الزرقاء). يمكن أن يؤدي العتبة جنبا إلى جنب مع تجزئة كائن مستجمعات المياه وتحديد عائد الاستثمار إلى تعيين عائد الاستثمار الملطخ ب BODIPY (B). قد تفوت العتبة بعض قطرات الدهون الخافتة (B ؛ السهم المزدوج الوردي) ، مما يتطلب تحديد الهوية باليد (C). قد يقوم تجزئة مستجمعات المياه بتجميع عدة قطرات دهنية معا (B ؛ علامة النجمة الحمراء) ، مما يتطلب حذف عائد الاستثمار وإعادة التقدير يدويا (D). يتم تحديد نفس قطرة الدهون في شرائح متعددة تتطلب تسجيل الصورة (E) لحذف عائد الاستثمار المكرر. قضبان المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تصف هذه المخطوطة طرقا للتصور النوعي والقياس الكمي للتسلل الدهني للعضلات الهيكلية في نماذج حيوانية صغيرة يمكن تطبيقها لزيادة فهم التسبب في تطور الأنسجة الدهنية العضلية (IMAT) والتوسع المرضي. يسمح استخدام إزالة الخلايا من العضلات بالكامل والتلوين القابل للذوبان في الدهون بمنهجية فعالة من حيث التكلفة وقابلة للتكرار وبسيطة لتقييم شامل لوجود IMAT في العضلات بأكملها.
أساس هذا البروتوكول هو أن إزالة الخلايا من العضلات مع SDS يزيل المكونات الخلوية للألياف العضلية ، بما في ذلك قطرات الدهون الصغيرة من IMCL ، ولكن يجنب قطرات الدهون الكبيرة في الخلايا الشحمية داخل الخلايا العضلية. تم استخدام SDS على نطاق واسع42 في هندسة الأنسجة لإزالة الخلايا من المصفوفات. تتطلب الأنسجة مثل العضلات الدهنية والهيكلية عادة تفككا ميكانيكيا إضافيا و / أو استخراج الكحول لإزالة الدهون الشحمية المتبقية42,43. لقد أظهرنا سابقا أن هذا يرجع إلى أنه في حين أن إزالة الخلايا باستخدام SDS تقضي على IMCL ، فإنها توفر قطرات الدهون الكبيرة في الخلايا الشحمية37. أثبت تصوير العضلات السليمة الملطخة برباعي أكسيد الأوزميوم قبل وبعد إزالة الخلايا باستخدام μCT أن النمط المكاني ل IMAT لم يتعطل بسبب إزالة الخلايا. علاوة على ذلك ، كان قياس كمية الدهون الثلاثية العضلية في عضلة منزوعة الخلايا مع IMAT ضئيل ~ 5٪ من قيم العضلات السليمة ، مما تحقق من إزالة IMCL. لذلك ، تحتفظ هذه المنهجية بقطرات الدهون IMAT في توزيعها التشريحي الأصلي من خلال مصفوفة عضلية شبه شفافة.
إزالة الخلايا المناسبة هي الخطوة الأكثر أهمية في هذا البروتوكول. إذا كانت عملية إزالة الخلايا غير مكتملة ، فسيكون من الصعب تصور قطرات الدهون IMAT وسيتسبب IMCL المتبقي في تلطيخ الخلفية العالية إما باستخدام ORO أو BODIPY (الشكل 2). الأخطاء الشائعة من قبل المستخدمين عديمي الخبرة هي عدم كفاية تغطية SDS لكل عضلة (داخل كل بئر) ، بحيث لا يتم تغطية كل عضلة بالكامل في محلول SDS ، وعدم استخدام الروك لتحريك الحل أثناء إزالة الخلايا ، وعدم إجراء تغييرات الحل بشكل متكرر بما فيه الكفاية. في هذه المخطوطة ، أوصينا بكمية SDS اللازمة لكل وحدة كتلة عضلية ، لكن المستخدم سيظل بحاجة إلى التأكد من تغطية العضلات بالكامل بالحلول ، حيث أن كل عضلة لها هندسة فريدة. ينصح المستخدمون أيضا بتغيير الحلول بحرية (بقدر مرتين في اليوم) لضمان اكتمال إزالة الخلايا. تم تحقيق تلطيخ عالي الجودة لقطرات الدهون IMAT بعد ما يصل إلى 4 أيام من علاج SDS. للحصول على نتائج تلطيخ ORO عالية الجودة ، يعد التثبيت المناسب وإعداد محلول ORO مهمين أيضا. على غرار علاج SDS الموصوف أعلاه ، هناك حاجة إلى تغطية كافية لمحلول الفورمالديهايد بنسبة 3.7٪ لكل عينة عضلية. إذا تمت إزالة العضلات من المثبت في وقت مبكر جدا ، فإن قطرات الدهون سوف تلطخ بشكل ضعيف فقط باستخدام ORO. يجب أن يكون ما مجموعه 1-2 ساعة كافيا ، ولكن يوصى بالتثبيت بين عشية وضحاها لضمان اختراق المثبت لمركز العضلات وإصلاح جميع قطرات الدهون بالكامل. التحدي الإضافي مع تلطيخ ORO هو أنه عندما يتم تقليل تركيز الكحول إلى 60٪ ، تبدأ الجسيمات في التكون. يمكن أن تستقر هذه الجسيمات على السطح وتصبح عالقة على حدود العضلات. أفضل طريقة لتجنب ذلك هي عمل حل عمل جديد لكل تلطيخ واستخدام مرشحات 40 شبكة ميكرومتر و 0.22 ميكرومتر. بعد ذلك ، سيساعد الحفاظ على الهياج مع الروك والحد من وقت التلوين إلى 10 دقائق في منع أي جسيمات تتشكل من الاستقرار. إذا استمرت المشكلة ، فقد يساعد إنشاء حل جديد لمخزون ORO. إذا بقيت بعض القطع الأثرية عالقة على سطح العضلات المنزوع الخلايا ، فيمكن استخدام مجهر ستيريو وملقط ومقص جراحي لإزالة هذه القطعة الأثرية. سيؤدي الفشل في التخلص من القطع الأثرية إلى التأثير على جودة صورة العضلات والمبالغة في تقدير محتوى IMAT أثناء جزء استخراج الدهون استعدادا لقراءة OD.
بشكل عام ، هذه التقنية واضحة ومباشرة وتوفر العديد من المزايا مقارنة بالطرق القياسية الذهبية لتصور وقياس تسلل الدهون في العضلات الهيكلية. التقنيات غير الباضعة ، مثل التصوير المقطعي المحوسب والتصوير بالرنين المغناطيسي والولايات المتحدة ، والتي تستخدم على نطاق واسع في البشر وأحيانا في النماذج الحيوانية ، لها دقة مكانية محدودة وغير قادرة على التمييز بين قطرات الدهون وألياف العضلات. وبالتالي ، يتم تعيين بكسل أو فوكسل من شدة الإشارة المتوسطة ك "عضلة" أو "دهون" ، بينما في الواقع من المحتمل أن يكون مزيجا من الألياف العضلية والخلايا الشحمية. بشكل أكثر شيوعا ، يتم تقييم التسلل الدهني في عضلات الحيوان عن طريق الأنسجة ، في أغلب الأحيان بواسطة ORO في عمليات تشريح العضلات. ومع ذلك ، يتم إجراء ذلك عادة في قسم تمثيلي واحد فقط ويصعب تحديده كميا بسبب تشتت الدهون فوق القسم. على النقيض من ذلك ، يوفر تلطيخ ORO لعضلة كاملة منزوعة الخلايا تقييما شاملا ل IMAT بتكاليف وجهد مماثل للتشكل السليم. علاوة على ذلك ، بالإضافة إلى تعزيز التصور ، يتيح تلطيخ ORO لإزالة الخلايا تحديد كمية التسلل الدهني عن طريق استخراج الدهون. للغوص بشكل أعمق في ميزات التسلل الدهني ، يمكن استخدام صبغة الفلورسنت ، BODIPY ، جنبا إلى جنب مع الفحص المجهري متحد البؤر. وهذا يتيح إعادة بناء قطرات الدهون IMAT الفردية لرسم خريطة المشهد 3D ، وهو أمر غير ممكن مع الأنسجة ما لم يتم تحليل المقاطع على طول العضلات. في حين أن المجهر متحد البؤر ليس من معدات المختبر القياسية ، فمن المرجح أن يكون متاحا في بيئة جامعية أو صناعية أكثر من التصوير بالرنين المغناطيسي للحيوانات الصغيرة أو التصوير المقطعي المحوسب. علاوة على ذلك ، يمكن أتمتة الكثير من هذه العملية ، مما يقلل من تكلفة الوقت مقارنة بالأنسجة المتسلسلة. يعد تحسين الإعدادات على المجهر متحد البؤر اعتبارا إضافيا لتلطيخ BODIPY. هذه فريدة من نوعها لكل مجهر. القيمة الحرجة هي شدة الليزر ، والتي يجب أن تكون عالية بما يكفي للكشف عن قطرات الدهون على السطح البعيد للعضلة مع عدم تشبع الإشارة من قطرات الدهون على الجانب القريب. لهذا السبب ، يقترح أن استخدام تلطيخ BODIPY مع الفحص المجهري متحد البؤر هو الأنسب للعضلات الرقيقة ، بما في ذلك EDL أو الحجاب الحاجز.
وهناك عدة قيود على هذا النهج تستحق المناقشة. أولا ، في حين أنه من المتوقع أن يكون لهذه التقنية قابلية تطبيق واسعة تتجاوز نماذج الإصابة (سم القلب والجلسرين) في الفئران المعروضة هنا ، قد تتطلب التطبيقات الجديدة (على سبيل المثال ، نموذج mdx) التحسين ، حيث يمكن أن يؤثر حجم وتكوين العضلات (على سبيل المثال ، التليف) على إزالة الخلايا ، مما يتطلب زيادة تركيز SDS أو أوقات الحضانة. تتطلب نماذج الأمراض الأخرى ذات الكتلة العضلية المتغيرة أيضا تحليل كل من المقاييس المطلقة والطبيعية (لكتلة العضلات) للتسلل الدهني لتحديد الكمية المطلقة من الدهون أو النسبة المئوية للدهون بالنسبة لحجم العضلات لتوفير مقياس نتائج أكثر وضوحا. علاوة على ذلك ، من المتوقع أن تكون هذه التقنية قابلة للتطبيق على نطاق واسع على النماذج الحيوانية الأكبر حجما والخزعات البشرية ، ولكن هذا قد يتطلب تحسينا لكل تطبيق جديد. ثانيا ، في هذه الاستراتيجية ، يجب تخصيص العضلات بأكملها لهذا الفحص ولا يمكن استخدامها لتقييم ميزة مرضية أخرى. يتم تقديم الدراسات التي تهدف إلى تقييم التغيرات الطولية في IMAT بشكل أفضل من خلال تقنيات التصوير غير الباضعة والدراسات التي يتطلب هدفها الأساسي العضلات لأغراض أخرى (علم الأنسجة ، تفاعل البلمرة المتسلسل الكمي ، النشاف الغربي) يتم تقديمها بشكل أفضل من خلال التقييم النسيجي ، حيث يمكن تخصيص ما تبقى من العضلات المجمدة لفحوصات أخرى. ومع ذلك ، فإن هذا الفحص مناسب تماما للاقتران بالاختبار في الجسم الحي ، مثل تشغيل جهاز المشي ، أو اختبار انقباض خارج الجسم الحي ، حيث يمكن إجراء هذه التدابير قبل إزالة الخلايا44. ثالثا ، على الرغم من أن استخدام صبغة BODIPY مع الفحص المجهري متحد البؤر يوفر تصورا عالي الدقة وتقديرا كميا لقطرات الدهون ، إلا أنه لا يمكنه تحديد قطرات الدهون بشكل قاطع كخلايا دهنية فردية ، حيث تتم إزالة غشاء الخلية وفقدان بروتينات الخلايا الشحمية الذاتية. يمكن تحديد الخلايا الشحمية متعددة العينين ، التي تمثل الخلايا الشحمية غير الناضجة أو النمط الظاهري "البني / البيج" ، على أنها قطرات دهنية متعددة. أخيرا ، لا يعمل البروتوكول بشكل جيد على العضلات المجمدة مسبقا. ربما تكون هذه القيود أكثر عمقا بالنسبة للخزعات البشرية ، لأنه في حين يمكن إزالة الخلايا من الخزعة بأكملها ، فمن غير المحتمل أن يكون التوزيع المكاني ل IMAT في الخزعة أكثر تمثيلا للعضلة بأكملها من شريحة نسيجية. ومع ذلك ، نظرا لأن هذه التقنية غير حساسة نسبيا لظروف معالجة الخزعة غير المجمدة (على سبيل المثال ، ساعات على الجليد في برنامج تلفزيوني) ، يمكن تقسيم الخزعة لاحقا لمقايسات مختلفة ، بما في ذلك جزء لإزالة الخلايا ، مما يوفر دقة أفضل لقطرات الدهون الفردية.
في الختام ، تم تطوير طريقة جديدة للتحليل النوعي والكمي للتسلل الدهني للعضلات الهيكلية عن طريق تلطيخ وتصوير الدهون المحتفظ بها للتركيبات المنزوعة الخلايا. تقدم هذه المنهجية تحسينات على الأساليب القياسية الذهبية ، من حيث أنها تتيح التصوير الشامل للتسلل الدهني ثلاثي الأبعاد داخل العضلات والقياس الكمي السريع والرخيص مع تلطيخ ORO. للحصول على مقاييس أكثر تفصيلا ، توفر صبغة BODIPY الثانية القابلة للذوبان في الدهون تقديرا كميا أكثر تفصيلا لعدد قطرات الدهون وحجمها ونمط توزيعها ، كما تم تصويرها بواسطة الفحص المجهري متحد البؤر. توفر هذه المقاييس معا للباحثين طريقة لقياس تسلل العضلات الهيكلية الدهنية بدقة على مستوى قطرات الدهون الفردية دون أخذ عينات أو تصوير غير جراحي باهظ الثمن.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
وحظي هذا العمل بدعم R01AR075773 إلى أمانة عمان الكبرى.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm Syringe Filter | Fisher Scientific | SLGP033RS | |
| 1 mL LuerLock Syringes | Fisher Scientific | 14823434 | |
| 12 mm Coverslips | Fisher Scientific | 12545F | |
| 12 well plates | Fisher Scientific | 08-772-29 | |
| 24 well plates | Fisher Scientific | 08-772-1H | |
| 2-Propanol (Isopropanol) | Sigma Aldrich | I9516 | 0.5 mg/mL stock solution can be stored at room temperature for 1 month. Working solution must be made fresh. |
| 37% Formaldehyde Solution | Sigma Aldrich | 8187081000 | |
| 40 µm Mesh Filter | Fisher Scientific | 87711 | |
| 6 well plates | Fisher Scientific | 08-772-1B | |
| 96 well plates | Fisher Scientific | 08-772-2C | |
| BODIPY 493/503 | Fisher Scientific | D-3922 | |
| C57BL/6J Mice | Jackson Laboratory | 000664 | |
| Confocal Imaging Dish | VWR | 734-2905 | |
| Confocal Microscope | Leica | TCS SPEII | |
| Dissecting/stereo Microscope | Zeiss | 4107009123001000 | |
| Dissection scissors | Fine Science Tools | 14060-09 | |
| Dumont #5 forceps | Fine Science Tools | 11254-20 | |
| Ethanol | Fisher Scientific | 033361.K2 | |
| ImageJ | NIH | ||
| Matlab | Mathworks | ||
| Oil Red O Powder | Sigma Aldrich | O0625 | |
| Plate reader | Bio-tek | Synergy II | |
| Rocker/Shaker | Reliable Scientific | 55D | |
| Sodium Dodecyl Sulfate (SDS) | Sigma Aldrich | L3771 | 1% Solution can be stored at room temperature for 1 month |
| Transfer pipettes | Fisher Scientific | 137119D | |
| Vannas spring scissors | Fine Science Tools | 15000-00 |
References
- Delmonico, M. J., et al. Longitudinal study of muscle strength, quality, and adipose tissue infiltration. The American Journal of Clinical Nutrition. 90 (6), 1579-1585 (2009).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Freda, P. U., et al. Lower visceral and subcutaneous but higher intermuscular adipose tissue depots in patients with growth hormone and insulin-like growth factor I excess due to acromegaly. The Journal of Clinical Endocrinology and Metabolism. 93 (6), 2334-2343 (2008).
- Garg, A., Peshock, R. M., Fleckenstein, J. L. Adipose tissue distribution pattern in patients with familial partial lipodystrophy (Dunnigan variety). The Journal of Clinical Endocrinology and Metabolism. 84 (1), 170-174 (1999).
- Gorgey, A. S., Dudley, G. A. Skeletal muscle atrophy and increased intramuscular fat after incomplete spinal cord injury. Spinal Cord. 45 (4), 304-309 (2007).
- Goutallier, D., Postel, J. M., Bernageau, J., Lavau, L., Voisin, M. C. Fatty muscle degeneration in cuff ruptures. Pre- and postoperative evaluation by CT scan. Clinical Orthopaedics and Related Research. (304), 78-83 (1994).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. The American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Elder, C. P., Apple, D. F., Bickel, C. S., Meyer, R. A., Dudley, G. A. Intramuscular fat and glucose tolerance after spinal cord injury-a cross-sectional study. Spinal Cord. 42 (12), 711-716 (2004).
- Albu, J. B., et al. Independent association of insulin resistance with larger amounts of intermuscular adipose tissue and a greater acute insulin response to glucose in African American than in white nondiabetic women. The American Journal of Clinical Nutrition. 82 (6), 1210-1217 (2005).
- Tuttle, L. J., Sinacore, D. R., Mueller, M. J. Intermuscular adipose tissue is muscle specific and associated with poor functional performance. Journal of Aging Research. 2012, 172957 (2012).
- Gerber, C., Schneeberger, A. G., Hoppeler, H., Meyer, D. C. Correlation of atrophy and fatty infiltration on strength and integrity of rotator cuff repairs: a study in thirteen patients. Journal of Shoulder and Elbow Surgery. 16 (6), 691-696 (2007).
- Hilton, T. N., Tuttle, L. J., Bohnert, K. L., Mueller, M. J., Sinacore, D. R. Excessive adipose tissue infiltration in skeletal muscle in individuals with obesity, diabetes mellitus, and peripheral neuropathy: association with performance and function. Physical Therapy. 88 (11), 1336-1344 (2008).
- Gaeta, M., et al. Muscle fat-fraction and mapping in Duchenne muscular dystrophy: evaluation of disease distribution and correlation with clinical assessments. Preliminary experience. Skeletal Radiology. 41 (8), 955-961 (2012).
- Buford, T. W., et al. Age-related differences in lower extremity tissue compartments and associations with physical function in older adults. Experimental Gerontology. 47 (1), 38-44 (2012).
- Addona, J., et al. Estimating 3D supraspinatus intramuscular fatty infiltration in older adults: a pilot study. Acta Radiologica. , 2841851221139597 (2022).
- Crook, J., et al. Comparison of multifidus muscle intramuscular fat by ultrasound echo intensity and fat-water based MR images in individuals with chronic low back pain. Musculoskeletal Science & Practice. 63, 102717 (2023).
- Lee, C., et al. Beige FAPs transplantation improves muscle quality and shoulder function after massive rotator cuff tears. Journal of Orthopaedic Research. 38 (5), 1159-1166 (2020).
- Lee, C., et al. Beige fibro-adipogenic progenitor transplantation reduces muscle degeneration and improves function in a mouse model of delayed repair of rotator cuff tears. Journal of Shoulder and Elbow Surgery. 29 (4), 719-727 (2020).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Overend, T. J., Cunningham, D. A., Paterson, D. H., Lefcoe, M. S. Thigh composition in young and elderly men determined by computed tomography. Clinical Physiology. 12 (6), 629-640 (1992).
- Li, W., et al. Progression and variation of fatty infiltration of the thigh muscles in Duchenne muscular dystrophy, a muscle magnetic resonance imaging study. Neuromuscular Disorders. 25 (5), 375-380 (2015).
- Davis, D. L., et al. Supraspinatus fatty infiltration on MRI among older adults receiving physical therapy as initial management for clinically suspected rotator cuff tear: A pilot study. Journal of Clinical Imaging Science. 12, 66 (2022).
- Salaffi, F., et al. Ultrasound and magnetic resonance imaging as diagnostic tools for sarcopenia in immune-mediated rheumatic diseases (IMRDs). La Radiologia Medica. 127 (11), 1277-1291 (2022).
- Gallagher, D., et al. Adipose tissue in muscle: a novel depot similar in size to visceral adipose tissue. The American Journal of Clinical Nutrition. 81 (4), 903-910 (2005).
- Tuttle, L. J., Sinacore, D. R., Cade, W. T., Mueller, M. J. Lower physical activity is associated with higher intermuscular adipose tissue in people with type 2 diabetes and peripheral neuropathy. Physical Therapy. 91 (6), 923-930 (2011).
- Matsumura, N., et al. Quantitative assessment of fatty infiltration and muscle volume of the rotator cuff muscles using 3-dimensional 2-point Dixon magnetic resonance imaging. Journal of Shoulder and Elbow Surgery. 26 (10), 309-318 (2017).
- Cheuy, V. A., Hastings, M. K., Commean, P. K., Ward, S. R., Mueller, M. J. Intrinsic foot muscle deterioration is associated with metatarsophalangeal joint angle in people with diabetes and neuropathy. Clinical Biomechanics. 28 (9-10), 1055-1060 (2013).
- Samagh, S. P., et al. MRI quantification of fatty infiltration and muscle atrophy in a mouse model of rotator cuff tears. Journal of Orthopaedic Research. 31 (3), 421-426 (2013).
- Gerber, C., Meyer, D. C., Schneeberger, A. G., Hoppeler, H., von Rechenberg, B. Effect of tendon release and delayed repair on the structure of the muscles of the rotator cuff: an experimental study in sheep. The Journal of Bone and Joint Surgery. American Volume. 86 (9), 1973-1982 (2004).
- Goodpaster, B. H., Kelley, D. E., Thaete, F. L., He, J., Ross, R. Skeletal muscle attenuation determined by computed tomography is associated with skeletal muscle lipid content. Journal of Applied Physiology. 89 (1), 104-110 (2000).
- Torriani, M., et al. Lower leg muscle involvement in Duchenne muscular dystrophy: an MR imaging and spectroscopy study. Skeletal Radiology. 41 (4), 437-445 (2012).
- Kim, H. M., Galatz, L. M., Lim, C., Havlioglu, N., Thomopoulos, S. The effect of tear size and nerve injury on rotator cuff muscle fatty degeneration in a rodent animal model. Journal of Shoulder and Elbow Surgery. 21 (7), 847-858 (2012).
- Rowshan, K., et al. Development of fatty atrophy after neurologic and rotator cuff injuries in an animal model of rotator cuff pathology. The Journal of Bone and Joint Surgery. American Volume. 92 (13), 2270-2278 (2010).
- Li, B., et al. Skeletal muscle respiratory uncoupling prevents diet-induced obesity and insulin resistance in mice. Nature Medicine. 6 (10), 1115-1120 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), 1 (2017).
- Hakim, C. H., Wasala, N. B., Duan, D. Evaluation of muscle function of the extensor digitorum longus muscle ex vivo and tibialis anterior muscle in situ in mice. Journal of Visualized Experiments. (72), 50183 (2013).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. Journal of Visualized Experiments. (71), e50036 (2013).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Ungerleider, J. L., Johnson, T. D., Rao, N., Christman, K. L. Fabrication and characterization of injectable hydrogels derived from decellularized skeletal and cardiac muscle. Methods. 84, 53-59 (2015).
- Biltz, N. K., et al. Infiltration of intramuscular adipose tissue impairs skeletal muscle contraction. The Journal of Physiology. 598 (13), 2669-2683 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved