A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تجربة معشاة ذات شواهد لدراسة الآثار الحادة لتمارين القوة على حساسية الأنسولين لدى البالغين الذين يعانون من السمنة المفرطة
In This Article
Summary
تصف هذه الدراسة بروتوكول تجربة معشاة ذات شواهد تهدف إلى تقييم الآثار الحادة لحجم تمارين القوة على حساسية الأنسولين لدى الأفراد الذين يعانون من السمنة المفرطة.
Abstract
جلسة حادة من تمارين القوة (SE) تخفف من حساسية الأنسولين (IS) لعدة ساعات. ومع ذلك ، فإن تأثيرات حجم SE (أي عدد المجموعات) لم تتم دراستها بدقة. على الرغم من أنه من البديهي أن بعض SE أفضل من لا شيء ، وأكثر من البعض لتحسين IS ، إلا أن الجلسات ذات الحجم الكبير قد تكون صعبة على السكان المرضى لإكمالها ، وخاصة البالغين الذين يعانون من السمنة المفرطة ، والذين قد يكون المشي السريع أمرا صعبا بالنسبة لهم. يفصل هذا البروتوكول تجربة سريرية عشوائية لتقييم الآثار الحادة ل SE على IS لدى البالغين الذين يعانون من السمنة المفرطة. معايير الإدراج هي مؤشر كتلة الجسم >30 كجم / م2 ، والسمنة المركزية (محيط الخصر >88 سم و >102 سم للنساء والرجال ، على التوالي) ، والعمر >40 سنة. سيتم تعريف المشاركين ب SE (7 تمارين تستهدف مجموعات العضلات الرئيسية) ثم سيؤدون ثلاث جلسات بترتيب عشوائي: الجلسة 1 - جلسة كبيرة الحجم (3 مجموعات / تمرين) ؛ الجلسة 1 - جلسة كبيرة الحجم (3 مجموعات / تمرين) ؛ الجلسة 1 - جلسة عالية الحجم (3 مجموعات / تمرين) ؛ الجلسة 1 - جلسة عالية الحجم (3 مجموعات / تمرين) ؛ الجلسة 1 - جلسة عالية الحجم (3 مجموعات / تمرين) ؛ الجلسة 1 - جلسة كبيرة الحجم (3 مجموعات / تمرين) ؛ الجلسة 1 - جلسة كبيرة الحجم (3 مجموعات / تمرين) ؛ الجلسة 1 - جلسة عالية الحجم (3 الجلسة 2 - جلسة منخفضة الحجم (1 مجموعة / تمرين) ؛ الجلسة 3 - جلسة التحكم (بدون تمرين). سيتم التحكم في النظام الغذائي في اليوم السابق وفي يوم الجلسات. سيتم الانتهاء من الجلسات في الليل ، وسيتم إجراء اختبار تحمل الجلوكوز عن طريق الفم في صباح اليوم التالي ، والذي سيتم اشتقاق العديد من مؤشرات IS ، مثل المنطقة الواقعة تحت منحنى (AUC) للجلوكوز والأنسولين ، ومؤشر ماتسودا ، ومؤشر Cederholm ، ومؤشر IS للعضلات ، ومؤشر Gott. استنادا إلى الدراسات التجريبية ، نتوقع تحسنا ~ 15٪ في IS (الأنسولين AUC ، ومؤشرات Matsuda و Cederholm) بعد الجلسة ذات الحجم الكبير ، و ~ 8٪ تحسنا بعد الجلسة ذات الحجم المنخفض مقارنة بجلسة التحكم. ستفيد هذه الدراسة الأفراد الذين يجدون جلسات SE ذات الحجم الكبير صعبة ولكنهم ما زالوا يهدفون إلى تحسين IS من خلال استثمار 1/3 من وقتهم وجهدهم.
Introduction
على الرغم من أن الآثار المزمنة لتدريب القوة على حساسية الأنسولين قد أظهرت مرارا وتكرارا1،2،3 ، حتى جلسة حادة من تمارين القوة يمكن أن تحسن عمل الأنسولين لمدة تصل إلى 48 ساعة4. وقد ثبت هذا التأثير فيالأصحاء 5،6،7،8 ، والسمنة 9 ، وكبار السن10 ، والأفراد المقاومين للأنسولين4 ، ومرضى السكري من النوع 211. لم يبلغ آخرون عن آثار إيجابية12،13،14،15،16،17 ، ومن غير الواضح سبب حدوث هذه الاختلافات.
في مراجعة سردية حديثة18 ، اقترح أن حجم تمرين القوة (عدد المجموعات لكل تمرين) ضروري لتحسين حساسية الأنسولين. على سبيل المثال ، أظهرت مراجعة منهجية حديثة وتحليل تلوي أن الجلسات المكونة من 21 مجموعة أو أكثر أدت إلى تحسن أكبر في عمل الأنسولين مقارنة بالجلسات التي تحتوي على أقل من 21 مجموعة19. ومع ذلك ، فإن أدلة محدودة فقط من الأدبيات تدعم هذه الفكرة بشكل مباشر. على سبيل المثال ، أدى حجم التمارين ذات القوة العالية (30 مجموعة) إلى تحسين استقلاب الجلوكوز أكثر من الحجم المنخفض (10 مجموعات)20. ولكن تجدر الإشارة إلى أن هذه الدراسة نفذت تمارين القوة على غرار الدائرة ، مما يحد من المقارنة مع تمارين القوة التقليدية. في دراسة أخرى ، لوحظت حساسية أفضل للأنسولين بعد بروتوكول تمرين القوة المكون من 32 مجموعة مقارنة ببروتوكول21 المكون من 8 مجموعات. ومع ذلك ، لم يتم الإبلاغ عن درجة الجهد بعد المجموعات ، ويفترض أنها كانت أكبر بعد بروتوكول الحجم الكبير. هذا مهم لأن درجة الجهد (أو القرب من الفشل العضلي متحد المركز ، الذي يتميز بعدم القدرة على مواصلة المجموعة بسبب الفشل في الحركة متحدة المركز لتكرار معين) قد اعتبرت أيضا متغيرا مهما لتحسين استقلاب الأنسولين والجلوكوز18. وبالتالي ، فإن الدراسات المحدودة المتاحة حول هذا الموضوع ، إلى جانب قيودها المنهجية ، تمنع المزيد من الاستدلالات فيما يتعلق بتأثيرات حجم تمرين القوة على حساسية الأنسولين.
نقطة أخرى مثيرة للاهتمام عند مناقشة حجم تمارين القوة هي أنها مرتبطة بطبيعتها بالالتزام بالوقت. انخفاض حجم التمرين ، حسب التصميم ، يعني قضاء وقت أقل في صالة الألعاب الرياضية. من بين أسباب عدم الالتزام ببرنامج التمرين ، يأتي ضيق الوقت على رأس القائمة22. وبالتالي ، فإن جلسة تمرين القوة منخفضة الحجم التي تحسن حساسية الأنسولين بشكل فعال تعني التزاما أقلبالوقت 23 وقد تؤدي إلى التزام أعلى على المدى الطويل. علاوة على ذلك ، ترتبط المشاعر الذاتية ، مثل الكفاءة الذاتية (الإدراك الذاتي للقدرة على إنجاز شيء ما) وأحاسيس المتعة والمرح (المتعة) ، أيضا بالالتزام بالتمرين24،25،26. من المعقول التكهن بأن الناس قد يشعرون بمزيد من الثقة ويستمتعون بتجربة التمرين أكثر عندما يؤدون جلسة تمرين قوة منخفضة الحجم تترجم إلى تحسن في الصحة.
لمعالجة الثغرات في الأدبيات الملخصة أعلاه ، وصفنا بروتوكولا لتجربة سريرية عشوائية ومضبوطة ومتقاطعة بهدف أساسي هو تقييم آثار حجم تمارين القوة على حساسية الأنسولين لدى الأفراد الذين يعانون من السمنة المفرطة. كهدف ثانوي ، نقوم بتقييم آثار حجم تمرين القوة على المشاعر الذاتية (الكفاءة الذاتية والمودة والمتعة).
يصف البروتوكول هنا تجربة سريرية عشوائية ، خاضعة للرقابة ، 3 اتجاهات ، متقاطعة. يشمل التسلسل الزمني للبروتوكول ما يلي: تقييم ما قبل المشاركة للتاريخ الصحي والمقاييس البشرية (كتلة الجسم والطول ومحيط الخصر وتكوين الجسم) ؛ موعد مع أخصائي التغذية المعتمد للفريق ؛ فترة التعرف على تمارين القوة واستبيانات المشاعر الذاتية ؛ تقييم القوة في كل تمرين ؛ التوزيع العشوائي لترتيب الجلسات ؛ أداء 3 جلسات (مفصولة ب 7-28 يوما) ، تليها مباشرة الإجابة على استبيانات المشاعر الذاتية ؛ اختبار تحمل الجلوكوز عن طريق الفم (OGTT) في صباح اليوم التالي ؛ وتحليل البيانات. يوضح الشكل 1 تصميم البروتوكول.
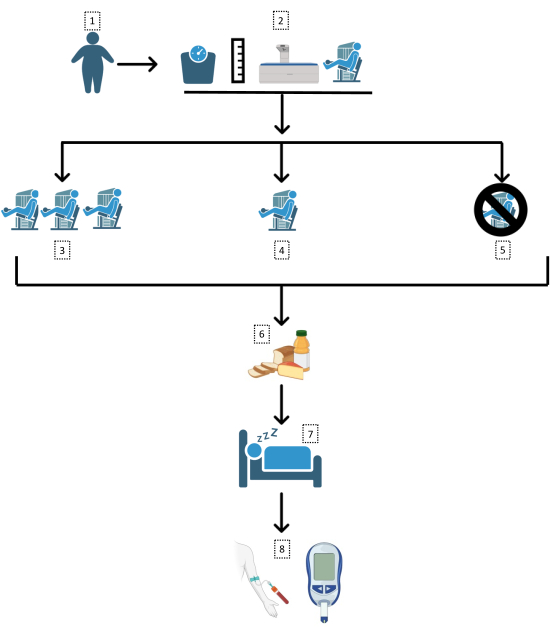
الشكل 1: تصميم الدراسة. يتبع هنا مخطط انسيابي لمنهجية التجربة. 1: السمنة (مؤشر كتلة الجسم [BMI] >30 كجم / م2 ؛ محيط الخصر >102/88 سم) ؛ 2: التقييمات الأنثروبومترية والتعريف؛ تعيين عشوائي إلى 3: جلسة تمرين قوة كبيرة الحجم (21 مجموعة) ، 4: جلسة تمرين قوة منخفضة الحجم (7 مجموعات) ، أو 5: يوم تحكم ؛ 6: وجبة قياسية بعد الجلسات ؛ 7: النوم والصيام بين عشية وضحاها. 8: اختبار تحمل الجلوكوز عن طريق الفم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
Protocol
الحصول على تصريح أخلاقي للدراسة من خلال تقديم بروتوكول الدراسة ووثيقة الموافقة المستنيرة إلى مجلس المراجعة المؤسسية المحلي (IRB) أو لجنة أخلاقيات البحث المحلية (REC). لا يمكن أن تبدأ الدراسة إلا بعد موافقة IRB أو REC. النتائج المعروضة أدناه مأخوذة من دراسة تجريبية ، حيث وقع الأشخاص على موافقة خطية مستنيرة قبل التسجيل. بعد موافقة IRB أو REC ، قم بتسجيل البروتوكول بشكل مستقبلي في مستودع عام ، مثل التجارب السريرية (https://clinicaltrials.gov). إذا كان لدى بلدك مستودع وطني ، فقم بتسجيل البروتوكول هناك (على سبيل المثال ، في البرازيل ، هناك التجارب السريرية البرازيلية (https://ensaiosclinicos.gov.br). تمت الموافقة على الدراسة الحالية من قبل IRB المحلي (رقم الشهادة CAAE 63190422.0.0000.5108) وتم تسجيلها مستقبلا في سجل التجارب السريرية (ReBEC #RBR-3vj5dc5 https://ensaiosclinicos.gov.br/rg/RBR-3vj5dc5).
1. اختيار وإعداد المتطوعين
- حساب حجم العينة المطلوب للتجارب
- حدد الموضوعات التي: يعانون من السمنة المفرطة (مؤشر كتلة الجسم >30 كجم / م2) ؛ لديهم السمنة المركزية (محيط الخصر > 102/88 سم في الرجال / النساء) ؛ تتراوح أعمارهم بين >40 سنة ؛ قادرون على أداء تمارين القوة.
- استبعاد الموضوعات التي: تظهر علامات أو أعراض أو وجود مرض السكري أو أي مرض استقلابي آخر ، وأمراض القلب والأوعية الدموية ، وأمراض الأوعية الدموية الدماغية ، وأمراض الكلى ، وأمراض الجهاز التنفسي ، وأمراض العظامالمفصلية 27 ؛ الإبلاغ عن استخدام أي دواء قد يؤثر على النتائج المتوقعة (بما في ذلك وسائل منع الحمل عن طريق الفم28) ؛ الإبلاغ عن استخدام المنشطات. حاملا أو تنوي الحمل أثناء الدراسة ؛ وصف تناول المكملات الغذائية المعروف أنه يؤثر على أداء التمارين الرياضية ، مثل الكافيين وبيتا ألانين والكرياتين وبيكربونات الصوديوم29.
- احصل على توقيع المشارك في الموافقة المستنيرة وقم بتخزينه في خزانة خاصة.
2. قياس تكوين جسم المشارك
- في هذه الدراسة ، قم بتقييم تكوين الجسم عن طريق قياس امتصاص الأشعة السينية ثنائي الطاقة ، باتباع تعليمات الشركة المصنعة لتحليل كتلة الدهون والكتلة الخالية من الدهون. ومع ذلك ، يمكن استخدام أي طريقة أخرى ثابتة (مثل Bod Pod ، الوزن تحت الماء ، طية الجلد).
3. الرقابة الغذائية
- حدد موعدا مع أخصائي التغذية المعتمد لفريق البحث لإرشاد المشاركين حول كيفية تسجيل نظامهم الغذائي لمدة 3 أيام (2 أيام الأسبوع ، 1 عطلة نهاية الأسبوع).
- ضع خطة غذائية مع أخصائي التغذية بناء على احتياجات المشاركين من الطاقة وتناول الطعام ، لضمان اتباع نظام غذائي متساوي السعرات الحرارية في اليوم السابق وفي يوم الجلسات30.
4. التعريف
- اطلب من المشاركين إجراء جلسات تعريف 5 ، مفصولة بأيام 2 على الأقل.
- الجلسة التعريفية 1
- إرشاد المشارك على شكل الرفع: نطاق الحركة ، ومدة المراحل متحدة المركز وغريب الأطوار (~ 3 ثانية إجمالي مدة التكرار) في كل من تمارين القوة السبعة (1 - القرفصاء السداسي ؛ 2 - الضغط على مقاعد البدلاء ؛ 3 - الضغط على الساق ؛ 4 - السحب اللات. 5 - تمديد الساق ؛ 6 - الضغط على الكتف ؛ 7 - حليقة الساق).
- قم بإرشاد المشاركين حول كيفية تقييم جهودهم بناء على مقياس OMNI-RES30.
- اطلب من المشارك إجراء عملية إحماء لمدة 5 دقائق عن طريق المشي على جهاز المشي بسرعة ~ 3-4 كم / ساعة.
- اطلب من المشاركين أداء 3 مجموعات من 8 تكرارات في كل تمرين من التمارين السبعة التي يعتبرونها سهلة أو بين المستويين 3 و 4 وفقا لمقياس OMNI-RES.
- اسمح بالتعافي من 90 إلى 120 ثانية بين المجموعات والتمارين.
- الجلسة التعريفية 2
- إرشاد المشارك حول كيفية الإجابة على مقياس المودة31,32 ، ومقياس متعة النشاط البدني (PACES) 32,33 ، ومقياس الكفاءة الذاتية 34.
- اطلب من المشارك الإجابة على مقياس المودة قبل جلسة التعريف.
- اطلب من المشارك إجراء عملية إحماء لمدة 5 دقائق عن طريق المشي على جهاز المشي بسرعة 3-4 كم / ساعة.
- اطلب من المشارك أداء 3 مجموعات من 8 تكرارات في كل تمرين من التمارين السبعة ، التي يعتبرونها صعبة أو بين المستويين 5 و 7 وفقا لمقياس OMNI-RES.
- اسمح بالتعافي من 90 إلى 120 ثانية بين المجموعات والتمارين.
- اطلب من المشارك الإجابة على مقياس المودة ، و PACES ، ومقياس الكفاءة الذاتية بعد جلسة التعريف.
- الجلسة التعريفية 3
- اطلب من المشارك الإجابة على مقياس المودة قبل جلسة التعريف.
- اطلب من المشارك إجراء عملية إحماء لمدة 5 دقائق عن طريق المشي على جهاز المشي بسرعة ~ 3-4 كم / ساعة.
- اطلب من المشاركين أداء 3 مجموعات من 8 تكرارات في كل تمرين من التمارين السبعة ، التي يعتبرونها صعبة ، أو بين المستويين 7 و 9 وفقا لمقياس OMNI-RES.
- اسمح بالتعافي من 90 إلى 120 ثانية بين المجموعات والتمارين.
- اطلب من المشارك الإجابة على مقياس المودة ، و PACES ، ومقياس الكفاءة الذاتية بعد جلسة التعريف.
- جلسة التعريف 4
- اطلب من المشارك الإجابة على مقياس المودة قبل جلسة التعريف.
- اطلب من المشارك إجراء عملية إحماء لمدة 5 دقائق عن طريق المشي على جهاز المشي بسرعة 3-4 كم / ساعة.
- اطلب من المشارك أداء 3 مجموعات من 8 تكرارات في كل تمرين من التمارين السبعة ، والتي يعتبرونها صعبة وصعبة للغاية أو بين المستويين 9 و 10 وفقا لمقياس OMNI-RES.
- اسمح بالتعافي من 90 إلى 120 ثانية بين المجموعات والتمارين.
- اطلب من المشارك الإجابة على مقياس المودة ، و PACES ، ومقياس الكفاءة الذاتية بعد جلسة التعريف.
- جلسة تعريفية 5
- اطلب من المشارك تقليد اختبارات القوة (انظر التفاصيل في الخطوة 5). يمكن أن تصل الفترة الفاصلة بين جلسات التعريف إلى 7 أيام ويمكن جدولتها بناء على وجود وجع عضلي متأخر.
ملاحظة: تهدف جلسة التعريف الأخيرة هذه إلى تعريف المشارك باختبارات القوة. من المهم للغاية في هذه الدراسة أن يكون لديك فترة تعريف شاملة 1) للتأكد من أن المشارك يمكنه أداء المجموعات عند أو قريب جدا من الفشل متحد المركز18 ، و 2) لتجنب التأثير السلبي لتلف العضلات على حساسية الأنسولين35،36،37.
- اطلب من المشارك تقليد اختبارات القوة (انظر التفاصيل في الخطوة 5). يمكن أن تصل الفترة الفاصلة بين جلسات التعريف إلى 7 أيام ويمكن جدولتها بناء على وجود وجع عضلي متأخر.
- الجلسة التعريفية 1
5. اختبارات القوة (8 تكرار كحد أقصى)
- قم بإجراء اختبارات القوة (8 تكرار كحد أقصى [RM]) في كل تمرين من التمارين السبعة لما مجموعه 72 ساعة على الأقل (ولكن ليس أكثر من 7 أيام) بعد آخر جلسة تعريف.
- اطلب من المشارك إجراء عملية إحماء لمدة 5 دقائق عن طريق المشي على جهاز المشي بسرعة 3-4 كم / ساعة.
- اطلب من المشارك أداء مجموعة واحدة مع حمولة منخفضة (12 تكرارا ، 40٪ -50٪ من RM ، مقياس 3-4 OMNI) قبل كل تمرين.
- اضبط الوزن على الحمل المتوقع الذي سيتمكن فيه المشارك من أداء 8 ، ولكن ليس 9 ، التكرار بشكل جيد. سجل هذا الحمل.
- إذا كان المشارك غير قادر على أداء 8 تكرارات بسبب فقدان الشكل الجيد ، أو الفشل العضلي متحد المركز ، أو إذا أوقف المشارك المجموعة طواعية بسبب التعب ، فقم بتقليل الحمل بنسبة 5-10٪ ، دعهم يستريحون لمدة 3-5 دقائق ، وقم بمحاولة أخرى.
- إذا كان المشارك قادرا على أداء 9 تكرارات ، فقم بزيادة الحمل بنسبة 5-10٪ ، واتركه يستريح لمدة 3-5 دقائق ، وقم بمحاولة أخرى.
- كرر الخطوتين 5.1.4 و 5.1.5 حتى يتمكن المشارك من أداء 8 مرات وليس 9 تكرارات وتسجيل الحمل.
ملاحظة: لتجنب التباين بين المقيمين ، يجب على نفس عضو فريق البحث إجراء اختبارات القوة مع جميع المشاركين. - إجراء الاختبارات بنفس ترتيب التمارين الموضحة أعلاه 1 - القرفصاء شريط سداسي عشري ؛ 2 - الصحافة مقاعد البدلاء. 3 - الصحافة الساق. 4 - خط العرض المنسدل ؛ 5 - تمديد الساق. 6 - ضغط الكتف ؛ 7 - تجعيد الساق ، مما يسمح ب 3 دقائق على الأقل بين التمارين.
ملاحظة: قم بتأسيس الحمل المتوقع على أداء جلسة التعريف الخامسة ، عندما يتم محاكاة اختبارات القوة. لتجنب التعب المفرط ، من الأفضل العثور على حمل 8 RM في المحاولة الأولى لكل تمرين ، ولكن محاولات 2 مقبولة.
6. تخصيص جلسة عشوائية
- اطبع تسلسلات عشوائية بالأرقام 1 و 2 و 3 التي تمثل الحجم الكبير والحجم المنخفض والتحكم ، على التوالي ، وأدخل كل واحدة داخل مغلف معتم ومرقم بالتسلسل وختم الأظرف.
- افتح الأظرف للكشف عن ترتيب الجلسة بعد اختبارات القوة.
ملاحظة: يجب تنفيذ الخطوة 6.1 من قبل متعاون بحثي لا يشارك بشكل مباشر في جمع البيانات ، أو مسؤول عن فتح المغلفات.
7. جمع البيانات العمياء
- توجيه المشاركين بعدم الكشف عن الجلسة التي أدوها في الليلة السابقة لموظفي المختبر السريري حيث سيتم إجراء OGTT.
- اطلب من متعاون بحثي، لا يشارك بشكل مباشر في جمع البيانات وتحليلها، إدخال البيانات من المكتب العام التونسي للشغل في جداول بيانات منفصلة باستخدام رموز لإخفاء هوية المشارك والجلسة التي تم تنفيذها.
ملاحظة: نظرا للخصائص المتأصلة في تصميم هذه الدراسة (التمرين) ، فإن تعمية كل من المشارك والمعالج غير ممكن.
8. جلسات التمرين
- الجلسة 1 - حجم كبير
- اطلب من المشارك عدم الانخراط في تمرين معتدل إلى عالي الكثافة لمدة 2 أيام على الأقل قبل الجلسة.
- اطلب من المشارك اتباع النظام الغذائي الذي يحدده أخصائي التغذية في اليوم السابق وفي يوم الجلسة. الوجبة الأخيرة الساعة 6:30 مساء
- اطلب من المشارك الحضور إلى صالة الألعاب الرياضية في الساعة 7:30 مساء.
- اطلب من المشارك الإجابة على مقياس المودة قبل جلسة التمرين في الساعة 7:55 مساء.
- اطلب من المشارك إجراء عملية إحماء لمدة 5 دقائق عن طريق المشي على جهاز المشي بسرعة 3-4 كم / ساعة.
- اطلب من المشارك أداء 3 مجموعات مع أكبر عدد ممكن من التكرار (حتى فشل عضلي متحد المركز أو حتى يتوقف المشارك عن المجموعة طواعية) في كل تمرين من التمارين ال 7 مع الحمل من اختبار 8 RM وسجل عدد التكرار في كل مجموعة.
- اطلب من المشارك تقييم جهوده بناء على مقياس OMNI-RES بعد كل مجموعة وسجل. اسمح باستعادة 120 ثانية بين المجموعات والتمارين.
- اطلب من المشارك الإجابة على مقياس المودة و PACES ومقياس الكفاءة الذاتية بعد الانتهاء من الجلسة.
- اطلب من المشارك تناول وجبة ما بعد الجلسة بين الساعة 9:00 و 9:30 مساء واطلب من المشارك عدم تناول أي شيء آخر (باستثناء الماء) حتى صباح اليوم التالي عندما يتم إجراء OGTT وإرساله إلى المنزل.
- الجلسة 2 - الحجم المنخفض
- كرر الخطوات من 8.1.1 إلى 8.1.3. اطلب من المشارك الإجابة على مقياس المودة في الساعة 8:35 مساء. كرر الخطوة 8.1.5.
- اطلب من المشارك أداء مجموعة 1 مع أكبر عدد ممكن من التكرار (حتى فشل عضلي متحد المركز أو حتى يتوقف المشارك عن المجموعة طواعية) في كل تمرين من التمارين ال 7 مع الحمل من اختبار 8 RM وتسجيل عدد التكرار في كل مجموعة.
- كرر الخطوات من 8.1.7 إلى 8.1.9
- الجلسة 3 - يوم التحكم
- كرر الإجراءات من 8.1.1 إلى 8.1.4.
- ضع المشارك في كل تمرين / جهاز لمدة 30 ثانية (محاكاة فترة المجموعة النشطة) ولكن اطلب منهم عدم إجراء أي تقلص عضلي (أو ببساطة البقاء ثابتين في التمرين / المعدات).
- كرر الخطوة 8.3.2 ل 3 مجموعات مزيفة لجميع التمارين السبعة (محاكاة الجلسة 1 ، ولكن دون أي تقلص عضلي).
- كرر الخطوات من 8.1.7 إلى 8.1.9
9. OGTT وتحليل البيانات
- اطلب من المشاركين تقديم تقرير إلى المختبر بين الساعة 7:00 و 7:30 صباحا.
- اجمع عينة دم صائم كما هو موضح في38,39.
- اطلب من المشاركين تناول 75 جم من الجلوكوز في محلول 300 مل. اجمع عينات الدم في 30 دقيقة و 60 دقيقة و 90 دقيقة و 120 دقيقة بعد تناول الجلوكوز.
- قياس تركيز الجلوكوز في البلازما والأنسولين في الدم في جميع عينات الدم كما هو موضح في38،39. بيانات المؤامرة من OGTT.
- احسب أ) AUC للجلوكوز والأنسولين باتباع القاعدة شبه المنحرفة40 ؛ ب) مؤشر حساسية الأنسولين الجلوكوز عن طريق الفم41 ؛ ج) مؤشر حساسية الأنسولين ماتسودا42 ؛ د) مؤشر سيديرهولم43 ؛ ه) مؤشر حساسية الأنسولين في العضلات44,45 ؛ و) مؤشر Gutt46 ؛ ز) فهرس أفينيون وآخرون47 ؛ و ح) مؤشر Stumvoll et al.48.
10. التحليل الإحصائي
- تحليل البيانات العمياء عن التخصيص باستخدام جداول البيانات المشفرة من الخطوة 7.2.
- التعبير عن البيانات كمتوسط وانحراف معياري. تقييم الحالة الطبيعية للبيانات باستخدام اختبار Shapiro-Wilk. بالنسبة للبيانات الموزعة بشكل طبيعي ، قم بتحليل البيانات باستخدام تحليلات أحادية الاتجاه للتباين ، إذا لوحظ تأثير رئيسي كبير ، فاستخدم اختبار Tukey اللاحق.
- بالنسبة للبيانات غير البارامترية ، استخدم اختبار Kruskal-Wallis أو اختبار فريدمان. ضع في اعتبارك الأهمية عندما تكون قيم p أقل من 0.05.
- كشف التخصيص بعد تشغيل جميع الإحصائيات.
Access restricted. Please log in or start a trial to view this content.
النتائج
يوضح الشكل 2 استجابات تمثيلية (من دراسة تجريبية) للجلوكوز (الشكل 2 أ) والأنسولين (الشكل 2 ب) خلال OGTT. عادة ، يتم ملاحظة قمم قيم الجلوكوز والأنسولين عند قياس 30 دقيقة ، يليه انخفاض مستمر حتى قياس 120 دقيقة. كلما انخفضت ذروة الجلوكوز ، كانت النتيجة أ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
فصلت هذه الورقة خطوات تجربة معشاة ذات شواهد تهدف إلى تقييم آثار حجم تمارين القوة على حساسية الأنسولين لدى البالغين الذين يعانون من السمنة المفرطة. التجارب المعشاة ذات الشواهد هي أفضل بروتوكولات البحث لتحديد سبب ونتيجة العلاج بطريقة غير متحيزة49,50. على وجه ا...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
هذه الدراسة مدعومة من قبل المجلس الوطني للتنمية العلمية والتكنولوجية (CNPQ: Grant # 407975 / 2018-7 و # 402091 / 2021-3) ووكالة ولاية ميناس جيرايس للبحث والتطوير (FAPEMIG: Grant # APQ-00008-22). لم يلعب الممولون أي دور في تصميم هذه الدراسة ، ولا يلعبون أي أدوار في إجراء الدراسة أو تفسير البيانات أو الإبلاغ عن النتائج. تستند هذه الدراسة إلى الجامعة الفيدرالية في وديان جيكيتينهونها وموكوري (Diamantina-MG ، البرازيل) التي توفر المعدات والمساحة (DXA ، غرفة تدريب القوة ، معدات تدريب القوة ، إلخ) اللازمة لإجراء البحث.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| dual-energy X-ray absorptiometry | GE | DXA, Lunar, iDXA Advanced | for assessing body composition |
| G*Power program | Heinrich-Heine-Universität Düsseldorf, Germany | version 3.1.9.6 | for calculating sample size |
References
- Ismail, A. D., et al. The effect of short-duration resistance training on insulin sensitivity and muscle adaptations in overweight men. Experimental physiology. 104 (4), 540-545 (2019).
- Jiahao, L., Jiajin, L., Yifan, L. Effects of resistance training on insulin sensitivity in the elderly: A meta-analysis of randomized controlled trials. Journal of Exercise Science and Fitness. 19 (4), 241-251 (2021).
- Liu, Y., et al. Resistance exercise intensity is correlated with attenuation of HbA1c and insulin in patients with type 2 diabetes: A systematic review and meta-analysis. International Journal of Environmental Research and Public Health. 16 (1), (2019).
- van Dijk, J. W., et al. Both resistance- and endurance-type exercise reduce the prevalence of hyperglycaemia in individuals with impaired glucose tolerance and in insulin-treated and non-insulin-treated type 2 diabetic patients. Diabetologia. 55 (5), 1273-1282 (2012).
- Koopman, R., et al. A single session of resistance exercise enhances insulin sensitivity for at least 24 in healthy men. European Journal of Applied Physiology. 94 (1-2), 180-187 (2005).
- Andersen, E., Høstmark, A. T. Effect of a Single Bout of Resistance Exercise on Postprandial Glucose and Insulin Response the Next Day in Healthy, Strength-Trained Men. The Journal of Strength and Conditioning Research. 21 (2), 487(2007).
- Tong, T. K., Kong, Z., Shi, X., Shi, Q. Comparable Effects of Brief Resistance Exercise and Isotime Sprint Interval Exercise on Glucose Homeostasis in Men. Journal of Diabetes Research. 2017, (2017).
- Monroe, J. C., Naugle, K. M., Naugle, K. E. Effect of Acute Bouts of Volume-Matched High-Intensity Resistance Training Protocols on Blood Glucose Levels. Journal of Strength and Conditioning Research. 34 (2), 445-450 (2020).
- Bittel, A. J., et al. A Single Bout of Premeal Resistance Exercise Improves Postprandial Glucose Metabolism in Obese Men with Prediabetes. Medicine and science in sports and exercise. 53 (4), (2021).
- Fluckey, J. D., et al. Effects of resistance exercise on glucose tolerance in normal and glucose-intolerant subjects. Journal of Applied Physiology. 77 (3), 1087-1092 (1994).
- Fenicchia, L. M., et al. Influence of resistance exercise training on glucose control in women with type 2 diabetes. Metabolism: Clinical and Experimental. 53 (3), 284-289 (2004).
- Gordon, B. A., Fraser, S. F., Bird, S. R., Benson, A. C. Insulin sensitivity not modulated 24 to 78h after acute resistance exercise in type 2 diabetes patients. Diabetes, Obesity and Metabolism. 15 (5), 478-480 (2013).
- Gordon, B. A., Fraser, S. F., Bird, S. R., Benson, A. C. Insulin sensitivity in response to a single resistance exercise session in apparently healthy individuals. Journal of Endocrinological Investigation. 35 (7), 665-669 (2012).
- Malin, S. K., Hinnerichs, K. R., Echtenkamp, B. G., Evetovich, T. K., Engebretsen, B. J. Effect of adiposity on insulin action after acute and chronic resistance exercise in non-diabetic women. European Journal of Applied Physiology. 113 (12), 2933-2941 (2013).
- Moreno-Cabañas, A., et al. One Bout of Resistance Training Does Not Enhance Metformin Actions in Prediabetic and Diabetic Individuals. Medicine and Science in Sports and Exercise. 54 (7), (2022).
- Luebbers, P. E., et al. Glucose Uptake After Resistance Training of Different Intensities but of Equal Work Volume. Journal of Strength and Conditioning Research. 22 (4), 1094-1100 (2008).
- Chapman, J., Garvin, A. W., Ward, A., Cartee, G. D. Unaltered insulin sensitivity after resistance exercise bout by postmenopausal women. Medicine & Science in Sports & Exercise. 34 (6), 936-941 (2002).
- Brown, E. C., Franklin, B. A., Regensteiner, J. G., Stewart, K. J. Effects of single bout resistance exercise on glucose levels, insulin action, and cardiovascular risk in type 2 diabetes: A narrative review. Journal of Diabetes and its Complications. 34 (8), (2020).
- Ishiguro, H., et al. In Search of the Ideal Resistance Training Program to Improve Glycemic Control and its Indication for Patients with Type 2 Diabetes Mellitus: A Systematic Review and Meta-Analysis. Sports Medicine. 46 (1), 67-77 (2016).
- Reed, M. E., Ben-Ezra, V., Biggerstaff, K. D., Nichols, D. L. The Effects of Two Bouts of High- and Low-Volume Resistance Exercise on Glucose Tolerance in Normoglycemic Women. Journal of Strength and Conditioning Research. 26 (1), 251-260 (2012).
- Black, L. E., Swan, P. D., Alvar, B. A. Effects of Intensity and Volume on Insulin Sensitivity During Acute Bouts of Resistance Training. Journal of Strength and Conditioning Research. 24 (4), 1109-1116 (2010).
- Carballo-Fazanes, A., et al. Physical Activity Habits and Determinants, Sedentary Behaviour and Lifestyle in University Students. International Journal of Environmental Research and Public Health. 17 (9), 3272(2020).
- SCHOENFELD, B. J., et al. Resistance Training Volume Enhances Muscle Hypertrophy but Not Strength in Trained Men. Medicine & Science in Sports & Exercise. 51 (1), 94-103 (2019).
- Neupert, S. D., Lachman, M. E., Whitbourne, S. B. Exercise Self-Efficacy and Control Beliefs: Effects on Exercise Behavior after an Exercise Intervention for Older Adults. Journal of Aging and Physical Activity. 17 (1), 1-16 (2009).
- Gjestvang, C., Abrahamsen, F., Stensrud, T., Haakstad, L. A. H. Motives and barriers to initiation and sustained exercise adherence in a fitness club setting—A one-year follow-up study. Scandinavian Journal of Medicine and Science in Sports. 30 (9), (2020).
- Collado-Mateo, D., et al. Key factors associated with adherence to physical exercise in patients with chronic diseases and older adults: An umbrella review. International Journal of Environmental Research and Public Health. 18 (4), (2021).
- Riebe, D., et al. Updating ACSM’s Recommendations for Exercise Preparticipation Health Screening. Medicine & Science in Sports & Exercise. 47 (11), 2473-2479 (2015).
- Cortés, M. E., Alfaro, A. A. The effects of hormonal contraceptives on glycemic regulation. Linacre Quarterly. 81 (3), (2014).
- Kerksick, C. M., et al. ISSN exercise & sports nutrition review update: research & recommendations. , 1-57 (2018).
- ROBERTSON, R. J., et al. Concurrent Validation of the OMNI Perceived Exertion Scale for Resistance Exercise. Medicine & Science in Sports & Exercise. 35 (2), 333-341 (2003).
- Hardy, C. J., Rejeski, W. J. Not What, but How One Feels: The Measurement of Affect during Exercise. Journal of Sport and Exercise Psychology. 11 (3), (2016).
- Alves, E. D., Panissa, V. L. G., Barros, B. J., Franchini, E., Takito, M. Y. Translation, adaptation, and reproducibility of the Physical Activity Enjoyment Scale (PACES) and Feeling Scale to Brazilian Portuguese. Sport Sciences for Health. 15 (2), (2019).
- Kendzierski, D., DeCarlo, K. J. Physical Activity Enjoyment Scale: Two Validation Studies. Journal of Sport and Exercise Psychology. 13 (1), (2016).
- McAuley, E., Lox, C., Duncan, T. E. Long-term maintenance of exercise, self-efficacy, and physiological change in older adults. Journals of Gerontology. 48 (4), (1993).
- Chen, T. C., et al. Changes in Insulin Sensitivity and Lipid Profile Markers Following Initial and Secondary Bouts of Multiple Eccentric Exercises. Frontiers in Physiology. 13, (2022).
- Jimenez, C., Santiago, M., Sitler, M., Boden, G., Homko, C. Insulin-Sensitivity Response to a Single Bout of Resistive Exercise in Type 1 Diabetes Mellitus. Journal of Sport Rehabilitation. 18 (4), 564-571 (2009).
- Gonzalez, J. T., Barwood, M. J., Goodall, S., Thomas, K., Howatson, G. Alterations in whole-body insulin sensitivity resulting from repeated eccentric exercise of a single muscle group: A pilot investigation. International Journal of Sport Nutrition and Exercise Metabolism. 25 (4), 405-410 (2015).
- Ismail, A. D., et al. The effect of short-duration resistance training on insulin sensitivity and muscle adaptations in overweight men. Experimental Physiology. 104 (4), 540-545 (2019).
- de Matos, M. A., et al. High-Intensity Interval Training Improves Markers of Oxidative Metabolism in Skeletal Muscle of Individuals With Obesity and Insulin Resistance. Frontiers in Physiology. 9 (OCT), (2018).
- Carbohydrate Homeostasis. New England Journal of Medicine. 283 (5), 237-246 (1970).
- Mari, A., Pacini, G., Murphy, E., Ludvik, B., Nolan, J. J. A Model-Based Method for Assessing Insulin Sensitivity From the Oral Glucose Tolerance Test. Diabetes Care. 24 (3), 539-548 (2001).
- Matsuda, M., DeFronzo, R. A. Insulin sensitivity indices obtained from oral glucose tolerance testing: comparison with the euglycemic insulin clamp. Diabetes Care. 22 (9), 1462-1470 (1999).
- Cederholm, J., Wibell, L. Insulin release and peripheral sensitivity at the oral glucose tolerance test. Diabetes Research and Clinical Practice. 10 (2), 167-175 (1990).
- Abdul-Ghani, M. A., Matsuda, M., Balas, B., DeFronzo, R. A. Muscle and Liver Insulin Resistance Indexes Derived From the Oral Glucose Tolerance Test. Diabetes Care. 30 (1), 89-94 (2007).
- de Matos, M. A., et al. High-Intensity Interval Training Improves Markers of Oxidative Metabolism in Skeletal Muscle of Individuals With Obesity and Insulin Resistance. Frontiers in Physiology. 9, (2018).
- Gutt, M., et al. Validation of the insulin sensitivity index (ISI0,120): comparison with other measures. Diabetes Research and Clinical Practice. 47 (3), 177-184 (2000).
- Avignon, A., Bœgner, C., Mariano-Goulart, D., Colette, C., Monnier, L. Assessment of insulin sensitivity from plasma insulin and glucose in the fasting or post oral glucose-load state. International Journal of Obesity. 23 (5), (1999).
- Stumvoll, M., van Haeften, T., Fritsche, A., Gerich, J. Oral Glucose Tolerance Test Indexes for Insulin Sensitivity and Secretion Based on Various Availabilities of Sampling Times. Diabetes Care. 24 (4), 796-797 (2001).
- Kendall, J. M. Designing a research project: Randomised controlled trials and their principles. Emergency Medicine Journal. 20 (2), (2003).
- Moher, D., et al. CONSORT 2010 explanation and elaboration: updated guidelines for reporting parallel group randomised trials. BMJ (Clinical research ed.). 340, (2010).
- Sibbald, B., Roberts, C. Understanding controlled trials Crossover trials. BMJ. 316 (7146), (1998).
- Lim, C. Y., In, J. Considerations for crossover design in clinical study. Korean Journal of Anesthesiology. 74 (4), (2021).
- Taylor, H. L., et al. Post-exercise carbohydrate-energy replacement attenuates insulin sensitivity and glucose tolerance the following morning in healthy adults. Nutrients. 10 (2), (2018).
- Johnson-Bonson, D. A., et al. Interactive effects of acute exercise and carbohydrate-energy replacement on insulin sensitivity in healthy adults. Applied physiology, nutrition, and metabolism = Physiologie appliquee, nutrition et metabolisme. 46 (10), (2021).
- Patarrão, R. S., Wayne Lautt, W., Paula Macedo, M. Assessment of methods and indexes of insulin sensitivity. Revista Portuguesa de Endocrinologia, Diabetes e Metabolismo. 9 (1), 65-73 (2014).
- DeFronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. American Journal of Physiology Endocrinology Metabolism and Gastrointestinal Physiology. 6 (3), (1979).
- Monzillo, L. U., Hamdy, O. Evaluation of Insulin Sensitivity in Clinical Practice and in Research Settings. Nutrition Reviews. 61 (12), 397-412 (2003).
- Radziuk, J. Insulin Sensitivity and Its Measurement: Structural Commonalities among the Methods 1. The Journal of Clinical Endocrinology & Metabolism. 85 (12), (2000).
- Gordon, B. A., Fraser, S. F., Bird, S. R., Benson, A. C. Reproducibility of multiple repeated oral glucose tolerance tests. Diabetes Research and Clinical Practice. 94 (3), (2011).
- Beaudry, K. M., Surdi, J. C., Mari, A., Devries, M. C. Exercise mode influences post-exercise glucose sensitivity and insulin clearance in young, healthy males and females in a sex-dependent manner: A randomized control trial. Physiological Reports. 10 (13), (2022).
- Aguiar, S. daS., et al. Acute metabolic responses following different resistance exercise protocols. Applied Physiology, Nutrition and Metabolism. 43 (8), 838-843 (2018).
- Venables, M. C., Shaw, C. S., Jeukendrup, A. E., Wagenmakers, A. J. M. Effect of acute exercise on glucose tolerance following post-exercise feeding. European Journal of Applied Physiology. 100 (6), 711-717 (2007).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved