مقايسة تفاعل البلمرة المتسلسل الرقمي للقطرات القابلة للتحقق من صحتها للكشف عن النواقل الفيروسية المرتبطة بالغدي في دراسات الدموع البيولوجية
In This Article
Summary
هنا ، نقدم بروتوكولا لتطوير الممارسات المختبرية الجيدة والتحقق من صحتها في الكشف المتوافق عن النواقل الفيروسية المرتبطة بالغدي في الدموع البشرية عن طريق تفاعل البلمرة المتسلسل الرقمي لدعم التطوير السريري لنواقل العلاج الجيني.
Abstract
ازداد استخدام النواقل الفيروسية لعلاج الأمراض الوراثية بشكل كبير في السنوات الأخيرة ، حيث تم تسجيل أكثر من 2000 دراسة حتى الآن. حققت النواقل الفيروسية المرتبطة بالغدي (AAV) نجاحا خاصا في علاج الأمراض المرتبطة بالعين ، كما يتضح من الموافقة على voretigene neparvovec-rzyl. لجلب علاجات جديدة إلى السوق ، تطلب الوكالات التنظيمية عادة دراسات بيولوجية مؤهلة أو معتمدة لتقييم إطلاق الناقل في البيئة. ومع ذلك ، لم تصدر إدارة الغذاء والدواء الأمريكية أي مبادئ توجيهية رسمية لتطوير المقايسات الجزيئية لدعم دراسات التساقط هذه ، تاركة للمطورين تحديد أفضل الممارسات لأنفسهم. الغرض من هذا البروتوكول هو تقديم بروتوكول قابل للتحقق من صحته للكشف عن ناقلات AAV في الدموع البشرية عن طريق تفاعل البلمرة المتسلسل الرقمي (ddPCR) لدعم دراسات التكاثر البيولوجي السريرية. تناقش هذه المخطوطة مناهج الصناعة الحالية للتحقق من صحة الفحص الجزيئي وتوضح أن الطريقة تتجاوز معايير قبول الفحص المستهدف المقترحة حاليا في الأوراق البيضاء. أخيرا ، تتم مناقشة الخطوات الحاسمة في أداء أي مقايسة ddPCR ، بغض النظر عن التطبيق.
Introduction
تختلف تعريفات العلاج الجيني ، ولكنها تحفز بشكل عام تناوبا دائما مقصودا ومتوقعا في كثير من الأحيان لتسلسل معين من الحمض النووي للجينوم الخلوي لتعديل أو التلاعب بتعبير الجين أو لتغيير الخصائص البيولوجية للخلية الحية لغرض سريري 1,2. يتم استخدام النواقل الفيروسية بشكل متزايد كوسيلة للعلاج الجيني بسبب كفاءتها في النقل ، حيث يشير أحد التقارير إلى أن أكثر من 70٪ من التجارب السريرية الحالية للعلاج الجيني تستخدم النواقل الفيروسية3. يزداد الاهتمام بالنواقل الفيروسية للعلاج الجيني بشكل مطرد. أفاد تقرير البيانات الفصلية للربع 4 2022 حول مشهد العلاج بالجينات والخلايا والحمض النووي الريبي من الجمعية الأمريكية للعلاج الجيني والخلوي أنه في عام 2022 ، نما خط أنابيب العلاج بالجينات والخلايا والحمض النووي الريبي من التسجيل قبل السريري إلى التسجيل المسبق بنسبة 7٪ ، ليصل العدد الإجمالي للعلاجات قيد التطوير إلى 3,726 ، منها 2,053 (55٪) علاجات جينية4. وافقت إدارة الغذاء والدواء الأمريكية (USA FDA) حاليا على 27 علاجا للخلايا والجينات للاستخدام السريري في البشر ، خمسة منها تستخدم على وجه التحديد النواقل الفيروسية5.
اكتسبت الفيروسات المرتبطة بالغدي (AAVs) اهتماما خاصا كوسيلة للعلاج الجيني. كشف تحليل تلوي حديث أن هناك ما يقرب من 136 تجربة سريرية تحقق في استخدام AAVs في العقدين الماضيين6. بالإضافة إلى ذلك ، فإن ثلاثة من العلاجات الجينية الخمسة المعتمدة من إدارة الغذاء والدواء الأمريكية تعتمد على AAV. ويرجع ذلك إلى طبيعتها القابلة للتحرير بدرجة كبيرة ، ونطاق المضيف الواسع الذي يمكن ضبطه بناء على استخدام نواقل محددة تحدث بشكل طبيعي أو مهندسة صناعيا ، وانخفاض الإمراضية والسمية في البشر ، وانخفاض المناعةبشكل عام 7,8. كما تم استخدام AAVs بنجاح لعلاج أمراض العين في بيئة سريرية معتمدة. Voretigene neparvovec-rzyl هو علاج قائم على AAV2 تمت الموافقة عليه من قبل إدارة الغذاء والدواء الأمريكية في عام 2017 ومن قبل وكالة الأدوية الأوروبية (EMA) في عام 2018 لعلاج حثل الشبكية المرتبط بالطفرة ثنائية الأليلي RPE65 9.
مع الاهتمام المتزايد بتطوير العلاجات القائمة على AAV تأتي الحاجة إلى التوجيه التنظيمي بشأن المقايسات. يعد الكشف الدقيق عن أي ناقل فيروسي وقياسه جزءا لا يتجزأ من مراحل الاكتشاف والتصنيع والاختبار قبل السريري / السريري لتطوير المنتج. بدأت إدارة الغذاء والدواء الأمريكية في إصدار بعض الإرشادات للعلاجات الجينية ، بما في ذلك الكيمياء والتصنيع والتحكم في تطبيقات الأدوية الجديدة التجريبية للعلاج الجيني البشري 10 ، والمتابعة طويلة الأجل بعد إعطاء العلاج الجيني 11 ، واختبار الفيروس القهقري المؤهل للتكرار12 ، والتوصيات الخاصة بالنواقل الميكروبية المستخدمة في العلاجات الجينية 13. أصدرت EMA أيضا سلسلة من الإرشادات المتعلقة بتطوير منتجات العلاج الجيني التي تتوافق بشكل عام مع توصيات إدارة الغذاء والدواء ، على الرغم من وجود بعض الاختلافات14. من المهم ملاحظة أنه على الرغم من أن هذه الإرشادات لا تحدد مسؤوليات قابلة للتنفيذ قانونا ، إلا في حالة الإشارة إلى لوائح محددة ، إلا أنها توفر وضوحا بشأن التفكير الحالي من الوكالات التنظيمية حول هذا الموضوع وتوقعاتها للمقايسات المطلوبة لإيداعات الأدوية والموافقة التنظيمية.
توصي إدارة الغذاء والدواء على وجه التحديد بإجراء دراسات لتقييم توزيع وثبات وتخليص ناقل من موقع الإعطاء لاستهداف أنسجة العين وغير العين والسوائل داخل العين والدم15. هذه تأخذ شكل التوزيع البيولوجي ودراسات سفك. تقوم دراسات التوزيع الحيوي بتقييم التعرض من خلال التحقيق في كيفية انتشار المنتج في جميع أنحاء جسم المريض من موقع الإدارة. يقيم سفك على وجه التحديد إطلاق المنتج من المريض إلى البيئة ويزيد من إمكانية انتقال الناقل إلى الأفراد غير المعالجين16. تقدم إدارة الغذاء والدواء توصيات لتصميم دراسات التوزيع الحيوي وسفك فيما يتعلق بتكرار جمع العينات ومدة جمع العينات وأنواع العينات التي تم جمعها وظروف التخزين.
بالإضافة إلى ذلك ، توصي إدارة الغذاء والدواء الأمريكية باستخدام تفاعل البوليميراز المتسلسل الكمي (qPCR ، أو تفاعل البوليميراز المتسلسل في الوقت الفعلي) للكشف الكمي عن جينومات النواقل نظرا لسهولة أدائها ، وتنسيقها عالي الإنتاجية ، وأوقات التسليم السريعة ، وحساسية الفحص. ومع ذلك ، هناك نقص نسبي في التوصيات الخاصة بتصميم وتقييم أداء الطرق الجزيئية مقارنة بتلك الموجودة للجزيئات الصغيرة والكبيرة. يصعب تطبيق العديد من المبادئ التوجيهية لمثل هذه الدراسات على الطرق الجزيئية بسبب التصميم الفريد والمعقد لكل من المنتجات والمقايسات نفسها ، مما يثير تساؤلات حول مدى ملاءمة المنصات المتاحة للتقييمات الموصى بها والطرق المناسبة للتحقق من صحة الفحص. حتى الآن ، لم تطلب إدارة الغذاء والدواء الأمريكية التحقق الرسمي من المقايسات القائمة على تفاعل البوليميراز المتسلسل ، على الرغم من أن وكالة الأدوية الأوروبية فرضت هذا المطلب17. في ضوء هذا الفراغ ، أصدرت مجموعات وورش عمل مختلفة أوراقا بيضاء وتوصيات سعى المصنعون ومنظمات البحوث التعاقدية إلى اتباعها18،19،20،21،22،23،24،25. تمت كتابة معظم هذه التوصيات على وجه التحديد مع وضع مقايسات qPCR في الاعتبار ، مع اقتراحات أو تعديلات للمنصات الناشئة ، مثل تفاعل البوليميراز المتسلسل الرقمي بالقطرات (ddPCR) ، المدرجة فقط حسب الاقتضاء. ركزت التوصيات الأحدث عهدا على اعتبارات مقايسات ddPCR ، لكنها ركزت إلى حد كبير على تطبيقاتها على القياس الكمي لجينوم المتجهات في بيئة التصنيع بدلا من المصفوفات البيولوجية المعقدة التي تمت مواجهتها في دراسات التكاثر البيولوجي.
اعتمادا على التطبيق السريري والأهداف ، قد يفضل ddPCR على qPCR لدعم دراسات التوزيع الحيوي والتساقط بسبب زيادة حساسية ddPCR وقدرته على التعامل مع تداخل المصفوفة مقارنة ب qPCR. علاوة على ذلك ، نظرا لتقسيم العينات إلى ما يقرب من 20000 قطرة ، يمكن تحقيق تقدير كمي دقيق لرقم النسخة دون استخدام منحنى قياسي باستخدام إحصائيات بواسون ، مما يبسط تطوير الطريقة والتحقق من صحتها. الهدف من هذا البروتوكول هو وصف نهج موحد لتطوير والتحقق من صحة طريقة قائمة على ddPCR للكشف عن ناقلات AAV في الدموع التي تم جمعها من سطح العين لدعم دراسات التكاثر البيولوجي السريرية.
Protocol
1. إعداد جزء من الحمض النووي الاصطناعية
- تصميم وطلب جزء من الحمض النووي الاصطناعي يحتوي على منطقة التضخيم المستهدفة لاستخدامها كمراقبة الجودة.
- تأكد من أن التسلسل يحتوي على تسلسل amplicon بالكامل من التمهيدي الأمامي إلى التمهيدي العكسي للجين المستهدف محل الاهتمام ، مع امتداد من أربعة إلى ستة أزواج أساسية من التسلسل عند نهايات 5 'لكل تسلسل ربط التمهيدي.
- تجنب البوليمرات المتجانسة للأدينين والثايمين أكبر من 12 زوجا من القواعد أو أزواج قواعد الجوانين والسيتوزين أكبر من ثمانية أزواج من القواعد ، حيث قد تتداخل البوليمرات المتجانسة الطويلة مع تخليق جزء الجين.
ملاحظة: إذا كانت الأمبليكونات تحتوي على مثل هذه التسلسلات ، فيمكن إجراء بدائل القاعدة طالما يتم الحفاظ على مواقع التلدين للبادئات والمجسات. - بدلا من ذلك ، قم بإعداد بلازميد خطي يحتوي على الأمبليكون باستخدام استراتيجيات الاستنساخ النموذجية.
- أجهزة الطرد المركزي الأنبوب الذي يحتوي على جزء الحمض النووي الاصطناعي في جهاز طرد مركزي دقيق لمدة ~ 10 ثوان لضمان جمع المواد في قاع الأنبوب.
- أعد تعليق جزء الحمض النووي الاصطناعي باستخدام المخزن المؤقت tris-EDTA (TE) إلى تركيز 1.0 × 1010 نسخ / ميكرولتر ، أو حسب الاقتضاء بناء على نطاق الفحص المستهدف.
- دوامة لفترة وجيزة ، ثم احتضان في 50 درجة مئوية لمدة 20 ± 5 دقائق. بارد على الجليد.
- قم بإعداد حصص متعددة ومثالية للاستخدام مرة واحدة وتخزينها في درجة حرارة -70 إلى -90 درجة مئوية حتى الاستخدام.
ملاحظة: عادة ما تكون شظايا الحمض النووي الاصطناعية المحضرة بهذه الطريقة مستقرة لمدة 24 شهرا على الأقل من تاريخ التعليق. - إذا رغبت في ذلك ، حدد التركيز الدقيق لمخزون الحمض النووي الاصطناعي المحضر قبل استخدامه كمراقبة للجودة ، أو قم بتقدير التركيز الاسمي بناء على إعادة التعليق المستخدمة.
2. إعداد الاشعال والتحقيق
- تصميم وطلب الاشعال ومسبار التحلل المائي لاستهداف منطقة التضخيم المطلوبة باستخدام استراتيجيات التصميم النموذجية26,27.
- استخدم صبغة مراسل فلورية مقاس 5 بوصات (على سبيل المثال ، FAM) وجهاز إخماد 3 بوصات (على سبيل المثال ، Iowa Black dark Quencher) متوافق مع نظام ddPCR.
ملاحظة: توجد العديد من حزم برامج تصميم مقايسة تفاعل البوليميراز المتسلسل ، ويمكن استخدام أي منها. على سبيل المثال ، يستخدم Primer-BLAST من قبل المركز الوطني لمعلومات التكنولوجيا الحيوية28 على نطاق واسع بسبب الخيارات القوية لتصميم الفحص والسهولة التي يمكن بها تقييم الخصوصية المعلوماتية الحيوية لتحديد الآثار المحتملة خارج الهدف. تجدر الإشارة إلى أن إعداد الاشعال والتحقيقات قد يختلف عن الخطوات المذكورة هنا اعتمادا على التنسيق الذي يتم توفيره به.
- استخدم صبغة مراسل فلورية مقاس 5 بوصات (على سبيل المثال ، FAM) وجهاز إخماد 3 بوصات (على سبيل المثال ، Iowa Black dark Quencher) متوافق مع نظام ddPCR.
- أجهزة الطرد المركزي الأنابيب التي تحتوي على التمهيدي الأمامي ، التمهيدي العكسي ، والتحقيق في جهاز طرد مركزي دقيق ل ~ 10 ثانية لحبيبات المواد إلى أسفل الأنبوب.
- أعد تعليق البادئات إلى 20 ميكرومتر باستخدام المخزن المؤقت TE. دوامة لفترة وجيزة.
- أعد تعليق المسبار إلى 10 ميكرومتر باستخدام المخزن المؤقت TE. دوامة لفترة وجيزة.
- قم بإعداد حصص متعددة تستخدم مرة واحدة بشكل مثالي وقم بتخزينها في درجة حرارة -20 درجة مئوية على الأقل حتى الاستخدام.
ملاحظة: عادة ما تكون البادئات والمجسات المعدة بهذه الطريقة مستقرة لمدة 24 شهرا على الأقل من تاريخ التعليق.
3. إعداد المخزن المؤقت لتخفيف العينة
- قم بإذابة محلول PCR والحمض النووي للحيوانات المنوية المنفصمة في درجة حرارة الغرفة. دوامة جيدا لخلط.
- قم بإعداد مخزن مؤقت لتخفيف العينة ، كما هو موضح في الجدول 1.
- دوامة بدقة. يحفظ في درجة حرارة 2-8 درجة مئوية لمدة تصل إلى شهر واحد بعد التحضير.
الجدول 1: تحضير المخزن المؤقت لتخفيف العينة. الرجاء الضغط هنا لتنزيل هذا الجدول.
4. إعداد مزيج رئيسي
- قم بإذابة المزيج الرئيسي ddPCR للمجسات ، والتمهيدي الأمامي ، والتمهيدي العكسي ، والمسبار في درجة حرارة الغرفة واتركه يسخن لمدة 10 دقائق على الأقل بعد الذوبان قبل الاستخدام. يحفظ في درجة حرارة الغرفة حتى الاستخدام.
ملاحظة: يجب إحضار هذه الكواشف بالكامل إلى درجة حرارة الغرفة لضمان تكوين قطرات بكفاءة. لا تحمل الكواشف على الجليد أثناء التحضير.- دوامة بدقة ولفترة وجيزة الطرد المركزي في جهاز طرد مركزي صغير قبل الاستخدام.
ملاحظة: عادة ما يتم توفير إنزيمات التقييد في الجلسرين ويجب إزالتها من التخزين مباشرة قبل الاستخدام. تخلط بلطف. لا دوامة.
- دوامة بدقة ولفترة وجيزة الطرد المركزي في جهاز طرد مركزي صغير قبل الاستخدام.
- قم بإعداد مزيج رئيسي PCR لكل هدف تضخيم. انظر الجدول 2 للحصول على تركيبة مزيج رئيسي مقترحة من تفاعل البوليميراز المتسلسل وتعديل تركيزات البادئات والمجسات حسب الحاجة.
- دوامة تماما وأجهزة الطرد المركزي لفترة وجيزة قبل إضافة إنزيم التقييد. أضف إنزيم التقييد واقلبه للخلط.
ملاحظة: في هذه الخطوة ، يلزم 22 ميكرولتر من تفاعل تفاعل البوليميراز المتسلسل للحصول على حجم نهائي قدره 40 ميكرولتر من تفاعل تفاعل البوليميراز المتسلسل بعد تكوين القطيرات (يتكون من 15 ميكرولتر من المزيج الرئيسي PCR ، و 5.0 ميكرولتر من القالب ، و 20 ميكرولتر من زيت توليد القطيرات).
- دوامة تماما وأجهزة الطرد المركزي لفترة وجيزة قبل إضافة إنزيم التقييد. أضف إنزيم التقييد واقلبه للخلط.
- أضف 16.5 ميكرولتر من المزيج الرئيسي إلى كل بئر وفقا لخريطة اللوحة. انظر الشكل 1 للحصول على مثال لخريطة اللوحة للحصول على دقة التحقق من الصحة والتشغيل الدقيق.
- تأكد من أن اللوحة تحتوي على ثلاثة مستحضرات مستقلة من سلسلة مراقبة الجودة (QC) ، وثلاثة حصص تمزق داخلية تم اختبارها بشكل مستقل ، وارتفعت إلى مستوى عال ومنخفض وغير مسنن ، وثلاثة عناصر تحكم مستقلة بدون قالب (NTCs).
- قم بتغيير تخطيط هذه الآبار عبر اللوحة ، حيث يتم تحميل المجموعة 1 من أجل تقليل التركيز ، ويتم تحميل المجموعة 2 من أجل زيادة التركيز ، ويتم تحميل المجموعة 3 بترتيب عشوائي لتقييم ما إذا كانت هناك أي تأثيرات خاصة بموقع اللوحة.
- قم بترتيب العينات لملء أكبر قدر ممكن من العمود وملء الآبار غير المستخدمة داخل عمود باستخدام مخزن مؤقت للتحكم. قم بتضمين العديد من مجموعات التحكم الداخلية (على سبيل المثال ، المزيد من برك الدموع أو الدموع التي تم جمعها من الأفراد) في الآبار المتبقية ، إذا رغبت في ذلك.
- ختم اللوحة مع فيلم لاصق واضح. امسك اللوحة في درجة حرارة الغرفة أثناء تحضير القالب. بدلا من ذلك ، أمسك اللوحة لمدة تصل إلى 4 ساعات عند 2-8 درجة مئوية ، ولكن أعدها إلى درجة حرارة الغرفة لمدة 10 دقائق على الأقل قبل إضافة القالب.
الجدول 2: مثال على تحضير المزيج الرئيسي PCR. الرجاء الضغط هنا لتنزيل هذا الجدول.
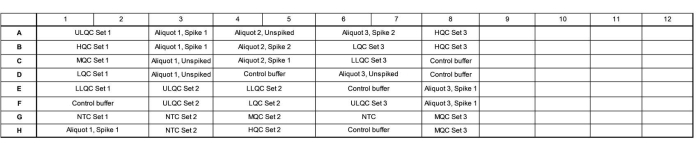
الشكل 1: مثال على خريطة اللوحة للتحقق من دقة التحقق والتشغيل الدقيق. الاختصارات: ULQC = الحد الأعلى لمراقبة الجودة ؛ HQC = مراقبة الجودة العالية ؛ MQC = مراقبة الجودة المتوسطة ؛ LQC = مراقبة الجودة المنخفضة ؛ LLQC = مراقبة جودة الحد الأدنى ؛ NTC = لا يوجد عنصر تحكم قالب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. إعداد مراقبة الجودة
- قم بإذابة شظايا الحمض النووي الاصطناعية أو البلازميدات الخطية في درجة حرارة الغرفة واتركها تسخن لمدة 10 دقائق على الأقل بعد الذوبان قبل الاستخدام. أحضر القوالب إلى درجة حرارة الغرفة لضمان تكوين القطرات بكفاءة.
- يحفظ في درجة حرارة الغرفة حتى الاستخدام. دوامة بدقة ولفترة وجيزة الطرد المركزي في جهاز طرد مركزي صغير قبل الاستخدام.
- تحضير تخفيفات مراقبة الجودة باستخدام المخزن المؤقت لتخفيف العينة كمخفف. ويرد في الجدول 3 مثال على التركيزات الموصى بها للتحضير لدقة التحقق ودقة التشغيل.
ملاحظة: بعد الانتهاء بنجاح من عمليات التشغيل الدقيقة والدقيقة ، يجب فقط تشغيل مراقبة الجودة العالية (HQC) ومراقبة الجودة المتوسطة (MQC) ومراقبة الجودة المنخفضة (LQC) على كل لوحة. من أجل الدقة والدقة ، يتم تضمين ثلاثة تخفيفات مستقلة على الأقل من QCs لتقييم دقة ودقة الفحص الداخلي. بعد تشغيل الدقة والدقة ، يجب تضمين سلسلة تخفيف واحدة فقط. - بعد التحضير ، قم بتخزين التخفيفات في درجة حرارة الغرفة حتى تضاف إلى اللوحة.
- قم بتخزين التخفيفات على الثلج أو في درجة حرارة 2-8 درجة مئوية إذا لزم الأمر. قبل الاستخدام اللاحق ، اترك التخفيفات تسخن إلى درجة حرارة الغرفة لمدة 10 دقائق على الأقل قبل الاستخدام. تجاهل QCs في نهاية اليوم.
الجدول 3: مثال على إعداد مراقبة الجودة (QC) باستخدام شظايا الحمض النووي الاصطناعية المزدوجة التي تقطعت بها السبل. الاختصارات: ULQC = الحد الأعلى لمراقبة الجودة ؛ HQC = مراقبة الجودة العالية ؛ MQC = مراقبة الجودة المتوسطة ؛ LQC = مراقبة الجودة المنخفضة ؛ LLQC = مراقبة جودة الحد الأدنى ؛ NTC = لا يوجد عنصر تحكم قالب. الرجاء الضغط هنا لتنزيل هذا الجدول.
6. إعداد العينات
- قم بإذابة عينات المسيل للدموع التي تم جمعها من تجربة سريرية في درجة حرارة الغرفة حتى تذوب واتركها دافئة لمدة 10 دقائق على الأقل بعد الذوبان قبل الاستخدام.
- يحفظ في درجة حرارة الغرفة حتى الاستخدام. دوامة بدقة ولفترة وجيزة الطرد المركزي في أجهزة الطرد المركزي الصغيرة قبل الاستخدام.
- قم بتخفيف عينات التمزق 1:10 (أو أكثر) باستخدام المخزن المؤقت لتخفيف العينة كمخفف إلى أنابيب PCR سعة 0.2 مل أو شرائط PCR ذات 8 آبار. ختم الأنابيب.
ملاحظة: اعتمادا على التركيز المتوقع للهدف في الدموع ، قد يكون من الضروري زيادة تخفيف العينات أو اختبار التخفيفات المتعددة لكل عينة. - سخني العينات في جهاز تدوير حراري على حرارة 95 درجة مئوية لمدة 10 دقائق ، متبوعا بالاحتفاظ عند 4 درجات مئوية لمدة 5 دقائق على الأقل لتبرد. استخدم معدل منحدر 3 °C / s.
ملاحظة: قد تبقى العينات في جهاز التدوير الحراري عند 4 درجات مئوية حتى الاستخدام في نفس اليوم أو قد يتم تجميدها عند -70 إلى -90 درجة مئوية لتخزين أطول. تعمل هذه الخطوة على تشويه قفيصة المتجه ، وإطلاق الجينوم. نظرا لأن شظايا الحمض النووي الاصطناعية لمراقبة الجودة أو البلازميدات الخطية مزدوجة تقطعت بهم السبل ، فلا ينبغي أن تخضع لخطوة التسخين هذه. - أعد العينات بعد التبريد إلى درجة حرارة الغرفة (أو إذا تم تجميدها ، قم بإذابة الثلج في درجة حرارة الغرفة) واتركها تسخن لمدة 10 دقائق على الأقل.
ملاحظة: يجب إحضار العينات بالكامل إلى درجة حرارة الغرفة لضمان تكوين قطرات بكفاءة.
7. إضافة قالب
- استرجع لوحة ddPCR التي تحتوي على المزيج الرئيسي. دوامة كل عينة أو أنبوب تخفيف مراقبة الجودة بدقة ولفترة وجيزة الطرد المركزي لتجميع المواد.
- قم بإزالة الفيلم اللاصق وإضافة 5.5 ميكرولتر من QCs أو العينات إلى الآبار المناسبة للوحة 96 بئرا ، وفقا لخريطة اللوحة.
ملاحظة: راجع الخطوة 4.2.1 للحصول على شرح لوحدات التخزين المطلوبة - أضف 5.5 ميكرولتر من المخزن المؤقت لتخفيف العينة إلى آبار NTC.
- يتطلب توليد القطرات أن يكون لجميع آبار العمود تفاعل أو تحكم في المخزن المؤقت. إذا كانت أي آبار في العمود لا تحتوي على تفاعلات عينة ، فقم بتخفيف 2x ddPCR buffer control 1: 2 باستخدام الماء الخالي من النيوكلياز. أضف 22 ميكرولتر من 1x ddPCR التحكم في المخزن المؤقت إلى أي آبار فارغة من العمود.
ملاحظة: إذا لم يتم استخدام عمود بأكمله، فإنه ليس من الضروري إضافة عنصر تحكم المخزن المؤقت إلى هذه الآبار. - أضف ختم رقائق قابل للثقب إلى اللوحة. ضع اللوحة في مانع تسرب الألواح وأغلقها لمدة 5 ثوان عند 180 درجة مئوية.
- بدلا من ذلك ، قم بإغلاق اللوحة وفقا لتوصيات الشركة المصنعة لنظام ddPCR.
- دوامة اللوحة بأقصى سرعة لمدة 30 ثانية على الأقل (باستخدام إعداد الدوامة المستمرة ؛ لا تستخدم دوامة اللمس) وأجهزة الطرد المركزي لفترة وجيزة في لوحة الدوران.
ملاحظة: يعد الخلط الشامل والكامل للوحة في هذه الخطوة أمرا بالغ الأهمية للتقسيم الصحيح لتفاعل تفاعل تفاعل البوليميراز المتسلسل إلى قطرات. تأكد من عدم وجود فقاعات مرئية في الآبار. إذا لزم الأمر ، يمكن الاحتفاظ باللوحة عند 2-8 درجة مئوية قبل توليد القطيرات لمدة أقصاها 4 ساعات. إذا تم الإمساك به ، اترك اللوحة تصل إلى درجة حرارة الغرفة لمدة لا تقل عن 10 دقائق قبل توليد القطيرات.
8. توليد القطرات الآلي ، وركوب الدراجات الحرارية ، وقراءة القطيرات
- قم بإنشاء قطرات في مولد القطيرات الآلي على النحو التالي.
- على الشاشة باللمس، حدد الأعمدة الموجودة على خريطة اللوحة التي تحتوي على عينات. سيضيء سطح الجهاز للإشارة إلى المواد الاستهلاكية (خراطيش DG32 ، والنصائح ، وحاوية النفايات ، وزيت توليد القطرات) المطلوبة. تشير الأضواء الصفراء إلى أنه من الضروري إضافة مادة استهلاكية ، بينما تشير الأضواء الخضراء إلى توفر مواد استهلاكية كافية.
- قم بتحميل مولد القطيرات من الخلف إلى الأمام.
- بالنسبة لمجسات التحلل المائي ، تأكد من تركيب زيت توليد القطيرات للمجسات وبقاء زيت كاف لعدد الآبار. إذا تم استخدام كيمياء PCR بديلة ، فتأكد من تركيب زيت توليد قطرات متوافق.
- ضع كتلة باردة في حامل لوحة القطرات. تأكد من أن الكتلة زرقاء اللون بالكامل ولا يوجد لون وردي مرئي. ضع لوحة DDPCR جديدة ذات 96 بئرا في الكتلة الباردة.
- ضع لوحة PCR المعدة في حامل لوحة العينة. أغلق غطاء الجهاز. اضغط على بداية لتوليد القطيرات.
- بعد تكوين القطيرات ، يتم نقل ما مجموعه 40 ميكرولتر لكل تفاعل تلقائيا إلى لوحة PCR الجديدة.
- في غضون 30 دقيقة بعد الانتهاء من توليد القطيرات ، قم بإزالة اللوحة التي تحتوي على القطرات من الكتلة الباردة. اعمل برفق لأن القطرات تكون أكثر هشاشة في هذه المرحلة.
- أضف ختم رقائق قابل للثقب إلى اللوحة. ضع اللوحة في مانع تسرب الألواح وأغلقها لمدة 5 ثوان عند 180 درجة مئوية.
- بدلا من ذلك ، قم بإغلاق اللوحة وفقا لتوصيات الشركة المصنعة لنظام ddPCR.
- ضع اللوحة في جهاز تدوير حراري متوافق. أدخل شروط ركوب الدراجات (انظر الجدول 4).
- بعد نهاية الدورة الحرارية ، أمسك اللوحة في جهاز الدورة الحرارية ، أو انقلها إلى 2-8 درجة مئوية ، أو اقرأها على الفور.
ملاحظة: قد يؤدي حمل اللوحة لمدة 12 ساعة عند 4-12 درجة مئوية إلى تحسين عدد القطيرات ، لكن هذا غير مطلوب. يجب الحصول على قطرات كافية دون تعليق. - قم بتحميل اللوحة في قارئ القطيرات ، مع ضمان بقاء زيت قارئ كاف ومساحة كافية في حاوية النفايات. اقرأ القطرات. قم بإجراء قراءة القطيرات في غضون 24 ساعة من بدء الدورة الحرارية.
الجدول 4: ظروف الدراجات الحرارية النموذجية. الرجاء الضغط هنا لتنزيل هذا الجدول.
9. تحليل البيانات
ملاحظة: ما لا يقل عن 10000 قطرة لكل بئر ضروري للحساب الصحيح للتركيز باستخدام إحصائيات بواسون. لا تحاول التحليل على أي آبار تحتوي على أقل من 10000 قطرة.
- مطلوب عتبة لتحديد القطرات على أنها إيجابية أو سلبية. يطبق برنامج تحليل ddPCR تلقائيا عتبة قد تختلف عبر الآبار. ومع ذلك ، قم بتعيين عتبة يدويا لجميع آبار اللوحة عند أعلى قليلا من كثافة الفلورسنت لآبار NTC للحصول على نتائج أكثر اتساقا ودقة ودقة.
ملاحظة: قد يتطلب وضع العتبة بشكل صحيح تحسينا اعتمادا على فصل القطرات الموجبة والسالبة وكمية المطر القطيرات الموجودة (انظر الشكل 2). في هذا المثال ، يعرض الرسم البياني لسعة القطرة أمثلة على الآبار عند كل مستوى لمراقبة الجودة و NTC. يشير الخط الأرجواني إلى عتبة 1000 ، أعلى قليلا من عدد القطيرات السلبية. - تتطلب النمذجة الإحصائية بواسون ثلاث قطرات موجبة على الأقل لحساب التركيز بثقة 95٪. ضع في اعتبارك أن جميع الآبار التي تحتوي على قطرة صفرية أو واحدة أو قطرتين موجبتين سالبة ومضبوطة على تركيز صفر27.
- احسب رقم النسخة مرة أخرى في كل عينة تمزق.
- ويرد التركيز، بالنسخ/ميكرولتر، في تقرير البيانات. استخدم هذه القيمة لتحديد التركيز في نسخ / ميكرولتر من العينة الأصلية (أي في عينة التمزق).
- لحساب تخفيف تفاعل ddPCR ، قسم حجم تفاعل تفاعل PCR الأولي قبل تكوين القطيرات على حجم القالب المضاف. عند استخدام وحدات التخزين المعروضة في هذه الطريقة ، ينتج عن ذلك قيمة 4.
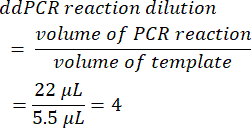
- حدد عامل التخفيف التسلسلي من العينة الأصلية (الخطوة 6.2).
- لتحديد النسخ / ميكرولتر في العينة ، اضرب النسخ / ميكرولتر في تخفيف تفاعل ddPCR ، ثم في عامل التخفيف التسلسلي. فعلى سبيل المثال، كان التركيز في النسخ/الميكرولتر المتولد في تقرير البيانات 966؛ تمت إضافة 5.5 ميكرولتر من القالب لكل 22 ميكرولتر من التفاعل. تم استخدام تخفيف تسلسلي 1: 50,000 للعينة.
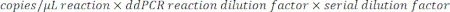
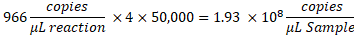
- إذا تم اختبار تخفيفات متعددة لنفس العينة ، فقم بتحليل جميع التخفيفات الصحيحة في النطاق واحسب المتوسط.
- لكل مراقبة الجودة ، احسب النسخ المتوقعة / ميكرولتر تفاعل تفاعل البوليميراز المتسلسل بقسمة تركيز تخفيف مراقبة الجودة المعطى (بالنسخ / ميكرولتر) على حجم تفاعل ddPCR (20 ميكرولتر). وهذا يسمح بإجراء مقارنة مباشرة لهذه القيمة الاسمية مع قيمة النسخ/الميكرولتر الواردة في تقرير البيانات دون إجراء مزيد من الحسابات.
ملاحظة: تم استخدام هذا النهج أيضا لتحليل عينات التمزق المسننة المستخدمة في النتائج التمثيلية. - تحديد القيمة المتوسطة والانحراف المعياري ومعامل التغير (٪ CV) والنسبة المئوية للخطأ النسبي للتركيز الاسمي (٪ RE) للعينة أو قيمة مراقبة الجودة باستخدام الآبار المكررة (بما في ذلك التخفيفات المتعددة إن وجدت).
- لتقييم الدقة بين الآبار ، حدد ذلك لكل من التكرارات الجيدة ، إذا تم تضمينها.
- لتقييم دقة ودقة الفحص الداخلي ، حدد ذلك لكل سلسلة تخفيف أو قسمة مستخدمة داخل الدفعة.
- لتقييم دقة ودقة الفحص البيني ، حدد ذلك باستخدام وسائل الفحص الداخلي لكل دفعة من الدفعات المضمنة.
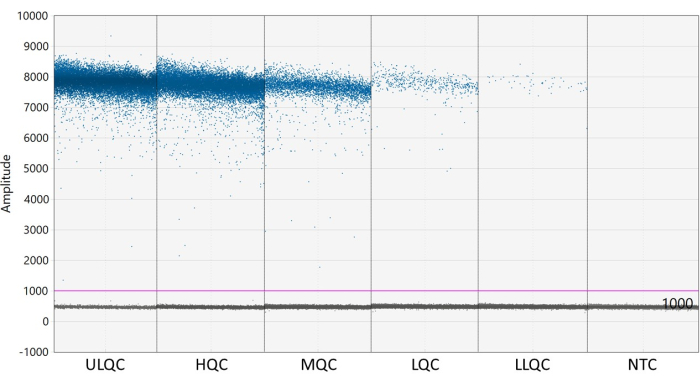
الشكل 2: مثال على تحديد العتبة. الاختصارات: ULQC = الحد الأعلى لمراقبة الجودة ؛ HQC = مراقبة الجودة العالية ؛ MQC = مراقبة الجودة المتوسطة ؛ LQC = مراقبة الجودة المنخفضة ؛ LLQC = مراقبة جودة الحد الأدنى ؛ NTC = لا يوجد عنصر تحكم قالب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
10. معايير قبول الفحص
- استخدم المواصفات التالية للبيانات المحسوبة لكل دفعة لتحديد ما إذا كانت الدفعة مقبولة أم لا. إذا لم يتم استيفاء هذه الشروط ، فقم بإبطال الدفعة وتكرارها.
ملاحظة: تم تحديد هذه المعايير كإجماع من الأوراق البيضاء المنشورة حول التحقق من صحة الفحص المستند إلى تفاعل البوليميراز المتسلسل18،19،20،21،22،23،24،25. قد يكون من الضروري تعديل المعايير المستهدفة حسب الاقتضاء للتطبيق السريري. - لا يوجد عنصر تحكم قالب (NTC)
- تأكد من أن كل بئر NTC يحتوي على 10000 قطرة على الأقل.
- تأكد من أن كل بئر NTC يحتوي على أقل من 3 قطرات موجبة.
- مراقبة الجودة ونطاق الفحص
- تأكد من أن كل بئر لمراقبة الجودة يحتوي على 10000 قطرة على الأقل.
- تأكد من أن دقة الآبار المكررة لتركيز مراقبة الجودة هي ≤25.0٪ CV ، باستثناء الحدود العليا والدنيا للقياس الكمي ، حيث يكون ≤30.0٪ مقبولا. قم بتقييم هذا بشكل مستقل لكل مجموعة مراقبة الجودة ومستوى التركيز.
- تأكد من أن الخطأ النسبي للتركيز المحسوب مرة أخرى عند كل مستوى متوسط لمراقبة الجودة يقع في حدود ±25.0٪ RE من التركيز الاسمي (النسخ / تفاعل تفاعل البوليميراز المتسلسل) ، باستثناء الحدود العليا والدنيا للقياس الكمي ، حيث ±30.0٪ RE مقبول. قم بتقييم هذا بشكل مستقل لكل مجموعة مراقبة الجودة ومستوى التركيز.
- تأكد من أن ما لا يقل عن 2/3 من عينات مراقبة الجودة (على سبيل المثال ، أربعة من أصل ست نتائج) و 50٪ من عينات مراقبة الجودة في كل مستوى (منخفض ، متوسط ، مرتفع) يفي بهذه الإرشادات.
- العينات
- تأكد من أن آبار العينات المراد تحليلها تحتوي على 10000 قطرة على الأقل.
- تأكد من أن دقة الآبار المكررة لتخفيف العينة المراد تحليلها هي ≤25.0٪ CV.
- تأكد من أن تخفيفا واحدا على الأقل مضمنا للعينة المعطاة يقع ضمن نطاق القياس الكمي المحدد للمقايسة ، كما هو محدد أعلاه بناء على الحد الأعلى والأدنى لمراقبة الجودة.
- إذا تضمنت جميع التخفيفات نتائج إنتاجية أكبر من الحد الأعلى المحدد للقياس الكمي ، وإذا بقي حجم عينة كاف ، كرر الفحص باستخدام تخفيف أعلى للعينة.
- إذا كانت جميع التخفيفات متضمنة تعطي نتيجة أقل من الحد الأدنى للقياس الكمي ، وإذا بقي حجم عينة كاف ، كرر الفحص باستخدام تخفيف أقل للعينة.
ملاحظة: يمكن وصف العينات التي تحتوي على أكثر من ثلاث قطرات موجبة ، ولكن تركيزها أقل من الحد الأدنى للقياس الكمي ، بأنها قابلة للاكتشاف ، ولكنها غير قابلة للقياس الكمي.
النتائج
لأغراض توضيحية ، تم تطوير اختبار مصمم للكشف عن ناقل AAV2 المتاح تجاريا والمحسن للبروتين الفلوري الأخضر (eGFP) ، مع جزء من الحمض النووي الاصطناعي المزدوج الذي تقطعت به السبل يحتوي على eGFP كمراقبة للجودة. حاليا ، هناك جدل مستمر حول ما إذا كان الناقل نفسه أو جزء الحمض النووي الاصطناعي أو البلازميد الخطي هو الأنسب للاستخدام كمراقبة الجودة. بشكل عام ، يمكن استخدام جزء الحمض النووي الاصطناعي أو البلازميد الخطي إذا تم إثبات التكافؤ مع المتجه في تطوير الطريقة (البيانات غير معروضة). تم تصميم البادئات والمجسات وتحسينها للكشف عن جين eGFP. يرجى الرجوع إلى الجدول التكميلي S1 للاطلاع على التسلسلات المستخدمة في هذا العمل. تم تحديد تركيز مخزون شظايا مراقبة الجودة تجريبيا باستخدام ddPCR. تم إجراء جميع المقايسات باستخدام التركيزات وشروط تفاعل البوليميراز المتسلسل الواردة كأمثلة في قسم البروتوكول.
بالنسبة لفحوصات qPCR ، يوصى بتقييم الخطية والحساسية والنطاق الديناميكي والدقة والدقة للمنحنى القياسي. نظرا لأن ddPCR لا يعتمد على منحنى قياسي للقياس الكمي المستهدف ، يجب تعديل هذه التوصيات. بدلا من ذلك ، تم استخدام QCs التي تتكون من شظايا الحمض النووي الاصطناعية المزدوجة التي تقطعت بها السبل المخففة إلى تركيزات مختلفة لتمتد على النطاق الكمي المتوقع لتفاعل ddPCR بناء على النمذجة الإحصائية بواسون29،30،31،32 لتحديد النطاق الديناميكي والحساسية وتقييم الدقة والدقة. استند اختيار تركيزات مراقبة الجودة في المقام الأول إلى النسبة المتوقعة للقطرات الموجبة إلى الكلية داخل بئر عند تركيز معين. رياضيا ، يكون ddPCR أكثر دقة من الناحية النظرية عندما يتم تضخيم ما يقرب من 80٪ من الأقسام بشكل إيجابي. مع زيادة نسبة القطيرات الموجبة إلى الكلية فوق 0.8 ، تنخفض الدقة بسبب تشبع الأقسام ، مع عدم إمكانية القياس الكمي بمجرد أن تكون 100٪ من القطرات موجبة. في النهاية المنخفضة ، من الناحية النظرية ، يمكن اكتشاف أقل من قطرة إيجابية واحدة وتحديدها كميا ، على الرغم من أن الدقة أضعف والفحص يخضع لإيجابيات كاذبة منخفضة المستوى. عادة ، يجب أن تكون ثلاث قطرات على الأقل موجبة حتى يتم حساب النتيجة بثقة 95٪ ، وهي عتبة حساب التركيز الذي استخدمناه هنا.
تم إعداد سلسلة من خمسة تركيزات مختلفة لمراقبة الجودة ، مع عدد النسخ المستهدف / ميكرولتر من أحجام تفاعل تفاعل البوليميراز المتسلسل المحسوبة من المتوقع أن تسفر عن نسب قطرات موجبة إلى إجمالي تمتد على النطاق القابل للقياس الكمي ل ddPCR ، كما هو موضح في الجدول 5. تم استخدام هذه لتقييم دقة ودقة الفحص. في التقييم هنا ، لم يتم دفع الحدود العليا والدنيا للقياس الكمي إلى الحد الأقصى النظري الممكن في ddPCR. قد يكون القياس الكمي الدقيق ممكنا في مستويات أعلى وأدنى مما هو موضح هنا. يجب تطوير النطاق بما يتماشى مع التطبيقات النهائية لهذه الطريقة.
تم إعداد ما مجموعه ثلاث سلاسل تخفيف معدة بشكل مستقل من هذه QCs في مخزن تخفيف العينة لكل دفعة لتقييم دقة ودقة الفحص الداخلي. تم تضمين الآبار المكررة لكل تخفيف لمراقبة الجودة. لمحاكاة بروتوكول التحقق الفعلي ، تم إجراء ما مجموعه ست دفعات من الدقة والدقة بواسطة العديد من المحللين على مدار عدة أيام. تم تحليل النتائج من هذه الدفعات الست لتحديد دقة ودقة الفحص الداخلي والفحص الداخلي للطريقة وتحديد النطاق الديناميكي للمقايسة.
تم تقييم أداء الفحص الداخلي لكل دفعة على كل مستوى من مستويات مراقبة الجودة. توقعنا أن تحتوي جميع آبار مراقبة الجودة و NTC على 10000 قطرة على الأقل. وقد تم تحقيق ذلك في 216 بئرا من أصل 216 بئرا تم اختبارها عبر جميع الدفعات الست ، بمتوسط عدد قطرات يبلغ 19,748 قطرة / بئر (الجدول 6). بعد ذلك ، كان من المتوقع أن تكون النسبة المئوية للسيرة الذاتية لكل مجموعة من الآبار المكررة لكل مراقبة الجودة ≤25.0٪ ، باستثناء الحد الأعلى والأدنى لمراقبة الجودة ، حيث كان من المتوقع ≤30.0٪. وقد تم تحقيق ذلك في مجموعات من 90 بئرا من أصل 90 بئرا تم اختبارها عبر جميع الدفعات الست لمراقبة الجودة ، بمتوسط CV بين الآبار بنسبة 3.9٪ عبر جميع مستويات مراقبة الجودة (الجدول 7). أسفرت جميع QCs عن متوسط إيجابي إلى إجمالي نسب القطيرات ضمن النطاقات المتوقعة الموضحة أعلاه (الجدول 6).
داخل كل دفعة ، تم حساب المتوسط داخل الفحص والانحراف المعياري لكل نقطة من نقاط سلسلة التخفيف المعدة بشكل مستقل ، وتم استخدامها لحساب متوسط الفحص الداخلي لكل تركيز في كل فحص. تم استخدام هذا لتقييم دقة ودقة الفحص (الجدول 8). تشير الدقة إلى التباين في البيانات من النسخ المتماثلة لنفس العينة المتجانسة في ظل ظروف الفحص العادية ويتم تقييمها عن طريق حساب النسبة المئوية للسيرة الذاتية للحصص المتعددة المضمنة. توقعنا أن تسفر الحصص الثلاثة التي تم اختبارها داخل كل دفعة عن CV داخلي ≤25.0٪ ، باستثناء الحد الأعلى والأدنى لمراقبة الجودة حيث كان من المتوقع ≤30.0٪. تم استيفاء ذلك لجميع مستويات مراقبة الجودة الخمسة في كل دفعة من الدفعات ال 60 (30 من إجمالي 30 عرضا). بشكل عام ، يمكن تحقيق دقة أكبر داخل الفحص من المعايير المستهدفة ، بمتوسط CV داخل المقايسة بنسبة 7.7٪ عبر جميع مستويات مراقبة الجودة. تشير الدقة إلى قرب الاتفاق بين القيمة المحددة تجريبيا والقيمة الاسمية. يتم تقييم ذلك عن طريق حساب النسبة المئوية للخطأ النسبي (٪ RE ، أو ٪ Bias) بين التركيزات المحسوبة لكل مراقبة الجودة وتركيزاتها الاسمية المتوقعة نظريا. كان من المتوقع أن يكون المتوسط الداخلي للمقايسة للحصص الثلاثة ±25.0٪ RE من التركيز الاسمي ، باستثناء الحد الأعلى والأدنى لمراقبة الجودة حيث كان من المتوقع ±30.0٪. تم استيفاء ذلك لجميع مستويات مراقبة الجودة الخمسة في كل دفعة من الدفعات ال 60 (30 من إجمالي 30 عرضا). بشكل عام ، يمكن تحقيق دقة أكبر داخل الفحص من هدفنا ، بمتوسط مطلق للمقايسة الداخلية٪ RE بنسبة 4.2٪ عبر جميع مستويات مراقبة الجودة. في جميع عروض NTC (إجمالي 30) ، لم يتم اكتشاف قطرات إيجابية.
كما تم حساب الدقة والدقة بين المقايسة باستخدام المتوسط الداخلي لكل مستوى من مستويات مراقبة الجودة داخل كل دفعة. كان من المتوقع أن تكون دقة الفحص الداخلي ≤25.0٪ CV ، باستثناء الحد الأعلى والأدنى لمراقبة الجودة حيث كان من المتوقع ≤30.0٪. وبالمثل ، بالنسبة لدقة الفحص الداخلي ، كان من المتوقع ±25.0٪ RE ، باستثناء الحد الأعلى والأدنى لمراقبة الجودة حيث كان من المتوقع ±30.0٪. وقد لوحظت دقة ودقة أكبر بكثير بين المقايسة من هذه الأهداف (الجدول 9) ، مع دقة بين المقايسة تتراوح من 4.0٪ إلى 8.5٪ ودقة مطلقة بين المقايسة تتراوح من 1.0٪ إلى 3.2٪. بشكل جماعي ، توضح هذه النتائج أن هذه الطريقة يمكن أن تحقق دقة ودقة كافية داخل وبين المقايسة بشكل جيد ضمن أهداف الصناعة الحالية. يمكن تحديد النطاق الديناميكي لهذا الفحص من 2500-2.5 نسخة لكل ميكرولتر من تفاعل تفاعل تفاعل البوليميراز المتسلسل بناء على هذه النتائج ، مع حساسية فحص إجمالية تبلغ 2.5 نسخة لكل ميكرولتر من تفاعل تفاعل تفاعل البوليميراز المتسلسل. كما ذكرنا سابقا ، قد يكون من الممكن التحقق من صحة النطاقات الديناميكية الأوسع.
بعد ذلك ، كان من الضروري تقييم دقة الفحص ودقته داخل المصفوفة المستهدفة - في هذه الحالة ، الدموع. عادة ، يتم التحقق من صحة المقايسات قبل بدء الدراسات السريرية ، مما يعني أنه من غير المحتمل أن تكون الدموع التي تم جمعها من المرضى المعالجين بالنواقل متاحة لأغراض التحقق من الصحة. يمكن إنشاء هذا بشكل مصطنع عن طريق رفع ناقل AAV المستهدف إلى دموع تم جمعها من المتبرعين المتطوعين لإنشاء QCs مسننة بالمصفوفة. تم جمع الدموع البشرية المجمعة من قبل طرف ثالث (BioIVT). لإثبات المبدأ ، تم استخدام متجه AAV2 يعبر عن eGFP تم الحصول عليه من مصدر تجاري. تم تحديد تركيز مخزون ناقل AAV2 تجريبيا باستخدام ddPCR ، دون استخدام خطوة عزل الحمض النووي ، كما هو موضح في هذا البروتوكول. في كل شوط ، تم رفع AAV2 بشكل مستقل إلى القسامات الثلاثة المسيل للدموع عند مستوى مرتفع (متوقع 1.41 × 103 نسخ / تفاعل PCR ميكرولتر) ومستوى منخفض (28.2 نسخة / تفاعل PCR ميكرولتر). تم تضمين القسامات غير المسننة كعنصر تحكم لإثبات خصوصية الطريقة.
تم تقييم أداء الفحص الداخلي لكل دفعة عند كل مستوى سبايك. كان من المتوقع أن تحتوي جميع عينات المسيل للدموع على 10000 قطرة على الأقل. وقد تم تحقيق ذلك في 108 من أصل 108 آبار تم اختبارها عبر جميع الدفعات الست، بمتوسط إجمالي لعدد القطرات يبلغ 20,208 قطرة/بئر (الجدول 10). بعد ذلك ، كان من المتوقع أن تكون النسبة المئوية للسيرة الذاتية لكل مجموعة من الآبار المكررة لكل مراقبة الجودة ≤25.0٪ لمستويات الارتفاع العالية والمنخفضة. وقد تم استيفاء ذلك في 36 من أصل 36 مجموعة من الآبار التي تم اختبارها عبر جميع الدفعات الست لمراقبة الجودة ، بمتوسط CV بين الآبار بنسبة 3.2٪ (الجدول 11).
داخل كل دفعة ، تم حساب متوسط الفحص الداخلي والانحراف المعياري لكل من مسامير الدموع المعدة بشكل مستقل ، وتم استخدامها لحساب متوسط الفحص الداخلي لكل تركيز في كل فحص. تم استخدام هذا لتقييم دقة ودقة الفحص في المصفوفة (الجدول 12). توقعنا أن تكون نسبة CV داخل الفحص ≤25.0٪ ومستويات ارتفاع عالية ومنخفضة. وقد تم تحقيق ذلك في ست دفعات من أصل ست دفعات لكل مستوى. بشكل عام ، يمكن تحقيق دقة أكبر للفحص الداخلي في المصفوفة من الهدف ، بمتوسط CV داخل المقايسة بنسبة 3.7٪ عند المستوى العالي و 12.2٪ عند المستوى المنخفض (إجمالي 8.0٪). كان من المتوقع أيضا أن تكون نسبة RE للفحص الداخلي ±25.0٪ عند كلا مستويي الارتفاع. وقد تم تحقيق ذلك في ست دفعات من أصل ست دفعات لكل مستوى. وبالمثل ، وجد بشكل عام أنه يمكن تحقيق دقة أكبر داخل المقايسة في المصفوفة من الهدف ، بمتوسط نسبة RE المطلقة داخل المقايسة بنسبة 8.1٪ عند المستوى المنخفض و 11.3٪ عند المستوى العالي (بشكل عام 9.7٪). بالنسبة للتحكم غير المسنن ، لم يتم اكتشاف أي إشارة eGFP في أي من الحصص (الجدول 12) ، مما يدل على خصوصية الطريقة في مصفوفة الدموع البشرية.
كما تم حساب دقة الفحص الداخلي والدقة في مصفوفة المسيل للدموع باستخدام المتوسط الداخلي لكل مستوى ارتفاع داخل كل دفعة. كان من المتوقع أن تكون دقة الفحص الداخلي ≤25.0٪ CV ، وللدقة بين المقايسة ، توقعنا ±25.0٪ RE. وقد لوحظت دقة ودقة أكبر بكثير بين المقايسات من هذه الأهداف (الجدول 13)، مع دقة بين المقايسة بنسبة 5.5٪ عند المستوى العالي و 7.1٪ عند المستوى المنخفض، وبدقة مقايسة بينية مطلقة تبلغ 11.3٪ عند المستوى العالي و 8.1٪ عند المستوى المنخفض. بشكل جماعي ، توضح هذه النتائج دقة ودقة وخصوصية الطريقة في مصفوفة الدموع.
الجدول 5: ضوابط الجودة المستخدمة لتحديد النطاق الدينامي للفحص. الاختصارات: ULQC = الحد الأعلى لمراقبة الجودة ؛ HQC = مراقبة الجودة العالية ؛ MQC = مراقبة الجودة المتوسطة ؛ LQC = مراقبة الجودة المنخفضة ؛ LLQC = مراقبة جودة الحد الأدنى ؛ NTC = لا يوجد عنصر تحكم قالب. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 6: إجمالي عدد القطرات ونسب القطرات الإيجابية إلى الكلية لمراقبة جودة الحمض النووي الاصطناعي المزدوج الشريط و NTC. الاختصارات: ULQC = الحد الأعلى لمراقبة الجودة ؛ HQC = مراقبة الجودة العالية ؛ MQC = مراقبة الجودة المتوسطة ؛ LQC = مراقبة الجودة المنخفضة ؛ LLQC = مراقبة جودة الحد الأدنى ؛ NTC = لا يوجد عنصر تحكم قالب. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 7: إحصائيات مراقبة الجودة بين الآبار (أهداف النسخ / تفاعل تفاعل تفاعل البوليميراز المتسلسل بالميكرولتر). الاختصارات: ULQC = الحد الأعلى لمراقبة الجودة ؛ HQC = مراقبة الجودة العالية ؛ MQC = مراقبة الجودة المتوسطة ؛ LQC = مراقبة الجودة المنخفضة ؛ LLQC = مراقبة جودة الحد الأدنى ؛ NTC = لا يوجد عنصر تحكم قالب. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 8: دقة ودقة الفحص الداخلي لمراقبة الجودة (أهداف النسخ / تفاعل تفاعل تفاعل البوليميراز المتسلسل بالميكرولتر). الاختصارات: ULQC = الحد الأعلى لمراقبة الجودة ؛ HQC = مراقبة الجودة العالية ؛ MQC = مراقبة الجودة المتوسطة ؛ LQC = مراقبة الجودة المنخفضة ؛ LLQC = مراقبة جودة الحد الأدنى ؛ NTC = لا يوجد عنصر تحكم قالب. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 9: دقة ودقة الفحص البيني لمراقبة الجودة (أهداف النسخ / تفاعل تفاعل البوليميراز المتسلسل بالميكرولتر). الاختصارات: ULQC = الحد الأعلى لمراقبة الجودة ؛ HQC = مراقبة الجودة العالية ؛ MQC = مراقبة الجودة المتوسطة ؛ LQC = مراقبة الجودة المنخفضة ؛ LLQC = مراقبة جودة الحد الأدنى ؛ NTC = لا يوجد عنصر تحكم قالب. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 10: إجمالي عدد قطرات عينات الدموع. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 11: إحصائيات عينة المسيل للدموع بين الآبار (أهداف النسخ / تفاعل تفاعل البوليميراز المتسلسل ميكرولتر). الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 12: دقة الفحص الداخلي ودقة عينات الدموع (أهداف النسخ / تفاعل تفاعل البوليميراز المتسلسل ميكرولتر). الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 13: دقة الفحص البيني ودقة عينات الدموع (أهداف النسخ / تفاعل تفاعل البوليميراز المتسلسل ميكرولتر). الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول التكميلي S1: تسلسل التمهيدي والمجسات ومراقبة جودة الحمض النووي الاصطناعية المزدوجة التي تقطعت بها السبل المستخدمة في هذه الدراسة. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
هناك عدة خطوات لبروتوكول ddPCR ضرورية للأداء السليم للفحص. الخطوة الأولى الحاسمة هي تصميم وتحسين الاشعال والمسبار. بشكل عام ، يوصى باستخدام الكيمياء القائمة على مسبار التحلل المائي على الكيمياء القائمة على الصبغة (على سبيل المثال ، SYBR Green) في بيئة ما قبل السريرية أو السريرية نظرا لخصوصيتها الفائقة. بالإضافة إلى ذلك ، يعد اختيار هدف التضخيم أمرا بالغ الأهمية. عادة ، يتم استهداف جين التحوير الذي يهم الناقل. ومع ذلك ، في المراحل قبل السريرية المبكرة أو في النواقل حيث قد لا يكون من الممكن التمييز بين جين التحوير الناقل مقابل الحمض النووي الجينومي ، قد يكون من المناسب استخدام أهداف النواقل الموحدة. على سبيل المثال ، يمكن للمرء أن يستهدف منطقة التكرار الطرفي المقلوب ، أو المروج ، أو ذيل poly-A ، أو التقاطعات بين الأجزاء بين مكونات المتجه هذه. سيختلف اختيار الهدف بناء على تصميم المتجه. عادة ما تكون استراتيجيات وبرامج تصميم البرايمر والمسبار qPCR التقليدية مناسبة ل ddPCR. يجب اختيار معلمات التصميم التي من المتوقع أن تسفر عن درجة حرارة تلدين ثابتة (على سبيل المثال ، 60 درجة مئوية) لتقليل مقدار التحسين المطلوب. كما تمت التوصية بتصميم وترتيب وتقييم ثلاث مجموعات مختلفة على الأقل لكل هدف. يجب على المرء بعد ذلك اختيار المجموعة التي تظهر أكبر قدر من الخصوصية (لا يوجد تضخيم في بئر التحكم السلبي أو في مصفوفة من الحمض النووي المستهدف ذي الصلة) والحساسية (أي حد الكشف)20.
إذا كان من المفيد أن تكون قادرا على نقل الفحص بين qPCR و ddPCR ، فمن المستحسن تحسين ظروف الفحص باستخدام qPCR أولا ، وتحديد شروط المجموعة المحددة التي تؤدي إلى كفاءة تضخيم بنسبة 90٪ -110٪ مع R2 ≥ 0.98. ومع ذلك ، فإن ddPCR كطريقة نقطة نهاية عادة ما تكون أقل حساسية من qPCR بسبب الاختلافات في كفاءات التضخيم. كحد أدنى ، يوصى بتشغيل تدرج درجة حرارة حراري في خطوة التلدين / التمديد لتغطية درجات الحرارة أعلى وأقل من درجات حرارة التلدين المتوقعة ولتقييم فصل سعة المطر والفلورسنت بين مجموعات القطرات السالبة والموجبة كدالة لدرجة الحرارة. إذا سمحت مساحة العمل ، فمن المستحسن أن يكون لديك محطات عمل فردية مخصصة لإعداد المزيج الرئيسي وإضافة القوالب والتضخيم. حيثما أمكن ، يجب فصلها ماديا عن طريق سير عمل أحادي الاتجاه مع ضوابط هندسية مدمجة ، مثل الوصول المتحكم فيه وضغوط الهواء التفاضلية ، لتقليل مخاطر التلوث المتبادل والإيجابيات الخاطئة. إذا لم يكن ذلك ممكنا ، فيجب توخي الحذر الشديد لمنع انتقال التلوث.
هناك خطوتان في هذا البروتوكول قد تبدوان غير عاديتين لأولئك الذين اعتادوا أكثر على تطوير مقايسة qPCR. الأول هو إدراج إنزيم تقييد في مزيج PCR الرئيسي. أثناء تضخيم ddPCR ، يتم تدوير كل قطرة بالحرارة إلى نقطة النهاية. في الفحص المحسن بشكل صحيح ، ينتج عن هذا مجموعتان من القطرات ، مجموعة واحدة تعرض مستوى مرتفعا باستمرار من إشارات الفلورسنت - الإيجابيات - وأخرى تعرض باستمرار مستوى منخفضا من إشارة الفلورسنت - السلبيات. في حالة حدوث تداخل تفاعل البوليميراز المتسلسل ، فقد يؤدي ذلك إلى إلغاء مزامنة بدء تضخيم تفاعل البوليميراز المتسلسل ، مما يؤدي إلى عدم وصول القطرة إلى هضبة التضخيم ، وبالتالي نقاط نهاية الفلورسنت غير المتسقة. في هذه الحالة ، سيتم توزيع القطرات بين السلبيات والإيجابيات ، مما يؤدي إلى ظاهرة تسمى مطر ddPCR. ويمكن أن يؤدي ذلك إلى تقدير كمي غير دقيق للهدف وإلى عتبات مطبقة بشكل غير متسق وذاتي. توصيتنا بتعيين العتبة أعلى قليلا من إشارة NTC ، والتي يجب أن تقلل من آثار المطر في القياس الكمي النهائي حيث لا تزال جميع القطرات تعتبر إيجابية ، حتى لو لم يتم تدويرها بالكامل إلى نقطة النهاية. تحتوي AAVs على بنية ثانوية معقدة للغاية ، اعتمادا على هدف التضخيم ، قد تقلل من إمكانية الوصول إلى البادئات والمجسات ، مما يؤدي إلى تداخل تفاعل البوليميراز المتسلسل وبالتالي المطر. يؤدي إدراج إنزيم التقييد في المزيج الرئيسي إلى شق هذا الهيكل الثانوي لزيادة الوصول بواسطة البادئات والمجسات ، مما يقلل من المطر ، مما قد يحسن بالتالي دقة الفحص. تم وصف آثار إدراج إنزيم تقييد في تفاعل ddPCR سابقا25,32. يمكن استخدام أي إنزيم تقييد ، طالما تم التأكد من عدم قطعه داخل منطقة التضخيم المستهدفة. لا توجد خطوات ما قبل الهضم أو تركيبات عازلة بديلة مطلوبة.
الخطوة الثانية غير العادية هي إعداد عينة المسيل للدموع التي تحتوي على AAV. في هذا البروتوكول ، تم استخدام نسبة 1:10 (أو أكثر) من الدموع وبعد ذلك تم تسخين العينة. عادة ، عندما يتم جمع الدموع عبر أنبوب شعري ، وهي طريقة جمع مستخدمة على نطاق واسع ، في المتوسط يمكن جمع حوالي 10.0 ميكرولتر33. يساعد التخفيف على معالجة حجم العينة المحدود وتوفير مواد كافية لاختبار الآبار المكررة. في حين أن هذا يقلل من الحد النظري للكشف ، إلا أن الحساسية القوية ل ddPCR يجب أن تؤدي إلى اكتشاف جميع الجسيمات المتجهة باستثناء عدد قليل للغاية. بالإضافة إلى ذلك ، يؤدي هذا النهج إلى إنشاء بئر "نسخ احتياطي" إذا فشل أحدهم بشكل غير متوقع. في هذه الحالة ، أو في حالات عدم كفاية حجم العينة لتشغيل بئرين ، يمكن استخدام خطأ بواسون لتقييم الدقة. علاوة على ذلك ، في الحالات التي يكون فيها التركيز أقل من حد الكشف ، فإنه يخلق فرصة لدمج بيانات البئر لتحديد التركيز. من الضروري تحرير ناقلات AAV من القفيصات الفيروسية للكشف عن ddPCR. تضمنت بعض طرق القياس الكمي ل AAV خطوة هضم البروتيناز K لإزالة القفيصة الفيروسية34،35،36. جميع الأنماط المصلية AAV التي تحدث بشكل طبيعي لها درجات حرارة انصهار عند أو أقل من حوالي 90 درجة مئوية ، مع انخفاض معظمها إلى أقل من 80 درجة مئوية. لذلك ، يبدو أن هذا إدراج غير ضروري37. يبدو أن التسخين وحده كاف لإطلاق الحمض النووي المتجه.
علاوة على ذلك ، يكون ddPCR بشكل عام أقل عرضة لمثبطات تفاعل البوليميراز المتسلسل التي قد تكون موجودة في عينة قد تؤثر على مقايسة qPCR. إذا تم تضمين خطوة عزل الحمض النووي المحددة ، فسيتطلب ذلك أيضا التحقق من الصحة المحددة ، والتي يتم تجنبها في هذا البروتوكول. يتم تخفيف العينات قبل التسخين بسبب حركية انتشار جينومات الناقل في السائل. أثناء عملية التسخين والتبريد اللاحقة ، يمكن أن تلتصق خيوط الحس الإيجابي والسلبي لجينوم الحمض النووي أحادي الشريط معا لإنتاج وسيط مزدوج الشريط إذا كانت التركيزات عالية بما فيه الكفاية. يقلل التخفيف قبل التسخين من التركيزات ويجعل من غير المحتمل رياضيا أن يتشكل ما يكفي من المواد الوسيطة المزدوجة التي تقطعت بها السبل ليكون لها تأثير سلبي على دقة القياس الكمي. وتجدر الإشارة إلى أن شظايا الحمض النووي الاصطناعية أو البلازميدات الخطية المستخدمة كضوابط للجودة يجب ألا تخضع لخطوة التسخين هذه. نظرا لأن هذه مزدوجة الخيوط ، فإن التسخين سيؤدي إلى التحويل إلى مواد وسيطة مفردة تقطعت بها السبل. بعد التقسيم المستقل لهذه QCs التي تقطعت بها السبل إلى قطرات ، من المتوقع أن يؤدي ذلك إلى زيادة مضاعفة في تركيز مراقبة الجودة بالنسبة للتركيز الاسمي. بدلا من ذلك ، إذا كان سيتم تسخين QCs لتوحيد الطريقة ، فيجب أخذ ذلك في الاعتبار في إعادة تكوين وتخصيص تركيز اسمي.
أخيرا ، فيما يتعلق بإعداد العينة ، توصي العديد من البروتوكولات أيضا بإدراج خطوة معالجة DNase لإزالة أي حمض نووي ناقل غير مغلف. هذه الخطوة حاسمة في الحالات التي لا يرغب فيها في تحديد كمية الحمض النووي الحر المرتبط بإعداد الناقل (مثل أثناء القياس الكمي لأغراض الجرعة). ومع ذلك ، في سياق دراسات التوزيع البيولوجي والتحليل البيولوجي ، يرغب المرء عادة في معرفة أين سافر أي حمض نووي متجه ، بغض النظر عما إذا كان مغلفا أم لا. لذلك ، يقترح عدم إجراء خطوة علاج DNase أثناء هذه الدراسات. إذا تقرر أنه من الضروري تضمين خطوة DNase ، فيجب أن تكون هذه الخطوة قبل التخفيفات والتسخين.
في هذه الورقة ، يتم تقديم بيانات تمثل نهج تقييم النطاق الديناميكي والحساسية والدقة والدقة للطريقة في سياق التحقق المناسب للغرض والمتوافق مع الممارسات المختبرية الجيدة. إن النقص الحالي في التوجيه حول هذا الموضوع يترك مختبرات التحقق من الصحة لتحديد معايير الفحص المستهدفة لأنفسهم ، بما يتماشى مع تفكير الصناعة الحالي. طرحت مجموعات مختلفة معايير مستهدفة أعلى وأقل مما هو مستخدم في هذه الدراسة19،20،21،22،23،24،25. يجب اختيار معايير الفحص المستهدفة ، حتى يتم تحديدها بشكل أكثر صرامة ، قبل التحقق من الصحة بناء على التطبيقات السريرية المقصودة للطريقة. اعتمادا على القرارات النهائية التي يتعين اتخاذها على أساس البيانات ، قد تكون هناك حاجة إلى مستويات أعلى من الدقة والدقة. على العكس من ذلك ، قد تكون النتيجة الإيجابية البسيطة مقابل النتيجة السلبية كافية.
وتناول النهج أيضا توصيات لتقييم الخصوصية وتأثير المصفوفة. فشلت مجموعة من الدموع التي تم جمعها من الأفراد غير المعالجين في تحقيق نتيجة إيجابية في هذا الفحص ، في حين يمكن اكتشاف الهدف عندما تم رفع الناقل في الدموع بتركيز عال ومنخفض ضمن معدلات الشفاء الموصى بها. ومن الناحية المثالية، ستدرج في هذه التقييمات أيضا مصفوفة تحتوي على ناقل داخلي المنشأ (على سبيل المثال، تجمع بعد العلاج بالناقل الفيروسي). ومع ذلك ، فمن غير المحتمل أن تكون هذه العينات متاحة للاستخدام في التحقق من الصحة. لزيادة قوة التحقق من الصحة ، يمكن تقييم مجموعات متعددة من الدموع ، أو الدموع التي تم جمعها من مجموعة متنوعة من الأفراد ، لتحديد ما إذا كان تأثير المصفوفة الخاص بالمريض يحدث. أخيرا ، يوصى بتقييم الاستقرار. في سير العمل حيث يحدث استخراج الحمض النووي خارج المصفوفة الحيوية ، قد يكون من الضروري تقييم استقرار كل من العينة والحمض النووي المستخرج. في سير العمل هذا ، يتم اختبار العينة مباشرة في الفحص دون الحاجة إلى استخراج الحمض النووي. لذلك ، بالنظر إلى تقييم الاستقرار لهذه الطريقة ، يجب على المرء تقييم استقرار عينات الدموع. عادة ، يوصى بتقييمات الطاولة والثلاجة والتجميد / الذوبان وتقييمات الاستقرار طويلة الأجل. لم يتم إجراء هذه كجزء من هذه الدراسة ، ولكن يمكن استخدام الأساليب التي تم تطويرها هنا في هذا التقييم ، بعد التلاعب بعينات المدخلات.
بشكل عام ، ثبت أن هذه الطريقة هي اختبار قوي وقابل للتكرار ويمكن التحقق من صحته للكشف عن النواقل القائمة على AAV في عينات الدموع. ويمكن أن يكون بمثابة منصة لتكييفها مع نواقل محددة لدعم التجارب السريرية ويوفر أساسا للتحقق من صحة الفحص بما يتفق مع الممارسات المختبرية الجيدة.
Disclosures
جميع المؤلفين هم موظفون في KCAS Bioanalytical and Biomarker Services ، وهي منظمة أبحاث تعاقدية تقدم خدمات تطوير شاملة متوافقة مع الممارسات المختبرية الجيدة / الممارسات السريرية الجيدة من دعم الاكتشاف المبكر من خلال تسجيل المنتج ، بما في ذلك دعم المقايسات القائمة على AAV ، كما هو موضح في هذا البروتوكول. مولت KCAS هذا المشروع ونشر هذا البروتوكول. على الرغم من عدم وجود إرشادات حالية لإدارة الغذاء والدواء لتصميم التجارب المقدمة في هذه الورقة والتحقق من صحتها ، فقد اعتمد الخبراء وقادة الفكر الذين يطورون مثل هذه الدراسات في KCAS هذا النهج كنهج أساسي. وتناقش معايير وبارامترات إضافية على أساس كل مشروع على حدة ويمكن إدراجها بناء على الاستخدام المقصود.
Acknowledgements
نود أن نشكر راسل وبراندون ماكيثان من Bio-Rad على مناقشاتهم المفيدة أثناء تطوير هذه الطريقة.
Materials
| Name | Company | Catalog Number | Comments |
| AAV-eGFP Vector | Charles River Laboratories | RS-AAV2-FL | Lot AAV2-0720-FL, used as a proof of principle vector |
| AutoDG Droplet Digital PCR system | Bio-Rad | QX200 | Alternative ddPCR system may be used following manufacturer’s protocol. |
| AutoDG Oil for Probes | Bio-Rad | 1864110 | Or use material compatible with ddPCR system. |
| ddPCR Buffer Control for Probes | Bio-Rad | 1863052 | Or use material compatible with ddPCR system and PCR chemistry. |
| ddPCR Droplet Reader Oil | Bio-Rad | 1863004 | Or use material compatible with ddPCR system. |
| ddPCR Piercable Foil Seals | Bio-Rad | 1814040 | Or use material compatible with ddPCR system. |
| ddPCR Plates 96-Well, Semi-Skirted | Bio-Rad | 12001925 | Or use material compatible with ddPCR system. |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023, 1863024, or 1863025 | Use master mix compatible with primers/probes and ddPCR system. |
| DG32 AutoDG Cartidges | Bio-Rad | 1864108 | Or use material compatible with ddPCR system. |
| Droplet Reader | Bio-Rad | QX200 | Alternative ddPCR system may be used following manufacturer’s protocol. |
| GeneAmp PCR Buffer | Applied Biosystems | N8080129 | N/A |
| Nuclease-Free Water | Ambion | AM9906 | N/A |
| PCR Plate Sealer | Bio-Rad | PX1 | Or use material compatible with ddPCR system. |
| Pipet Tips for AutoDG | Bio-Rad | 1864120 | Or use material compatible with ddPCR system. |
| Pluronic F-68 Non-ionic Surfactant | Gibco | 24040 | N/A |
| Primer and Hydrolysis Probes | Various | Various | Design based on target sequence using general approaches for primer/probe design. Select fluorphores and quenchers compatible with ddPCR system. |
| Restriction Enzyme | Various | Various | Varies with target amplification sequence. Use restriction enzyme that does not cut in the amplified sequence |
| Sheared salmon sperm DNA | ThermoFisher | AM9680 | N/A |
| Synthetic DNA gene fragment or linearized plasmid | Various | Various | Design a synthetic DNA fragment containing the target amplification region for use as a quality control |
| TE Buffer | Teknova | T0224 | Ensure prepared or purchases nuclease free. 10 mM Tris-HCl, 1.0 mM EDTA, pH=8.0 |
| Touch Thermal Cycler | Bio-Rad | C1000 | Or use material compatible with ddPCR system. |
References
- Sherkow, J. S., Zettler, P. J., Greeley, H. T. Is it 'gene therapy. Journal of Law and the Biosciences. 5 (3), 786-793 (2018).
- Ginn, S. L., Amaya, A. K., Alexander, I. E., Edelstein, M., Abedi, M. R. Gene therapy clinical trials worldwide to 2017: an update. The Journal of Gene Medicine. 20 (5), 3015 (2018).
- Ghosh, S., Brown, A. M., Jenkins, C., Campbell, K. Viral vector systems for gene therapy: a comprehensive literature review of progress and biosafety challenges. Applied Biosafety. 25 (1), 7-18 (2020).
- Gene, Cell, & RNA therapy landscape, Q4 2022 quarterly data report. American Society for Gene & Cell Therapy Available from: https://asgct.org/global/documents/asgct_citeline-q4-2022-report_final.aspx (2022)
- Approved Cellular and Gene Therapy Products. United States Food and Drug Administration Available from: https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/approved-cellular-and-gene-therapy-products (2022)
- Au, H. K. E., Isalan, M., Meilcarek, M. Gene therapy advances: a meta-analysis of AAV usage in clinical settings. Frontiers in Medicine. 8, 809118 (2022).
- Lundstrom, K. Viral vectors in gene therapy. Diseases. 6 (2), 42 (2018).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs. 31, 317-334 (2017).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: a randomized, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drugs (INDs). United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/chemistry-manufacturing-and-control-cmc-information-human-gene-therapy-investigationsal-new-drug (2020)
- Long term follow-up after administration of human gene therapy products. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/long-term-follow-after-adminstration-human-gene-therapy-products (2020)
- Testing of retroviral vector-based human gene therapy products for replication competent retrovirus during product manufacture and patient follow-up. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/testing-retroviral-vector-based-human-gene-therapy-products-replication-competent-retrovirus-during (2020)
- Recommendations for microbial vectors used in gene therapy. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/recommendations-microbial-vectors-used-gene-therapy (2016)
- Multidisciplinary: gene therapy. European Medicines Agency Available from: https://www.europa.eu/en/human-regulatory-development/scientific-guidelines/multidisciplinary/multidisciplinary-gene-therapy (2023)
- Human gene therapy for retinal disorders. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/human-gene-therapy-retinal-disorders (2020)
- Design and analysis of shedding studies for virus or bacterial-based gene therapy and oncolytic products. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/design-and-analysis-shedding-studies-virus-or-bacteria-based-gene-therapy-and-oncolytic-products (2015)
- Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products. European Medicines Agency Available from: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-quality-non-clinical-clinical-aspects-gene-therapy-medicinal-products_en.pdf (2018)
- Kaur, S. white paper on recent issues in bioanalysis: mass spec of proteins, extracellular vesicles, CRISPR, chiral assays, oligos; nanomedicines bioanalysis; ICH M10 section 7.1; non-liquid & rare matrices; regulatory inputs (part 1A - recommendations on endogenous compounds, small molecules, complex methods, regulated mass spec of large molecules, small molecule, PoC & part 1B - regulatory agencies' inputs on bioanalysis, biomarkers, immunogenicity, gene & cell therapy and vaccine). Bioanalysis. 14 (9), 505-580 (2022).
- Hays, A., Islam, R., Matys, K., Williams, D. Best practices in qPCR and qPCR validation in regulated bio analytical laboratories. The AAPS Journal. 24 (2), 36 (2022).
- Ma, H., Bell, K. N., Loker, R. N. qPCR and qRT-PCR analysis: Regulatory points to consider when conducting biodistribution and vector shedding studies. Molecular Therapy. Methods & Clinical Development. 17 (20), 152-168 (2020).
- Wissel, M. Recommendations on qPCR/ddPCR assay validation by GCC. Bioanalysis. 14 (12), 853-863 (2022).
- Expectations for biodistribution (BD) assessments for gene therapy (GT) products. International Pharmaceutical Regulators Programme Available from: https://admin.iprp.global/sites/default/files/2018-09/IPRP_GTWG_ReflectionPaper_BD_Final_2018_0713.pdf (2018)
- Pinheiro, L., Emslie, K. R. Basic concepts and validation of digital PCR measurements. Methods in Molecular Biology. 1768, 11-24 (2018).
- Tzonev, S. Fundamentals of counting statistics in digital PCR: I measured two target copies-what does it mean. Methods in Molecular Biology. 1768, 25-43 (2018).
- Prantner, A., Marr, D. Genome concentration, characterization, and integrity analysis of recombinant adeno-associated viral vectors using droplet digital PCR. PLoS One. 18, 0280242 (2023).
- Primer-BLAST. National Library of Medicine, National Center for Biotechnology Information Available from: https://www.ncbi.nim.nih.gov/tools/primer-blast/ (2023)
- Koressaar, T., Remm, M. Enhancements and modifications of primer design program Primer 3. Bioinformatics. 23 (10), 1289-1291 (2007).
- Ye, J. Primer-BLAST: A tool to design target-specific primers for polymerase chain reaction. BMC Bioinformatics. 13, 134 (2012).
- Droplet Digital PCR Application Guide. Bio-Rad Available from: https://www.bio-rad.com/webroot/we/pdf/lsr/literature/Bulletin_6407.pdf (2023)
- Qian, P. L., Sauzade, M., Brouzes, E. dPCR: A technology review. Sensors. 18 (4), 1271 (2018).
- Basu, A. Digital assays part I: portioning statistics and digital PCR. SLAS Technology. 22 (4), 369-386 (2017).
- Sanmiguel, J., Gao, G., Vandeberghe, L. H. Quantitative and digital droplet-based AAV genome titration. Methods in Molecular Biology. 1950, 51-83 (2019).
- Bachhuber, F., Huss, A., Senel, M., Tumani, H. Diagnostic biomarkers in tear fluid: from sampling to preanalytical processing. Scientific Reports. 11, 10064 (2021).
- Martinez-Fernandez de la Camara, C., McClements, M. E., MacLaren, R. E. Accurate quantification of AAV vector genomes by quantitative PCR. Genes. 12 (4), 601 (2021).
- Ai, J., Ibraheim, R., Tai, P. W. L., Gao, G. A scalable and accurate method for quantifying vector genomes of recombinant adeno-associated viruses in crude lysate. Human Gene TherapyMethods. 28 (3), 139-147 (2017).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Frontiers in Microbiology. 10, 1570 (2019).
- Bennett, A., et al. Thermal stability as a determinant of AAV serotype identity. Molecular Therapy Methods and Clinical Development. 6, 171-182 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved